280
www.postepybiochemii.pl
Monika Anna Chomczyk
1,2,*
Piotr Czajka
3
1
Zakład Klinicznej Biologii Molekularnej
2
II Klinika Chirurgii Ogólnej i Gastroentero-
logicznej
3
Zakład Patomorfologii Lekarskiej Uniwersy-
tetu Medycznego w Białymstoku
*
Zakład Klinicznej Biologii Molekularnej,
Uniwersytet Medyczny w Białymstoku, ul.
Waszyngtona 13, 15-269 Białystok; tel.: (85)
748 59 35, e-mail: m.chomczyk@wp.pl, e-mail:
tchayka@wp.pl
Artykuł otrzymano 21 listopada 2012 r.
Artykuł zaakceptowano 14 lutego 2013 r.
Słowa kluczowe: PIK3CA, PI3K, nowotwory,
onkogeny, mutacje, kancerogeneza
Wykaz skrótów: PDK1 — ang. 3-phosphoino-
sitide-dependent protein kinase-1; PH — ang.
pleckstrin homology; PI3K — ang. phosphatidyli-
nositol 3-kinases; PIK3CA — ang. phosphatidy-
linositol-4,5-bisphosphate 3-kinase; PIP
3
— ang.
phosphatidyloinosytol 3,4,5, trisphosphate; PTEN
— ang. phosphatase and tensin homolog; Ras —
ang. rat sarkoma proteins; Raf — ang. serine/the-
roine-specific protein kinase; ERK — ang. mitogen
activated protein kinase; FOXO3 — ang. forhead
box03; GSK-3 — ang. glycogen synthase kinase
Mutacje genu
PIK3CA w najczęściej występujących nowotworach
STRESZCZENIE
C
iągłe udoskonalenia odpowiednich metod walki z chorobami nowotworowymi wyma-
gają aktywnych poszukiwań możliwości zastosowania coraz nowszych celowanych te-
rapii. Doniesienia naukowe, oprócz najlepiej opisanego białka KRAS, podkreślają znaczącą
rolę PI3K w procesie nowotworzenia. Poniższa praca przeglądowa przedstawia występowa-
nie mutacji genu
PIK3CA w ścieżce PI3K/PTEN/Akt w najczęściej występujących nowotwo-
rach. Celowane zatrzymanie najważniejszych komponentów tej ścieżki może posłużyć do
tworzenia celowanych terapii. Mutacja w genie
PIK3CA może również stać się ważnym czyn-
nikiem dla podjęcia decyzji o doborze terapii celowanych. Dużo pytań pozostaje bez odpo-
wiedzi, na przykład jak biochemiczna struktura i efekty wewnątrzkomórkowe wpływają
na różne mutacje w genie
PIK3CA, czy wszystkie mutacje w genie prowadzą do aktywacji
podjednostki p110α? Dodatkowe badania dotyczące biochemicznej struktury oraz struktury
komórkowej są niezbędne do całkowitego odkrycia funkcji genu
PIK3CA, a w szczególności
podjednostki p110α.
WPROWADZENIE
Nowotwory złośliwe stanowią obecnie podstawowy problem, z którym
współczesna medycyna radzi sobie w sposób niezadowalający zarówno w Pol-
sce jak i w całej Europie. Pomimo ciągłego rozwoju nauki, coraz doskonalszych
technik diagnostycznych i nowych terapii opartych na lekach działających wy-
biórczo na komórki nowotworowe, nowotwory zajmują pierwsze miejsce u ko-
biet, drugie u mężczyzn (po chorobach układu krążenia) pod względem przy-
czyn zgonów. Do najczęstszych przyczyn zgonów z nowotworów złośliwych
należą: rak płuca, prostaty, jelita grubego, trzustki oraz białaczki, u kobiet rak
płuca, piersi, układu rozrodczego, jelita grubego i trzustki. Dane pochodzące
z International Reserch of Cancer IARC wskazują, że około 10 milionów ludzi
choruje na nowotwory złośliwe, a liczba zgonów z tego powodu przekroczyła
6 milionów. Jeśli obecne tendencje nie ulegną zmianie to w 2020 roku liczby te
mogą ulec podwojeniu.
W przypadku schorzeń nowotworowych czas potrzebny na prawidłowe roz-
poznanie i wdrożenie odpowiedniego leczenia odgrywa niezwykle istotną rolę.
Zgodnie z raportem EUROCARE3 Polska zajmuje jedno z ostatnich miejsc w
Unii Europejskiej pod względem skuteczności leczenia nowotworów. Powodów
można wymieniać wiele: niewiedza lub lekceważenie pierwszych objawów oraz
zbyt późna diagnoza. W Polsce 1/3 chorych traci możliwość wyleczenia w wy-
niku niewłaściwej lub zbyt późno wykonanej diagnostyki [1].
ŚCIEŻKA PI3K/PTEN/AKT
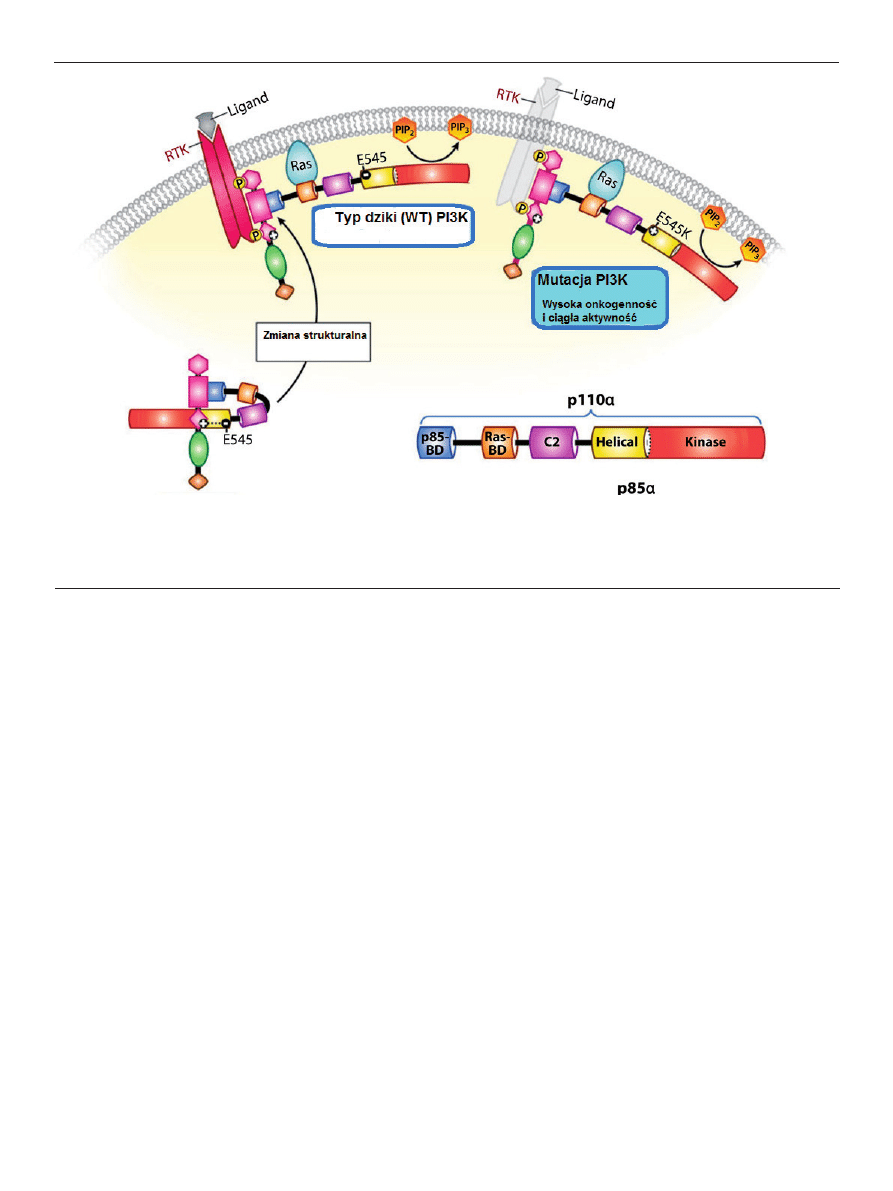
PI3K może być aktywowane poprzez dwa mechanizmy. Pierwszy z nich to
fosforylacja reszt tyrozyny odbywająca się poprzez receptor, który jest jednostką
regulatorową p85 PI3K. Drugi mechanizm polega na aktywacji receptora cyto-
kiny i powstaniu kompleksu białek Shc, Grb-2 i SOS, które aktywują białko Ras.
Białko Ras zdolne jest indukować przemieszczanie do błony i aktywację podjed-
nostki p110 α PI3K.
Aktywacja PI3K powoduje przekształcenie PIP
2
(ang. phosphatidyloinosytol
4,5, bisphosphate) w PIP
3
(ang. phosphatidyloinosytol 3,4,5, triphosphate), czego skut-
kiem jest translokacja PDK1 (ang. 3-phosphoinositide-dependent protein kinase-1) do
błony, dzięki obecności w tym białku domeny PH (ang. pleckstrin homology).
Akt jest pierwszym mediatorem inicjującym przekazywanie sygnałów. Ak-
tywacji Akt podlega wiele białek, z którego każde może przyczyniać się do po-
wstania nowotworu (ang. Bad — genes coding BCL-2, procaspase-9, FKHR/AFX —
forehead in rhabdomysarcoma/aristaless related homebox, GSK-3 — glycogen synthase
kinase, p21
CIP
). Wart podkreślenia jest fakt, że Akt powoduje inaktywację specy-
Postępy Biochemii 59 (3) 2013
281
ficznych białek (Raf, Bad, FOXO3 — forhead box03 i GSK-
3).Dodatkowo wyżej opisana ścieżka zawiera fosfatazy,
które wpływają negatywnie na aktywność PI3K. Mutacja
w genie kodującym fosfatazy mogą prowadzić do progresji
guza [2,3].
NIEPRAWIDŁOWOŚCI PI3K
I TRANSFORMACJA NOWOTWOROWA
Powstanie komórki nowotworowej uzależnione jest od
zaburzenia równowagi trzech procesów: proliferacji, róż-
nicowania i apoptozy. Dużą rolę wśród czynników wpły-
wających na nadmierną proliferację odgrywają onkogeny
(zmutowane protoonkogeny). Różnicowanie komórek no-
wotworowych zostaje zahamowane na wczesnych etapach
dojrzewania i może być uzależnione od zaburzeń syntezy
receptorów dla hormonów i innych czynników wzrostu na
powierzchni komórki nowotworowej. Markery nowotwo-
rowe powinny być oznaczane w komórkach nowotworo-
wych, a to wiąże się niekiedy z problemami dostępności
materiału. Markery molekularne (mutacje w genach biorące
udział w kancerogenezie) mogą być wykryte dzięki technice
reakcji łańcuchowej polimerazy (PCR) opracowanej w 1984
roku przez Mullisa oraz technice sekwencjonowania DNA
opisanej przez Sangera 3 lata wcześniej [1,5,7].
W ciągu ostatnich lat nastąpił gwałtowny wzrost wiedzy
dotyczącej roli ścieżki PI3K/PTEN/Akt (PTEN — ang. pho-
sphatase and tensin homolog, Akt — ang. protein kinase B) oraz
ścieżki Ras/Raf/MEK/ERK (Ras — ang. rat sarkoma prote-
ins, Raf — ang. serine/theroine-specific protein kinase, ERK —
ang. mitogen activated protein kinase) w etiologii ludzkich no-
wotworów. Ścieżka Ras/Raf/MEK/ERK jest ściśle powią-
zana ze ścieżką PI3K/PTEN/Akt [25]. Białka Ras regulują
aktywację dwóch ścieżek. W niektórych typach komórek
aktywność Raf jest regulowana przez Akt, które może od-
działywać pomiędzy dwoma ścieżkami. Obie ścieżki mogą
powodować ich fosforylację, a przez to wpływać na regula-
cję przeżycia komórki i proliferacji [2].
Związek pomiędzy nieprawidłową regulacją PI3K a po-
czątkiem procesu nowotworzenia jest dobrze opisany. Zmu-
towana wersja p85 PI3K została opisana w linii komórkowej
Hodgkin’s oraz raka prostaty. Inne doniesienia pokazują
rolę mutacji w raku piersi, płuc, melanomach i białaczkach.
Kinaza PI3K jest również mocno zaangażowana w złośliwą
transformację komórek [5]. Reasumując wszystkie donie-
sienia naukowe podkreślają znaczącą rolę PI3K w procesie
nowotworzenia. Celowane zatrzymanie najważniejszych
komponentów ścieżki (wyżej opisanej) może posłużyć do
tworzenia celowanych terapii [7].
WYKORZYSTANIE MUTACJI GENU
PIK3CA W TERAPII CELOWANEJ
Obecnie najistotniejsze zarówno z praktycznego jak i
naukowego punktu widzenia jest określenie czynników
determinujących odpowiedź na zastosowane leczenie. W
wielu schorzeniach nowotworowych charakterystyka mo-
lekularna komórek nowotworowych pozwala również na
Rycina 1. Ścieżka PI3K. Aktywowane receptory kinaz tyrozynowych (RTK) rekrutują i aktywują PI3K, prowadząc do zwiększenia poziomu fosfatydyloinozytolu-3,4,5-
-trisfosfatazy (PIP3). PIP3 rekrutuje wiele białek błonowych poprzez wiązanie domeny PH, w tym seryny/treoniny kinaz Y Akt, 3-kinazy zależnej od fosfoinozytydu
(PDK1) oraz domenę PH fosfatazy i leucynę bogatą w fosfatazę białkową. Na podstawie [4].
282
www.postepybiochemii.pl
ocenę możliwości zastosowania tak zwanych terapii celo-
wanych opartych na lekach, które działają wybiórczo na
komórki nowotworowe. Terapię taką cechuje stosunkowo
duża skuteczność oraz względnie mała liczba powikłań,
która znacząco wzrasta po zastosowaniu standardowej ra-
dioterapii lub chemioterapii. Niejednokrotnie wybór mię-
dzy mniej lub bardziej intensywną terapią podyktowany
jest obecnością lub brakiem określonych czynników pro-
gnostycznych, a przede wszystkim predykcyjnych. Celo-
we wydaje się więc określenie roli genu PIK3CA jak i jego
mutacji w oporności lekowej oraz jako czynnika predykcyj-
nego w leczeniu chorych z różnymi nowotworami. Idealne
biomarkery powinny dostarczać informacji o braku lub nie
odpowiedzi na leczenie lekami terapii celowanej [8]. Przy-
szłe rozważania oraz badania muszą dostarczyć informacji,
czy dany biomarker pojawia się we wczesnej bądź późnej
kancerogenezie (co będzie miało duże znaczenie przy biop-
syjnym materiale do badań we wczesnych zmianach). Dla
genu PIK3CA bardzo zachęcający jest fakt, że dostępne są
związki chemiczne hamujące PI3Ks i wykazano ich wpływ
na zahamowanie progresji guza.
Badania efektów ścieżki PI3K/PTEN/Akt na oporność
leków w raku piersi dotyczyły nadprodukcji WT i mutacji
w białku PTEN. Inne badania sugerują, że również ścieżki
PI3K/PTEN/AKT/mTOR (ang. mTOR-mamalian target of
rapamycin) i JAK/STAT (ang. Janus kinase/Signac transducer
activater of transcription) są zaangażowane w mechanizm
oporności EGFR (ang. epidermal growth factor) [9,10]. Pacjenci
z rakiem jelita grubego z mutacją w genie PIK3CA w bada-
niach Perronie i wsp. nie odpowiadali na leczenie cetuksy-
mabem [3,11].
MUTACJA GENU
PIK3CA W RÓŻNYCH
TYPACH NOWOTWORÓW
PIK3CA to gen kodujący podjednostkę p110α PI3K o ma-
sie 110 kDa znajdujący się w regionie 3q26 i został amplifi-
kowany w różnych ludzkich nowotworach: jajnika, głowy i
szyi, piersi, dróg moczowych, jelita grubego, płuca [5].
Mutacja genu PIK3CA w raku jelita grubego jest mutacją
somatyczną tzn. powstającą w komórkach somatycznych i
nie jest dziedziczona. Badania sugerują, że mutacja w genie
PIK3CA pojawia się w późnym etapie kancerogenezy. Po-
nad 80 % mutacji dotyczy eksonu 9 i 20 oraz 1 i 2. Mutacje
w genie PIK3CA są podobne do mutacji w innych genach
takich jak: KRAS (ang. Kirsten rat sarcoma), BRAF (ang. v-Raf
Marine sarkoma oncogene homolog B1), CTNNB1 (ang. catenin,
cadherin associated protein beta 1) [12,13]. W nowotworach
wiele z tych genów z mutacją w regionie katalitycznym
powoduje aktywację zmutowanych białek kodowanych
przez dany gen [13]. Bardzo interesujący jest fakt, iż więk-
szość guzów z mutacją w genie PIK3CA również posiada
zmutowane geny KRAS i BRAF, co sugeruje, że PIK3CA jest
związane z tymi genami [15]. Badania przeprowadzone na
grupie ponad 1000 pacjentów z rakiem jelita grubego leczo-
nych cetuksymabem w latach 2001–2008 z 11 ośrodków w 7
państwach Europy określiły korelacje pomiędzy mutacją w
poszczególnych eksonach a czynnikami prognostycznymi.
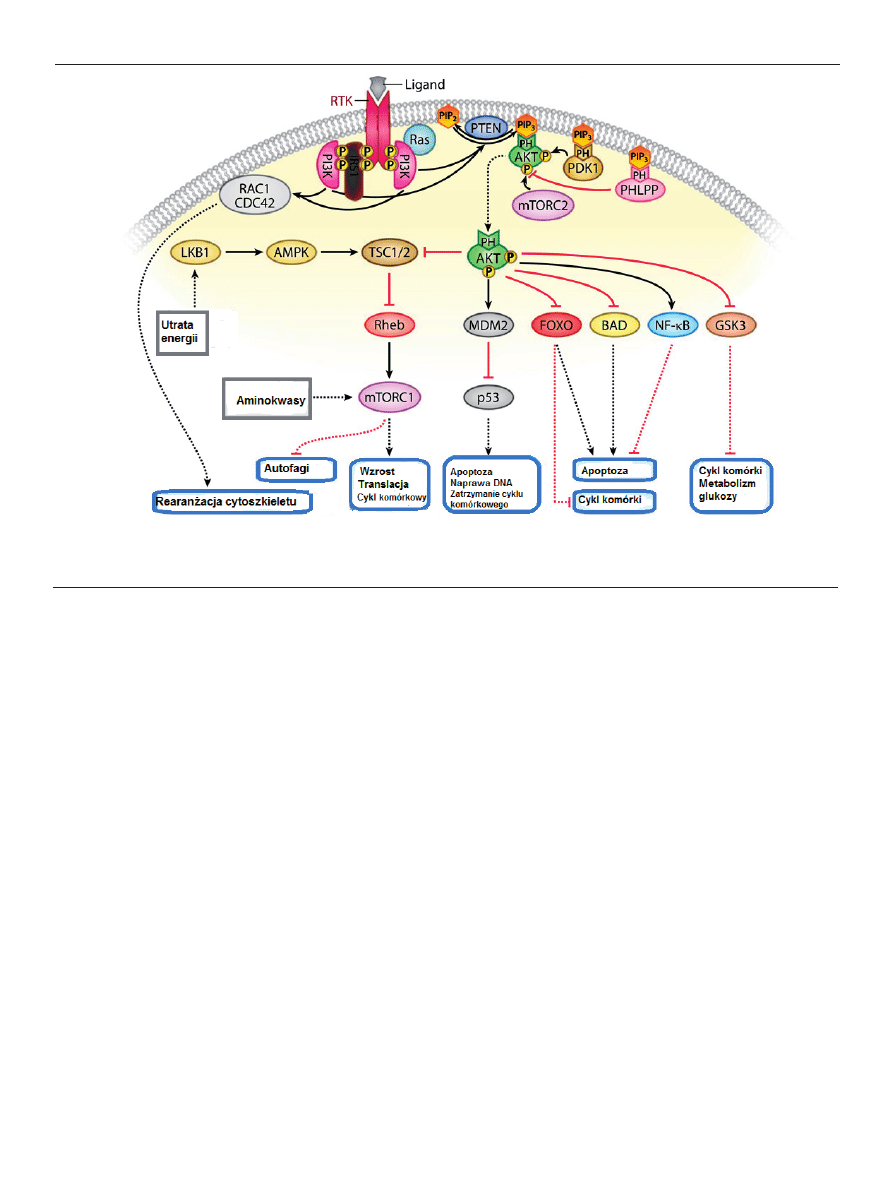
Rycina 2. Model aktywacji wywołanej mutacją E545K w podjednostce 110α (na podstawie analizy struktury krystalicznej p110α). Typ dziki podjednostki katalitycznej
110α jest stabilizowany przez wiązanie podjednostki p85α-regulowany poprzez domeny wiążące p85. Na podstawie [4].

Postępy Biochemii 59 (3) 2013
283
Mutacja w eksonie 9 nie miała wpływu na odpowiedź na
leczenie cetuksymabem i chemioterapią oraz na czas wolny
od wznowy. Mutacja w kodonie 20 w porównaniu z typem
dzikim WT miała gorsze prognozowanie, krótszy okres
przeżycia [16]. Reasumując mutacja w genie PIK3CA w eks-
onie 20 jest znacząco związana z mniejszą odpowiedzią na
leczenie.
Badania w kierunku mutacji genu PIK3CA w raku piersi
przeprowadzone na grupie 92 pacjentek z guzami pierwot-
nymi piersi wykazały obecność 19 mutacji somatycznych,
co stanowiło 20,6% badanej grupy (13 mutacji w eksonie 9,
zaś 6 w eksonie 20). Uzyskane wyniki pokazują, że mutacja
w genie PIK3CA w raku piersi należy do bardzo częstych i
zachęca do dalszych badań nad korelacją mutacji z czynni-
kami klinicznymi jaki i patomorfologicznymi [17,18].
Publikacji poświęconych mutacjom genu PIK3CA w raku
płuca jest niewiele, być może związane jest to z trudnością
pobrania materiału do badań. Ciekawe doniesienie obejmu-
jące badania na grupie 173 pacjentów z NSCLCs (niedrob-
nokomórkowy rak płuca) rakiem płuca (w tym 56 z drob-
nokomórkowym rakiem płuca i 117 z gruczolakorakiem)
wskazuje, że mutacje w genach PIK3CA/PTEN były częstsze
w drobnokomórkowym rakiu płuca w porównaniu z gru-
czolakorakiem (p<0,05 — istotne statystycznie) [19]. Intere-
sujący jest fakt, że mutacje były częstsze u osób palących.
Inne badania na grupie osób niepalących z Schanghaju w
Chinach obejmujące 52 pacjentów pokazały wystąpienie
mutacji w 4 przypadkach (zawsze współwystępujące z
mutacją EGFR) [20]. W badaniach na liniach w raku płuca
stwierdzono, że linie komórkowe z mutacją w genie PIK-
3CA są bardziej wrażliwe na tricibrine (inhibitor Akt) niż
linie komórkowe z typem dzikim (bez mutacji). Badania na
liniach komórkowych mogą przyczynić się do powstania te-
rapii skierowanej na ścieżkę z PIK3CA, a dokładnie terapię
anty-Akt u pacjentów chorych na raka płuca [21].
EFEKTY MUTACJI GENU PIK3CA
Charakterystyka mutacji genu PIK3CA w wielu donie-
sieniach naukowych stwierdza jednoznacznie jego onko-
genność. Obecność „hotspot” mogą świadczyć o tym, że
zmiany w sekwencji genu przyczyniają się do aktywacji
kinazy podobnie jak onkogenne mutacje w kinazie biał-
kowej. W badaniach przeprowadzonych przez Samuels i
wsp. dotyczących konsekwencji mutacji jednostki p110α i
prawidłowej wersji jednostki p110α oraz mutacji w kodo-
nie 20 tego genu przeprowadzonych na komórkach in vitro
stwierdzono większą aktywność kinazy lipidowej w ko-
mórkach z mutacją. Opisane badania sugerują, iż mutacja
w domenie katalitycznej genu PIK3CA powoduje aktywację
kinazy. Proces aktywacji tego mechanizmu nie został do tej
pory poznany, ale może być podobny do aktywacji innych
kinaz białkowych poprzez mutacje w genach. Naukowcy są
zgodni, że najczęściej zmutowany region 1047 (w kodonie
20) jednostki p110α jest analogiczny do najczęściej zmuto-
wanej pętli w kinazie białkowej [21,22]. Drugi najczęściej
zmutowany fragment występuje w eksonie 9 (heliakalna
domena jednostki p110α). Krystaliczna struktura podjed-
nostki p110α sugeruję, że jest ona kręgosłupem, do którego
przymocowane są inne domeny. Podjednostka p110α może
zatem oddziaływać z innymi regionami, podjednostkami
regulatorowymi lub innymi białkami [23,24]. Trzecia pod
względem częstości mutacja występuje w 1 i 2 kodonie i jest
związana z domeną p85. Badania wskazują, że aktywacja
domeny p85 prowadzi do aktywacji podjednostki p110α
poprzez zahamowanie funkcji kinazy [14,25,26]. Dużo py-
tań pozostaje bez odpowiedzi np.: jak biochemiczna struk-
tura i efekty wewnątrzkomórkowe wpływają na różne
mutacje w genie PIK3CA, czy wszystkie mutacje w genie
prowadzą do aktywacji podjednostki p110α? Dodatkowe
badania dotyczące biochemicznej struktury oraz struktury
komórkowej są niezbędne do całkowitego odkrycia funkcji
genu PIK3CA, a w szczególności podjednostki p110α. Nie-
zbędne są dalsze badania dotyczące mutacji w genie PIK-
3CA w różnych typach nowotworów złośliwych najczęściej
występujących takich jak: rak płuca, piersi i jelita grubego.
Poznanie mechanizmów molekularnych i biochemicznych
kierujących ścieżką PI3K może zostać w przyszłości wyko-
rzystane do terapii celowanej pacjentów z różnymi nowo-
tworami [27-30].
PIŚMIENNICTWO
1. Mlak R, Krawczyk P, Limanowski J (2010) Czynniki biochemiczne i
genetyczne w diagnostyce i prognozowaniu chorób nowotworowych.
Forum Medycyny Rodzinnej 4: 122-134
2. McCubrey
JA, Steelman LS, Abram SL (2004) Roles of the RAF/MEK/
ERK and PI3K/PTEN/AKT pathways in malignant transformation
and drug resistance. Advan Enzyme Regul 46: 249-279
3. Barbi S, Cataldo I, Manzoni G (2010) The analysis of PIK3CA muta-
tions in gastric carcinoma and metanalysis of literature suggest that
exon-selectivity is a signature of cancer type. J Exp Clinic Res 16: 29-32
4. Chalhoub N, Baker SJ (2009) PTEN and the PI3-kinase pathway in can-
cer. Annu Rev Pathol 4: 127-150
5. Samuels Y, Velculescu VE (2004) Oncogenic mutations of PIK3CA in
human cancers. Cell Cycle 3: 1221-1224
6. Gos M, Leszkiewicz M, Abramowicz A (2012) Ścieżka sygnałowa
RAS/MAPK i jej rola w etiopatogenezie zespołu Noonan. Postepy
Biochem 58: 255-264
7. Rodriguez-Viciana P, Warne PH, Dhand R (1994) Phosphatidylinosi-
tol-3-OH kinase as a direct target of Ras. Nature 370: 527–532
8. Wong R, Cunningham D (2008) Using predictive biomarkers to select
patients with advanced colorectal cancer for treatment with epidermal
growth factor receptor antibodies. J Clin Oncol 26: 5668-5670
9. Frattini M, Saletti P, Romagnani E (2007) PTEN loss of expression pre-
dicts cetuximab efficacy in metastatic colorectal cancer patients. Br J
Cancer 97: 1139-1145
10. Loupakis F, Pollina L, Stasi I, Ruzzo A, Scartozzi M, Santini D, Masi G,
Graziano F, Cremolini C, Rulli E, Canestrari E, Funel N, Schiavon G,
Petrini I, Magnani M, Tonini G, Campani D, Floriani I, Cascinu S, Fal-
cone A (2009) PTEN expression and KRAS mutations on primary tu-
mors and metastases in the prediction of benefit from cetuximab plus
irinotecan for patients with metastatic colorectal cancerEvaluation of
PTEN expression in colorectal cancer (CRC) metastases (mets) and in
primary tumors as predictors of activity of cetuximab plus irinotecan
treatment. J Clin Oncol 27: 2622-2629
11. Perrone F, Lampis A, Orsenigo M (2008) PI3KCA/PTEN deregulation
contributes to impaired responses to cetuximab in metastatic colorec-
tal cancer patients. Ann Oncol 20: 84-90
12. Sartore-Bianchi A, Martini M, Molinari F (2009) PIK3CA mutations in
colorectal cancer are associated with clinical resistance to EGFR-target-
ed monoclonal antibodies. Cancer Res 69: 1851-1857
13. Sidransky D (2002) Emerging molecular markers of cancer. Nat Rev
Cancer 2: 210-219

284
www.postepybiochemii.pl
PIK3CA mutations in the most common types of cancer
Monika Anna Chomczyk
1,2,*
, Piotr Czajka
3
1
Department of Clinical Molecular Biology,
2
II Department of General and Gastroenterological Surgery and
3
Department of Medical Pathomor-
phology, Medical University of Bialystok, 13 Waszyngtona St., 15-269 Białystok, Poland
*
e-mail: m.chomczyk@wp.pl, e-mail: tchayka@wp.pl
Key words: PIK3CA, PI3K, cancer, oncogenes, mutations, carcinogenesis
ABSTRACT
Continuous improvement of appropriate methods of dealing with cancer require active search for the possibility of applying more and newer
targeted therapies. Scientific reports, in addition to best-described proteins KRAS, PI3K emphasize the important role in carcinogenesis.
This paper presents overview
PIK3CA mutations in the path PI3K/PTEN/Akt the most common cancers. Targeted to stop the most important
components of this path can be used to create targeted therapies.
PIK3CA mutation may also be a predictive factor in the selection of targeted
therapies. A lot of questions remain unanswered such as: how the structure and biochemical effects of intracellular affect different mutations
in
PIK3CA, and all mutations in the gene lead to the activation of p110α subunit? Additional research on the biochemical structure and cell
structure are necessary to complete the discovery of
PIK3CA gene function and, in particular subunits of p110α.
14. Philp AJ, Campbell IG, Leet C (2001) The phosphatydyloinositol 3’-ki-
nase p85α gene is an oncogene in human ovarian and colon tumors.
Cancer Res 61: 7426-7429
15. Rajagopalan H, Bardelli A, Lengauer C, Kinzler KW, Vogelstein B,
Velculescu VE, Bardelli A, Lengauer C (2002) Tumorigenesis: raf/ras
oncogenes and mismatch-repair status. Nature 418: 934
16. De Roock W, Claes B, Bernasconi D (2010) Effects of KRAS, BRAF,
NRAS, and PIK3CA mutations on the efficacy of cetuximab plus che-
motherapy in chemotherapy-refractory metastatic colorectal cancer: a
retrospective consortium analysis. Lancet Oncol 11: 753-762
17. Larramendy ML, Lushnikova T, Bjorkqvist AM (2000) Comparative
genomic hybridization reveals complex genetic changes in primary
breast cancer tumors and their cell lines. Cancer Genet Cytogenet 119:
132-138
18. Wu G, Xing M, Mambo E (2005) Somatic mutation and gain of copy
number of PIK3CA in human breast cancer. Breast Cancer Res 7: 609-
616
19. Lee SY, Kim MJ, Jin G (2010) Somatic mutations in epidermal growth
factor receptor signaling pathway genes in non-small cell lung can-
cers. Thorac Oncol 5: 1734-740
20. Sun Y, Ren Y, Fang Z et al. (2010). Lung adenocarcinoma from East
Asian never-smokers is a disease largely defined by targetable onco-
genic mutant kinases. J Clin Oncol 28: 4616-4620
21. Shibata T, Kokubu A, Tsuta K (2009) Oncogenic mutation of PIK3CA
in small cell lung carcinoma: a potential therapeutic target pathway for
chemotherapy-resistant lung cancer. Cancer Lett 283: 203-211
22. Samuels Y, Wang Z, Bardelli A (2004) High frequency of mutations of
the PIK3CA gene in human cancers. Science 304: 554
23. Walker EH, Perisic O, Ried C (1999) Structural insights into phos-
phoinositide 3-kinase catalysis and signaling. Nature 402: 313-320
24. Djordjevic S, Driscool PC (2002) Structural insight into substrate
specifity and regulatory mechanisms of phosphoinositide 3-kinases.
Trends Biochem Sci 27: 426-432
25. Luo J, Mannig BD, Cantley LC (2003) Targeting the PI3K-Akt pathway
in human cancer Rationale and promise. Cancer Cell 4: 257-263
26. Karakas B, Bachman KE, Park BH (2006) Mutation of the PIK3CA on-
cogene in human cancer. Br J Cancer 94: 455-459
27. Schildgen V, Lüsebrink J, Appel JD, Wübben C, Engel-Riedel W, Lu-
dwig C, Stoelben E, Schildgen O, Brockmann M (2013) Identification
of uncommon PIK3CA mutations in lung cancer by using pyrosequ-
encing. Diagn Mol Pathol 22: 22-27
28. Flatley E, Ang D, Warrick A, Beadling C, Corless CL, Troxell ML (2013)
PIK3CA-AKT pathway mutations in micropapillary breast carcinoma.
Hum Pathol 12: 401-407
29. Wang H, Wu H, Cai K, Ju Q, Wang W (2012) Phosphatidylinositol
3-kinase could be a promising target in lung cancer therapy. J Buon
17: 729-734
30. Sahin IH, Aspirin GC (2013) PIK3CA mutation and colorectal-cancer
survival. N Engl J Med 368: 289
Wyszukiwarka
Podobne podstrony:
273 280 id 31730 Nieznany (2)
273 280 id 31730 Nieznany (2)
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
więcej podobnych podstron