
Katedra Chemii Nieorganicznej, Wydział Chemiczny, Politechnika Gdańska
RÓWNOWAŻNIK SUBSTANCJI CHEMICZNEJ
Materiały dodatkowe do Ćwiczeń rachunkowych z Chemii Nieorganicznej
prowadzący: Anna Kropidłowska
RÓWNOWAŻNIK CHEMICZNY*
W obliczeniach stechiometrycznych użyteczne bywa pojęcie równoważnika chemicznego.
Jeśli rozważymy dwa przykłady reakcji zobojętniania:
a) HCl + NaOH = NaCl + H
2
O
b) H
2
SO
4
+ 2 NaOH= Na
2
SO
4
+ 2H
2
O
łatwo zauważyć, iż w przypadku (a) do zobojętnienia 1 mola kwasu potrzebny jest1 mol zasady,
podczas gdy w przypadku (b) na 1 mol kwasu należy zużyć 2 mole zasady. W przypadkach tego typu
1 mol kwasu nie zawsze jest zatem równoważny molowi zasady.
Kwas siarkowy (VI) oddysocjowuje 2 jony H
+
i może zobojętnić (zrównoważyć) 2 jony HO
-
,
zatem do zrównoważenia 1 mola NaOH wystarcza ½ mola H
2
SO
4
, które oddysocjowuje jeden mol
jonów H
+
Na podstawie powyższego przykładu można zatem napisać:
W
M
R
=
przy czym: R- ilość kwasu równoważna 1 molowi jonów H
+
M - masa cząsteczkowa
W- wartościowość reszty kwasowej
Równoważnik chemiczny (R, eq) - jest to taka masa substancji, która łączy się z 1,008 jednostki
wagowej wodoru lub z 8 jednostkami wagowymi tlenu, bądź też wypiera te ilości wodoru/tlenu ze
związku.
Równoważnik wyrażony w gramach nazywamy gramorównoważnikiem.
Gramorównoważnik (gR, inaczej zwany walem: wal, val,) posiada także określony sens
elektrochemiczny – jest mianowicie równy masie substancji (wyrażonej w gramach), wydzielanej na
elektrodzie ładunek elektryczny równy 1 Faraday = 96500C
Gramorównoważnik dowolnej substancji:
- taka ilość tej substancji, która reaguje z 1 gramorównoważnikiem dowolnej innej substancji.
Najistotniejszą konsekwencją tak zdefiniowanej wielkości jest to, że dwie dowolne substancje
reagują ze sobą zawsze w proporcji: 1 wal A + 1 wal B (niezależnie od współczynników w równaniu
reakcji!). Zależność ta jest spełniona dla każdej reakcji.
OBLICZANIE RÓWNOWAŻNIKÓW CHEMICZNYCH PIERWIASTKÓW I ZWIĄZKÓW
CHEMICZNYCH
• Równoważnik chemiczny pierwiastka
Pomiędzy równoważnikiem chemicznym R
x
pierwiastka X i jego masą atomową A
x
istnieje
następująca zależność:
W
A
R
x
x
=

przy czym W- oznacza wartościowość chemiczną pierwiastka, którą określa się jako liczbę atomów wodoru albo
pierwiastka równocennego wodorowi, z którą łączy się atom pierwiastka.
W zależności od rodzaju związków ten sam pierwiastek może przyjmować różne wartości
wartościowości, stąd pierwiastek może mieć też różne wartości równoważnika chemicznego
Przykład.
W związkach żelazo (A=55,85) może być np. dwu- i trójwartościowe
Stąd też:
92
,
27
2
85
,
55
)
(
=
=
II
Fe
R
61
,
18
3
85
,
55
)
(
=
=
III
Fe
R
• Równoważnik chemiczny kwasu
Równoważnik chemiczny kwasu jest liczbowo równy masie cząsteczkowej kwasy podzielonej przez
liczbę kwasowo czynnych atomów wodoru zawartych w cząsteczce kwasu (z wiec przez jonów H
+
,
które
mogą by oddysocjowane).
Przykłady.
46
,
36
1
46
,
36
=
=
HCl
R
04
,
49
2
08
,
98
4
=
=
SO
H
s
R
67
,
32
3
00
,
98
4
3
=
=
PO
H
R
• Równoważnik chemiczny zasady
Dla zasad równoważnik chemiczny jest równy masie cząsteczkowej zasady podzielonej przez liczbę
czynnych zasadowo grup wodorotlenowych wchodzących w jej skład.
Przykłady.
00
,
40
1
00
,
40
=
=
NaOH
R
70
,
85
2
4
,
171
2
)
(
=
=
OH
Ba
R
63
,
35
3
9
,
106
3
)
(
=
=
OH
Fe
R
• Równoważnik chemiczny soli pojedynczych
Równoważnik chemiczny jonów związków chemicznych, biorących udział w reakcjach typu
nieredoksowego, oblicza się uwzględniając ich masę atomową (lub cząsteczkową) oraz wartościowość
jonu, względnie atomów lub grup atomów dla danego związku charakterystycznych.
Równoważnik w przypadku soli pojedynczych obliczamy dzieląc masę cząsteczkową soli przez
liczbę jonów metalu zawartych w elementarnym zgrupowaniu jonowym (sumaryczny ładunek jonów
jednego rodzaju oddysocjowujących z cząsteczki). Jest w tym przypadku obojętne, czy wyznacza się
go względem kationu, czy anionu.
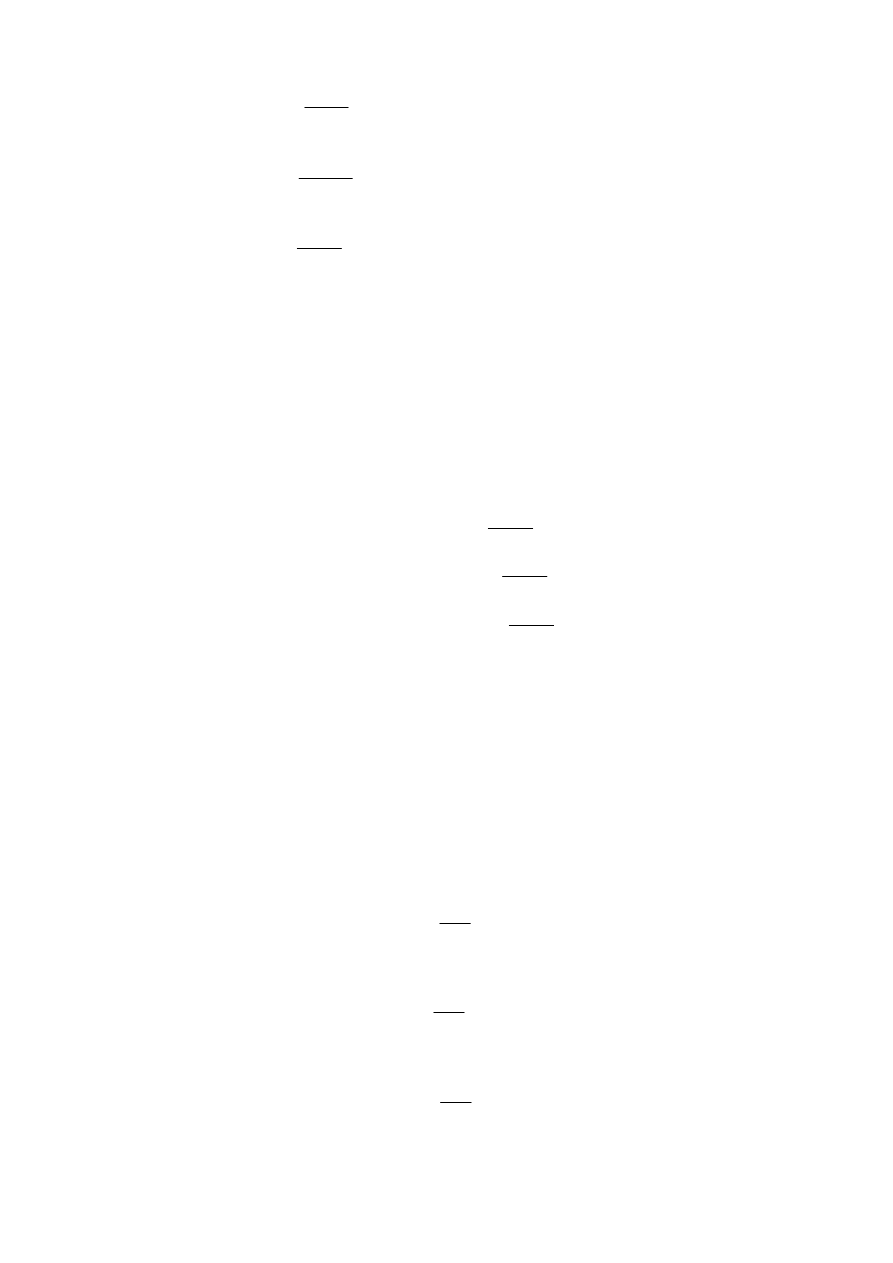
Przykłady.
9
,
169
1
9
,
169
3
=
=
AgNO
R
ponieważ: AgNO
3
= Ag
+
+ NO
3
-
(sumaryczny ładunek dla Ag
+
=1
⋅1=1);
02
,
71
2
05
,
142
4
2
=
=
SO
Na
R
ponieważ: Na
2
SO
4
= 2Na
+
+ SO
4
2-
(sumaryczny ładunek dla 2Na
+
=2
⋅1=2);
37
,
65
6
2
,
392
3
4
2
)
(
=
=
SO
Cr
R
ponieważ: Cr
2
(SO
4
)
3
= 2Cr
3+
+ 3SO
4
2-
(sumaryczny ładunek dla 2Cr
2+
=2
⋅3=6);
• Równoważnik chemiczny soli podwójnych
W omawianym przypadku równoważnik chemiczny oblicza się w stosunku do każdego rodzaju
jonów:
Przykład
K
2
Al
2
(SO
4
)
4
⋅24H
2
O (M=948,7)
w stosunku do K
+
:
4
,
474
1
2
7
,
948
)
(
=
⋅
=
+
K
R
w stosunku do Al
3+
:
1
,
158
3
2
7
,
948
)
(
3
=
⋅
=
+
Al
R
w stosunku do SO
4
2-
:
6
,
118
2
4
7
,
948
)
(
2
4
=
⋅
=
−
SO
R
• Równoważnik chemiczny utleniaczy i reduktorów
Równoważnikiem substancji utleniającej lub redukującej jest taka jej ilość, która pobiera lub oddaje
1 elektron.
Równoważnik w przypadku takich substancji oblicz się zatem dzieląc masę cząsteczkową przez
liczbę elektronów pobranych lub oddanych w reakcji redoks.
Przykłady.
2 KMnO
4
+ 5 K
2
C
2
O
4
+ 16 HNO
3
= 2 Mn(NO
3
)
2
+ 10 CO
2
+ 12 KNO
3
+ 8 H
2
O
6
,
31
5
158
4
=
=
KMnO
R
2 KMnO
4
+ 3 K
2
SO
3
+ H
2
O = 2 MnO
2
+ 3 K
2
SO
4
+ 2 KOH
67
,
52
3
158
4
=
=
KMnO
R
2 KMnO
4
+ HCOH + 2 KOH = 2 K
2
MnO
4
+ HCOOH + H
2
O
158
1
158
4
=
=
KMnO
R

PRAWO RÓWNOWAŻNIKÓW (Richtera)
Pierwiastki i związki chemiczne reagują ze sobą, bez reszty, w ilościach wagowych równych ich
gramorównoważnikom chemicznym lub ich wielokrotnościom.
2
1
2
1
R
R
m
m =
METODY WYZNACZANIA RÓWNOWAŻNIKA CHEMICZNEGO METALU
• Metoda chemiczna-bezpośrednia
Stosowana do wyznaczania równoważnika chemicznego metali nieszlachetnych (wypierających
wodór z kwasów)
• Metoda fizyczna
Metoda oparta na I prawie Faraday’a: ilość metalu osadzonego na katodzie podczas elektrolizy
jest proporcjonalna do ładunku przepływającego przez elektrolizer
• Metoda chemiczna – pośrednia
W przypadku metali szlachetnych (nie wypierających wodoru z kwasów) np. Ag – celem
wyznaczenia równoważnika roztwarza się naważkę badanego metalu w kwasie (HNO
3
), po czym
wytrąca kwasem solnym nierozpuszczalny osad AgCl, którego masę, po odsączeniu wysuszeniu,
wyznacza się.
STĘŻENIE NORMALNE
W praktyce pojęciem gramorównoważnika posługuje się m.in. w celu wyznaczenia normalności
roztworów.
Stężenie normalne podaje liczbę gramorównoważników chemicznych substancji rozpuszczonej
w 1 dm
3
roztworu.
Tak więc roztwór zawierający 1 gramorównoważnik substancji w 1 litrze jest 1 normalny (1N)
Normalność definiuje się jako:
V
R
m
c
N
⋅
=
gdzie: n – masa substancji rozpuszczonej
R – masa 1 gramorównoważnika tejże substancji
V – objętość roztworu w dm
3
Pomiędzy molowością, a normalnością danego roztworu istnieje zatem ścisła zależność –
normalność jest albo równa molowości, albo stanowi jej całkowitą wielokrotność.
Należy jednak pamiętać, że równoważnik chemiczny związku może przyjmować różne wartości
w zależności od reakcji, w której ten związek bierze udział.
* Równoważnik chemiczny, aczkolwiek bardzo użyteczny, jest jedynie pojęciem pomocniczym. Można
z niego zrezygnować i posługiwać się jedynie pojęciem jedynie masy cząsteczkowej i wartościowości,
jak zaleca IUPAC (Międzynarodowa Unia Chemii Czystej i Stosowanej)
Literatura:
[1] W. Brzyska (red.), Ćwiczenia z chemii ogólnej, Wydawnictwo UMCS, Lublin (1997) 51-58.
[2] Z. Bądkowska, E. Koliński, M. Wojnowska, Obliczenia z Chemii Nieorganicznej, Wydawnictwo
PG, Gdańsk (1996) 85-87.
[3] http://www.chem.univ.gda.pl/~tomek/gramorownowaznik.htm.
Wyszukiwarka
Podobne podstrony:
CW 8 pytania kontrolne v2 id 12 Nieznany
Cw 3 Tranzystor bipolarny id 12 Nieznany
cw 3 sterowanie szeregowe id 12 Nieznany
Podst poj i pr chem id 366070 Nieznany
Cw 06 Siatka dyfrakcyjna id 121 Nieznany
cwiczenie nr 2 instrukcja id 12 Nieznany
cwiczenie nr 3 instrukcja id 12 Nieznany
czy patriotyzm jest cnota id 12 Nieznany
MED CW 7 PLC S7 swiatla id 2919 Nieznany
Cw 24 Uklady cyfrowe id 122415 Nieznany
analiza chem 2 id 59885 Nieznany (2)
Cw 3 Bach Niew Wronk id 97649 Nieznany
Cw 06 Tranzystor MOSFET id 1213 Nieznany
Ekol cw lek I 2012 13 id 154764 Nieznany
CW 02 Miary statystyczne id 856 Nieznany
Cwiczenia obliczenia 2014 id 12 Nieznany
cwiczenie1 dos polecenia id 12 Nieznany
Cw 1 podstawyPP 14 15 id 97548 Nieznany
więcej podobnych podstron