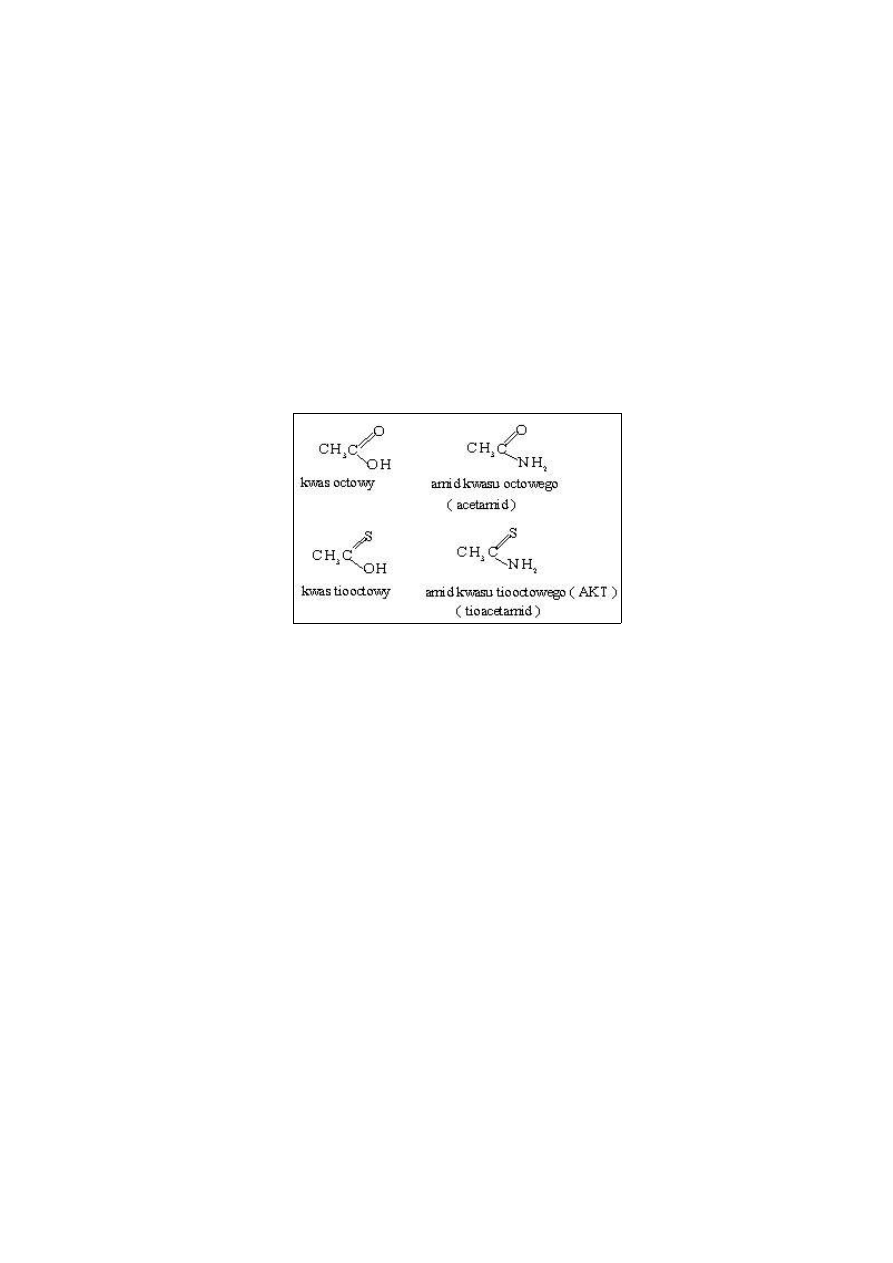
XIII.2. Teoria wytrącania siarczków
Jony siarczkowe wytrącają siarczki i wodorotlenki Cr(OH)
3
, Al(OH)
3
kationów II i III grupy analitycznej.
Odczynnikiem grupowym dla obu grup jest siarkowodór, który
najczęściej uzyskuje się w wyniku hydrolizy amidu kwasu tiooctowego
( AKT ). Związek ten o wzorze CH
3
CSNH
2
wywodzi się z kwasu tiooctowego
CH
3
CSOH.
AKT jest dobrze rozpu-szczalny w wodzie i jest trwały w roztworze,
nato-miast ogrzewany w środo-wisku kwaśnym lub zasa-dowym hydrolizuje z
wy-dzieleniem H
2
S, który w chwili powstania reaguje z większością kationów,
wytrącając osady siarczków.
Hydrolizę AKT można przedstawić reakcją :
CH
3
CSNH
2
+ 2H
2
O = CH
3
COO
-
+ NH
4
+
+ H
2
S
↑
Siarkowodór, a praktycznie AKT, jest odczynnikiem grupowym
zarówno dla II, jak i dla III grupy kationów, przy czym wytrącanie siarczków
grupy II odbywa się w środowisku kwaśnym, a siarczków i wodorotlenków
grupy III w środowisku zasadowym.
Zastosowanie wspólnego odczynnika grupowego jest możliwe ze
względu na różnice w rozpuszczalności siarczków obu grup, mianowicie
siarczki grupy III mają znacznie większe wartości iloczynów rozpuszczalności,

w granicach od 10
-15
do 10
-23
, niż siarczki II grupy kationów, których iloczyny
rozpuszczalności są poniżej wartości 10
-24
.
Na tej podstawie można stwierdzić, że do wytrącenia siarczków grupy
III potrzebne jest znacznie większe stężenie jonów siarczkowych, co można
osiągnąć wytrącając grupę II w środowisku kwaśnym, a następnie grupę III w
zasadowym.
Konieczność właściwego doboru pH w trakcie wytrącania kationów grupy II
i III wynika z zależności między stężeniem jonów wodorowych i siarczkowych,
które biorą udział w wytrącaniu osadów siarczków.
Siarkowodór w roztworze wodnym jest słabym kwasem, dysocjującym
dwustopniowo:
H
2
S D H
+
+ HS
-
K
H
HS
H S
1
2
8
9 1 10
=
⋅
=
⋅
+
−
−
[
] [
]
[
]
,
HS
-
D H
+
+ S
2-
K
H
S
HS
2
2
15
1 2 10
=
⋅
=
⋅
+
−
−
−
[
] [
]
[
]
,
Na tej podstawie można obliczyć wartość ogólnej stałej dysocjacji
siarkowodoru :
K
3
= K
1
· K
2
= 9,1·10
-8
· 1,2·10
-15
= 1,1·10
-22
Po przekształceniu wzoru na ogólną stałą dysocjacji siarkowodoru K
3
K
H
S
H S
3
2
2
2
22
11 10
=
⋅
=
⋅
+
−
−
[
] [
]
[
]
,
do postaci :
[ H
+
]
2
· [ S
2-
] = K
3
· [ H
2
S ]
oraz po uwzględnieniu faktu, że nasycony roztwór siarkowodoru powstający w
trakcie hydrolizy AKT jest w przybliżeniu roztworem 0,1 molowym, obliczyć
można wartość iloczynu jonowego siarkowodoru :
[ H
+
]
2
· [ S
2-
] = 1,1 · 10
-22
·
0,1 = 1,1 · 10
-23
; stąd [ S
2-
] = K
3
/ [ H
+
]
2
Z zależności tej wynika, że stężenie jonów siarczkowych jest odwrotnie

proporcjonalne do kwadratu stężenia jonów wodorowych. Zmieniając
odpowiednio pH roztworu uzyskać można wymagane stężenie jonów
siarczkowych :
pH
0,5
1,5
5
7
9,3
[ S
2-
]
10
-22
10
-20
10
-14
10
-10
2 · 10
-7
Wytrącenie siarczków kationów II grupy , w obecności kationów III
grupy, wymaga takiego stężenia jonów siarczkowych, by ilościowo wytrącić
wszystkie siarczki grupy II, a nie wytrącić, tzn. nie przekroczyć iloczynów
rozpuszczalności, siarczków i wodorotlenków grupy III. To niezbędne do
wytrącenia siarczków II grupy stężenie osiąga się przez dobór odpowiedniego
stężenia jonów wodorowych w roztworze.
Stężenie jonów S
2-
w roztworze siarkowodoru, zgodnie z ogólnym
prawem dla słabych kwasów dwuzasadowych, równa się stałej dysocjacji
drugiego stopnia - K
2
:
[ S
2-
] = K
2
= 1,2 · 10
-15
mol/L
Znając wartość iloczynu rozpuszczalności najłatwiej wytrącającego się siarczku
grupy III ZnS :
K
sO
ZnS
= [ Zn
2+
] · [ S
2-
] = 5,4 · 10
-22
Można ustalić graniczną wartość stężenia jonów wodorowych powyżej której
nie będą wytracały się siarczki kationów III grupy. Wynosi ona 5,41·10
-13
mol/L.
Stężenie soli cynku w roztworze powinno wynosić około 0,1 mol/L.
Podstawiając tę wartość do równania na iloczyn rozpuszczalności ZnS można
obliczyć stężenie jonów siarczkowych niezbędne do wytrącenia ZnS , które
wynosi 5,4 · 10
-21
mol/L.
Z iloczynu jonowego siarkowodoru : [ H
+
]
2
· [S
2-
] = 1,1 · 10
-23
wynika, że stężenie jonów wodorowych przy którym nie wytrąci się osad ZnS
wynosi :
[
]
,
,
,
/
H
mol L
+
−
−
−
=
⋅
⋅
≅
⋅
11 10
5 4 10
4 5 10
23
21
2

Stężenie jonów wodorowych powstających po dysocjacji
siarkowodoru jest na tyle małe ( ~ 10
-4
mol/L
), że można je pominąć i przyjąć,
że środowisko 0,6 molowego HCl w roztworze kwasu siarkowodorowego daje
tak małe stężenie jonów siarczkowych, że nie zostaną przekroczone iloczyny
rozpuszczalności siarczków kationów III grupy, a więc nie pojawią się one w
osadzie.
Stężenie jonów siarczkowych z dysocjacji siarkowodoru w 0,6
molowym roztworze HCl równe 2,9 · 10
-24
mol/L, po podstawieniu do iloczynu
jonowego CdS, najłatwiej rozpuszczalnego siarczku grupy II : [ Cd
2+
] · [ S
2-
] =
1,1·10
-25
pozwala obliczyć najniższe stężenie jonów kadmowych powyżej
którego w podanych warunkach wytrąca się osad CdS.
[
]
,
,
,
/
Cd
mol L
2
25
24
2
11 10
2 9 10
3 8 10
+
−
−
−
=
⋅
⋅
=
⋅
W jakościowej analizie chemicznej przyjmuje się, że wytrącenie kationu jest
całkowite wówczas, gdy jego stężenie w roztworze nasyconym trudno
rozpuszczalnego związku nie przekracza 10
-5
mol/L. Na tej podstawie można
przyjąć, że w podanych wyżej warunkach następuje ilościowe wytrącanie
siarczku kadmu, a więc i wszystkich pozostałych siarczków II grupy, które mają
mniejsze iloczyny rozpuszczalności, a więc łatwiej się wytrącają.
XIII.3. II grupa kationów
Do II grupy należą kationy : Hg
2+
, Pb
2+
, Bi
3+
, Cu
2+
, Cd
2+
, As
3+
, As
5+
,
Sb
3+
, Sb
5+
, Sn
2+
, Sn
4+
. Odczynnikiem grupowym jest siarkowodór, otrzymany w
wyniku hydrolizy tioacetamidu ( AKT ), w środowisku kwaśnym - przy pH
około 0,5, co odpowiada roztworowi kwasu chlorowodorowego o stężeniu 0,3
mola/L.
Uzyskanie warunków prowadzących do ilościowego wytrącenia
kationów II grupy w postaci siarczków zależy od :
1. iloczynu rozpuszczalności danego siarczku
2. stężenia jonów wodorowych w roztworze
3. stężenia jonów danego metalu.
Przy założeniu, że wytrącanie siarczków zachodzi przy odpowiednim
stężeniu jonów wodorowych, a stężenia kationów w roztworze są
porównywalne, decydujący wpływ na wytrącenie osadu mają iloczyny
rozpuszczalności poszczególnych siarczków (tab. 11).
Tabela 11 .Wartości iloczynów rozpuszczalności i rozpuszczalności w mol/L
siarczków metali II grupy (298 K)
Siarczek
Iloczyn
rozpuszczal-
ności
( K
sO
)
Rozpuszczal-
ność
siarczku
w mol / L
Siarczek
Iloczyn
Rozpuszczal-
ności
( K
sO
)
Rozpuszczal-
ność
siarczku
w mol / L
Bi
2
S
3
1,82 · 10
-99
9 · 10
-21
As
2
S
5
5 · 10
-34
4 · 10
-6
SnS
2
1 · 10
-70
3 · 10
-24
As
2
S
3
4 · 10
-29
8 · 10
-7
Sb
2
S
3
3 · 10
-59
8 · 10
-13
PbS
4,4 · 10
-26
2,1 · 10
-13
HgS
2,5 · 10
-51
5,0 · 10
-26
SnS
2,2 · 10
-24
1,5 · 10
-12
CuS
1,0 · 10
-34
1,0 · 10
-17
CdS
1,1 · 10
-25
3,3 · 10
-13

Siarczki o najmniejszych wartościach iloczynów rozpuszczalności (IR ~ 10
-99
–
10
-34
) mogą się wytrącać przy bardzo małym stężeniu jonów siarczkowych, a
więc w silnie kwaśnym środowisku, jednak w tych warunkach nie nastąpiłoby
wytrącenie siarczków łatwiej rozpuszczalnych : CdS i SnS. Przy stężeniu
kwasu mniejszym niż 0,3 mola/L może się zaś wytrącić ZnS z III grupy
kationów.
Roztwory rozpuszczalnych soli kationów II grupy ( azotany ) są bez-
barwne, z wyjątkiem niebieskiej barwy soli miedzi(II).
XIII.3.1. Właściwości siarczków kationów II grupy
Kationy tej grupy w reakcji z siarkowodorem wytrącają
bezpostaciowe siarczki, nierozpuszczalne w rozcieńczonym kwasie
chlorowodorowym i siarkowym(VI). Siarczki te mają następujące barwy :
PbS, HgS, CuS - czarne
CdS, As
2
S
3
, As
2
S
5
, SnS
2
- żółte
Sb
2
S
3
, Sb
2
S
5
- pomarańczowe
SnS - brunatny
Bi
2
S
3
- ciemnobrunatny
Wytrącanie poszczególnych siarczków przebiega zawsze w ściśle
określonych warunkach. Dotyczy to w szczególności siarczków ołowiu, arsenu
i rtęci.
Siarczek ołowiu(II) PbS
Kation ołowiu(II) należy do I grupy analitycznej, w której wytrąca
się w postaci stosunkowo łatwo rozpuszczalnego chlorku ( K
sO
= 4,1 · 10
-5
, a
roz-puszczalność 1,8 · 10
-2
mol/L). Roztwór znad osadu po wytrąceniu I grupy
kationów zawiera więc stosunkowo duże stężenie jonów Pb
2+
, które w
warunkach wytrącania II grupy analitycznej tworzą osad trudno
rozpuszczalnego siarczku PbS ( K
sO
= 4,4 · 10
-26
, rozpuszczalność 2,1 · 10
-13
mol/L ).
Chlorek ołowiu(II) w reakcji z siarkowodorem tworzy przejściowo

pomarańczowy osad chlorosiarczku, który stopniowo, przy nadmiarze jonów
siarczkowych przechodzi w czarny PbS :
2PbCl
2
+ H
2
S = PbS·PbCl
2
↓
+ 2HCl
pomarańczowy
PbS·PbCl
2
+ H
2
S = 2PbS↓ + 2HCl
czarny
Siarczki arsenu (III) i (V) As
2
S
3
, As
2
S
5
Amfoteryczne właściwości soli arsenu, z przewagą kwasowych, są
przyczyną występowania związków arsenu w postaci anionów AsO
3
3-
i AsO
4
3-
,
które nie wytrącają siarczków w reakcji z siarkowodorem. Arseniany(III) i (V)
w środowisku stężonego kwasu chlorowodorowego przechodzą w kationy :
AsO
3
3-
+ 6H
+
= As
3+
+ 3H
2
O
AsO
4
3-
+ 8H
+
= As
5+
+ 4H
2
O
co umożliwia ich wytrącenie w postaci siarczków .
Ilościowe wytrącenie siarczków arsenu w słabo kwaśnym środowisku
nie jest więc możliwe, dlatego roztwór znad osadu po wytrąceniu siarczków II
grupy zawiera stosunkowo duże stężenie soli arsenu, który można wytrącić w
postaci siarczku po zakwaszeniu stężonym kwasem chlorowodorowym.
Otrzymany osad siarczków arsenu należy dołączyć do osadu siarczków II grupy
i analizować wspólnie.
Siarczek rtęci(II) HgS
Chlorek lub azotan rtęci(II) w reakcji z siarkowodorem wytrąca
związek przejściowy, chlorosiarczek rtęci(II) ,który w reakcji z nadmiarem
siarkowodoru przechodzi w czarny HgS :
2HgCl
2
+ H
2
S = HgS·HgCl
2
↓
+ 2HCl
biały
HgS·HgCl
2
+ H
2
S = 2HgS↓ + 2HCl
czarny
Pozostałe kationy w reakcji z siarkowodorem bezpośrednio wytrącają
odpowiednie siarczki :
2Bi
3+
+ 3S
2-
= Bi
2
S
3
↓

Cu
2+
+ S
2-
= CuS↓
Sn
2+
+ S
2-
= SnS↓
[SnCl
6
]
2-
+ 2S
2-
= SnS
2
↓
+ 6Cl
-
Siarczki kationów II grupy wykazują różnice w charakterze
kwasowo-zasadowym. Wyraźnie kwasowy charakter siarczków arsenu,
antymonu i cyny, z wyjątkiem SnS, związany z położeniem tych pierwiastków
układzie okresowym (14 – 15 ( IV - V) grupa ), jest powodem ich
rozpuszczalności w mocnych zasadach, siarczku amonu i wielosiarczku amonu.
Siarczek cyny(II) rozpuszcza się w wielosiarczku amonu i w
roztworach wodorotlenków sodu i potasu w obecności wody utlenionej,
bowiem z tych warunkach następuje utlenienie cyny z +2 na +4 stopień .
Siarczki arsenu, antymonu i cyny rozpuszczają się w :
1. siarczku amonu z utworzeniem tiosoli :
As
2
S
3
+ 3S
2-
= 2AsS
3
3-
As
2
S
5
+ 3S
2-
= 2AsS
4
3-
Sb
2
S
3
+ 3S
2-
= 2SbS
3
3-
Sb
2
S
5
+ 3S
2-
= 2SbS
4
3-
SnS
2
+ S
2-
= SnS
3
2-
2. wielosiarczku amonu ( odczynnik ten otrzymuje się w wyniku rozpuszczenia
siarki w siarczku amonu (NH
4
)
2
S i oprócz głównego składnika (NH
4
)
2
S
2
zawiera także inne siarczki od (NH
4
)
2
S
3
do (NH
4
)
2
S
9
, dlatego nazywany jest
wielosiarczkiem amonu, ale zawiera głównie aniony S
2
2-
):
As
2
S
3
+ 3S
2
2-
= 2AsS
4
3-
+ S↓
As
2
S
5
+ 3S
2
2-
= 2AsS
4
3-
+ 3S↓
Sb
2
S
3
+ 3S
2
2-
= 2SbS
4
3-
+ S↓
Sb
2
S
5
+ 3S
2
2-
= 2SbS
4
3-
+ 3S↓
SnS + S
2
2-
= SnS
3
2-
SnS
2
+ S
2
2-
= SnS
3
2-
+ S↓
3. mocnych zasadach NaOH, KOH :
As
2
S
3
+ 6OH
-
= AsO
3
3-
+ AsS
3
3-
+ 3H
2
O

As
2
S
5
+ 6OH
-
= AsS
4
3-
+ AsO
3
S
3-
+ 3H
2
O
Sb
2
S
3
+ 2OH
-
= SbS
2
-
+ SbOS
-
+ H
2
O
Sb
2
S
5
+ 6OH
-
= SbS
4
3-
+ SbO
3
S
3-
+ 3H
2
O
3SnS
2
+ 6OH
-
= [Sn(OH)
6
]
2-
+ 2SnS
3
2-
W reakcjach rozpuszczania siarczków arsenu , antymonu i cyny w zasadach
powstają odpowiednio : arseniany(III), tioarseniany(III), tioarseniany(V) ,
oksotioarseniany(V) , tioantymoniany(III), oksotiooantymoniany(III),
tioantymoniany(V),oksotioantymoniany(V), oraz heksahydroksocyniany(IV) i
tiocyniany(IV).
Siarczek cyny(II) rozpuszcza się w KOH lub NaOH tylko w obecności
nadtlenku wodoru tworząc tiocyniany(IV) i cyniany(IV):
3SnS + 6OH
-
+ 3H
2
O
2
= SnS
3
2-
+ 2SnO
3
2-
+ 6H
2
O
Pozostałe siarczki kationów II grupy są nierozpuszczalne w tych odczynnikach.
Z przedstawionych wyżej reakcji wynika, że wielosiarczek amonu, lub KOH z
dodatkiem H
2
O
2
można wykorzystywać do rozdzielania kationów II grupy na
dwie podgrupy, co znakomicie ułatwia przeprowadzenie analizy
systematycznej.
XIII.3.2. Ogólna charakterystyka kationów II grupy
Reakcje kationów II grupy z wybranymi odczynnikami
Mocne zasady NaOH, KOH
Rozcieńczone roztwory NaOH lub KOH wytrącają na zimno, bez użycia
nadmiaru, z roztworów soli kationów II grupy osady : Pb(OH)
2
, Cd(OH)
2
, Bi
(OH)
3
, Sb(OH)
3
, HSbO
3
, Sn(OH)
2
, Sn(OH)
4
- białe, Cu(OH)
2
- niebieski, HgO
– żółty. W obecności nadmiaru mocnej zasady następuje rozpuszczenie
wodorotlenków amfoterycznych :
Pb(OH)
2
+ 2OH
-
=
PbO
2
2-
+ 2H
2
O
ołowian(II)
Sb(OH)
3
+ OH
-
= [Sb(OH)
4
]
-
tetrahydroksoantymonian(III)

Sn(OH)
2
+ 2OH
-
= [Sn(OH)
4
]
2-
tetrahydroksocynian(II)
Sn(OH)
4
+ 2OH
-
= [Sn(OH)
6
]
2-
heksahydroksocynian(IV)
Wodorotlenki miedzi(II) i kadmu(II) reagują z roztworem amoniaku, tworząc
rozpuszczalne w wodzie aminakompleksy :
Cu(OH)
2
+ 4NH
3
= [Cu(NH
3
)
4
]
2+
+ 2OH
-
Cd(OH)
2
+ 4NH
3
= [Cd(NH
3
)
4
]
2+
+ 2OH
-
Jon tetraaminamiedziowy(II) ma barwę intensywnie niebieską, a jon
tetraamina-kadmowy jest bezbarwny.
Roztwory wodorotlenków sodu i potasu nie wytrącają osadów z roztworów soli
arsenu(III) i (V), ponieważ tworzą się rozpuszczalne w wodzie arseniany(III) i
(V).
Amoniak
Rozcieńczony roztwór amoniaku w reakcji z jonami Pb
2+
, Cd
2+
, Sb
3+
, Sn
2+
i Sn
4+
wytrąca białe osady wodorotlenków :
Pb
2+
+ 2OH
-
= Pb(OH)
2
↓
Cd
2+
+ 2OH
-
= Cd(OH)
2
↓
Sb
3+
+ 3OH
-
= Sb(OH)
3
↓
Sn
2+
+ 2OH
-
= Sn(OH)
2
↓
Sn
4+
+ 4OH
-
= Sn(OH)
4
↓
spośród których tylko wodorotlenek kadmu rozpuszczalny jest w
nadmiarze amoniaku. Rozpuszczalne sole bizmutu(III), miedzi(II), rtęci(II) i
antymonu(V) w reakcji z rozcieńczonym roztworem amoniaku tworzą sole
zasadowe lub związki kompleksowe :
Bi(NO
3
)
3
+ NH
3
+ H
2
O = Bi(OH)(NO
3
)
2
↓
+ NH
4
NO
3
biały
Bi(NO
3
)
3
+ 2NH
3
+ 2H
2
O = Bi(OH)
2
NO
3
↓
+ 2NH
4
NO
3
biały
2CuSO
4
+ 2NH
3
+ 2H
2
O =(CuOH)
2
SO
4
↓
+ (NH
4
)
2
SO
4
jasnoniebieski

HgCl
2
+ 2NH
3
= HgNH
2
Cl↓ + NH
4
Cl
biały chlorek amidortęci(II)
biały azotan(V) amidooksortęci(II)
Amoniak, podobnie jak wodorotlenki litowców, wytrąca z roztworu soli Sb(V)
biały osad kwasu metaantymonowego(V), a nie daje osadu z solami arsenu.
Nadmiar roztworu amoniaku wytrąca biały wodorotlenek bizmutu(III), oraz
rozpuszcza (CuOH)
2
SO
4
z utworzeniem intensywnie niebieskiego roztworu :
Bi
3+
+ 3OH
-
= Bi(OH)
3
↓
CuOH
+
+ 4NH
3
= [Cu(NH
3
)
4
]
2+
+ OH
-
Wszystkie osady powstałe w wyniku reakcji roztworu amoniaku z kationami
II grupy rozpuszczają się w mocnych kwasach, a ponadto wodorotlenek ołowiu
(II), wodorotlenki cyny(II) i (IV), oraz wodorotlenek antymonu(III) i kwas
metaaantymonowy(V) rozpuszczają się w nadmiarze mocnej zasady.
Hydroliza
W wyniku rozcieńczania wodą kwaśnych roztworów soli bizmutu,
antymonu i cyny zachodzi hydroliza i wytrącają się białe osady odpowiednich
oksosoli.
Spośród soli bizmutu(III) najłatwiej hydrolizuje chlorek, następnie
azotan(V), a najtrudniej siarczan(VI). W wyniku tych reakcji wytrącają się
osady chlorku tlenku bizmutu(III) BiClO, azotanu(V) tlenku bizmutu(III)
BiONO
3
i siarczanu(VI) tlenku bizmutu(III) (BiO)
2
SO
4
, które rozpuszczają się
w roz-cieńczonych kwasach mineralnych, a nie rozpuszczają się w 2 molowych
roztworach wodorotlenków litowców i w kwasie winowym, w odróżnieniu od
produktów hydrolizy soli antymonu i cyny.
Reakcje hydrolizy soli bizmutu(III) przebiegają według schematu :
Bi
3+
+ 2H
2
O D Bi(OH)
2
+
↓
+ 2H
+
↨
BiO
+
+ H
2
O
Oksosole bizmutu w reakcji z H
2
S przechodzą w siarczki :
Hg(NO
3
)
2
NH
3
H
2
O O
Hg
Hg
NH
2
NO
3
NH
4
NO
3
2
+ 4
+
=
+ 3

2BiClO + 3H
2
S = Bi
2
S
3
↓
+ 2HCl + 2H
2
O
Hydroliza niezbyt kwaśnych soli antymonu(III) i antymonu(V)
prowadzi do wytrącenia białego osadu oksosoli: chlorku tlenku antymonu(III) ,
chlorku tlenku antymonu(V), albo kwasu antymonowego(V) :
Sb
3+
+ 3Cl
-
+ H
2
O D SbClO↓ + 2H
+
+ 2Cl
-
[SbCl
6
]- + 2H
2
O D SbO
2
Cl↓ + 5Cl
-
+ 4H
+
SbO
2
Cl + 2H
2
O D H
3
SbO
4
↓
+ HCl
Osady oksochlorków antymonu rozpuszczają się w kwasie chlorowodorowym
i ,w odróżnieniu od soli bizmutu, w kwasie winowym..
Sole cyny wykazują niewielką tendencję do hydrolizy i są trwałe w
środowisku kwaśnym, jednak po rozcieńczeniu dużą ilością wody z roztworu
soli cyny(II) wytrącają się białe osady chlorku hydroksocyny(II) i wodorotlenku
cyny(II), a z roztworu soli cyny(IV) w wyniku hydrolizy wytrącają się
uwodnione tlenki cyny (SnO
2
)
x
· (H
2
O)
y
, tzw. kwasy α, którym przypisuje się
wzór kwasu ortocynowego(IV) H
4
SnO
4
. Osad kwasów α z upływem czasu
"starzeje się" i w wyniku reakcji poli-kondensacji przechodzi w
nierozpuszczalny w kwasach i zasadach kwas meta-cynowy(IV) (H
2
SnO
3
)
n
.
Jodki
Roztwór KI w reakcji z jonami Hg
2+
, Pb
2+
, Bi
3+
i Cu
2+
wytrąca :
HgI
2
- czerwony , rozpuszczalny w nadmiarze KI z utworzeniem bezbarwnego
kompleksu [HgI
4
]
2-
;
PbI
2
- żółty, rozpuszczalny w gorącej wodzie oraz w roztworze KI z
utworzeniem bezbarwnych jonów kompleksowych [PbI
4
]
2-
;
BiI
3
- brunatnoczarny, z nadmiarem KI tworzy żółtopomarańczowy jon
kompleksowy [BiI
4
]
-
;
Cu
2
I
2
- biały, powstający w wyniku rozkładu nietrwałego CuI
2
:
2Cu
2+
+ 4I
-
= 2CuI
2
↓
= Cu
2
I
2
↓
+ I
2
czarny biały brun.
Pozostałe kationy II grupy nie reagują z roztworem KI .

XIII.3.3. Analiza systematyczna II grupy kationów
( wg schematu na rys. 3 str. 99)
Oddzielanie kationów II grupy od pozostałych
Po oddzieleniu kationów I grupy, z roztworu zawierającego kationy
grup II - V wytrąca się kationy II grupy w postaci siarczków, stosując AKT w
środowisku kwaśnym (pH około 0,5).
W celu uzyskania właściwego odczynu roztworu, dodaje się
kroplami, mieszając ,stężony roztwór amoniaku, aż do odczynu zasadowego
wobec papierka uniwersalnego ( unikać nadmiaru ), a następnie 1 molowego
HCl do uzyskania odczynu słabo kwaśnego i ściśle 0,5 mL 2 molowego HCl .
Jeśli odczyn jest obojętny należy do objętości około 2 mL badanego roztworu
dodać 0,5 mL 2 molowego HCl.
Do otrzymanego roztworu dodaje się 1,5 mL AKT (około 15 kropli) i
ogrzewa na wrzącej łaźni wodnej przez co najmniej 15 minut ,wytrącając
siarczki
(osad I):
Hg
2+
+ S
2-
= HgS
↓
Pb
2+
+ S
2-
= PbS
↓
2Bi
3+
+ 3S
2-
= Bi
2
S
3
↓
Cu
2+
+ S
2-
= CuS
↓
Cd
2+
+ S
2-
= CdS
↓
2As
3+
+ 3S
2-
= As
2
S
3
↓
2As
5+
+ 5S
2-
= As
2
S
5
↓
2Sb
3+
+ 3S
2-
= Sb
2
S
3
↓
2Sb
5+
+ 5S
2-
= Sb
2
S
5
↓
Sn
2+
+ S
2-
= SnS
↓
Sn
4+
+ 2S
2-
= SnS
2
↓
Osad siarczków należy odwirować i po stwierdzeniu całkowitości wytrącenia
oddzielić od roztworu.
W celu stwierdzenia całkowitości wytrącenia siarczków arsenu,
należy do próbki roztworu dodać podobną objętość stężonego kwasu
chlorowodorowego, w celu przeprowadzenia arsenianów(III i V) w kationy,
dodać AKT i ogrzewać na łaźni wodnej. Gdy wytrąci się żółty osad
identycznie postąpić z całym roztworem, a wytrącony osad dołączyć do osadu
siarczków II grupy. Osad siarczków należy przemyć kilkoma kroplami

wrzącego roztworu zawierającego NH
4
Cl i AKT.
Roztwór I, zawierający kationy grup III - V, należy zachować do
dalszych badań.
Oddzielanie kationów podgrupy II A od II B
Rozdzielanie kationów II grupy na dwie podgrupy jest możliwe ze
względu na dobrą rozpuszczalność siarczków arsenu, antymonu i cyny w
wielosiarczku amonu, oraz w KOH w obecności nadtlenku wodoru, zgodnie z
reakcjami przedstawionymi w podrozdziale XIII.3.1.(str.84) .
Daje to możliwość zastosowania dwóch sposobów rozdziału :
1. Metoda z użyciem wielosiarczku amonu
Do osadu siarczków dodać 10 - 15 kropli wielosiarczku amonu
(żółtego) i ogrzewać na łaźni wodnej w temperaturze ok. 333 K (60
0
C) przez 5
minut. W tych warunkach siarczki arsenu, antymonu i cyny rozpuszczają się,
tworząc tiosole amonowe : (NH
4
)
3
AsS
4
, (NH
4
)
3
SbS
4
i (NH
4
)
2
SnS
3
.
Osad siarczków kationów grupy IIA :HgS, PbS, Bi
2
S
3
, CuS i CdS
(osad IIA) odwirowuje się i oddziela od roztworu w którym znajdują się jony
grupy IIB (roztwór IIB).
2. Metoda z użyciem KOH i wody utlenionej
Do osadu dodać około 1 mL 1-molowego roztworu KOH i 5 kropli 3
% H
2
O
2
, zamieszać , ogrzewać na wrzącej łaźni wodnej ok. 3 minuty i
odwirować. Oddzielony osad siarczków kationów grupy IIA (osad IIA)
przemyć dwukrotnie małą ilością wody i wodę z przemycia dołączyć do
roztworu zawierającego rozpuszczone siarczki arsenu, antymonu i cyny
(roztwór IIB).
Użycie KOH umożliwia rozpuszczenie siarczków antymonu, w odróżnieniu od
zasady sodowej, która tworzy trudno rozpuszczalny heksahydroksoantymonian
(V) sodu - Na[Sb(OH)
6
]. Dodatek H
2
O
2
jest konieczny dla utlenienia Sn
2+
do
Sn
4+
, gdyż SnS nie rozpuszcza się całkowicie w KOH.
Metoda z użyciem LiOH i KNO
3
Przeprowadzone w przez Holnessa i Trewicka (1950) badania nad wpływem
różnych odczynników na rozdział kationów grupy II na dwie podgrupy

wykazały, że stosowane do tego czasu odczynniki nie dawały czystego
rozdziału, np. siarczek amonu rozpuszcza nie tylko siarczki kationów podgrupy
IIB, lecz także częściowo HgS i CuS, a siarczek kadmu przeprowadza w stan
koloidalny. Odczynnik ten daje również duże ilości siarki po zakwaszeniu.
Mocne zasady z kolei rozpuszczają HgS w stopniu proporcjonalnym do ich
stężenia.
Najlepszym odczynnikiem do rozdziału siarczków II grupy okazał się
1% roztwór LiOH z 5% roztworem KNO
3
.
Wykonanie. Mieszaninę siarczków II grupy ogrzewa się 10 - 15 minut na łaźni
wodnej z roztworem tych odczynników. W osadzie pozostają HgS, PbS,
CuS, CdS i Bi
2
S
3
, a do roztworu przechodzą AsO
3
3-
, AsS
3
3-
, SbO
3
3-
, SbS
3
3-
i
[Sn(OH)
6
]
2-
.
Rozdzielanie kationów podgrupy IIA
Oddzielanie i identyfikacja Hg
2+
Do osadu zawierającego siarczki HgS, PbS, Bi
2
S
3
, CuS i CdS należy dodać ok.
1 mL 6 m HNO
3
, gotować kilka minut, a następnie odwirować. Wszystkie
siarczki, z wyjątkiem HgS, rozpuszczają się i przechodzą do roztworu (roztwór
IIIA) :
3PbS + 2NO
3
-
+ 8H
+
= 3Pb
2+
+ 3S↓ + 2NO↑ + 4H
2
O
Bi
2
S
3
+ 2NO
3
-
+ 8H
+
= 2Bi
3+
+ 3S↓ + 2NO↑ + 4H
2
O
3CuS + 2NO
3
-
+ 8H
+
= 3Cu
2+
+ 3S↓ + 2NO↑ + 4H
2
O
3CdS + 2NO
3
-
+ 8H
+
= 3Cd
2+
+ 3S↓ + 2NO↑ + 4H
2
O
Czarny osad HgS lub biały HgS ·Hg(NO
3
)
2
(osad IIIA) odwirowuje
się, oddziela od roztworu, przemywa kilkoma kroplami wody i przenosi do
małej parowniczki dodając 8 kropli wody królewskiej (6 kropli stęż. HCl + 2
krople stęż. HNO
3
). Zawartość parowniczki należy ostrożnie ogrzewać, aż do
rozpuszczenia się osadu i odparować prawie do sucha :
3HgS + 12Cl
-
+ 2NO
3
-
+ 8H
+
= 3[HgCl
4
]
2-
+ 2NO↑ + 4H
2
O + 3S↓
Do pozostałości w parowniczce dodać 5 - 10 kropli wody i po oddzieleniu

wydzielonej siarki, na szkiełku zegarkowym lub w probówce wykonać reakcje
charakterystyczne na jon Hg
2+
:
1. do kilku kropli badanego roztworu dodać 2 - 3 krople roztworu SnCl
2
.
Powstanie białego, ciemniejącego osadu świadczy o obecności jonu Hg
2+
:
2Hg
2+
+ Sn
2+
+ 8Cl
-
= Hg
2
Cl
2
↓
+ [SnCl
6
]
2-
biały
Hg
2
Cl
2
+ Sn
2+
+ 4Cl
-
= 2Hg↓ + [SnCl
6
]
2-
czarny
2. do kilku kropli roztworu dodawać kroplami roztwór KI. Powstanie
pomarańczowo-czerwonego osadu, rozpuszczalnego w nadmiarze odczynnika
świadczy o obecności Hg
2+
:
Hg
2+
+ 2I
-
= HgI
2
↓
HgI
2
+ 2I
-
= [ HgI
4
]
2-
bezbarwny
Wytrącanie PbSO
4
- osad IVA
Roztwór IIIA zawierający jony Pb
2+
, Bi
3+
, Cu
2+
i Cd
2+
przenosi się do
parowniczki, zadaje 2 kroplami stężonego H
2
SO
4
i ostrożnie odparowuje na
siatce, aż do ukazania się białych dymów SO
3
. Po ostygnięciu roztwór
rozcieńcza się kilkoma kroplami wody i przenosi do probówki wirówkowej.
Wytrąca się biały osad PbSO
4
:
Pb
2+
+ SO
4
2-
= PbSO
4
↓
który po odwirowaniu i oddzieleniu od roztworu przemywa się bardzo
rozcieńczonym H
2
SO
4
i rozpuszcza w octanie amonu :
PbSO
4
+ 2CH
3
COO
-
= (CH
3
COO)
2
Pb + SO
4
2-
a następnie przeprowadza reakcje charakterystyczne na jon Pb
2+
np. z chro-
mianem(VI) potasu :
Pb
2+
+ CrO
4
2-
= PbCrO
4
↓
żółty
Oddzielanie i wykrywanie Bi
3+
Roztwór IVA , po wytrąceniu i oddzieleniu PbSO
4
, zobojętnia się
stężonym amoniakiem i doprowadza do odczynu zasadowego. Wytrąca się
biały Bi(OH)
3
(osad VA), a Cu
2+
i Cd
2+
przy nadmiarze amoniaku tworzą jony

kompleksowe :ciemnoniebieski tetraaminamiedziowy(II) - [ Cu(NH
3
)
4
]
2+
i
bezbarwny tetraaminakadmowy(II) - [Cd(NH
3
)
4
]
2+
(roztwór VA).
Bi
3+
+ 3OH
-
= Bi(OH)
3
↓
Osad wodorotlenku bizmutu(III) po oddzieleniu od roztworu należy przemyć
dwukrotnie 5 kroplami wody destylowanej i przeprowadzić reakcję ze świeżo
przygotowanym trihydroksocynianem(II) sodu - Na[Sn(OH)
3
], który redukuje w
środowisku zasadowym jony bizmutu (zarówno w związkach rozpuszczalnych,
jak i nierozpuszczalnych) z utworzeniem czarnego osadu metalicznego
bizmutu:
2Bi
3+
+ 3[Sn(OH)
3
]
-
+ 9OH
-
= 2Bi
0
↓
+ 3[Sn(OH)
6
]
2-
Wykrywanie jonów miedzi i kadmu
Ciemnoniebieska barwa roztworu VA świadczy o obecności jonów
Cu
2+
. W tej sytuacji jony kadmu wykrywa się stosując cyjanek potasu, który
tworzy bezbarwne związki kompleksowe z jonami miedzi i kadmu -
tetracyjanomiedzian(I) i tetracyjanokadmian(II):
2[Cu(NH
3
)
4
]
2+
+ 10CN
-
= 2[Cu(CN)
4
]
3-
+ 8NH
3
+ (CN)
2
↑
[Cd(NH
3
)
4
]
2+
+ 4CN
-
= [Cd(CN)
4
]
2-
+ 4NH
3
W odróżnieniu od analogicznego jonu kompleksowego miedzi, jon [Cd(CN)
4
]
2-
jest dość dobrze zdysocjowany, na skutek czego stężenie jonu Cd
2+
jest
wystarczające do wytrącenia CdS. Reakcja ta pozwala wykryć jony kadmu w
obecności jonów miedzi bez konieczności uprzedniego ich rozdzielenia.
[Cd(CN)
4
]
2-
+ H
2
S = CdS↓ + 2HCN↑ + 2CN
-
żółty
Sposób postępowania przy wykrywaniu jonów Cu
2+
i Cd
2+
zależy od barwy
roztworu. Roztwór niebieski od jonu [Cu(NH
3
)
4
]
2+
może także zawierać jony
[Cd(NH
3
)
4
]
2+
. W celu wykrycia jonów kadmu dodaje się kroplami roztwór
KCN, do zupełnego odbarwienia roztworu, a następnie 5 - 10 kropli AKT i
ogrzewa. Wytrącenie żółtego osadu świadczy o obecności jonów Cd
2+
.
Bezbarwny roztwór nie zawiera jonów miedzi i w celu wytrącenia
siarczku kadmu należy dodać 5 - 10 kropli AKT i ogrzać .
Cd
2+
+ S
2-
= CdS↓ (żółty)

Rozdzielanie kationów podgrupy IIB
Wytrącanie siarczków
Po przeprowadzeniu rozdziału II grupy kationów na podgrupy przy
użyciu wielosiarczku amonu ( metoda I ) roztwór IIB zawiera jony : AsS
4
3-
,
SbS
4
3-
i SnS
3
2-
.
Roztwór ten zakwasza się rozcieńczonym kwasem chlorowodorowym w
obecności papierka lakmusowego, ogrzewa przez kilka minut, a następnie ,po
odwirowaniu osadu, sprawdza się całkowitość wytrącenia i ciecz znad osadu
wylewa. Osad IIIB zawiera As
2
S
5
, Sb
2
S
5
, SnS
2
i S :
2AsS
4
3-
+ 6H
+
= As
2
S
5
↓
+ 3H
2
S↑
2SbS
4
3-
+ 6H
+
= Sb
2
S
5
↓
+ 3H
2
S↑
SnS
3
2-
+ 2H
+
= SnS
2
↓
+ H
2
S↑
Rozdział kationów na podgrupy przy użyciu 1 molowego KOH i
wody utlenionej (metoda 2), daje roztwór IIB zawierający jony: AsO
4
3-
, SbS
2
-
,
SbOS
-
, SbS
4
3-
,SbO
3
S
3-
, [Sn(OH)
6
]
2-
i SnS
3
2-
,z którego po zakwaszeniu
rozcieńczonym kwasem chlorowodorowym wobec papierka lakmusowego,
dodaniu 5 - 10 kropel AKT i ogrzaniu wytrąca się osad siarczków: As
2
S
3
, Sb
2
S
3
,
SnS
2
i S - (osad IIIB):
2AsO
4
3-
+ 5H
2
S + 6H
+
= As
2
S
5
↓
+ 8H
2
O
Jednocześnie następuje redukcja As
5+
do As
3+
pod wpływem jonów
siarczkowych :
AsO
4
3-
+ S
2-
+ 8H
+
= As
3+
+ S
↓
+ 4H
2
O
i powstałe jony As
3+
reagują z jonami siarczkowymi :
2As
3+
+ 3S
2-
= As
2
S
3
↓
W osadzie należy się więc spodziewać mieszaniny siarczków arsenu(III) i (V).
SbS
4
3-
+ SbO
3
S
3-
+ 6H
+
= Sb
2
S
5
↓+
3H
2
O
SbS
2
-
+ SbOS
-
+ 2H
+
= Sb
2
S
3
↓
+ H
2
O
SnS
3
2-
+ 2H
+
= SnS
2
↓
+ H
2
S↑
[Sn(OH)
6
]
2-
+ 2H
2
S + 2H
+
= SnS
2
↓
+ 6H
2
O
Roztwór po oddzieleniu siarczków należy wylać.

Rozpuszczanie siarczków antymonu i cyny
Do osadu siarczków (osad IIIB) dodać 5 - 10 kropli stężonego HCl i ogrzewać
przez kilka minut na wrzącej łaźni wodnej .Następuje rozpuszczenie siarczków
antymonu i cyny:
Sb
2
S
3
+ 6H
+
= 2Sb
3+
+ 3H
2
S↑
Sb
2
S
5
+ 6H
+
= 2Sb
3+
+ 2S↓ + 3H
2
S↑(rozpuszczanie i redukcja)
SnS
2
+ 4H
+
+ 6Cl
-
= [SnCl
6
]
2-
+ 2H
2
S↑
W osadzie pozostają nierozpuszczalne w stęż. HCl siarczki arsenu: As
2
S
3
lub
As
2
S
5
i S (osad IVB) , a w roztworze jony Sb
3+
i [SnCl
6
]
2-
(roztwór IVB).
Wykrywanie arsenu
Do osadu dodać 5 - 10 kropli stężonego HNO
3
i ogrzewać do rozpu-
szczenia, a następnie usunąć bagietką wydzieloną siarkę.
3As
2
S
3
+ 28 NO
3
-
+ 4H
2
O + 4H
+
= 6H
2
AsO
4
-
+ 9 SO
4
2-
+ 28NO↑
3As
2
S
5
+ 40NO
3
-
+ 4H
2
O = 6AsO
4
3-
+ 15SO
4
2-
+ 8H
+
+ 40NO↑
Jony arsenianowe(V) należy zidentyfikować stosując reakcje
charakte-rystyczne np. dodając molibdenianu(VI) amonu (NH
4
)
2
MoO
4
i
ogrzewając do wrzenia. Żółty osad molibdoarsenianu(V) amonu wskazuje na
obecność AsO
4
3-
:
AsO
4
3-
+ 3NH
4
+
+ 12MoO
4
2-
+ 24H
+
= (NH
4
)
3
As(Mo
3
O
10
)
4
↓
+ 12H
2
O
Identyfikacja jonów antymonu i cyny
Roztwór IVB, zawierający jony Sb
3+
i [SnCl
6
]
2-
oraz nadmiar HCl i
H
2
S , po ogrzaniu w celu usunięcia siarkowodoru, podzielić na dwie części.
W pierwszej części roztworu wykrywa się jony cyny. W tym celu
dodaje się niewielką ilość opiłek żelaza i ogrzewa. Zachodzi redukcja jonów
antymonu i cyny:
2Sb
3+
+ 3Fe = 3Fe
2+
+ 2Sb↓
[SnCl
6
]
2-
+ Fe = Sn
2+
+ Fe
2+
+ 6Cl
-
Po odwirowaniu i oddzieleniu osadu, do roztworu dodać 1 - 2 krople HgCl
2
.
Biały, szarzejący osad świadczy o obecności jonu Sn
2+
:
2Hg
2+
+ 8Cl
-
+ Sn
2+
= Hg
2
Cl
2
↓
+ [SnCl
6
]
2-

Hg
2
Cl
2
+ Sn
2+
+ 4Cl
-
= Hg↓ + [SnCl
6
]
2-
Drugą część roztworu należy zbadać na obecność jonów Sb
3+
:
- jeśli nie stwierdzono uprzednio obecności Sn
2+
roztwór badany rozcieńczyć
wodą do podwójnej objętości, dodać 5 kropli AKT i ogrzewać na łaźni
wodnej.
Pomarańczowy osad Sb
2
S
3
wskazuje na obecność jonu Sb
3+
;
- jeżeli obecność Sn
2+
została stwierdzona należy roztwór zobojętnić
amoniakiem i dodać stałego kwasu szczawiowego, który tworzy trwały
kompleks z jonami cyny(IV) - [Sn(C
2
O
4
)
4
(H
2
O)
2
]
4-
, 5 kropli AKT i ogrzewać.
Pomarańczowy osad Sb
2
S
3
wskazuje na obecność jonów antymonu. Metoda ta
pozwala więc na wykrycie antymonu obok cyny.
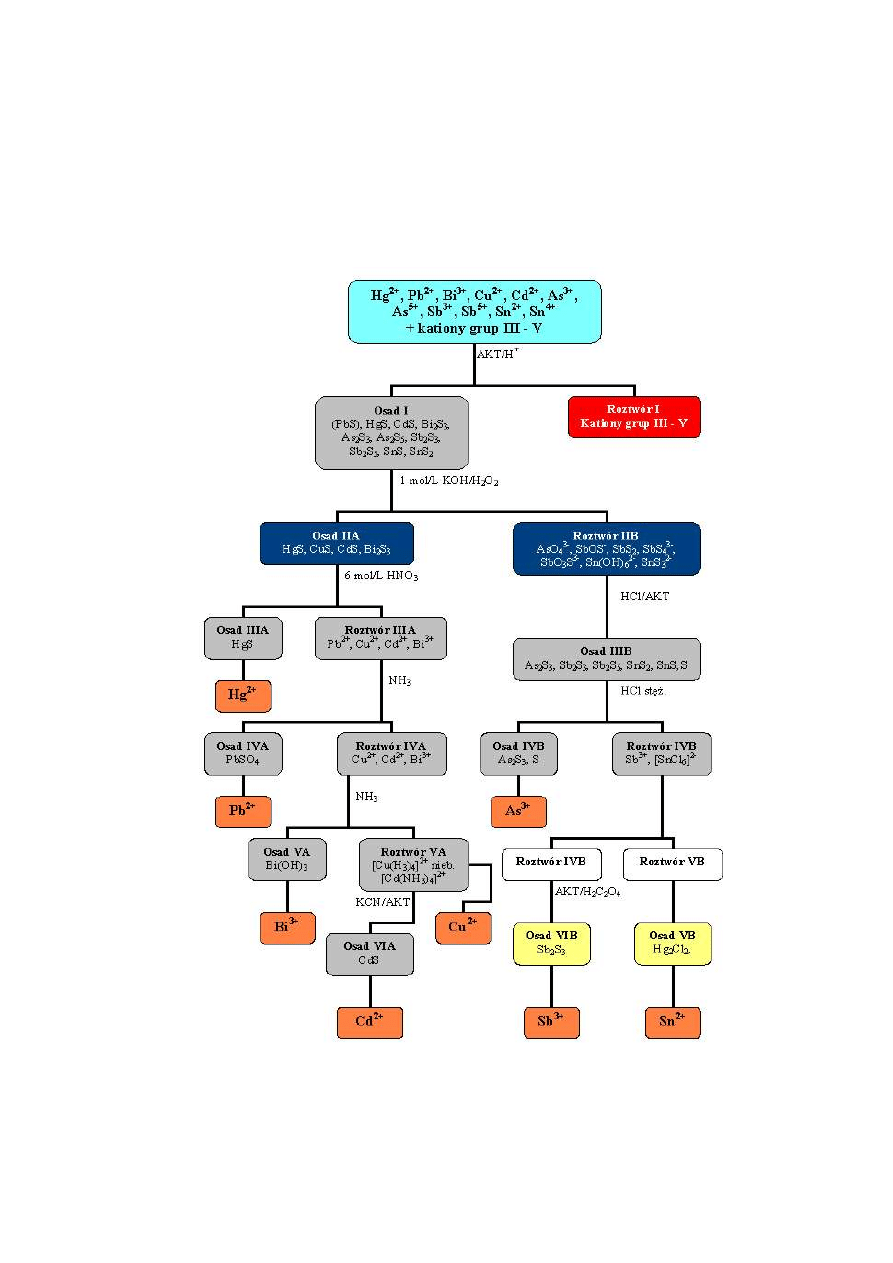
Rys. 3. Schemat analizy systematycznej II grupy kationów
metodą z użyciem KOH/ H
2
O
2
XIII.3.4. Reakcje kationów II grupy
Rtęć Hg
Właściwości rtęci omówiono przy I grupie kationów.
Reakcje jonu rtęci(II) Hg
2+
1. AKT (CH
3
CSNH
2
) i rozpuszczalne w wodzie siarczki
wytrącają białe, przechodzące w żółte i ceglaste osady soli podwójnych o
wzorze ogólnym xHgCl
2
· yHgS, które przechodzą szybko w czarny osad
siarczku :
Hg
2+
+ S
2-
= HgS↓
HgS, jeden z najtrudniej rozpuszczalnych osadów, nie rozpuszcza się w
rozcieńczonym HCl, H
2
SO
4
i gorącym HNO
3
.
Rozpuszcza się :
a) w wodzie królewskiej :
3HgS + 12Cl
-
+ 2NO
3
-
+ 8H
+
= 3[HgCl
4
]
2-
+ 2NO↑ + 3S↓ + 4H
2
O
b) w stężonych roztworach siarczków z utworzeniem tiortęcianów(II) :
HgS + K
2
S = K
2
[HgS
2
]
2. Mocne zasady NaOH, KOH
wytrącają żółty osad tlenku rtęci(II), nierozpuszczalny w nadmiarze odczynnika
:
Hg
2+
+ 2OH
-
= HgO↓ + H
2
O
3. Amoniak NH
3
z roztworem HgCl
2
( sublimat ) tworzy biały osad chlorku amidortęci(II) :
HgCl
2
+ 2NH
3
= HgNH
2
Cl↓ + NH
4
Cl
w reakcji z Hg(NO
3
)
2
daje biały osad azotanu(V) amidooksortęci(II) :
4. Jodki
wytrącają żółty, przechodzący szybko w czerwony , osad jodku rtęci(II),
rozpuszczalny w nadmiarze jodku potasu z utworzeniem bezbarwnego
Hg(NO
3
)
2
NH
3
H
2
O O
Hg
Hg
NH
2
NO
3
NH
4
NO
3
2
+ 4
+
=
+ 3

jodortęcianu(II) [HgI
4
]
2-
:
Hg
2+
+ 2I
-
= HgI
2
↓
HgI
2
+ 2I
-
= [HgI
4
]
2-
5. Chromian(VI) potasu K
2
CrO
4
wytrąca czerwonobrunatny osad chromianu(VI) rtęci(II), rozpuszczalny w
kwasach:
Hg
2+
+ CrO
4
2-
= HgCrO
4
↓
6. Tiocyjanian potasu KSCN
wytrąca biały osad Hg(SCN)
2
, rozpuszczalny w nadmiarze odczynnika z
utworzeniem jonu tetratiocyjanortęcianowego(II) :
Hg
2+
+ 2SCN
-
= Hg(SCN)
2
↓
Hg(SCN)
2
+ 2SCN
-
= [Hg(SCN)
4
]
2-
7. Chlorek cyny(II) SnCl
2
redukuje sole rtęci(II) początkowo do białego chlorku dirtęci(II) :
2Hg
2+
+ 8Cl
-
+ Sn
2+
= Hg
2
Cl
2
↓ + [SnCl
6
]
2-
który przy dalszym dodawaniu chlorku cyny(II) szarzeje na skutek tworzenia
czarnego osadu metalicznej rtęci :
Hg
2
Cl
2
+ Sn
2+
+ 4Cl
-
= 2Hg↓ + [SnCl
6
]
2-
8. Jodek miedzi(I) CuI
wytrąca z roztworu soli rtęci(II) w obecności KI pomarańczowoczerwony osad
Cu
2
[HgI
4
] trwały nawet w bardzo kwaśnym środowisku.
Wykonanie : Do 1 mL 10% roztworu CuSO
4
dodać 1 mL 5% KI i 20% roztw.
Na
2
SO
3
do odbarwienia wydzielonego jodu, oraz parę kropli 1 molowego HCl
do zakwaszenia. Do powstałej zawiesiny CuI dodać 1 mL badanej próbki
zakwaszonej 1 molowego HNO
3
lub HCl . W obecności Hg
2+
wytrąca się biały
osad CuI barwi się na kolor intensywnie pomarańczowoczerwony. Reakcja jest
charakterystyczna dla jonów rtęciowych(II) i pozwala je wykryć w obecności
innych kationów.

Bizmut Bi
6s
2
p
3
Bizmut jest metalem leżącym w 15(VA) grupie układu okresowego i
tworzy związki na +3 i +5 stopniu utlenienia, przy czym związki bizmutu(V) są
nietrwałe.
Sole bizmutu(III) ulegają w wodzie hydrolizie tworząc oksosole z
kationem BiO
+
„bizmutylowym”, lub wodorotlenek o właściwościach
zasadowych..
Sole bizmutu(III) mocnych kwasów są łatwo rozpuszczalne w
kwasach. W środowisku obojętnym i słabo kwaśnym ulegają hydrolizie,
przechodząc w trudno rozpuszczalne sole zasadowe z kationem BiO
+
.
Do nierozpuszczalnych związków bizmutu należą : Bi
2
S
3
, BiO(OH),
BiPO
4
, BiI
3
, oraz sole bizmutylowe - (BiO)
2
Cr
2
O
7
, BiClO, BiBrO i BiIO.
Reakcje jonu Bi
3+
1. AKT (CH
3
CSNH
2
) i rozpuszczalne w wodzie siarczki
wytrącają brunatny siarczek bizmutu(III) :
2Bi
3+
+ 3S
2-
= Bi
2
S
3
↓
Bi
2
S
3
nie rozpuszcza się w rozcieńczonych kwasach na zimno i w
siarczkach metali alkalicznych. Rozpuszcza się w gorącym rozcieńczonym
HNO
3
i gorącym stężonym HCl:
Bi
2
S
3
+ 2NO
3
-
+ 8H
+
= 2Bi
3+
+ 2NO↑ + 3S↓ + 4H
2
O
2. Mocne zasady NaOH, KOH
wytrącają biały osad wodorotlenku bizmutu(III), nierozpuszczalny w nadmiarze
mocnej zasady:
Bi
3+
+ 3OH
-
= Bi(OH)
3
↓
Wodorotlenek bizmutu(III) ogrzewany żółknie przechodząc w tlenek
wodorotlenek bizmutu(III) BiO(OH).
3. Amoniak NH
3
z roztworów soli bizmutu(III) wytrąca zasadowe sole o różnym składzie,
nierozpuszczalne w nadmiarze odczynnika, w odróżnieniu od Cu(OH)
2
i
Cd(OH)
2
.

4. Jodki
wytrącają ciemnobrunatny osad jodku bizmutu(III), rozpuszczalny w
nadmiarze odczynnika z utworzeniem jonu jodobizmutanowego(III), który daje
ciemno-pomarańczowe zabarwienie roztworu:
Bi
3+
+ 3I
-
= BiI
3
↓
BiI
3
+
I
-
= [BiI
4
]
-
Po rozcieńczeniu wodą wytrąca się pomarańczowy osad jodku tlenku bizmutu
(III) BiIO:
[BiI
4
]
-
+ H
2
O = BiIO↓ + 2H
+
+ 3I
-
5. Chromiany(VI) i dichromiany(VI) , K
2
CrO
4
i K
2
Cr
2
O
7
wytrącają ze słabo kwaśnych roztworów żółtopomarańczowy osad dichromianu
(VI) tlenku bizmutu(III), nierozpuszczalny w zasadach (w odróżnieniu od
PbCrO
4
), rozpuszczalny w rozcieńczonych HCl i HNO
3
:
2Bi
3+
+ Cr
2
O
7
2-
+ 2H
2
O = (BiO)
2
Cr
2
O
7
↓ + 4H
+
6. Trihydroksocynian(II) sodu Na[Sn(OH)
3
]
w środowisku zasadowym redukuje związki bizmutu do czarnego metalicznego
bizmutu. Cynian(II) sodu przygotowuje się dodając rozcieńczony roztwór
NaOH do roztworu SnCl
2
aż do momentu rozpuszczenia powstałego
początkowo białego wodorotlenku cyny(II) :
Sn
2+
+ 2OH
-
= Sn(OH)
2
↓
Sn(OH)
2
+ OH
-
= [Sn(OH)
3
]
-
2Bi
3+
+ 3[Sn(OH)
3
]
-
+ 9OH
-
= 2Bi↓ + 3[Sn(OH)
6
]
2-
W reakcji tej należy unikać dużego nadmiaru stężonego ługu, i reakcję
prowadzić na zimno, ze względu na możliwość zajścia reakcji
dysproporcjonowania cynianu(II) z utworzeniem czarnego osadu metalicznej
cyny :
2[Sn(OH)
3
]
-
= [Sn(OH)
6
]
2-
+ Sn↓
7. Hydroliza soli bizmutu(III)
Woda dodawana w większych ilościach do kwaśnych roztworów zawierających
sole bizmutu(III) wytrąca białe osady soli BiO
+
, przy czym najłatwiej

hydrolizuje chlorek, następnie azotan(V), a najtrudniej siarczan(VI) bizmutu
(III), tworząc osady nierozpuszczalne w 2 m roztworach wodorotlenków
alkalicznych, w odróżnieniu od osadów otrzymanych w wyniku hydrolizy soli
antymonu i cyny:
BiCl
3
+ H
2
O = BiClO↓ + 2HCl
Bi(NO
3
)
3
+ H
2
O = BiO(NO
3
) ↓ + 2HNO
3
Bi
2
(SO
4
)
3
+ 2H
2
O
= (BiO)
2
SO
4
↓ + 2H
2
SO
4
Oksosole bizmutu(III) rozpuszczają się w mocnych kwasach mineralnych, a
pod wpływem H
2
S przechodzą w siarczki.
Miedź Cu
3d
10
4s
1
Miedź jest metalem półszlachetnym leżącym w grupie 11(I B) układu
okresowego. Miedź w związkach może występować na +1 i +2 stopniu
utlenienia, przy czym związki miedzi(I) są przeważnie trudno rozpuszczalne w
wodzie i wykazują tendencję do utleniania się do związków miedzi(II).
Jony Cu
2+
w roztworze wodnym dają charakterystyczne niebieskie
zabarwienie, co jest wynikiem hydratacji prowadzącej do powstawania jonów
kompleksowych [Cu(H
2
O)
4
]
2+
, a ponadto tworzą także inne jony kompleksowe
z liczbą koordynacyjną 4 :[ CuCl
4
]
2-
i [ Cu(NH
3
)
4
]
2+
.
Do rozpuszczalnych soli miedzi(II) zaliczamy : CuSO
4
, Cu(NO
3
)
2
,
CuCl
2
, Cu(CH
3
COO)
2
, natomiast CuS, Cu(OH)
2
, Cu
2
[Fe(CN)
6
] i Cu
3
(PO
4
)
2
są
trudno rozpuszczalne.
Reakcje jonu Cu
2+
1. AKT (CH
3
CSNH
2
) i rozpuszczalne w wodzie siarczki
wytrącają czarny osad siarczku miedzi(II) :
Cu
2+
+ S
2-
= CuS↓
CuS nie rozpuszcza się w rozcieńczonych kwasach mineralnych i w siarczkach
alkalicznych na zimno. Rozpuszcza się w gorącym rozcieńczonym HNO
3
:
3CuS + 2NO
3
-
+ 8H
+
= 3Cu
2+
+ 3S↓ + 2NO↑ + 4H
2
O

2. Mocne zasady NaOH, KOH
wytrącają niebieski osad wodorotlenku miedzi(II) , który czernieje podczas
gotowania przechodząc stopniowo w czarny CuO:
Cu
2+
+ 2OH
-
= Cu(OH)
2
↓
Cu(OH)
2
= CuO + H
2
O
3. Amoniak NH
3
dodawany w małej ilości wytrąca jasnoniebieski osad soli zasadowej, łatwo
rozpuszczalny w nadmiarze odczynnika z utworzeniem jonu tetraaminamiedzi
(II), który zabarwia roztwór na kolor intensywnie lazurowy:
2Cu
2+
+ 2SO
4
2-
+ 2NH
3
+ 2H
2
O = Cu
2
(OH)
2
SO
4
↓ + 2NH
4
+
+ SO
4
2-
Cu
2
(OH)
2
SO
4
+ 8NH
3
= 2[Cu(NH
3
)
4
]
2+
+ SO
4
2-
+ 2OH
-
W wyniku zakwaszenia następuje rozkład kompleksu i zmiana zabarwienia
lazurowego na niebieskie.
4. Jodki
wytrącają początkowo czarny jodek miedzi(II), który rozkłada się natychmiast z
wydzieleniem białego jodku miedzi(I) i wolnego jodu, który zabarwia
roztwór na brunatno:
2Cu
2+
+ 4I
-
= 2CuI
2
↓ = 2CuI↓ + I
2
5. Heksacyjanożelazian(II) potasu K
4
[Fe(CN)
6
]
wytrąca z obojętnych, lub zakwaszonych kwasem octowym roztworów
czerwonobrunatny osad heksacyjanożelazianu(II) miedzi(II):
2Cu
2+
+
[Fe(CN)
6
]
4-
= Cu
2
[Fe(CN)
6
] ↓
6. Cyjanek potasu KCN
wytrąca początkowo żółty cyjanek miedzi(II) który jest związkiem bardzo
nietrwałym i ulega rozkładowi do cyjanku miedzi(I) i dicyjanu:
Cu
2+
+ 2CN
-
= Cu(CN)
2
↓
2Cu(CN)
2
= 2CuCN↓ + (CN)
2
↑
Powstający cyjanek miedzi(I) rozpuszcza się w nadmiarze cyjanku potasu
tworząc bezbarwny jon tetracyjanomiedzianowy(I):
CuCN + 3CN
-
= [Cu(CN)
4
]
3-

Jon ten jest bardzo trwały, tzn. w niewielkim stopniu dysocjuje na jony Cu
+
i
CN
-
, dlatego siarkowodór w reakcji z [Cu(CN)
4
]
3-
nie wytrąca siarczku miedzi
(I), w odróżnieniu od Cd
2+
.
7. Metale
leżące w szeregu napięciowym przed miedzią (np. Al, Zn, Fe ) wypierają
wolną miedź z roztworu jej soli.
Cu
2+
+ Fe = Cu + Fe
2+
8. Lotne sole miedzi np. Cu(NO
3
)
2
, CuCl
2
barwią płomień palnika na kolor zielony lub niebieski.
Kadm Cd
4d
10
5s
2
Kadm leży w grupie 12 (II B) układu okresowego i w związkach
występuje na +2 stopniu utlenienia. Wszystkie proste sole kadmu są bezbarwne,
z wyjątkiem CdS, który ma intensywnie żółtą barwę.
Do rozpuszczalnych soli kadmu należą białe:Cd(NO
3
)
2
, Cd(NO
2
)
2
,
Cd(CH
3
COO)
2
, CdCl
2
, CdBr
2
, CdI
2
i CdSO
4
. Jon Cd
2+
tworzy jony
kompleksowe: [CdCl
4
]
2-
, [CdI
4
]
2-
, [Cd(NH
3
)
4
]
2+
, [Cd(CN)
4
]
2-
. Sole rozpuszczalne
w wodzie wykazują przeważnie, wskutek hydrolizy , odczyn kwaśny.
W wodzie nie rozpuszczają się : Cd(OH)
2
, CdS, Cd
3
(PO
4
)
2
, CdC
2
O
4
,
CdCO
3
, Cd
2
[Fe(CN)
6
] i Cd
3
[Fe(CN)
6
]
2
. Związki te rozpuszczają się w kwasach.
Reakcje jonu Cd
2+
1. AKT (CH
3
CSNH
2
) i rozpuszczalne w wodzie siarczki
wytrącają z roztworów obojętnych i słabo kwaśnych jasnożółty osad siarczku
kadmu:
Cd
2+
+ S
2-
= CdS↓
CdS nie rozpuszcza się w rozcieńczonych kwasach i zasadach, z wyjątkiem
rozcieńczonego gorącego kwasu azotowego(V) :
3CdS + 2NO
3
-
+ 8H
+
= 3Cd
2+
+ 2NO↑ + 3S↓ + 4H
2
O
Rozpuszcza się w stężonych roztworach chlorków (np. NaCl), w odróżnieniu

od pozostałych siarczków II grupy :
CdS + 4Cl
-
= [CdCl
4
]
2-
+ S
2-
2. Mocne zasady NaOH, KOH
wytrącają biały osad wodorotlenku kadmu, nierozpuszczalny w nadmiarze
odczynnika:
Cd
2+
+ 2OH
-
= Cd(OH)
2
↓
3. Amoniak NH
3
wytrąca biały osad wodorotlenku kadmu, łatwo rozpuszczalny w nadmiarze
odczynnika z utworzeniem wodorotlenku tetraaminakadmowego :
Cd
2+
+ 2OH
-
= Cd(OH)
2
↓
Cd(OH)
2
+ 4NH
3
= [Cd(NH
3
)
4
](OH)
2
4. Jodki
nie wytrącają osadu, w odróżnieniu od pozostałych kationów grupy IIA.
5. Heksacyjanożelazian(II) potasu K
4
[Fe(CN)
6
] i heksacyjanożelazian(III)
potasu K
3
[Fe(CN)
6
]
wytrącają odpowiednio, biały osad heksacyjanożelazianu(II) kadmu :
2Cd
2+
+ [Fe(CN)
6
]
4-
= Cd
2
[Fe(CN)
6
] ↓
oraz pomarańczowożółty osad heksacyjanożelazianu(III) kadmu :
3Cd
2+
+ 2[Fe(CN)
6
]
3-
= Cd
3
[Fe(CN)
6
]
2
↓
6. Cyjanek potasu KCN
wytrąca biały osad cyjanku kadmu, łatwo rozpuszczalny w nadmiarze
odczynnika, z utworzeniem bezbarwnego jonu tetracyjanokadmianowego :
Cd
2+
+ 2CN
-
= Cd(CN)
2
↓
Cd(CN)
2
+ 2CN
-
= [Cd(CN)
4
]
2-
Jon [Cd(CN)
4
]
2-
w odróżnieniu od [Cu(CN)
4
]
3-
jest dość dobrze zdysocjowany,
co zapewnia uzyskanie stężenia jonów kadmowych wystarczającego do
wytrącenia osadu CdS .

Arsen As
4s
2
p
3
Arsen leży w grupie 15 (V A) układu okresowego i występuje na +3
i +5 stopniu utlenienia. Arsen tworzy tlenki As
2
O
3
i As
2
O
5
, oba o
właściwościach amfoterycznych z przewagą kwasowych, co powoduje że arsen
w związkach występuje przeważnie w postaci anionów: arsenianów(III) AsO
3
3-
i AsO
2
-
lub arsenianów(V) AsO
4
3-
. Arsen jako kation występuje jedynie w
nielicznych związkach np. As
2
S
3
, AsCl
3
, As
2
S
5.
Do trudno rozpuszczalnych soli zaliczamy : As
2
S
3
, As
2
S
5
, Ag
3
AsO
4
,
CuHAsO
3
, MgNH
4
AsO
4
, (NH
4
)
3
As(Mo
3
O
10
)
4
.
Reakcje jonów arsenu(III) As
3+
; AsO
3
3-
1. AKT (CH
3
CSNH
2
) i rozpuszczalne w wodzie siarczki
wytrącają z roztworów zawierających jony As
3+
żółty siarczek arsenu(III) :
2As
3+
+ 3S
2-
= As
2
S
3
↓
Gdy arsen występuje w roztworze w postaci anionu, należy go przeprowadzić w
kation silnie zakwaszając roztwór :
AsO
3
3-
+ 6H
+
= As
3+
+ 3H
2
O
Siarczek arsenu(III) nie rozpuszcza się w rozcieńczonych kwasach, w
odróżnieniu od siarczków antymonu i cyny.
Rozpuszcza się w :
a) wodorotlenkach metali alkalicznych ( NaOH, KOH ), z utworzeniem
arsenianu(III) i tioarsenianu(III) :
As
2
S
3
+ 6OH
-
= AsO
3
3-
+ AsS
3
3-
+ 3H
2
O
Po zakwaszeniu roztworu ponownie wytrąca się siarczek arsenu(III) :
AsS
3
3-
+ AsO
3
3-
+ 6H
+
= As
2
S
3
↓ + 3H
2
O
b) gorącym, stężonym kwasie azotowym :
3As
2
S
3
+ 28HNO
3
+ 4H
2
O = 6H
3
AsO
4
+ 9H
2
SO
4
+ 28NO↑
c) stężonym roztworze węglanu amonu i węglanów metali alkalicznych, w
odróżnieniu od siarczków antymonu i cyny :
As
2
S
3
+ 3CO
3
2-
= 3CO
2
↑ + AsO
3
3-
+ AsS
3
3-

d) siarczku amonu (NH
4
)
2
S i wielosiarczku amonu (NH
4
)
2
S
2
:
As
2
S
3
+ 3S
2-
= 2AsS
3
3-
As
2
S
3
+ 3S
2
2-
= 2AsS
4
3-
+ S↓
2. Roztwór jodu I
2
ulega odbarwieniu na skutek redukcji do bezbarwnego jonu jodkowego :
AsO
3
3-
+ I
2
+ H
2
O AsO
4
3-
+ 2I
-
+ 2H
+
Reakcja jest odwracalna, bowiem powstające jony jodkowe mogą redukować
jony arsenianowe(V) do arsenianowych(III) i nie obserwuje się odbarwienia
roztworu. Aby temu zapobiec należy dodać roztworu wodorowęglanu sodu,
który wiąże powstające jony wodorowe tworząc słabo zdysocjowany kwas
węglowy i przesuwa równowagę reakcji w stronę produktów :
HCO
3
-
+ H
+
H
2
CO
3
Nie należy stosować mocnych zasad, ponieważ reagują z jodem.
3. Roztwór azotanu(V) srebra(I) AgNO
3
wytrąca żółty osad arsenianu(III) srebra(I) :
3Ag
+
+ AsO
3
3-
= Ag
3
AsO
3
↓
4. Mieszanina magnezowa ( roztwór MgCl
2
+ NH
4
Cl + NH
3
)
nie wytrąca osadu z roztworów arsenianów(III), w odróżnieniu od arsenianów
(V).
5. Molibdenian(VI) amonu (NH
4
)
2
MoO
4
nie wytrąca osadu z roztworu arsenianów(III).
Reakcje jonów arsenu(V) As
5+
; AsO
4
3-
1.AKT (CH
3
CSNH
2
) i rozpuszczalne w wodzie siarczki
wytrącają z roztworów zawierających As
5+
żółty osad siarczku arsenu(V) :
2As
5+
+ 5S
2-
= As
2
S
5
↓
Jeżeli w roztworze arsen znajduje się w postaci anionu AsO
4
3-
, należy go
przeprowadzić w kation , zakwaszając roztwór, podobnie jak przy jonie
arsenianowym(III).

Siarczek arsenu(V) ,podobnie jak As
2
S
3,
nie rozpuszcza się w rozcieńczonych
kwasach, a także w gorącym, stężonym kwasie chlorowodorowym.
As
2
S
5
rozpuszcza się w :
a) mocnych zasadach ( NaOH, KOH ) z utworzeniem tioarsenianu(V) i
oksotioarsenianu(V) :
As
2
S
5
+ 6OH
-
= AsS
4
3-
+ AsO
3
S
3-
+ 3H
2
O
Po zakwaszeniu roztworu ponownie wytrąca się siarczek arsenu(V) :
AsS
4
3-
+ AsO
3
S
3-
+ 6H
+
= As
2
S
5
↓ + 3H
2
O
b) gorącym, stężonym kwasie azotowym(V) :
3As
2
S
5
+ 40HNO
3
+ 4H
2
O = 6H
3
AsO
4
+ 40NO↑ + 15H
2
SO
4
c) stężonym roztworze węglanu amonu i węglanów metali alkalicznych, w
odróżnieniu od siarczków antymonu i cyny :
As
2
S
5
+ 3CO
3
2-
= AsS
4
3-
+ AsO
3
S
3-
+ 3CO
2
↑
d) siarczku amonu (NH
4
)
2
S i w wielosiarczku amonu (NH
4
)
2
S
2
:
As
2
S
5
+ 3S
2-
= 2AsS
4
3-
As
2
S
5
+ 3S
2
2-
= 2AsS
4
3-
+ 3S↓
e) mocnych zasadach ( NaOH, KOH ) z dodatkiem nadtlenku wodoru :
As
2
S
5
+ 20H
2
O
2
+ 16OH
-
= 2AsO
4
3-
+ 5SO
4
2-
+ 28H
2
O
2. Jodki
z jonami arsenianowymi, w środowisku kwaśnym, dają brunatne zabarwienie
roztworu, na skutek utlenienia I
-
do I
2
:
AsO
4
3-
+ 2I
-
+ 2H
+
= AsO
3
3-
+ I
2
+ H
2
O
3. Roztwór azotanu(V) srebra(I) AgNO
3
wytrąca arseniany(V) w postaci czekoladowo-brunatnego osadu arsenianu(V)
srebra(I) :
3Ag
+
+ AsO
4
3-
= Ag
3
AsO
4
↓
4. Mieszanina magnezowa (roztwór MgCl
2
+ NH
4
Cl + NH
3
)
wytrąca z roztworów arsenianu(V) biały osad arsenianu(V) amonu i magnezu :
Mg
2+
+ NH
4
+
+ AsO
4
3-
= MgNH
4
AsO
4
↓

5. Molibdenian(VI) amonu (NH
4
)
2
MoO
4
dodawany w nadmiarze do roztworu zawierającego arsenian(V) i stężony kwas
azotowy(V), wytrąca na gorąco żółty osad trimolibdoarsenianu(V) amonu :
AsO
4
3-
+ 3NH
4
+
+ 12MoO
4
2-
+ 24H
+
= (NH
4
)
3
As(Mo
3
O
10
)
4
↓ + 2H
2
O
Metody wykrywania małych ilości arsenu
Poza podanymi poprzednio reakcjami, istnieją próby specjalne,
pozwalające wykryć minimalne ilości arsenu, niezależnie od charakteru
połączeń w jakich występuje.
Próba Marsha
Przeprowadza się redukcję związków arsenu do arsenowodoru, pod
wpływem wodoru in statu nascendi, otrzymanego w reakcji cynku z kwasem
siarkowym(VI) :
Zn + H
2
SO
4
= ZnSO
4
+2H↑
AsO
4
3-
+ 8H + 3H
+
= AsH
3
↑ + 4H
2
O
Powstający w trakcie reakcji arsenowodór, pod wpływem ogrzewania bez
dostępu powietrza w trudno topliwej rurce szklanej, rozkłada się na wodór i
arsen ,tworzący na zimnych częściach rurki tzw. lustro arsenowe :
4AsH
3
= As
4
↓ + 6H
2
↑
Podobną reakcję daje antymon, jednak powstałe lustro antymonowe nie
rozpuszcza się w chloranach(I) metali alkalicznych i w wodzie utlenionej, w
przeciwieństwie do lustra arsenowego.
Próba Gutzeita
Jest to zmodyfikowana próba Marsha i różni się sposobem
identyfikacji powstającego arsenowodoru, który ze stężonym roztworem
AgNO
3
( 50 % ), lub z kryształkami stałego AgNO
3
tworzy sól podwójną o
żółtej barwie :
6AgNO
3
+ AsH
3
= Ag
3
As·3AgNO
3
↓ + 3HNO
3
Powstająca sól rozkłada się pod wpływem wody z wydzieleniem metalicznego
srebra, co powoduje zczernienie osadu :
Ag
3
As·3AgNO
3
+ 3H
2
O = H
3
AsO
3
+ 3HNO
3
+ 6Ag↓

Wykonanie :
Do probówki z badaną substancją dodaje się niewielkie ilości Zn i H
2
SO
4
,
probówkę u wylotu zatyka się zwitkiem waty i nad wylotem probówki, z której
ulatnia się AsH
3
, umieszcza się bibułę z kryształkiem AgNO
3
. Po zżółknięciu
kryształka bibułę zwilża się wodą - następuje zczernienie.
Próba Bettendorffa
Nasycony roztwór chlorku cyny(II) w stężonym kwasie chlorowodorowym
redukuje związki arsenu do wolnego arsenu. Roztwór początkowo zabarwia się
na brunatno, a następnie wytrąca się czarny osad arsenu :
3Sn
2+
+ 18Cl
-
+ 2As
3+
= 3[SnCl
6
]
2-
+ 2As↓
2AsO
2
-
+ 3Sn
2+
+ 18Cl
-
+ 8H
+
= 2As↓ + 3[SnCl
6
]
2-
+ 4H
2
O
Reakcji tej nie przeszkadza obecność jonów Pb
2+
, Cu
2+
, Cd
2+
i Sb
3+
.
Antymon Sb
5s
2
p
3
Antymon jest metalem tworzącym związki na +3 i +5 stopniu
utlenienia, jednak ze względu na właściwości amfoteryczne jego tlenków
(Sb
2
O
3
i Sb
2
O
5
) tworzy dwa szeregi soli, w których antymon występuje w
postaci kationów : Sb
3+
i Sb
5+
lub anionów : SbO
3
3-
i SbO
4
3-
.
Sole antymonu w roztworach wodnych ulegają daleko posuniętej
hydrolizie, podobnie jak sole bizmutu.
Do trudno rozpuszczalnych soli antymonu należą : Sb
2
S
3
, Sb
2
S
5
, oraz
kwasy : H
3
SbO
3
, H
3
SbO
4
, H[Sb(OH)
6
] i ich sole : Ag
3
SbO
3
, Ag
3
SbO
4
i Na[Sb
(OH)
6
].
Reakcje jonów antymonu(III) Sb
3+
; SbO
3
3-
1. AKT CH
3
CSNH
2
i rozpuszczalne w wodzie siarczki
wytrącają ze słabo kwaśnych roztworów pomarańczowy siarczek antymon (III):
2Sb
3+
+3S
2-
= Sb
2
S
3
↓

Siarczek antymonu(III) rozpuszcza się :
a) w stężonym HCl, w odróżnieniu od As
2
S
3
:
Sb
2
S
3
+ 6H
+
= 2Sb
3+
+ 3H
2
S↑
b) w siarczku i wielosiarczku amonu, z utworzeniem tioantymonianu(III) i
tioantymonianu(V) :
Sb
2
S
3
+ 3S
2-
= 2SbS
3
3-
Sb
2
S
3
+ 3S
2
2-
= 2SbS
4
3-
+ S↓
c) w wodorotlenkach sodu i potasu, z utworzeniem tioantymonianu(III) i
oksotioantymonianu(III) :
Sb
2
S
3
+ 2OH
-
= SbS
2
-
+ SbOS
-
+ H
2
O
Po zakwaszeniu roztworu ponownie wytrąca się osad siarczku antymonu(III).
Sb
2
S
3
nie rozpuszcza się w węglanie amonu, w odróżnieniu od siarczków
arsenu.
2. Mocne zasady i amoniak NaOH, KOH, NH
3
wytrącają biały osad wodorotlenku antymonu(III), któremu przypisuje się
raczej wzór uwodnionego tlenku - Sb
2
O
3
· xH
2
O :
Sb
3+
+ 3OH
-
= Sb(OH)
3
↓
Osad rozpuszcza się w stężonym wodorotlenku z utworzeniem antymonianu
(III) :
Sb(OH)
3
+ OH
-
= [Sb(OH)
4
]
-
3. Hydroliza
Woda powoduje hydrolizę niezbyt kwaśnych roztworów soli antymonu(III) i
wytrącenie białego osadu hydrokso- lub oksosoli, który przy dalszej hydrolizie
przechodzi w uwodniony tlenek antymonu(III) Sb
2
O
3
· H
2
O :
SbCl
3
+ H
2
O Sb(OH)Cl
2
↓ + HCl
Sb(OH)Cl
2
+ H
2
O Sb(OH)
2
Cl↓ + HCl
Sb(OH)
2
Cl = SbClO↓ + H
2
O
chlorek tlenek antymonu(III)
4. Metale : Zn, Fe, Sn
redukują sole antymonu(III) do wolnego antymonu, wytrącającego się w

postaci czarnego osadu:
2Sb
3+
+ 3Fe
0
=
3Fe
2+
+ 2Sb
0
↓
5. Jodki
wytrącają ze słabo kwaśnych stężonych roztworów żółty osad jodku antymonu
(III), rozpuszczalny w nadmiarze odczynnika :
Sb
3+
+ 3I
-
= SbI
3
↓
Reakcje jonów antymonu(V) : Sb
5+
; SbO
4
3-
1. AKT (CH
3
CSNH
2
) i rozpuszczalne w wodzie siarczki
wytrącają ze słabo kwaśnych roztworów czerwonopomarańczowy osad siarczku
antymonu(V):
2Sb
5+
+ 5S
2-
= Sb
2
S
5
↓
Siarczek antymonu(V) rozpuszcza się :
a) w stężonym HCl, w odróżnieniu od siarczków arsenu :
Sb
2
S
5
+ 10H
+
= 2Sb
5+
+ 5H
2
S↑
b) w siarczku i wielosiarczku amonu z utworzeniem tioantymonianu(V) :
Sb
2
S
5
+ 3S
2-
= 2SbS
4
3-
Sb
2
S
5
+ 3S
2
2-
= 2SbS
4
3-
+ 3S↓
c) w wodorotlenku potasu ( w reakcji z NaOH tworzy się trudno rozpuszczalny
heksahydroksoantymonian(V) sodu Na[Sb(OH)
6
]):
Sb
2
S
5
+ 6OH
-
= SbS
4
3-
+ SbO
3
S
3-
+ 3H
2
O
Po zakwaszeniu roztworu zawierającego tiosole i oksotiosole wytrąca się
czerwonopomarańczowy Sb
2
S
5
.
Siarczek antymonu(V) nie rozpuszcza się w węglanie amonu, w odróżnieniu od
siarczków arsenu.
2. Wodorotlenek potasu i amoniak
przeprowadzają sole antymonowe(V) w odpowiednie antymoniany(V), przy
czym przejściowo tworzy się uwodniony tlenek antymonu(V) :
2Sb
5+
+ 10OH
-
= Sb
2
O
5
↓ + 5H
2
O

Sb
2
O
5
+ 2OH
-
+ 5H
2
O = 2[Sb(OH)
6
]
-
Heksahydroksoantymonian(V) potasu jest rozpuszczalny w wodzie i znalazł
zastosowanie jako odczynnik do wykrywania jonów sodowych, tworzy bowiem
trudno rozpuszczalny osad heksahydroksoantymonianu(V) sodu :
[Sb(OH)
6
]
-
+ Na
+
= Na[Sb(OH)
6
] ↓
3. Woda
powoduje hydrolizę soli antymonu(V) z wytrąceniem białego osadu oksosoli,
które w toku dalszej hydrolizy, w wyniku rozcieńczania i ogrzania roztworu,
przechodzą w kwas antymonowy(V) H
3
SbO
4
:
[SbCl
6
]
-
+2H
2
O SbO
2
Cl↓ + 4H
+
+ 5Cl
-
SbO
2
Cl + 2H
2
O H
3
SbO
4
↓ + HCl
4. Metale : Mg, Al, Zn, Fe
redukują związki antymonu(V) do metalicznego antymonu :
2[SbCl
6
]
-
+ 5Fe
0
= 2Sb
0
↓ + 5Fe
2+
+ 12Cl
-
5. Jodki
utleniają się pod wpływem związków antymonu(V) do wolnego jodu :
Sb
5+
+ 2I
-
= Sb
3+
+ I
2
Cyna Sn
5s
2
p
2
Cyna jest metalem leżącym w grupie 14 (IVA) układu okresowego i
w związkach występuje na +2 i +4 stopniu utlenienia. Ze względu na charakter
amfoteryczny tworzy dwa szeregi soli, podobnie jak związki antymonu. Sole
cyny w wodzie ulegają hydrolizie. Związki cyny(II) łatwo utleniają się do
cynowych(IV), dlatego są silnymi reduktorami.
Do trudno rozpuszczalnych związków cyny zaliczamy : SnS, SnS
2
,
Sn(OH)
2
, Sn(OH)
4
, H
2
SnO
3
, Sn
3
(PO
4
)
4
. Azotany(V), siarczany(VI) i haloidki
rozpuszczają się w wodzie, przy czym dodatek kwasu zapobiega słabej
hydrolizie. Cyna tworzy rozpuszczalne jony kompleksowe : [Sn(C
2
O
4
)
2
]
2-
, [Sn
(C
4
H
4
O
6
)
2
]
2-
, [SnCl
4
]
2-
i inne.

Reakcje jonu Sn
2+
1. AKT (CH
3
CSNH
2
) i rozpuszczalne w wodzie siarczki
wytrącają ze słabo kwaśnych roztworów soli cyny(II) brunatny osad siarczku
cyny(II):
Sn
2+
+ S
2-
=
SnS↓
Siarczek cyny(II) rozpuszcza się :
a) w stężonym kwasie chlorowodorowym , w odróżnieniu od siarczków
arsenu :
SnS + 2H
+
= Sn
2+
+ H
2
S↑
b) w wielosiarczku amonu (NH
4
)
2
S
2
z utworzeniem tiocynianu(IV):
SnS + S
2
2-
= SnS
3
2-
c) w KOH lub NaOH w obecności H
2
O
2
, który utlenia Sn
2+
do Sn
4+
:
3SnS+ 6OH
-
+ 3H
2
O
2
= SnS
3
2-
+ 2SnO
3
2-
+ 6H
2
O
SnS nie rozpuszcza się w KOH, NaOH, (NH
4
)
2
S i NH
3
, w odróżnieniu od
siarczków As, Sb oraz SnS
2
.
2. Mocne zasady NaOH, KOH
wytrącają biały , galaretowaty osad wodorotlenku cyny(II), rozpuszczalny w
nadmiarze odczynnika z utworzeniem cynianu(II) :
Sn
2+
+ 2OH
-
= Sn(OH)
2
↓
Sn(OH)
2
+ OH
-
= [Sn(OH)
3
]
-
Używanie dużegonadmiaru zasady przyrozpuszczaniu wodorotlenku
cyny(II) może spowodować powstanieczarnego osadu cyny metalicznej,
na skutek reakcji dysproporcjonowania :
2Na[Sn(OH)
3
] = Na
2
[Sn(OH)
6
] + Sn
0
↓
3. Chlorek rtęci(II) HgCl
2
wobec nadmiaru jonów Sn
2+
wytrąca biały osad kalomelu Hg
2
Cl
2
, który
następnie szarzeje i przechodzi w czarny osad metalicznej rtęci :
2Hg
2+
+ 8Cl
-
+ Sn
2+
= Hg
2
Cl
2
↓ + [SnCl
6
]
2-
Sn
2+
+ Hg
2
Cl
2
+4Cl
-
= [SnCl
6
]
2-
+ 2Hg
0
↓

4. Sole bizmutu(III)
w środowisku zasadowym utleniają sole cyny z +2 na +4 stopień utlenienia z
jednoczesnym wytrąceniem czarnego osadu metalicznego bizmutu :
2Bi
3+
+ 3[Sn(OH)
3
]
-
+ 9OH
-
= 2Bi
0
↓ + 3[Sn(OH)
6
]
2-
5. Metale : Zn, Al, Mg
redukują jony Sn
2+
do metalicznej cyny :
Zn + Sn
2+
= Sn
0
↓ + Zn
2+
Reakcje jonu Sn
4+
1. AKT (CH
3
CSNH
2
) i rozpuszczalne w wodzie siarczki
wytrącają ze słabo kwaśnych roztworów soli cyny(IV) jasnożółty osad SnS
2
:
Sn
4+
+ 2S
2-
= SnS
2
↓
Siarczek cyny(IV) rozpuszczalny jest :
a) w stężonym kwasie chlorowodorowym ( sposób odróżnienia i oddzielenia od
siarczków arsenu) :
SnS
2
+ 4H
+
+ 6Cl
-
= [SnCl
6
]
2-
+ 2H
2
S↑
b) w KOH i NaOH z utworzeniem tiocynianu(IV) i heksahydroksocynianu(IV):
3SnS
2
+ 6OH
-
= 2SnS
3
2-
+[ Sn(OH)
6
]
2-
c) w siarczku i wielosiarczku amonu :
SnS
2
+ S
2-
= SnS
3
2-
SnS
2
+ S
2
2-
= SnS
3
2-
+ S↓
Po zakwaszeniu roztworu zawierającego tiocyniany(IV) wytrąca się żółty osad
SnS
2
:
SnS
3
2-
+ 2H
+
= SnS
2
↓ + H
2
S↑
W obecności nadmiaru jonów szczawianowych C
2
O
4
2-
jony S
2-
nie wytrącają
SnS
2
, gdyż powstaje trwały jon kompleksowy : [Sn(C
2
O
4
)
4
]
4-
.
2. Mocne zasady i amoniak NaOH, KOH i NH
3
wytrącają z roztworu soli cyny(IV) biały galaretowaty osad wodorotlenku
Sn(OH)
4
, który wykazuje właściwości amfoteryczne i jest rozpuszczalny w
kwasach i nadmiarze mocnej zasady z utworzeniem cynianu(IV) :
SnCl
6
2-
+ 4OH
-
= Sn(OH)
4
↓ + 6Cl
-

Sn(OH)
4
+ 6HCl = H
2
[SnCl
6
] + 4H
2
O
kwas chlorocynowy(IV)
Sn(OH)
4
+ 2OH
-
= [Sn(OH)
6
]
2-
jon heksahydroksocynianowy(IV)
3. Żelazo metaliczne
redukuje związki cynowe(IV) do cynowych(II) :
Fe + Sn
4+
= Fe
2+
+ Sn
2+
4. Woda
powoduje hydrolizę soli cyny(IV) wytrącając biały osad tlenku cyny(IV) :
Sn
4+
+ 2H
2
O SnO
2
↓ + 4H
+
5. Barwienie płomienia
Lotne sole cyny(II) i cyny(IV) barwią płomień na kolor jasnobłękitny.
XIII.3.5. Zagadnienia
1. Charakterystyka odczynnika grupowego dla kationów II grupy.
2. Warunki wytrącania kationów II grupy.
3. Reakcje azotanów(V) kationów podgrupy IIA z nadmiarem mocnej zasady i
amoniaku.
4. Reakcje kationów podgrupy IIA z jonami jodkowymi i ich nadmiarem.
5. Reakcje hydrolizy soli bizmutu, antymonu i cyny.
6. Metody podziału kationów II grupy na dwie podgrupy.Napisać odpowiednie
reakcje.
7. Napisać reakcje pozwalające wykryć jony kadmu w obecności jonów miedzi
(II) metodą cyjankową.
8. Wyjaśnić dlaczego kation I grupy - Pb
2+
wytrąca się także w postaci siarczku
wraz z kationami II grupy. Napisać reakcje pozwalające oddzielić jon Pb
2+
od pozostałych kationów II grupy.
9. Jak reagują siarczki kationów podgrupy IIA z kwasem azotowym(V)?
10.
Jakimi metodami można oddzielić jony Hg
2+
od Cu
2+
? Napisać

odpowiednie reakcje.
11.Jak rozdzielić jony Hg
2+
i Sb
3+
? Podać najprostszy tok analizy i odpowiednie
reakcje.
12.Jakie jony tworzą związki arsenu, antymonu i cyny:
a) w roztworze kwasu chlorowodorowego
b) w roztworze wodnym
c) w roztworze wodorotlenku sodu.
13.Próby specjalne na wykrywanie małych ilości arsenu. Podać sposób
wykonania i odpowiednie reakcje.
14.Jak oddzielić jony Sb
3+
od jonów Sn
4+
? Napisać odpowiednie reakcje.
15.Jakimi metodami można oddzielić jony Sn
2+
i Sn
4+
od jonów Cd
2+
? Napisać
reakcje.
16.Jak można oddzielić siarczek arsenu(III) od siarczków antymonu(III) i
cyny(II)? Napisać reakcje.
17.Jak rozdzielić mieszaninę składającą się z As
2
S
3
, CuS i HgS posługując się
tylko dwoma odczynnikami?
Wyszukiwarka
Podobne podstrony:
analiza notatki 3 id 559208 Nieznany (2)
analiza ilosciowa 6 id 60541 Nieznany (2)
Analiza struktury id 61534 Nieznany (2)
analiza ilosciowa 2 id 60539 Nieznany
Podst poj i pr chem id 366070 Nieznany
Analiza czynnikowa id 59935 Nieznany (2)
Darfur analiza kryzysu id 13186 Nieznany
Analiza Finansowa 3 id 60193 Nieznany (2)
Analiza finansowhga id 60398 Nieznany (2)
IMW W02 analiza stanow id 21233 Nieznany
Analiza krancowa id 60743 Nieznany (2)
analiza skupien id 61367 Nieznany
Analiza termiczna id 61671 Nieznany (2)
Analiza biochemiczna id 59863 Nieznany
analiza wzory id 61812 Nieznany (2)
analiza kationow 2 id 60685 Nieznany
analizaf 7I id 61960 Nieznany (2)
Analiza matematyczna 2 id 60894 Nieznany
więcej podobnych podstron