
Ró
wn
ow
agi
w
roz
two
rac
h

Wprowadzenie
W wielu wypadkach reakcje chemiczne mogą zachodzić
przy spełnieniu pewnych warunków praktycznie w jedną
bądź w drugą stronę !!!

Prawo działania mas
• podczas działania pary wodnej na żelazo w podwyższonej
temperaturze zachodzi reakcja:
3Fe + 4H
2
O
→ Fe
3
O
4
+ 4H
2
(
↑
)
• jeżeli weźmiemy otrzymany tlenek i zadziałamy na niego
wodorem w podwyższonej temperaturze to:
• reakcje które mogą przebiegać w obydwu kierunkach
nazywamy
reakcjami odwracalnymi
Fe
3
O
4
+ 4H
2
→ 3Fe + 4H
2
O
3Fe + 4H
2
O Fe
3
O
4
+ 4H
2

Prawo działania mas
• jeśli weźmiemy najprostszy przykład reakcji odwracalnej:
• miarą szybkości takiej reakcji jest wzrost stężenia produktu
w jednostce czasu:
• dla reakcji przebiegającej w prawo:
v
1
= k
1
[A][B]
A + B AB
t
[AB]
d
d
v
====
v
-1
= k
-1
[AB]
• dla reakcji przebiegającej w lewo:
Prawo działania mas
• Dla reakcji odwracalnej:
w momencie ustalenia się stanu równowagi:
k
1
[A][B] = k
-1
[AB]
A + B AB
v
1
= v
-1
[A][B]
[AB]
=
−1
1
k
k
Prawo działania mas
• stosunek stałych szybkości obu reakcji jest stały i nosi
nazwę
stałej równowagi
reakcji:
m
1
A
1
+ m
2
A
2
+ ...= n
1
B
1
+ n
2
B
2
+ ...
[A][B]
[AB]
=
=
−1
1
k
k
K
...
]
[A
]
[A
...
]
[B
]
[B
2
1
2
1
m
2
m
1
n
2
n
1
=
c
K
• w ogólnym przypadku reakcji chemicznej:

Prawo działania mas
znaczenie
stałej równowagi
reakcji:
m
1
A
1
+ m
2
A
2
+ ...= n
1
B
1
+ n
2
B
2
+ ...
...
]
[A
]
[A
...
]
[B
]
[B
2
1
2
1
m
2
m
1
n
2
n
1
=
c
K
• gdy K >> 1 reakcja przesunięta w stronę
tworzenia produktów
• gdy K << 1 reakcja przesunięta w stronę
tworzenia substratów

Prawo działania mas
znaczenie
stałej równowagi
reakcji:
...
]
[A
]
[A
...
]
[B
]
[B
2
1
2
1
m
2
m
1
n
2
n
1
=
c
K
• gdy K = 10
-6
oznacza to, że iloczyn stężeń
produktów jest milion razy mniejszy niż
iloczyn stężeń substratów

Zmiana warunków reakcji:
Reguła Le Chateliera Browna
Zmieniając warunki reakcji można zwiększyć lub
zmniejszyć wydajności otrzymywanych produktów
• Zmiana
stężenia
poprzez usunięcie produktów lub dodanie
substratów do naczynia reakcyjnego
• Zmiana
ciśnienia cząstkowego
gazowych reagentów i
produktów poprzez zmniejszenie objętości
• Zmiana
temperatury
W przypadku mieszaniny gazowej znamy trzy
sposoby aby wpłynąć na skład równowagowy

Jeżeli na układ znajdujący się w stanie równowagi
działa bodziec zewnętrzny, to w układzie tym
następują zmiany zmniejszające skutki tego bodźca.
Reguła Le Chateliera
mówi że:
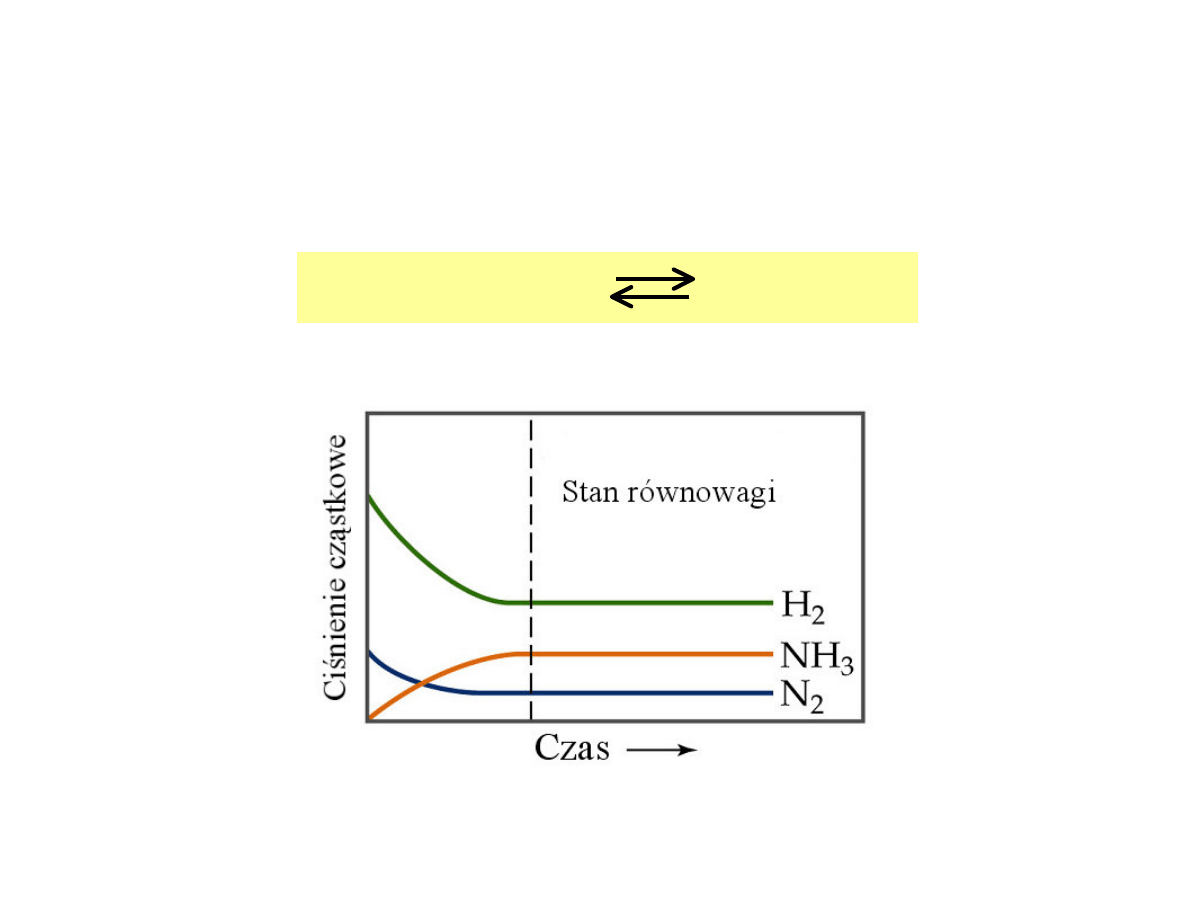
Przykład reakcji z gazowymi reagentami
(synteza amoniaku)
N
2
(g)
+ 3H
2
(g)
2 NH
3
(g)
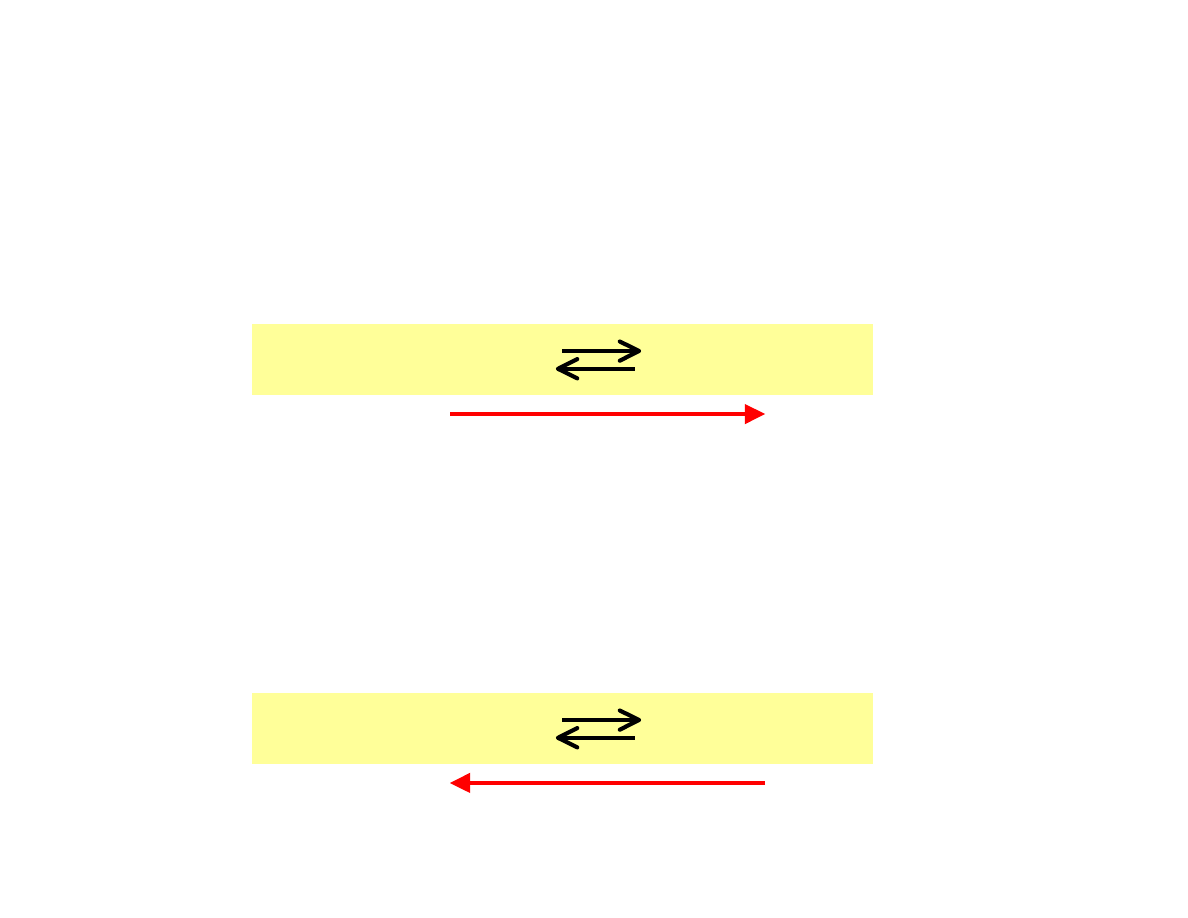
Efekty zmiany stężeń
Ogólnie:
•
wprowadzenie substratu do układu w stanie równowagi
powoduje jej przesunięcie w stronę tworzenia produktów
N
2
(g)
+ 3H
2
(g)
2 NH
3
(g)
•
wprowadzenie produktu do układu znajdującego sięw stanie
równowagi spowoduje przesunięcie się równowagi w stronę
tworzenia substratów
Przesunięcie równowagi reakcji
N
2
(g)
+ 3H
2
(g)
2 NH
3
(g)
Przesunięcie równowagi reakcji
Efekty zmiany stężeń
Ogólnie:
•
usuwanie produktu z układu w stanie równowagi chemicznej
powoduje jej przesunięcie w stronę tworzenia się produktów
N
2
(g)
+ 3H
2
(g)
2 NH
3
(g)
•
usuwanie substratów z układu w stanie równowagi chemicznej
powoduje jej przesunięcie w stronę tworzenia się substratów
Przesunięcie równowagi reakcji
N
2
(g)
+ 3H
2
(g)
2 NH
3
(g)
Przesunięcie równowagi reakcji
Efekty zmian objętości i ciśnienia
Gdy
zwiększamy ciśnienie
poprzez
zmniejszenie objętości
mieszaniny reakcyjnej,
reakcja
przesuwa się
w kierunku
mniejszej
ilości moli gazu.
Ogólnie:
N
2
(g)
+ 3H
2
(g)
2 NH
3
(g)
Przesunięcie kierunku reakcji
1 + 3 = 4 mole
2 mole
Efekt zmiany temperatury
Dla
reakcji
egzotermicznych
(∆
∆
∆
∆H ujemne), ilość
produktów zmniejsza się w przypadku
podwyższenia temperatury
Dla
reakcji
endotermicznych
(∆
∆
∆
∆H dodatnie),
ilość produktów zwiększa się w przypadku
podwyższenia temperatury
A + B C + D +
ciepło
A + B +
ciepło
C + D

Zastosowanie reguły przekory przy zmianie temperatury
Jednym z etapów produkcji kwasu siarkowego jest
tworzenie trójtlenku siarki(VI) poprzez reakcję SO
2
z O
2
.
W jaki sposób skład równowagowy mieszaniny reakcji
zmieni się gdy podwyższymy temperaturę?
2SO
2(g)
+ O
2(g)
2 SO
3(g)
∆
∆
∆
∆H = -198 kJ
Zastosowanie reguły przekory przy zmianie
temperatury i ciśnienia
Jakie będą optymalne warunki przeprowadzenia
następującej reakcji?
2CO
(g)
+ O
2(g)
2 CO
2(g)
∆
∆
∆
∆H <0
2 + 1 = 3 mole
2 mole
Reakcja egzotermiczna
Obniżenie temperatury
(niska temperatura)
Podwyższenie ciśnienia
(wysokie ciśnienie)
N
2(g)
+ O
2(g)
2 NO
(g)
∆
∆
∆
∆H > 0
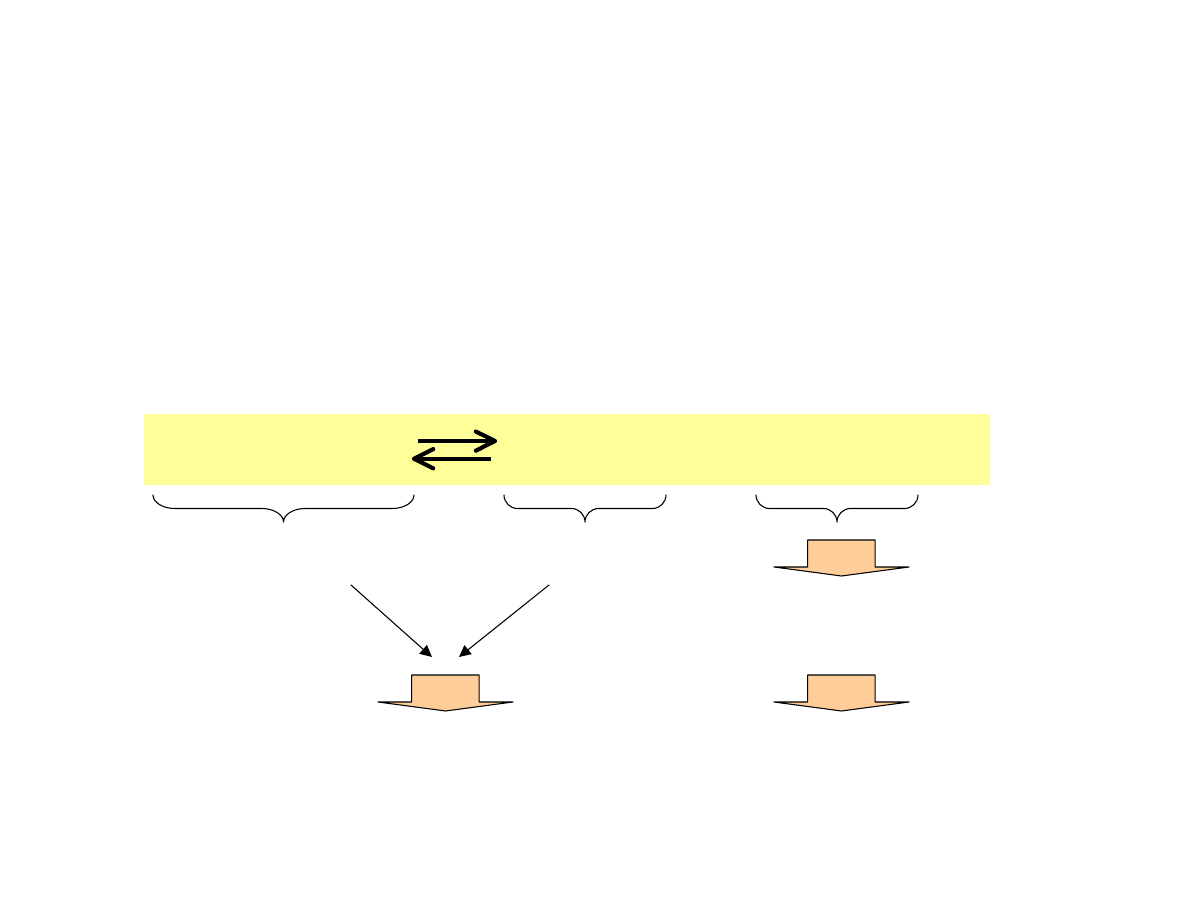
Zastosowanie reguły przekory przy zmianie
temperatury i ciśnienia
Jakie będą optymalne warunki przeprowadzenia
następującej reakcji?
1 + 1 = 2 mole
2 mole
Reakcja endotermiczna
Podwyższenie temperatury
(wysoka temperatura)
Ciśnienie nie wpływa
na przebieg reakcji
N
2
(g)
+ 3H
2
(g)
2 NH
3
(g)
∆
∆
∆
∆H <0
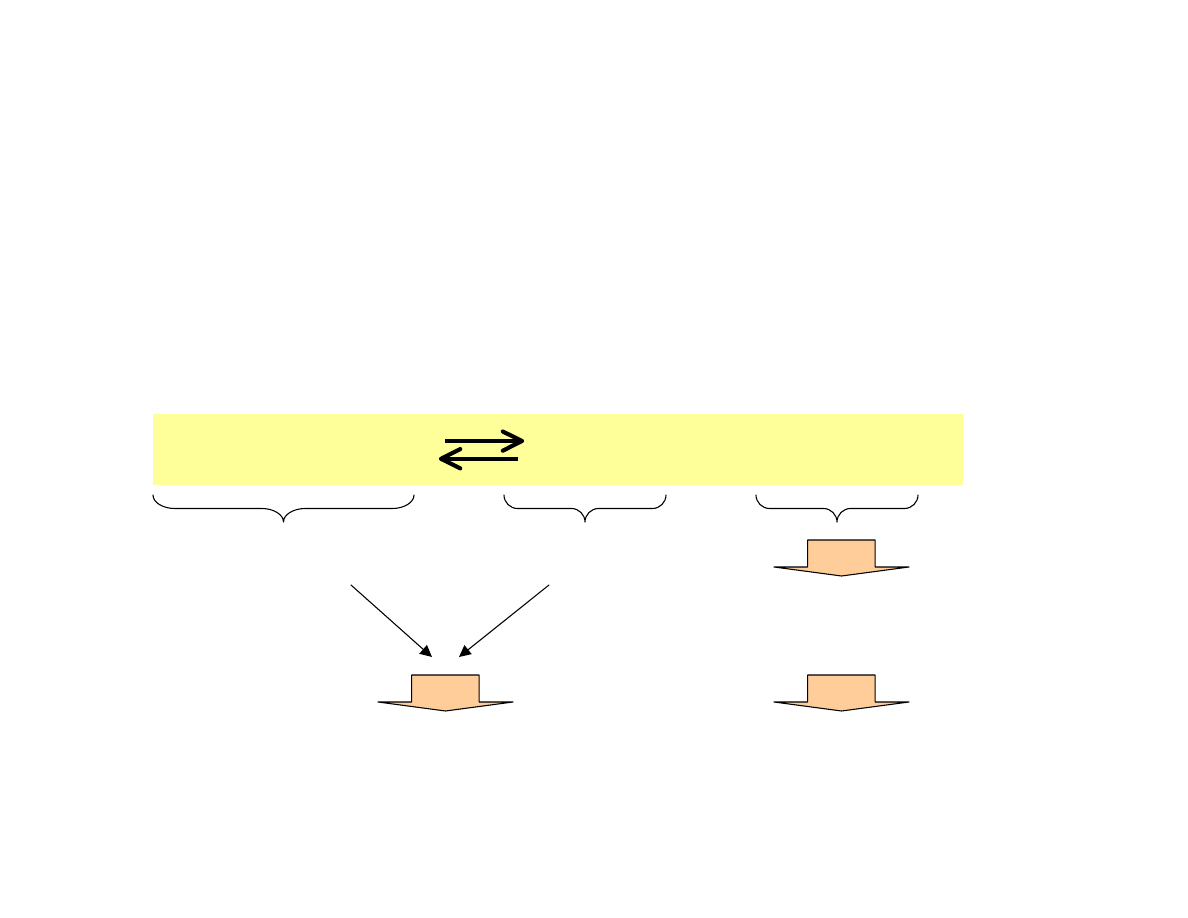
Zastosowanie reguły przekory przy zmianie
temperatury i ciśnienia
Jakie będą optymalne warunki przeprowadzenia
następującej reakcji?
1 + 3 = 4 mole
2 mole
Reakcja egzotermiczna
Obniżenie temperatury
(niska temperatura)
Podwyższenie ciśnienia
(wysokie ciśnienie)
Zależność szybkości reakcji od temperatury
Szybkość reakcji w bardzo znacznym
stopniu zależy od temperatury
T
A
ln
−
= B
k
Reguła Van’t Hoffa
orientacyjna reguła stwierdzająca, że podwyższenie temperatury
o 10 K powoduje od 2-4 krotny wzrost szybkości reakcji.
zatem wzrost o 100K
2
10
- 4
10
wzrost szybkości
reakcji
Zależność empiryczna łącząca k z T:
równanie
Arrheniusa
A i B stałe które możemy
obliczyć gdy zostały wykonane
pomiary k w różnych T
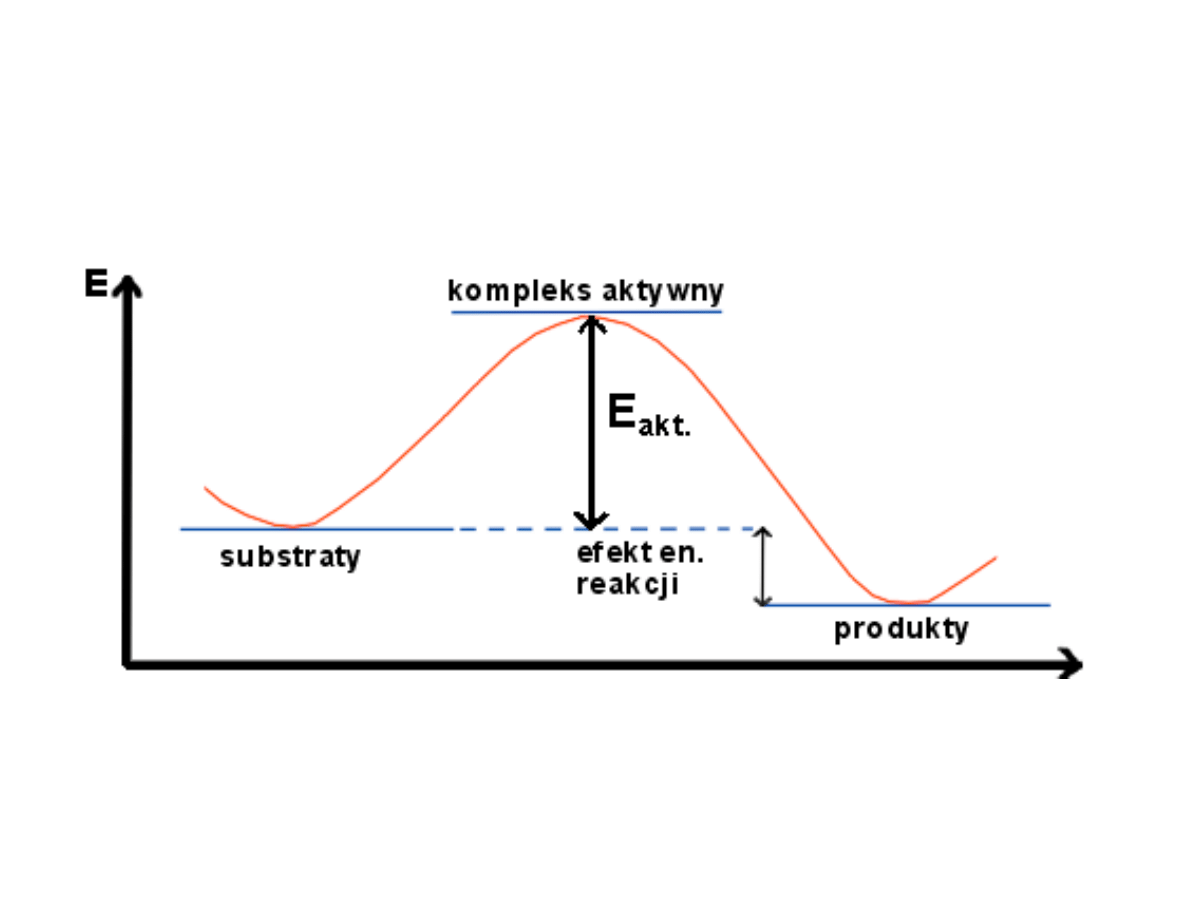
Energia aktywacji

Aktywność i siła jonowa
Roztwory elektrolitów mocnych
AB
→
→
→
→
A
+
+ B
−
to roztwory substancji praktycznie całkowicie zdysocjowanych,
które wykazują znaczną przewodność elektryczną:
przykłady:
• mocne kwasy
• mocne zasady
• większość soli
Roztwory elektrolitów słabych
to roztwory substancji zdysocjowanych w małym stopniu, a
dysocjacja wzrasta w miarę ich rozcieńczania:
przykłady:
• słabe kwasy
• słabe zasady
• niektóre sole
AB A
+
+ B
−
Aktywność i siła jonowa
Roztwory elektrolitów słabych
prawo działania mas wyrażone wzorem:
nie można go stosować do elektrolitów mocnych!!!
AB A
+
+ B
−
[AB]
]
][B
[A
-
+
=
c
K
odnosi się tylko do rozcieńczonych
roztworów elektrolitów słabych:

Aktywność i siła jonowa
Teoria roztworów elektrolitów mocnych
Debye’a i Hückla
uwzględnia wzajemne oddziaływania na siebie wszystkich jonów
istniejących w roztworze
im większe stężenie tym oddziaływania mocniejsze!!!
rzeczywista zdolność cząsteczek do reagowania
nosi nazwę
aktywności (a)
Aktywność i siła jonowa
Termodynamiczna stała równowagi:
prawo działania mas w znacznie ściślejszym wyrażeniu
przedstawia
termodynamiczna stała równowagi
:
f - współczynnik
aktywności
...
...
...
]
[A
]
[A
...
]
[B
]
[B
2
1
2
1
m
2
m
1
n
2
n
1
2
2
1
1
2
2
1
1
m
A
m
A
n
B
n
B
a
f
f
f
f
K
•
=
m
1
A
1
+ m
2
A
2
+ ...= n
1
B
1
+ n
2
B
2
+ ...
...
...
2
2
1
1
2
2
1
1
m
A
m
A
n
B
n
B
a
a
a
a
a
K
=
• rodzaju jonów
• ich ładunków
• stężenia i ładunków innych
jonów obecnych w roztworze
zależy od
Aktywność i siła jonowa
Termodynamiczna stała równowagi:
do obliczenia termodynamicznej stałej równowagi niezbędna jest
znajomość
współczynników aktywności f
:
zależy
od mocy jonowej (µ) oraz ładunku jonów (z)
∑
=
i
i
c
z
2
2
1
µ
z
i
- ładunek jonu i
c
i
- stężenie molowe jonu i
Aktywność i siła jonowa
Zadanie:
Obliczyć siłę jonową roztworu siarczanu potasu o stężeniu 0.2 mol/l
∑
=
i
i
c
z
2
2
1
µ
K
2
SO
4
→
→
→
→
2 K
+
+ SO
4
2
−
µ =
1/2 [1
2
· (2· 0.2) + 2
2
· 0.2] = 0.6
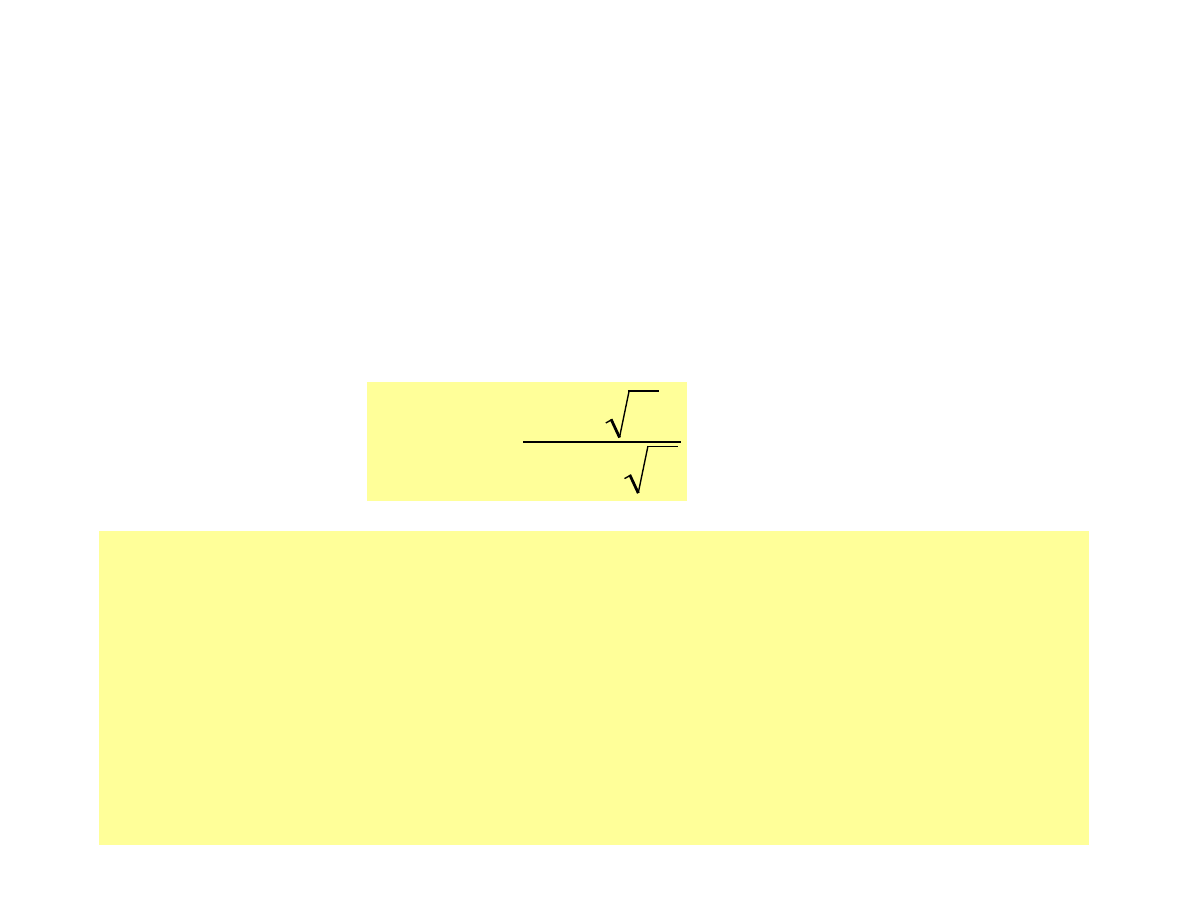
Aktywność i siła jonowa
Współczynnik aktywności
znając skład roztworu (siłę jonową i ładunek rozpatrywanego jonu)
współczynnik aktywności f
można obliczyć ze wzoru Debye’a i
Hückla;
µ
µ
Bd
Az
f
i
i
+
−
=
1
log
2
z
i
- ładunek jonu
µ
- moc jonowa roztworu
A i B - stałe zależne od temperatury i właściwości
rozpuszczalnika (dla wody w temp. 25
o
C wynoszą
one 0.51 i 3.3· 10
7
)
d - średnica uwodnionego jonu (3 · 10
-8
do 11 · 10
-8
cm)
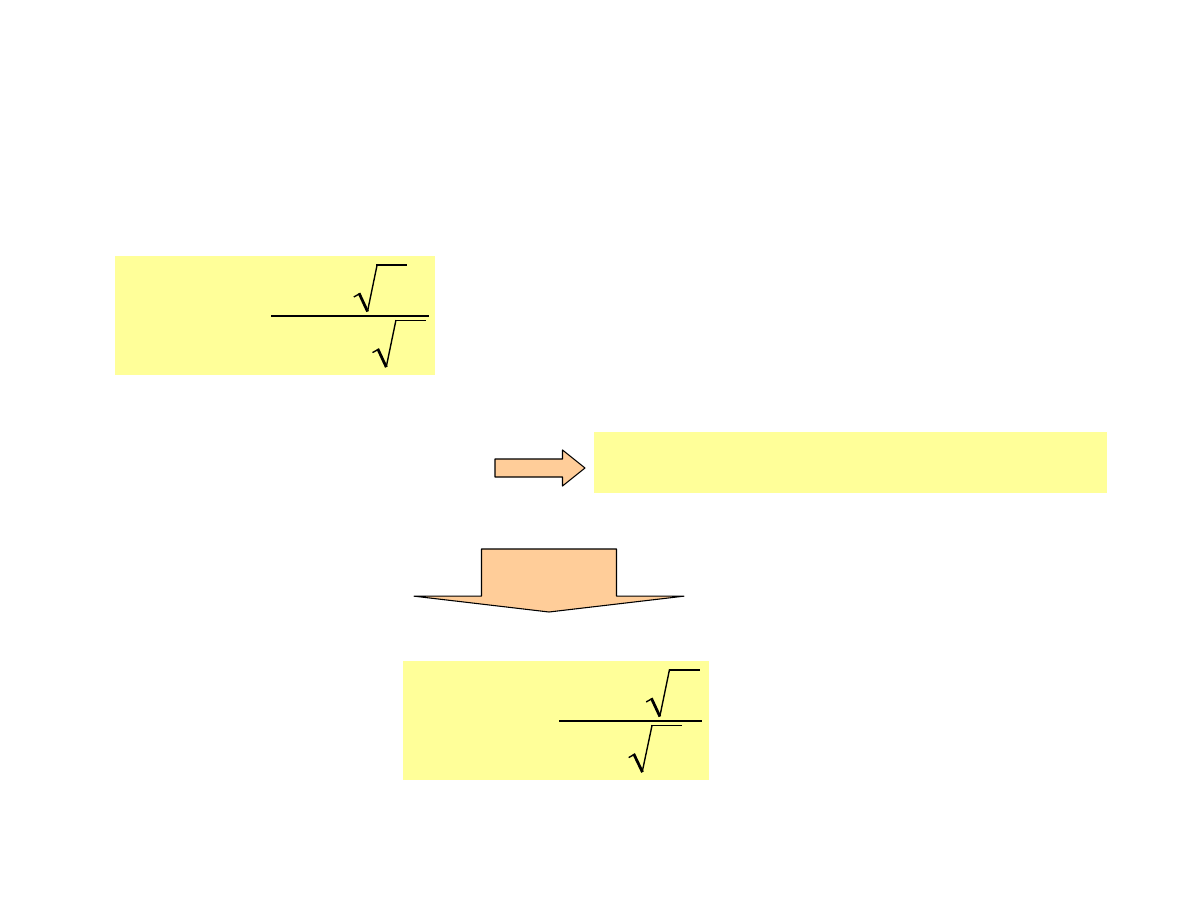
Aktywność i siła jonowa
Współczynnik aktywności
poprawna wartość
dla roztworów gdzie
µ
µ
µ
µ
µ
µ
µ
µ
≤≤≤≤
≤≤≤≤
0.1
0.1
µ
µ
Bd
Az
f
i
i
+
−
=
1
log
2
B · d = 3.3· 10
7
· 3 · 10
-8
≈
1
ponieważ w przypadku wielu
jonów wartość d = 3
·
10
-8
cm
µ
µ
+
−
=
1
5
.
0
log
2
i
i
z
f
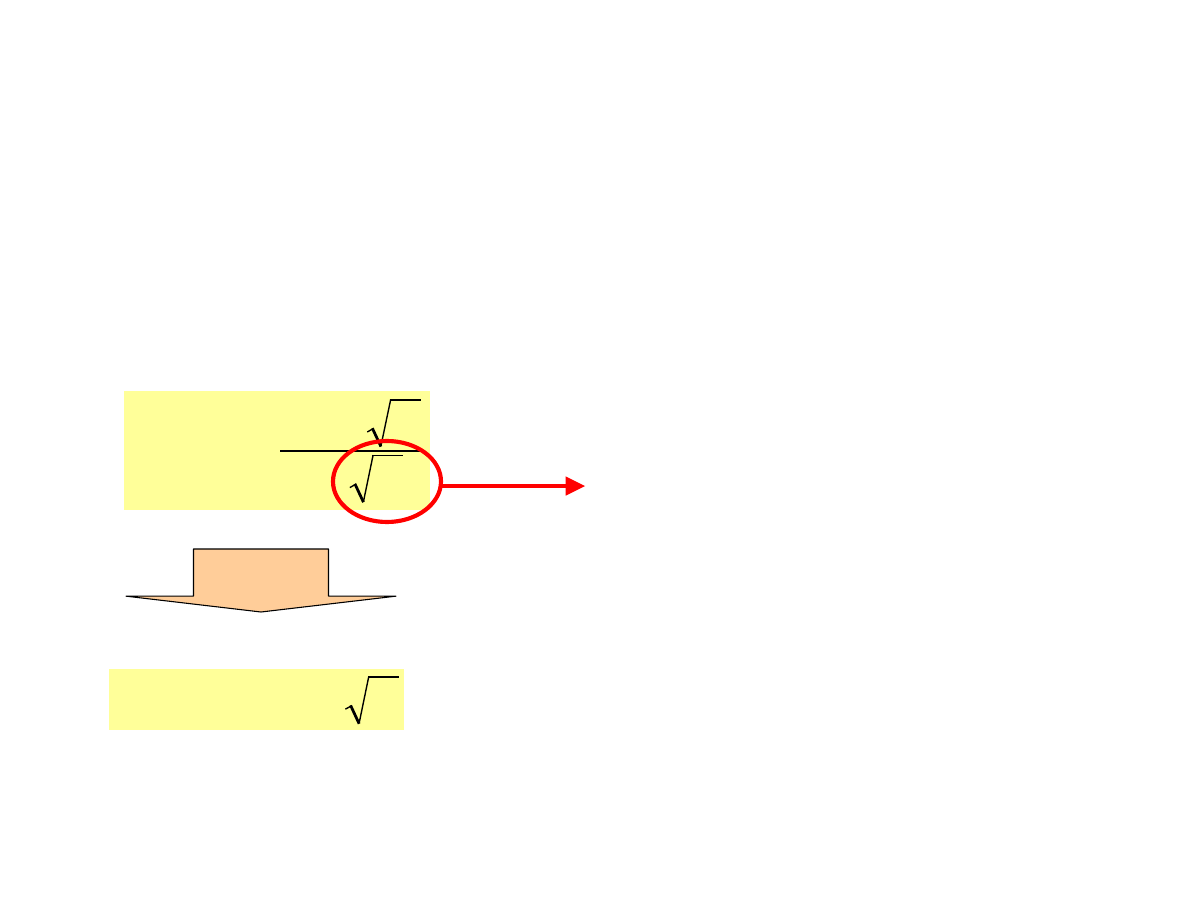
Aktywność i siła jonowa
Współczynnik aktywności
można pominąć
µ
µ
+
−
=
1
5
.
0
log
2
i
i
z
f
dla roztworów jeszcze bardziej
rozcieńczonych gdzie
µ
µ
µ
µ
µ
µ
µ
µ
≤≤≤≤
≤≤≤≤
0.02
0.02
µ
2
5
.
0
log
i
i
z
f
−
=
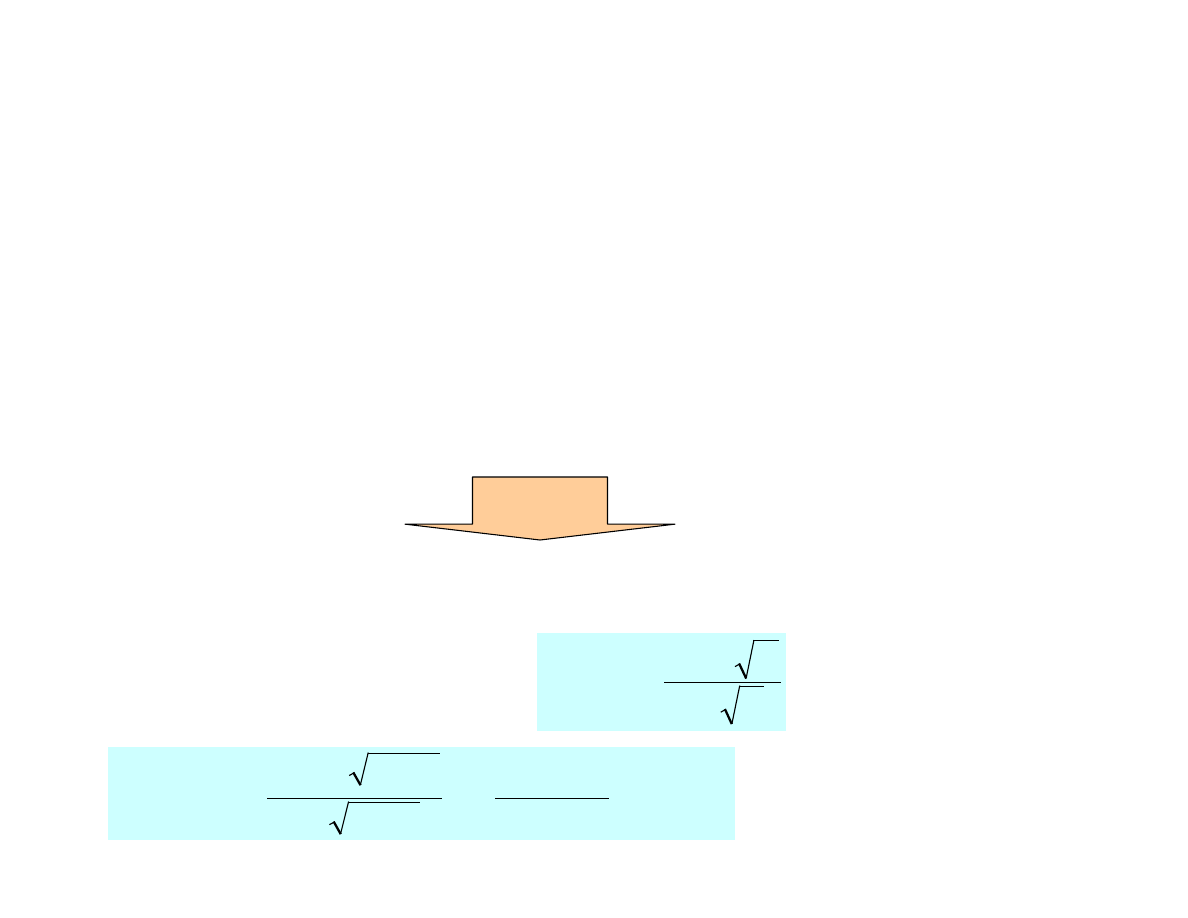
Aktywność i siła jonowa
Zadanie
a) 0.001M NaOH + 0.01M Na
2
SO
4
µ
µ
+
−
=
1
5
.
0
log
2
i
i
z
f
Obliczyć współczynniki aktywności jonów OH
-
w 0.001M zasadzie sodowej
NaOH znajdującej się w roztworze
a) 0.01M Na
2
SO
4
i
b) 0.001 M Na
2
SO
4
[OH
-
] - 0.001 mol/L; [SO
4
2-
] - 0.01 mol/L; [Na
+
] - 0.021 mol/L
µ
a
= 1/2(1
2
· 0.001 + 2
2
· 0.01 + 1
2
· 0.021) = 1/2 · 0.062 = 0.031
Ponieważ µ
a
>0.02
076
.
0
18
.
0
1
18
.
0
5
.
0
031
.
0
1
031
.
0
1
5
.
0
log
2
−
=
+
⋅
−
=
+
⋅
−
=
−
OH
f
f = 0.84
Aktywność i siła jonowa
Zadanie
b) 0.001M NaOH + 0.001M Na
2
SO
4
Obliczyć współczynniki aktywności jonów OH
-
w 0.001M zasadzie sodowej
NaOH znajdującej się w roztworze
a) 0.01M Na
2
SO
4
i
b) 0.001 M Na
2
SO
4
µ
2
5
.
0
log
i
i
z
f
−
=
[OH
-
] - 0.001 mol/L; [SO
4
2-
] - 0.001 mol/L; [Na
+
] - 0.003 mol/L
µ
a
= 1/2(1
2
· 0.001 + 2
2
· 0.001 + 1
2
· 0.003) = 1/2 · 0.008 = 0.004
Ponieważ µ
a
< 0.02
032
.
0
063
.
0
5
.
0
004
.
0
1
5
.
0
log
2
−
=
⋅
−
=
⋅
−
=
−
OH
f
f = 0.93
Ag
+
+ Cl
−
AgCl (
↓
)
Iloczyn rozpuszczalności
Charakterystyczną cechą reakcji przebiegających w roztworach
jest tworzenie się związków trudno rozpuszczalnych
]
][Cl
[Ag
[AgCl]
-
+
=
strąc
K
W przypadku osadów trudno rozpuszczalnych szczególne
znaczenie praktyczne ma stała reakcji rozpuszczania tych osadów:
AgCl (
↓
) Ag
+
+ Cl
−
[AgCl]
]
][Cl
[Ag
-
+
=
rozp
K
K
so
- iloczyn rozpuszczalności
]
][Cl
[Ag
-
+
=
so
K
Iloczyn rozpuszczalności
Z definicji
Iloczyny rozpuszczalności
K
so
są wielkościami stałymi dla
danego
rozpuszczalnika
i w danej
temperaturze
mM
n+
+ nA
m
−
M
m
A
n
(
↓)
Termodynamiczny iloczyn rozpuszczalności:
n
A
m
M
a
so
f
f
K
−
+
⋅
⋅
=
+
n
-
m
m
n
]
[A
]
[M
K
so
=[M
n+
]
m
[A
m
−
]
n
pK
so
= -log K
so
często podaje się w postaci ujemnego logarytmu:
w praktyce podczas obliczania iloczynów rozpuszczalności
mamy do czynienia z roztworami o małej sile jonowej
(f
≈≈≈≈
1) stąd korzystamy zazwyczaj ze wzoru uproszczonego:

Iloczyn rozpuszczalności
termin
iloczyn rozpuszczalności
można stosować do substancji
których rozpuszczalność nie przekracza 0.01 mol/L
rozpuszczalność danej substancji można przedstawić:
- jako
iloczyn rozpuszczalności
(K
so
)
- jako
rozpuszczalność
(wyrażoną w gramach na litr (g/L)
bądź w molach na litr (mol/L) )
Uwaga:
Jeśli w roztworze pojawią się w dużych stężeniach obce sole
wówczas należy rozpatrywać
termodynamiczny iloczyn
rozpuszczalności
Iloczyn rozpuszczalności
Zadanie
Obliczyć iloczyn rozpuszczalności AgCl wiedząc, że rozpuszczalność
tego związku wynosi 1.81· 10
-3
g/L (M
AgCl
=143.4)
Rozpuszczalność molowa
w roztworze nasyconym dysocjacja jest całkowita stąd:
1 mol AgCl
→ 1 mol Ag
+
+ 1 mol Cl
−
pK
so,AgCl
= - log (1.6· 10
-10
) = 9.8
mol/L
10
26
.
1
143.4
10
1.81
5
3
−
−
⋅
=
⋅
[Ag
+
] = 1.26· 10
-5
mol/L
[Cl
-
] = 1.26· 10
-5
mol/L
K
so
= [Ag
+
] [Cl
-
] = 1.26· 10
-5
· 1.26· 10
-5
=
1.60· 10
-10
Iloczyn rozpuszczalności
Zadanie
Obliczyć jaka jest rozpuszczalność w g/L siarczku antymonu
jeśli jego iloczyn rozpuszczalności K
so
= 1.0· 10
-30
.
jeżeli przyjmiemy rozpuszczalność molową związku jako
x
Sb
2
S
3
(
↓
) 2Sb
3+
+ 3S
2
−
x = 3.9· 10
-7
mol/L
3
-
2
2
3
]
[S
]
[Sb
+
=
SO
K
w roztworze nasyconym dysocjacja jest całkowita stąd:
1 mol Sb
2
S
3
→ 2 mole Sb
3+
+ 3 mole S
2
−
K
so
= [2x]
2
[3x]
3
= 2
2
· x
2
· 3
3
· x
3
= 108 · x
5
5
30
108
10
0
.
1
−
⋅
=
x
3.9· 10
-7
mol/L · 339.52 g/mol
R = 1.3· 10
- 4
g/L
Iloczyn rozpuszczalności
efekt wspólnego jonu
AgCl (
↓) Ag
+
+ Cl
−
K
so
= [Ag
+
] [Cl
-
]
w roztworze nasyconym mamy równowag
ę
:
co si
ę
stanie gdy dodamy jonów Cl
-
?
K
so
= [Ag
+
] [Cl
-
]
wzrasta
maleje
wartość stała
dla danego
rozpuszczalnika
zmniejsza si
ę
zatem rozpuszczalno
ść
AgCl
Efekt wspólnego jonu jest to zmniejszanie rozpuszczalno
ś
ci
trudno rozpuszczalnej soli przez dodanie soli rozpuszczalnej
zawieraj
ą
cej z ni
ą
wspólny jon.
Iloczyn rozpuszczalności
efekt wspólnego jonu
Zadanie
Jaka jest przybliżona wartość rozpuszczalności molowej AgCl w
roztworze KCl o stężeniu 0.10 mol/L? K
so,AgCl
=1.6· 10
-10
[Cl
-
] = 0.10 mol/L
st
ęż
enie jonów Ag
+
w roztworze
rozpuszczalność AgCl =1.6· 10
-9
mol/L
mol/L
10
6
.
1
10
.
0
10
6
.
1
]
[Cl
K
]
[Ag
9
10
-
so
−
−
+
⋅
=
⋅
=
=
K
so
= [Ag
+
] [Cl
-
]
1.6 · 10
-9
mol/L
rozpuszczalno
ść
AgCl = 1.3· 10
-5
mol/L
( w wodzie )
>10 000
razy mniejsza
W przypadku gdy mamy do czynienia z wytr
ą
caniem trudno
rozpuszczalnej soli w układzie w którym znajduj
ą
si
ę
równie
ż
inne jony wpływ
siły jonowej
jest do
ść
znaczny
const (T=const)
Iloczyn rozpuszczalności
efekt solny
AgCl (
↓) Ag
+
+ Cl
−
K
so
= [Ag
+
] [Cl
-
] · f
Ag+
· f
Cl
-
gdy siła jonowa wzrasta
(w miar
ę
wzrostu st
ęż
enie obcych
elektrolitów nie maj
ą
cych wspólnych jonów z rozpuszczanym
osadem)
malej
ą
zatem współczynniki aktywno
ś
ci
(w tym
przypadku f
Ag+
i f
Cl
-
)
Poniewa
ż
K
so
= const (w danej temperaturze)
musz
ą
wzrosn
ąć
st
ęż
enia jonów
rozpuszczanej
soli (w tym przypadku [Ag
+
] i [Cl
-
] )
zwi
ę
ksza si
ę
rozpuszczalno
ść
AgCl
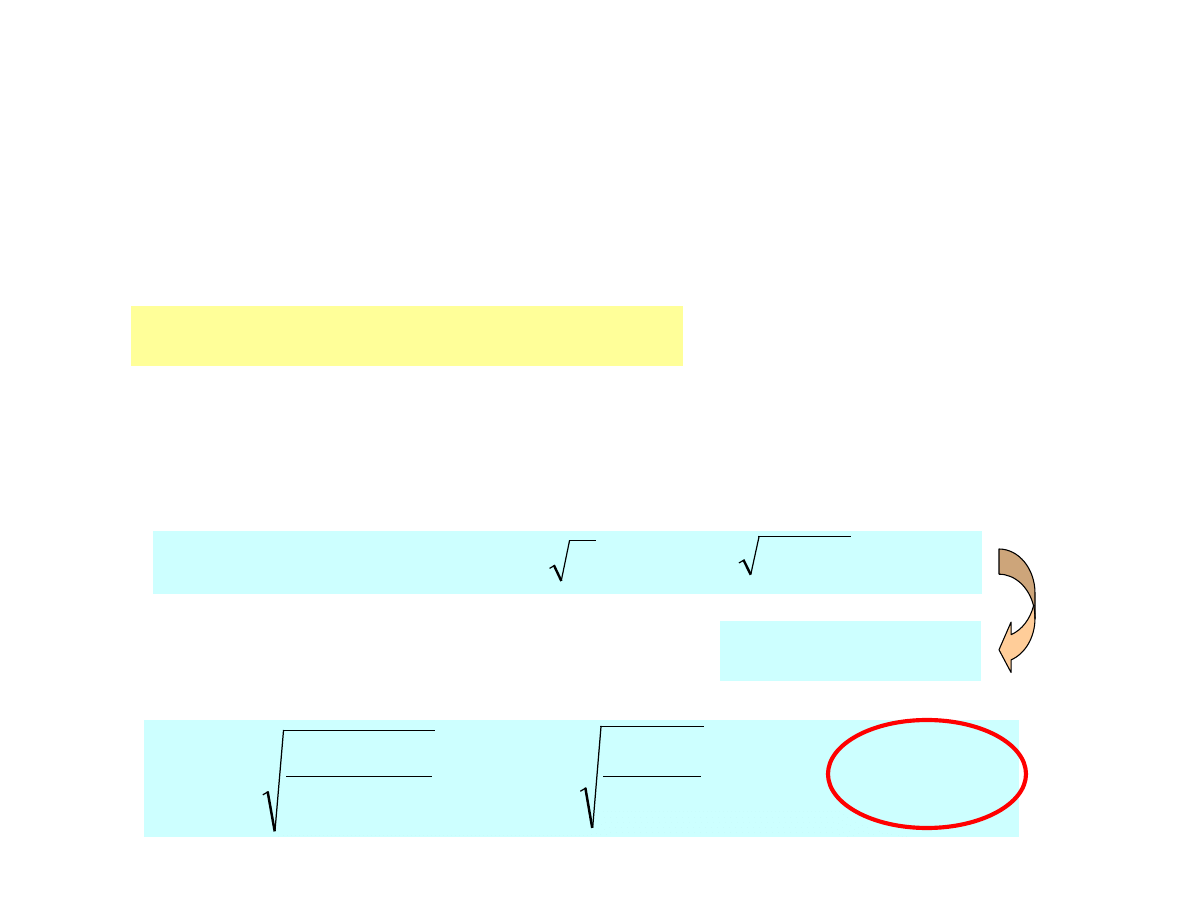
Zadanie
Obliczy
ć
rozpuszczalno
ść
osadu BaSO
4
w
wodzie
i
0.1M NaCl
przy zało
ż
eniu,
ż
e [Ba
2+
] = [SO
4
2-
] = 10
-5
mol/L
Iloczyn rozpuszczalności
efekt solny
10
-
2
4
2
10
1
]
][SO
[Ba
2
4
2
−
+
⋅
=
⋅
⋅
=
−
+
SO
Ba
a
so
f
f
K
µ = 1/2 · (2
2
· 10
-5
+ 2
2
· 10
-5
) = 4 · 10
-5
013
.
0
10
4
2
5
.
0
5
.
0
log
log
5
2
2
2
4
2
−
=
⋅
⋅
−
=
⋅
−
=
=
−
−
+
µ
i
SO
Ba
z
f
f
97
.
0
2
4
2
=
=
−
+
SO
Ba
f
f
L
g
M
f
f
K
R
BaSO
SO
Ba
so
BaSO
/
10
4
.
2
4
.
233
97
.
0
10
1
3
2
10
4
2
4
2
4
−
−
⋅
=
⋅
⋅
=
⋅
⋅
=
−
+
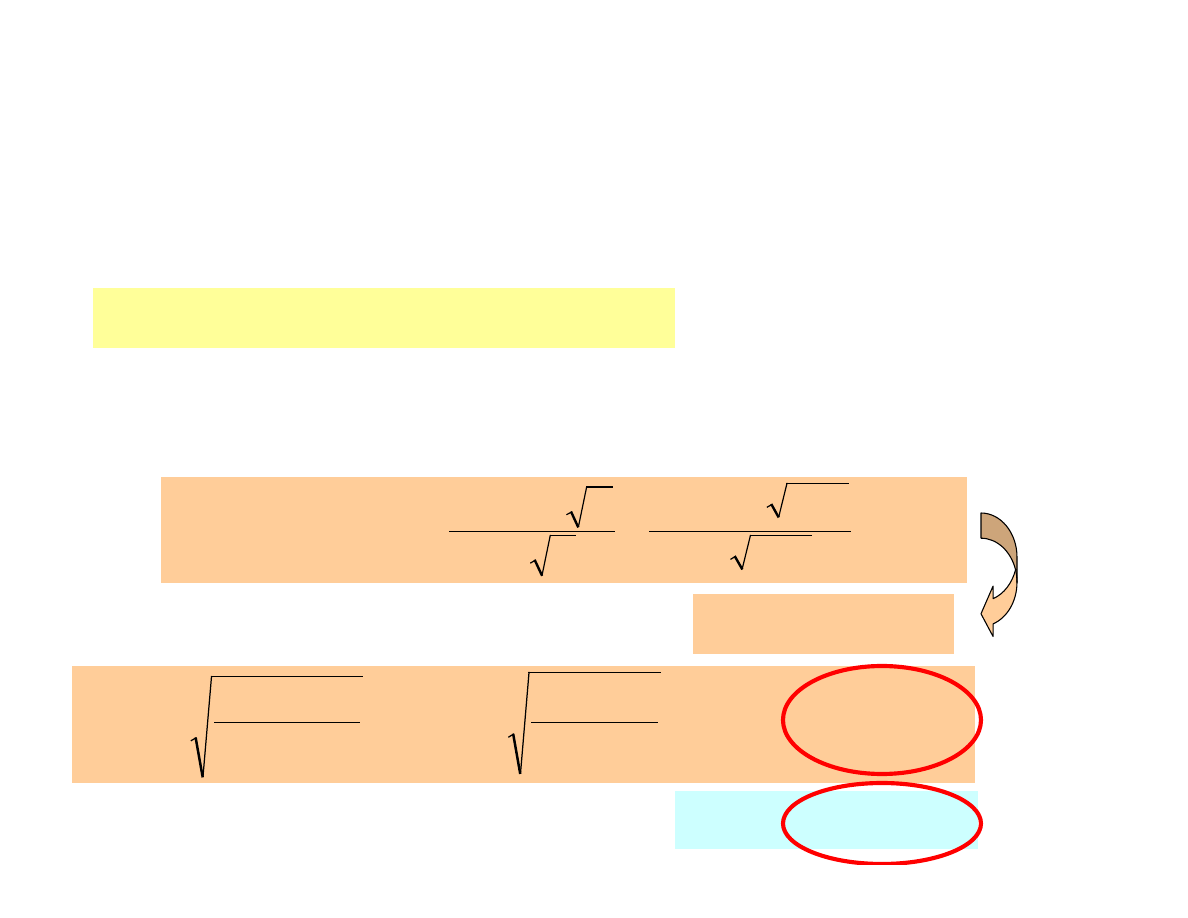
Zadanie
Obliczy
ć
rozpuszczalno
ść
osadu BaSO
4
w
wodzie
i
0.10M NaCl
przy założeniu, że [Ba
2+
] = [SO
4
2-
] = 10
-5
mol/L << [Na
+
]=[Cl
-
]=0.10 mol/L
Iloczyn rozpuszczalności
efekt solny
10
-
2
4
2
10
0
.
1
]
][SO
[Ba
2
4
2
−
+
⋅
=
⋅
⋅
=
−
+
SO
Ba
a
so
f
f
K
µ = 1/2 · (1
2
· 0.10 + 1
2
· 0.10) = 0.10
48
.
0
10
.
0
1
10
.
0
2
5
.
0
1
5
.
0
log
log
2
2
2
4
2
−
=
+
⋅
−
=
+
⋅
−
=
=
−
+
µ
µ
i
SO
Ba
z
f
f
33
.
0
2
4
2
=
=
−
+
SO
Ba
f
f
L
g
M
f
f
K
R
BaSO
SO
Ba
so
BaSO
/
10
1
.
7
4
.
233
33
.
0
10
0
.
1
3
2
10
4
2
4
2
4
−
−
⋅
=
⋅
⋅
=
⋅
⋅
=
−
+
L
g
R
BaSO
/
10
4
.
2
3
4
−
⋅
=

W domu potrenować obliczenia
zadania z Galusa
Iloczyn rozpuszczalno
ś
ci :
4.246 - 4.317
Jedno z tych zada
ń
pojawi si
ę
na pewno
na I kolokwium z pracowni
zadania z Galusa
przeliczanie st
ęż
e
ń
:
3.9, 3.41-3.43, 3.46, 3.47, 3.50, 3.51
rozcie
ń
czanie i przygotowywanie roztworów:
3.76, 3.77, 3.80, 3.86, 3.90, 3.97, 3.100, 3.114, 3.115, 3.117
Jedno z tych zada
ń
równie
ż
na pewno
pojawi si
ę
na I kolokwium z pracowni

Osady analityczne
• osady koloidalne
– serowate (chlorek srebra)
– galaretowate (wodorotlenek
ż
elaza III)
• osady krystaliczne (uporz
ą
dkowana budowa krystaliczna)
– drobnokrystaliczne
– grubokrystaliczne

Osady analityczne
koloidy
• cz
ą
steczki substancji rozpuszczonych zbite w niewielkie
cz
ą
stki tworz
ą
zawiesin
ę
(np. mydło w wodzie)
grupy zbitych (zwartych) cz
ą
steczek -
micele
micele wraz z rozpuszczalnikiem -
koloid
posta
ć
materii składaj
ą
ca si
ę
z ogromnej liczby
cz
ą
stek o
ś
rednicy od 1 nm do 10 mm
rozproszonych w cieczy, ciele stałym lub gazie

Osady analityczne
koloidy
Faza
rozproszona
Ośrodek
rozpraszający
Nazwa
Przykłady
stała
gaz
aerozol
dym
ciekła
gaz
aerozol
lakier w sprayu, mgła
stała
ciecz
zol lub żel
atrament, farba malarska
ciekła
ciecz
emulsja
mleko, majonez
stała
ciało stałe
stała dyspersja szkło rubinowe (Au w
szkle), niektóre stopy
ciekła
ciało stałe
stała emulsja
bitumiczne nawierzchnie
dróg, lody
gazowa
ciało stałe
stała pianka
pianki izolacyjne

Osady analityczne
koloidy
• w procesie tworzenia osadu koloidalnego powstaj
ą
ce
aglomeraty obdarzone jednoimiennym ładunkiem
odpychaj
ą
si
ę
od siebie
zol
(pseudoroztwór)
ż
el
elektrolit
(zobojętnia ładunki)
woda
(przy przemywaniu)
zol
osad nale
ż
y przemywa
ć
roztworem elektrolitu !!!
proces
peptyzacji
koagulacja

Osady analityczne
koloidy
koloidy - du
ż
e skupiska - łatwo adsorbuj
ą
inne jony
aby temu zapobiec stosuje si
ę
podwójne str
ą
canie
Podział koloidów:
• hydrofilowe (emulsoidy) - ch
ę
tnie przył
ą
czaj
ą
ce wod
ę
• hydrofobowe (suspensoidy) - nie maj
ą
ce powinowactwa do wody

Osady analityczne
osady krystaliczne
• w przypadku str
ą
cania osadów krystalicznych ich posta
ć
drobno czy grubokrystaliczna zale
ż
y od sposobu str
ą
cania
po przekroczeniu K
so
wzrost kryształów
zarodki
osad drobnokrystaliczny
osad grubokrystaliczny
szybko
wolno

Osady analityczne
osady krystaliczne
• osad grubokrystaliczny
– mały nadmiar jonów strącających
– powolne dodawanie odczynnika strącającego
– wysoka temperatura
– w przypadku rekrystalizacji powolne schładzanie
• gdy zapewnimy prawidłowe warunki str
ą
cania:
– osad grubokrystaliczny
– osad czysty o prawidłowej sieci krystalicznej
– osad pozbawiony obcych inkluzji

Osady analityczne
osady krystaliczne
• Zjawiska wtórne towarzysz
ą
ce str
ą
caniu
– starzenie osadu
– postr
ą
canie
– współstr
ą
canie
Wyszukiwarka
Podobne podstrony:
BTChwyklad 011
P23 032
BTChwyklad 141a
032 Mostek Wheatstone'a ćwiczenieid 4668
032
BTChwyklad 062
p11 032
BTChwyklad 022
P30 032
59 01 032 036 id 41760 Nieznany (2)
032 LS kp6
p39 032
BTChwyklad 101
p41 032
P27 032
BTChwyklad 031
026 032 R01 Ratownictwo med AZ
032
więcej podobnych podstron