
Halogenki metali alkalicznych
Kryształy jonowe należą do grupy izolatorów. Cechuje je całkowicie zapełnione pasmo
walencyjne, które jest oddzielone szeroką przerwą energetyczną od pustego pasma przewodnictwa.
Typowe kryształy jonowe tworzone są przez związki dwóch pierwiastków, z których jeden ma
duże powinowactwo elektronowe, czyli zdolność atomu do zapełnienia swej powłoki walencyjnej
przez przyłączenia odpowiedniej ilości elektronów w stanie gazowym, a drugi – małą energię
jonizacji, która
potrzebna jest do oderwania najsłabiej związanego z atomem elektronu. Bilans
energetyczny tej pary
musi być dodatni. Oznacza to, że powinowactwo elektronowe jednego
pierwiastka jest większe niż energia jonizacji drugiego. Możliwe jest zatem przekazanie elektronów
pierwszego atomu atomowi drugiemu, któremu brakuje elektronów do zapełniania swojej powłoki.
Konfiguracje elektronowe, obu powstałych w ten sposób jonów (dodatniego i ujemnego), będą należeć
do stabilnego typu ns
2
np
6
powłok zamkniętych. Między tak powstałymi jonami różnoimiennymi
działają siły odpychania związane z małymi odległościami rdzeni jonów, między jonami
równoimiennymi –
silne przyciąganie elektrostatyczne. Zasadniczy wkład do energii wiązania
kryształów jonowych daje oddziaływanie elektrostatyczne zwane energią Madelunga. Całkowita
energia wiązania jonowego:
).
1
(
0
0
2
R
q
R
q
N
U
Calk
−
−
=
α
(1)
Wyraz
0
2
R
q
N
α
−
jest energią Madelunga.
Cechy wiązania jonowego:
•
kryształy jonowe są twarde, mają wysoką temperaturę topnienia (znaczne wartości energii
wiązania),
•
nie ma wyróżnionego kierunku wiązania (zamknięte powłoki elektronowe o symetrii
sferycznej),
•
kryształy są złymi przewodnikami ciepła i prądu (brak elektronów swobodnych),
•
występuje w czystej postaci w kryształach typu I-VII (np. NaCl, KCl, CsCl, LiF, KBr).
Kryształy jonowe typu I-VII nazywane są halogenkami metali alkalicznych. Zbudowane są z
jonów dodatnich - jon jednego z metali alkalicznych: Li+, Na+, K+, Rb+ lub Cs+, oraz jonów
ujemnych – jon halogenu: F-, Cl-, Br- lub I-
. Do opisu struktury elektronowej tych związków
wykorzystuje się model naładowanych kul bilardowych. Jony traktuje się jako wzajemnie
nieprzenikalne, naładowane kule. Wzajemna nieprzenikalność jest konsekwencją zakazuPauli’ego i
stabilności zamkniętych powłok elektronowych.
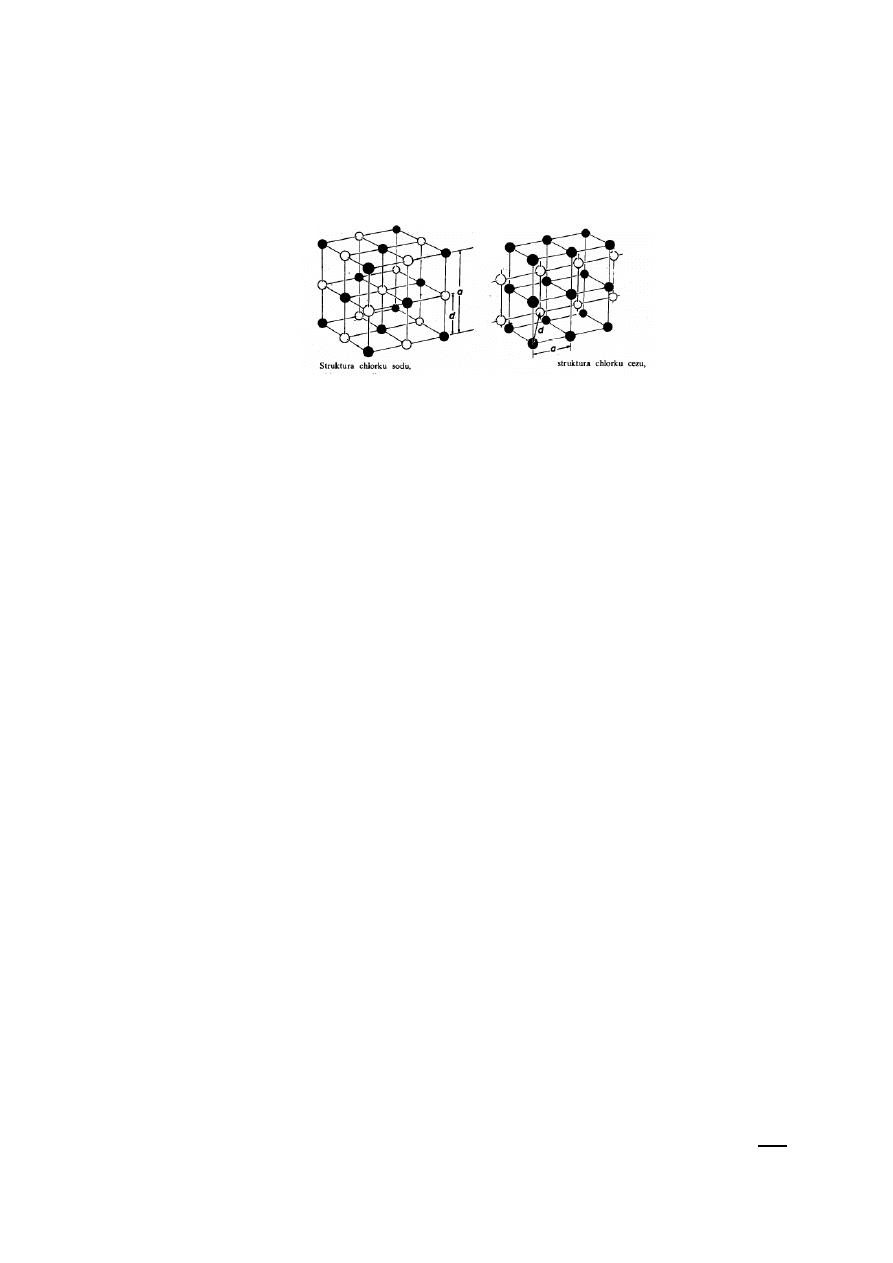
Większość tych związków tworzy kryształy o strukturze chlorku sodu, której sieć Bravais’go
jest siecią regularnie centrowaną powierzchniowo. Wyjątki stanowią związki CsCl, CsBr i CsI, które
krystalizują w strukturze chlorku cezu (sieć Bravais’go jest siecią regularnie centrowaną
objętościowo) (Rys.1).
Rys. 1
Struktury kryształów jonowych
Halogenki metali alkalicznych posiadają ujemną wartość powinowactwa elektrycznego, tak
jak gazy szlachetne. Gazy szlachetne mają ujemne powinowactwa elektronowe, gdyż przyłączany do
nich elektron musi zająć orbital znajdujący się poza zamkniętą powłoką, daleko od jądra. Oznacza to,
że energia anionu jest większa od energii obojętnego atomu i przyłączenie elektronu do atomu
wymaga dostarczenia dodatkowej energii.
Inną ważną cechą kryształów halogenków metali alkalicznych jest występowanie w ich
strukturz
e niedoskonałości, zwanymi centrami barwnymi. Centra barwne są to luki po jonie, w okolicy
której znajduje się zlokalizowany nadmiarowy elektron lub dziura. Nazwa centrów barwnych wynika
z ich podstawowej właściwości – absorpcji promieniowania elektromagnetycznego (specyficznego dla
danego rodzaju kryształu, ale mieszczącego się w zakresie promieniowania widzialnego). Podczas
przenoszenia elektronu z jednego poziomu centrum barwnego na drugi otrzymamy widmo
absorpcyjne odpowiadające częstościom optycznym, analogicznie jak to miejsce w obserwacji
liniowych serii widmowych dla pojedynczego izolowanego atomu. Przejścia takie pojawiają się w
przedziale optycznie wzbronionym dla idealnego kryształu, wobec tego odpowiadają im bardzo
wyraźne maksima w widmie. Jeśli takie pasmo absorpcyjne znajduje się w obrębie widma
widzialnego, oznacza to zabarwienie kryształu (kryształy halogenków metali alkalicznych pozbawione
tego rodzaju defektów są bezbarwne). W przypadku centrów F (w luce po jonie ujemnym znajduje się
jeden nadmiarowy elektron)
absorbowane światło pochłaniane jest przez elektrony zlokalizowane
tworzące te centra.
Elektrony lokalizowane w F centrach nie są elektronami walencyjnymi, gdyż nie są
przywiązane do żadnego rdzenia atomowego. Jednocześnie nie są też elektronami przewodnictwa,
ponieważ nie mają pełnej swobody przemieszczania się wewnątrz sieci krystalicznej. Należy go zatem
sytuować w przerwie pomiędzy pasmami. Typowa struktura energetyczna centrum F jest zaś taka, że
w wyniku omawianego wzbudzenia e
lektrony otrzymują wystarczającą energię do opuszczenia swego
pierwotnego położenia i przeniesienia do pasma przewodnictwa.
S.B.
Wyszukiwarka
Podobne podstrony:
Wyklad 7 Wlasnosci elektryczne metali
14 Korozja metali i stopów
Technologia metali mikrostruktura
Obróbka plastyczna metali obejmuje
Foundry Contstruction piec do topienia metali
Ćw 3 wytwarzanie powłok metalicznych na podłożu metalicznym i niemetalicznym
Metalizacja tworzyw sztucznych
halogenki alkilowe
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Korozja metali, Energetyka, Chemia
Inhibitory korozji metali
reakcje metali z kwasami wniosek zadanie domowe
ODKSZTAŁCENIE PLASTYCZNE I REKRYSTALIZACJA METALI
Odkształcenie plastyczne i rekrystalizujące metali
Harmonogram zajęć Podstawy Recyklingu Metali Nieżelaznych
więcej podobnych podstron