
MIKROBIOLOGIA OGÓLNA
dla studentów studiów licencjackich
kierunków medycznych
pod redakcją
Wojciecha Króla i Bogdana Mazura
ŚLĄSKI UNIWERSYTET MEDYCZNY W KATOWICACH

Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

MIKROBIOLOGIA OGÓLNA
dla studentów studiów licencjackich
kierunków medycznych
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

Autorzy
Joanna Bronikowska
Zenon Czuba
Aleksandra Garbusińska
Dagmara Jaworska
Mariola Kunicka
Wojciech Król
Bogdan Mazur
Anna Mertas
Mariusz Skiba
Ewelina Szliszka
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

MIKROBIOLOGIA OGÓLNA
dla studentów studiów licencjackich
kierunków medycznych
pod redakcją
Wojciecha Króla i Bogdana Mazura
ŚLĄSKI UNIWERSYTET MEDYCZNY W KATOWICACH
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

Recenzent
Prof. dr hab. Jerzy Pacha
Redakcja
Teresa Pawlok
© Copyright by Śląski Uniwersytet Medyczny w Katowicach
Katowice 2014
Wszelkie prawa zastrzeżone
Dzieło może być wykorzystywane tylko na użytek własny,
do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja,
redystrybucja lub odsprzedaż
Wydanie I
ISBN 978-83-7509-277-6
Skład komputerowy i łamanie
Wydawnictwo Uczelni
ul. Medyków 12
40-752 Katowice
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

5
SPIS TREŚCI
Przedmowa (Wojciech Król, Bogdan Mazur) ................................................................................................... 7
I. WIADOMOŚCI OGÓLNE Z ZAKRESU MIKROBIOLOGII .............................................................. 9
1. Morfologia i fizjologia komórki bakteryjnej. Metody barwienia i hodowli bakterii (Dagmara
Jaworska) .................................................................................................................................................
11
1.1. Podstawowe różnice między bakteriami, a innymi drobnoustrojami ................................................ 11
1.2. Technika mikroskopii. Mikroskop świetlny – zasada działania ........................................................ 12
1.3. Metody barwienia bakterii ................................................................................................................ 13
1.4. Metody hodowli bakterii ................................................................................................................... 15
1.5. Budowa komórki bakteryjnej ............................................................................................................ 16
1.6. Substancje i czynniki niezbędne do wzrostu i rozwoju bakterii ........................................................ 20
1.7. Rozmnażanie bakterii ........................................................................................................................ 21
2. Pobieranie materiału do badań bakteriologicznych (Anna Mertas) ......................................................... 23
3. Flora fizjologiczna (Zenon Czuba) .......................................................................................................... 26
3.1. Pozytywne funkcje prawidłowej mikroflory ..................................................................................... 26
3.2. Negatywna rola mikroflory fizjologicznej ........................................................................................ 27
3.3. Mikroflora organizmu człowieka ...................................................................................................... 28
4. Dezynfekcja i sterylizacja (Aleksandra Garbusińska) ........................................................................... 30
4.1. Pojęcia ogólne ................................................................................................................................... 30
4.2. Metody sterylizacji ............................................................................................................................ 31
4.3. Monitorowanie cykli sterylizacyjnych .............................................................................................. 33
4.4. Antyseptyka ...................................................................................................................................... 35
II. BAKTERIOLOGIA SZCZEGÓŁOWA .................................................................................................. 37
1. Ziarenkowce Gram-dodatnie – Staphylococcus i Streptoccocus (Joanna Bronikowska) .................... 39
1.1. Gronkowce, Staphylococcus ............................................................................................................. 39
1.2. Paciorkowce, Streptococcus .............................................................................................................. 43
1.3. Paciorkowce kałowe, Enterococcus, „ziarniaki jelitowe” ................................................................. 46
2. Ziarenkowce Gram-ujemne Neisseria (Joanna Bronikowska) .............................................................. 48
2.1. Neisseria gonorrhoeae ...................................................................................................................... 48
2.2. Neisseria meningitidis ....................................................................................................................... 49
3. Laseczki Gram-dodatnie: Corynebacterium, Listeria, Clostridium, Bacillus (Dagmara Jaworska) 51
3.1. Bacillus .............................................................................................................................................. 51
3.2. Clostridium ....................................................................................................................................... 53
3.3. Corynebacterium ............................................................................................................................... 57
3.4. Listeria .............................................................................................................................................. 59
4. Wybrane pałeczki Gram-ujemne z rodziny Enterobacteriaceae (Mariusz Skiba) .............................. 60
4.1. Zasady hodowli i diagnostyki zakażeń wywoływanych przez pałeczki jelitowe .............................. 61
4.2. Czynniki chorobotwórczości pałeczek Enterobacteriaceae .............................................................. 62
4.3. Najważniejsi przedstawiciele Enterobacteriaceae ............................................................................ 63
5. Spiralne bakterie Gram-ujemne (Mariola Kunicka) ............................................................................. 67
5.1. Treponema ......................................................................................................................................... 67
5.2. Leptospira ......................................................................................................................................... 70
5.3. Borrelia ............................................................................................................................................. 71
6. Prątki (Joanna Bronikowska) .................................................................................................................. 73
6.1. Gruźlica ............................................................................................................................................. 73
6.2. Trąd ................................................................................................................................................... 74
7. Bakteryjne czynniki zjadliwości (Mariusz Skiba) ................................................................................. 76
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

6
III. MECHANIZMY LEKOOPORNOŚCI .................................................................................................. 79
1. Lekooporność (Aleksandra Garbusińska) ............................................................................................. 81
1.1. Metody oznaczania wrażliwości bakterii ........................................................................................ 81
2. Zakażenia szpitalne – wiadomości ogólne (Mariola Kunicka) ........................................................... 90
IV. WIRUSOLOGIA ...................................................................................................................................... 95
1. Wirusologia ogólna (Dagmara Jaworska) ............................................................................................ 97
1.1. Struktura wirusów ........................................................................................................................... 97
1.2. Klasyfikacja wirusów ...................................................................................................................... 98
1.3. Replikacja wirusów zwierzęcych .................................................................................................... 99
1.4. Drogi przenoszenia zakażeń wirusowych ........................................................................................ 102
1.5. Diagnostyka zakażeń wirusowych ................................................................................................... 103
2. Wirusologia szczegółowa (Ewelina Szliszka) ....................................................................................... 105
2.1. Wirusowe choroby wysypkowe ...................................................................................................... 105
2.2. Wirusowe zakażenia dróg oddechowych ........................................................................................ 109
2.3. Wirusowe zakażenia przewodu pokarmowego ................................................................................ 111
2.4. Pozostałe choroby wirusowe ........................................................................................................... 113
2.5. Zakażenia pracowników medycznych w związku z wykonywanym zawodem .............................. 116
V. GRZYBY (Mariola Kunicka) ...................................................................................................................... 119
1. Diagnostyka mykologiczna .................................................................................................................. 122
2. Zakażenia grzybicze ............................................................................................................................. 123
VI. PODSTAWY IMMUNOLOGII .............................................................................................................. 125
1. Odporność nieswoista (Bogdan Mazur) ............................................................................................... 127
1.1. Etapy procesu fagocytozy ................................................................................................................ 129
1.2. Układ dopełniacza ........................................................................................................................... 129
2. Odporność swoista (Bogdan Mazur) .................................................................................................... 131
2.1. Pierwotne narządy limfatyczne ....................................................................................................... 131
2.2. Wtórne narządy limfatyczne ............................................................................................................ 131
2.3. Limfocyty T i ich subpopulacje ....................................................................................................... 133
2.4. Limfocyty B i ich subpopulacje ...................................................................................................... 134
3. Rola cytokin w odpowiedzi immunologicznej (Bogdan Mazur) ......................................................... 138
4. Typy reakcji nadwrażliwości (Bogdan Mazur) ................................................................................... 139
5. Szczepionki – wiadomości ogólne (Mariola Kunicka) ......................................................................... 142
Bibliografia ...................................................................................................................................................... 145
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

7
Przedmowa
Mikrobiologia jest nauką, która ujmuje holistycznie oraz integruje dziedziny wiedzy, takie jak
immunologia, wirusologia, bakteriologia, mykologia i parazytologia. Z punktu widzenia zagrożeń,
jakie niosą ze sobą czynniki patogenne, elementem łączącym te obszary nauki jest interakcja pomię-
dzy mikro- i makroorganizmami, które predysponują w niektórych sytuacjach do zakażenia i choroby.
Dziedziny mikrobiologii podlegają niezależnemu rozwojowi. Stale też odkrywane są nowe czynniki
patogenne oraz obserwuje się nabywanie lekooporności przez drobnoustroje, które komplikują lecze-
nie zakażeń i determinują pojawienie się szczepów szpitalnych.
Celem tego skryptu jest przekazanie niezbędnej wiedzy na ten temat studentom medycznych
kierunków licencjackich. Publikacja ta powstała na bazie wieloletniego doświadczenia dydaktycznego
pracowników Katedry i Zakładu Mikrobiologii i Immunologii w Zabrzu Rokitnicy.
Wojciech Król, Bogdan Mazur
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

I. WIADOMOŚCI OGÓLNE
Z ZAKRESU MIKROBIOLOGII
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

11
1. Morfologia i fizjologia komórki bakteryjnej. Metody barwienia
i hodowli bakterii
(Dagmara Jaworska)
Mikrobiologia (gr. mikros – mały, bios – życie, logos – nauka) jest szeroką dziedziną nauki
o drobnoustrojach, które zasiedlają świat. Są obecne wszędzie, choć nieuzbrojonym okiem nie może-
my ich dostrzec. Żyją w środowiskach zupełnie nieprzychylnych innym organizmom, np. znajdziemy
je w gorących źródłach, strumieniach lodowcowych, głębinach morskich i na górskich szczytach. Jako
flora fizjologiczna kolonizują skórę, błony śluzowe czy przewód pokarmowy ludzi i zwierząt. Bez ich
obecności funkcjonowanie tych organizmów byłoby niemożliwe. Dobroczynne działanie drobnoustro-
jów wykorzystywano już dawno temu do produkcji wina czy sera. Natomiast chorobotwórcze bakterie
i grzyby towarzyszą nam również od zarania dziejów, stanowiąc przyczynę strasznych epidemii, za-
raz, przerażających wydarzeń, których konsekwencją była tajemnicza śmierć setek tysięcy ludzi
i zwierząt. Ich aktywność przyczyniała się do wyludnienia całych okolic, budząc postrach i powszech-
ne przerażenie.
Bakterie zostały po raz pierwszy zaobserwowane w 1686 roku przez holenderskiego biologa
Antoniego van Leeuwenhoeka, który używał własnoręcznie wykonanego mikroskopu zawierającego
tylko jedną soczewkę. Uczony ten swoimi odkryciami znacznie wybiegał poza swoją epokę i, niestety,
jego odkrycia poszły w zapomnienie. Dalszy rozwój mikrobiologii nastąpił wraz z rozwojem
i upowszechnieniem technik mikroskopowych. Pierwszą próbę usystematyzowania drobnoustrojów
podjął duński uczony Otto Müller, który – kontynuując prace van Leeuwenhoeka – narysował i opisał
wiele grup bakterii.
Mikroskop jako narzędzie badawcze do celów bakteriologicznych wykorzystywał również je-
den z wielkich ojców mikrobiologii – Ludwik Pasteur (1822–1893). Badacz ten obalił m.in. teorię
samorództwa, wprowadził metodę pasteryzacji wina (metody zapobiegającej jego kwaśnieniu), a także
po raz pierwszy w historii wyodrębnił żywe kultury bakterii i hodował je na pożywce płynnej zwanej
bulionem. Serią eksperymentów udowodnił również, że to drobnoustroje są odpowiedzialne za rozwój
chorób, takich jak wąglik, cholera czy wścieklizna. Innym wielkim uczonym żyjącym w tamtym okre-
sie był mikrobiolog Robert Koch, któremu zawdzięczamy wprowadzenie nowych metod hodowli
drobnoustrojów (na agarze), opracowanie technik barwienia drobnoustrojów, a wreszcie odkrycie
prątka gruźlicy, nazywanego czasami na pamiątkę prątkiem Kocha.
1.1. Podstawowe różnice między bakteriami a innymi drobnoustrojami
Komórki prokariotyczne różnią się od eukariotycznych przede wszystkim brakiem jądra i in-
nych organelli komórkowych, ale także odmienną zawartością i organizacją DNA. Unikalną cechą
bakterii jest występowanie ściany komórkowej zbudowanej z peptydoglikanu. Organizmy eukario-
tyczne, jeżeli w ogóle ścianę komórkową posiadają, to jest ona zbudowana z chityny bądź celulozy.
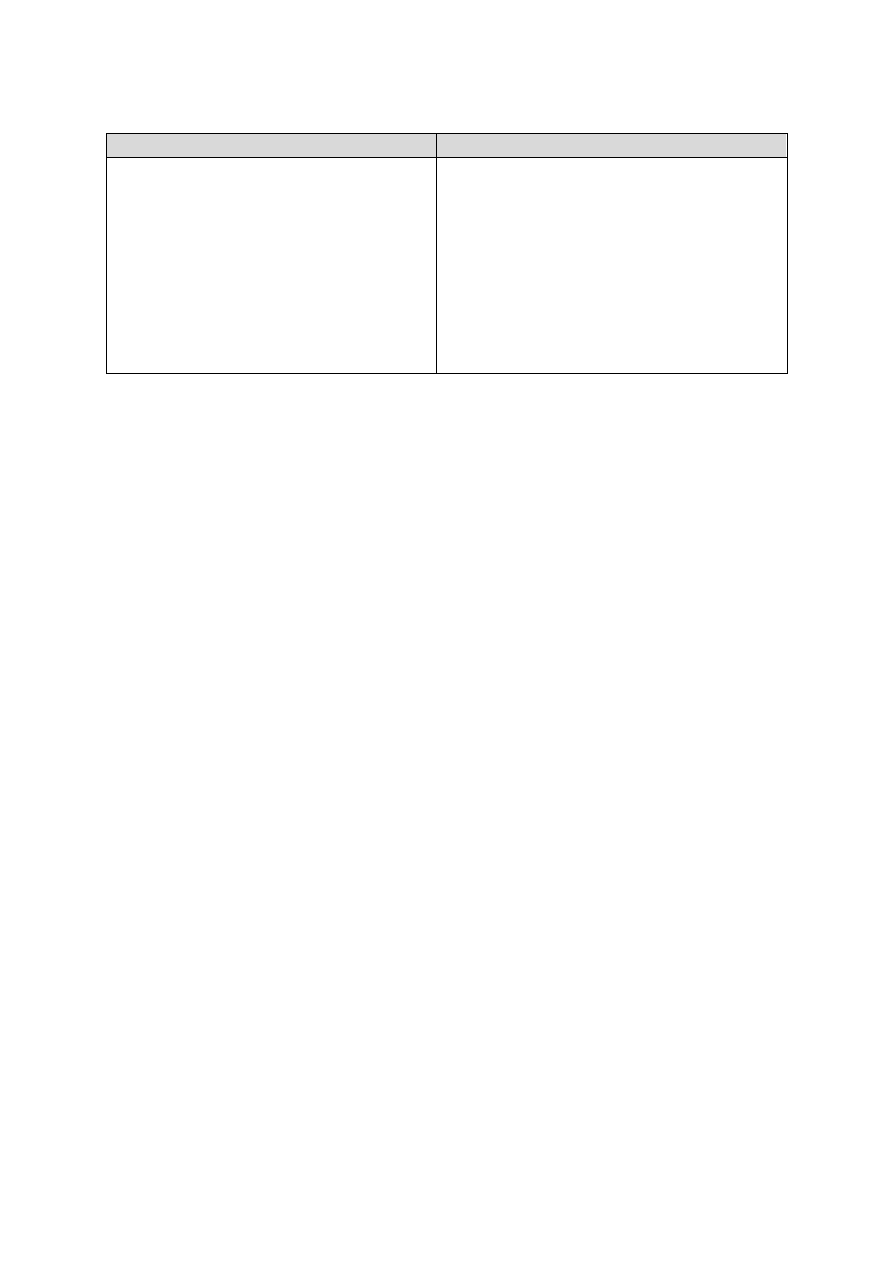
Pozostałe cechy różnicujące drobnoustroje prokariotyczne od eukariotycznych prezentuje tabela I.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż
12
Tabela I. Różnice pomiędzy organizmami prokariotycznymi i eukariotycznymi
Prokariota
Eukariota
Wielkość komórki 0,1–10 μm
Wielkość komórki 10–100 μm
Brak błony jądrowej
Obecność błony jądrowej
Pojedynczy chromosom – nukleoid – występujący
w formie kolistej
Wiele chromosomów występujących w formie linio-
wej
Brak histonów związanych z DNA
Histony związane z DNA
Brak intronów
Obecność intronów w genach
Prosty podział komórki
Podział mitotyczny
Brak kompartmentów błonowych
Obecne kompartmenty błonowe
Ściana komórkowa zbudowana z peptydoglikanu
Rybosomy 70S
Ściana komórkowa zbudowana z chityny lub celulo-
zy, lub nieobecna
Rybosomy 80S
Wstępną metodą klasyfikacji bakterii jest ich wygląd pod mikroskopem, np. kształt, rozmiar
komórki, organizacja przestrzenna komórek, barwienie – szczególnie metodą Grama.
Bakterie występują w trzech podstawowych kształtach:
kulistym – ziarniaki, ziarenkowce (cocci); niektóre bakterie w obrazie mikroskopowym tworzą
różnego rodzaju skupiska, np. kuliste bakterie mogą tworzyć dwoinki, czworaczki, grona (staphy-
lococcus) czy łańcuszki (streptococcus);
cylindrycznym – pałeczki (bacteria), laseczki (bacilli); nazwę pałeczki zwykle odnosi się do bak-
terii nieprzetrwalnikujących, a laseczki do przetrwalnikujących;
spiralnym – krętki (spirochetae), przecinkowce (vibrio), przypominają kształtem przecinki, śru-
bowce (spirilla), o kształcie litery S.
1.2. Technika mikroskopii. Mikroskop świetlny – zasada działania
W mikroskopie świetlnym możemy oglądać organizmy i tkanki utrwalane, barwione lub żywe
w świetle przechodzącym. W tym celu każdy mikroskop jest wyposażony w dwie główne składowe:
mechaniczną i optyczną. Pierwsza służy do manipulowania preparatem i przesuwania części optycz-
nych względem niego, druga do jego oświetlenia i wytworzenia obrazu.
Część optyczna
Na zespół optyczny mikroskopu świetlnego składają się:
Źródło światła – wbudowane w podstawę własne źródło światła lub dwustronne lusterko, które umoż-
liwia korzystanie z zewnętrznych źródeł światła (np. światło dzienne).
Przesłona – umieszczona zwykle pod kondensorem; pozwala na regulację jasności pola widzenia
i kontrastu.
Kondensor – układ soczewek skupiający wiązkę promieni świetlnych pochodzących ze źródła światła,
w celu oświetlenia pola widzenia.
Obiektyw – element tworzenia obrazu powiększonego, składający się z układu soczewek. Obiektywy
można podzielić na suche (małych i średnich powiększeń) oraz immersyjne (dużych powiększeń).
Podczas używania obiektywów immersyjnych należy wypełnić przestrzeń pomiędzy preparatem a so-
czewką obiektywu specjalnym olejkiem immersyjnym (współczynnik załamania światła olejku jest ta-
ki sam, jak współczynnik szkła). Pozwala to na poprawę jakości obrazu przy dużych powiększeniach.
Najczęściej stosowane powiększenia obiektywów to: 5, 10, 20, 40 razy (suche) oraz 100 razy (immer-
syjne).
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

13
Okular – jest to układ soczewek, za pomocą którego oglądamy obraz mikroskopowy. Okulary po-
większają wytworzony przez obiektyw obraz. Jest on pozorny i odwrócony. Powiększenie okularu
to 5–15 razy.
Część mechaniczna
Na część mechaniczną mikroskopu świetlnego składają się:
Podstawa mikroskopu – zapewniająca jego stabilność.
Statyw – na nim umieszczone są stolik i tubus.
Stolik – usytuowany pod obiektywami. Służy do ustawienia preparatu względem obiektywu za
pomocą wyposażonych w pokrętła prowadnic.
Tubus – element, do którego umocowane są podstawowe elementy optyczne, czyli okular i obiek-
tyw.
Rewolwer – obrotowa tarcza, do której wkręcane są obiektywy.
Śruby makro- i mikrometryczna – umożliwiają precyzyjne ustawienie ostrości obrazu. Śruba mi-
krometryczna to śruba szybkiego przesuwu, a mikrometryczna – wolnego przesuwu.
Podstawowe pojęcia związane z techniką mikroskopii to powiększenie i zdolność rozdzielcza
mikroskopu. Powiększenie mikroskopu (w bakteriologii najczęściej 1000–1500 razy) jest iloczynem
powiększenia okularu i obiektywu. Wartości te są umieszczone na obudowach części optycznych.
Zdolność rozdzielcza mikroskopu to najmniejsza odległość dzieląca dwa punkty, które w obrazie
mikroskopowym będą jeszcze dostrzegane jako oddzielne. Im jest ona mniejsza, tym lepszą zdolność
rozdzielczą posiada mikroskop. W przypadku mikroskopu świetlnego wynosi ona około 0,2–0,3
m.
Większa zdolność rozdzielcza umożliwia także stosowanie wyższych powiększeń.
1.3. Metody barwienia bakterii
Bakterie są organizmami jednokomórkowymi o niewielkich rozmiarach (przeciętnie około
1
m), więc mogą być widziane tylko za pomocą mikroskopu. W celu badania morfologii komórek
bakteryjnych wykonuje się preparaty przyżyciowe lub utrwalone. Każdy z tych typów ma inne zasto-
sowanie, a wybór technik barwienia zależy od kierunku prowadzonych badań mikroskopowych.
Preparaty przyżyciowe
Preparaty przyżyciowe służą do obserwacji ruchliwości, żywotności, sposobu rozmnażania
bakterii, albo do wykrywania substancji zapasowych. Preparaty przyżyciowe można wykonać na
szkiełku podstawowym (metoda kropli spłaszczonej), albo na szkiełku z wgłębieniem, zwanym komo-
rą Lindnera (metoda kropli wiszącej). Preparaty przyżyciowe należy oglądać bezpośrednio po przygo-
towaniu, żeby nie dopuścić do wyschnięcia materiału. Preparat przyżyciowy może być barwiony lub
niebarwiony.
Preparaty utrwalone
Przygotowanie preparatów utrwalonych obejmuje następujące czynności:
Wykonanie rozmazu – kroplę badanego materiału rozprowadza się cienką warstwą na odtłuszczo-
nym szkiełku podstawowym. Jeśli pobierany materiał pochodzi z hodowli stałej (np. na płytce Pe-
triego), należy najpierw na szkiełku umieścić kroplę roztworu 0,9% chlorku sodu, a następnie po-
brany za pomocą ezy materiał rozprowadzić w tej kropli.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

14
Utrwalenie preparatu – najczęściej przeprowadzane metodą termiczną. Wyschnięty preparat prze-
prowadza się trzykrotnie w pozycji poziomej (rozmazem do góry) przez płomień palnika. Utrwala-
nie preparatów ma na celu zabicie komórek, przyklejenie ich do powierzchni szkiełka i odsłonięcie
w ścianach komórkowych związków, z którymi łączy się barwnik.
Preparaty utrwalone poddaje się następnie barwieniu, co pozwala określić kształt komórek,
umożliwia obserwację ich układów czy struktur wewnątrzkomórkowych.
Metody barwienia drobnoustrojów
Metody barwienia można podzielić ze względu na to, jaka część preparatu mikroskopowego
ulega wybarwieniu:
Pozytywne – polega na zabarwieniu komórek, podczas gdy tło zostaje bezbarwne. Najczęściej sto-
sowanym pojedynczym barwnikiem pozytywnym jest błękit metylenowy. Aby preparat wybarwić
pozytywnie, musi on zostać najpierw utrwalony.
Negatywne – komórki pozostają bezbarwne na barwnym tle. Wykorzystuje się tu barwniki o cha-
rakterze tuszu, gruboziarniste, niewnikające do wnętrza komórki. Najczęściej stosowane są barw-
niki czarne, jak nigrozyna, tusz chiński, lub czerwone – czerwień Kongo. Przy barwieniu negatyw-
nym preparaty nie są utrwalane.
Pozytywno–negatywne – jest kombinacją barwienia pozytywnego i negatywnego. Stosuje się je do
wykazywania obecności otoczek bakteryjnych.
Inny podział, ze względu na liczbę barwników użytych do barwienia preparatu, wyróżnia:
Barwienie proste – stosuje się tylko jeden barwnik (np. fiolet krystaliczny lub gencjanowy, błękit
metylenowy, fuksynę).
Barwienie złożone – używa się więcej niż jednego barwnika, często też wykorzystuje się odbar-
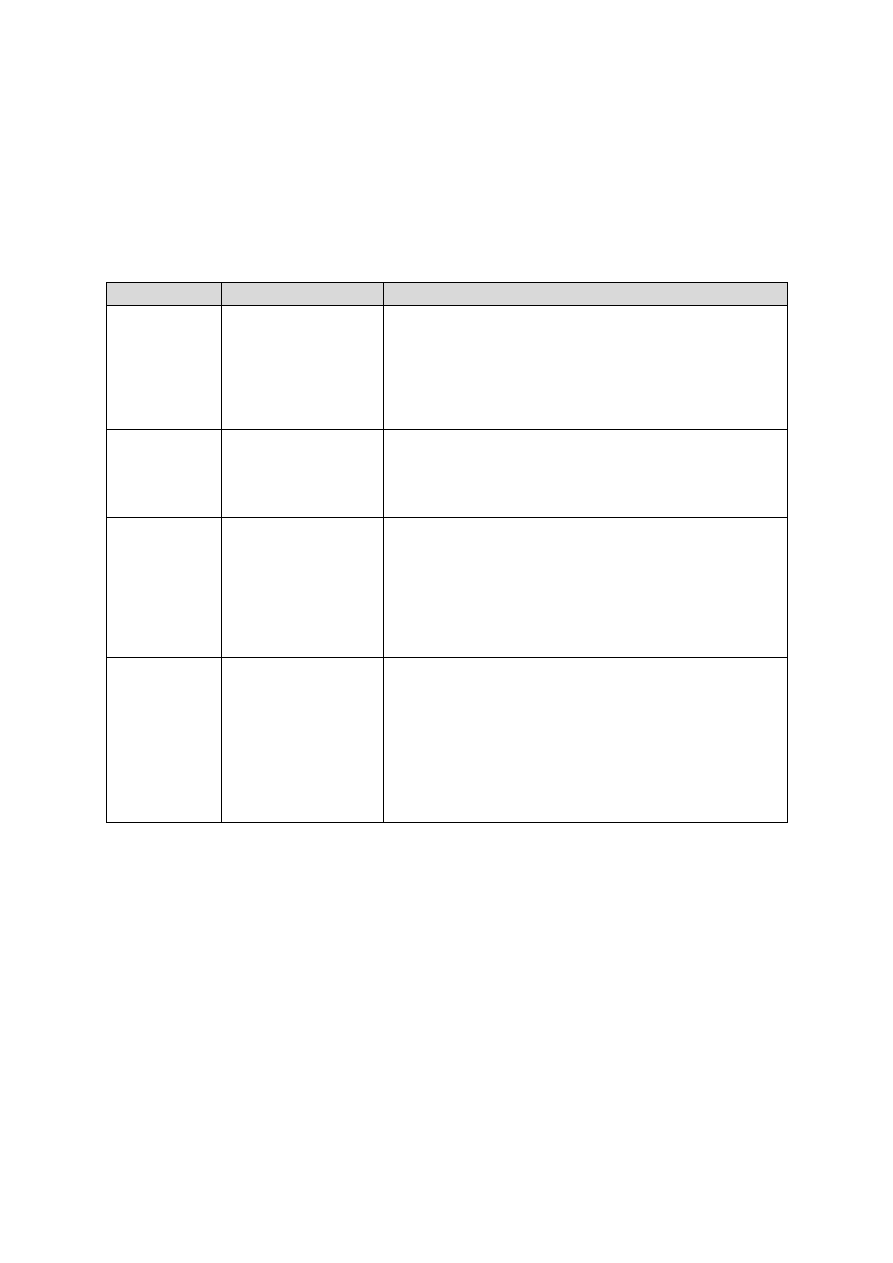
wiacze. Przykłady barwienia złożonego zamieszczono w tabeli II.
Tabela II. Barwienie drobnoustrojów
Barwienie
Przebieg barwienia
Zastosowanie i wynik barwienia
Barwienie
Grama
Fiolet krystaliczny (1–2 min), spłuka-
nie wodą
Płyn Lugola (1–2 min), spłukanie
wodą
Etanol (odbarwienie), spłukanie wodą
Barwienie kontrastowe rozcieńczoną
fuksyną (30 s), spłukanie wodą
Najczęściej stosowane w mikrobiologii barwienie,
które różnicuje bakterie na dwie grupy, w zależności
od budowy ich ściany komórkowej:
Gram-dodatnie – wybarwiają się na kolor fioleto-
wy
Gram-ujemne – przyjmują kolor różowo-czer-
wony
Barwienie
Ziehl-
-Neelsena
Stężona fuksyna karbolowa (trzykrot-
ne ogrzewanie do pojawienia się pary)
Odbarwienie mieszaniną HCl/alkohol
Spłukanie wodą
Barwienie kontrastowe błękitem me-
tylenowym (1–2 min)
Spłukanie wodą
Metoda stosowana do barwienia prątków. Ze wzglę-
du na wysoką zawartość lipidów w ścianie komór-
kowej drobnoustroje te nie odbarwiają się pod
wpływem kwaśnego alkoholu – z tego powodu na-
zywa się je kwasoopornymi. W wyniku barwienia
widoczne są czerwone komórki bakterii kwasoopor-
nych na tle innych drobnoustrojów, które przyjmują
kolor niebieski.
Barwienie
Neissera
Barwienie mieszaniną barwnika I
(błękit metylenowy) i barwnika II
(fiolet krystaliczny) w stosunku 2 : 1
przez 10 minut
Spłukanie wodą
Dobarwienie chryzoidyną
Spłukanie wodą
Metoda uwidacznia charakterystyczne dla maczu-
gowca błonicy ziarnistości Ernsta-Babesa (materiał
zapasowy, ziarna wolutyny), wybarwiające się na
granatowo, natomiast komórki drobnoustrojów bar-
wią się na kolor żółty.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

15
1.4. Metody hodowli bakterii
Pierwsza pożywka mikrobiologiczna, służąca do namnażania drobnoustrojów in vitro, została
stworzona przez Pasteura pod koniec XIX w. Była to pożywka płynna zwana bulionem. Dalsze mody-
fikacje podłoży mikrobiologicznych wprowadził Robert Koch, dzięki zastosowaniu czynnika zestala-
jącego zwanego agarem (otrzymywanego z morskich krasnorostów). Nazwa tej substancji służy obec-
nie do określania pożywek stałych (agar). Od tego czasu wprowadzono setki różnorodnych przepisów
na podłoża mikrobiologiczne. Niektóre z nich są przystosowane do wzrostu wybranych grup drobnou-
strojów, a nawet pojedynczych gatunków czy szczepów.
Pożywki, zwane też podłożami mikrobiologicznymi, to mieszaniny różnych związków che-
micznych, które służą do namnażania drobnoustrojów w warunkach laboratoryjnych. Można je po-
dzielić pod kątem ich konsystencji, zawartości substancji odżywczych albo funkcji diagnostycznej.
Poniżej przedstawiono cztery podstawowe podziały podłoży mikrobiologicznych.
Podział podłoży ze względu na konsystencję:
− płynne – służą głównie do namnażania drobnoustrojów;
− półpłynne – zawierają 0,1–0,7% agaru i służą np. do obserwowania ruchu;
− stałe – zawierają 1,5–2% agaru i służą do namnażania oraz różnicowania bakterii.
Podłoża hodowlane przygotowuje się w różnego rodzaju naczyniach. Hodowle płynne o małej ob-
jętości prowadzi się w probówkach lub kolbach, na większą skalę w butlach lub biofermentatorach.
Natomiast hodowle na podłożu stałym wykonywane są na płytkach Petriego lub w probówce na
słupach czy skosach.
Podział podłoży ze względu na ich skład chemiczny:
− naturalne – nieposiadające zdefiniowanego składu chemicznego, zawierające wyciągi z tkanek
roślinnych lub zwierzęcych, hydrolizaty białkowe itp., np. bulion odżywczy;
− syntetyczne – o ściśle określonym składzie chemicznym zarówno jakościowym, jak i ilościo-
wym;
− półsyntetyczne – o częściowo znanym składzie chemicznym.
Podział podłoży ze względu na dodatek składników odżywczych:
− minimalne – zawierają tylko najbardziej podstawowe składniki pokarmowe, które są niezbędne
do podtrzymania wzrostu drobnoustrojów;
− proste – zawierają niezbędne substancje odżywcze, które umożliwiają dobry wzrost drobnou-
strojów o niezbyt wysokich wymaganiach (np. bulion odżywczy, agar odżywczy);
− wzbogacone – podłoża dla drobnoustrojów o większych wymaganiach wzrostowych; jako
czynniki wzbogacające stosowane są np.: krew, surowica, płyny wysiękowe; przykłady podłoży
wzbogaconych: agar z krwią, agar czekoladowy, agar Mueller-Hinton, bulion tioglikolanowy.
Podział podłoży ze względu na zastosowanie:
− namnażające – służą do otrzymania dużej biomasy drobnoustrojów, najczęściej są to podłoża
płynne;
− wybiórczo–namnażające (selekcyjne) – podłoża z dodatkiem takich związków chemicznych,
które hamują wzrost pewnej grupy drobnoustrojów (inhibitory wzrostu), natomiast umożliwiają
wzrost innych gatunków, np. bulion z żółcią, pożywka SF, podłoże Sabourauda;
− wybiórczo–różnicujące – są to podłoża zawierające dodatek specyficznych składników, które
pozwolą na identyfikację drobnoustroju; podłoża te różnicują bakterie, ze względu na ich meta-
bolizm; identyfikacja opiera się najczęściej na produkcji jakiegoś enzymu, który wytwarza je-
den ze szczepów rosnący na tym podłożu; częstym dodatkiem do pożywki jest wskaźnik infor-
mujący o zajściu reakcji chemicznej; przykłady podłoży: pożywka Chapmana, MacConkeya,
SS, Endo, Levine’a;
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż
16
− specjalne – są to podłoża opracowane w celu namnożenia i identyfikacji określonych mikroor-
ganizmów, które mają szczególnie wysokie wymagania hodowlane lub są obecne w próbkach
klinicznych wśród wielogatunkowej mieszaniny drobnoustrojów (np. zanieczyszczenie florą fi-
zjologiczną); przykłady podłoży specjalnych: Löwensteina-Jensena, Clauberga, Löfflera, podło-
ża dla beztlenowców (Tarozziego-Wrzoska, Hiblera);
− transportowe – podłoża służące do transportu próbek z drobnoustrojami.
Tabela III. Typy podłoży mikrobiologicznych
Typ
Przykładowe podłoże
Zastosowanie
Nieselektywne
podłoże
wzbogacone
Agar z krwią
Podłoże dla większości bakterii, można zaobserwować na nim
zdolność drobnoustroju do wywoływania hemolizy
Agar czekoladowy
Podłoże używane do hodowli bardziej wybrednych szczepów
bakterii w tym Haemophilus czy Neisseria
Agar Mueller-Hinton
Podłoże do wykonywania antybiogramów (oznaczania leko-
wrażliwości drobnoustrojów)
Podłoże
wybiórczo-
-namnażające
Bulion z żółcią
Podłoże do hodowli Salmonella
Pożywka SF
Podłoże do hodowli Salmonella i Shigella
Pożywka Sabourauda
Podłoże dla grzybów (zawiera antybiotyki hamujące wzrost
bakterii)
Podłoże
wybiórczo-
-różnicujące
Agar MacConkeya
Podłoże wybiórcze dla pałeczek Gram-ujemnych, różnicuje
gatunki, ze względu na zdolność do fermentacji laktozy
Podłoże Chapmana
(agar z mannitolem)
Podłoże wybiórcze dla gronkowców (ze względu na dodatek
NaCl), różnicujące dla gronkowca złocistego, który fermentuje
mannitol
Pożywka SS
Selektywny agar używany do wykrywania Salmonella i Shigella
w próbkach kału
Podłoże
specjalne
Pożywka Löwensteina-
-Jensena
Podłoże używane do hodowli prątków
Pożywka Clauberga
(z tellurynem potasu)
Podłoże różnicujące do hodowli maczugowca błonicy
Pożywka Löfflera
Podłoże namnażające do hodowli maczugowca błonicy
Podłoża dla beztlenow-
ców (Tarozziego-
-Wrzoska, Hiblera)
Podłoża zawierające kawałeczki tkanki zwierzęcej (wątroby,
mózgu) zanurzone w bulionie, przykryte warstwą płynnej para-
finy
1.5. Budowa komórki bakteryjnej
Głównymi składnikami komórek bakteryjnych są:
Cytoplazma
Jest to substancja koloidalna, wypełniająca wnętrze komórki. Zawiera wodę, jony nieorga-
niczne, niskocząsteczkowe metabolity, substancje zapasowe, białka, rybosomy i DNA.
Nukleoid
Jest to chromosom bakteryjny. Materiał genetyczny w postaci DNA nie tworzy tak uporząd-
kowanej struktury jak prawdziwy chromosom eukariotyczny i nie jest osłonięty błoną jądrową. Ko-
mórka bakteryjna jest haploidalna, a więc chromosom bakteryjny występuje w postaci tylko jednej
kopii (poza okresem replikacji). Nukleoid to zwinięta spirala DNA, złożona z dwóch łańcuchów poli-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

17
nukleotydowych, mająca postać kolistą. Nukleoid może kodować do 4000 różnych genów koniecz-
nych do egzystencji, rozprzestrzeniania i zjadliwości danej bakterii.
Pozachromosomowe elementy genetyczne
Zalicza się do nich plazmidy i transpozony. Plazmidy są to koliste cząsteczki DNA, które
w cytoplazmie ulegają autonomicznej, niezależnej od nukleoidu replikacji. Plazmidy determinują ce-
chy, które zwiększają możliwość przeżycia komórek bakteryjnych w określonych warunkach środowi-
skowych czy też określają ich zjadliwość (np. oporność na antybiotyki, zdolność do produkcji egzo-
toksyn). Plazmidy mogą kodować nawet 40–50 genów. Wyróżnia się plazmidy koniugacyjne, sto-
sunkowo duże, występujące w liczbie 1–2 kopii na komórkę i przekazywane pomiędzy bakteriami na
drodze koniugacji, oraz plazmidy niekoniugacyjne, które są mniejsze, a w komórce może znajdować
się nawet kilkadziesiąt ich kopii. Transpozonami określa się fragmenty DNA charakteryzujące się
podatnością na translokację z jednego miejsca genomu bakterii w inne.
Rybosomy
Są to struktury składające się z cząsteczek RNA i wielu białek, zbudowane z dwóch podjedno-
stek 50S i 30S. Współczynnik sedymentacji całych rybosomów bakteryjnych wynosi 70S. Funkcją
rybosomów jest synteza białek.
Błona komórkowa
Otacza cytoplazmę bakterii, stanowiąc fizyczną barierę pomiędzy wnętrzem komórki a śro-
dowiskiem zewnętrznym. Charakteryzuje się selektywną przepuszczalnością. W błonie cytoplazma-
tycznej znajduje się bakteryjny system transportu elektronów, który ma za zadanie produkcję energii
w procesie fosforylacji. Błona cytoplazmatyczna zbudowana jest z podwójnej warstwy fosfolipidów,
w którą wbudowane są różne białka zaangażowane w transport substancji na zewnątrz i do wnętrza
komórki.
Mezosomy
Utworzone są przez wpuklenia w błonie do wnętrza komórki. Mezosomy to miejsce przycze-
pienia nukleoidu do błony, umożliwiające równomierny podział materiału genetycznego podczas po-
działu komórki.
Ściana komórkowa
Jest to sztywna ściana zapewniająca komórce kształt i ochronę przed szkodliwym wpływem
środowiska. Ze względu na różnice w budowie ściany komórkowej, bakterie dzieli się na Gram-do-
datnie i Gram-ujemne. Podstawowy jej składnik stanowi peptydoglikan, czyli mureina. Cząsteczka
peptydoglikanu zbudowana jest z długich łańcuchów polisacharydowych, połączonych między sobą
w sieci za pomocą mostków tetrapeptydowych. Podstawową podjednostką w łańcuchu polisachary-
dowym peptydoglikanu jest dwucukier zbudowany z N-acetyloglukozaminy (NAG) i kwasu N-acety-
lomuraminowego (NAM), połączonych wiązaniem glikozydowym
(1,4). Wiązanie to podlega rozbi-
ciu w wyniku działania lizozymu.
Budowa ściany komórkowej u bakterii Gram-dodatnich i Gram-ujemnych
Bakterie Gram-dodatnie i Gram-ujemne różnią się strukturą, grubością oraz składem ściany
komórkowej. W ścianie komórkowej każdej z tych grup występują unikatowe dla nich struktury, które
często są wysoce immunogenne i prowadzą do wzbudzenia odpowiedzi immunologicznej w zakażo-
nym organizmie.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

18
Budowę ściany komórkowej bakterii Gram-dodatnich i Gram-ujemnych przedstawiono sche-
matycznie na rycinie 1.
GRAM +
GRAM -
cytoplazma
cytoplazma
nukleoid
błona komórkowa
błona zewnętrzna
kwasy tejchojowe i lipotejchojowe
przestrzeń
periplazmatyczna
peptydoglikan
peptydoglikan
LPS
poryna
białka
białka
Ryc. 1. Budowa ściany komórkowej bakterii Gram-dodatnich i Gram-ujemnych.
Bakterie Gram-dodatnie
Ściana komórkowa u tych bakterii jest gruba (20–80 nm) i składa się w 60–100% z peptydo-
glikanu tworzącego trójwymiarową sieć. Peptydoglikan może być hydrolizowany przez lizozym – roz-
kłada on wiązania glikozydowe
(1,4) pomiędzy NAG i NAM, w wyniku czego dochodzi do degrada-
cji szkieletu peptydoglikanowego i lizy komórki. W budowie ściany komórkowej bakterii Gram-do-
datnich charakterystyczne są również kwasy tejchojowe. Występują one w dwóch postaciach – jako
rybitolowy kwas tejchojowy i glicerolowy kwas tejchojowy. Rybitolowy kwas tejchojowy związany
jest zwykle z kwasem N-acetylomuraminowym i nazywany kwasem tejchojowym ściany komórko-
wej. Glicerolowy kwas tejchojowy, związany z glikolipidami błony, określa się jako kwas lipotejcho-
jowy. Kwasy te są ważnym wyznacznikiem zjadliwości drobnoustrojów i odpowiadają też za proces
przylegania (adherencji) do powierzchni innych drobnoustrojów albo komórek gospodarza.
Ważną rolę pełnią także polisacharydy oraz białka zawarte w ścianie komórkowej. Są one
przede wszystkim silnymi antygenami, a zmienność ich struktury odpowiada za zmienność serotypo-
wą bakterii Gram-dodatnich. Białka znajdują się głównie na zewnętrznej powierzchni ściany komór-
kowej i pełnią funkcję adhezyn, enzymów oraz mogą chronić bakterie przed atakiem ze strony układu
odporności (m.in. dopełniacza).
Bakterie Gram-ujemne
Ściana bakterii Gram-ujemnych jest znacznie bardziej złożoną strukturą, choć jej grubość wy-
nosi jedynie 2–10 nm. Warstwa peptydoglikanu jest tutaj dużo cieńsza (stanowi 5–10% masy całej
ściany komórkowej). Na zewnątrz, ponad warstwą peptydoglikanu znajduje się błona zewnętrzna.
Miejsce pomiędzy błoną cytoplazmatyczną a wewnętrzną stroną błony zewnętrznej określane jest jako
przestrzeń periplazmatyczna. U bakterii Gram-ujemnych nie stwierdzono obecności kwasów tejcho-
jowych i lipotejchojowych.
W przestrzeni periplazmatycznej znajdują się systemy transportu żelaza, białek, cukrów,
a także enzymy niezbędne do rozkładu makrocząsteczek. Oprócz tego stwierdzono w niej obecność
czynników wirulencji, takich jak kolagenazy, hialuronidazy czy enzymy rozkładające antybiotyki
-
-laktamowe.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

19
Specyficzna budowa ściany komórkowej bakterii Gram-ujemnych powoduje, że są one bar-
dziej odporne na działanie lizozymu, ze względu na występowanie unikatowej struktury, czyli ze-
wnętrznej błony komórkowej. Znajduje się ona na zewnątrz od warstwy peptydoglikanowej, nadając
komórce kształt i służąc jako bariera dla różnych cząstek (jak środki przeciwdrobnoustrojowe). Błona
ta ma charakter dwuwarstwy lipidowej, jednakże znacząco różni się od innych błon biologicznych.
Wewnętrzna warstwa zbudowana jest z fosfolipidów, natomiast zewnętrzna składa się głównie z lipo-
polisacharydu (LPS).
LPS, inaczej endotoksyna, ma budowę długiego heteropolimeru złożonego z trzech regionów:
lipidu A, oligocukru rdzeniowego i wielocukru o swoistości antygenowej O, będącego antygenem
somatycznym. Lipidowa część LPS osadzona jest w błonie zewnętrznej, a antygen somatyczny wysta-
je ponad powierzchnię błony. Za efekty toksycznego działania LPS odpowiada przede wszystkim jego
lipidowa składowa, czyli lipid A.
Lipopolisacharyd jest odpowiedzialny za wiele objawów chorobowych wywoływanych przez
bakterie Gram-ujemne. Cząsteczka ta stanowi jeden z najsilniejszych stymulatorów zarówno wrodzo-
nej, jak i nabytej odpowiedzi immunologicznej. Uwolnienie znacznych ilości LPS w organizmie jest
przyczyną wstrząsu endotoksycznego.
Usunięcie ściany komórkowej
Pozbawienie komórki bakteryjnej ściany komórkowej zwykle prowadzi do lizy bakterii, jed-
nakże w odpowiednich warunkach mogą utworzyć się takie formy, jak:
Protoplasty – komórki bakterii Gram-dodatnich całkowicie pozbawione ściany, np. poprzez działa-
nie lizozymu. Jeżeli utrzymywane są w środowisku izotonicznym, przeżywają, przyjmując postać
kuli.
Sferoplasty – odpowiedniki protoplastów u bakterii Gram-ujemnych, posiadające fragmenty ściany
komórkowej dzięki oporności na rozkład enzymatyczny. Sferoplasty utrzymują kształt kulisty na-
wet w nieizotonicznym środowisku.
Formy L bakterii – formy komórkowe z uszkodzoną ścianą komórkową, powstające pod wpływem
terapii antybiotykami lub innych czynników zaburzających syntezę ściany. Postać L rośnie na pod-
łożach stałych (protoplasty i sferoplasty nie mają takiej zdolności), kolonie przypominają wyglą-
dem sadzone jajko. Formy L mogą wrócić do postaci macierzystej po usunięciu czynnika transfor-
mującego.
Dodatkowe elementy struktury komórki bakteryjnej
Niektóre bakterie Gram-dodatnie oraz Gram-ujemne posiadają jeszcze, oprócz omówionych
wcześniej, dodatkowe elementy strukturalne. Należą do nich:
Otoczki
Warstwy substancji o charakterze polimerów, polisacharydowe lub białkowe, przylegające do
zewnętrznej powierzchni ściany komórkowej, wydzielane przez bakterie. Bakterie otoczkowe na od-
powiednich podłożach tworzą charakterystyczne śluzowate kolonie (S), natomiast ich bezotoczkowe
odmiany – kolonie szorstkie (R). Otoczki mają niskie powinowactwo do barwników, dlatego można je
uwidocznić tylko poprzez barwienie pozytywno-negatywne. Ich funkcją jest ochrona bakterii przed
wysychaniem oraz udział w adhezji. Otoczka stanowi też czynnik wirulencji, ponieważ zwiększa cho-
robotwórczość, jest nieprzepuszczalna dla niektórych antybiotyków, chroni przed działaniem mecha-
nizmów obronnych gospodarza (fagocytozą, aktywacją dopełniacza).
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

20
Rzęski
Rzęski to długie, puste w środku, spiralne filamenty zbudowane z białka o nazwie flagellina,
dzięki którym odbywa się ruch bakterii. Zakotwiczone są w błonie cytoplazmatycznej za pomocą
struktur przypominających haczyk oraz płytki lub pierścienie (tzw. ciałko podstawne). Ze względu na
umiejscowienie, wyróżnia się następujące typy urzęsienia:
peritrychalne – wkołorzęse – rzęski na całej powierzchni komórki,
monotrychalne – bakterie posiadają tylko jedną rzęskę,
lofotrychalne – czuborzęse – mają rzęski na jednym lub dwóch biegunach.
Fimbrie
Fimbrie, zwane inaczej pili, są krótsze i prostsze w budowie niż rzęski. Można je dostrzec wy-
łącznie pod mikroskopem elektronowym. Zbudowane są z białka będącego polimerem utworzonym
z podjednostek o nazwie pilina. Wyróżnia się fimbrie zwykłe i płciowe.
Fimbrie zwykłe – odgrywają rolę w przyleganiu. Występują u bakterii Gram-ujemnych z rodziny
Enterobacteriaceae, rodzaju Pseudomonas, Haemophilus i Neisseria. Należą do czynników wiru-
lencji tych bakterii.
Fimbrie płciowe – uwarunkowane genami zlokalizowanymi w plazmidach, nadają komórce bakte-
ryjnej zdolność funkcjonowania jako dawcy plazmidowego genu, przekazywanego komórce biorcy
w procesie koniugacji.
Wtręty cytoplazmatyczne
Są to z reguły zapasowe substancje odżywcze, które mogą być otoczone cienką błoną. Najczę-
ściej występują ziarnistości utworzone z polimeru kwasu
-hydroksymasłowego lub ziarna wolutyny
(charakterystyczne dla Corynebacterium diphtheriae).
1.6. Substancje i czynniki niezbędne do wzrostu i rozwoju bakterii
Wymagania odżywcze
Autotrofy – bakterie samożywne, dla których jedynym źródłem węgla wykorzystywanego w prze-
mianach metabolicznych jest dwutlenek węgla. Należą tutaj bakterie przeprowadzające fotosyntezę
lub chemosyntezę.
Heterotrofy – bakterie cudzożywne, które wymagają do wzrostu złożonych składników organicz-
nych, a źródłem węgla są dla nich węglowodany lub aminokwasy. Bakterie te można dalej podzie-
lić na:
− prototrofy (drobnoustroje wymagające do wzrostu nielicznych prostych związków organicz-
nych; należą do nich np. bakterie saprofityczne);
− auksotrofy (wymagają do wzrostu wielu złożonych związków organicznych; należą do tej grupy
bakterie chorobotwórcze i symbiotyczne).
Produkcja energii przez bakterie heterotroficzne odbywa się poprzez rozkład węglowodanów na
drodze fermentacji i oddychania tlenowego lub beztlenowego:
− oddychanie tlenowe – końcowym akceptorem elektronów u bakterii przeprowadzających ten
typ oddychania jest tlen;
− fermentacja – oddychanie beztlenowe, końcowymi akceptorami elektronów są pirogronian,
mleczan i inne związki organiczne.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

21
Wymagania tlenowe
Ze względu na zapotrzebowanie na tlen bakterie dzieli się na następujące grupy:
Bezwzględne beztlenowce – nie są zdolne do wzrostu, jeżeli zawartość tlenu w atmosferze prze-
kracza 0,5% – tlen jest dla nich toksyczny, np. Clostridium botulinum i Clostridium tetani.
Względne beztlenowce – mogą rosnąć w warunkach tlenowych i beztlenowych, do grupy tej nale-
ży zarówno większość bakterii stanowiących naturalną mikroflorę, jak i chorobotwórczych dla
człowieka, np.: Escherichia coli, Staphylococcus aureus.
Bezwzględne tlenowce – bakterie wymagające do wzrostu obecności tlenu atmosferycznego, np.:
Serratia marcescens, Mycobacterium tuberculosis.
Mikroaerofile – wymagają do wzrostu tlenu, jednak jego stężenie w atmosferze powinno być
obniżone. Optymalny wzrost odbywa się przy pięcioprocentowym stężeniu tlenu i dziesięcioproce-
towym CO
2
, np. Helicobacter pylori.
Wymagania temperaturowe
We wzroście bakterii uwzględnia się temperatury: minimalną, poniżej której ustaje wzrost
bakterii, maksymalną, powyżej której komórki giną, optymalną, oraz w której zachodzi wzrost i roz-
mnażanie bakterii.
Bakterie psychrofilne – ich naturalnym środowiskiem są głębiny mórz, oceanów, regiony podbie-
gunowe i strumienie lodowcowe. Optymalna temperatura wynosi od 0 do 20ºC.
Bakterie mezofilne – do tej grupy należy większość bakterii chorobotwórczych dla człowieka
i zwierząt oraz wchodzących w skład flory fizjologicznej. Wzrastają w temperaturze od 20 do
45ºC, ale optymalny zakres to od 35 do 37ºC.
Bakterie termofilne – naturalnym środowiskiem dla tych bakterii są m.in. gorące źródła. Zakres
temperatur to od 30 do 90ºC, natomiast optimum dla wzrostu wynosi od 50 do 70ºC. Przykładem
bakterii termofilnej jest Bacillus stearothermophilus.
1.7. Rozmnażanie bakterii
Komórki bakterii, w odróżnieniu od komórek eukariotycznych, odtwarzają się poprzez bezpo-
średni podział poprzeczny. Komórka wydłuża się i w miejscu występowania mezosomów ściennych
zaczyna powstawać poprzeczna błona komórkowa, a następnie ściana komórkowa. Nowa błona i ścia-
na powstają poprzez wrastanie zewnętrznych warstw do wewnątrz. Nukleoidy przed podziałem są
powielane, a następnie rozdzielane do komórek potomnych. Taki mechanizm podziału nie zapewnia
jednak zmienności genetycznej, gdyż powstają dwie identyczne komórki potomne. Zmienność u bak-
terii jest związana z rekombinacją, polegającą na wymianie materiału genetycznego pomiędzy komór-
kami. Przekazywanie genów odbywa się na trzy różne sposoby: poprzez transformację, transdukcję
i koniugację.
Transformacja
Proces ten polega na pobraniu wolnych cząsteczek DNA znajdujących się w otoczeniu, które
mogą pochodzić z rozpadu komórek innych bakterii (dawcy). Transformacja zachodzi u komórek bę-
dących w stanie kompetencji. Jest to zdolność do wychwytywania DNA, która zależy od obecności
w błonie białek, mających powinowactwo do DNA. Sztuczną kompetencję można wywołać w labora-
torium, działając na komórki np. chlorkiem wapnia.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

22
Transdukcja
W procesie transdukcji przekazanie DNA pomiędzy komórkami odbywa się za pomocą bakte-
riofagów, czyli grupy wirusów infekujących bakterie. Wyróżnia się dwa rodzaje zakażeń wywoływa-
nych przez bakteriofagi:
Zakażenie lityczne – bakteriofag wykorzystuje komórkę bakterii do syntezy nowych cząstek fago-
wych, a uwalnianie nowo powstałych wirusów zachodzi na drodze lizy komórki gospodarza.
Zakażenie lizogenne – charakteryzuje się tym, że wirusowe DNA jest włączane do genomu gospo-
darza, a nowe fagi nie zostaną wyprodukowane, póki nie dojdzie do konwersji do cyklu litycznego.
W ten sposób bakterie uzyskują nowy zestaw genów należących do bakteriofaga.
Koniugacja
Jest to najczęściej obserwowany sposób przekazywania DNA pomiędzy komórkami bakterii.
Do procesu koniugacji niezbędny jest czynnik płciowy (F), czyli czynnik przenoszenia będący poza-
chromosomową cząsteczką DNA (zawiera informację kodującą wytworzenie fimbrii płciowych). Pod-
czas koniugacji dochodzi do połączenia się fimbrii płciowych komórki dawcy z powierzchnią komórki
biorcy. Komórka dawcy może mieć kilka fimbrii płciowych i wejść w kontakt z kilkoma biorcami.
Pomiędzy koniugującymi bakteriami powstaje mostek, przez który dochodzi do przeniesienia czą-
steczki DNA. W ten sposób bakterie uzyskują nowy zestaw genów należących do bakteriofaga.
Formy przetrwalnikowe bakterii
Przetrwalniki to formy drobnoustrojów, które pozwalają im na przeżycie w niekorzystnych
warunkach środowiskowych, takich jak brak składników odżywczych czy wody. Proces tworzenia
przetrwalników w komórce bakteryjnej nosi nazwę sporulacji. Jest złożony i wieloetapowy. W jego
trakcie zachodzą zmiany morfologiczne, strukturalne i chemiczne, do których należą zagęszczenie
cytoplazmy wokół nukleoidu oraz synteza warstw stanowiących ochronę przetrwalnika. W przetrwal-
niku ustają wówczas wszystkie procesy metaboliczne. Jest on odporny na działanie różnych czynni-
ków, takich jak: brak wody, substancji odżywczych, wysoka temperatura, promieniowanie UV, pro-
mienie X. Oporność na ogrzewanie wiąże się ze stanem wysuszenia, a także obecnością kwasu dipiko-
linowego, który stabilizuje białka przetrwalnika. Bakterie w formie przetrwalników mogą pozostawać
w sta-nie anabiozy przez wiele lat.
Przetrwalniki, w momencie przeniesienia w sprzyjające warunki środowiska, rozpoczynają
proces kiełkowania (germinacji). Jest on indukowany pod wpływem czynników takich, jak ciepło czy
dostępność składników odżywczych. Następnie aktywowane są enzymy hydrolityczne, które rozkłada-
ją osłony przetrwalnika. Rozpad warstw zewnętrznych powoduje pojawienie się nowej komórki wege-
tatywnej. Bakterie mogą nabywać oporność np. na środki przeciwdrobnoustrojowe.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

23
2. Pobieranie materiału do badań bakteriologicznych
(Anna Mertas)
Badania diagnostyczne, mające na celu wyizolowanie czynnika zakaźnego, dzielą się na:
bezpośrednie – polegające na wykazaniu obecności drobnoustrojów w próbkach materiałów pobra-
nych od chorych poprzez wykonanie preparatu bezpośredniego i hodowli;
pośrednie – polegające na wykryciu swoistych przeciwciał w surowicy krwi chorych.
Wynik badania bakteriologicznego zależy od prawidłowego pobrania materiału diagnostycz-
nego i zabezpieczenia próbek do badań podczas transportu.
Zasady pobierania i przesyłania próbek do badań bakteriologicznych
Materiał powinien być pobrany przed rozpoczęciem leczenia środkami przeciwdrobnoustro-
jowymi lub 2 tygodnie po zakończeniu ich aplikowania. Materiał należy dobrać odpowiednio do to-
czącego się procesu chorobowego. W przypadku badania płynów (krew, mocz, żółć, płyn mózgowo-
-rdzeniowy) na posiew należy pobrać minimum 10 cm
3
. Gdy badania są wielokierunkowe (bakteriolo-
giczne, immunologiczne, cytologiczne), konieczne jest uzyskanie materiału w większej ilości. Czas
transportu próbek do laboratorium trzeba skrócić do minimum. Niektóre materiały muszą być pobrane
przy łóżku chorego, dlatego należy zabezpieczyć materiał przed wysychaniem, wylaniem, przegrza-
niem i zapewnić prawidłowy transport. Próbki do badania bakteriologicznego powinny być dostarczo-
ne do pracowni mikrobiologicznej w ciągu 2 godzin. Zbyt długie przetrzymywanie pobranego mate-
riału może prowadzić do namnożenia się bakterii, które są przyczyną infekcji. Uzyskany wówczas
wynik nie jest miarodajny, zwłaszcza jeśli dotyczy ilościowego posiewu (np. przy podejrzeniu zaka-
żenia układu moczowego).
Materiał należy pobrać jałowo z miejsca, w którym toczy się proces zapalny, pamiętając, aby
uniknąć zanieczyszczenia florą fizjologiczną. Ma to szczególne znaczenie w przypadku uzyskiwania
materiału z dróg oddechowych, moczowych, rodnych, skóry, gdyż miejsca te są wyjątkowo skoloni-
zowane florą komensalną.
W razie konieczności poboru prób w celu zidentyfikowania rzadkich schorzeń (np. brucelloza,
krztusiec, shigelloza), należy zgłosić ten fakt, aby pracownia mikrobiologiczna mogła przygotować
specjalne podłoża do hodowli drobnoustrojów wywołujących te choroby.
Naczynie, do którego chcemy pobrać materiał diagnostyczny, powinno być wyjałowione
w autoklawie, a następnie opisane według schematu:
imię i nazwisko,
data,
godzina pobrania.
Zaleca się również podanie informacji dotyczącej kierunku badań, np. ogólne bakteriologicz-
ne, antybiogram i wstępne rozpoznanie (w kierunku gruźlicy, krztuścia, błonicy).
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

24
Instrukcja pobierania materiałów do badań bakteriologicznych
Zakażenia dróg oddechowych
Wymazy należy pobierać na jałowe wymazówki z tylnej ściany gardła na czczo, bez mycia
zębów. W przypadku użycia wymazówki suchej (bez podłoża transportowego) próbkę trzeba nie-
zwłocznie dostarczyć do laboratorium i wysiać na odpowiednie podłoża bakteriologiczne. Wymazy
z podłożem transportowym przez jakiś czas mogą przetrwać w oryginalnym składzie, ale powinny być
przesłane do pracowni mikrobiologicznej jak najszybciej. Plwocinę pobiera się do jałowych spluwa-
czek po uprzednim przepłukaniu jamy ustnej przegotowaną wodą. Materiał ten powinien pochodzić
z głębokiego odkrztuszania. Czasami wydzieliny do badań bakteriologicznych pozyskuje się w czasie
bronchoskopii, z nakłucia przeztchawiczego lub bronchofiberoskopii (popłuczyny oskrzelowo-pęche-
rzykowe).
Zakażenia układu moczowego (ZUM)
Badanie bakteriologiczne moczu polega na ilościowej ocenie bakterii w nim się znajdujących.
W prawidłowych warunkach jest on jałowy, a o zakażeniu świadczy obecność powyżej 10
5
bakterii
w 1 cm
3
moczu. Tylko odpowiednie pobranie próby moczu pozwoli na prawidłową interpretację wy-
niku, w innym razie może on być zaburzony obecnością bakterii z okolicy ujścia cewki moczowej.
Próbkę moczu na posiew należy pobrać rano, po dokładnym umyciu ujścia cewki moczowej, ze środ-
kowego strumienia do jałowego pojemnika. Mocz do badania bakteriologicznego należy niezwłocznie
po pobraniu dostarczyć do laboratorium. Jeśli nie jest to możliwe, dopuszcza się przetrzymanie próbki
w temp. 4ºC maksymalnie do 2 godzin.
Płyn mózgowo-rdzeniowy
Płyn mózgowo-rdzeniowy należy pobierać przy łóżku chorego bezpośrednio na podłoże trans-
portowe (np. Meningomedium). Jego transport musi odbywać się w 37ºC, gdyż niższa temperatura
zmniejsza lub uniemożliwia wyhodowanie bakterii odpowiedzialnych za zapalenie opon mózgowo-
-rdzeniowych (np. Neisseria meningitidis).
Posiew ropy
Ropę najczęściej pobiera się jałową wymazówką lub przy większej ilości strzykawką bądź pi-
petą. Ropę z ropnia należy pobrać z okolicy jego ścian, z uwagi na fakt, że w części środkowej ropa
może być jałowa. Przed pobraniem materiału z ropni otwartych nie należy wcześniej odkażać skóry,
natomiast w przypadku zamkniętych, trzeba zdezynfekować i naciąć tak, aby uzyskać materiał.
Pobieranie krwi do badań bakteriologicznych
W przypadku podejrzenia bakteriemii (obecność bakterii we krwi), fungemii (obecność grzy-
bów we krwi) i wiremii (obecność wirusów we krwi) krew pobiera się na specjalne podłoże hodowla-
ne, np. tryptozowe, tryptozowo-sojowe, bulion wzbogacony, 2–3 razy na dobę, pół godziny przed
szczytem gorączkowym w ilości 10–30 ml u dorosłych, 1–5 ml u dzieci. Zaleca się pobranie krwi do
dwóch butelek zawierających podłoże płynne w celu izolacji w jednej z nich beztlenowców, a w dru-
giej bakterii tlenowych. Z uwagi na trudność określenia czasu gorączki, zaleca się dwukrotne pobranie
w odstępie 45–60 min za pomocą igły i strzykawki lub zestawu próżniowego z zachowaniem wszel-
kich zasad aseptyki.
Pobieranie krwi do badania serologicznego
Do badania serologicznego krew należy pobrać jałową strzykawką w ilości od 5 do 10 ml, za-
chowując zasady aseptyki. Zabezpieczoną krew należy przesłać do laboratorium wraz z załącznikiem
zawierającym informację o badaniu serologicznym, które należy wykonać. Z uwagi na zmieniające się
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

25
w trakcie procesu chorobowego miana przeciwciał, krew należy pobrać kilkakrotnie w ciągu przebie-
gu choroby.
Podsumowanie
Diagnostyka mikrobiologiczna obejmuje zarówno rozpoznanie patogenu, jak i dobór leczenia
przeciwbakteryjnego, który opiera się na wynikach badań laboratoryjnych. Wyniki te natomiast zależą
od rodzaju, prawidłowego pobrania i transportu materiału. Niezwykle ważna jest też współpraca leka-
rza i diagnosty laboratoryjnego, właściwa interpretacja wyniku i dobór optymalnego leczenia. Na
uwagę zasługuje również fakt, że na wyhodowanie czynnika etiologicznego potrzeba czasu. Często
więc należy wprowadzić leczenie, nie czekając na zakończenie procedur laboratoryjnych. Po otrzyma-
niu pełnego, ostatecznego wyniku badań mikrobiologicznych lekarz w razie potrzeby powinien zwery-
fikować leczenie. Diagnostyka mikrobiologiczna obejmuje wykrycie drobnoustrojów drogą bezpo-
średnią poprzez badanie mikroskopowe, izolację, wyhodowanie i identyfikację na podstawie ich bio-
chemicznych cech. Identyfikacja może też polegać na wykryciu określonych antygenów, toksyn, ma-
teriału genetycznego i miana swoistych przeciwciał w surowicy krwi pacjenta.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

26
3. Flora fizjologiczna
(Zenon Czuba)
W warunkach naturalnych rozwój ludzi i zwierząt przebiegał w ścisłym związku ze środowi-
skiem, którego nieodłącznym elementem jest mikroflora. Szacuje się że organizmowi towarzyszy oko-
ło 10
14
drobnoustrojów, które około 10-krotnie przekraczają liczbę komórek organizmu człowieka.
Przewaga ta oraz ich stały wpływ na organizm człowieka w toku ewolucyjnego rozwoju musiały wa-
runkować zarówno czynności fizjologiczne, jak i zmiany w budowie anatomicznej. Badania prowa-
dzone na zwierzętach hodowanych w warunkach jałowych i karmionych jałową karmą potwierdziły
zmiany anatomiczne, głównie w przewodzie pokarmowym, w postaci cieńszych ścian jelit oraz niedo-
rozwój układu odpornościowego. Wystawienie takich zwierząt na kontakt z naturalną mikroflorą
z reguły kończyło się ich śmiercią. Jednocześnie wykorzystanie takich modeli zwierzęcych pozwoliło
na badanie kolonizacji organizmu zwierząt przez wybrane rodzaje drobnoustrojów. Normalna mikro-
flora organizmu, tzw. biocenoza, jest utrzymywana zarówno jakościowo, jak i ilościowo w stanie ko-
rzystnej równowagi. Drobnoustroje te nie stanowią przypadkowego zanieczyszczenia ciała człowieka,
ale pełnią korzystną, ochronną i odżywczą rolę w różnych miejscach organizmu, zaczynając od naro-
dzin i pozostając w nich przez całe życie. W warunkach fizjologicznych pierwszy kontakt z drobnou-
strojami ma miejsce podczas porodu. Noworodek urodzony naturalnie styka się po raz pierwszy
z drobnoustrojami dróg rodnych kobiety. Najczęściej są to bakterie z rodzaju Lactobacillus. W przy-
padku rozwiązania za pomocą cięcia cesarskiego stan mikroflory jest zależny od sposobu karmienia.
I tak dzieci karmione piersią kolonizowane są głównie przez bakterie pochodzące ze skóry kobiety,
którymi są Gram-dodatnie ziarenkowce. Natomiast u dzieci karmionych butelką dominują pałeczki
Gram-ujemne. Rodzaj „pionierskich” drobnoustrojów może mieć wpływ na kolonizację noworodka
przez inne drobnoustroje, w tym formy patogenne. Należy zwrócić uwagę na możliwość zakażenia
noworodka w czasie karmienia naturalnego wirusami HIV znajdującymi się w mleku zakażonej matki.
Dalsza kolonizacja dziecka zachodzi z udziałem drobnoustrojów z jego najbliższego otoczenia, w tym
duże znaczenie mają drobnoustroje matki. Również skład mikroflory zależy od zmian w organizmie
związanych z jego rozwojem.
3.1. Pozytywne funkcje prawidłowej mikroflory
Fizjologiczna mikroflora pełni istotną rolę w odżywianiu człowieka. Bakterie mogą wytwa-
rzać witaminy K i z grupy B oraz ułatwiać rozkład niektórych substancji, np. pochodnych policukro-
wych. Dodatkowe znaczenie mają tu także drobnoustroje znajdujące się w produktach spożywczych,
które mogą uzupełniać i/lub wytwarzać sztuczną mikroflorę, szczególnie istotną przy stosowaniu
środków przeciwdrobnoustrojowych. Nazywane są probiotykami, a pożywki, na których one wzrasta-
ją, prebiotykami. Na wpływ diety na mikroflorę przewodu pokarmowego zwrócił uwagę na przełomie
XIX i XX wieku Miecznikow. Doszedł do przekonania, że wiele chorób okresu starzenia jest spowo-
dowanych przez toksyczne produkty fermentacji jelitowej i można byłoby je ograniczyć przez spoży-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

27
wanie dużych ilości mleka zakwaszonego przez pałeczki kwasu mlekowego. Wniosek taki wysunął na
podstawie obserwacji sędziwych chłopów w Bułgarii i na południu Rosji stosujących taką dietę.
Zwiększyło to zainteresowanie świata naukowego pałeczkami kwasu mlekowego i wzrostem spożycia
produktów opartych na sfermentowanym mleku. Odkryciem, inspirowanym obserwacją Miecznikowa,
było stwierdzenie Tissiera, że mikroflora kału niemowląt karmionych piersią składa się głównie
z Gram-dodatnich pałeczek kwasu mlekowego, a inne gatunki bakterii, szczególnie Gram-ujemne
enterokoki, mnożą się dopiero po rozpoczęciu sztucznego karmienia dziecka. Od czasów obserwacji
Tissiera badania ludzi i zwierząt potwierdzają stale, że sposób żywienia może mieć znaczący wpływ
na mikroflorę jelitową.
Prawidłowa mikroflora wpływa także na inne procesy związane z ograniczeniem rozwoju mi-
kroflory patogennej (odporność kolonizacyjna). Może to łączyć się z brakiem wolnej powierzchni do
zasiedlenia przez bakterie patogenne oraz wydzielaniem białka mucyny, która ogranicza możliwość
przylegania innych drobnoustrojów do powierzchni komórek. Ponadto bakterie gospodarza mogą ry-
walizować o substancje odżywcze i produkować bakteriocyny – substancje podobne do antybiotyków,
zwalczające inne pokrewne drobnoustroje. Zaburzenie mikroflory organizmu umożliwia skuteczne
zakażenie mniejszą dawką bakterii patogennych. Na przykład, aby skutecznie wywołać zapalenie jelit
u człowieka, należy wprowadzić drogą pokarmową powyżej 1 miliona bakterii Salmonella. Przy osła-
bieniu mikroflory, po podaniu antybiotyków takie skuteczne zakażenie może wywołać już od 10 do
100 komórek Salmonella.
Mikroflora fizjologiczna, jej metabolity oraz produkty ich rozpadu mają istotne znaczenie
w modulacji funkcji układu odpornościowego, przede wszystkim w przewodzie pokarmowym, gdzie
mikroflora jest najliczniejsza i jednocześnie występuje obfita tkanka limfatyczna. U zwierząt hodowa-
nych w warunkach jałowych stwierdzono znaczne osłabienie funkcji układu odpornościowego, m.in.
w ilości produkowanych przeciwciał. Ponadto mikroflora stymuluje odnowę nabłonka jelita. Brak
takiej stymulacji prowadzi do atoniczności i zmniejszenia wytrzymałości jelita.
3.2. Negatywna rola mikroflory fizjologicznej
Niedobory immunologiczne i immunosupresja, tj. pierwotne i wtórne niedobory odpornościowe,
mogą ograniczyć kontrolę nad własną mikroflorą organizmu i w konsekwencji spowodować nega-
tywne skutki związane z rozwojem w organizmie drobnoustrojów oportunistycznych. Wtórne nie-
dobory mogą występować po zakażeniach wirusowych, np. po infekcji wirusem grypy (rozwój za-
każeń z udziałem dwoinki zapalenia płuc – Streptococcus pneumoniae) czy zakażenia oportuni-
styczne w AIDS oraz u pacjentów poddanych immunosupresji po transplantacji narządów. Efekt
immunosupresji można również obserwować w wyniku wyczynowego uprawiania sportu.
Urazy powypadkowe oraz inne uszkodzenia z przerwaniem ciągłości tkanek mogą spowodować
przemieszczenie drobnoustrojów do krwi oraz innych tkanek pierwotnie jałowych, w których ich
rozwój może prowadzić do patologii. Zabiegi stomatologiczne stanowią częstą przyczynę sepsy.
Leczenie antybiotykami może spowodować rozpad drobnoustrojów i uwolnienie dużej ilości
składników bakteryjnych, np. endotoksyn. Ponadto stosowanie antybiotyków prowadzi często do
selekcji opornych na nie drobnoustrojów. Przykładem może być rzekomobłoniaste zapalenie jelit
spowodowane przez laseczki Clostridium difficile.
Uszkodzenia zębów – rozwój płytki nazębnej z udziałem drobnoustrojów należących do mikroflory
jamy ustnej może prowadzić do próchnicy zębów. Duże znaczenie w tym procesie ma Strepto-
coccus mutans.
Translokacja bakterii – bakterie jelitowe w określonych sytuacjach mogą przedostawać się z prze-
wodu pokarmowego przez nabłonek śluzówki do krążenia trzewnego i układowego. Zjawisko to
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

28
zdarza się u wcześniaków, pacjentów w stanie krytycznym, podczas ograniczonego pasażu jelito-
wego, stosowania antybiotyków i w stanach niedokrwienia trzewi.
3.3. Mikroflora organizmu człowieka
Mikroflora skóry
Zależy od właściwości skóry, której powierzchnia jest sucha, pokryta obumarłymi komórkami
o lekko kwaśnym pH. Dodatkowo substancje zawarte w wydzielinie gruczołów łojowych oraz pocie
stwarzają niekorzystne warunki do kolonizacji przez bakterie. Obszary skóry bardziej wilgotne zawie-
rają więcej drobnoustrojów. Skórę kolonizują głównie bakterie Gram-dodatnie. Są to najczęściej
gronkowce skórne (Staphylococcus epidermidis) i Propionibacterium acnes, czyli bakteria będąca
Gram-dodatnią, beztlenową pałeczką izolowaną ze zmian w trądziku. Obecnie pojawiły się pewne
wątpliwości co do głównej roli tej bakterii w trądziku. Gronkowce skórne są zdolne do wytwarzania
biofilmu na powierzchniach plastikowych, co może utrudnić działanie antybiotyków. Jest to szczegól-
nie ważne przy wprowadzaniu cewników do żył. Bakterie te mogą kolonizować powierzchnie rurek
i w ten sposób przemieszczać się z powierzchni skóry do światła żyły, powodując zakażenie krwi.
Aby ograniczyć zakażenie, należy usunąć rurkę pokrytą biofilmem z drobnoustrojami. Impregnacja
cewników środkami przeciwbakteryjnymi nie zawsze przynosi efekt, ze względu na wzrost oporności
tych bakterii na leki. Obecność, skład ilościowy i jakościowy drobnoustrojów w organizmie determi-
nuje wiele czynników, z których naistotniejsze to: wiek, płeć, stan zdrowotny, dieta oraz miejsce za-
mieszkania.
Mikroflora jamy ustnej i nosa
Pionierskimi drobnoustrojami jamy ustnej są paciorkowce, m.in. Streptococcus salivarius.
W niewielkich ilościach występują także bakterie z rodzaju Lactobacillus i niektóre beztlenowce. Sy-
tuacja ulega zmianie po pojawieniu się zębów lub protez w obrębie jamy ustnej. Wówczas to stałe
powierzchnie, bez możliwości złuszczania, mogą kolonizować inne drobnoustroje, przede wszystkim
Streptococcus sanguis i mutans, inni przedstawiciele beztlenowców, a także gatunki należące do Acti-
nomyces. W jamie ustnej liczebnie dominują paciorkowce Streptococcus sanguis i salivarius. Drobno-
ustroje kolonizują wszystkie powierzchnie, także wewnętrzną część policzków i język. U części osób
w jamie ustnej i gardle są obecne dwoinki zapalenia płuc, które mogą wykorzystać czasowe osłabienie
układu obronnego płuc, wywołując chorobę, np. po infekcji wirusowej. Wraz z pojawieniem się zę-
bów może zostać skolonizowane przyzębie. Przewaga drobnoustrojów Gram-ujemnych nad Gram-
dodatnimi sprzyja pojawieniu się krętków i rozwojowi chorób przyzębia. Uszkodzenia dokonane przez
proteazy oraz tworząca się płytka nazębna poddziąsłowa stymulują proces zapalny i zwiększają zakres
uszkodzeń. Większość drobnoustrojów uczestniczących w chorobach przyzębia to formy beztlenowe.
Przykładami bakterii związanymi z chorobami przyzębia są: Porphyromonas gingivalis, Prevotella
intermedia, gatunki z rodzaju Fusobacterium oraz krętki Treponema denticola.
Drobnoustrojem odpowiedzialnym także za ostre zmiany w przyzębiu jest Aggregatibacter
acitinmycetemcomitans. Zaburzenia w obrębie mikroflory jamy ustnej mogą prowadzić do rozwoju
grzybic (pleśniawki u dzieci) z udziałem Candida albicans. Przy niedoborach odporności, np.
w AIDS, może występować grzybica jamy ustnej.
Mikroflora nosa człowieka zawiera głównie bakterie Gram-dodatnie o składzie zbliżonym do
powierzchni skóry. Czasami nos jest siedliskiem gronkowców Staphylococcus aureus. Może to pro-
wadzić, zwłaszcza gdy nosicielami jest personel medyczny, do zakażeń szpitalnych. Ponadto nosiciele
mogą doprowadzić do skażenia produktów spożywczych, w których rozwijające się gronkowce wy-
twarzają enterotoksynę wywołującą w konsekwencji zatrucia pokarmowe.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

29
Mikroflora żołądka i jelita cienkiego
Zależnie od diety, pH w żołądku może wynosić od 1 do 3. Tak niskie pH zawęża mikroflorę
w tym środowisku i w związku z tym mogą przeżyć głównie bakterie z rodzaju Lactobacillus, prątki,
Helicobacter pylori oraz niektóre grzyby. Helicobacter pylori jest jednym z czynników odpowiedzial-
nych za chorobę wrzodową żołądka. Bakteria ta może wytwarzać w reakcji z udziałem ureazy amo-
niak, alkalizujący kwas solny w żołądku. Największe zagęszczenie bakterii w jelicie cienkim jest
w okolicach zastawki krętniczo-kątniczej, w ostatnim odcinku przed jelitem grubym, w miejscu wol-
niejszego przepływu zawartości i wynosi około miliona komórek w 1 mililitrze.
Mikroflora okrężnicy
W odróżnieniu od jelita cienkiego przepływ zawartości w okrężnicy jest dużo mniejszy. Stwa-
rza to dogodne warunki do rozwoju bakterii, które nie muszą przylegać do ściany jelita, a tempo nam-
nażania nadąża za przepływem. Ponadto znajduje się tu dla nich dużo składników odżywczych. Bakte-
rie w okrężnicy mogą stanowić około 30% jej zawartości, a liczba drobnoustrojów wynosi około
10
12
/gram jej zawartości. Około 25% bakterii w okrężnicy to beztlenowe Bacteroides odgrywające
istotną rolę w fermentacji wielocukrów. Ponadto można tam spotkać inne beztlenowe, Gram-dodatnie
bakterie z rodzajów Eubacterium, Peptostreptococcus i Clostridium. W okrężnicy noworodków
w chwili urodzenia nie ma bakterii. Pierwsze pojawiają się bakterie zużywające tlen, takie, jak Esche-
richia coli, które po zasiedleniu i zużyciu tlenu umożliwiają kolonizację tego obszaru przez Bacteroi-
des. Przemiana mikroflory dziecka do stanu, jak u dorosłego człowieka, trwa około dwóch lat. Bakte-
riami, które mogą wykorzystać okres kształtowania się mikroflory okrężnicy są laseczki Clostridium
botulinum, mogące w tych warunkach wytworzyć toksynę i doprowadzić do śmiertelnego paraliżu
zwanego botulizmem dziecięcym. Takie zjawisko nie występuje u osób dorosłych. Około 5% osób jest
nosicielem laseczek Clostridium difficile, drobnoustrojów, które przy stosowaniu antybiotyków mogą
spowodować rzekomobłoniaste zapalenie okrężnicy. Przyczyną poważnych konsekwencji dla organi-
zmu są również Escherichia coli oraz Enterococus, które często uczestniczą w infekcjach pooperacyj-
nych. Ponadto przemieszczenie się Bacteroides (głownie Bacteroides fragilis) z okrężnicy może spo-
wodować powstanie wielu ropni w różnych narządach ciała i doprowadzić do śmierci.
Mikroflora dróg moczowo-płciowych
Mikroflora w dolnym odcinku dróg moczowych nie jest obfita i wynosi od około tysiąca do
dziesięciu tysięcy w 1 mililitrze w dystalnej części cewki moczowej. Cewka moczowa u mężczyzn
bardziej skutecznie chroni przed wnikaniem bakterii do pęcherza moczowego. Najczęściej spotykane
drobnoustroje to: Stapylococcus epidermidis, paciorkowce grupy D, Peptococcus spp., Escherichia
coli i inne saprobiotyczne pałeczki. Ponadto w mastce (mazista wydzielina występująca pod naplet-
kiem u mężczyzn i w okolicy łechtaczki u kobiet) można spotkać prątki Mycobacterium smegmatis.
U kobiet mikroflora pochwy składa się głównie z Gram-dodatnich pałeczek Lactobacillus. Bakterie te
powodują obniżenie pH do około 4–4,5, co ogranicza zakażenie tego środowiska innymi bakteriami
patogennymi. Zaburzenia mikroflory (dominacja Gram-ujemnych pałeczek) mogą prowadzić do roz-
woju drożdżycy lub bakteryjnego zapalenia pochwy i jajowodów. U wielu osób mogą występować
Chlamydia trachomatis, odpowiedzialne za zakażenia okołoporodowe i prowadzące do wielu poważ-
nych konsekwencji.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

30
4. Dezynfekcja i sterylizacja
(Aleksandra Garbusińska)
4.1. Pojęcia ogólne
W zakładach opieki zdrowotnej wyroby medyczne, tzn. narzędzia chirurgiczne, sprzęt me-
dyczny, bielizna operacyjna, materiały opatrunkowe, zakwalifikowane do kategorii wysokiego ryzyka,
podlegają obowiązkowej sterylizacji. Wymóg sterylności dotyczy również sprzętu przeznaczonego do
zabiegów przebiegających z naruszeniem ciągłości tkanek w zakładach poza opieką medyczną, np.
firmach kosmetycznych, pracowniach tatuaży itp. Ustawa o zapobieganiu oraz zwalczaniu zakażeń
(Dz.U.2008.234.1570) określa sterylizację jako proces zniszczenia zdolnych do namnażania się form
biologicznych czynników chorobotwórczych. Celem sterylizacji jest więc inaktywacja zanieczyszczeń
mikrobiologicznych znajdujących się na wyrobie (drobnoustrojów komórkowych, tj. form wegetatyw-
nych oraz przetrwalnikowych bakterii, cząstek wirusowych) i przekształcenie w ten sposób wyrobów
niesterylnych w sterylne.
Wyrób medyczny można określić jako sterylny wówczas, gdy teoretyczne prawdopodobień-
stwo znalezienia na/w nim zdolnych do życia drobnoustrojów wynosi:
SAL
*
= 1 x 10
-6
lub mniejsze
*
SAL – Sterility Assurance Level, inaczej: Poziom Zapewnienia Sterylności
Z powyższej definicji wynika, że nie można zagwarantować sterylności żadnego pojedyncze-
go wyrobu poddawanego procesowi sterylizacji. Sterylność wyrobów poddawanych procesowi steryli-
zacji określa się jako prawdopodobieństwo wystąpienia zdolnego do życia drobnoustroju na pojedyn-
czym wyrobie. Istnieje zatem zawsze możliwość przeżycia drobnoustroju, lecz nie może to być liczba
większa niż jedna komórka lub cząstka czynnika biologicznego na jeden milion sterylizowanych jed-
nostek, bez względu na zakres zastosowanego procesu.
W danym procesie sterylizacyjnym, bez względu na rodzaj metody, prawdopodobieństwo
przeżycia drobnoustrojów zależy od ich oporności na parametry procesu oraz od ich liczby na po-
wierzchni wyrobu poddawanego sterylizacji, czyli od tzw. wstępnego zanieczyszczenia mikrobiolo-
gicznego. Czas redukcji populacji żywych drobnoustrojów w wyniku zastosowanej techniki jest
wprost proporcjonalny do poziomu wstępnego zanieczyszczenia mikrobiologicznego, a nawet może
nie gwarantować osiągnięcia wymaganego poziomu SAL sterylizowanego wyrobu. Tak więc produkty
medyczne, które nie były właściwie oczyszczone przed cyklem sterylizacji, mogą pozostać niesterylne
nawet po prawidłowo przeprowadzonym cyklu w sterylizatorze.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

31
4.2. Metody sterylizacji
Wyrób medyczny przekazywany do sterylizacji powinien być kompatybilny z wybraną meto-
dą sterylizacji, tzn. odporny na zastosowane w niej parametry krytyczne, czyli powinien być spełniony
tzw. warunek sterylizowalności.
Wyróżnia się następujące metody sterylizacji:
Sterylizacja wysokotemperaturowa parą wodną w nadciśnieniu
Czynnikiem sterylizującym jest ciepło wilgotne – nasycona para wodna w nadciśnieniu, po-
wodująca destrukcję białek drobnoustrojów. Stosowane są następujące programy:
Program 121ºC – przebiegający w środowisku nasyconej pary wodnej w nadciśnieniu 1 atm.
(101,3 kPa), przy wilgotności względnej 100% oraz czasie ekspozycji 15 lub 20 minut (w zależno-
ści od urządzenia).
Program 134ºC – przebiegający w środowisku nasyconej pary wodnej w nadciśnieniu 2 atm.
(202,6 kPa), przy wilgotności względnej 100% oraz czasie ekspozycji 5 lub 7 minut (w zależności
od urządzenia).
Parametrami krytycznymi sterylizacji podlegającymi stałemu monitorowaniu, są: czas, tempe-
ratura oraz nasycona para wodna. Kontroli podlega również ciśnienie pary, które warunkuje uzyskanie
określonej temperatury sterylizacji. Według zaleceń Instytutu Roberta Kocha, obecnie funkcjonujące
sterylizatory parowe powinny posiadać również program dezaktywujący priony w temp. 134ºC
i w czasie 60 minut, który należy uruchamiać w przypadku ryzyka skażenia sprzętu prionami. Program
antyprionowy, aby był skuteczny, musi być poprzedzony etapem specjalnego, tzw. alkalicznego mycia
sprzętu.
Sterylizacja niskotemperaturowa parą wodną z formaldehydem
Czynnikiem sterylizującym jest mieszanina pary wodnej i formaldehydu, który inaktywuje
drobnoustroje poprzez koagulację białek oraz metylację ich kwasów nukleinowych. Temperatura ste-
rylizacji waha się w zależności od urządzenia od 40 do 75ºC, natomiast czas od 40 do 180 minut. Jest
to metoda przeznaczona do sterylizacji termolabilnego sprzętu. Parametrami krytycznymi metody są:
czas, temperatura, nasycona para wodna, stężenie formaldehydu. Cykle sterylizacyjne przebiegają
w warunkach podciśnienia i polegają na pulsacyjnym wprowadzaniu mieszaniny pary wodnej i for-
maldehydu do komory sterylizatora. Po etapie sterylizacji następuje odgazowanie i płukanie wsadu
parą wodną oraz powietrzem. Degazacja sprzętu nie jest wymagana, ponieważ czynnik sterylizujący
nie penetruje wgłąb struktury materiałów.
Sterylizacja niskotemperaturowa tlenkiem etylenu
Czynnikiem sterylizującym jest toksyczny, mutagenny, karcinogenny gaz – tlenek etylenu
(inaczej epoksyetan), który niszczy białka i kwasy nukleinowe mikroorganizmów poprzez alkilację.
Gaz ten doskonale penetruje tworzywa sztuczne (np. polietylen, polipropylen, polistyren, poliwęglan,
polisulfony, nylon, poliuretan, polibutylen, metakrylan), bez względu na ich kształt i nie zmieniając
ich struktury. Metoda jest polecana do sterylizacji długich i wąskich przewodów, delikatnego, termo-
labilnego sprzętu, np. narzędzi elektrochirurgicznych, części aparatów do oddychania/wentylacji, endo-
skopów giętkich, kamer, urządzeń światłowodowych, sprzętu posiadającego połączenia z różnych
materiałów itp. Nie sterylizuje się natomiast płynów, żeli, kremów, maści, proszków. Parametrami
krytycznymi cyklu są czas, temperatura oraz wilgotność względna i stężenie tlenku etylenu. Faza
ekspozycji na gaz jest poprzedzona odpowiednim przygotowaniem sterylizatora, tj. wytworzeniem
podciśnienia, nawilżeniem i ogrzaniem komory. Czas trwania fazy ekspozycji cyklu „ciepłego”
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

32
i „zimnego” wynosi odpowiednio 1 i 3 godziny. Po tym czasie następuje usunięcie pozostałości tlenku
etylenu z komory przewodami na zewnątrz i wyrównanie ciśnienia. Wysoka toksyczność i karcino-
genność epoksyetanu wymusza stosowanie zabezpieczeń pracowników przed ewentualną ekspozycją
na gaz. Po skończonym cyklu obowiązuje automatyczna aeracja aktywna wysterylizowanych materia-
łów, aby z wyrobów i opakowań usunąć pozostałości gazu toksycznego.
Sterylizacja niskotemperaturowa plazmą
Czynnikiem sterylizującym jest będąca czwartym stanem skupienia materia. Plazma to chmu-
ra poruszających się elektronów, jonów, obojętnych jąder atomowych wytworzonych w warunkach
głębokiej próżni z nadtlenku wodoru pod wpływem pola elektromagnetycznego. Niszczy kwasy nu-
kleinowe (DNA, RNA), enzymy oraz fosfolipidy drobnoustrojów. Temperatura sterylizacji wynosi
40–55ºC, a parametrami krytycznymi procesu są: czas, temperatura, stężenie nadtlenku wodoru. Po
zakończonym cyklu, trwającym około 30–45 minut, następuje usunięcie plazmy i wyrównanie ciśnie-
nia w komorze. Aeracja sprzętu po procesie nie jest wymagana. Plazmą sterylizuje się termolabilne
materiały, delikatne narzędzia chirurgiczne (np. mikrochirurgiczne, jednokanałowe endoskopy, prze-
wody światłowodowe, sondy, elementy optyczne, elektroniczne). Metody tej nie stosuje się do steryli-
zacji płynów, artykułów z celulozy (np. papieru, ligniny), materiałów porowatych (np. bielizny, ręcz-
ników, opatrunków), ponieważ absorbują one nadtlenek wodoru. Z tego też powodu do sporządzania
pakietów wykorzystuje się specjalne opakowania bezcelulozowe. Istnieją także ograniczenia do sto-
sowania tej techniki dotyczące narzędzi z kanałami, zwłaszcza zamkniętymi na jednym końcu.
Sterylizacja wysokotemperaturowa ciepłem suchym
Czynnikiem sterylizującym jest suche, gorące powietrze. Stosuje się temperaturę 160ºC przez
2 godz. lub 180ºC w czasie 30 min w urządzeniach z naturalnym obiegiem powietrza lub temperaturę
160ºC przez 1 godz. bądź 180ºC przez 15 min w urządzeniach z wymuszonym obiegiem powietrza.
Parametrami krytycznymi tej metody są czas i temperatura. Gorące powietrze spala mikroorganizmy.
Metoda jest stosowana do sterylizacji wyrobów szklanych, ceramicznych, metalowych, proszków,
smarów, olejów, wosków, parafiny, wazeliny, szkła laboratoryjnego itp. Nie należy jej używać do
narzędzi chirurgicznych, opatrunków, podkładów operacyjnych, bielizny operacyjnej.
Sterylizacja niskotemperaturowa ozonem
Czynnikiem sterylizującym jest ozon wytwarzany z tlenu pod wpływem wyładowań elek-
trycznych, a cały proces przebiega w temp. 25ºC i wilgotności 75–95%. Opracowano także technolo-
gię sterylizacji wykorzystującą synergistyczne działanie ozonu O
3
i par nadtlenku wodoru H
2
O
2
.
W wyniku połączenia obu związków uzyskano wysoki efekt mikrobójczy spowodowany silnym dzia-
łaniem utleniającym ozonu oraz grup hydroksylowych. Temperatura sterylizacji wynosi 40–42ºC.
W warunkach podciśnienia do komory wprowadza się najpierw nadtlenek wodoru, a następnie ozon,
dokonując od 2 do 4 powtórzeń wtrysków i ekspozycji. Metodę można stosować do sterylizacji różno-
rodnego, skomplikowanego, termolabilnego sprzętu medycznego. Techniki tej nie wdrożono jeszcze
w polskich zakładach opieki zdrowotnej.
Sterylizacja w kwasie nadoctowym
Proces sterylizacji przeprowadza się w urządzeniu – kasecie, w którym czynnikiem sterylizu-
jącym jest roztwór wodny kwasu nadoctowego, podawany z jednorazowych nabojów. W sporządzo-
nym roztworze o temperaturze 50–55ºC zanurza się sprzęt na 12 min, a następnie po ekspozycji kilka-
krotnie przepłukuje się go jałową wodą. Cykl trwa około 30 minut. Działanie mikrobójcze czynnika
sterylizującego polega na utlenianiu białek. Parametry krytyczne procesu to stężenie kwasu nadocto-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

33
wego oraz temperatura i czas. (Metodę tę stosuje się w gabinetach zabiegowych i salach operacyjnych
do szybkiej sterylizacji sprzętu termowrażliwego, głównie endoskopów giętkich. Ujemną stroną tego
procesu jest brak możliwości wykorzystywania opakowań sterylizacyjnych, a więc sprzęt należy użyć
bezpośrednio po sterylizacji, gdyż jego przechowywanie jest niedozwolone.) Z tego też powodu pro-
ces w ciekłym kwasie nadoctowym kwalifikuje się często do metod dezynfekcji wysokiego poziomu,
a nie sterylizacji.
Sterylizacja radiacyjna
Czynnikiem sterylizującym jest najczęściej promieniowanie jonizujące gamma o dużej sile
penetracji, którego źródłem są izotopy promieniotwórcze, głównie kobaltu Co-600, rzadziej zaś cezu
Cs-137. Jest nim również promieniowanie jonizujące beta powstające w akceleratorach elektronów.
Promieniowanie wytwarza się przy rozpadzie atomów i działa niszcząco na materiał genetyczny oraz
błony komórkowe mikroorganizmów. Procesy są prowadzone w temperaturze otoczenia. Parametrem
krytycznym jest całkowita dawka pochłonięta. Określa się zatem minimalną dawkę pochłoniętą wy-
wołującą efekt sterylności (zwykle 25 kGy) oraz dawkę maksymalną, którą dany produkt wytrzymuje,
zachowując swoje właściwości użytkowe. Sterylizację radiacyjną stosuje się w przemyśle do wyjała-
wiania sprzętu medycznego jednorazowego użytku.
Filtracja
Jest metodą sterylizacji polegającą na usuwaniu bakterii ze sterylizowanego powietrza lub cie-
czy bez ich zabijania. W metodzie stosowane są filtry zatrzymujące komórki większe niż oczka filtra.
Wyróżnia się: filtrację gazów, np. powietrza w komorach laminarnych, oraz filtrację termolabilnych
cieczy. Dla zachowania warunków aseptyki, w komorach laminarnych powietrze wchodzące przecho-
dzi przez filtry HEPA. Z kolei, aby uzyskać płyny wolne od bakterii, stosuje się membrany filtracyjne
o wielkości porów 0,22 µm lub mniejsze, zatrzymujące komórki bakteryjne. Płyn po przeprowadzeniu
filtracji, zachowując warunki aseptyki, należy umieścić w jałowym pojemniku ze szczelnym zamknię-
ciem.
4.3. Monitorowanie cykli sterylizacyjnych
Monitorowanie prawidłowości przebiegu cyklu sterylizacyjnego jest realizowane poprzez kon-
trolę techniczną działania sterylizatorów oraz kontrolę sterylizacji z użyciem wskaźników chemicz-
nych i biologicznych.
Kontrola techniczna działania sterylizatorów
Obejmuje ona:
kontrolę parametrów cyklu w trakcie trwania procesu, przy użyciu: wskazań manometrów, termo-
metrów, wydruków rejestratora cykli (wykresy);
testowanie szczelności komory oraz usunięcie powietrza z komory (np. test dzienny Bowie-Dicka
w sterylizatorach parowych).
Kontrola sterylizacji z użyciem wskaźników chemicznych i biologicznych
Wskaźnik chemiczny to system określający zmianę jednej lub większej liczby zmiennych
procesu sterylizacji. Opiera się na chemicznej lub fizycznej zmianie będącej wynikiem poddania go
ekspozycji w procesie. Wskaźniki chemiczne należą do różnych klas, co pozwala na monitorowanie
cyklu w różnym zakresie. Wyróżnia się następujące wskaźniki:
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

34
klasy 1. – do kontroli ekspozycji,
klasy 2 – do kontroli określonych procedur badawczych (np. test Bowie-Dicka),
klasy 3 – jednoparametrowe, reagujące na jedną zmienną procesu,
klasy 4 – wieloparametrowe, reagujące na dwie lub więcej zmiennych krytycznych,
klasy 5 – zintegrowane, reagujące na wszystkie zmienne krytyczne procesu,
klasy 6 – emulacyjne, reagujące na wszystkie zmienne procesu określonych cykli.
Wskaźnik biologiczny to nośnik zaszczepiony przetrwalnikami (inaczej: sporami, zarodnika-
mi) organizmu testowego, który odznacza się wysoką opornością na określony proces sterylizacyjny.
Tymi organizmami testowymi są zarodniki bakterii:
Geobacillus stearothermophilus ATCC 7953 – stosowany do kontroli procesów parowych,
Bacillus atrophaeus ATCC 9372 – stosowany do kontroli procesów w tlenku etylenu.
Zasadą testowania cykli sterylizacyjnych i pakietów jest umieszczanie wskaźników zarówno
chemicznych, jak i biologicznych w punktach krytycznych, tj. miejscach najtrudniejszych do penetra-
cji przez czynniki sterylizujące. Prawidłowa reakcja wskaźnika w punkcie krytycznym świadczy
o osiągnięciu żądanych parametrów sterylizacji w badanym punkcie kontrolnym i tym samym pozwa-
la na orzekanie o prawdopodobnym osiągnięciu parametrów we wszystkich innych miejscach komory
oraz sterylizowanych pakietów.
Zaleca się stosowanie wskaźników chemicznych do kontroli ekspozycji poprzez umieszczanie
wskaźników na pakiecie, wewnątrz pakietu oraz usytuowanie wskaźników chemicznych i biologicz-
nych wewnątrz symulatorów pakietów ,,trudnych”, tzn. w których występują znaczne utrudnienia dla
penetracji czynnika sterylizacyjnego. Pakiety symulatory powinny być reprezentatywne dla sterylizo-
wanego materiału, wsadu oraz kompatybilne z metodą sterylizacji i typem sterylizatora.
Sterylizację wyrobów medycznych należy rozumieć nie tylko jako proces przeprowadzany
w sterylizatorach, lecz jako wieloetapowy proces technologiczny, składający się z kolejnych kroków
redukcji drobnoustrojów na wyrobie medycznym: dezynfekcji wstępnej, czyszczenia/mycia wstępne-
go, mycia właściwego, dezynfekcji właściwej, płukania i suszenia, konserwacji, pakowania i na końcu
etapu sterylizacji. Efektem tego procesu jest finalnie wysterylizowany wyrób medyczny.
Każdy wyrób medyczny poddaje się sterylizacji w opakowaniu sterylizacyjnym, stanowiącym
tzw. system bariery sterylnej. Zasadniczymi funkcjami tej bariery są: utrzymanie sterylności zawarto-
ści pakietu do momentu użycia, umożliwienie aseptycznego podania wyrobu po otwarciu pakietu,
a także możliwości penetracji oraz ewakuacji czynnika sterylizującego do i ze środka pakietu w czasie
sterylizacji. W przypadku braku opakowania, wysterylizowany materiał przestaje być jałowy bezpo-
średnio po otworzeniu drzwi sterylizatora. Poza wymienionymi właściwościami, opakowania powinny
cechować się odpowiednią gramaturą i składem chemicznym, odpornością na uszkodzenia mecha-
niczne, gwarantować możliwość szczelnego zamknięcia (zgrzewem), zapewnić informację (np. wska-
zać kierunek otwierania pakietu), być mikrobiologicznie czyste.
Stosowane są:
Opakowania jednorazowego użytku (tzw. system miękkich barier sterylnych). Są to: papiery stery-
lizacyjne krepowane, włóknina, rękawy papierowo-foliowe, papierowo-włókninowe, torebki.
Opakowania wielorazowego użytku (tzw. system sztywnych barier sterylnych). Są to kontenery,
czyli zamykane szczelnie pojemniki wykonane z materiałów odpornych na parametry sterylizacji
i dezynfekcji. Posiadają wloty dla czynnika sterylizującego, które są zabezpieczone filtrami jedno-
razowego użytku lub zaworami. Każdy kontener posiada wskaźnik, tzw. system uwidaczniający
próbę otwierania. Zmiana jego zabarwienia świadczy o otwarciu kontenera po sterylizacji oraz
o jego nieszczelności, a więc o niesterylności wypełnienia. System bariery sterylnej może być do-
datkowo zabezpieczany opakowaniem ochronnym (pojemnik, karton, torba foliowa), zakładanym
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

35
na pakiet bezpośrednio po sterylizacji. Kombinacja bariery sterylnej i opakowania ochronnego to
tzw. system opakowaniowy.
Dla każdego wysterylizowanego pakietu określa się okres przydatności do użycia, tj. okres za-
chowania sterylności zawartości pakietu, który uwarunkowany jest rodzajem opakowania, warunkami
przechowywania i transportu. Każdy przygotowywany pakiet musi spełniać warunki pakietu sterylne-
go okolicznościowego, tzn. zawartość powinna być przeznaczona do zużycia przez jednego pacjenta,
do jednej operacji, zabiegu, badania, w jednym czasie, „na raz”. Zasada ta obowiązuje zarówno
w przypadku pakietów zawierających jedno lub kilka narzędzi/opatrunków/bielizny, jak i dużych ze-
stawów operacyjnych, zabiegowych, diagnostycznych, pielęgnacyjnych itp. Niezużyte z pakietu wy-
roby należy zawsze traktować jako skażone i przekazywać do sterylizacji. Przestrzeganie tej zasady
zabezpiecza przed szerzeniem się zakażeń.
4.4. Antyseptyka
Antyseptyka to postępowanie mające na celu hamowanie wzrostu oraz niszczenie drobnou-
strojów z użyciem środków chemicznych – antyseptyków, działających na żywe tkanki: skórę, błony
śluzowe, rany, miejsca oparzone. Do zabiegów antyseptycznych należą: higieniczne i chirurgiczne
mycie rąk, higieniczna lub chirurgiczna dezynfekcja rąk metodą wcierania, dezynfekcja skóry chorego
przed zabiegami, kąpiel chorego przed operacją, mycie głowy, płukanie jamy ustnej, zabiegi związane
z higieną intymną itp. Prawidłowo wykonywane oraz rutynowo stosowane procedury antyseptyczne
zapobiegają oraz zwalczają zakażenia i dlatego są zalecane do powszechnego stosowania, a przede
wszystkim na oddziałach, gdzie przebywają pacjenci z osłabioną odpornością immunologiczną. W za-
biegach tych wykorzystuje się antyseptyki, czyli środki aplikowane na żywe tkanki, negatywnie dzia-
łające na strukturę i metabolizm drobnoustrojów. Hamują ich wzrost lub wywierają działanie bójcze,
redukując liczbę drobnoustrojów aż do uzyskania poziomu uznanego za odpowiedni do zapobiegania
lub ograniczenia zakażenia tkanek. Antyseptyk powinien odznaczać się następującymi cechami: sze-
rokim spektrum aktywności przeciwdrobnoustrojowej, w tym aktywności wobec spor bakteryjnych
i szczepów lekoopornych, zdolnością do eradykacji biofilmów, niską cytotoksycznością, brakiem ne-
gatywnego wpływu na proces gojenia się ran, brakiem barwy, wykazywaniem zgodności z substan-
cjami zawartymi w opatrunkach, brakiem rozkładu pod wpływem obciążeń białkowych, pH, zdolno-
ścią do przedłużonego działania.
Główne grupy stosowanych antyseptyków to:
Alkohole w stężeniach 70–80% zalecane w antyseptyce skóry, z wyłączeniem błon śluzowych
i uszkodzonej skóry.
Związki chloru – zalecane tylko w antyseptyce skóry rąk.
Związki jodu (jodofory) – stosowane w antyseptyce ran, tkanek oparzonych, pola operacyjnego,
skóry.
Czwartorzędowe związki amoniowe (chlorek/bromek benzalkoniowy) – wykorzystywane w anty-
septyce skóry, błon śluzowych, pola operacyjnego.
Chlorheksydyna w stężeniu 0,5–1% – stosowana w antyseptyce ran, skóry, pola operacyjnego.
Zabiegi higienicznego i chirurgicznego mycia oraz dezynfekcji rąk należą do najczęściej wy-
konywanych procedur antyseptycznych zapobiegających szerzeniu się zakażeń. Czynności te mają na
celu usunięcie flory przejściowej ze skóry rąk, tj. kolonizującej skórę, ale nie namnażającej się, lub
redukcję flory stałej skóry rąk, tj. bytującej i namnażającej się w warstwach skóry.
Zabiegi higienicznego mycia rąk usuwają florę przejściową i częściowo stałą, z kolei chirur-
giczne mycie rąk usuwa także florę przejściową, ale w większym stopniu stałą.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

36
Lepszy efekt higieniczny, w przypadku procedury chirurgicznego mycia, osiąga się poprzez
wydłużenie jego czasu, powiększenie obszaru mytej skóry, dodatkową higienę paznokci i stosowanie
powtórzonej dezynfekcji metodą wcierania.
W przypadku rany zagrożonej ryzykiem infekcji lub zainfekowanej zaleca się stosowanie
antyseptyków oraz produktów wspomagających ich działanie terapeutyczne, tj. opatrunków z zawarto-
ścią lub bez substancji przeciwdrobnoustrojowej oraz lawaseptyków, tzn. środków do fizycznego
oczyszczania ran z zanieczyszczeń, resztek tkanek, biofilmu. Nie zaleca się natomiast włączenia anty-
biotyków miejscowo działających, ponieważ powodują szybkie narastanie lekooporności drobnoustro-
jów i nie gwarantują oczekiwanych efektów klinicznych.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

II. BAKTERIOLOGIA SZCZEGÓŁOWA
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż
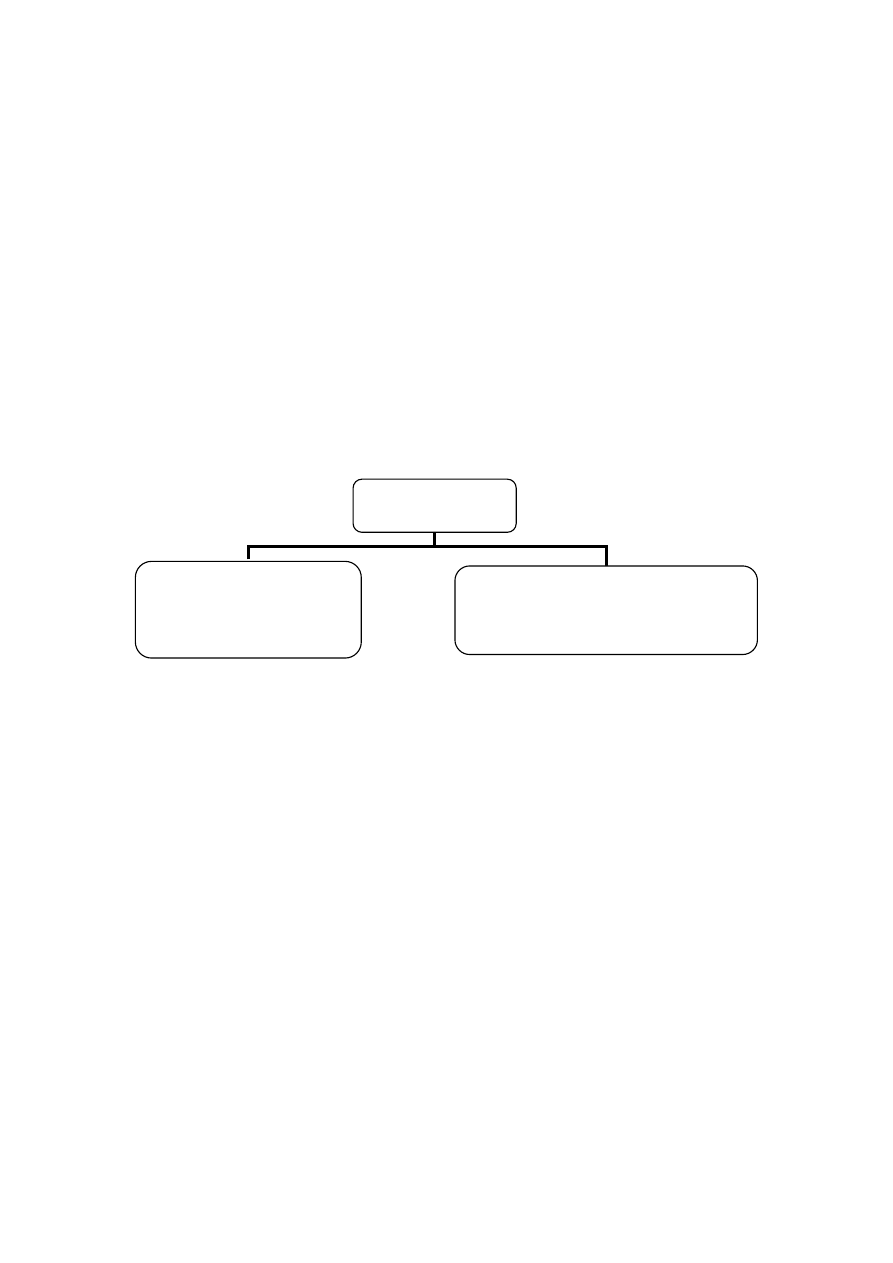
39
1. Ziarenkowce Gram-dodatnie – Staphylococcus i Streptoccocus
(Joanna Bronikowska)
Ziarenkowce Gram-dodatnie należą do grupy heterogennych bakterii o kulistym kształcie. Nie
wytwarzają przetrwalników. W celu identyfikacji spośród innych ziarniaków wykonuje się test na
obecność katalazy – enzymu, który rozkłada nadtlenek wodoru do wody i tlenu. Zasadniczo ziaren-
kowce dzielimy na katalazo-dodatnie (Staphylococcus, Micrococcus i inne) i katalazo-ujemne (Strep-
tococcus, Enterococcus i inne). Wśród ziarenkowców Gram-dodatnich na szczególne uwzględnienie
zasługują dwa rodzaje: gronkowce i paciorkowce.
1.1. Gronkowce, Staphylococcus
Ogólna charakterystyka
Nazwa gronkowce związana jest z obrazem widocznym w preparacie barwionym barwnikami
anilinowymi (metoda Grama), w którym komórki tych bakterii układają się w charakterystyczne gro-
na. Należą do tlenowców lub względnych beztlenowców, nie są zdolne do ruchu. Zalicza się je do
halofitów, co przejawia się wzrostem na podłożach zawierających wysokie stężenie soli.
Budowa ściany komórkowej gronkowców
Ściana komórkowa gronkowców zbudowana jest z peptydoglikanu, w skład którego wchodzi
N-acetyloglukozamina i kwas N-acetylomuraminowy. Jej cechę charakterystyczną w przypadku Sta-
phylococcus aureus stanowi obecność mostków pentaglicynowych. Warstwy peptydoglikanów gron-
kowców są usieciowane, co prowadzi do usztywnienia komórki bakteryjnej. Ściana komórkowa gron-
kowców zawiera również rybitolowy (S. aureus) i glicerolowy kwas tejchojowy (S. saprophyticus).
Klasyfikacja
Do gronkowców zaliczamy trzy ważne gatunki:
Staphylococcus aureus,
Staphylococcus epidermidis,
Staphylococcus saprophyticus.
ziarenkowce
Gram-dodatnie
katalazo-dodatnie
Staphylococcus – gronkowce
Micrococcus – mikrokoki
Peptococcus – ziarniaki beztlenowe
katalazo-ujemne
Streptococcus – paciorkowce
Enterococcus – enterokoki, paciorkowce kałowe
Peptostreptococcus – paciorkowce beztlenowe
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

40
Czynniki determinujące chorobotwórczość gronkowców
Białko A
Białko A jest składnikiem ściany komórkowej 90% szczepów gronkowca złocistego (S. aureus).
Wiąże się ono zarówno z peptydoglikanem, jak i błoną cytoplazmatyczną oraz przyłącza się do regio-
nu F
c
przeciwciał klasy IgG. Przeciwciała związane przez białko A mogą zapoczątkować gwałtowną
aktywację komplementu.
Koagulaza i CF
Koagulaza wolna to enzym, który ścina osocze krwi ludzkiej i króliczej w obecności aktywa-
tora. Działa na aktywator i przekształca go w związek podobny do trombiny, a ten z kolei wpływa na
fibrynogen, przekształcając go w nierozpuszczalną fibrynę.
CF (clumbing factor) to inaczej koagulaza związana, która również katalizuje reakcję prze-
kształcania fibrynogenu do fibryny, jednak bez udziału aktywatora. Zdolność do produkcji koagulazy
jest podstawą podziału gronkowców na koagulazo-dodatnie i koagulazo-ujemne. Przedstawicielem
gronkowców wytwarzających koagulazę jest S. aureus, natomiast reprezantantami gronkowców
koagulazo-ujemnych są S. epidermidis i S. saprophyticus. Oba te czynniki (koagulaza i CF) aktywują
kaskadę krzepnięcia, sprawiając, że bakteria jest niedostępna dla fagocytów.
Enzymy gronkowcowe
Oprócz wymienionej już wcześniej koagulazy, gronkowce wytwarzają liczne enzymy, np.:
hialuronidazę, która umożliwia bakteriom rozprzestrzenianie się w organizmie (inwazyjność), katali-
zując reakcję hydrolizy kwasów hialuronowych, fibrynolizynę, rozpuszczającą skrzepy fibrynowe,
oraz lipazy, hydrolizujące lipidy i pozwalające na przeżycie gronkowców w tkance tłuszczowej, i nu-
kleazy, które hydrolizują DNA.
Toksyny produkowane przez gronkowce
Cytotoksyny
Cytotoksyny są toksynami uszkadzającymi błonę komórki gospodarza. Wśród nich wyróż-
niamy:
Toksynę
– jej działanie prowadzi do uszkodzenia wielu typów komórek, w tym: erytrocytów,
leukocytów, hepatocytów, płytek krwi, a także mięśniówki gładkiej wyścielającej naczynia krwio-
nośne. Toksyna α jest odpowiedzialna za zakażenia wywołane przez gronkowca złocistego.
Toksynę β, inaczej nazywaną sfingomielinidazą C – jest białkiem produkowanym przez szczepy
gronkowca złocistego, toksycznym w stosunku do wielu typów komórek, w tym erytrocytów, fi-
broblastów, leukocytów i makrofagów.
Toksynę δ – produkowana jest nie tylko przez szczepy gronkowca złocistego, ale także przez inne
gatunki bakterii z rodzaju Staphylococcus (np. S. epidermidis, S. haemolyticus).
Toksynę γ – powoduje lizę neutrofilii i makrofagów. Wykazuje dużą aktywność hemolityczną.
Toksyny eksfoliatywne
Wśród toksyn eksfoliatywnych zidentyfikowano dwie podobne toksyny. Jedna z nich jest ko-
dowana przez gen chromosomowy, a druga przez plazmidowy. Obie rozszczepiają warstwę ziarnistą
skóry, powodując powstawanie dużych, płaskich pęcherzy, stąd nazywane są też toksynami złuszcza-
jącymi lub epidermolitycznymi.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

41
Enterotoksyny
Enterotoksyny gronkowca są odpowiedzialne za zatrucia pokarmowe. Dotychczas wyodręb-
niono enterotoksyny od A do F, przy czym najlepiej poznana jest toksyna A, odpowiedzialna za więk-
szość zatruć pokarmowych. Enterotoksyny gronkowcowe są ciepłostałe. Wytrzymują temperaturę
100ºC przez 30 min, nie tracąc przy tym swojej aktywności.
Toksyna-1 zespołu wstrząsu toksycznego (TSST-1)
Toksyna TSST-1 jest egzotoksyną odporną na działanie wysokiej temperatury i proteolizę.
Toksyna ta to superantygen, produkowany głównie przez szczepy S. aureus. TSST-1 poprzez uwol-
nienie cytokin, może prowadzić do uszkodzenia ciągłości błon komórek nabłonkowych i w konse-
kwencji doprowadzić do infekcji ogólnoustrojowej.
Choroby wywoływane przez Staphylococcus aureus
Zakażenia skórne
Występują dość często, a ich charakterystycznymi objawami są:
Intensywne ropne zapalenie, utworzenie miejscowego ropnia, a także martwica tkanek.
Liszajec – występuje głównie u dzieci, jest zakażeniem powierzchownym zlokalizowanym naj-
częściej w okolicach twarzy i kończyn. Charakteryzuje się występowaniem różnej wielkości pęche-
rzy, które zawierają przejrzysty lub żółtawy płyn i po czasie przekształcają się w strupy.
Folliculitis – czyli zapalenie mieszków włosowych. Jest ropną infekcją mieszka włosowego, które-
go podstawa jest zaczerwieniona, a na nabłonku zbiera się mała ilość ropy. Jeśli ten rodzaj infekcji
dotyka rzęsę i powiekę nosi nazwę jęczmienia.
Czyraki – duże, rozległe, bolesne grudki, które pękają samoistnie lub wymagają nacięcia.
Czyraki mnogie – występują często na szyi i karku w następstwie rozrastania się czyraków. Mogą
być źródłem bakteriemii zakażenia uogólnionego. Najczęściej wymagają opracowania chirurgicz-
nego oraz antybiotykoterapii.
Choroby wywołane toksynami gronkowcowymi
Gronkowcowe złuszczające zapalenie skóry (SSSS – staphylococcal scaled skin syndrome)
wywoływane jest przez szczepy gronkowca złocistego wytwarzającego toksyny eksfoliatywne. Głów-
nym objawem są duże płaskie pęcherze, które w konsekwencji pękają i odsłaniają skórę właściwą
pozbawioną naskórka. Choroba ta najczęściej dotyka noworodki i młodsze dzieci do 5 r.ż.
Gronkowcowe zatrucia pokarmowe wywoływane są przez gronkowca złocistego wytwarza-
jącego enterotoksyny. Najlepiej poznana z nich jest enterotoksyna A, odpowiedzialna za psucie się
żywności. Pozostałe (B-F) są podobne pod względem budowy i funkcji do enterotoksyny A, przy
czym C i D występują w zanieczyszczonych gronkowcami produktach mlecznych, a B wywołuje rze-
komobłoniaste zapalenie jelit. Gronkowcowe zatrucia pokarmowe charakteryzują się nagłymi (1–
–5 godz. po spożyciu skażonego pożywienia) wymiotami, biegunką. Zazwyczaj objawy ustępują sa-
moistnie w ciągu 24–48 godz. po nawodnieniu i uzupełnieniu elektrolitów.
TSS jest chorobą gorączkową wywoływaną przez egzotoksynę TSST-1. Charakteryzuje się
gwałtownymi wymiotami i biegunką, rumieniowatą wysypką na ciele, bólami mięśniowymi, a także
obniżeniem ciśnienia tętniczego krwi. Egzotoksyna ta może prowadzić do uszkodzenia błon komórek
nabłonkowych i ma zdolność penetracji barier śluzowych. W konsekwencji może spowodować nie-
wydolność wielonarządową, wstrząs, śmierć.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

42
Choroby wywoływane przez S. saprophyticus i S. epidermidis
S. saprophyticus jest drobnoustrojem oportunistycznym, jednak może być przyczyną zakażeń
układu moczowego u kobiet, natomiast S. epidermidis odpowiada za zakażenia oportunistyczne u osób
z obniżoną odpornością.
Epidemiologia
Gronkowce są drobnoustrojami powszechnie kolonizującymi skórę i błony śluzowe. Często
stwierdza się też obecność gronkowca złocistego na skórze, w kikucie pępkowym i w okolicach kro-
cza noworodków, a u starszych dzieci w nosogardzieli, rzadziej w części ustnej gardła. U około 30%
zdrowych dorosłych osób stwierdza się obecność S. aureus w nosogardzieli. Odsetek nosicieli tej
bakterii jest jednak wyższy u osób hospitalizowanych, personelu medycznego, a także u pacjentów
z wypryskowymi chorobami skóry. Z uwagi na łatwość transmisji tych bakterii z miejsc bytowania
(gardło i skóra), stanowią one częstą przyczynę zakażeń szpitalnych. Gronkowcowe zatrucia pokar-
mowe mogą być wywoływane przez personel przygotowujący żywność, a będący nosicielami szcze-
pów S. aureus.
Diagnostyka laboratoryjna
Gronkowce metodą Grama barwią się Gram-dodatnio, a w mikroskopie widoczne są jako sku-
piska bakterii ułożone w grona.
Hodowla
Gronkowce rosną szybko na podłożach wzbogaconych zarówno w warunkach tlenowych, jak
i beztlenowych. Próbki, które nie są zanieczyszczone inną florą, posiewamy na agar z krwią. Więk-
szość szczepów S. aureus i niektóre szczepy gronkowców koagulazo-ujemych wywołują na agarze
z krwią hemolizę typu β. Jeśli w posianej próbce materiału pochodzącego od pacjenta znajduje się
dużo innej flory towarzyszącej, zaleca się użycie podłoża wybiórczo-różnicującego (podłoże Chapma-
na), które oprócz agaru zawiera sól hamującą wzrost większości bakterii i mannitol różnicujący gron-
kowce (S. aureus fermentuje mannitol, a S. epidermidis nie). Dodany do podłoża NaCl pełni więc
funkcję wybiórczą, a mannitol różnicującą dla gronkowców.
Identyfikacja
Do identyfikacji S. aureus stosuje się testy biochemiczne. Można go odróżnić od innych gron-
kowców, wykonując test na obecność koagulazy, CF (clumbing factor), białka A. W celu wyszczegól-
nienia podgatunków, można wykonać antybiogramy, biotypowanie (oznaczanie profilu biochemiczne-
go) i analizę kwasów nukleinowych.
Leczenie
Zarówno zakażenia powierzchowne, jak i głębokie wymagają leczenia przeciwbakteryjnego.
Z uwagi na dużą oporność gronkowców na penicylinę, leczenie powinno się rozpocząć od podawania
penicylinazoopornych penicylin (oksacyliny, flukloksacyliny) lub cefalosporyn pierwszej generacji.
Lekiem z wyboru stosowanym dożylnie, najczęściej u pacjentów hospitalizowanych, jest wankomy-
cyna, choć coraz więcej szczepów gronkowców wykazuje zmniejszoną wrażliwość na ten lek (szczepy
VISA). Doustnie mogą być podawane klindamycyna i doksycyklina.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

43
1.2. Paciorkowce, Streptococcus
Ogólna charakterystyka
Paciorkowce to Gram-dodatnie ziarniaki ułożone w charakterystyczne dwoinki lub tworzące
łańcuszki. Dzieli się je na względne tlenowce i beztlenowce; niektóre z nich są kapnofilne (rosną
w atmosferze wzbogaconej w CO
2
). Stanowią florę fizjologiczną jamy ustnej, gardła, przewodu po-
karmowego. Niektóre gatunki są chorobotwórcze i powodują niebezpieczne dla życia schorzenia.
Klasyfikacja
Paciorkowce można sklasyfikować według następujących kryteriów:
Podział oparty na właściwościach serologicznych według grup Lancefield. Jego podstawą jest wę-
glowodan ściany komórkowej paciorkowców nazywany wielocukrem C.
Podział oparty na właściwościach hemolitycznych paciorkowców. Paciorkowce na agarze z krwią
powodują trzy typy hemolizy:
− Hemoliza typu α (niecałkowita) daje zielone zabarwienie hemoglobiny, stąd paciorkowce nale-
żące do tej grupy nazywane są zieleniejącymi. Zaliczamy do nich paciorkowce jamy ustnej
wchodzące w skład mikroflory człowieka, wyjątek stanowi otoczkowy chorobotwórczy gatunek
Streptococcus pneumoniae.
− Hemoliza typu β (całkowita) tworzy strefę przeźroczystą na agarze z krwią. Paciorkowce nale-
żące do tej grupy są odpowiedzialne za większość zakażeń wywołanych przez te bakterie.
− Szczepy γ hemolizujące wykazują brak hemolizy na agarze z krwią i przeważnie nie są choro-
botwórcze.
Czynniki determinujące chorobotwórczość paciorkowców
Białko M jest głównym czynnikiem zjadliwości paciorkowców β-hemolizujących, zbudowa-
nym z kwasu hialuronowego i powierzchniowego białka. Ma właściwości antyfagocytarne i antykom-
plementarne, jest silnie immunogenne. Działa cytotoksycznie na neutrofile.
Białko F wiąże fibronektynę. Jest białkiem adhezyjnym, które razem z białkiem M umożliwia
paciorkowcom grupy A przyczepianie się do komórek gardła.
Białko G wiąże immunoglobulinę IgG przez region Fc, uniemożliwiając w ten sposób opsoni-
zację, a także fagocytozę.
Otoczka hialuronowa – niektóre szczepy paciorkowców, w tym głównie z grupy A (Strepto-
coccus pyogenes), wytwarzają z kwasu hialuronowego otoczkę. Nie jest ona immunogenna, a szczepy
otoczkowe zazwyczaj odpowiadają za zakażenia ogólnoustrojowe.
Toksyny i enzymy produkowane przez paciorkowce
Toksyny erytrogenne (pirogenne egzotoksyny) są wytwarzane przez szczepy lizogenne (tzn.
bakterie utrzymujące zintegrowany fag). Są to ciepłostałe toksyny wydzielane głównie przez S. pyoge-
nes, rzadziej przez paciorkowce grupy C lub G. Wynikiem ich działania jest charakterystyczna wy-
sypka w płonicy.
Egzotoksyny. Wśród egzotoksyn paciorkowcowych wyróżniamy dwie toksyny – A i B. Egzo-
toksyna A jest superantygenem odpowiedzialnym za większość zakażeń paciorkowcami grupy A.
Egzotoksyna B to inaczej proteaza cysteinowa, odpowiadająca za niszczenie tkanek u pacjentów
z martwiczym zapaleniem powięzi.
Hemolizyny i enzymy paciorkowcowe
Streptolizyna O jest immunogenną hemolizyną wrażliwą na tlen, działającą toksycznie na
erytrocyty i leukocyty, wytwarzaną przez S. pyogenes. Stymuluje powstawanie przeciwciał, tzw. strep-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

44
tolizyn, które można wykryć w odczynie antystreptolizynowym (ASO). Oznaczenie poziomu tych
przeciwciał pozwala na określenie aktualnego lub przebytego zakażenia paciorkowcem ropotwór-
czym.
Streptolizyna S jest nieimmunogenną, niewrażliwą na tlen hemolizyną, która powoduje roz-
pad erytrocytów, leukocytów i płytek krwi. Odpowiada za strefę całkowitej hemolizy (typu β) na aga-
rze z krwią.
Enzymy paciorkowcowe. Większość enzymów jest czynnikami rozprzestrzeniania. Strepto-
kinazy A i B są enzymami powodującymi zmianę plazminogenu w plazminę, będącą z kolei enzymem
proteolitycznym, który rozkłada fibrynę i inne białka, prowadząc do rozpuszczania skrzepów krwi. Ta
cecha ułatwia rozprzestrzenianie się S. pyogenes w zakażonych tkankach. Do innych ważnych enzy-
mów wytwarzanych przez paciorkowce należą: hialuronidaza, proteinazy, nukleazy (np. streptodorna-
za). Większość z tych enzymów jest immunogenna, wytwarza przeciwciała, które są ważnym czynni-
kiem diagnostycznym, służącym do określenia, czy pacjent był i w jakim czasie zakażony paciorkow-
cami, głównie grupy A.
Choroby wywoływane przez Streptococcus pyogenes
Zakażenia pierwotne
Do tej grupy zaliczamy przede wszystkim zakażenia ropne, w których czynnikiem etiologicz-
nym są szczepy paciorkowców grupy A wytwarzające białko M.
Zapalenie gardła – angina – pojawia się od 2 do 4 dni od kontaktu z patogenem. Początek jest na-
gły, a objawami charakterystycznymi są: ból gardła, gorączka, ból głowy, złe samopoczucie. Na
migdałkach często pojawia się wysięk ropny, a okoliczne węzły chłonne mogą być powiększone.
U małych dzieci często występuje ból brzucha.
Płonica (szkarlatyna) jest szczególnym typem zapalenia gardła, ponieważ wywołują ją szczepy
S. pyogenes, które wytwarzają jedną z dwóch toksyn erytrogennych. W ciągu pierwszych dni cho-
roby, obok początkowych objawów choroby (zapalenie gardła, gorączka itp.), pojawia się drobno-
plamista wysypka, która głównie występuje w pachwinach, na brzuchu i pośladkach. Okolica wo-
kół ust zwykle pozostaje wolna od wysypki (tzw. Trójkąt Fiłatowa). Język w miarę upływu czasu
staje się malinowy. Wysypka zanika po 5–7 dniach, po czym może wystąpić złuszczanie się na-
skórka.
Ropne zapalenie skóry (liszajec) umiejscawia się na odkrytych częściach ciała. Jest ograniczonym
zakażeniem, najczęściej wywoływanym przez S. pyogenes, choć jego przyczyną mogą być też pa-
ciorkowce z grupy C i G. Rozszerzenie się zakażenia na inne części skóry obserwuje się w wyniku
zadrapania, głównie u dzieci. Do zakażenia ogólnoustrojowego dochodzi rzadko.
Róża to ostre, rozlane zakażenie skóry, charakteryzujące się miejscowym bólem i stanem zapal-
nym. Występuje rumień, często podwyższona temperatura ciała i powiększone węzły chłonne. Ró-
ża najczęściej lokalizuje się na twarzy i kończynach.
Cellulitis – zapalenie tkanki łącznej – obejmuje skórę oraz głębsze tkanki podskórne. Nie widać
dokładnie różnicy między tkanką chorą i zdrową. Konieczna jest więc dokładna identyfikacja pato-
genu, gdyż wiele drobnoustrojów może wywoływać podobne zapalenie tkanki łącznej.
Martwicze zapalenie powięzi – gangrena paciorkowcowa – rozległe zakażenie obejmujące tkanki
podskórne i powodujące martwicę powięzi. Charakteryzuje się rozległym zniszczeniem tkanki
mięśniowej i tłuszczowej. W wyniku uszkodzenia skóry S. pyogenes przedostaje się do tkanek. Po-
czątkowe zmiany są typowe dla zapalenia tkanki łącznej, następnie pojawiają się pęcherze i mar-
twica tkanki związana z utrudnionym dopływem krwi (gangrena). Najczęściej wymaga leczenia
z chirurgicznym opracowaniem miejsc chorobowych.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

45
Paciorkowce grupy A mogą być też przyczyną: gorączki połogowej, zapalenia ucha środkowego,
zapalenia zatok, zapalenia wyrostka sutkowego, bakteriemii, zapalenia płuc.
Choroby wywołane toksynami paciorkowcowymi
Paciorkowcowy zespół wstrząsu toksycznego występuje dużo rzadziej niż gronkowcowy ze-
spół wstrząsu toksycznego. Początkowymi objawami zakażenia są najczęściej zapalenie tkanki łącz-
nej, ból, gorączka, nudności, wymioty i ogólne złe samopoczucie. W miarę postępu choroby dochodzi
do niewydolności wielonarządowej i wstrząsu. Najczęściej zespół ten dotyka osób z niedoborami im-
munologicznymi, chorobami nowotworowymi, cukrzycą, chorobami serca i płuc.
Następstwa zakażeń paciorkowcami
Do nieropnych następstw zakażeń paciorkowcami zaliczamy: gorączkę reumatyczną, ostre pa-
ciorkowcowe kłębuszkowe zapalenie nerek i rumień guzowaty. Choroby te mają charakter chorób
autoimmunologicznych.
Choroby wywoływane przez Streptococcus pneumoniae
Zapalenie płuc – początek choroby jest nagły, poprzedzony objawami wirusowej infekcji dróg
oddechowych, z wysoką temperaturą ciała około 39ºC i dreszczami, często z towarzyszącym bólem
klatki piersiowej. Zapalenie na ogół rozwija się w dolnych płatach płucnych (płatowe zapalenie
płuc). Zdrowienie następuje po rozpoczęciu terapii antybiotykowej.
Zapalenie zatok i ucha środkowego – poprzedzone zazwyczaj infekcją wirusową górnych dróg
oddechowych. Na zapalenie ucha środkowego chorują zwykle małe dzieci, natomiast zapalenie za-
tok występuje w każdej grupie wiekowej.
Zapalenie opon mózgowo-rdzeniowych – do pneumokokowego zapalenia opon mózgowo-rdze-
niowych może dojść w wyniku przedostania się tej bakterii do centralnego układu nerwowego
w przebiegu bakteriemii, zapalenia ucha czy zatok. Rzadziej taka sytuacja zdarza się u noworod-
ków, częściej u dzieci i dorosłych.
Choroby wywoływane przez Streptococcus agalactiae z grupy B
Zakażenie wczesne i późne noworodków – dotyczy zakażeń nabytych w życiu płodowym lub
w czasie porodu. Objawy pojawiają się w pierwszym tygodniu życia noworodka. Najczęściej
obserwuje się obecność bakterii we krwi (bakteriemia), zapalenie płuc. Zakażenie późne noworod-
ków rozwija się między pierwszym tygodniem a trzecim miesiącem życia dziecka. Charaktery-
stycznymi objawami klinicznymi są bakteriemia i zapalenie opon mózgowo-rdzeniowych.
Zakażenie kobiet ciężarnych – poporodowe zapalenie śluzówki macicy, zakażenie rany i układu
moczowego (ZUM) to najczęstsze zakażenia, które mogą pojawić się w czasie ciąży lub wkrótce
po porodzie. Wtórne powikłania, takie jak: bakteriemia, zapalenie wsierdzia, zapalenie opon mó-
zgowo-rdzeniowych, szpiku kostnego, występują rzadko.
Diagnostyka laboratoryjna
Paciorkowce barwią się Gram-dodatnio, tworząc w obrazie mikroskopowym pary bądź łań-
cuszki. Z uwagi na fakt, że Streptococcus mogą być naturalną częścią flory fizjologicznej gardła, wy-
kazanie ich obecności w materiale pochodzącym z tego miejsca ma małe znaczenie diagnostyczne.
Hodowla
Paciorkowce hoduje się na podłożu wzbogaconym, takim jak agar z dodatkiem 5-procentowej
krwi baraniej. Wstępną identyfikację przeprowadza się więc na podstawie typu hemolizy, którą dany
szczep wywołuje.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

46
Identyfikacja paciorkowców grupy A
Wykazanie grupowo-swoistego wielocukru C – składnika ściany komórkowej.
Wykazanie wrażliwości szczepu na bacytracynę (mieszanina związków organicznych z grupy anty-
biotyków polipeptydowych. Wykazuje działanie bakteriobójcze na bakterie Gram-dodatnie).
Wykrycie obecności przeciwciał antystreptolizynowych w odczynie ASO, zwłaszcza w diagnosty-
ce gorączki reumatycznej i kłębuszkowego zapalenia nerek będących nieropnym powikłaniem za-
każenia Streptococcus pyogenes.
Identyfikacja Streptococcus pneumoniae
W preparacie zabarwionym metodą Grama z materiału pobranego od pacjenta (najczęściej plwoci-
na) widoczne są Gram-dodatnie dwoinki.
Test rozpuszczalności w żółci – pneumokoki rozpuszczają się w żółci.
Test Neufelda (test pęcznienia otoczek) – jest to test serologiczny, polegający na interakcji polisa-
charydów otoczki, którą mają pneumokoki z odpowiednimi przeciwciałami. W preparacie wyglą-
dają na spęczniałe.
Test optochinowy – wzrost pneumokoków jest hamowany przez optochinę.
Leczenie
Lekiem z wyboru jest penicylina, choć coraz częściej izoluje się szczepy na nią oporne. W ta-
kich przypadkach należy określić wrażliwość na antybiotyki. W ciężkich zakażeniach (zapalenie opon
mózgowo-rdzeniowych, bakteriemia) stosuje się cefalosporyny trzeciej generacji (np. ceftriakson),
wankomycynę lub fluorochinolony.
1.3. Paciorkowce kałowe, Enterococcus, „ziarniaki jelitowe”
Są to Gram-dodatnie ziarniaki ułożone w pary lub krótkie łańcuszki. Powszechnie izoluje się
je z kału ludzi i zwierząt, z jelita grubego oraz układu moczowo-płciowego. Dawniej były klasyfiko-
wane do grupy D paciorkowców, ze względu na obecność antygenu grupowego D w ścianie komór-
kowej. Obecnie nowy rodzaj – Enterococcus – obejmuje około 38 gatunków Enterococcus faecalis
i Enterococcus faecium. Są to gatunki najczęściej izolowane i ważne klinicznie.
Czynniki determinujące chorobotwórczość enterokoków
Adhezyjne białka powierzchniowe umożliwiające wiązanie się do nabłonka wyścielającego jelito
i pochwę.
Hemolityczne białka (cytolizyna).
Proteolityczne białka (żelatynaza, proteaza serynowa).
Choroby wywoływane przez Enterococcus spp.
Odpowiadają za zakażenia szpitalne u pacjentów hospitalizowanych, dotyczą głównie układu
moczowego, otrzewnej i serca. Infekcje te obserwuje się przede wszystkim u pacjentów z cewnikami
urologicznymi, naczyniowymi, a także otrzymujących antybiotyki o szerokim spektrum działania.
Diagnostyka laboratoryjna
Badanie mikroskopowe – w preparacie widoczne są jako Gram-dodatnie ziarniaki ułożone w pary
lub krótkie łańcuszki.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

47
Hodowla – enterokoki dobrze rosną zarówno w warunkach tlenowych, jak i beztlenowych w szero-
kim zakresie temperatur (10–45ºC), na podłożach wzbogaconych w krew baranią (agar krwawy
i agar czekoladowy). W hodowli tworzą duże kolonie ze strefą γ-hemolizy. Rosną w obecności żół-
ci i soli żółciowych.
Identyfikacja – enterokoki nie rozpuszczają się w żółci i wykazują oporność na optochinę. W róż-
nicowaniu gatunkowym (E. faecalis i E. faaecium) niezbędne są testy biochemiczne, sekwencjo-
nowanie kwasów nukleinowych, a także określenie cech fenotypowych.
Leczenie
Najczęściej stosuje się terapię skojarzoną, polegającą na podaniu aminoglikozydów i antybio-
tyków hamujących syntezę ściany komórkowej (ampicylina, wankomycyna). Jednak około 25%
szczepów enterokoków jest opornych na te antybiotyki. Czasami więc stosuje się fluorochinolony.
Najważniejszym jednak celem jest zapobieganie i kontrolowanie zakażeń szpitalnych wywołanych
przez Enterococcus spp.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

48
2. Ziarenkowce Gram-ujemne Neisseria
(Joanna Bronikowska)
Ziarenkowce Gram-ujemne najczęściej układają się w charakterystyczne dwoinki. Posiadają
często otoczkę i są urzęsione. Należą do bakterii tlenowych i mają duże wymagania odżywcze. Do
najważniejszego rodzaju bakterii Neisseria należą: Neisseria gonorrhoeae i Neisseria meningitidis.
Ogólna charakterystyka
Ziarenkowce Gram-ujemne mają nerkowaty kształt i układają się w dwoinki. Nie wykazują
zdolności do ruchu i nie wytwarzają przetrwalników. Posiadają otoczkę, są urzęsione, tlenowe, oksy-
dazododatnie. Mają duże wymagania odżywcze, wzrastają na podłożach wzbogaconych i specjalnych
z dodatkiem CO
2
.
Klasyfikacja
Rodzaj Neisseria obejmuje 10 gatunków, z których dwa są chorobotwórcze dla ludzi: Neisse-
ria gonorrhoeae (gonokok) i Neisseria meningitidis (meningokok).
2.1. Neisseria gonorrhoeae
Czynniki determinujące chorobotwórczość
Fimbrie – odpowiadają za przyłączanie się bakterii do nabłonka, zaburzają też proces niszczenia
przez neutrofile.
Zewnętrzne białka błonowe I i II. Białko I odpowiedzialne jest za inwazyjność i roprzestrzenianie
się zakażenia. II białko to zestaw białek zwanych też białkami OPA. Odpowiadają za przyleganie
bakterii do komórek błon śluzowych. Mają też właściwości fagocytarne.
Białka porynowe – tworzą pory, kanały, przez które substancje odżywcze wnikają do wnętrza ko-
mórki.
Otoczka – pozwala na przeżycie wewnątrzkomórkowe gonokoków.
Lipooligosacharyd o aktywności endotoksyny – bierze udział w rozprzestrzenianiu się zakażenia.
Enzymy – proteaza IgA, która chroni N. gonorrhoeae przed przeciwciałami IgA, znajdującymi się
na powierzchni błon śluzowych, i beta-laktamaza, która degraduje penicylinę.
Choroby wywoływane przez Neisseria gonorrhoeae
Rzeżączka – u mężczyzn głównie objawia się jako zapalenie cewki moczowej. Po 2–5 dniach in-
kubacji pojawia się ropna wydzielina z cewki i skąpomocz. Powikłania są rzadkie, jednak niele-
czona rzeżączka może doprowadzić do zapalenia najądrzy, gruczołu krokowego i ropnia około-
cewkowego. U kobiet najczęstszym objawem jest zapalenie szyjki macicy, zwykle z towarzyszą-
cym bólem podbrzusza, wydzieliną z pochwy i skąpomoczem. Do powikłań zakażeń N. gonorr-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

49
hoeae u kobiet należą: stan zapalny miednicy, rzeżączka odbytniczo-odbytowa i rozsiane zakażenie
gonokokowe.
Noworodkowe zapalenie gałki ocznej – do zakażenia dochodzi podczas porodu przy przechodzeniu
przez kanał rodny i objawia się jako zapalenie spojówek noworodków. Profilaktycznie noworod-
kom wkrapia się do worka spojówkowego 1-procentowy roztwór azotanu srebra – zabieg Crédego.
Zespół Fitza, Hugha i Curtisa – zapalenie torebki wątroby. Manifestuje się bólem w prawym pod-
żebrzu. Zwykle występuje u młodych, aktywnych seksualnie kobiet.
Zakażenia rozsiane – występują stosunkowo rzadko (około 1–3% zakażonych kobiet, jeszcze rza-
dziej u mężczyzn) jako konsekwencja zakażenia N. gonorrhoeae. Dochodzi do krwiopochodnego
szerzenia się infekcji. Zwykle klinicznymi objawami infekcji są gorączka, bóle stawowe, ropne
zmiany skórne, a rzadziej: zapalenie wsierdzia, opon mózgowo-rdzeniowych i szpiku.
Diagnostyka laboratoryjna
Badanie mikroskopowe – w preparacie bezpośrednim, który wykonuje się z wydzieliny cewki mo-
czowej lub szyjki macicy, obserwuje się wewnątrzkomórkowe Gram-ujemne dwoinki. Wynik ba-
dania mikroskopowego i charakterystyczne objawy przeważnie są potwierdzeniem zakażenia go-
nokokowego.
Hodowla i izolacja – gonokoki rosną na podłożach wzbogaconych i specjalnych, ze względu na
duże wymagania odżywcze. Wykonuje się posiew wydzieliny z cewki moczowej, szyjki macicy,
czasami z odbytu na następujące podłoża hodowlane: agar czekoladowy, gdy spodziewamy się, że
N. gonorrhoeae jest dominującym gatunkiem w materiale, i podłoże Thayera-Martina, gdy próbka
najprawdopodobniej została zanieczyszczona florą fizjologiczną.
Leczenie
W przypadku miejscowych zakażeń najczęściej stosuje się leki, które są skuteczne w zwalcza-
niu bakterii szerzących się drogą płciową, takie jak ceftriakson, który jest oporny na β-laktamazę,
cefiksym, fluorochinolony lub amnioglikozydy (podaje się je pacjentom uczulonym na aminoglikozy-
dy). Podczas rozsianego zakażenia pacjenci powinni być hospitalizowani.
2.2. Neisseria meningitidis
Czynniki determinujące chorobotwórczość
Fimbrie jako czynniki przylegania.
Polisacharydowa otoczka mająca własności antyfagocytarne.
Lipopolisacharyd, czyli endotoksyna.
Proteazy IgA.
Choroby wywoływane przez Neisseria meningitidis
Zapalenie opon mózgowo-rdzeniowych – stwierdza się ból głowy, objawy oponowe i wysoką go-
rączkę. Czasami pojawiają się wymioty, objawy neurologiczne, bóle mięśniowe, stawowe, a nawet
śpiączka. Śmiertelność u osób nieleczonych jest bardzo wysoka.
Ostra posocznica meningokokowa – początkowo występuje różowata wysypka, która może przy-
brać charakter krwotoczny, następnie stwierdza się zakrzepicę małych naczyń krwionośnych, mar-
twicę. Może wystąpić wykrzepianie wewnątrznaczyniowe (DIC) ze wstrząsem, a także szczególna
postać posocznicy meningokokowej, tzw. zespół Waterhouse’a-Friderichsena, który charakteryzuje
się zapaleniem mięśnia sercowego i zapaleniem nadnerczy.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

50
Łagodna posocznica meningokokowa – objawami są niewysoka gorączka, zapalenie stawów,
zmiany na skórze.
Diagnostyka laboratoryjna
Badanie mikroskopowe – dwoinki zapalenia opon mózgowo-rdzeniowych można wykryć w płynie
mózgowo-rdzeniowym. Trzeba to jednak uczynić przed zastosowaną antybiotykoterapią.
Hodowla i izolacja – należy wykonać posiew płynu mózgowo-rdzeniowego na podłoża wzbogaco-
ne, tj. agar krwawy lub czekoladowy, a także równolegle posiew krwi, gdyż N. meningitidis, jako
główny czynnik etiologiczny zapalenia opon mózgowo-rdzeniowych, często dostaje się do krwi
Zaleca się wykonanie antybiogramu w celu ustalenia sposobu leczenia.
Leczenie
N. meningitidis jest wrażliwa na działanie penicyliny, którą należy podać dożylnie. Można też
stosować cefalosporyny III generacji, które przedostają się do płynu mózgowo-rdzeniowego.
Profilaktyka
Profilaktycznie można podać szczepionkę otrzymywaną z otoczek polisacharydowych seroty-
pów A i C.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

51
3. Laseczki Gram-dodatnie: Corynebacterium, Listeria,
Clostridium
, Bacillus
(Dagmara Jaworska)
Bakterie Gram-dodatnie o cylindrycznym kształcie są zaliczane do kilku różnych rodzajów.
Wśród nich możemy wyróżnić bakterie niewytwarzające przetrwalników określane jako pałeczki oraz
bakterie tworzące przetrwalniki, czyli laseczki. Do laseczek Gram-dodatnich należą rodzaje: Bacillus
i Clostridium. Regularne pałeczki Gram-dodatnie klasyfikowane są do Listeria, Erysipelothrix i in-
nych, natomiast nieregularne pałeczki zwane maczugowcami stanowią rodzaj Corynebacterium.
3.1. Bacillus
Do rodzaju Bacillus należy około 200 gatunków bakterii, spośród których jedynie kilka jest
chorobotwórczych dla człowieka. Najważniejszy to Bacillus anthracis wywołujący wąglika, ale też
Bacillus cereus odpowiedzialny za zatrucia pokarmowe oraz inne zakażenia u osób z obniżoną odpor-
nością.
Bacillus anthracis
– laseczka wąglika
Bacillus anthracis należy do dużych, nieruchliwych Gram-dodatnich laseczek. Przetrwalniki
wytwarzane są, gdy bakteria znajdzie się poza żywym organizmem, np. w glebie. Wąglik jest głównie
chorobą zwierząt roślinożernych, natomiast człowiek może zarazić się poprzez kontakt ze zwierzę-
ciem lub produktami pochodzenia zwierzęcego (wąglik jest zoonozą – chorobą odzwierzęcą). Natural-
ne zakażenia wąglikiem zdarzają się bardzo rzadko. Bakteria ta była również wykorzystywana w ata-
kach bioterrorystycznych i jest postrzegana jako jeden z najważniejszych czynników zakaźnych
w wojnie biologicznej.
Czynniki zjadliwości
W zakażonej tkance bakteria wytwarza otoczkę peptydową zbudowaną z kwasu D-glutamino-
wego, która chroni ją przed fagocytozą. B. anthracis wytwarza również trójskładnikową egzotoksynę,
na którą składają się trzy białka: antygen ochronny (PA), czynnik obrzęku (EF) i czynnik letalny (LF).
Białka te tylko w kompleksie wykazują swoją toksyczność.
Patogeneza i objawy kliniczne
Do zakażenia ludzi wąglikiem dochodzi poprzez uszkodzenia skóry, wdychanie przetrwalni-
ków albo spożycie zakażonej żywności. W zależności od drogi zakażenia wyróżnia się następujące
postaci wąglika:
Wąglik skórny jest najczęstszą postacią wąglika. W miejscu wniknięcia przetrwalników poprzez
uszkodzoną skórę pojawia się mała niebolesna grudka, która przekształca się w pęcherzyk, a na-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

52
stępnie w czarny, martwiczy strup. U nieleczonych pacjentów może pojawić się duży obrzęk
i objawy systemowe.
Wąglik płucny (wziewny, choroba sortowaczy wełny) – rozwija się na skutek wdychania prze-
trwalników z zakażonych produktów zwierzęcych. Pierwsze pojawiają się nieswoiste objawy: go-
rączka, bóle mięśni, kaszel i złe samopoczucie, które szybko się nasilają, doprowadzając do krwo-
tocznego obrzęku płuc, znacznego powiększenia śródpiersiowych węzłów chłonnych, rozwinięcia
się niewydolności oddechowej i posocznicy. W ciągu 3 dni od pojawienia się pierwszych objawów
dochodzi do wstrząsu i śmierci.
Wąglik przewodu pokarmowego – rozwija się w wyniku spożycia zakażonej żywności. Do obja-
wów należą: nudności i wymioty oraz biegunka, które jednak szybko przechodzą w zakażenie
układowe, po czym następuje śmierć w wyniku wstrząsu.
Diagnostyka
Zakażenie wąglikiem charakteryzuje obecność dużej liczby drobnoustrojów we krwi, ranach
i węzłach chłonnych, dlatego łatwo wyizolować i zidentyfikować bakterie, zarówno metodą badania
mikroskopowego (barwienie Grama), jak i na podstawie hodowli.
Bakterie w preparatach uzyskanych z tkanek czy krwi występują najczęściej pojedynczo, na-
tomiast po przeniesieniu na podłoże obserwuje się wzrost w postaci długich łańcuszków komórek
przypominających sznury pereł. Na agarze z krwią bakterie rosną w postaci niehemolizujących kolo-
nii, o morfologii w kształcie głowy Meduzy (suche kolonie z nieregularnymi krawędziami i licznymi
wypustkami). W rozpoznawaniu wąglika u ludzi serodiagnostyka nie ma większego znaczenia, nato-
miast w martwych tkankach zwierząt można wykrywać antygeny laseczki wąglika za pomocą odczynu
termoprecypitacji Ascoliego.
Leczenie i zapobieganie
Wąglik jest wrażliwy na penicylinę, a także na doksycyklinę i ciprofloksacynę. Rokowanie
w przypadku zakażenia zależy od postaci tej choroby. W przypadku zmian skórnych kuracja antybio-
tykowa daje prawie całkowitą gwarancję wyleczenia. Postać płucna poddaje się leczeniu tylko
w przypadku bardzo wczesnego zastosowania kuracji antybiotykowej. Po wystąpieniu objawów ostrej
fazy, pomimo zastosowania leczenia, występuje blisko 100-procentowa śmiertelność.
Zapobieganie zakażeniu ludzi polega na kontrolowaniu zakażeń u zwierząt. Na terenach wy-
stępowania tej bakterii prowadzi się zapobiegawcze szczepienia wśród bydła szczepionką atenuowaną.
Szczepionka z zabitych bakterii jest zalecana u osób narażonych na kontakt z wąglikiem, ze względu
na wykonywaną pracę.
Bacillus cereus
– laseczka woskowa
Bakteria ta jest szeroko rozpowszechniona w przyrodzie, skąd może przedostać się do żywno-
ści i wywoływać zatrucie pokarmowe. Wyróżnia się dwie postaci zatruć:
Postać biegunkowa – jest spowodowana spożyciem wraz z pożywieniem żywych komórek B. ce-
reus, które namnażają się w układzie pokarmowym pacjenta i produkują enterotoksynę ciepło-
chwiejną, co skutkuje pojawieniem się wodnistej biegunki i bólu brzucha po średnio 24-godzinnej
inkubacji. Źródłem tego rodzaju zakażeń jest mięso i warzywa, w których znajdują się żywe ko-
mórki laseczki woskowej.
Postać wymiotna – pojawia się w wyniku spożycia potraw zanieczyszczonych przetrwalnikami
B. cereus, w większości przypadków wielokrotnie odgrzewanego ryżu. Wysoka temperatura nie
zabija przetrwalników, które następnie w temperaturze pokojowej kiełkują do form wegetatywnych
i produkują ciepłostałą enterotoksynę, nie podlegającą zniszczeniu przy kolejnym podgrzaniu. Spo-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

53
życie ryżu wraz z toksynami wywołuje po kilku godzinach (1–6 godz.) objawy zatrucia: nudności,
wymioty, ostre bóle brzucha.
Zatrucia pokarmowe wywołane przez B. cereus nie wymagają specjalnego leczenia poza
objawowym i ustępują samoistnie po kilku dniach.
3.2. Clostridium
Do rodzaju Clostridium należą beztlenowe laseczki wytwarzające przetrwalniki, dla których
naturalnym środowiskiem jest gleba oraz układ pokarmowy ludzi i zwierząt. Rodzaj ten liczy ponad
60 gatunków, jednak chorobotwórcze dla człowieka są przede wszystkim cztery z nich: C. perfrin-
gens, C. difficile, C. botulinum i C. tetani.
Clostridium perfringens
– laseczka zgorzeli gazowej
Czynniki zjadliwości
C. perfringens wytwarza 14 toksyn, oznaczonych kolejnymi literami alfabetu greckiego. Naj-
ważniejsze z nich to: α (alfa), β (beta), ε (epsilon) i ι (jota). Główną rolę w patologii zakażeń odgrywa
toksyna α, która jest lecytynazą. Wywołuje lizę komórek krwi i śródbłonka naczyń. Ze względu na
produkowane toksyny, gatunek C. perfringens podzielono na 5 typów (A-E). Najbardziej niebezpiecz-
ny dla człowieka jest typ A, który wytwarza największą ilość toksyny α. Laseczka zgorzeli gazowej
produkuje ponadto liczne enzymy stanowiące przyczynę znacznej inwazyjności tej bakterii. Należą do
nich kolagenaza, hemolizyny, hialuronidaza i proteinazy. C. perfringens odpowiedzialny za zatrucia
pokarmowe wytwarza podczas sporulacji enterotoksynę, która uszkadza nabłonek jelita.
Patogeneza i objawy kliniczne
Zakażenia wywoływane przez C. perfringens mogą mieć źródło endogenne (skutek operacji
lub urazu w obrębie jamy brzusznej, w wyniku których dochodzi do skażenia rany bakteriami flory
przewodu pokarmowego) lub egzogenne (np. skażenie glebą, ściekami).
Do zakażeń wywoływanych przez laseczkę zgorzeli gazowej należą:
Zatrucia pokarmowe.
Zakażenia skóry, tkanki podskórnej i tkanek miękkich.
Zatrucia pokarmowe Clostridium perfringens typu A. Dochodzi do nich w wyniku spożycia zaka-
żonych zarodnikami potraw (np. zup, sosów, konserw mięsnych i warzywnych). Czynnikiem de-
terminującym chorobotwórczość jest enterotoksyna produkowana w czasie sporulacji komórek
w jelitach cienkim i grubym. Objawy występują zwykle po około 18 godzinach od spożycia zatru-
tego pokarmu. Należą do nich biegunka i gwałtowne bóle brzucha, które jednak zwykle samoistnie
ustępują.
Inne zakażenia, do których zaliczamy: zapalenie tkanki łącznej, zapalenie powięzi, ropiejące zapa-
lenie mięśni.
Zgorzel gazowa – najgroźniejsze zakażenie wywoływane przez C. perfringens. Może wystąpić
w głębokich skażonych ranach (np. rany powypadkowe). Jest to martwica mięśni lub tkanki łącznej
z wytworzeniem gazu. Przy uciskaniu zakażonej rany słychać trzeszczenie banieczek gazu (stąd
nazwa zgorzel gazowa). Zwiastunem jest bardzo silny ból w okolicach rany. Zakażenie postępuje
niezwykle szybko, prowadząc do rozległej martwicy, wstrząsu i w konsekwencji do śmierci chore-
go.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

54
Sepsa – przebieg jest zwykle bardzo ciężki, występuje wysoka gorączka, martwica nerek i nasilona
hemoliza wewnątrznaczyniowa. Posocznica wywołana laseczką zgorzeli gazowej może być np.
wynikiem poronienia.
Diagnostyka laboratoryjna
Diagnostyka mikrobiologiczna zakażeń tkanek miękkich jest jedynie potwierdzeniem rozpo-
znania klinicznego, gdyż wymagają one natychmiastowego leczenia. W przypadkach zatrucia pokar-
mowego wykrycie bakterii w kale nie ma znaczenia diagnostycznego, ponieważ są one składnikiem
mikroflory przewodu pokarmowego.
Leczenie
Zakażenia tkanek miękkich wymagają natychmiastowego leczenia, które polega na opracowa-
niu chirurgicznym rany, wysokich dawek antybiotyków (z grupy penicylin) oraz terapii tlenem hiper-
barycznym, który hamuje wzrost tych bezwzględnie beztlenowych bakterii.
Clostridium difficile
Bakterie z tego gatunku są jedną z najczęstszych przyczyn rzekomobłoniastego zapalenia jelit.
U osób zdrowych i hospitalizowanych są w niewielkim odsetku obecne w normalnej florze przewodu
pokarmowego. Ich nadmierna proliferacja, która jest przyczyną objawów, to skutek eradykacji nor-
malnej flory fizjologicznej w wyniku antybiotykoterapii. Czynnikami zjadliwości C. difficile są wy-
dzielane cytotoksyny A i B.
Do objawów infekcji należą różne postaci biegunki, krew w stolcu, gorączka, bóle brzucha,
nudności i złe samopoczucie. W ciężkich przypadkach może rozwinąć się rzekomobłoniaste zapalenie
jelit, które jest powikłaniem zagrażającym życiu. Łagodnie przebiegające zakażenia zwykle ustępują
same po odstawieniu antybiotyków. W ciężkich przypadkach konieczna jest terapia metronidazolem
lub antybiotykami z grupy glikopeptydów (wankomycyna, teikoplanina), ponieważ laseczki C. dif
fici-
le są oporne na większość stosowanych antybiotyków. Po zakończeniu leczenia często zdarzają się
nawroty, gdyż antybiotyki nie niszczą przetrwalników, natomiast poza tym powszechna obecność
drobnoustroju w środowisku szpitalnym utrudnia profilaktykę tych zakażeń.
Clostridium tetani
– laseczka tężca
Bakterie te należą do bezwzględnie beztlenowych laseczek, które są bardzo szeroko rozpo-
wszechnione w przyrodzie (w glebie, ściekach, odchodach zwierząt). Tworzą przetrwalniki umiesz-
czone na końcu komórki, dlatego w obrazie mikroskopowym przypominają przez to „pałeczki dobo-
sza”. Zakażenie tężcem może nastąpić w wyniku urazów penetrujących, zanieczyszczenia rany mate-
riałem, który zawierał przetrwalniki C. tetani.
Czynniki zjadliwości i patogeneza
C. tetani należy do bakterii nieinwazyjnych, dlatego zakażenie ogranicza się do miejsca wnik-
nięcia drobnoustroju. Środowisko beztlenowe rany (rany głębokie, z towarzyszącymi zakażeniami
ropnymi) sprzyja kiełkowaniu przetrwalników. W miejscu wniknięcia bakteria wytwarza toksynę
zwaną tetanospasminą, która jest bardzo silną neurotoksyną i odpowiada za rozwój klinicznych obja-
wów tężca. Działanie tetanospasminy polega na inaktywacji inhibitorów neuroprzekaźnikowych
w neuronach hamujących, co prowadzi do nadmiernej aktywacji neuronów ruchowych, regulujących
skurcz mięśni. Skutkuje to porażeniem spastycznym i napadami skurczów mięśni szkieletowych.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż
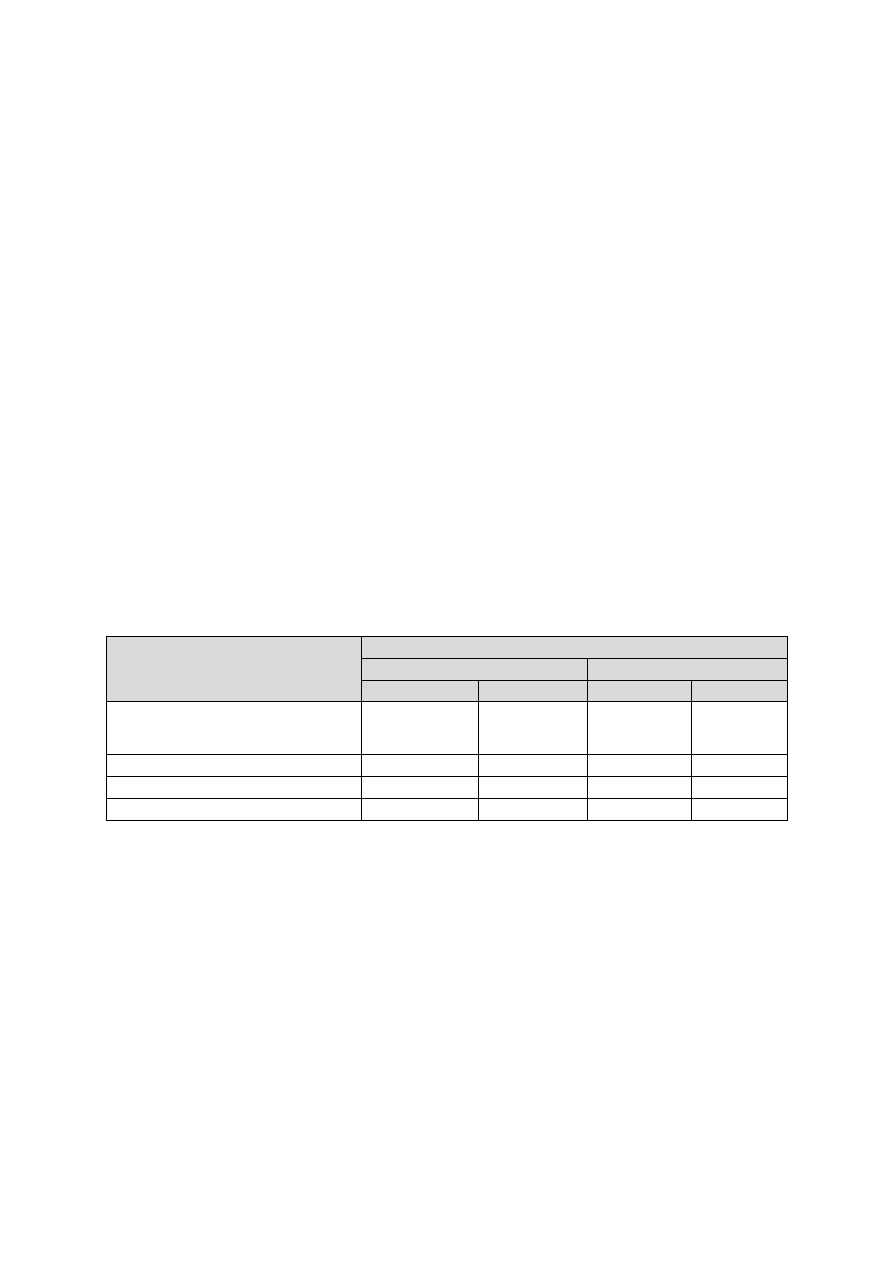
55
Objawy kliniczne zakażenia
Okres inkubacji tężca i nasilenie objawów zależą od lokalizacji rany, tzn. im bliżej do central-
nego układu nerwowego, tym objawy są poważniejsze. Wyróżniamy następujące rodzaje tężca:
Tężec miejscowy – najłagodniejsza forma, która charakteryzuje się przedłużającym się skurczem
w okolicach rany.
Tężec głowy – postać tężca miejscowego, w przypadku którego rana zlokalizowana jest w obrębie
głowy, postać związana ze złym rokowaniem.
Tężec uogólniony – najczęstsza postać zakażenia. U pacjentów obserwuje się skurcz silnych mięś-
ni, co prowadzi do rozwoju charakterystycznych objawów: szczękościsku (skurcz mięśni żuchwy),
uśmiechu sardonicznego (skurcz mięśni twarzy) i łukowatego wyprężenia ciała – opistotonusu
(skurcz mięśni karku i tułowia). Do innych objawów należą: tachykardia, zaburzenia rytmu serca,
zmiany ciśnienia krwi, nadmierne pocenie i znaczne odwodnienie.
Diagnostyka
Podstawą diagnostyki są objawy kliniczne zakażenia. Badania mikroskopowe i hodowle są
często ujemne, gdyż zakażenie może wywołać już bardzo niewielka ilość bakterii.
Profilaktyka i leczenie
Postępowanie w przypadku podejrzenia zakażenia laseczką tężca obejmuje: chirurgiczne
opracowanie rany, terapię antybiotykową oraz immunoterapię czynno-bierną (szczepienie anatoksyną
tężcową oraz bierne uodpornienie poprzez podanie immunoglobuliny przeciwtężcowej). Profilaktykę
poekspozycyjną tężca przedstawiono w tabeli I.
Tabela I. Profilaktyka poekspozycyjna tężca
Historia szczepienia
Ryzyko zakażenia
Małe
1
Duże
2
Szczepienie
Surowica
Szczepienie
Surowica
Brak szczepienia,
szczepienie niekompletne, historia
szczepienia niepewna
(+)
*
(–)
(+)
*
(+)
Od szczepienia upłynęło ponad 10 lat
(+)
(–)
(+)
(+)
Od szczepienia upłynęło 5–10 lat
(+)
(–)
(+)
(–)
Od szczepienia upłynęło mniej niż 5 lat
(–)
(–)
(–)
(–)
1
Rany świeże, mało zanieczyszczone, bez martwicy.
2
Rany późno opracowane chirurgicznie, mocno zanieczyszczone, rany kłute, postrzałowe, gryzione, odmrożenia.
*
Kontynuacja szczepienia według schematu podstawowego 0–1–6 miesięcy.
Antytoksynę (surowicę) stosuje się domięśniowo w ilości 250–500 j.m. Warunkiem działania
przeciwciał jest odpowiednio szybkie ich podanie, zanim toksyna tężcowa zwiąże się z tkanką nerwo-
wą. Szczepionkę przeciwtężcową stanowi toksoid, zwany inaczej anatoksyną (odzjadliwiona toksyna,
która zachowała własności immunogenne). U dzieci stosowana jest w formie szczepionki Di-Per-Te,
w skład której wchodzą anatoksyna błonicza, anatoksyna tężcowa i zabite bakterie krztuśca. Pierwsza
dawka szczepionki podawana jest w 2 miesiącu życia, kolejna po upływie 6 tygodni, następna po ko-
lejnych 6 tygodniach od ostatniego szczepienia, a czwarta dawka w 16–18 miesiącu życia. Później
podaje się jeszcze 3 dawki przypominające szczepionką Td (w 6, 14 i 19 roku życia). U dorosłych
powinno się podawać dawki przypominające co 10 lat szczepionką Td, czyli tylko anatoksyną tężco-
wą i błoniczą.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

56
Clostridium botulinum
– laseczka jadu kiełbasianego
Laseczka jadu kiełbasianego jest dużą, Gram-dodatnią laseczką odpowiedzialną za botulizm.
Bakterie te powszechnie występują w glebie, wodzie, osadach dennych i przewodzie pokarmowym
zwierząt, skąd mogą dostawać się do żywności. Przyczyną zatrucia jest produkowana przez C. botuli-
num neurotoksyna zwana botuliną.
Czynniki zjadliwości i patogeneza
Toksyna jadu kiełbasianego jest jedną z najsilniejszych trucizn znanych ludzkości. Spożycie
już 0,1 g żywności, w której rozwinęły się laseczki C. botulinum może wywołać botulizm. Opisano
osiem toksyn botulinowych (A, B, C
1
, C
2
, D, E, F i G), ale jeden szczep bakterii produkuje zwykle
tylko jeden rodzaj toksyny. Zatrucia u ludzi wywołują toksyny A, B, E i F.
Toksyna botulinowa jest ciepłochwiejna, jednakże do jej inaktywacji konieczne jest gotowanie
przez około 20 minut. Stanowi typową neurotoksynę. Działa w synapsie nerwowo-mięśniowej, hamu-
je uwalnianie acetylocholiny, będącej przekaźnikiem pobudzającym skurcz mięśnia. Efektem działa-
nia toksyny botulinowej jest porażenie wiotkie.
Objawy kliniczne
U osób zatrutych toksyną botulinową po okresie inkubacji trwającym 1–3 dni pojawiają się
pierwsze objawy – zawroty głowy i osłabienie, a następnie zaburzenia widzenia (podwójne widzenie),
suchość w ustach oraz zaparcia i bóle brzucha. Zstępujące porażenie wiotkie powoduje obustronne
osłabienie napięcia mięśni, a ostatecznie porażenie oddychania i śmierć.
Wyróżniamy następujące postacie botulizmu:
Botulizm pokarmowy – występuje najczęściej w wyniku spożycia żywności utrwalanej w warun-
kach domowych, sposobem pojedynczej pasteryzacji, która nie niszczy wysoce odpornych prze-
trwalników C. botulinum i stwarza możliwość produkcji botuliny. Źródłem zatrucia mogą być kon-
serwy mięsne i rybne, wędzone i peklowane mięso, konserwy warzywne.
Botulizm niemowląt – najczęściej występująca postać botulizmu. Dotyczy zwykle dzieci w wieku
1–6 miesięcy. Przyczyną jest podawanie niemowlęciu produktów zanieczyszczonych sporami la-
seczki jadu kiełbasianego (najczęściej miodu lub mleka w proszku) albo spożycia przez nie gleby
czy kurzu zawierającego przetrwalniki. Laseczka jadu kiełbasianego (z powodu słabo zróżnicowa-
nej mikroflory w przewodzie pokarmowym dziecka) namnaża się w jelitach i produkuje toksynę,
będącą przyczyną objawów (zespół „zwiotczałego dziecka”).
Botulizm przyranny – wywołuje go toksyna uwalniana z rany zanieczyszczonej C. botulinum. Są to
zakażenia bardzo rzadkie.
Diagnostyka
Rozpoznanie kliniczne można potwierdzić poprzez wykrycie toksyny botulinowej w pokar-
mie, który wywołał zatrucie, albo w próbkach kału czy treści żołądka chorych osób. W przypadkach
botulizmu niemowląt można wyizolować bakterie z próbek kału.
Leczenie i zapobieganie
Najważniejszym postępowaniem w przypadku zatrucia botuliną jest sztuczne podtrzymywanie
oddychania. Stosuje się trójwalentną antytoksynę A, B, E, ale warunkiem jej skuteczności jest szyb-
kość podania. Włączenie antybiotyków (penicylina, metronidazol) ma uzasadnienie w przypadkach,
gdy choroba jest spowodowana przez rozwijającą się w organizmie bakterię, która produkuje toksyny
(botulizm niemowląt, botulizm przyranny).
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

57
Zatruciom pokarmowym można zapobiegać poprzez właściwe przechowywanie i konserwo-
wanie żywności (niska temperatura, kwaśnie pH) lub niszcząc toksynę powstałą w produktach żywno-
ściowych poprzez ogrzewanie ich do 100ºC przez około 20 minut.
3.3. Corynebacterium
Do rodzaju Corynebacterium należy wiele gatunków drobnoustrojów, które wchodzą w skład
prawidłowej mikroflory naszego organizmu (flory skóry, jamy nosowo-gardłowej, układu pokarmo-
wego oraz dróg moczowo-płciowych). Te mikroorganizmy określane są jako dyfteroidy. Jedynym
chorobotwórczym drobnoustrojem należącym do tego gatunku jest Corynebacterium diphtheriae,
który wywołuje błonicę.
Budowa i fizjologia maczugowców
Bakterie z rodzaju Corynebacterium są Gram-dodatnimi (choć często barwią się nierówno-
miernie), pleomorficznymi (różnokształtnymi) pałeczkami, które przypominają maczugę, ze względu
na rozszerzający się koniec komórki. Komórki maczugowców zawierają materiał zapasowy – ziarna
wolutyny (ciałka Ernsta-Babesa, ziarnistości metachromatyczne), wybarwiające się na fioletowo
w preparatach barwionych metodą Neissera. Maczugowce są drobnoustrojami nieruchliwymi, nie
wytwarzają przetrwalników ani otoczek. Większość z nich jest tlenowa lub względnie beztlenowa,
wiele gatunków fermentuje węglowodany.
Epidemiologia
Błonica to choroba zakaźna, która rozprzestrzenia się poprzez kontakt z wydzieliną z nosa czy
gardła zarażonego człowieka lub nosiciela. Najczęściej zakażają się nią dzieci. Błonica jest chorobą
występującą naturalnie, tylko u ludzi, nie ma rezerwuarów pośród zwierząt.
Czynniki zjadliwości Corynebacterium diphtheriae
Chorobotwórczość maczugowca błonicy wynika przede wszystkim z produkcji toksyny błoni-
czej, wytwarzanej w miejscu wtargnięcia drobnoustroju, gdzie powoduje śmierć komórek gospodarza.
Mechanizm działania tej egzotoksyny polega na hamowaniu syntezy białek w komórce docelowej.
Następnie dostaje się do krwi, prowadząc do rozwoju objawów ogólnych zakażenia. Toksyna błonicza
działa wybiórczo na poszczególne narządy. Najbardziej podatne na uszkodzenie są mięsień sercowy
i układ nerwowy. Nie wszystkie szczepy maczugowca błonicy są zdolne do produkcji toksyny. Tylko
te, które uległy zakażeniu bakteriofagiem (niosącym gen tox) są toksynotwórcze i tylko one odpowia-
dają za wywołanie objawów błonicy.
Patogeneza, objawy kliniczne i przebieg zakażenia
Okres inkubacji błonicy wynosi około 2–5 dni. Przebieg choroby może być bardzo różny, od
postaci bardzo łagodnych po śmiertelne. Zakażenie jest zwykle zlokalizowane w gardle oraz krtani
i choć C. diphtheriae może również powodować zakażenia skóry (np. błonica przyranna), nosa, ucha,
spojówek, są to zakażenia rzadkie i o łagodnym przebiegu. Początkowe objawy błonicy mają charak-
ter mało swoisty – pojawia się ból gardła, gorączka, złe samopoczucie, utrudnienia w połykaniu,
obrzmiałe i bolesne węzły chłonne. Po zakażeniu maczugowce rozmnażają się na błonach śluzowych
i zaczynają produkować toksynę, która miejscowo uszkadza nabłonek i powoduje reakcję zapalną.
Martwy nabłonek pokrywa się obfitym wysiękiem zawierającym włóknik i granulocyty, co prowadzi
do tworzenia się błon rzekomych na powierzchni migdałków, w gardle i krtani. W ciężkiej postaci
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

58
błonicy błony rzekome są rozległe, a próby ich usunięcia bardzo bolesne, prowadzące do krwawienia.
Błony rzekome utrudniają oddychanie i powodują nasilanie się duszności. Charakterystyczne dla bło-
nicy jest także znaczne powiększenie węzłów chłonnych i obrzęk szyi (tzw. szyja Nerona).
Wytwarzana przez bakterie toksyna dostaje się do krwioobiegu i zaburza pracę serca (zmiany
zapalne i martwicze) oraz powoduje porażenie nerwów, głównie ruchowych. Dochodzi do porażenia
podniebienia miękkiego, trudności w połykaniu, zaburzenia widzenia. W ciężkich przypadkach może
nastąpić niewydolność serca, zaburzenia rytmu, a w konsekwencji śmierć.
Diagnostyka
Rozpoznanie błonicy początkowo opiera się na objawach klinicznych, ponieważ jednoznaczna
identyfikacja drobnoustroju wymaga czasu (około 1 tygodnia). Materiałem do badań najczęściej są
wymazy z gardła, migdałków, jamy nosowo-gardłowej. Diagnostyka laboratoryjna zakażeń wywoły-
wanych przez C. diphtheriae polega na:
Wykryciu drobnoustroju w preparatach bezpośrednich barwionych metodą Grama i Neissera oraz
hodowli na podłożach namnażających (z krwią) i specjalnych, np. podłoże Löfflera i Clauberga
(agar z dodatkiem tellurynu potasu).
Wykonaniu podstawowych testów biochemicznych umożliwiających identyfikację patogennych
szczepów Corynebacterium (np. ocena wytwarzania ureazy, rozkładu glukozy, maltozy, skrobi).
Wykazaniu toksynotwórczości szczepu maczugowca błonicy za pomocą testu Eleka. Jest to test
podwójnej immunodyfuzji w żelu agarowym. Na podłoże z badanym szczepem nakłada się pasek
bibuły nasączony antytoksyną (przeciwciałami przeciwko toksynie błoniczej). Jeżeli szczep produ-
kuje toksynę, to reakcja toksyny z antytoksyną tworzy w żelu linie precypitacyjne.
Leczenie
Leczenie w przypadku błonicy polega na jak najszybszym podaniu antytoksyny błoniczej
w celu neutralizacji toksyny. Aby zahamować wzrost bakterii, stosuje się antybiotyki (penicylina jest
lekiem z wyboru). Pacjent powinien przebywać w szpitalu i zostać odizolowany, aby uniemożliwić
rozprzestrzenienie się choroby. Ważne jest również leczenie podtrzymujące, mające na celu utrzyma-
nie drożności dróg oddechowych (w razie konieczności należy wykonać tracheostomię) oraz wspoma-
ganie układu sercowo-naczyniowego.
Profilaktyka
W celu zapobiegania błonicy stosuje się obowiązkowe szczepienia przy użyciu trójwalentnej
szczepionki Di-Per-Te, w skład której wchodzi anatoksyna błonicza, tężcowa i zabite bakterie krztuś-
ca. Do czasu wprowadzenia szczepienia błonica była przyczyną wielu epidemii. Chorowały i umierały
na nią głównie dzieci. Po wprowadzeniu obowiązkowego szczepienia częstość zachorowań gwałtow-
nie spadła. Ze względu na bardzo rzadkie występowanie błonicy, pojawienie się takiego przypadku
stanowi obecnie duży problem diagnostyczny. Choroba ta jest wciąż obecna w krajach tropikalnych
o niskim statusie ekonomicznym i niskim poziomie higieny.
Ponieważ odporność poszczepienna u dorosłych może być obniżona, zagrożone błonicą są
osoby podróżujące do krajów endemicznego jej występowania. Przyczyną zachorowań mogą być
również imigranci z tych krajów. Odporność zależy od ilości antytoksyny obecnej w organizmie.
Względny poziom toksyny można określić, wykonując próbę Schicka. Po wszczepieniu podskórnym
toksyny, jeżeli nie zostanie ona zneutralizowana przez krążące przeciwciała, powstanie zaczerwienie-
nie i obrzęk. Dlatego wystąpienie takiej reakcji (dodatni odczyn Schicka) oznacza brak odporności na
błonicę (wrażliwość na toksynę błoniczą), natomiast brak zmian świadczy o istniejącej odporności
(ujemny odczyn Schicka).
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

59
3.4. Listeria
Do rodzaju Listeria należy kilka gatunków bakterii, z których największe znaczenie, ze
względu na potencjał chorobotwórczy, ma Listeria monocytogenes. Bakterie te należą do grupy tleno-
wych pałeczek, zdolnych do wzrostu w szerokim zakresie temperatur i wysokim stężeniu soli. L. mo-
nocytogenes jest dość powszechnie występującym drobnoustrojem, wywołującym poważne zakażenia
tylko u określonych grup: noworodków i kobiet w ciąży oraz pacjentów z osłabioną odpornością typu
komórkowego.
Czynniki zjadliwości Listeria monocytogenes
L. monocytogenes jest patogenem wewnątrzkomórkowym, namnażającym się w komórkach
gospodarza (np. makrofagach). Przetrwanie we wnętrzu komórek i uniknięcie fagocytozy umożliwiają
bakterii następujące czynniki zjadliwości: internalina (ułatwia wchłanianie mikroorganizmu przez
różne komórki), listeriolizyna O (główny czynnik zjadliwości, odpowiadający za przerywanie błony
fagolizosomu i ucieczkę bakterii do cytoplazmy komórki żernej), fosfolipazy (rozpuszczają błony
komórkowe, odpowiedzialne za rozprzestrzenianie się bakterii).
Patogeneza, źródło zakażenia i objawy kliniczne
Zakażenie listeriozą następuje zasadniczo przez układ pokarmowy. Przypadki tej choroby są
zwykle związane ze spożyciem zakażonego mleka, miękkich serów, niedogotowanego mięsa, nieumy-
tych surowych warzyw. Ponieważ pałeczki mogą rozwijać się w niskich temperaturach, żywność
przechowywana przez długi czas w chłodniach również może zawierać znaczną ilość drobnoustrojów.
Nazwa gatunkowa tej bakterii – Listeria monocytogenes – wiąże się ze znaczącą monocytozą obser-
wowaną w niektórych przypadkach listeriozy.
Choroba ta może przebiegać w różnych formach i mogą jej towarzyszyć różnorodne objawy:
Listerioza u kobiet w ciąży i u noworodków – wczesne zakażenia w okresie ciąży mogą prowadzić
do poronienia, porodu martwego płodu oraz przedwczesnego porodu. Choroba nabyta w czasie
akcji porodowej lub wkrótce po niej skutkuje występowaniem u noworodka zapalenia opon mó-
zgowo-rdzeniowych. Zakażenie u noworodków następuje podczas przejścia przez kanał rodny albo
przez łożysko w czasie ciąży.
Listerioza dorosłych – przybiera różne formy – od łagodnej, grypopodobnej, poprzez zakażenia
z objawami żołądkowo-jelitowymi, aż do postaci poważnych i zagrażających życiu u pacjentów
z upośledzoną odpornością (biorcy przeszczepów, chorzy na AIDS, pacjenci z chorobą nowotwo-
rową), u których może występować zapalenie opon mózgowo-rdzeniowych i posocznica.
Diagnostyka
W celu postawienia rozpoznania konieczna jest izolacja i hodowla drobnoustroju. Pałeczki
wzrastają szybko na zwykłych podłożach. W przypadku materiałów zanieczyszczonych innymi drob-
noustrojami należy zastosować podłoża selektywne albo inkubację w obniżonej temperaturze (Listeria
wzrasta w temperaturze 0–4ºC).
Leczenie i zapobieganie
Większość antybiotyków działa jedynie bakteriostatycznie na L. monocytogenes, stąd lekami
z wyboru są antybiotyki β-laktamowe. Z powodu szerokiego występowania drobnoustroju nie ma
możliwości całkowitej kontroli zakażeń. Osoby z grup podwyższonego ryzyka powinny unikać spo-
żywania pokarmów, w których może pojawiać się L. monocytogenes.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż
60
4. Wybrane pałeczki Gram-ujemne z rodziny Enterobacteriaceae
(Mariusz Skiba)
Pałeczki Gram-ujemne określa się jako bakterie enteropatogenne lub bakterie jelitowe, gdyż
wywołują zakażenia górnego i dolnego odcinka przewodu pokarmowego. Stanowią również przyczy-
nę zakażeń pozajelitowych, najczęściej układu moczowego, a także w mniejszym stopniu innych na-
rządów, takich jak: płuca, OUN, szpik kostny, skóra i tkanka podskórna, przede wszystkim jako czyn-
niki etiologiczne zakażeń szpitalnych.
Bakterie enteropatogenne należą zwykle do trzech głównych rodzin: Enterobacteriaceae, Vi-
brionaceae i Campylobacteriaceae (tab. II).
Tabela II. Przykłady głównych drobnoustrojów enteropatogennych
Rodzina
Drobnoustrój
Rezerwuar
Enterobacteriaceae
(warunkowo chorobotwórcze)
– Escherichia coli (większość
szczepów)
– Enterobacter
– Serratia
– Klebsiella
– Proteus
– Yersinia
– Flora jelitowa człowieka
– Flora jelitowa niektórych zwie-
rząt
– Środowisko
Enterobacteriaceae
(chorobotwórcze)
– Enterotoksykogenne: E. coli (ETEC)
– Enterokrwotoczne: E. coli (EHEC
i VTEC),
– Enteroadherentne: E. coli (EAEC)
– Shigella
– Salmonella
– Ludzie nosiciele
– Zwierzęta nosiciele
Vibrionaceae
– Vibrio cholerae (przecinkowiec
cholery)
– Przewód pokarmowy człowieka
– Woda morska, owoce morza
Campylobacter i Helicobacter
– Helicobacter pylori
– Zwierzęta nosiciele
– Ludzie nosiciele
Pałeczki z rodziny Enterobacteriaceae, mimo różnic właściwych dla poszczególnych gatun-
ków, mają wiele cech wspólnych. Pozwala to na określenie charakterystyki typowego przedstawiciela
tej rodziny. Tabela III prezentuje kilka najważniejszych cech określających drobnoustroje należące do
Enterobacteriaceae.
Tabela III. Charakterystyczne cechy Enterobacteriaceae
Cecha
Typowy przedstawiciel Enterobacteriaceae
1
2
Barwliwość
Gram-ujemne
Zdolność do ruchu
Znakomita większość, dzięki posiadaniu rzęsek, prezentuje zdolność do
ruchu w mniejszym lub większym stopniu. Wybitne zdolności do ruchu
zauważalne nawet na podłożach stałych prezentuje Proteus
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż
61
cd. tab. III
1
2
Wytwarzanie otoczek
Większość posiada
Wytwarzanie zarodników
Nie wytwarzają
Wymagania odżywcze
Mało wybredne
Wymagania tlenowe
Względnie beztlenowe lub tlenowe
Zdolność do fermentacji gluko-
zy i produkcji kwasu
Większość posiada
Zdolność do wymiany informa-
cji genetycznej
Większość łatwo wymienia informacje genetyczne przez koniugację i wy-
mianę plazmidów, a także przez transdukcję. Pałeczki w ten sposób naby-
wają zdolność produkowania różnych czynników zjadliwości, w tym tok-
syn, a także wytwarzania różnych mechanizmów lekooporności
4.1. Zasady hodowli i diagnostyki zakażeń wywoływanych przez pałeczki
jelitowe
Wiele przypadków zakażeń pałeczkami jelitowymi, zwłaszcza jeżeli mają one postać zatruć
pokarmowych lub zakażeń układu pokarmowego, rozpoznawanych jest na podstawie obrazu klinicz-
nego. Jeśli zachodzi potrzeba bakteriologicznego ich potwierdzenia, wówczas w diagnostyce stosuje-
się następujące metody:
Hodowla i izolacja drobnoustroju z odpowiednich materiałów klinicznych, takich jak krew, mocz,
kał, wysięki z jam ciała, wymazy, płyn mózgowo-rdzeniowy, plwocina, popłuczyny oskrzelowe,
punktaty, fragmenty tkanek i inne. Przeprowadza się je na podłożach namnażających i wybiórczo
namnażających (najczęściej agar z krwią, podłoże Mac Conkeya), czasami specjalnych, np. w przy-
padku podejrzenia zakażeń pałeczkami Salmonella i Shigella (podłoże SS, bulion z żółcią, podłoże
SF).
Zróżnicowanie wyizolowanych rodzajów, gatunków i szczepów za pomocą tzw. szeregów bioche-
micznych. Jest to metoda opierająca się na różnicach w zdolności poszczególnych pałeczek do zu-
żywania dostępnych w środowisku (w którym się namnażają) różnych składników odżywczych
i wytwarzaniu z nich charakterystycznych metabolitów. W ten sposób dla każdej pałeczki można
określić charakterystyczny tylko dla danego rodzaju i gatunku wzór biochemiczny pomagający
w identyfikacji (tab. IV).
Tabela IV. Szereg biochemiczny różnicujący pałeczki jelitowe
Szereg biochemiczny
Y
ers
ini
a
E.
co
li
E
nte
ro
b
a
cter
Sh
ig
ella
Sa
lm
o
nella
K
leb
siella
p
ne
u
m
o
nia
e
P
ro
teus
m
ir
a
b
ilis
P
seud
o
m
o
na
s
a
er
ug
ino
sa
1
2
3
4
5
6
7
8
9
Gazowy rozkład glukozy
(zmiana koloru – zielony na żółty + gaz w rurce)
+
+
+
-
+
+
+
Bez
gazu
Fermentacja laktozy
(zmiana koloru – fioletowy na żółty)
-
+
+
-
-
+
-
-
Wytwarzanie indolu z bulionu tryptofanowego,
odczynnik Erliha
(różowa obrączka)
-
+
-
-
-
-
-
-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

62
cd. tab. IV
1
2
3
4
5
6
7
8
9
Wytwarzanie ureazy
mocznik + indykator
(zmiana koloru – zielony na niebieskofioletowy)
+
-
+
-
-
+
+
-
Rozkład cytrynianu
skos Simonsa
(zmiana koloru – zielony na niebieski)
-
-
+
-
+
+
+
+
H
2
S
(kolor czerwony)
-
-
-
-
+
-
+
-
Dezaminaza fenyloalaniny
Phe+FeCl
3
(kolor ciemnozielony)
-
-
-
-
-
-
+
-
Dekarboksylaza lizyny
(zmiana koloru – żółty na fioletowy)
-
+ +/- -
+
+
-
+/-
Ruch
+
+
+
-
+
-
+
+
Serotypowanie wyizolowanych szczepów. Ma szczególne znaczenie w przypadku zakażeń pałecz-
kami Salmonella, a także w dochodzeniach epidemiologicznych. Pałeczki z rodziny Enterobacte-
riaceae posiadają antygeny: somatyczny O, rzęskowy H i otoczkowy K. Każdy z nich ma wiele
wariantów (do kilkudziesięciu), które można identyfikować za pomocą specyficznych przeciwciał
dających w testach dodatni odczyn aglutynacyjny lub precypitacyjny. Powstaje w ten sposób uni-
kalny wzór serologiczny dla poszczególnych serotypów identyfikowanych drobnoustrojów, np.
O111:K55:H3. (schemat identyfikacji serotypów opartych na antygenach O, H i K w odniesieniu
do pałeczek Salmonella nazywany jest schematem Kauffmanna-White’a).
Wykazanie zdolności badanego szczepu do wytwarzania istotnych z punktu widzenia chorobo-
twórczości czynników zjadliwości, a zwłaszcza niektórych toksyn. Powszechną metodą jest wy-
krywanie tych czynników za pomocą testów opierających się na technikach immunologicznych.
Określenie lekowrażliwości wyizolowanych drobnoustrojów. Celem tego etapu badania jest włą-
czenie skutecznego, celowanego leczenia antybiotykami zakażeń wywołanych przez te bakterie.
4.2. Czynniki chorobotwórczości pałeczek Enterobacteriaceae
Pałeczki jelitowe dysponują całą gamą różnych czynników chorobotwórczości, które odpo-
wiedzialne są za wywoływanie bardzo różnorodnych efektów działania na wrażliwe tkanki i narządy.
Do najważniejszych należą:
Endotoksyny – można wyróżnić wiele rodzajów endotoksyn właściwych dla poszczególnych ga-
tunków. Zależnie od budowy części lipidowej, wyróżnia się endotoksyny o mniejszej lub większej
toksyczności. W gwałtowny sposób pobudzają one komórki układu odpornościowego, czego efek-
tem jest uwalnianie cytokin prozapalnych prowadzących do nasilonej reakcji zapalnej i rozwoju
wstrząsu septycznego.
Główne antygeny – otoczkowy K, rzęskowy H i somatyczny O. Każdy z tych antygenów posiada
wiele różnych wariantów. Jest to cecha wykorzystywana do tzw. serotypowania drobnoustrojów.
Czynniki adhezyjności, czyli przylegania – ułatwiają przyleganie bakterii do komórki gospodarza.
Wielu przedstawicieli tej rodziny posiada fimbrie, odgrywające znaczącą rolę w przyleganiu bakte-
rii do komórek gospodarza oraz w procesach wymiany informacji genetycznej między komórkami
bakterii.
Egzotoksyny – białkowe toksyny wytwarzane przez bakterie, wydzielane na zewnątrz komórki.
Zadaniem egzotoksyn jest uszkadzanie komórek zainfekowanej tkanki, uszkadzanie i rozpuszcza-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

63
nie substancji międzykomórkowej w tkankach, ułatwianie rozprzestrzeniania się zakażenia i kolo-
nizacji bakteryjnej.
Otoczki – pomagają zredukować niekorzystny wpływ czynników zewnętrznego środowiska bakte-
rii, w tym utrudniają proces przenikania antybiotyków przez jej ścianę. Głównym zadaniem otoczki
jest jednak obrona bakterii przed atakiem komórek układu odpornościowego gospodarza.
Jeżeli pałeczki z rodziny Enterobacteriaceae przełamią, dzięki posiadanym czynnikom zja-
dliwości, zabezpieczenia „wrót zakażenia” i będą w stanie, wykorzystując je, uniknąć ataku mechani-
zmów odporności gospodarza, wówczas mogą wywołać jedną z niżej wymienionych postaci zakaże-
nia:
− zakażenie przewodu pokarmowego i zatrucie pokarmowe;
− zakażenie układu moczowego – pałeczki z rodziny Enterobacteriaceae odpowiadają za znakomitą
większość wszystkich (szpitalnych i pozaszpitalnych zakażeń układu moczowego);
− zakażenia dolnych i górnych dróg oddechowych – najczęstszą postacią tych zakażeń jest zapalenie
płuc o ciężkim przebiegu i wysokiej śmiertelności, zazwyczaj w środowisku szpitalnym; ten typ
zakażeń dotyczy pacjentów z licznymi schorzeniami przewlekłymi i obniżoną odpornością;
− zapalenie opon mózgowo-rdzeniowych i mózgu – dotyczy przede wszystkim noworodków, osób
w podeszłym wieku oraz chorych ze znacznie upośledzoną czynnością układu odpornościowego;
− zakażenia łożyska naczyniowego i posocznice – najczęściej występują jako postać zakażenia szpi-
talnego, szczególnie u pacjentów z wtórnym do innych schorzeń lub urazów deficytem odporności;
posocznice wywołane zakażeniem pałeczkami Gram-ujemnymi spotyka się przede wszystkim na
oddziałach zabiegowych i intensywnej opieki medycznej;
− zakażenia układu kostno-stawowego i szpiku – powstają w wyniku rozprzestrzenienia się zakaże-
nia z innych ognisk pierwotnych drogą krwiopochodną lub przemieszczeniem bakterii do tkanek
wrażliwych na skutek na przykład urazu;
− zakażenia skóry, tkanki podskórnej i ran.
4.3. Najważniejsi przedstawiciele Enterobacteriaceae
Escherichia coli
Pałeczki E. coli występują stale w przewodzie pokarmowym człowieka i zwierząt. Pełnią rolę
symbiontów, uczestniczą w procesach rozkładu trawionych pokarmów, syntezy wielu niezbędnych
witamin z grupy B, K i C. Mogą wchodzić w skład prawidłowej mikroflory wielu innych okolic ciała.
Występują też w otaczającym środowisku, w glebie i w wodzie. Obecność pałeczek E. coli w wodzie
pitnej uważa się za wskaźnik zanieczyszczenia wody odchodami. Miano coli jest parametrem określa-
jącym liczbę drobnoustrojów stwierdzoną w 1 ml badanej wody i stanowiącym miernik bakteriolo-
gicznej czystości wody oraz jej przydatności do picia.
Potencjał poszczególnych szczepów E. coli do wywoływania różnych postaci zakażeń zależy
od konfiguracji czynników zjadliwości, którymi dysponują. Posiadanie przez pałeczki E. coli czynni-
ków ułatwiających ich przyleganie do wrażliwych tkanek (tzw. czynniki adhezyjności) jest powodem
ich kolonizacji i w konsekwencji wywołania w tym miejscu objawów infekcji. Pewne specyficzne
rodzaje antygenu O, charakterystyczne dla szczepów E. coli, pełnią rolę czynników ułatwiających
przyleganie do nabłonka wyścielającego pęcherz moczowy, natomiast fimbrie ułatwiają przyleganie
innym szczepom E. coli do nabłonka miedniczek nerkowych i moczowodów i w konsekwencji powo-
dowanie zakażeń układu moczowego.
Niektóre szczepy pałeczek jelitowych, tak zwane enterotoksyny (ETEC – enterotoksykogenne
E. coli), zdolne są do wytwarzania egzotoksyn uszkadzających błonę śluzową jelita. Pałeczki E. coli
mogą dzięki plazmidom wytwarzać enterotoksyny, które dzielimy na: ciepłochwiejne (w tej grupie
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

64
wyróżnia się toksyny: LT-I i LT-II) oraz enterotoksynę ciepłostałą. Toksyny te, działając na nabłonek
błony śluzowej jelita, wywołują efekt toksyczny podobny do toksyny cholery. Natomiast szczepy
EHEC (enterohemolityczne E. coli) mają zdolność wytwarzania oraz uwalniania werotoksyny i hemo-
lizyn. Te czynniki zjadliwości działają silnie cytotoksycznie, czyli bezpośrednio uszkadzają różne
komórki i tkanki, doprowadzając do ich martwicy, i odpowiadają za zagrażające życiu zakażenia
układu moczowego, prowadzące do ostrej niewydolności nerek oraz groźnych powikłań krwotocz-
nych.
Pałeczki jelitowe, zdolne do unikania pewnych mechanizmów odporności organizmu gospo-
darza, należących do pierwszej linii obrony przed zakażeniami, takimi jak fagocytoza, stanowią duże
zagrożenie, wywołując ciężkie infekcje zajmujące drogą krwionośną różne, ważne życiowo narządy,
w tym ośrodkowy układ nerwowy. Unikanie fagocytozy, czyli „pożerania” mikroorganizmów przez
wyspecjalizowane komórki fagocytujące, możliwe jest między innymi dzięki otoczkom, które chronią
bakterie przed tym zjawiskiem.
Do różnego rodzaju zakażeń, jakie może wywołać E. coli, należą:
zakażenia żołądka i jelit,
zakażenia dróg moczowych,
zapalenie opon mózgowo-rdzeniowych,
znacznie rzadziej: zapalenie płuc, zakażenia szpitalne i posocznica.
Najczęstszymi postaciami zakażeń przewodu pokarmowego są:
Biegunka sekrecyjna – dotyczy ludzi w każdym wieku, ale szczególnie często dotyka niemowląt
oraz ludzi podróżujących (tzw. „biegunka podróżnych”). Mechanizm wywoływanych objawów
chorobowych zależy od zdolności do wytwarzania enterotoksyn. Najczęściej za ten typ infekcji je-
litowej odpowiadają enterotoksykogenne E. coli (ETEC).
Ciężkie postacie zapalenia śluzówki przewodu pokarmowego, zwłaszcza jelita, związane z bezpo-
średnim inwazyjnym działaniem drobnoustrojów, fizycznie uszkadzających integralność śluzówki,
wnikających w jej głębokie warstwy i powodujących nasiloną reakcję zapalną w ścianie jelita. Za
tę postać toksykoinfekcji pokarmowej odpowiedzialne są enteroinwazyjne E. coli (EIEC).
Epidemicznie występujące biegunki zwłaszcza u dzieci i niemowląt. Objawy kliniczne i powstające
uszkodzenia śluzówki przewodu pokarmowego związane są głównie z występowaniem czynników
adhezyjności szczepów enteropatogennych E. coli (EPEC). Enteroadherentne E. coli (EAEC) wy-
wołują różne, mniej groźne postacie zakażeń żołądkowo-jelitowych i innych tkanek.
Ciężkie zakażenia wywołane przez enterokrwotoczne E. coli (EHEC). Na skutek działania wero-
toksyn powodują ciężkie zespoły chorobowe, takie jak:
− krwotoczne zapalenie jelita grubego,
− zespół hemolityczno-mocznicowy.
Śmiertelność w przypadku obu postaci zakażeń jest bardzo wysoka. Mają one tendencję do
występowania epidemicznego.
Najczęściej zakażamy się tymi drobnoustrojami na drodze:
− feralno-oralnej (człowiek–człowiek),
− pokarmowej (przez skażoną żywność),
− najrzadziej – z przeniesienia ze źródła endogennego – tak się dzieje najczęściej w przypadku zaka-
żeń układu moczowego.
Shigella
Cechą odróżniającą pałeczki Shigella od pozostałych Enterobacteriaceae jest ich brak zdolno-
ści do ruchu. Nie fermentują również laktozy, dlatego na podłożu Mac Conkeya nie zabarwiają oto-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

65
czenia na kolor różowy. Ich mała aktywność biochemiczna wyraża się także brakiem zdolności do
produkcji gazu.
Gatunki z rodzaju Shigella podzielone są na grupy na podstawie różnic w budowie antygenu
somatycznego O. Wyróżnia się następujące grupy:
A (S. dysenteriae) – wywołuje najgroźniejsze zakażenia; odpowiada za objawy tzw. czerwonki
bakteryjnej,
B (S. flexneri),
C (S. boydii),
D (S. sonnei).
Objawy kliniczne zakażeń wywołanych przez pałeczki Shigella związane są z działaniem róż-
nych czynników zjadliwości. Niektóre z nich kodowane są w komórkach bakteryjnych chromosomal-
nie, inne zależą od plazmidów. Bez względu na pochodzenie produkowane przez pałeczki toksyny
działają synergistycznie, bezpośrednio uszkadzając integralność śluzówki jelita i zaburzając jej funk-
cję. Pałeczki Shigella wywołują zakażenia o charakterze inwazyjnym, odpowiedzialne za martwicę
enterocytów (komórek nabłonkowych wyścielających śluzówkę jelita) i uszkodzenie głębszych
warstw śluzówki jelita. Uwalniana podczas śmierci komórek bakteryjnych toksyna Shiga wywołuje
z kolei objawy zespołu hemolityczno-mocznicowego, który potęgowany jest działaniem endotoksyny
uwalnianej ze ścian bakteryjnych. Zmiany zapalne związane z bezpośrednią inwazyjną aktywnością
drobnoustrojów ograniczają się do śluzówki jelita grubego, natomiast uwolniona endotoksyna i toksy-
na Shiga wykazują działanie ogólnoustrojowe. Dominującymi objawami klinicznymi shigellozy są:
biegunka, kurczowe bóle brzucha, obecność krwi w stolcu, natomiast wśród powikłań wymienia się
wystąpienie objawów ciężkiej niewydolności nerek, zaburzeń krzepnięcia krwi oraz wstrząsu.
Nie jest znany zwierzęcy rezerwuar dla tego drobnoustroju, zatem oznacza to, że zakażamy się
tą bakterią drogą feralno-oralną, pokarmową lub przez bezpośredni kontakt z chorym człowiekiem.
Salmonella
Pałeczki Salmonella na podłożu Mac Conkeya nie fermentują laktozy lecz glukozę i wydziela-
ją gaz. Głównymi gatunkami są:
S. cholerasuis,
S. typhi,
S. enteritidis (wyróżnia się setki serotypów).
Najważniejszymi czynnikami zjadliwości, jakimi dysponują pałeczki z rodzaju Salmonella, są:
endotoksyna – lipopolisacharyd zawierający antygen O,
inwazyny – białka ułatwiające przyleganie i penetrację pod warstwę enterocytów śluzówki jelita,
antygen Vi – otoczkowy polisacharyd o działaniu antyfagocytarnym.
Najczęstszymi postaciami zakażeń wywoływanych przez pałeczki Salmonella są:
Salmonelloza – jest to postać zakażenia żołądka i jelit wywoływana przez bakterie chorobotwórcze
zwierząt, zwłaszcza hodowlanych (najczęściej S. enteritidis i S. typhimurium). W takich sytuacjach
łatwo o przeniesienie zakażenia drogą feralno-oralną, pokarmową lub bezpośrednią (szczególnie
przez drób i jaja). Wrota zakażenia stanowi nabłonek śluzówki jelita cienkiego.
Wszystkie gatunki Salmonella, dzięki czynnikom zjadliwości, z łatwością pokonują barierę na-
błonka i łatwo wnikają w głąb śluzówki, jednak tylko S. typhi jest zdolna do wywołania uogólnio-
nego zakażenia (wówczas może rozwinąć się dur brzuszny). Objawy kliniczne salmonellozy są ty-
powe dla innych toksykoinfekcji pokarmowych występujących po około 24–48 godzinach inkuba-
cji.
Zapalenie szpiku kostnego – zazwyczaj czynnikiem etiologicznym jest S. enteritidis.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

66
Dur brzuszny – źródłem tej postaci zakażenia jest S. typhi. Dochodzi do niego drogą feralno-oralną,
przez skażoną wodę lub żywność (w takim przypadku rezerwuarem zakażenia są bezobjawowi no-
siciele przygotowujący żywność).
Spożycie zakażonego pokarmu wiąże się z wniknięciem drobnoustrojów do przewodu pokarmo-
wego. Pałeczki z łatwością pokonują górny odcinek przewodu pokarmowego, ponieważ są odporne na
działanie kwasu żołądkowego. Szybko, w stanie nienaruszonym przedostają się do jelita cienkiego.
Łatwo penetrują do warstwy podśluzowej, wnikają do grudek chłonnych i kępek Peyera, wywołując
zapalenie i owrzodzenia. Objawami tych zmian są biegunka, krwawienie z przewodu pokarmowego,
możliwa jest perforacja jelit. Następnie naczyniami chłonnymi pałeczki wędrują do węzłów chłonnych
jamy brzusznej, a stamtąd do układu krwionośnego. Mogą spowodować bakteriemię. Drogą krwi wę-
drują do różnych narządów, w których się namnażają i wywołują odczyn zapalny (wątroba, nerki,
śledziona, szpik kostny, płuca). Z żółcią wydzielane są do światła przewodu pokarmowego, gdzie
infekują jelito, po raz kolejny zamykając cykl, i są wydalane z kałem. Na tym etapie mogą kolonizo-
wać pęcherzyk żółciowy i stanowić przyczynę trudnego w leczeniu nosicielstwa.
Dur brzuszny występuje często epidemicznie, dlatego niezbędne jest przestrzeganie zasad dia-
gnostycznych. Do potwierdzenia rozpoznania niezbędna jest hodowla i izolacja pałeczek. Identyfika-
cja opiera się na charakterystyce biochemicznej i serotypowaniu. Rozpoznanie uzupełnia się badaniem
odczynu serologicznego. W tym przypadku stosuje się odczyn Widala, tj. odczyn aglutynacyjny, który
wykorzystuje się w rozpoznawaniu i różnicowaniu durów: brzusznego oraz rzekomych.
Helicobacter pylori
Jest to drobnoustrój kształtu spiralnego, barwiący się metodą Grama na kolor różowy. Do
wzrostu wymaga zwiększonego stężenia dwutlenku węgla i zmniejszonego stężenia tlenu, należy więc
do bakterii mikroaerofilnych. Charakterystyczną cechą biochemiczną tych drobnoustrojów jest zdol-
ność do wytwarzania ureazy, czyli enzymu przekształcającego mocznik w amoniak. Ponieważ amo-
niak ma odczyn zasadowy, potrafi w dużym stopniu neutralizować silnie kwasowe środowisko soku
żołądkowego otaczające drobnoustroje (tym tłumaczy się ich zdolność do przeżywania w tak ekstre-
malnie nieprzyjaznym środowisku, jak kwaśny sok żołądkowy). Ureaza wytwarzana przez Helicobac-
ter pylori wykorzystywana jest do wykrywania tych drobnoustrojów w wycinkach tkankowych (tak
zwane testy ureazowe wykonywane rutynowo podczas badania endoskopowego żołądka i dwunastni-
cy). Najważniejszym czynnikiem zjadliwości dla tego drobnoustroju jest cytotoksyna, tzn. czynnik
uszkadzający komórki nabłonka wyścielającego śluzówkę oraz gruczoły żołądka. Poprzez swoje bez-
pośrednio cytotoksyczne działanie powoduje powstanie przewlekłego stanu zapalnego śluzówki, pro-
wadząc do tworzenia się nadżerek, a następnie owrzodzeń w obrębie śluzówki żołądka i dwunastnicy
(czynnik etiologiczny choroby wrzodowej żołądka i dwunastnicy).
Wykazano również związek infekcji Helicobacter pylori z nowotworami żołądka jako konse-
kwencją przewlekłego stanu zapalnego śluzówki.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

67
5. Spiralne bakterie Gram-ujemne
(Mariola Kunicka)
Treponema, Borellia i Leptospira należą do chorobotwórczych dla człowieka Gram-
-ujemnych bakterii spiralnych.
5.1. Treponema
Najważniejszym czynnikiem chorobotwórczym dla człowieka jest Treponema pallidum, który
wywołuje kiłę. Dzieli się go na 4 podgatunki, z czego 3 są chorobotwórcze dla człowieka. Są to dłu-
gie, cienkie, przypominające korkociąg bakterie, wykazujące zdolność ruchu rotacyjnego i zgięciowe-
go, co wykorzystuje się w diagnostyce mikroskopowej. Nie barwią się metodą Grama, są względnie
beztlenowe, mogą wzrastać tylko na żywych tkankach.
Czynniki warunkujące chorobotwórczość T. pallidum zostały mało poznane. Wiadomo, że
zdolność drobnoustroju do przylegania do komórek oraz wiązanie krętków do śródbłonka odgrywają
istotną rolę w wytwarzaniu miejscowej reakcji zapalnej. Białka wchodzące w skład ściany komórko-
wej tego gatunku bakterii są słabo immunogenne.
T. pallidum jest czynnikiem etiologicznym kiły. Główną drogę zakażenia stanowią kontakty
seksualne. Schorzenie to zalicza się do grupy chorób wenerycznych. Do zakażenia może również
dojść poprzez łożysko oraz przypadkowo w wyniku przetoczenia krwi oraz kontaktu z nią.
Diagnostyka laboratoryjna
1. Badanie polega na obserwacji żywych, ruchliwych bakterii w mikroskopie z ciemnym polem wi-
dzenia.
2. Odczyny serologiczne, które dzielimy na:
− odczyny klasyczne,
− odczyny krętkowe.
Klasyczne odczyny kiłowe są to tzw. standardowe odczyny kiłowe – OWD lub kłaczkujące.
Polegają na oddziaływaniu przeciwciał zawartych w surowicy kiłowej z nieswoistymi antygenami
lipidowymi (antygeny kardiolipinowe). Treponema pallidum obok innych antygenów, zawiera anty-
gen lipidowy wykazujący podobieństwo immunologiczne z lipidami tkankowymi. Do klasycznych
odczynów kiłowych należą:
Odczyn VDRL (Vereral Diseases Research Laboratory):
− kłaczkujący odczyn z antygenem kardiolipinowym,
− bardzo znaczna czułość i swoistość odczynu,
− łatwy do wykonania,
− odczyn jakościowy określający intensywność skłaczenia (określany od – do 4+),
− odczyn ilościowy – miano stanowi największe rozcieńczenie surowicy dające jeszcze wyniki
dodatnie; odznacza się bardzo dobrą powtarzalnością.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

68
Odczyn USR (Unheated Serum Reagin – test):
− szybki odczyn reaginowy (dodatek chlorku choliny działa unieczynniająco na dopełniacz),
− nie trzeba inaktywować surowicy badanej,
− łatwe wykonanie,
− ustępuje pod względem swoistości odczynowi VDRL,
− bardziej czuły niż VDRL.
Wykonując odczyny klasyczne, należy pamiętać, że możemy otrzymywać wyniki fałszywie
dodatnie (odczyny biologicznie mylne), występujące u osób, które nie przeszły zakażenia krętkowego.
Częstość tych odczynów wynosi około 1%. Odczyny biologicznie mylne, stwierdzane przez okres
krótszy niż 6 miesięcy to tzw. odczyny typu ostrego, a w okresie dłuższym niż 6 miesięcy noszą mia-
no typu przewlekłego.
Przyczyny występowania odczynów biologicznie mylnych:
Typu ostrego:
− odczyny poszczepienne,
− mononukleoza,
− wirusowe zapalenie płuc,
− ospa wietrzna,
− odra,
− wirusowe zapalenie mózgu,
− żółtaczka zakaźna (WZW A),
− ciąża,
− bliżej nieokreślone.
Typu przewlekłego:
− układowy liszaj rumieniowy (SLE),
− guzkowe zapalenie okołotętnicze,
− twardzina układowa (Scleroderma),
− zapalenie mięśni i skóry,
− autoimmunologiczne schorzenia nerek,
− schorzenia reumatoidalne,
− choroba Hashimoto,
− zespół Sjögrena,
− bliżej nieokreślone.
Odczyny te mogą występować u osób, u których najdokładniejsze badania kliniczne nie wy-
kazują żadnych zmian chorobowych. Odczyny biologicznie mylne typu przewlekłego są często obja-
wem nierozpoznanej choroby autoimmunologicznej lub zapowiedzią jej wystąpienia. W takich przy-
padkach stwierdza się często różne rodzaje autoprzeciwciał.
Odczyny krętkowe stosowane w praktyce serologicznej:
TPI – odczyn Nelsona-Mayera – unieruchamianie krętków w obecności dopełniacza – antygen:
żywe krętki blade w pożywce Nelsona- Mayera.
FTA – immunofluorescencja pośrednia – antygen: krętki blade utrwalone na szkiełku podstawo-
wym.
FTA-ABS – j.w. oraz wstępna absorpcja surowicy ultrasonatem krętków Reitera.
FTA-ABS-Ig M – j.w. oraz zastosowanie znakowanej surowicy odpornościowej, skierowanej prze-
ciwko IgM.
TPHA – pośrednia bierna hemaglutynacja – krwinki barana opłaszczone ultrasonatem krętków
bladych.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

69
Objawy kliniczne kiły
Kiła dorosłych
Kiła pierwotna – w okresie 3–4 tygodni od momentu zakażenia w miejscu wniknięcia patogenu
pojawia się zmiana pierwotna, która charakteryzuje się tym, że jest to: ognisko pojedyncze, niebo-
lesne, okrągłe, zanikające bez pozostawienia blizny, z odczynem ze strony okolicznych węzłów
chłonnych. Zmiana ta zawiera bardzo dużą liczbę bakterii, a zatem jest wysoce zakaźna. Po około
2 tygodniach samoistnie zanika bez pozostawienia śladu.
Kiła drugorzędowa – objawy zwykle pojawiają się po upływie 3–8 tygodni od zaniku zmiany pier-
wotnej. Jest to okres, w którym manifestują się objawy ogólnoustrojowe, świadczące o szerzeniu
się zakażenia krętkami bladymi. Zalicza się do nich: stany podgorączkowe, złe samopoczucie, po-
większenie węzłów chłonnych i często łysienie tzw. kiłowe (wyglądem przypomina „futro wygry-
zione przez mole”). W obrębie błon śluzowych może pojawić się wysypka w postaci odbarwionych
plam oraz kłykciny kiłowe w postaci brodawkowatych nieuszypułowanych wykwitów. Zmiany na
skórze i błonach śluzowych są wysoce zakaźne.
Kiła utajona – może dotyczyć okresu wczesnego i późnego utajenia, w zależności od czasu, jaki
upłynął od pojawienia się zmiany pierwotnej. Postać ta charakteryzuje się tym, że odczyny serolo-
giczne są dodatnie, natomiast nie występują żadne objawy kliniczne charakterystyczne dla kiły.
Kiła trzeciorzędowa: okres ten charakteryzuje się występowaniem nieodwracalnych zmian martwi-
czo-degeneracyjnych. Zmiany nie są zakaźne. Objawy kliniczne zależą od narządów, które zostały
objęte procesem chorobowym. Mogą dotyczyć aorty (tętniak aorty), zaburzeń mięśniowo-kostnych,
zaburzeń ze strony układu nerwowego (zmiany otępienne, utrata wzroku itd.). Z uwagi na fakt, że
objawy kliniczne mogą mieć różnorodny obraz i naśladować wiele innych schorzeń, często okre-
ślana jest mianem „wielkiego naśladowcy”.
Kiła wrodzona
Po ukończeniu 16 tygodnia ciąży krętki blade mogą przechodzić przez łożysko i zakażać płód.
Często kończy się obumarciem płodu, zgonem zaraz po urodzeniu lub urodzeniem dziecka z poważ-
nymi wadami rozwojowymi. Przy urodzeniu stwierdza się często: opóźnienie rozwoju wewnątrzma-
cicznego, występowanie wycieku surowiczego z nosa, powiększenie wątroby i/lub śledziony, żółtacz-
kę oraz powiększenie węzłów chłonnych, zaburzenia w budowie układu kostnego oraz zmiany budo-
wy twarzoczaszki – zęby karbowane, nos siodełkowaty, mikroszczęka, guzy czołowe. Obserwuje się
występowanie tzw. triady Hutchinsona: karbowane zęby, śródmiąższowe zapalenie rogówki i głuchota.
Leczenie
Lekiem z wyboru w leczeniu kiły jest penicylina, natomiast alternatywnie, kiedy występuje
np. uczulenie na penicylinę, można stosować doksycyklinę lub erytromycynę. Schematy leczenia zale-
żą od stopnia zaawansowania choroby i są domeną wenerologów, którzy, kontrolując odczyny serolo-
giczne, monitorują leczenie. Powikłaniem związanym z zastosowanym leczeniem może być reakcja
Jarischa–Herxheimera, która polega na wystąpieniu u chorych, którym podano penicylinę, spadku
ciśnienia krwi, sinicy, wysokiej gorączki i dreszczy. Objawy te związane są z szybkim rozpadem (po
podaniu antybiotyku) krętków i uwolnieniem produktów ściany komórkowej bakterii, których właści-
wości są podobne do endotoksyn. Mogą przypominać wstrząs anafilaktyczny, jednak we wstrząsie
nigdy nie występuje gorączka, poza tym przed podaniem penicyliny każdorazowo wykonuje się próbę
uczuleniową.
Leczenie kiły wrodzonej schematycznie przypomina leczenie kiły nabytej. Włącza się je
w każdym potwierdzonym przypadku zakażenia oraz w sytuacjach, kiedy jest ono wysoce prawdopo-
dobne, a matka nie była leczona przed porodem.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

70
5.2. Leptospira
Są to bakterie charakteryzujące się kształtem spiralnym, posiadające zdolność ruchu, które
mogą wzrastać na wzbogaconych podłożach sztucznych, najlepiej w temperaturze około 30ºC. Lepto-
spiroza jest chorobą odzwierzęcą, wywoływaną przez krętki Leptospira interrogans. Do najczęściej
występujących postaci klinicznych zakażenia należy choroba Weila, zwana żółtaczką krętkową zakaź-
ną, wywoływana przez serotyp icterohaemorrhagiae. Rezerwuarem patogenów są zwierzęta: szczury,
psy, koty, natomiast człowiek jest gospodarzem końcowym, co oznacza, że zakażenie nie przenosi się
z człowieka na człowieka.
Drogi zakażenia
Do zakażenia może dojść przez kontakt z wodą, glebą, żywnością skażonych moczem zwie-
rząt lub zakażonymi zwierzętami. Bakterie wnikają przez nieuszkodzone błony śluzowe lub mikro-
uszkodzenia skóry, natomiast nieuszkodzona skóra stanowi barierę.
Przebieg choroby
Drobnoustrój wnika do krążenia i rozprzestrzenia się do wszystkich narządów wewnętrznych,
przyjmując postać zakażenia ogólnoustrojowego, ze szczególnymi zmianami w wątrobie, nerkach
i ośrodkowym układzie nerwowym. Zmiany w wątrobie charakteryzują się podwyższonymi warto-
ściami transaminaz, bilirubiny oraz występowaniem żółtaczki. Uszkodzenie śródbłonka naczyń obja-
wia się zaburzeniami wodno-elektrolitowymi, które prowadzą do wstrząsu hipowolemicznego oraz
zespołu DIC (wewnątrznaczyniowego wykrzepiania). Uszkodzenie nerek przyjmuje obraz martwicy
cewek i niewydolności nerek. W ostatnich latach maleje liczba przypadków leptospiroz, często jednak
mają one przebieg śmiertelny. Postać subkliniczna choroby często występuje u weterynarzy, pracow-
ników rzeźni. Mogą występować też przeciwciała u osób, które nie wiedzą, że zostały zakażone. Lep-
tospiroza, która przebiega bez żółtaczki, jest bardzo trudna do zdiagnozowania. Po okresie inkubacji,
który trwa zwykle od 1 do 2 tygodni, występują objawy rzekomogrypowe. Następnie, po upływie
kilku dni do miesiąca od ustąpienia objawów rzekomogrypowych pojawiają się: bóle głowy, mięśni,
nudności i wymioty. W badaniu fizykalnym stwierdza się powiększenie śledziony i rzadziej wątroby
oraz występowanie objawów oponowych.
Choroba Weila (leptospiroza z żółtaczką) jest najcięższą klinicznie postacią choroby, wywo-
łaną głównie przez serotyp L. icterohaemorrhagiae. W obrazie klinicznym dominują rozsiane uszko-
dzenie śródbłonka naczyń i ich zapalenie, które prowadzi do zaburzenia pracy nerek, wątroby, krwo-
toków wewnętrznych, zapalenia opon mózgowo-rdzeniowych i wstrząsu.
Diagnostyka
Opiera się na rozpoznaniu klinicznym, które należy potwierdzić hodowlą z izolacją bakterii
oraz badaniem serologicznym. Leptospira można izolować z krwi, płynu mózgowo-rdzeniowego lub
moczu. Badanie bezpośrednie polega na obserwacji materiału diagnostycznego w mikroskopie z ciem-
nym polem widzenia. Badania serologiczne, na podstawie których stwierdza się obecność przeciwciał,
są dodatnie po upływie 4 tygodni od zakażenia, co zmniejsza ich przydatność w ustaleniu rozpoznania
choroby.
Leczenie
Lekiem z wyboru jest penicylina lub w wyjątkowych sytuacjach tetracyklina.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

71
5.3. Borrelia
Spośród licznych gatunków Borrelia, aż 13 może być chorobotwórczych dla człowieka.
W większości wywołują one gorączkowe zespoły chorobowe, podobne do duru powrotnego, które
przenoszone są przez kleszcze. Bakterie te barwią się metodą Wrighta lub Giemzy, są po wybarwieniu
dobrze widoczne w mikroskopie świetlnym, łatwo hoduje się je na podłożach sztucznych, należą do
grupy bakterii mikroaerofilnych.
Wśród licznych gatunków dwa zasługują na szczegółowe omówienie: Borrelia recurrentis
wywołująca dur powrotny oraz Borrelia burgdorferi wywołująca boreliozę (chorobę z Lyme).
Borrelia recurrentis
B. recurrentis wywołuje dur powrotny, którego nazwa pochodzi od obrazu klinicznego, tzn.
pojawiających się nawrotów bakteriemii z wysoką gorączką. Bakterie atakują narządy wewnętrzne:
śledzionę, wątrobę, opony mózgowo-rdzeniowe, nerki i przewód pokarmowy. Początek choroby jest
nagły, z krótkim okresem inkubacji (3–10 dni). Występują dreszcze, wysoka gorączka, która utrzymu-
je się kilka dni. Po około tygodniowej przerwie ma miejsce drugi atak choroby, tj. dreszcze, gorączka
i bardzo silne bóle głowy. Następne nawroty przebiegają podobnie, zwykle jest ich od 3 do 10.
Drobnoustrój przenoszony jest przez kleszcze i wszy. Zakażone szczury są źródłem choroby
u kleszczy, natomiast wesz ludzka, poprzez spożycie krwi zakażonego człowieka może przenieść cho-
robę po kilku dniach na inną osobę.
Diagnostyka
1. Badanie rozmazów krwi, obserwacja w mikroskopie z ciemnym polem widzenia i barwienie metodą
Wrighta i Giemzy pozwalają na wykrycie krętków we wczesnym okresie zakażenia.
2. Hodowla krwi i testy serologiczne potwierdzają zakażenie.
3. VDRL może być fałszywie dodatni.
Borrelia burgdorferi
Drobnoustrój ten wywołuje chorobę z Lymę (boreliozę) przenoszoną przez kleszcze. Czynniki
zjadliwości tych krętków nie są dobrze poznane, wiadomo jednak, że odpowiedź immunologiczna
odgrywa główną rolę w patogenezie choroby. Ściana komórkowa bakterii zawiera toksyczny lipopoli-
sacharyd i peptydoglikan, które wykazują właściwości pozapalne, istotnie różniąc się od endotoksyn
bakteryjnych.
Przebieg choroby
Okres inkubacji jest różnie długi i wynosi od 3 do około 30 dni. W miejscu ugryzienia przez
kleszcza pojawia się zmiana skórna pod postacią rumienia wędrującego – erythema migrans, która ma
postać pierścienia z jasnym środkiem i czerwonym uniesionym brzegiem. U połowy pacjentów mogą
pojawiać się zmiany wtórne, tzw. satelitarne z towarzyszącymi: gorączką, dreszczami, bolesnością
i powiększeniem węzłów chłonnych. Krętki szerzą się drogami chłonnymi do narządów wewnętrz-
nych. Po tygodniach lub miesiącach od ustąpienia pierwotnej zmiany u chorego pojawiają się objawy
ze strony narządów wewnętrznych, najczęściej serca i układu nerwowego. Jest to drugie stadium cho-
roby. U większości pacjentów w późniejszym okresie rozwija się trzecie stadium pod postacią zapale-
nia stawów oraz zmęczenia.
Epidemiologia
Krętki uwalniane są wraz ze śliną kleszcza Ixodes dammini lub innych gatunków tego paję-
czaka. Dorosły kleszcz zakaża się krętkami przez krew jeleni. Wiosną samice kleszczy składają jaja
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

72
w ziemi. Z nich wylęgają się larwy, które bytują na myszach i innych ssakach, aż do momentu uzy-
skania dojrzałości. Następnie kleszcze stają się pasożytami jeleni i cykl się zamyka. Na obszarach
endemicznych nawet 80% kleszczy jest zakażonych krętkami.
Rozpoznanie choroby opiera się głównie na podstawie objawów klinicznych oraz badań sero-
logicznych krwi. B. burgdorferi można wykryć w rozmazach krwi, w osadzie płynu mózgowo-rdze-
niowego. Bakterie te barwią się metodą Giemzy, można je hodować na podłożach płynnych.
Testy serologiczne odgrywają w diagnostyce bardzo ważną rolę. Jest ich wiele i przy ich uży-
ciu określa się poziomy przeciwciał w klasach IgM i IgG. Istnieją jednak liczne problemy związane
z interpretacją testów. Ważną rolę w diagnostyce choroby odgrywa metoda Western blot, która pozwa-
la wykryć białko 39 kDa, uważane za typowe dla B. burgdorferi.
Leczenie
Zależy od stadium choroby i prowadzone jest przez lekarzy chorób zakaźnych. W leczeniu
stosuje się: doksycyklinę, amoksycyklinę i erytromycynę. W drugim i trzecim stadium choroby do
leczenia włącza się: ceftriakson. Ogromne nadzieje wiązane są ze stosowaniem rekombinowanej
szczepionki.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

73
6. Prątki
(Joanna Bronikowska)
Prątki (Mycobacterium) należą do nieruchomych, wolno rosnących, nieprzetrwalnikujących
bakterii tlenowych. Ściana komórkowa prątków jest unikatowa, ze względu na obecność lipidów (40–
–60%), i odpowiada za następujące ich cechy: kwasooporność, powolny wzrost oraz oporność na de-
tergenty i antybiotyki. W ścianie komórkowej znajdują się białka, stanowiące około 15% jej masy,
które są ważnymi antygenami, stymulującymi rozwój odporności komórkowej gospodarza na infekcje.
Oczyszczone pochodne tych białek (PPD) wykorzystuje się do wykonania próby tuberkulinowej. Prąt-
ki mają zdolność przeżywania wewnątrz makrofagów, stając się drobnoustrojami względnie we-
wnątrzkomórkowymi. Prątki dzielą się powoli, co 12–24 godziny, a kolonie na podłożach specjalnych
widoczne są po kilku tygodniach. Prątki po zabarwieniu nie ulegają odbarwieniu, stąd mówi się o ich
kwasooporności. Niektóre są saprofityczne. Najważniejsze chorobotwórcze dla człowieka prątki to:
Mycobacterium tuberculosis, Mycobacterium avium-intracellulare i Mycobacterium leprae.
Dzieli się je na wolno i szybko rosnące, oraz skotochromogenne (wytwarzają barwnik po eks-
pozycji na światło i w ciemności), fotochromogenne (wytwarzają barwnik po ekspozycji na światło)
oraz niefotochromogenne (niewytwarzające barwnika).
Czynniki determinujące chorobotwórczość prątków
Czynnik wiązkowy (cord factor) to glikolipidowa pochodna kwasu mikolowego. Glikolipid
hamuje migrację wielojądrzastych leukocytów i stymuluje tworzenie charakterystycznych ziarniaków.
Czynnik wiązkowy jest immunogenny, w hodowli powoduje wzrost prątków w postaci „wężowatych”
sznurów.
Sulfatydy to glikolipidy występujące na powierzchni prątków, hamujące tworzenie fagolizo-
somów (organelle komórkowe powstające na skutek zlania się fagosomu z lizosomem są odpowie-
dzialne za przeżycie prątków wewnątrz makrofagów).
6.1. Gruźlica
Gruźlica jest chorobą wywoływaną przez Mycobacterium tuberculosis.
Zakażenie pierwotne
W gruźlicy pierwotnej powstaje małe ognisko zapalne, zwykle pojedyncze, w środkowym lub
dolnym płacie płuca. Mogą być też powiększone węzły chłonne śródpiersiowe. Rzadko gruźlica pier-
wotna ujawnia się klinicznie, zmiany w płucu wapnieją, dając w obrazie rtg nieregularne intensywne
wysycenie. Bakterie w miejscu zakażenia powoli obumierają, jednak niektóre pozostają żywe nawet
przez 20 lat.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

74
Gruźlica wtórna – popierwotna
Czynna postać gruźlicy rozwija się albo w wyniku reinfekcji, albo reaktywacji uprzedniego
zakażenia. Może prowadzić do powstania dużych ziarniaków z ogniskiem martwicy. Typowymi kli-
nicznymi objawami gruźlicy wtórnej są: kaszel, krwioplucie, popołudniowa gorączka, nocne poty,
spadek masy ciała i złe samopoczucie.
Gruźlica prosówkowa – rozsiana
Gruźlica ta charakteryzuje się występowaniem licznych, małych gruzełków. Na tę postać cho-
rują głównie ludzie młodzi lub w podeszłym wieku, często z zaburzeniami odporności. Utworzone
gruzełki powodują nadżerki naczyń krwionośnych, co prowadzi do krwiopochodnego szerzenia się
tych bakterii. Ponadto zakażenie rozwija się w wielu narządach, przebiega w różnej formie, prowadząc
często do zgonu.
6.2. Trąd
Trąd, zwany też chorobą Hansena, jest wywołany przez Mycobacterium leprae. Może wystę-
pować w dwóch postaciach: tuberkuloidowej i lepromatycznej. O tym, która z nich się rozwinie, de-
cydują limfocyty pomocnicze (T
h
). U chorych, u których dominuje reakcja ze strony Th
1
, rozwinie się
postać tuberkuloidowa, a u pacjentów, u których przeważa odpowiedź ze strony Th
2
– lepromatyczna.
W trądzie tuberkuloidowym zmiany skórne są skąpoprątkowe, przeważają plamki, odbarwienia skóry,
brzegi rumieniowate, pozbawione skóry. U chorych z lepromatyczną postacią trądu (bogatoprątkową)
występuje zajęcie nerwów czuciowych z miejscowym zniesieniem czucia, zniekształcenie twarzy
(tzw. lwia twarz). Ta postać trądu jest bardziej zakaźna niż tuberkuloidowa.
Epidemiologia
Zakażenia najczęściej dotyczą osób mieszkających w południowo-wschodniej Azji i w Afry-
ce. W krajach Europy zachodniej zachorowalność na gruźlicę zmniejszyła się, choć w krajach rozwija-
jących się jest nadal wysoka. Choroba zwykle przenosi się drogą kropelkową wyłącznie z człowieka
na człowieka. Czynnikami predysponującymi do zakażenia są złe warunki socjalno-ekonomiczne,
pacjenci z niedoborami immunologicznymi, narkomani.
Okres inkubacji w przypadku trądu trwa bardzo długo i może wynosić nawet 20 lat. Choroba
ta nie jest bardzo zakaźna, choć kontakt z osobą zakażoną zwiększa ryzyko zachorowania. Występuje
głównie w Afryce, w regionach tropikalnych.
Diagnostyka laboratoryjna
Jak już wspomniano, prątki są kwasooporne. Wynika to z obecności kwasów mykolowych
w ścianie komórkowej tych bakterii. Barwią się na czerwono w gorącej karbolofuksynie (barwienie
Ziehla-Neelsena).
Prątki są bakteriami o bardzo dużych wymaganiach odżywczych. Ich izolacja trwa około 4–25
dni w bulionie, a na podłożu stałym średnio około 6 tygodni. Najczęściej stosuje się podłoże Löwen-
steina-Jensena (jajeczne), do którego można dodać czynniki przeciwbakteryjne w celu zahamowania
wzrostu innych bakterii (zieleń malachitowa). Do hodowli małych kolonii prątków stosuje się stałe
podłoże agarowe przeźroczyste (Middlebrooka). M. leprae nie hoduje się na podłożach bakteriolo-
gicznych.
Oprócz wymienionych już metod barwienia i hodowli, prątki można identyfikować na pod-
stawie testów biochemicznych, analizy chromatograficznej, hybrydyzacji kwasów nukleinowych.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

75
W przypadku zakażeń wywołanych przez prątek trądu można wykonać test z leprominą. W tuberkulo-
idowej postaci jest on dodatni.
Leczenie
Z uwagi na narastającą oporność prątków, niezbędne jest określenie wrażliwości wyizolowa-
nych szczepów na leki. Najczęściej terapia gruźlicy wymaga podawania leczenia skojarzonego (co
najmniej dwóch leków). Lekami pierwszego rzutu są np. ryfampicyna, izoniazyd, a drugiego np. cy-
kloseryna, fluorochinolony. Leczenie w przypadku gruźlicy jest długie i trwa od 2 do 6 miesięcy.
W przypadku choroby Hansena podaje się trzy leki przeciwprątkowe. Najtańszy, ale skutecz-
ny jest dapson (diaminofenylosulfon). Leczenie w przypadku trądu ma na celu głównie zapobieganie
nawrotom tej choroby.
Kontrola i zapobieganie
Szczepionka BCG (Bacillus Calmette-Guerin) jest sporządzona z atenuowanego szczepu
otrzymanego z Mycobacterium bovis. W badaniach przesiewowych, sprawdzających skuteczność
szczepienia, wykonuje się test skórny (Test Mantoux), polegający na podaniu śródskórnie tuberkuliny
(białko uzyskiwane z hodowli prątków) lub oczyszczonej białkowej pochodnej (PPD). Wynik odczy-
tuje się po 48 i 72 godzinach. Wystąpienie stwardniałego rumienia mierzącego 10 mm stanowi wynik
dodatni. Dodatni odczyn tuberkulinowy nie oznacza jednak, że pacjent jest chory na gruźlicę, a jedy-
nie informuje, że był wcześniej narażony na kontakt z prątkami. Szczepienie też może dawać dodatni
wynik testu.
Nie ma dostępnej szczepionki przeciwko trądowi.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

76
7. Bakteryjne czynniki zjadliwości
(Mariusz Skiba)
Bakteryjnymi czynnikami zjadliwości określa się cechy charakterystyczne bakterii, umożli-
wiające im wywoływanie i rozprzestrzenianie zakażenia w obrębie wrażliwych tkanek. Bakterie mogą
dysponować jednym lub kilkoma czynnikami zjadliwości. Wszystkie one składają się na potencjał
chorobotwórczy drobnoustrojów. Czynniki wirulencji mogą być jednakowe dla całego gatunku drob-
noustrojów bądź tylko dla danego szczepu bakterii. Mikroorganizmy nabywają zdolność do wytwa-
rzania określonych czynników zjadliwości dzięki różnym mechanizmom wymiany materiału gene-
tycznego, takim jak koniugacja i transdukcja (zjawiska te omówione zostały w rozdziale dotyczącym
morfologii i fizjologii bakterii).
Znaczenie czynników zjadliwości
Znajomość różnych cech charakterystycznych drobnoustrojów, obejmujących ich właściwości
morfologiczne, fizjologiczne, a także mechanizmów, dzięki którym drobnoustroje są w stanie wywo-
łać zakażenie i szerzenie się go w obrębie tkanek, leży u podstaw zrozumienia patogenezy chorób
infekcyjnych. Jest też niezbędna do wdrożenia skutecznej i adekwatnej profilaktyki, a także leczenia
(immunoprofilaktyka, immunoterapia, leczenie antybiotykami i chemioterapeutykami o działaniu
przeciwbakteryjnym).
Wśród najpowszechniej występujących czynników zjadliwości wyróżniamy:
otoczki,
adhezyny (czynniki przylegania),
tak zwaną „inwazyjność”,
egzoenzymy,
toksyny.
Rola otoczki bakteryjnej polega na możliwości unikania, albo w znacznym stopniu utrudniania
zjawiska fagocytozy, czyli mechanizmu obronnego należącego do odporności nieswoistej (wrodzo-
nej), polegającego na pochłanianiu i trawieniu czynników toksycznych, w tym bakterii, przez komórki
żerne. Otoczki to płaszcz gęstego polimeru, najczęściej polisacharydu. Ich wytwarzanie jest zdetermi-
nowane genetycznie (transdukcja). Adhezyny to bakteryjne struktury powierzchniowe, umożliwiające
przyleganie bakterii do powierzchni komórek gospodarza. Wśród czynników ułatwiających adhezję,
czyli przyleganie, wyróżniamy na przykład:
fimbrie,
boczne łańcuchy lipopolisacharydu (antygen O),
białko M (S. pyogenes).
„Inwazyjność” oznacza różne mechanizmy i narzędzia wchodzące w zakres fizjologii komórki
bakteryjnej, umożliwiające penetrację do głębszych warstw skolonizowanych i zakażonych tkanek.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

77
Egzoenzymy, czyli tak zwane enzymy wydzielnicze, wytwarzane są w obrębie komórki bakte-
ryjnej i wydzielane do otaczającego drobnoustrój środowiska. Enzymy te ułatwiają drobnoustrojom
szerzenie się zakażenia poprzez:
rozkład kolagenu i włóknika,
rozkład materiału komórkowego i macierzy pozakomórkowej,
enzymatyczną modyfikację i inaktywację antybiotyków.
Podział toksyn bakteryjnych
Egzotoksyny
Egzotoksyny to białka wytwarzane głównie przez bakterie Gram-dodatnie, ale także przez
drobnoustroje Gram-ujemne. Cząsteczką antygenową jest białko labilne termicznie. Egzotoksyny są
wytwarzane i uwalniane przez żywe komórki. Mogą być gatunkowo swoiste lub charakterystyczne
(kodowane chromosomalnie) dla szczepu (plazmidy, fagi lizogenne). Posiadają dwie domeny struktu-
ralne – wiążącą i aktywną.
Egzotoksyny funkcjonalnie i pod względem powinowactwa do wrażliwych tkanek dzielą się na:
enterotoksyny (np. ciepłochwiejną, ciepłostałą, toksynę cholery),
neurotoksyny (np. toksyna botulinowa, tetanospazmina),
cytotoksyny (np. toksyna błonicza).
Egzotoksyny identyfikujemy za pomocą:
testów czynnościowych (np. testu izolowanej pętli jelitowej),
testów na hodowlach komórkowych,
testów serologicznych, opartych głównie na metodzie immunoenzymatycznej.
Głównymi czynnikami etiologicznymi zakażeń i wytwarzanych przez nie egzotoksyn są:
gronkowiec złocisty – enterotoksyny, eksfoliatyny, TSS-1,
paciorkowiec ropny – egzotoksyny pirogenne,
pałeczka krztuśca – toksyna krztuścowa,
maczugowiec błonicy – toksyna błonicza,
E. coli – enterotoksyny, toksyny typu czerwonkowego (werotoksyny),
Shigella – toksyna czerwonkowa,
Vibrio cholerae – choleragen,
Pseudomonas – egzotoksyna A,
Clostridium botulinum – toksyna jadu kiełbasianego,
Clostridium tetani – tetanospazmina,
Clostridium perfringens – toksyna alfa.
Endotoksyny
Endotoksyny stanowią część składową bakterii (ich ściany komórkowej), uwalnianą po śmier-
ci komórki bakterii Gram-ujemnej. Toksyczną cząstką endotoksyny, czyli lipopolisacharydu, jest lipid
A. Endotoksyna, w odróżnieniu od egzotoksyny, jest stabilna termicznie, wyróżnia ją brak swoistości
gatunkowej. W zależności od gatunku drobnoustroju, który ją wytwarza, różni się toksycznością i siłą
działania. Endotoksyny odpowiedzialne są za rozwój posocznicy i objawy wstrząsu septycznego. LPS
silnie aktywuje makrofagi i komórki żerne, powodując uwolnienie licznych, silnie działających media-
torów reakcji zapalnej, takich jak TNF-
, IL-1, IL-6, IL-8.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

III. MECHANIZMY LEKOOPORNOŚCI
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

81
1. Lekooporność
(Aleksandra Garbusińska)
Wobec faktu narastania oporności drobnoustrojów na antybiotyki i chemioterapeutyki, lecze-
nie zakażeń wymaga stosowania przez lekarzy zasad racjonalnej, opartej na współczesnej wiedzy me-
dycznej chemioterapii. Powinna ona zapewnić pełną eradykację drobnoustrojów będących czynnikami
zakażenia i jednocześnie być bezpieczna dla pacjenta, jak najmniej kosztowna i zawsze uwzględniać
ryzyko szerzenia się mechanizmów lekooporności. Stąd też w ramach Narodowego Programu Ochro-
ny Antybiotyków w Polsce są opracowywane i stale modyfikowane rekomendacje przeznaczone dla
lekarzy oraz mikrobiologicznych laboratoriów diagnostycznych, dotyczące zasad wykonywania in
vitro badań lekooporności oraz praktycznego stosowania leków przeciwdrobnoustrojowych. Zasadą
przyjętą w racjonalnej chemioterapii przeciwdrobnoustrojowej jest ustalanie schematu leczenia zaka-
żenia zgodnie z wynikiem badania mikrobiologicznego, zwane antybiotykoterapią celowaną. Badania
mikrobiologiczne są jednak czasochłonne, a ciężkie, szybko rozwijające się zakażenia wymagają po-
dejmowania natychmiastowych decyzji odnośnie podania odpowiedniego leku. W takich sytuacjach
stosuje się tzw. antybiotykoterapię empiryczną. Pacjent otrzymuje wówczas antybiotyk, który według
zaleceń powinien być aktywny wobec prawdopodobnego czynnika zakażenia. Kryterium doboru leku
opiera się na udokumentowanych badaniach klinicznych, świadczących o skuteczności danego sche-
matu leczenia w określonej postaci zakażenia. Zwykle stosuje się środki o szerokim zakresie działania
przeciwdrobnoustrojowego. Istotna jest również wiedza dotycząca izolowanych na danym oddziale
szpitalnym drobnoustrojów i ich wzorów lekowrażliwości. Bieżąca analiza raportów epidemiologicz-
nych powinna być praktykowana. Nie należy podawać pacjentowi antybiotyku, który odznacza się na
danym oddziale niską aktywnością. Terapia empiryczna jest oczywiście leczeniem początkowym,
które należy zawsze zweryfikować badaniem mikrobiologicznym. Wstępnie podany lek powinien być
zastąpiony innym (według antybiogramu) i, jeśli to możliwe, o jak najwęższym zakresie mikrobój-
czym. Jest to tzw. postępowanie deeskalacyjne, zapobiegające rozprzestrzenianiu się lekooporności.
1.1. Metody oznaczania wrażliwości bakterii
Metody ilościowe
Metoda seryjnych rozcieńczeń leku na podłożu płynnym (makrorozcieńczeniowa). Należy przygo-
tować szereg dwukrotnych rozcieńczeń badanego leku w probówkach, na podłożu płynnym, reko-
mendowanym do badania wrażliwości bakterii/grzybów na antybiotyki/chemioterapeutyki. Z 24-
-godzinnej hodowli badanego szczepu wykonuje się zawiesinę o określonej gęstości. Po wymaga-
nym okresie inkubacji należy wskazać pierwszą probówkę z najniższym stężeniem leku, w której
wizualnie nie stwierdza się wzrostu (zmętnienia). Stężenie leku w tej probówce jest wartością MIC
(minimal inhibitory concentration), którą definiuje się jako najniższe stężenie leku hamujące
wzrost badanego szczepu drobnoustroju. Następnie należy oznaczyć wartość MBC/MFC dla
szczepu bakterii/ grzyba. MBC (minimal bactericidal concentration) to najniższe stężenie leku za-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

82
bijające badany szczep bakterii, natomiast MFC (minimal fungicidal concentration) to najniższe
stężenie leku zabijające badany szczep grzyba. Wartości MIC, MBC, MFC wyraża się w jednost-
kach µg/ml lub w mg/l. W celu oznaczenia wartości MBC/MFC należy z probówki, z której odczy-
tano MIC, oraz z 4 kolejnych probówek, w których wizualnie wzrostu nie stwierdzono, wysiać ilo-
ściowo próbki na podłoża agarowe. Najniższe stężenie leku, które po wysiewie na podłoże agarowe
nie dało wzrostu, odpowiada wartości MBC/MFC.
Metoda seryjnych rozcieńczeń na podłożu płynnym (mikrorozcieńczeniowa) jest wykonywana
analogicznie, na płytkach titracyjnych.
Metoda seryjnych rozcieńczeń leku na podłożu stałym. Szereg dwukrotnych rozcieńczeń badanego
leku należy wykonać na podłożu stałym, na którym następnie posiewa się jednakową objętość za-
wiesiny badanego szczepu. Wynik odczytuje się wizualnie po inkubacji. Stężenie leku na podłożu,
na którym nie stwierdzono wzrostu, ale poprzedzającym podłoże, na którym jeszcze obserwuje się
wzrost, to wartość MIC.
E-test – w metodzie tej są stosowane paski z antybiotykiem/chemioterapeutykiem o określonym
gradiencie stężeń. Pasek nakłada się na płytkę agarową z przygotowanym inokulum badanego
szczepu. Po czasie inkubacji wartość MIC leku jest odczytywana w punkcie przecięcia strefy za-
hamowania (elipsy) ze skalą na pasku. E-testy powinny być wykonywane zgodnie z instrukcją pro-
ducenta dołączoną do testu, która zawiera: wymagania dotyczące stosowanego podłoża hodowla-
nego, opis sposobu przygotowania inokulum na płytce, warunki inkubacji, odczytu testu, interpre-
tacji wyniku oraz opis kontroli jakości E-testu z użyciem szczepów wzorcowych.
Metody jakościowe
Dyfuzyjna metoda z użyciem krążków bibułowych. Na powierzchnię płytek agarowych z od-
powiednim, rekomendowanym podłożem nanoszona jest i następnie równomiernie rozprowadzana
zawiesina badanego szczepu o odpowiedniej gęstości. Na tak przygotowane inokulum nakładane są
krążki bibułowe – każdy z innym antybiotykiem/chemioterapeutykiem. Po wymaganym czasie inku-
bacji należy odczytać wielkość stref zahamowania wzrostu badanego szczepu, a następnie dokonać
interpretacji wyniku zgodnie z obowiązującymi rekomendacjami. Należy przeprowadzić kontrolę
prawidłowości wykonywania procedury z użyciem odpowiednich szczepów wzorcowych.
W Polsce 01.04.2011 r. wprowadzono do rutynowej diagnostyki mikrobiologicznej zalecenia
Europejskiego Komitetu ds. Oznaczania Lekowrażliwości EUCAST (European Committee on Antimi-
crobial Susceptibility Testing). Wcześniej obowiązywały rekomendacje amerykańskie – CLSI (Clini-
cal and Laboratory Standard Institute). Wytyczne EUCAST zawierają, między innymi wartości gra-
niczne minimalnych stężeń hamujących MIC oraz wskazówki do interpretacji stref zahamowania
wzrostu w metodzie dyfuzyjno-krążkowej dla poszczególnych grup drobnoustrojów. Kliniczne warto-
ści graniczne zdefiniowano następująco:
Wrażliwość kliniczna – to czułość drobnoustroju na standardowe dawki leku. Istnieje wysokie
prawdopodobieństwo sukcesu terapeutycznego.
Kliniczna średnia wrażliwość – oznacza szczep w zakresie wartości MIC pomiędzy wrażliwym
a opornym. Efekt terapeutyczny jest niepewny, ale może zostać osiągnięty, jeśli zakażenie przebie-
ga w takiej lokalizacji, gdzie lek podlega fizycznemu zagęszczeniu (np. drogi moczowe) lub istnie-
je możliwość podania jego wysokich dawek.
Kliniczna oporność – istnieje wysokie prawdopodobieństwo niepowodzenia terapeutycznego, na-
wet w przypadku zastosowania wysokich dawek leku.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

83
Mechanizmy działania leków przeciwdrobnoustrojowych na komórki bakterii
Leki przeciwdrobnoustrojowe hamujące syntezę ściany komórkowej
Leki: ß-laktamy, do których zalicza się: penicylinę, penicyliny przeciwgronkowcowe (np.
kloksacylina, flukloksacylina), aminopenicyliny (np. amoksycylina), ureidopenicyliny (np. azlocylina,
piperacylina), karboksypenicyliny (np. karbenicylina), cefalosporyny grupa I (cefazolina, cefradyna),
grupa II (cefuroksym, cefamandol), grupa III (cefotaksym, ceftriakson, ceftazydym), grupa IV (cefe-
pim), karbapenemy (meropenem, imipenem, ertapenem, doripenem), monobaktamy (aztreonam) oraz
leki glikopeptydowe: wankomycyna, teikoplanina.
Istotnym składnikiem ściany komórkowej bakterii jest peptydoglikan (mureina) występujący
jako struktura wielowarstwowa u bakterii Gram-dodatnich, oraz jednowarstwowa z dodatkową, ze-
wnętrzną błoną białkowo-lipidową u bakterii Gram-ujemnych. Antybiotyki ß-laktamowe doprowadza-
ją do zaburzenia syntezy mureiny, przyłączając się do enzymów biorących udział w syntezie tego
związku. Te enzymy, będące celami antybiotyków, to tzw. białka wiążące penicylinę PBP (penicillin
binding proteins), umiejscowione w błonie komórkowej. Antybiotyki mające powinowactwo do tych
białek trwale się z nimi wiążą, blokują ich aktywność enzymatyczną, co powoduje zahamowanie
wzrostu bakterii. Ostatecznym efektem ekspozycji na lek jest nagromadzenie się w komórce niewyko-
rzystanych prekursorów mureiny oraz autoliza komórki wskutek osłabienia struktury ściany komór-
kowej. Antybiotyki glikopeptydowe wiążą się natomiast do końcówki D-alanylo-D-alaniny prekursora
mureiny, doprowadzając do zahamowania syntezy mureiny, a więc osłabienia ściany komórkowej.
Leki przeciwdrobnoustrojowe hamujące funkcje błony cytoplazmatycznej
Leki: polimyksyna B, kolistyna.
Ekspozycja komórek bakterii Gram-ujemnych na leki z tej grupy doprowadza do zmian de-
strukcyjnych błony komórkowej. Antybiotyk wnika głęboko w lipidowe warstwy błony, powodując
wzrost jej przepuszczalności, a następnie wyciek związków z komórki i jej śmierć.
Konkurencja leków przeciwdrobnoustrojowych z metabolitami komórki bakterii
Leki: sulfonamidy (np. sulfametoksazol, sulfacetamid, kotrimoksazol).
Antybiotyk-antymetabolit, odznaczający się podobną strukturą chemiczną do substratu meta-
bolitycznego bakterii, wypiera na zasadzie współzawodnictwa właściwy metabolit z prawidłowego
szlaku, wchodzi jako analog na jego miejsce, zakłóca normalny bieg reakcji, doprowadzając do prze-
rwania szlaku bądź powstania nietypowych produktów. Sulfonamidy o podobnej strukturze do kwasu
p-aminobenzoesowego (PABA) konkurują z tym związkiem w reakcjach metabolitycznych, blokując
syntezę kwasu tetrahydrofoliowego, niezbędnego w syntezie szeregu związków, między innymi DNA.
Leki przeciwdrobnoustrojowe hamujące syntezę kwasu deoksyrybonukleinowego
Leki: chinolony: ciprofloksacyna, ofloksacyna, pefloksacyna, moksifloksacyna, kwas nalidyk-
sowy.
Materiał genetyczny bakterii zawarty jest w chromosomie oraz w strukturach pozachromoso-
mowych. Chromosom bakterii – nukleoid, będący odpowiednikiem jądra komórek eukariotycznych
zawiera skręconą, podwójną nić kwasu deoksyrybonukleinowego (DNA). Enzymy z klasy topoizome-
raz: gyraza DNA i topoizomeraza IV odpowiadają za właściwe skręcenie nici DNA, czyli tworzenie
funkcjonalnych, replikujących się superhelikalnych struktur DNA. Te właśnie topoizomerazy są celem
działania antybiotyków z grupy chinolonów. Cząsteczki leków wiążą się do podjednostek enzymów,
zakłócają procesy replikacji DNA, doprowadzając do powstania wadliwych cząsteczek.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

84
Leki przeciwdrobnoustrojowe hamujące syntezę kwasu rybonukleinowego
Leki: rifamycyny: rifampicyna.
Kwas rybonukleinowy informacyjny – mRNA (messenger RNA) zawiera przepisane z DNA
informacje. Leki z grupy rifamycyn blokują syntezę mRNA, poprzez związanie się z cząsteczką enzy-
mu – polimerazą RNA zależną od DNA, odpowiedzialną na nadzorowanie procesu syntezy.
Leki przeciwdrobnoustrojowe hamujące syntezę białek
Leki: tetracykliny (doksycyklina, tetracyklina), aminoglikozydy (gentamycyna, amikacyna,
kanamycyna, tobramycyna), streptograminy, linkozamidy (klindamycyna, linkomycyna), makrolidy
(erytromycyna, roksytromycyna, klarytromycyna), chloramfenikol.
W procesie syntezy białek bakteryjnych uczestniczą organelle komórkowe zwane rybosomami
o współczynniku sedymentacji 70S. Składają się z podjednostek: dużej 50S i małej 30S. W strukturze
chemicznej rybosomu wyróżnia się białka oraz rRNA (rybosomalny RNA). Inicjacja syntezy białek
jest uwarunkowana utworzeniem kompleksu rybosomu z mRNA (matrycowym RNA), po czym nastę-
puje elongacja łańcucha białkowego z udziałem tRNA (transportującego RNA) przyłączającego kolej-
ne cząsteczki aminokwasów, zgodnie z informacją zawartą w mRNA. Hamujące oddziaływanie leków
przeciwdrobnoustrojowych polega na wiązaniu się leku do podjednostki 30S lub 50S, co prowadzi do
deformacji rybosomu i utraty jego funkcji związanej z syntezą białek oraz do śmierci komórki.
Mechanizmy odporności na leki przeciwdrobnoustrojowe
Mechanizm metycylinooporności Staphylococcus spp.
Większość szczepów gronkowców złocistych wrażliwych na metycylinę (MSSA – methicyllin
susceptible Staphylococcus aureus) oraz gronkowców koagulazo-ujemnych wrażliwych na ten anty-
biotyk (MSCNS – methicyllin susceptible coagulase-negative Staphylococci) produkuje enzymy ß-
-laktamazy rozkładające powszechnie stosowane antybiotyki ß-laktamowe: penicylinę, ampicylinę,
amoksycylinę, ureidopenicyliny (np. tikarcylinę, piperacylinę), zachowując równocześnie wrażliwość
na penicyliny izoksazolinowe (np. kloksacylinę, flukloksacylinę), penicyliny z inhibitorami (np.
z kwasem klawulanowym), cefalosporyny i karbapenemy. Inaczej przedstawia się aktywność leków
wobec tzw. metycylinoopornych gronkowców złocistych (MRSA – methicyllin resistant Staphylococ-
cus aureus) oraz metycylinoopornych gronkowców koagulazo-ujemnych (MRCNS – methicyllin resi-
stant coagulase-negative Staphylococci). Są to szczepy oporne na antybiotyki ß-laktamowe: penicyli-
ny, penicyliny z inhibitorami, cefalosporyny i karbapenemy. Mechanizm metycylinooporności spowo-
dowany jest obecnością genu mecA warunkującego produkcję zmienionych białek błonowych, tj.
PBP2a lub PBP2’, które utraciły powinowactwo do antybiotyków ß-laktamowych. W leczeniu zaka-
żeń o tej etiologii poleca się wankomycynę, tigecyklinę, daptomycynę, linezolid. Klony szczepów
metycylinoopornych cechuje zwiększona wirulencja oraz wielolekooporność. Uzyskują one zdolność
do produkcji superantygenów oraz tworzenia biofilmów. Często są powodem wybuchu epidemii szpi-
talnych czy ognisk epidemicznych. Wprowadzono specjalną terminologię epidemiologiczną dotyczącą
tych szczepów:
HA-MRSA (hospital acquired methicyllin resistant Staphylococcus aureus) – gronkowiec złocisty
metycylinooporny związany ze środowiskiem szpitalnym.
CA-MRSA (community acquired methicyllin resistant Staphylococcus aureus) – gronkowiec złoci-
sty metycylinooporny nie związany ze środowiskiem szpitalnym.
FA-MRSA (farm acquired methicyllin resistant Staphylococcus aureus) – gronkowiec złocisty
metycylinooporny związany ze środowiskiem hodowlanym, zwierzęcym.
EMRSA – gronkowiec złocisty metycylinooporny epidemiczny.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

85
W szpitalach zaleca się wykonywanie badań przesiewowych hospitalizowanym pacjentom
przy przyjęciu na oddział, którzy wcześniej byli leczeni w szpitalu
i
mieli kontakt z nosicielem
MRSA.
Zasada ta powinna być stosowana szczególnie na oddziałach zabiegowych. Poszukując nosi-
cieli MRSA, należy pobierać próby z
nozdrzy,
gardła,
pachy,
pachwiny,
odbytu.
W Polsce częstotli-
wość zakażeń inwazyjnyvch wywoływanych przez szczepy MRSA wynosi około 20% (według da-
nych EARS-Net z 2011 r.).
W ostatnich latach stwierdza się wzrost częstości zakażeń powodowanych przez szczepy
CA-MRSA, chociaż ich rozpoznanie jest trudne. Najczęściej dotyczą one pacjentów, którzy ostatnio
nie byli ani hospitalizowani, ani poddawani zabiegom, nie leczono ich antybiotykami, a objawy cho-
robowe wystąpiły do 48 godzin od przyjęcia do szpitala.
Mechanizm oporności na wankomycynę
Mechanizm oporności występujący u enterokoków jest spowodowany zmianą w strukturze czą-
steczki prekursora mureiny. Nowy, wadliwy prekursor przestaje być rozpoznawalny przez wanko-
mycynę. Wankomycynooporne enterokoki (VRE – vancomycin-resistant enterococci) są zróżni-
cowaną fenotypowo grupą lekoopornych szczepów (Van A/B/C/D/E/G). Niektóre na przykład fe-
notypy odznaczają się opornością tylko na wankomycynę, ale większość wykazuje ją równocześnie
na wankomycynę i teikoplaninę. Enterococcus gallinarum i Enterococcus casseliflavus są natural-
nie oporne na wankomycynę.
Mechanizm oporności występujący u gronkowców może być spowodowany transferem genu vanA
od enterokoków. Mutant syntetyzuje mureinę o innych właściwościach, o zmienionym poziomie
usieciowienia. Gronkowce złociste, które nabyły cechę obniżonej wrażliwości na wankomycynę
lub oporności na ten lek, są oznaczane odpowiednio: VISA – vancomycin intermediate Staphylo-
coccus aureus (lub GISA – glycopeptide-intermediate Staphylococcus aureus), VRSA – vancomy-
cin resistant Staphylococcus aureus. W terapii poleca się stosowanie chinupristyny/dalfopristyny,
linezolidu, tygecykliny, daptomycyny.
Mechanizm oporności Streptococcus pneumoniae na penicylinę
Oporność szczepów na penicylinę i inne antybiotyki ß-laktamowe (cefalosporyny III) jest
związana z modyfikacją białek PBP (2x, 2b, 1a) będących celem tej grupy leków. Białka PBP to
transpeptydazy glikopeptydowe, które w procesie syntezy ściany komórkowej katalizują tworzenie
wiązań pomiędzy łańcuchami mureiny. Zmodyfikowane białka odznaczają się obniżonym powino-
wactwem do leków ß-laktamowych. Oporność jest nabywana drogą horyzontalnego transferu genów –
poprzez pobieranie cząsteczek DNA ze środowiska zewnętrznego od innych szczepów pneumokoków
bądź od paciorkowców w procesie transformacji. Wynikiem transferu jest powstanie tzw. genów mo-
zaikowych. Opcję terapeutyczną stanowią leki: wankomycyna, meropenem, chloramfenikol.
Pierwsze kliniczne izolaty szczepów opornych na penicylinę pojawiły się w 1967 r. w Austra-
lii i na Nowej Gwinei. Obecnie są hodowane już powszechnie. Według danych EARS-Net z 2011 r.,
w Polsce 80% szczepów Strepotcoccus pneumoniae odznacza się wrażliwością na penicylinę.
Mechanizm oporności typu MLS
B
Staphylococcus spp., Corynebacterium spp., paciorkowców
Jest uwarunkowany obecnością genów erm ulokowanych na chromosomach, plazmidach bądź
transpozonach. Mechanizm ten warunkuje wystąpienie zjawiska krzyżowej oporności bakterii na an-
tybiotyki z trzech grup: makrolidów, linkozamidów i streptogramin. W mechanizmie MLS
B
, w wyniku
oddziaływania enzymu metylazy, miejsce 23rRNA na rybosomie bakteryjnym, będące celem dla tych-
że antybiotyków, ulega modyfikacji. Antybiotyki, tracąc powinowactwo do tego miejsca, a więc
i zdolność hamowania biosyntezy białek, stają się nieaktywne wobec bakterii.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

86
W opcjach terapeutycznych można stosować leki: wankomycynę, teikoplaninę, tigecyklinę,
daptomycynę, ofloksacynę, lewofloksacynę.
Oporność na leki przeciwdrobnoustrojowe hamujące syntezę kwasu DNA
Oporność może wykształcić się poprzez:
mutacje punktowe w obrębie genów kodujących enzymy z klasy topoizomeraz: gyrazy i topoizo-
merazy IV; zmiana struktury tych enzymów powoduje, iż przestają być one celem działania anty-
biotyków,
wykształcenie pomp (efflux) skutecznie usuwających lek z komórki bakteryjnej,
mutacje genów kodujących białka porynowe w błonie zewnętrznej bakterii Gram-ujemnych, przez
co następuje redukcja bądź likwidacja kanałów porynowych, a więc leki przestają przedostawać się
do wnętrza komórki.
Oporność na leki przeciwdrobnoustrojowe hamujące syntezę białek
Oporność ta może objawić się poprzez: modyfikację miejsc – celów działania antybiotyków,
białek rybosomalnych i 16SrRNA, ograniczenie przepuszczalności błony komórkowej spowodowane
zmianami białek porynowych, aktywacją pomp (efflux), enzymatyczną modyfikacją bądź inaktywacją
leków. Przykładem enzymów oddziaływujących na leki są enzymy modyfikujące aminoglikozydy:
AAC-N-acetylotransferazy, APH-O-fosfotransferazy, ANT-O-adenylotransferazy. Zmodyfikowane le-
ki nie rozpoznają celów w komórce bakteryjnej. Z kolei chloramfenikol, również hamujący syntezę
białek, może ulec inaktywacji z powodu acetylotransferazy chloramfenikolowej, która prowadzi do
modyfikacji cząsteczki leku, czyniąc ją nieaktywną wobec bakterii.
Mechanizm ESBL (ESBL – extended-spectrum-beta-lactamases)
Mechanizm ten jest związany z produkcją ß-laktamaz o rozszerzonym spektrum substrato-
wym, uwarunkowanym genami zawartymi w plazmidach bądź chromosomach i decyduje o rozkładzie
antybiotyków ß-laktamowych: penicylin, cefalosporyn (z wyjątkiem cefamycyn), monobaktamów
(aztreonam). ß-laktamazy nie rozkładają natomiast karbapenemów, są przeważnie hamowane przez
inhibitory ß-laktamaz (kwas klawulanowy sulbaktam). Mechanizm ESBL występuje najczęściej wśród
pałeczek Enterobacteriaceae: Klebsiella pneumoniae, Escherichia coli, oraz rodzajów: Proteus, Ser-
ratia, Enterobacter, Salmonella, a ponadto wśród pałeczek nie-Enterobacteriaceae z rodzajów: Pseu-
domonas, Acinetobacter, Burkhoderia, Capnocytophaga, Alcaligenes.
Proponowane są następujące opcje terapeutyczne: penicyliny z inhibitorami ß-laktamaz
(w szczególności: piperacylina z tazobaktamem, cefoperazon z sulbaktamem) oraz karbapenemy lub
też leki innych grup.
Mechanizm AmpC
Występuje najczęściej wśród pałeczek produkujących chromosomalne lub plazmidowe cefalo-
sporynazy hydrolizujące antybiotyki ß-laktamowe: penicyliny wraz z ich połączeniami z inhibitorami,
cefalosporyny – z wyjątkiem IV generacji cefalosporyn (cefepim) – i aztreonam. Proponowane opcje
terapeutyczne to karbapenemy, cefepim, inne grupy leków. Mechanizm AmpC występuje najczęściej
wśród pałeczek Enterobactericeae: Escherichia coli, Morganella morganii oraz rodzajów: Enterobac-
ter, Citrobacter, Serratia, Providentia, a także u nie-Enterobacteriaceae: Pseudomonas aeruginosa
i Acinetobacter spp.
Mechanizmy oporności bakterii na karbapenemy
Mogą wynikać z przepuszczalności błony zewnętrznej bakterii Gram-ujemnych, z ekspresji
szerokiej gamy ß-laktamaz hydrolizujących karbapenemy.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

87
Mechanizm MBL jest związany z wytwarzaniem enzymów karbapenemaz klasy B, czyli metalo-ß-
-laktamaz MBL, oraz ß-laktamaz klasy A. W swej strukturze metaloenzymy zawierające jony cyn-
ku jako kofaktory hydrolizy leku, rozkładają karbapenemy i inne antybiotyki ß-laktamowe – peni-
cyliny oraz cefalosporyny, wraz z ich połączeniami z inhibitorami. Aztreonam (monobaktam) za-
chowuje natomiast aktywność. Mechanizm MBL może wystąpić u bakterii Pseudomonas aerugi-
nosa, Pseudomonas putida, Pseudomonas fluorescens oraz Proteus spp., Klebsiella pneumoniae,
Escherichia coli, Serratia marcescens, Enterobacter spp., rzadziej Acinetobacter baumannii, Bac-
teroides fragilis. Proponowane opcje terapeutyczne to: aztreonam, kolistyna, polimyksyna B, koli-
styna z rifampicyną, kolistyna z karbapenemem (nawet w przypadku oporności na karbapenemy),
amikacyna, piperacylina z tazobaktamem, fluorochinolony, ciprofloksacyna z gentamycyną, fos-
fomycyna.
Mechanizm KPC (KPC – Klebsiella pneumoniae carbapenemase) wiąże się z wytwarzaniem ß-
-laktamaz karbapenemaz, rozkładających wszystkie dostępne dzisiaj antybiotyki ß-laktamowe,
w tym karbapenemy: imipenem, meropenem, ertapenem, doripenem. Często mechanizm KPC wy-
stępuje łącznie z opornością na: aminoglikozydy, tetracykliny, fluorochinolony, kotrimoksazol.
Może wystąpić u Enterobacteriaceae: Klebsiella pneumoniae, Klebsiella oxytoca, Enterobacter
spp., Citrobacter freundii, Serratia marcescens, Salmonella enterica, oraz pałeczek nie-Entero-
bacteriaceae: Pseudomonas aeruginosa, Pseudomonas putida, Acinetobacter baumannii. Propo-
nowane opcje terapeutyczne to: kolistyna, tygecyklina, gentamycyna, amikacyna. Mechanizm
oporności KPC jest obecnie uznawany za najbardziej niebezpieczny dla pacjenta, sprawiający pro-
blemy terapeutyczne. Lokalizacja genów warunkujących tę oporność w plazmidach sprzyja szyb-
kiemu rozprzestrzenianiu się jej. Pierwszy szczep Klebsiella pneumoniae KPC wyizolowano
w 1996 r. w USA. Obecnie w kraju tym izoluje się często Klebsiella pneumoniae, przede wszyst-
kim ST258 KPC+, zwane „szczepami hiperepidemicznymi”, gdyż powodują zakażenia nawet z 50-
-procentową śmiertelnością. Szczepy KPC rozprzestrzeniły się następnie w Izraelu, Francji, Wiel-
kiej Brytanii, Brazylii, Kolumbii, Grecji, Chinach. W Polsce po raz pierwszy wyizolowano je
w 2008 r. w Warszawie. W 2010 r. zarejestrowano 153 pacjentów zakażonych lub skolonizowa-
nych, a w 2011 r. – 78. Izolacja szczepów KPC w szpitalu zobowiązuje Zespół Kontroli Zakażeń
Szpitalnych do wdrożenia postępowania zgodnie z zaleceniami rekomendowanymi przez Minister-
stwo Zdrowia, a dotyczącymi stwierdzenia przypadków KPC. Obejmuje ono zawiadomienie in-
spekcji sanitarnej, dyrekcji szpitala, izolowanie chorego, przeprowadzenie wywiadu epidemiolo-
gicznego w celu ewentualnego ustalenia pochodzenia szczepu KPC, zorganizowanie właściwej
opieki nad pacjentem, wykonanie badań przesiewowych wszystkim chorym oraz personelowi me-
dycznemu w celu poszukiwania nosicieli, dokonanie weryfikacji antybiotykoterapii i procedur hi-
gienicznych, zorganizowanie szkoleń dla personelu medycznego i pomocniczego. Pacjenci przyj-
mowani do szpitala z innych jednostek szpitalnych, w których izolowano szczepy KPC, powinni
być poddawani badaniom mikrobiologicznym. Laboratorium medyczne natomiast powinno wdro-
żyć rekomendowane procedury badawcze w celu poprawnej identyfikacji KPC.
Mechanizmy oporności bakterii na antymetabolity – sulfonamidy
Szczepy bakteryjne mogą uodpornić się na leki tej grupy poprzez uzyskanie na drodze gene-
tycznej zdolności do nadprodukcji właściwego metabolitu. Antymetabolit nie jest wówczas zdolny
konkurować z obficie produkowanym związkiem, traci więc swoje przeciwdrobnoustrojowe właści-
wości. Kolejnym mechanizmem odporności na antymetabolity jest zdolność bakterii do uruchomienia
nowych procesów metabolicznych, które są analogiczne do procesów zakłóconych oddziaływaniem
leków. Tym sposobem braki w zakresie produkcji substancji niezbędnych do życia bakterii podlegają
uzupełnieniu na drodze innych procesów komórkowych. Trzecim, najczęściej wykrywanym mechani-
zmem oporności jest modyfikacja enzymu – syntazy, będącego celem leków. Lek antybakteryjny nie
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

88
rozpoznaje nowej, zmodyfikowanej cząstki enzymu, a więc nie traci on swoich funkcji metabolicz-
nych.
Mechanizm aktywnego usuwania leku z komórki
Jest uwarunkowany obecnością w błonie białek transportowych, które pełnią funkcję pomp
usuwających leki i inne substancje chemiczne z komórki bakteryjnej na drodze aktywnej, tzn. z wyko-
rzystaniem energii ATP lub siły protonomotorycznej. Pompy odznaczają się swoistością budowy,
swoistością substratową oraz zróżnicowanym mechanizmem działania, stąd też należą one do różnych
klas, oznaczonych symbolami: MFS, MATE, SMR, RND, ABC. Swoistość substratowa pompy polega
na zdolności do wyrzucania tylko jednej lub kilku określonych substancji. Komórka bakteryjna uzy-
skuje wysoki poziom oporności na lek w wyniku genetycznie uwarunkowanej nadekspresji białek
transportowych. Wówczas mechanizm efflux staje się szczególnie wydajny.
Lekooporność grzybów
W zakażeniach grzybiczych stosowane są leki sklasyfikowane do kilku grup, z których naj-
ważniejsze to:
Polieny (amfoterycyna B, natamycyna, nystatyna) – hamują one biosyntezę błony komórkowej.
Szczepy grzybów niewrażliwe na polieny odznaczają się zmniejszoną zawartością celów działania
leku, tj. steroidów w błonie, oraz ich zmienioną strukturą.
Azole (imidazole: ketokonazol, klotrimazol, triazole: flukonazol, itrakonazol, worikonazol) – ha-
mują biosyntezę błony komórkowej. Szczepy oporne na nie odznaczają się ekspresją pompy
(efflux) usuwającą lek z komórki oraz posiadają genetycznie zmieniony, niewrażliwy na działanie
leku enzym uczestniczący w syntezie błony komórkowej – 14-α-demetylazę lanosterolu. Naturalną
opornością na flukonazol odznaczają się gatunki Candida glabrata i Candida kruzei.
5-fluorocytozyna podawana w skojarzeniu z amfoterycyną B hamuje syntezę kwasów nukleino-
wych. Oporność jest spowodowana utrudnieniem wychwytu leku do komórki grzyba lub zmianami
metabolitycznymi.
Echinokandyny (kaspofungina, mikafungina, anidulafungina) – to nowa generacja leków przeciw-
grzybiczych stosowana w ciężkich zakażeniach. Leki hamują enzym – syntazę ß-glukanu – który
nadzoruje syntezę ściany komórkowej grzybów. Oporność na echinokandyny może być spowodo-
wana zmienioną strukturą tego enzymu, o obniżonym powinowactwie do echinokandyn.
Pochodne alliloamin (terbinafina, naftifina) hamują enzym – epoksydazę skwalenową – biorącą
udział w syntezie ergosterolu, co prowadzi do destrukcji błony komórkowej grzybów. W mechani-
zmie oporności na leki tej grupy podkreśla się znaczenie pomp (efflux) oraz mutację epoksydazy.
W związku z coraz częściej występującym zjawiskiem oporności drobnoustrojów na więcej
niż jedną grupę antybiotyków, wprowadzono następujące definicje wielolekooporności drobnoustro-
jów:
Wielolekooporność MDR (multidrug-resistant) to niewrażliwość na co najmniej jeden lek z każdej
z trzech lub więcej klas antybiotyków aktywnych wobec danego gatunku.
Rozszerzona oporność XDR (extensively-drug-resistant) to niewrażliwość na co najmniej jeden lek
z niemal wszystkich, z wyjątkiem dwóch lub mniej klas antybiotyków aktywnych wobec danego
gatunku.
Całkowita oporność PDR (pandrug-resistant) to niewrażliwość na wszystkie antybiotyki we
wszystkich klasach antybiotyków aktywnych wobec danego gatunku drobnoustroju.
Szczepy drobnoustrojów ze stwierdzonymi mechanizmami oporności charakteryzują się zwy-
kle zwiększoną wirulencją i są poważnym zagrożeniem dla pacjenta. Izolacja lekoopornych patoge-
nów podlega szczególnemu nadzorowi epidemiologicznemu przez Inspekcję Sanitarną. Szczepy z naj-
bardziej niebezpiecznymi mechanizmami lekooporności są umieszczone w wykazie tzw. czynników
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

89
alarmowych (alert patogenów). Rozporządzenie Min. Zdrowia z 23.12.2011 r. (Dz.U.2011.11.294.1741)
w sprawie: listy czynników alarmowych, rejestrów zakażeń szpitalnych i czynników alarmowych oraz
raportów w bieżącej sytuacji epidemiologicznej szpitala definiuje czynnik alarmowy jako biologiczny
czynnik chorobotwórczy o szczególnej zjadliwości lub oporności. Spośród drobnoustrojów zamiesz-
czonych w tym wykazie znajdują się następujące szczepy bakterii i grzybów z mechanizmami oporno-
ści: Staphylococcus aureus MRSA, VISA, VRSA lub oporny na oksazolidynony, Enterococcus spp.
VRE lub oporny na oksazolidynony, pałeczki Enterobacteriaceae – ESBL, AmpC, KPC, lub oporne
na karbapenemy lub inne 2 grupy leków, lub polimyksyny, Pseudomonas aeruginosa oporna na kar-
bapenemy lub 2 inne grupy leków lub polimyksyny, Acinetobacter spp. oporny na karbapenemy lub 2
inne grupy leków, lub polimyksyny, Streptococcus pneumoniae oporny na penicylinę i cefalosporyny
III, Candida spp. oporna na azole, kandyny.
Wystąpienie u osoby hospitalizowanej czynnika alarmowego podlega obowiązkowej rejestra-
cji i archiwizacji, obowiązuje ponadto sporządzanie okresowych raportów i przekazywane ich do In-
spekcji Sanitarnej. Coraz większą uwagę przywiązuje się do rozpoznawania stopnia skolonizowania
populacji pozaszpitalnej florą potencjalnie patogenną z mechanizmami oporności na leki przeciw-
drobnoustrojowe. Transmisja tych bakterii między środowiskiem pozaszpitalnym a szpitalem jest
udowodniona i stanowi zagrożenie dla pacjentów. Ocenia się, iż około 30% populacji pozaszpitalnej
może być nosicielami Staphylococcus aureus, w tym około 0,8% to nosiciele szczepów MRSA. Re-
zerwuarem wieloopornych szczepów są często domy opieki społecznej. Badania rezydentów i pra-
cowników tych placówek (pobierane są wymazy z nosogardzieli i odbytu) wykazują znaczny poziom
kolonizacji patogenami z mechanizmami typu MRSA, KPC, ESBL, VRE. Zwierzęta także stanowią
niszę ekologiczną dla wielu lekoopornych szczepów drobnoustrojów. Antybiotyki są szeroko stoso-
wane nie tylko w celach leczniczych w weterynarii, ale też w hodowli zwierząt. Podawanie zwierzę-
tom przez dłuższy czas małych dawek wpływa na zwiększenie ich masy i jednocześnie sprzyja selek-
cji szczepów opornych. FA–MRSA, tj. metycylinooporne szczepy Staphyl
ococcus aureus związane ze
środowiskiem hodowlanym zwierzęcym, są izolowane ze świń, bydła, brojlerów, przy czym wskazuje
się ich wrażliwość na antybiotyki z innych grup. Występuje zwykle oporność jedynie na tetracykliny.
Kolonizację tymi szczepami stwierdza się zazwyczaj u 23–38% ludzi mających kontakt ze zwierzęta-
mi hodowlanymi, zwierzętami domowymi oraz wśród weterynarzy. Zakażenia natomiast występują
sporadycznie. W hodowlach roślin także szeroko stosowane są środki przeciwdrobnoustrojowe i tym
sposobem lekooporne szczepy przedostają się do żywności, powodując rozszerzanie się nosicielstwa
w populacji ludzkiej. Badania mikrobiologiczne gleby z terenów ekologicznych, uprawnych, miej-
skich czy zdegradowanych, także badania wód powierzchownych – rzek i jezior – oraz ścieków ko-
munalnych wykazują obecność komórek bakterii z genami lekooporności. Ze ścieków miejskich oraz
szpitalnych są hodowane najczęściej lekooporne pałeczki Enterobacteriaceae oraz nie należące do
tego szczepu. W wodzie, poniżej zrzutu ścieków stwierdza się zawsze zwiększoną częstość izolacji
szczepów bakteryjnych z genami oporności w porównaniu z wodą powyżej tego zrzutu.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

90
2. Zakażenia szpitalne – wiadomości ogólne
(Mariola Kunicka)
Z definicji zakażenie szpitalne występuje w związku z udzieleniem świadczenia zdrowotnego,
w przypadku gdy choroba w czasie pobytu w szpitalu nie była w okresie wylęgania lub gdy wystąpiła
w związku z udzieleniem tego świadczenia w okresie nie dłuższym niż najdłuższy okres jej wylęgania
(np. WZW typu B, WZW typu C). Z punktu widzenia prawa za zakażenie szpitalne uznaje się takie,
które wystąpiło w okresie 48–72 godzin od przyjęcia na oddział, natomiast w przypadku zakażeń
o długim okresie wylęgania (WZW typu B, WZW typu C, AIDS, gruźlica) przyjmuje się okres od
dwóch tygodni do wielu lat. Zatem ramy czasowe są zmienne. U noworodków za zakażenie szpitalne
uznaje się takie, które wystąpiło po upływie 48 godzin od porodu, a przed porodem u matki nie
stwierdzono jego objawów. W przypadku zakażenia miejsca operowanego, czyli rany operacyjnej,
u pacjentów niezakażonych przed zabiegiem, za zakażenie szpitalne uznaje się takie, które wystąpiło
do miesiąca od jego wykonania, a jeżeli pacjent ma wszczepione ciało obce (np. implant ortopedyczny
lub naczyniowy) w ciągu roku od tej procedury.
Źródła zakażeń szpitalnych
Źródłem zakażeń szpitalnych mogą być patogeny egzogenne, czyli pochodzące od innego cho-
rego, z otoczenia szpitalnego, lub endogenne, czyli takie, których źródłem jest sam chory. Wyróżnia
się również tzw. zakażenia endogenne późne, rozwijające się w czasie przedłużonego pobytu pacjenta
w szpitalu. Im krótszy jest okres przedoperacyjny, tym mniejsze prawdopodobieństwo wystąpienia
zakażenia endogenną florą szpitalną. Jeżeli u chorego operowanego natychmiast po przyjęciu do szpi-
tala rozwinie się zakażenie szpitalne, to prawdopodobnie jest ono wywołane przez własne drobnou-
stroje, które stanowiły florę fizjologiczną pacjenta w warunkach domowych. Takie zakażenie okre-
ślamy jako zakażenie endogenne wczesne. Drobnoustroje własne chorego są wrażliwe na większość
antybiotyków, a zatem zakażenia przez nie wywoływane łatwiej się leczy. Drobnoustroje szpitalne,
czyli pochodzące ze środowiska, w którym stosuje się różne antybiotyki i środki dezynfekcyjne, są
oporne na wiele antybiotyków i chemioterapeutyków, a więc o wiele trudniejsze w leczeniu. Źródło
zakażeń szpitalnych o etiologii egzogennej stanowią drobnoustroje pochodzące ze środowiska lub od
innego pacjenta, które – ze względu na sposób przenoszenia – nazywamy krzyżowymi. Przenoszone
są za pośrednictwem rąk personelu medycznego (najważniejsze źródło zakażeń szpitalnych egzogen-
nych) drogą kropelkową lub poprzez bezpośredni kontakt z zakażonym pacjentem, jego wydzielinami
lub/i wydalinami (tzw. zakażenie przez ciągłość). Ważnym rezerwuarem patogenów są przedmioty
znajdujące się w zasięgu pacjenta: łóżko, pościel, stolik, kubki, baseny, zabawki na oddziałach pedia-
trycznych, inkubatory. Istotną rolę odgrywa środowisko wilgotne: nawilżacze, miski do mycia, base-
ny, urządzenia sanitarne i zlewy.
Przyczyną zakażeń endogennych jest własna flora pacjenta bytująca na skórze i błonach ślu-
zowych, w przewodzie pokarmowym, drogach oddechowych itd.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

91
Zakażenia szpitalne, ze względu na postać kliniczną, dzielimy na:
zakażenia układu moczowego
zakażenia przewodu pokarmowego
zakażenia ośrodkowego układu nerwowego
zapalenia płuc
zapalenie otrzewnej
zakażenia ran operacyjnych
zakażenia u chorych onkologicznych
zakażenia u chorych po transplantacji (immunosupresyjnych)
zakażenia u chorych po wszczepieniu protez zastawkowych
zakażenia związane z terapią dożylną
bakteriemię i wstrząs septyczny
Zakażenia układu moczowego (ZUM)
Występują najczęściej wśród wszystkich zakażeń szpitalnych. Najczęściej dochodzi do nich
na drodze wstępującej od zewnętrznego ujścia cewki moczowej moczowodem do pęcherza moczowe-
go i nerek. Możliwe jest także zakażenie drogą krwiopochodną oraz limfatyczną. U pacjentów ambu-
latoryjnych bardzo często ma ono charakter endogenny, natomiast u pacjentów hospitalizowanych
zarówno endo-, jak i egzogenny. Zakażenia układu moczowego przyjmują postać zakażenia cewki
moczowej, moczowodu, pęcherza moczowego oraz nerek. Ze względu na budowę anatomiczną, czę-
ściej dochodzi do nich u kobiet. Profil bakterii, które są za nie odpowiedzialne, w większości zależy
od specyfiki oddziału. W większości oddziałów zachowawczych i zabiegowych czynnikiem dominu-
jących jest E. coli. Na oddziałach urologicznych czynnikiem dominującym są Pseudomonas i Proteus,
na Oddziałach Intensywnej Opieki Medycznej (OIOM) Enterobacter i Serratia, natomiast na oddzia-
łach niemowlęcych Klebsiella pneumoniae. Do czynników sprzyjających zakażeniom układu moczo-
wego zaliczamy przede wszystkim cewnikowanie i inne zabiegi wykonywane na drogach moczowych.
Zakażenia przewodu pokarmowego
Zakażenia przewodu pokarmowego nabyte w szpitalu należą do rzadkich postaci. Wśród
czynników etiologicznych główną rolę odgrywają pałeczki Salmonella, Shigella, Campylobacter, Yer-
sinia oraz enteropatogenne szczepy E. coli. Najczęstszym źródłem salmonelloz w szpitalu jest zakażo-
ny pokarm, jednak istotne znaczenie mają również zakażenia przeniesione od innego chorego, w tym
przez ręce personelu medycznego. Źródłem zakażenia pokarmów w kuchni szpitalnej mogą również
być jej pracownicy. Istotną rolę odgrywa nosicielstwo pałeczek Salmonella. Zakażenia szpitalne
przewodu pokarmowego o etiologii Salmonella występują często na oddziałach dziecięcych, szcze-
gólnie w krajach rozwijających się. Wśród przyczyn epidemii szpitalnych zatruć pokarmowych ważną
rolę odgrywa również toksyna gronkowcowa pochodząca od enterotoksycznych szczepów gronkow-
ców złocistych. Ich przebieg jest najczęściej gwałtowny i występuje krótko po spożyciu zakażonego
toksyną pokarmu. Innym ważnym zatruciem szpitalnym związanym ze spożyciem zakażonego po-
karmu jest listerioza. Patogeny te mają zdolność namnażania się w temperaturze lodówki, a u osób
z obniżoną odpornością są odpowiedzialne za wysoką śmiertelność. Należy wspomnieć, że do waż-
nych czynników zakażeń szpitalnych przewodu pokarmowego zaliczamy również Helicobacter pylori,
które przenoszone jest przez aparaturę diagnostyczną, np. endoskopy wykorzystywane w gastroskopii.
Zapobieganie zakażeniom szpitalnym przewodu pokarmowego polega przede wszystkim na
uświadomieniu faktu, że są one przenoszone drogą feralno-oralną.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

92
Zakażenia ośrodkowego układu nerwowego
Należą do rzadkich postaci zakażeń szpitalnych. Do form klinicznych zakażeń układu nerwo-
wego zaliczamy: zakażenia rany chirurgicznej, zakażenia drenów komorowych oraz ropnie mózgu.
Czynnikami ryzyka zwiększającymi prawdopodobieństwo wystąpienia zakażenia są: przerwanie cią-
głości skóry, kości czaszki, opon, otwarcie zatok przynosowych, wszczepienie implantu, wyciek płynu
mózgowo-rdzeniowego, punkcja lędźwiowa, urazy i złamania podstawy czaszki lub kości twarzy oraz
wcześniactwo z niską masą urodzeniową. Do czynników ryzyka związanych z zabiegami neurochirur-
gicznymi należą: rodzaj operacji, przygotowanie chorego do zabiegu, czas operacji, profilaktyka anty-
biotykowa, typ operacji, jej miejsce, przestrzeganie zasad aseptyki. Do czynników zależnych od cho-
rego zaliczamy: wiek, stan odżywienia, choroby podstawowe, cukrzycę, obecność ognisk zakażenia
oraz czas pobytu chorego na oddziale przed operacją.
Zakażenia chirurgiczne
Standaryzowana definicja zakażenia miejsca operowanego opiera się na kryteriach anatomicz-
nych, dlatego wyodrębniono trzy grupy zakażeń:
powierzchowne zakażenia rany chirurgicznej (operacyjnej),
głębokie zakażenia rany chirurgicznej (operacyjnej),
zakażenie narządu lub jamy ciała (przestrzeni).
Zakażenia miejsca operowanego stanowią około 14–16% wszystkich zakażeń szpitalnych na
świecie. Według Polskiego Towarzystwa Zakażeń Szpitalnych jest to 14% ogólnej liczby zakażeń
szpitalnych, w tym 35% na oddziałach chirurgicznych. W przeliczeniu na 1 łóżko chirurgiczne koszt
leczenia takiej osoby wynosi około 10 000 PLN rocznie oraz dodatkowo 7 osobodni straconych z po-
wodu braku możliwości przyjęcia i hospitalizacji nowego pacjenta. Do czynników zwiększających
ryzyko wystąpienia tych zakażeń zaliczamy:
relacja pacjent – czynnik chorobotwórczy (chirurg, środowisko),
przebieg operacji (typ zabiegu, okołooperacyjna profilaktyka antybiotykowa, czas trwania operacji,
golenie przed zabiegiem),
stan ogólny pacjenta (wskaźnik ASA),
stopień sprawności technicznej chirurga.
Istnieje ścisła zależność pomiędzy miejscem operacji a prawdopodobieństwem wystąpienia
określonego patogenu:
kardiochirurgia: Staphylococcus aureus, gronkowce koagulazoujemne,
neurochirurgia: Staphylococcus aureus, gronkowce koagulazoujemne,
chirurgia piersi: Staphylococcus aureus, gronkowce koagulazoujemne,
chirurgia okulistyczna: Staphylococcus aureus, gronkowce koagulazoujemne, paciorkowce, pa-
łeczki Gram-ujemne,
ortopedia: Staphylococcus aureus, gronkowce koagulazoujemne, pałeczki Gram-ujemne,
torakochirurgia: Staphylococcus aureus, gronkowce koagulazoujemne, Streptococcus pneumo-
niae, pałeczki Gram-ujemne,
głowa i szyja (z otwarciem przewodu pokarmowego lub oddechowego): Staphylococcus aureus,
paciorkowce, anaeroby z górnego odcinka przewodu pokarmowego,
ginekologia i położnictwo: pałeczki Gram-ujemne, enterococci, paciorkowce, anaeroby,
urologia: pałeczki Gram-ujemne.
Indeks ryzyka wystąpienia zakażenia miejsca operowanego to zmienne stanowiące realne
wskaźniki ryzyka, do których zaliczamy: czas trwania operacji (znacznie przekraczający średni czas
tego typu operacji), podatność pacjenta operowanego na wystąpienie zakażenia (skala ASA), kategoria
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

93
zabiegu, stopień skażenia mikrobiologicznego miejsca operowanego (rany powstałe w czasie operacji
w polu brudnym lub skażonym), technika klasyczna w operacjach brzucha, przyjęcia nagłe w zabie-
gach neurochirurgicznych.
Rodzaje ran z uwzględnieniem wskaźnika zakażeń:
Rany czyste powstają w przebiegu zabiegów operacyjnych, w czasie których w obrębie operowa-
nych tkanek nie stwierdza się cech stanu zapalnego, ani nie otwiera się światła dróg oddechowych,
rodnych, moczowych i przewodu pokarmowego (wskaźnik zakażeń 2,1%).
Rany czysto-skażone powstają w trakcie operacji, podczas których doszło w sposób kontrolowany
chirurgicznie do otwarcia światła dróg oddechowych, rodnych, moczowych, żółciowych i przewo-
du pokarmowego (wskaźnik zakażeń 3,3%).
Rany skażone to rany urazowe opracowane do 6 godzin od ich powstania oraz powstałe w trakcie
operacji w polu czysto-skażonym, w których podczas zabiegu wydostała się znaczna ilość treści,
głównie z przewodu pokarmowego. Do ran skażonych należą rany czyste i czysto-skażone, jeśli
w czasie zabiegu doszło do istotnego naruszenia zasad sterylności chirurgicznej (wskaźnik zakażeń
6,4%).
Rany brudne to wszystkie zastarzałe rany urazowe oraz operacje w przebiegu jawnego klinicznie
zakażenia (wskaźnik zakażeń 7,1%).
Zapobieganie zakażeniom pooperacyjnym polega na:
skróceniu czasu pobytu pacjenta w szpitalu przed operacją,
wyrównaniu pacjentów cukrzycowych,
wcześniejszym leczeniu zakażeń w warunkach ambulatoryjnych,
goleniu pacjenta bezpośrednio przed zabiegiem,
właściwym myciu i odkażaniu skóry przed operacją,
właściwej ochronie pola operacyjnego,
unikaniu niedokrwienia, zapewnieniu optymalnej kondycji rany w czasie operacji,
stosowaniu profilaktyki antybiotykowej.
Istotnym problemem zakażeń miejsca operowanego jest zajęcie rany szczepami MRSA (mety-
cylinooporne szczepy gronkowców szpitalnych), które mają charakter endemiczny i są bardzo trudne
w leczeniu. Inny ważny problem stanowią zakażenia ran oparzeniowych, które występują u wszyst-
kich pacjentów z głębokimi i rozległymi oparzeniami.
Zakażenia dróg oddechowych są trzecią pod względem częstości postacią zakażeń występują-
cą u chorych na oddziałach zabiegowych, natomiast na OIOM-ach stwierdza się je najczęściej.
W warunkach szpitalnych wyróżnia się dwie postacie zapaleń płuc: u chorych po zabiegach operacyj-
nych na klatce piersiowej, nadbrzuszu, głowie i szyi oraz u chorych inkubowanych, a także sztucznie
wentylowanych. Do czynników wywołujących szpitalne zapalenia płuc należą: Streptococcus pneu-
moniae, Haemphilus influenzae, Moraxella catarrhalis, Staphylococcus aureus, Enterobacteriaceae,
pałeczki Gram-ujemne, beztlenowce, drożdżaki, inne grzyby oraz wirusy.
Do czynników ryzyka wystąpienia zapalenia płuc u chorych hospitalizowanych zaliczamy:
ryzyko aspiracji wydzieliny: zaburzenia świadomości chorego,
duża objętość aspirowanej wydzieliny,
przewlekła choroba obturacyjna,
palenie tytoniu, alkoholizm,
porażenie nerwowo-mięśniowe,
wiek chorego,
niedożywienie, inne choroby podstawowe.
Zapobieganie szpitalnym zapaleniom płuc ma na celu istotne zmniejszenie częstości ich wy-
stępowania poprzez szybkie identyfikowanie chorych z grupy ryzyka, wprowadzanie ćwiczeń odde-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

94
chowych i przywrócenie odruchu kaszlu, podawanie środków przeciwbólowych, krótką hospitalizację,
zapobieganie transmisji patogenów od innych chorych i personelu, zmniejszenie czynników koloniza-
cji i właściwą dekontaminację sprzętu przez dezynfekcję wysokiego stopnia.
Fenotypowe cechy szczepów bakteryjnych:
Oporność na chemioterapeutyki rutynowo stosowane w szpitalu.
Oporność na liczne środki dezynfekcyjne stosowane w szpitalu.
Oporność na sole metali ciężkich, np. rtęć, kadm (S. aureus, P. aeruginosa).
Charakterystyczne typy bakteriofagowe (S. aureus, Klebsiella pneumoniae, P. aeruginosa).
Charakterystyczne typy serologiczne (P. aeruginosa, E. coli, S. aureus).
Częstsza zdolność do wytwarzania niektórych toksyn.
Zdolność do wytwarzania bakteriocyn i/lub charakterystyczne typy bakteriocynowe (S. aureus,
E. coli, P. aeruginosa, K. pneumoniae).
Brak zdolności do wytwarzania charakterystycznych barwników (Serratia marcescens, P. aerugi-
nosa).
Właściwości adhezyjne uzależnione od obecności fimbrii lub innych struktur oraz substancji po-
wierzchniowych komórki bakteryjnej.
Wytwarzanie sideroforów zdolnych do wychwytywania żelaza z transferrytyny.
Większa oporność na aktywność dopełniacza i fagocytozę.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

IV. WIRUSOLOGIA
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

97
1. Wirusologia ogólna
(Dagmara Jaworska)
Słowo virus wywodzi się z języka łacińskiego i oznacza jad lub truciznę, doskonale odzwier-
ciedlając chorobotwórczość tych mikroorganizmów. Pod koniec XIX wieku pojęcie to odnoszono do
zarazków przesączalnych przez filtry, jako czynników chorobotwórczych, znacznie mniejszych od
bakterii. Właściwości biologiczne i fizykochemiczne wirusów sprawiają, że znajdują się one na po-
graniczu świata organizmów żywych i martwej materii.
Ponieważ nie są zdolne do samodzielnego namnażania się, aby doszło do replikacji, konieczne
jest zakażenie komórki gospodarza. Komórka wrażliwa na zakażenie danym typem wirusa, posiadają-
ca na swojej powierzchni receptory umożliwiające jego wniknięcie oraz przeprowadzenie pełnego
cyklu replikacji, zwana jest komórką permisywną.
1.1. Struktura wirusów
Wirusy są bezkomórkowymi pasożytniczymi formami życia, które nie posiadają własnego
metabolizmu ani nie mają zdolności do samodzielnego wzrostu czy rozmnażania. Najmniejszą aktyw-
ną cząstką zakaźną wirusa jest wirion zawsze zbudowany z kapsydu i kwasu nukleinowego. Kwas
nukleinowy wraz z kapsydem tworzą nukleokapsyd. Niektóre wirusy mogą być otoczone dodatkową
osłonką lipidową, którą uzyskują z błony komórkowej podczas procesu pączkowania.
Kwasy nukleinowe. Wirusy zawierają w swojej cząstce zawsze tylko jeden typ kwasu nuklei-
nowego; tzn. deoksyrybonukleinowy (DNA) lub rybonukleinowy (RNA). Ta cecha odróżnia wirusy
od innych znanych komórkowych form życia, które posiadają zawsze oba te typy. Wirusowe genomy
mogą mieć różną postać, co odgrywa znaczącą rolę w systematyce tych drobnoustrojów. DNA lub
RNA będące genomem może występować u tych organizmów w formie zarówno jednoniciowej, jak
i dwuniciowej. Struktura kwasu nukleinowego u większości wirusów jest liniowa, przy czym wyjątek
stanowią papowawirusy, które mają genom kolisty. Genom wirusowy najczęściej tworzy jedną całość,
ale może również występować w postaci kilku segmentów. Przykład stanowią tutaj wirusy grypy,
których genom składa się z ośmiu części RNA.
Kapsyd. Płaszcz białkowy wirusa, określany jako kapsyd, zbudowany jest z powtarzających
się jednostek białkowych zwanych kapsomerami. Jeden kapsomer składa się z odpowiednio zorgani-
zowanych łańcuchów polipeptydowych. Funkcją kapsydu jest ochrona kwasu nukleinowego znajdują-
cego się wewnątrz wirionu oraz udział w adsorpcji i wnikaniu wirusa do komórki gospodarza.
W zależności od systemu ułożenia kapsomerów w przestrzeni, wirusy podzielono na:
Wirusy o symetrii helikalnej – posiadają śrubowato zwinięty nukleokapsyd, wyglądem przypomi-
nają długie pałeczki. Do przedstawicieli tej grupy należą wirusy grypy, paragrypy i wścieklizny
(ryc. 1A).
Wirusy o symetrii ikozaedralnej (kubicznej) – charakteryzują się tym, że kapsomery tworzą bryłę
foremną, o uporządkowanej strukturze. Nazwa tego typu symetrii pochodzi od ikosaedru, czyli
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż
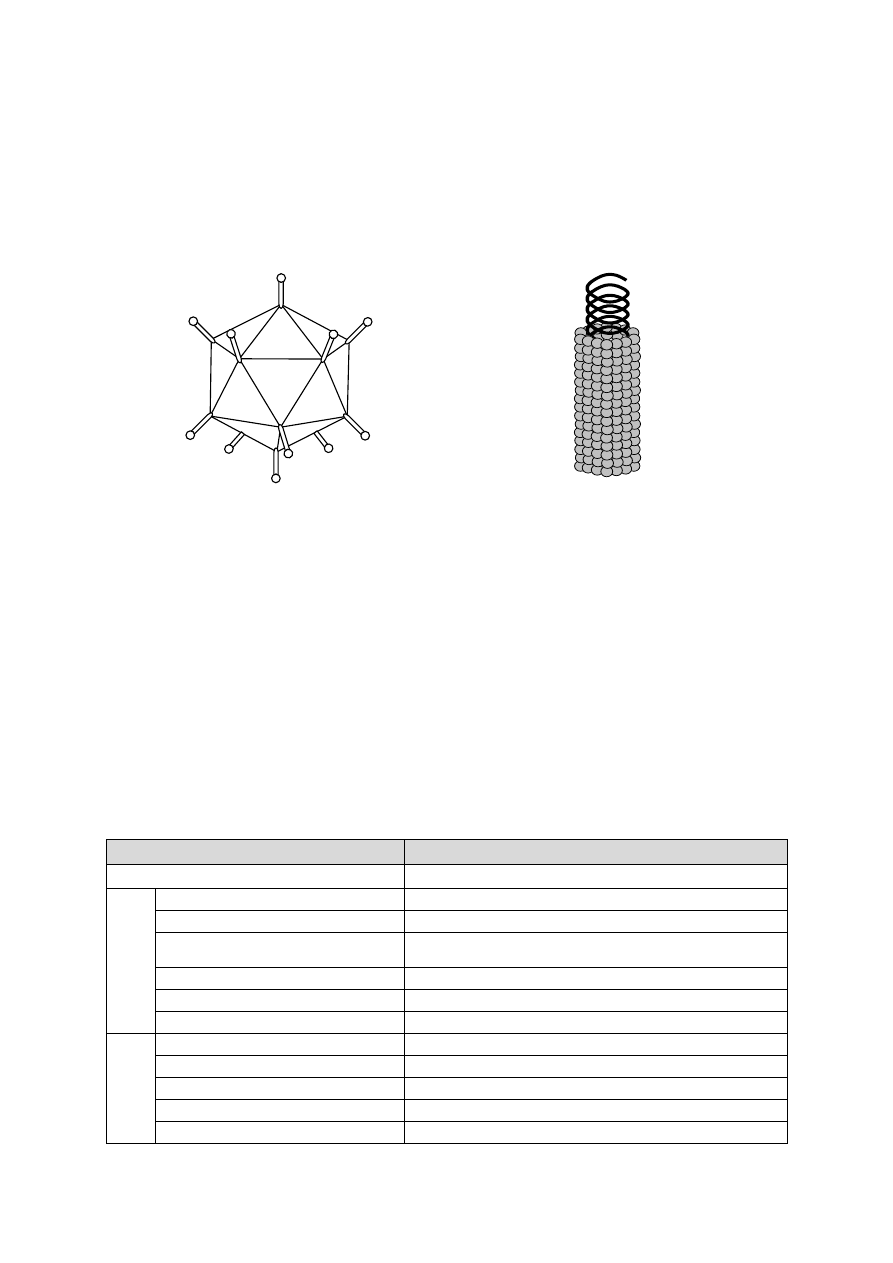
98
dwudziestościanu foremnego, który jest bryłą o 20 takich samych trójkątnych ścianach i 12 krawę-
dziach. Wiriony charakteryzujące się symetrią kubiczną mogą tworzyć różne formy wielościanów,
jednakże najczęściej jest to właśnie dwudziestościan foremny. Wszystkie wirusy DNA z wyjątkiem
pokswirusów mają symetrię ikozaedralną (ryc. 1B).
Wirusy o symetrii złożonej – mają tak skomplikowaną budowę, że nie można ich zaliczyć do żad-
nej z grup wymienionych powyżej. Należy do nich m.in. wirus ospy prawdziwej klasyfikowany do
grupy pokswirusów.
Ryc. 1A. Symetria kubiczna.
Ryc. 1B. Symetria helikalna.
Osłonka. U niektórych wirusów na powierzchni nukleokapsydu występuje podwójna warstwa
lipidowa pochodząca z błony komórkowej gospodarza, nabywana przez wirus w czasie późnych faz
replikacji. Przykładem ikozaedralnego wirusa posiadającego osłonkę jest wirus opryszczki, natomiast
helikalnego np. wirus grypy. Ponadto wirusy osłonkowe posiadają na swojej powierzchni wypustki
glikoproteinowe, które biorą udział w przyleganiu wirionu do receptorów komórkowych i mogą mieć
właściwości enzymatyczne oraz antygenowe.
1.2. Klasyfikacja wirusów
W klasyfikacji wirusów wykorzystuje się takie kryteria, jak typ kwasu nukleinowego, liczba
nici, polarność kwasu nukleinowego oraz symetria nukleokapsydu.
Tabela I. Klasyfikacja najważniejszych wirusów DNA i RNA (podział na rodziny)
Wirusy
Przykłady wirusów
1
2
DNA
Adenoviridae (Adenowirusy)
ludzki adenowirus
Hepadnaviridae (Hepadnawirusy)
wirus zapalenia wątroby typu B
Herpesviridae (Herpeswirusy)
wirusy opryszczki, wirus cytomegalii, wirus Epsteina-Barr,
wirus ospy wietrznej–półpaśca
Papovaviridae (Papowawirusy)
wirus brodawczaka ludzkiego
Parvoviridae (Parwowirusy)
ludzki parwowirus B19
Poxviridae (Pokswirusy)
wirus ospy prawdziwej
RNA
Bunyaviridae (Buniawirusy)
wirus Hantaan
Calciviridae (Kalciwirusy)
wirus Norwalk, wirus zapalenia wątroby typu E
Coronaviridae (Koronawirusy)
koronawirus
Filoviridae (Filowirusy)
wirus Ebola
Flaviviridae (Flawiwirusy)
wirus zapalenia wątroby typu C
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

99
cd. tab. I
1
2
Orthomyxoviridae (Ortomyksowirusy) wirusy grypy A i B
Paramyxoviridae (Paramyksowirusy) wirus odry, wirus nagminnego zapalenia ślinianek przyusz-
nych (świnki), wirus paragrypy, RSV
Picornaviridae (Pikornawirusy)
wirusy Coxackie A i B, poliowirus, wirusy ECHO, rinowi-
rusy, wirus zapalenia wątroby typu A
Reoviridae (Reowirusy)
rotawirusy
Retroviridae (Retrowirusy)
ludzkie wirusy upośledzenia odporności: HIV-1, HIV-2
Rhabdoviridae (Rabdowirusy)
wirus wścieklizny
Togaviridae (Togawirusy)
wirus różyczki
W zależności od typu komórki, w której wirus może ulegać replikacji, wyróżnia się podsta-
wowe grupy:
wirusy zakażające komórki bakterii (bakteriofagi),
wirusy roślinne,
wirusy zwierzęce.
1.3. Replikacja wirusów zwierzęcych
Wirusy mogą się namnażać tylko i wyłącznie w komórkach gospodarza, wykorzystując w tym
celu enzymy niezbędne do syntezy kwasów nukleinowych i białek. Całkowita zależność replikacji
wirusowej od metabolizmu komórki tłumaczy, dlaczego określone wirusy mogą zakażać tylko niektó-
re typy komórek. Każdy etap replikacji musi być bowiem dostosowany do metabolizmu komórki za-
każonego gospodarza.
Podstawowymi etapami cyklu replikacyjnego wirusów są kolejno: adsorpcja do powierzchni
komórki, wnikanie, odpłaszczenie, synteza, dojrzewanie i uwalnianie. Po zakażeniu komórki gospoda-
rza, kiedy proces odpłaszczania jest już zakończony, dalsze etapy replikacji odbywają się w jej wnę-
trzu i aż do momentu uwolnienia wirionów potomnych, wirus fizycznie „nie istnieje” poza komórką
gospodarza. Ta faza, w której nie wykrywa się wirionów w otoczeniu komórki, zwany jest fazą eklip-
sy. Ogólny schemat przebiegu infekcji wirusowej przedstawiono na rycinie 2.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż
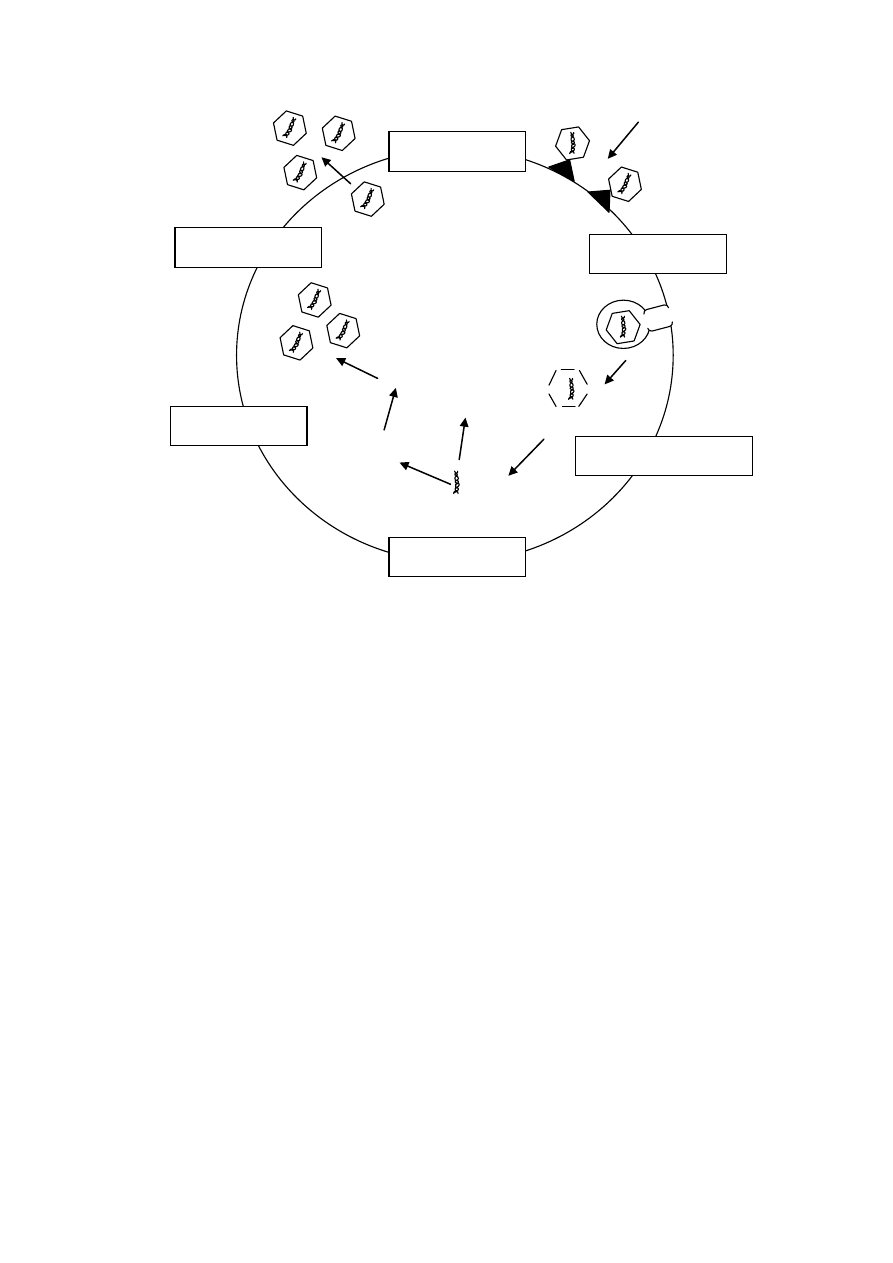
100
Ryc. 2. Ogólny schemat przebiegu infekcji wirusowej.
Rozpoznanie komórki gospodarza
Adsorpcja (przyleganie) jest pierwszą fazą cyklu replikacyjnego każdego wirusa. Proces ten
nie odbywa się w sposób przypadkowy. Opiera się na swoistym oddziaływaniu pomiędzy cząsteczka-
mi na powierzchni wirusa a powierzchnią błony plazmatycznej komórki gospodarza, która zawiera
specyficzne dla wirusa receptory. Ponieważ receptory obecne są w błonie komórkowej w znacznej
ilości, umożliwiają jednoczesne przyleganie setek cząstek wirusowych.
Wnikanie (penetracja)
Po wniknięciu do komórki danego typu wirusa, komórka ta staje się najczęściej oporna na za-
każenie cząstkami innych wirusów. Wnikanie odbywa się za pomocą dwóch głównych mechanizmów:
Fuzja z błoną komórkową – jest sposobem wnikania wirusów posiadających osłonkę i białka fu-
zyjne, które biorą udział w procesie zlewania się błon wirusa i komórki gospodarza. Po fuzji wiru-
sowe nukleokapsydy uwalniane są do cytoplazmy.
Endocytoza z udziałem receptora (wiropeksja) – jest częstszym sposobem wnikania wirusa do ko-
mórki. Wirusy wykorzystują w tym celu proces endocytozy (stosowany do pobierania substancji
odżywczych), czyli naturalną zdolność komórek do pochłaniania dużych cząsteczek. Uwalnianie
wirusa zachodzi na drodze wewnętrznej fuzji wirusowej osłonki z błoną pęcherzyka, w którego
wnętrzu znalazł się pochłonięty wirus.
W
iriony
potomne
A) Adsorpcja
B) Wnikanie
C) Odpłaszczenie
D) Synteza
E) Składanie
F) Uwalnianie
Materiał
genetyczny
Synteza
białek
wczesnych
Synteza
białek
późnych
Replikacja
kwasu
nukleinowego
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

101
Odpłaszczenie kwasu nukleinowego wirusa
Enzymy komórkowe i wirusowe (proteazy) trawią białka kapsydu wirusowego obecnego
w cytoplazmie. Płaszcz białkowy nagich (bezosłonkowych) wirusów, które wniknęły do komórki dro-
gą endocytozy, jest niszczony w kwaśnym środowisku wodniczki (endosomu) lub trawiony przez
proteazy po utworzeniu fagolizosomu. Gdy proces odpłaszczenia zostanie ukończony, oznacza to po-
czątek fazy eklipsy.
Synteza kwasu nukleinowego
Proces syntezy obejmuje replikację (powielenie) kwasu nukleinowego wirusa, a następnie
powstawanie białek wirusowych. Miejsce replikacji wirusowego genomu różni się u poszczególnych
grup wirusów, natomiast synteza białek wirusowych zachodzi zawsze w cytoplazmie. Zwykle
w pierwszej kolejności powstają białka niezbędne w procesie replikacji, a w późniejszej fazie potrzeb-
ne do syntezy wirionów potomnych. Proces replikacji przebiega w nieco odmienny sposób u różnych
grup wirusów, w zależności od tego, czy są to wirusy DNA czy RNA.
W przypadku wirusów DNA w czasie replikacji zachodzą dwa kluczowe procesy: transkryp-
cja, czyli kopiowanie cząsteczki DNA przez enzym zwany DNA-zależną polimerazą RNA w celu
utworzenia komplementarnej cząsteczki RNA, oraz translacja, oznaczająca „przetłumaczenie” infor-
macji zawartej w RNA na język aminokwasów w celu syntezy polipeptydów (białek).
Wśród wirusów RNA obserwuje się różnorodne strategie replikacyjne, w zależności od polar-
ności zawartej w nukleokapsydzie cząsteczki RNA (czyli od tego, czy może być ona bezpośrednio
matrycą do syntezy białek czy nie). Za namnożenie cząsteczek stanowiących materiał genetyczny
odpowiadają z kolei enzymy zwane RNA-zależnymi polimerazami RNA. Najbardziej skomplikowany
cykl replikacyjny występuje u retrowirusów (do których należy ludzki wirus upośledzenia odporności
– HIV). Ich materiałem genetycznym jest RNA, jednakże w procesie replikacji zostaje przepisany na
DNA przez enzym zwany odwrotną transkryptazą. W wyniku tego powstaje DNA, które następnie
zostaje wbudowane do genomu komórki gospodarza.
Dojrzewanie (morfogeneza)
Jest to etap składania wirionów potomnych, czyli umieszczania kwasu nukleinowego we-
wnątrz kapsydu. Aby nowo powstałe wiriony były cząstkami zakaźnymi, muszą zawierać w kapsydzie
kompletną cząsteczkę kwasu nukleinowego. Tworzenie wirusów potomnych oznacza zakończenie
fazy eklipsy.
Uwalnianie wirionów potomnych
Nowo zsyntetyzowane wirusy uwalniane są z komórki gospodarza do otoczenia na drodze
dwóch podstawowych mechanizmów, takich jak:
pączkowanie – jest charakterystyczne dla wirusów osłonkowych; nukleokapsyd łączy się z błoną
plazmatyczną i pączkuje, przesuwając się przez błonę komórkową, aż w końcu powstały pęcherzyk
odrywa się „zabierając ze sobą” fragmenty podwójnej błony lipidowej; w ten sposób powstaje no-
wy wirus;
liza (rozpad) zakażonej komórki – jest to mechanizm uwalniania wirusów bezosłonkowych; pod-
czas tego procesu dochodzi do nieodwracalnego uszkodzenia komórki gospodarza.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

102
1.4. Drogi przenoszenia zakażeń wirusowych
Przenoszenie poziome – przenoszenie zakażenia z człowieka na człowieka. Może zachodzić
kilkoma różnymi drogami:
Droga oddechowa – jest najczęstszym sposobem przenoszenia się wirusów pomiędzy ludźmi. Wi-
rusy rozsiewane są w czasie kichania czy kaszlu osoby zakażonej. Do zakażenia niezbędny jest bli-
ski kontakt między nimi, tak aby doszło do przeniesienia kropelek zawierających wirusy.
Droga fekalno-oralna – kolejny powszechny sposób przenoszenia wirusów, zwłaszcza z grupy
enterowirusów. Wirusy kolonizują układ pokarmowy, a do ich rozprzestrzeniania się dochodzi,
kiedy zostają wydalone wraz z kałem. Wirus może zakazić inne osoby, jeśli dojdzie do zanieczysz-
czenia pokarmu lub wody kałem zawierającym cząstki wirusa.
Droga płciowa – przeniesienie wirusów podczas kontaktów płciowych. Drogą tą przenoszone są
m.in. wirusy: HIV, opryszczki, zapalenia wątroby.
Droga przez skórę – poprzez mechaniczne uszkodzenia czy wszczepienie może również dojść do
zakażenia wirusowego.
Przenoszenie pionowe – przenoszenie wirusa z matki na dziecko. Wirus może zostać przeka-
zany tą drogą na trzech różnych etapach – podczas ciąży poprzez łożysko (m.in. wirus różyczki, cyto-
megalii), w trakcie porodu (m.in. wirus opryszczki) i drogą karmienia naturalnego (m.in. wirus HIV).
Wirusy odzwierzęce – wywołujące zoonozy, czyli zakażenia, w których naturalnym gospoda-
rzem dla wirusa jest zwierzę. Wirusy zwykle przenoszą się poprzez ukąszenie. Należą do nich np.
wirus wścieklizny czy cała grupa arbowirusów, dla których wektorami są ssące krew stawonogi, takie
jak komary.
Typy zakażeń wirusowych
Objawowe – cechuje się występowaniem charakterystycznych dla danego typu schorzenia obja-
wów. Występuje tylko w przypadku, gdy wirus zakazi komórki dla siebie permisywne, które umoż-
liwią przeprowadzenie pełnego cyklu replikacji i wytworzenie wirionów potomnych.
Poronne – występuje w przypadku, gdy wirus nie zakończy swojego cyklu replikacji, ze względu
na śmierć zakażonej komórki gospodarza i nie dojdzie do wytworzenia wirionów potomnych. Do
zakażenia poronnego może dojść, gdy wirus zakazi komórki niepermisywne.
Przetrwałe – jest skutkiem ustalenia się swoistej równowagi pomiędzy wzrostem i metabolizmem
zakażonej komórki a replikacją wirusa. Namnażanie wirusa nie prowadzi do śmierci komórki, ko-
mórka gospodarza jest zdolna do podziału, a komórki potomne również są zakażone wirusem. Pod-
czas zakażenia przetrwałego uwalniane są duże ilości wirionów potomnych.
Latentne – w tym typie zakażenia wirus rozpoczyna replikację, ale zostaje ona zahamowana na
pewnym etapie. Wirus pozostaje w stadium „uśpienia” aż do momentu reaktywacji zakażenia, któ-
ra może nastąpić na skutek jakiegoś bodźca wyzwalającego. Najczęściej dotyczy to wirusów DNA,
np. wirusów opryszczki.
Bezobjawowe (utajone) – zakażenie przebiegające bez objawów choroby.
Przebieg zakażenia wirusowego
Wniknięcie – wrotami zakażenia najczęściej są układ oddechowy, pokarmowy i skóra. Zakażenie
miejscowe to takie, które będzie się utrzymywało w miejscu wtargnięcia czynnika zakaźnego.
Przeważnie jednak w przypadku większości wirusów dochodzi do rozprzestrzenienia się zakażenia
do innych tkanek docelowych.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

103
Rozprzestrzenienie się wirusa – może obejmować tkanki wokół wrót zakażenia, albo cały organizm.
Czas od momentu zakażenia do wystąpienia objawów chorobowych zwany jest okresem inkubacji.
Zależy on od właściwości patogenu i może wahać się od kilku godzin do kilku miesięcy albo nawet
lat. W okresie inkubacji dochodzi do zwiększonego namnażania się wirusa, wystąpienia odpowie-
dzi immunologicznej na zakażenie, a w momencie dostania się wirusów do krążenia (pierwotnej
wiremii) do pojawienia się objawów prodromalnych (zwiastujących właściwą chorobę).
Narządy docelowe – większość wirusów wykazuje swoisty tropizm do konkretnych narządów.
Rodzaj narządu docelowego będzie determinował objawy kliniczne choroby. Tropizm taki jednak
nie jest absolutny, gdyż niektóre wirusy zakażające jedne narządy mogą również atakować inne.
1.5. Diagnostyka zakażeń wirusowych
Ponieważ wirusy nie mają zdolności do wzrostu poza żywą komórką, nie mogą być namnaża-
ne na sztucznych pożywkach. Do ich hodowli i namnażania w warunkach laboratoryjnych konieczne
są żywe układy, takie jak całe organizmy (zarodki kurze lub zwierzęta laboratoryjne) albo hodowle
komórkowe.
Zarodki kurze – rozwijające się zarodki ptasie wykorzystywano do hodowli wirusów już podczas
klasycznych eksperymentów w latach 30. XX w. Mogą być zakażane na różnych etapach rozwo-
jowych, najczęściej wykorzystuje się zarodki 9–15 dniowe. Doprowadza się do zakażenia błony
kosmówkowo-omoczniowej, jamy owodni, omoczni lub woreczka żółtkowego. Po upływie okre-
ślonego czasu z zakażonego jaja pobiera się płyn lub fragment tkanki i bada na obecność wirusów.
Zakażanie zarodków jest obecnie wykorzystywane na skalę przemysłową do namnażania niektó-
rych wirusów (np. grypy), które służą następnie do produkcji szczepionek.
Zwierzęta laboratoryjne – w przeszłości była to jedna z podstawowych metod hodowli wirusów.
Pierwsze szczepionki (np. na wściekliznę) przygotowywano w organizmach zwierząt, wykorzystu-
jąc do tego celu myszy, króliki, psy czy małpy. Obecnie metoda ta jest rzadko używana i prawie
całkowicie została zastąpiona przez inne, bardziej humanitarne metody, takie jak hodowle komór-
kowe.
Hodowle komórkowe – mają za zadanie utrzymać żywe komórki in vitro. Prowadzenie hodowli
komórkowych wymaga ścisłej kontroli środowiska (pH, temperatury, ciśnienia tlenu i dwutlenku
węgla). W czasie hodowli należy również kategorycznie przestrzegać reguł pracy w warunkach ja-
łowych. Wprowadzenie hodowli komórkowych jako rutynowych metod diagnostycznych i badaw-
czych pozwala na generowanie niższych kosztów niż w przypadku wykorzystywania zwierząt la-
boratoryjnych, nie naraża też zwierząt na niepotrzebne cierpienie.
Diagnostyka opiera się na identyfikacji wirusa wywołującego zakażenie (lub jego fragmentów
– specyficznych białek czy materiału genetycznego) albo wykrywaniu reakcji immunologicznej
u pacjenta, który jest zakażony tym wirusem. Wirusy hodowane w warunkach laboratoryjnych rozpo-
znaje się za pomocą następujących metod: wywoływanie efektu cytopatycznego (zmiany w wyglądzie
komórek gospodarza), hemaglutynacja czy hemadsorpcja – wykorzystywane do wykrywania wirusów
posiadających na swej powierzchni hemaglutyniny (np. wirus grypy). Ze względu na znaczny koszt
hodowli i długi okres oczekiwania, zrezygnowano z tych metod diagnostyki.
Metody serologiczne opierają się na badaniu przeciwciał występujących we krwi chorego
w celu identyfikacji wirusa wywołującego określone zakażenie i specyficzną odpowiedź immunolo-
giczną, przy czym ustalenie ogólnego poziomu nie pozwala jeszcze na postawienie rozpoznania. Do-
piero wykonanie testów rozpoznających stężenie swoistych immunoglobulin klas IgM i IgG daje peł-
niejszy obraz sytuacji. Stwierdzenie podwyższonego poziomu IgM świadczy o trwającym lub niedaw-
no przebytym ostrym zakażeniu, zaś podwyższony poziom IgG o zakażeniu przebytym wcześniej.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

104
Wiele z tych technik opiera się na reakcjach serologicznych wirusów lub ich antygenów ze
swoistymi przeciwciałami. Obecnie klasyczne metody serologiczne zostały w większości wyparte
przez nowoczesne oznaczenia (często metodami zautomatyzowanymi), które wykorzystują swoiste
przeciwciała monoklonalne, takie jak:
Immunofluorescencja – próbki zawierające antygeny wirusowe poddaje się reakcji ze swoistą su-
rowicą odpornościową (przeciwciałami). Przeciwciała wyznakowane są znacznikami fluorescen-
cyjnymi, które emitują światło pod mikroskopem fluorescencyjnym.
Metoda immunoenzymatyczna (ELISA) – obecnie jedna z podstawowych metod badawczych
w wielu laboratoriach wirusologicznych. Jest metodą zautomatyzowaną, która oferuje wysoki po-
ziom standaryzacji. Została zaadaptowana do identyfikacji wielu antygenów wirusowych, m.in. wi-
rusa HIV, wirusów zapalenia wątroby czy rotawirusów.
Testy aglutynacji lateksowej – są łatwe i szybkie, nie wymagają skomplikowanego wyposażenia
laboratorium, często wykorzystuje się je jako testy przesiewowe. Metoda opiera się na aglutynacji
(zlepianiu) cząsteczek lateksu opłaszczonych antygenem określonego wirusa, która następuje po
zmieszaniu ze swoistą dla wirusa surowicą.
Wykrywanie genomu wirusowego – szybkie rozpoznanie i szczegółowe informacje na temat wiru-
sa wywołującego dane zakażenie można uzyskać, wykorzystując nowoczesne metody diagnostycz-
ne opierające się na genetyce i biologii molekularnej. Umożliwiają one wykrycie już bardzo nie-
wielkich ilości wirusowego materiału genetycznego w badanych próbkach, a także pozwalają na
uzyskanie wyniku w ciągu kilku godzin. Do takich metod stosowanych w diagnostyce wirusolo-
gicznej oraz w dochodzeniach epidemiologicznych należą: metoda PCR i jej różne warianty,
a także metody oparte na hybrydyzacji DNA z sondami molekularnymi. Wadą pozostaje jednak
wciąż wysoka cena tego typu oznaczeń.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

105
2. Wirusologia szczegółowa
(Ewelina Szliszka)
2.1. Wirusowe choroby wysypkowe
Ostre choroby wirusowe przebiegające z wysypką grudkowo-plamistą
Plamka
To wykwit leżący w poziomie skóry, niewyczuwalny przy dotyku, różniący się od otaczającej
skóry wyłącznie zabarwieniem, o średnicy poniżej 1 cm (większy wykwit to plama).
Grudka
To wykwit wyniosły ponad powierzchnię skóry, wyraźnie odgraniczony od otoczenia, różnią-
cy się od otaczającej skóry spoistością i ustępujący bez pozostawienia śladu.
Odra
Choroba zakaźna wieku dziecięcego wywołana przez paramiksowirusa. Wirus przenosi się
między ludźmi drogą kropelkową lub za pośrednictwem przedmiotów zakażonych wydzieliną dróg
oddechowych. Odra jest chorobą bardzo zakaźną (do zakażenia może dojść nawet poprzez przebywa-
nie w pomieszczeniu, w którym kilkanaście godzin wcześniej była osoba chora). Chorzy zakażają od
okresu prodromalnego do 4 dnia po pojawieniu się wysypki.
Przebieg kliniczny:
Okres inkubacji: 10–20 dni.
Okres prodromalny: kilka dni. Objawy prodromalne to: gorączka, ból głowy, katar, kaszel, zapale-
nie spojówek zwykle ze światłowstrętem, plamki Koplika – patognomoniczne dla odry (objaw cha-
rakterystyczny), białe, drobne plamki na błonie śluzowej policzka.
Okres wysypkowy: wysypka grudkowo-plamista pojawiająca się początkowo na twarzy i klatce
piersiowej, a następnie rozszerzająca się obwodowo (na tułów i kończyny) i utrzymująca się 5 dni.
Grudki mają tendencję do tworzenia skupisk określanych jako girlandy.
Powikłania po zakażeniu wirusem odry: wczesne to zapalenie płuc i pozakaźne ostre zapalenie
mózgu, natomiast późne to podostre stwardniające zapalenie mózgu – przewlekła zwyrodnieniowa
choroba neurologiczna pojawiająca się kilka lat po zakażeniu wirusem odry w wyniku przetrwałego
zakażenia.
Zapobieganie: stosowanie szczepionki.
Różyczka
Choroba zakaźna wieku dziecięcego wywołana przez togawirusa, przenosząca się z człowieka
na człowieka drogą kropelkową poprzez wdychanie zakażonej wydzieliny dróg oddechowych, a także
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

106
z matki na płód przez łożysko. Pacjenci zakażają od 7 dni przed pojawieniem się wysypki do 14 dnia
po jej wystąpieniu.
Przebieg kliniczny:
Okres inkubacji: 12–23 dni.
Okres wysypkowy: choroba rozpoczyna się nagle gorączką i pojawia się wysypka grudkowo-
-plamista początkowo na twarzy (zwłaszcza policzkach) i klatce piersiowej, a następnie rozszerza
się obwodowo, występuje umiarkowana gorączka, powiększenie węzłów chłonnych szyjnych, za-
usznych i podpotylicznych oraz bóle stawów, czasem katar. U około 20% zakażenie ma charakter
bezobjawowy.
Powikłania po zakażeniu wirusem różyczki występują rzadko i obejmują przejściową mało-
płytkowość, bóle i zapalenie stawów, pozakaźne zapalenie mózgu.
Zapobieganie: stosowanie szczepionki.
Różyczka wrodzona – do zakażenia dochodzi przez łożysko. Zakażenie podczas I trymestru
ciąży stanowi największe ryzyko dla płodu, związane z wystąpieniem wad trwałych: małogłowia z
niedorozwojem umysłowym, wad serca, głuchoty, zaćmy lub wad przejściowych: niskiej masy uro-
dzeniowej, skazy małopłytkowej, powiększenia wątroby i śledziony, śródmiąższowego zapalenia płuc.
Może dojść także do samoistnego poronienia.
Mononukleoza zakaźna
Wywołana przez wirusa Epsteina-Barr należącego do herpeswirusów, który zakaża limfocyty
B. Wirus pozostaje latentny przez lata w limfocytach B zakażonych osób. U małych dzieci zakażenie
może mieć przebieg bezobjawowy, natomiast objawy rozwijają się najczęściej u dzieci starszych
i młodzieży. Do zakażenia dochodzi zazwyczaj drogą kropelkową poprzez wydzielinę z dróg odde-
chowych, głównie przez kontakt z jamą ustną. Istnieje możliwość zakażenia wirusem również przez
krew lub kontakt płciowy.
Obraz kliniczny ostrej mononukleozy: ostre zapalenie gardła, powiększenie węzłów chłon-
nych okolicy podżuchwowej, gorączka, delikatna (odropodobna) wysypka grudkowo-plamista.
Przewlekłe zakażenie wirusem Epsteina-Barr jest rozpoznawane, gdy objawy utrzymują się
ponad 6 miesięcy.
Zakażenie cytomagalowirusowe
Wywołane jest przez szeroko rozpowszechniony wirus cytomegalii (CMV) należący do her-
peswirusów. U zdrowych osób w dorosłym wieku najczęściej objawia się zakażeniem z niewielkimi
objawami lub przebiega bezobjawowo. CMV u noworodków i osób z obniżoną odpornością może
wywołać groźną chorobę. Zakażenie szerzy się drogą oddechową, przez krew lub przez kontakt
płciowy. U noworodków może dojść do zakażenia okołoporodowego podczas przechodzenia przez
kanał rodny zakażonej matki. U pacjentów z obniżoną odpornością, zwłaszcza u chorych po wielo-
krotnych przetoczeniach krwi lub po przeszczepie narządu, rozwija się zespół mononukleozopodobny.
Obraz kliniczny cytomegalii: gorączka, zapalenie płuc, zapalenie przełyku, jelit, wątroby,
siatkówki, jagodówki, może pojawić się wysypka grudkowo-plamista.
Zakażenie wrodzone CMV – występuje głównie w I trymestrze ciąży i objawia się u nowo-
rodków zapaleniem naczyniówki i siatkówki, wodogłowiem, powiększeniem wątroby i śledziony oraz
wysypką grudkowo-plamistą.
Zakażenie noworodków – u około 1% noworodków stwierdza się zakażenie wirusem CMV.
Po przetoczeniu noworodkowi krwi zakażonej może rozwinąć się uogólnione zakażenie, włącznie
z zapaleniem płuc, wątroby, ośrodkowego układu nerwowego i zakażeniem oczu.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

107
Zakażenia enterowirusowe
Wywoływane są przez wirusy ECHO lub wirusy Coxsackie.
Rumień nagły – jego przyczyną jest ludzki herpeswirus typu 6 (HHV-6). Może być również wy-
wołany przez wirusy Coxsackie i ECHO oraz ludzki herpeswirus typu 7. Okres inkubacji wynosi
około 9 dni. Choroba rozpoczyna się wysoka gorączką i wzmożoną pobudliwością, po 2–3 dniach
gorączka ustępuje i pojawia się wysypka grudkowo-plamista, szczególnie intensywna na tułowiu.
Rumień zakaźny – jest wywołany przez ludzki parwowirus B19. Okres inkubacji wynosi 5 dni,
ale wysypka pojawia się dopiero 2 tygodnie później. Chory jest źródłem zakażenia od 5 dnia od
zakażenia do 1 tygodnia przed pojawieniem się wysypki. Obraz kliniczny charakteryzuje się wy-
sypką rumieniową rozpoczynającą się na twarzy, a następnie przechodzącą w grudkowo-plamistą,
obejmującą również tułów i kończyny. Wysypka utrzymuje się przez 7 dni (może nawracać w cią-
gu 3–4 tygodni) i tworzy marmurkowaty wzór, brak świądu. Powikłania to retikulocytopenia krwi
obwodowej.
Ostre choroby wirusowe przebiegające z wysypką pęcherzykową
Pęcherzyk
Jest to wykwit wyniosły ponad powierzchnię skóry, do 1 cm średnicy (większy wykwit to pę-
cherz), wypełniony płynem i ustępujący bez pozostawienia śladu.
Ospa wietrzna
Wywołuje ją wirus ospy wietrznej–półpaśca należący do herpeswirusów. Ospa wietrzna jest
następstwem zakażenia pierwotnego tym wirusem (ten sam wirus w przebiegu reaktywacji zakażenia
może wywołać półpaśca). Choroba przenosi się z człowieka na człowieka i jest bardzo zakaźna od
pojawienia się pierwszej zmiany, aż do czasu, gdy pęcherzyki pokryją się strupami. Wirus ten szerzy
się droga oddechową. Pęcherzyki również zakażają poprzez kontakt z płynem w nim zawartym.
Okres wylęgania wynosi 10–20 dni.
Obraz kliniczny ospy wietrznej: nagłe pojawienie się rumieniowatych plamek na tułowiu, na-
stępnie wysypka szerzy się obwodowo na głowę i kończyny, mogą pojawić się owrzodzenia w jamie
ustnej i gardle. W ciągu kilku godzin z plamek powstają pęcherzyki, które po 5–6 dniach przysychają,
tworząc strup. U chorego obserwuje się jednoczesne występowanie wykwitów w różnych stadiach
rozwojowych. Wysypce towarzyszy gorączka.
Powikłania zdarzają się wyjątkowo rzadko i są to: zapalenie opon mózgowo-rdzeniowych lub
mózgu, zespół Reye’a, zapalenie płuc.
Dostępna jest skuteczna szczepionka.
Półpasiec
Wywoływany przez wirusa ospy wietrznej–półpaśca. Przyczyną jest reaktywacja zakażenia,
które pozostawało w formie utajonej (w komórkach nerwowych). Do reaktywacji zakażenia dochodzi
w przebiegu spadku odporności.
Obraz kliniczny półpaśca – występuje wysypka w postaci twardych, napiętych i bolesnych
zmian pęcherzykowych, grupujących się w przebiegu nerwu czuciowego odpowiadającego za uner-
wienie danego dermatonu. Wykwity utrzymują się przez 2–4 tygodnie.
Powikłaniami półpaśca są zapalenie rogówki i naczyniówki oka, gdy wirus zajmuje gałązkę
oczną nerwu czaszkowego V.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

108
Pierwotne opryszczkowe zapalenie jamy ustnej i dziąseł
Wywołane jest przez wirus opryszczki typu I (HSV-I), rzadziej typu II (HSV-II) należących
do herpeswirusów. Do zakażenia dochodzi przez bezpośredni kontakt z płynem pęcherzykowym
wskutek bezpośredniego kontaktu z chorym mającym zmiany chorobowe lub poprzez kontakt z zaka-
żonymi przedmiotami.
Okres wylęgania to 5–6 dni.
Objawy kliniczne: obrzęk i zaczerwienienie oraz pęcherzyki i bolesne owrzodzenia błony ślu-
zowej jamy ustnej – policzków, podniebienia, dziąseł, języka – oraz na wargach, gorączka, trudności
i ból przy przełykaniu, ból głowy, powiększenie regionalnych węzłów chłonnych. Objawy kliniczne
ustępują po 7–10 dniach.
Powikłaniami zakażeń opryszczkowych są zapalenie opon mózgowo-rdzeniowych, zapalenie
mózgu, zapalenie rogówki mogące być przyczyną ślepoty rogówkowej.
Nawrotowe opryszczkowe zapalenie jamy ustnej i dziąseł
Często dochodzi do nawrotów opryszczkowego zapalenia jamy ustnej z dominacją objawów
miejscowych (zmiany wokół ust i okolicy jamy ustnej) w wyniku reaktywacji latentnego wirusa w ko-
mórkach nerwowych zwojów czuciowych nerwu trójdzielnego. Bodźcami powodującymi nawroty są:
gorączka, przeziębienie, stres, niektóre pokarmy, ekspozycja na promieniowanie słoneczne, spadek
odporności.
Opryszczkowe zapalenie narządów płciowych
Wywołane jest wirus opryszczki typu II (HSV-II), który powoduje zmiany chorobowe na na-
rządach płciowych. Do zakażenia dochodzi poprzez kontakt płciowy z osobą mającą zmiany. Zdarza
się, że u kobiet występują bezobjawowe zmiany wewnątrzpochwowe. Do zakażenia może dochodzić
również przez spermę.
Herpangina
Jej przyczyną są przez wirusy Coxsackie A lub rzadziej Coxsackie B i ECHO, które przenoszą
się z człowieka na człowieka przez bezpośredni kontakt lub przez wodę, głównie późnym latem
i wczesną jesienią.
Okres inkubacji wynosi 2–4 dni.
Obraz kliniczny herpanginy: choroba rozpoczyna się gorączką i bólem głowy, następnie poja-
wiają się nudności i wymioty, występuje zapalenie gardła, tworzą się charakterystyczne pęcherzyki na
podniebieniu miękkim, głównie w pobliżu migdałków podniebiennych. Objawy utrzymują się przez
2–4 dni.
Zespół ręki, stopy i ust
Jest to bardzo zakaźna choroba wywołana przez wirusy Coxsackie. Do zakażenia dochodzi
przy bezpośrednim kontakcie z osobą chorą lub za pośrednictwem wody. Choroba występuje zwykle
na przełomie lata i jesieni.
Okres inkubacji wynosi 2–4 dni.
Objawy kliniczne: małe, powierzchowne pęcherzyki zlokalizowane na dłoniach i podeszwach
stóp, pęcherzyki i owrzodzenia jamy ustnej, gorączka oraz złe samopoczucie. U małych dzieci dodat-
kowo może wystąpić wysypka grudkowo-plamista na kończynach dolnych.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

109
Zakażenia wirusowe przebiegające z wysypką w postaci rumienia wielopostaciowego
Rumień
Są to liczne obrzękowe zmiany koloru sinoczerwonego, dobrze odgraniczone od otoczenia,
niekiedy z obecnością pęcherzy na powierzchni, wykazujące skłonność do tworzenia koncentrycznych
figur lub obrączek.
Rumień wielopostaciowy
Ma postać zmian skórnych o charakterze rumieniowo-obrzękowym (porównywane do tę-
czówki lub tarczy strzeleckiej). Początkowo są one pojedyncze, następnie łączą się w większe struktu-
ry i tworzą nieregularne kształty, wyraźnie odgraniczone od otoczenia. Wyróżniamy rumień wielopo-
staciowy pęcherzowy i krwotoczny. Chorba ta jest wywoływana przez adenowirusy, wirusy ECHO,
wirusy Coxsackie, poliowirusy, wirus Epsteina-Barr, wirus zapalenia wątroby typu B, wirusy
opryszczki typu I i II, wirus ospy wietrznej–półpaśca.
Zespół Stevensa-Johnsona
To ciężka postać rumienia wielopostaciowego. Zespół poprzedza okres prodromalny charakte-
ryzujący się gorączką, bólem głowy, gardła i złym samopoczuciem. Na początku wykwity przypomi-
nają rumień wielopostaciowy, ale z czasem pojawiają się zmiany pęcherzykowe na kończynach, sze-
rzące się na tułów i twarz. Powstają duże powierzchnie sączącej się, uszkodzonej skóry. Również na
błonach śluzowych pojawiają się rozległe, bolesne zmiany pęcherzykowe.
Powikłania to: wtórne infekcje bakteryjne powierzchni odsłoniętej skóry oraz odwodnienie.
2.2. Wirusowe zakażenia dróg oddechowych
Adenowirusy
Wywołują ostre zakażenia górnych dróg oddechowych, rozpoznawane jako tzw. przeziębienie.
Mogą odpowiadać również za zakażenia dolnych dróg oddechowych pod postacią zapalenia oskrzeli
i płuc.
Enterowirusy
Wywołują zakażenia górnych dróg oddechowych, tzw. przeziębienia, oraz choroby, których
jedynym objawem jest gorączka (wirusy Coxsackie oraz wirusy ECHO).
Rynowirusy
Stanowią przyczynę tzw. przeziębień, czyli zapaleń górnych dróg oddechowych. Do zakażenia
dochodzi drogą kropelkową. Okres wylęgania trwa 2–3 dni (w tym czasie chory jest zakaźny).
Objawy kliniczne to: katar towarzyszący nieżytowi błony śluzowej nosa, stan podgorączkowy
lub gorączka. Dolegliwości te z reguły ustępują po siedmiu dniach.
Do powikłań zaliczamy: zapalenie zatok przynosowych, zapalenie ucha środkowego i zapale-
nie oskrzeli.
Wirusy grypy
Wyróżniamy typy A, B i C, które są ortomiksowirusami. Skłonność do wywoływania epide-
mii mają typy A i B. Szczyt zachorowań na grypę przypada w grudniu i styczniu. Wirus przenosi się
z człowieka na człowieka drogą kropelkową wraz z wydzielinami z górnych dróg oddechowych. Pa-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

110
cjent jest zakaźny na około 24 godziny przed wystąpieniem objawów chorobowych. Wrotami zakaże-
nia są górne drogi oddechowe.
Okres wylęgania wynosi 1–3 dni.
Obraz kliniczny grypy: nagły początek z gorączką, dreszczami, bólami mięśni i napadami su-
chego kaszlu. Może wystąpić katar, ból gardła i powiększenie węzłów chłonnych. Dolegliwości
otrzymują się średnio 1–2 tygodnie.
Grypa jest znacznie groźniejszą chorobą u dzieci, osób starszych oraz pacjentów z innymi
przewlekłymi schorzeniami (choroba niedokrwienna serca, przewlekła obturacyjna choroba płuc)
i obniżoną odpornością.
Do powikłań, które są następstwem uogólnionego zakażenia wirusowego, zaliczamy: zapale-
nie krtani, tchawicy, oskrzeli, płuc, mięśnia sercowego, osierdzia. Wśród innych powikłań, związa-
nych z reakcją nadwrażliwości, wyróżniamy: zespół Guillaina-Barrego, czyli porażenie wstępujące,
i zespół Reya (podawanie kwasu salicylowego i predyspozycja genetyczna przyczynia się do rozwoju
zespołu) chrakteryzujący się encefalopatią (objawy senności prowadzące do śpiączki i zgonu).
Profilaktyka grypy obejmuje szczepienia zalecane u osób starszych, pacjentów z chorobami
serca i płuc, przewlekle chorych oraz pracowników służby zdrowia.
Wirusy paragrypy
Są to paramiksowirusy, które przenoszą się z człowieka na człowieka drogą kropelkową wraz
z wydzielinami z górnych dróg oddechowych. Wyróżniamy cztery podstawowe serotypy wirusa para-
grypy: typy 1 i 2, które wywołują najczęściej zakażenia u niemowląt i dzieci, zwykle w miesiącach
jesiennych (zakażenia mogą mieć charakter epidemii), typ 3, atakujący dzieci w wieku poniżej 2 lat
(zakażenia występują w ciągu całego roku i mają cięższy przebieg niż choroby wywołane przez typ 1
lub 2), oraz typ 4, który wywołuje zakażenia o łagodnym przebiegu.
Obraz kliniczny: wirusy paragrypy (wszystkie serotypy) mogą dawać objawy przeziębienia
(zakażenie górnych dróg oddechowych), typy 1 i 2 wywołują krup, czyli zapalenie krtani, tchawicy
i oskrzeli, typ 3 odpowiada za zapalenie oskrzeli i płuc.
Syncytialny wirus oddechowy
Wirus RS powoduje zakażenia układu oddechowego. Przenosi się drogą kropelkową (jest bar-
dzo zakaźny). Obserwuje się sezonowe występowanie zakażeń, głównie w grudniu i styczniu. Zacho-
rowania mogą mieć charakter epidemii. Okres inkubacji wynosi około 5 dni. Wirus RS stanowi głów-
ną przyczynę chorób układu oddechowego u dzieci, a u dzieci do 2 roku życia mogą one zagrażać
życiu.
Obraz kliniczny: najczęstszym objawem pierwotnego zakażenia są choroby dolnych dróg od-
dechowych: zapalenia tchawicy, oskrzeli i płuc. Wirus RS może wywoływać również zakażenie gór-
nych dróg oddechowych w postaci przeziębienia. Głównym objawem jest kaszel.
Powikłania zakażeń spowodowanych przez syncytialny wirus oddechowy to zapalenie ucha
środkowego i mięśnia sercowego.
Koronawirusy
Zakażenia koronawirusami są bardzo rozpowszechnione wśród dzieci, a częstość zachorowań
wzrasta w okresach zimowych i wiosennych. Przenoszą się drogą kropelkową przez drogi oddechowe.
Około połowa zakażeń przebiega bezobjawowo, natomiast zakażenia objawowe dotyczą górnych dróg
oddechowych (przeziębienia) z towarzyszącym stanem podgorączkowym lub niską gorączką.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

111
2.3. Wirusowe zakażenia przewodu pokarmowego
Wirus Norwalk
Należy do kalcywirusów. Zakażenie następuje na drodze fekalno-oralnej, a jego źródłem jest
najczęściej woda (zanieczyszczona kałem osoby zakażonej). Wirus Norwalk stanowi najczęstszą
przyczynę wirusowego zapalenia żołądka i jelit u dorosłych. Mogą występować epidemie zakażeń
dotyczące rodziny lub środowiska.
Okres wylęgania wynosi 1–2 dni.
Objawy zakażenia: nudności, wymioty, biegunka, bóle mięśni, bóle głowy, gorączka.
Rotawirusy
Zalicza się je do reowirusów. Do zakażenia dochodzi drogą fekalno-oralną. Szczyt zachoro-
wań przypada na miesiące jesienno-zimowe.
Okres wylęgania 2–4 dni.
Objawem zakażenia jest biegunka, bowiem wirus namnaża się w przewodzie pokarmowym
i uszkadza nabłonek jelitowy. Rotawirusy są najczęstszą przyczyną niebakteryjnych biegunek u nie-
mowląt, występują głównie u małych dzieci, choć mogą również wywoływać zakażenia u dorosłych.
Powikłaniem jest odwodnienie.
Wirusy zapalenia wątroby
Jest to heterogenna grupa wirusów będąca przyczyną zapalenia wątroby, wśród których wy-
różniamy 5 typów: A, B, C, D i E.
Zapalenie rozpoznaje się:
klinicznie, na podstawie objawów, takich jak: nudności, wymioty, bolesność w prawym łuku pod-
żebrowym, stany podgorączkowe, gorączka, złe samopoczucie, uczucie zmęczenia oraz żółtaczka,
stwierdzone w badaniu fizykalnym powiększenie i tkliwość wątroby, czasem również powiększona
śledziona,
w badaniach biochemicznych – podwyższone stężenie bilirubiny oraz zwiększona aktywność enzy-
mów wątrobowych nazywanych aminotransferazami (AlAT i AspAT), ciemne zabarwienie moczu,
jasne zabarwienie stolca,
na podstawie diagnostyki serologicznej (wykrywanie swoistych przeciwciał lub antygenów wirusa),
na podstawie biopsji wątroby.
Ostre zapalenie wątroby jest pierwotnym zakażeniem wirusem zapalenia wątroby. WZW typu
A i typu E występują wyłącznie w ostrej postaci, nie stwierdza się przewlekłych zakażeń. Natomiast
wirusy HBV i HCV dają ostre i bardzo często przewlekłe zakażenia, których konsekwencją jest prze-
wlekłe WZW odpowiednio typu B lub C.
Przewlekłe zapalenie wątroby jest procesem chorobowym trwającym ponad 6 miesięcy. Wy-
różniamy przewlekłe aktywne zapalenie wątroby, gdy naciek zapalny obejmuje miąższ i powoduje
martwicę hepatocytów, oraz przewlekłe przetrwałe zapalenie wątroby, gdy proces zapalny jest ograni-
czony do przestrzeni wrotnych narządu.
Przewlekli nosiciele to osoby, u których występuje przewlekłe zapalenie wątroby przebiegają-
ce bezobjawowo.
Wirus zapalenia wątroby typu A (HAV)
Przenosi się z człowieka na człowieka drogą fekalno-oralną, szczególnie w miejscach o ni-
skim poziomie higieny osobistej. Zanieczyszczenie nawet jednego źródła kałem osoby zakażonej (na
przykład wody) może doprowadzić do nagłego wystąpienia epidemii. Wirus HAV jest obecny w stol-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

112
cu chorego przez 2–3 tygodnie przed wystąpieniem objawów i przez 1–2 tygodnie po pojawieniu się
dolegliwości.
Okres wylęgania wynosi 2–6 tygodni.
Obraz kliniczny WZW typu A: brak apetytu, nudności, wymioty, złe samopoczucie, żółtaczka,
bolesność w prawym łuku podżebrowym, w badaniu fizykalnym stwierdza się powiększenie wątroby.
Zakażenia HAV nie przechodzą w fazę przewleką. W badaniach laboratoryjnych występuje hiperbili-
rubinemia, podwyższona aktywność enzymów wątrobowych – AlAT i AspAT, wykrywa się przeciw-
ciała anty-HAV klasy IgM. WZW typu A przyjmuje tylko ostrą postać zapalenia i charakteryzuje się
niewielkim, przejściowym uszkodzeniem wątroby oraz całkowitym wyzdrowieniem.
Zapobieganie: dostępna jest szczepionka. Leczenie polega na podaniu ludzkiej gamma-glo-
buliny zawierającej przeciwciała anty-HAV.
Wirus zapalenia wątroby typu B (HBV)
Przenosi się przez krew i produkty krwiopochodne. Do zakażenia może również dojść drogą
kontaktów płciowych (przez spermę). Oprócz krwi i spermy obecność wirusa stwierdza się również
w łzach, ślinie, moczu, kale, mleku kobiecym, płynie mózgowo-rdzeniowych osób z ostrym zakaże-
niem i nosicieli.
Okres wylęgania wynosi od 6 tygodni do 6 miesięcy. Zakażenie może mieć charakter bezob-
jawowy. Zakażenia objawowe różnią się przebiegiem klinicznym (od lżejszych do cięższych postaci).
Objawy ostrego WZW typu B są często mało swoiste: brak apetytu, złe samopoczucie, uczu-
cie zmęczenia, bolesność w prawym łuku podżebrowym, u niektórych pacjentów występuje żółtaczka.
W badaniu fizykalnym stwierdza się powiększenie wątroby. Występuje bilirubinemia i podwyższona
aktywność aminotransferaz w surowicy krwi oraz ciemne zabarwienie moczu. W przebiegu WZW
typu B może dojść do rozwoju choroby posurowiczej, guzkowego zapalenia tętnic lub kłębuszkowego
zapalenia nerek.
Przewlekłe WZW typu B rozwija się u większości osób zakażonych, które stają się nosiciela-
mi wirusa. Nosiciel to osoba, u której antygen wirusa HBsAg jest wykrywany przez co najmniej
6 miesięcy. Przewlekłe zapalenia wątroby typu B dzielimy na:
Przetrwałe przewlekłe zapalenia wątroby. Występują skąpe objawy kliniczne, ale chorzy są poten-
cjalnie zakaźni. Z czasem może dojść do niewydolności wątroby (marskości wątroby).
Aktywne przewlekłe zapalenia wątroby. Pacjenci mają nasilone objawy chorobowe, występują
zaostrzenia dolegliwości. Powikłaniami WZW typu B są przewlekły stan zapalny i martwica hepa-
tocytów prowadzące do marskości (niewydolności wątroby) i raka pierwotnego wątroby.
Diagnostyka laboratoryjna obejmuje wykrycie antygenu powierzchniowego wirusa zapalenia
wątroby typu B – HBsAg oraz przeciwciał przeciwko antygenowi rdzeniowemu wirusa anty-HBc
klasy IgM i przeciwciał przeciwko antygenowi powierzchniowemu wirusa anty-HBs. Wykrycie anty-
genu e wirusa – HBeAg – jest dowodem aktywnej replikacji wirusa u osób z przewlekłym zakaże-
niem i potwierdza, że osoby te są wysoce zakaźne.
Zapobieganie: zastosowanie szczepionki.
Wirus zapalenia wątroby typu C (HCV)
Przenosi się przez krew i produkty krwiopochodne. Do zakażenia może również dojść drogą
kontaktów płciowych.
Okres wylęgania wynosi od 6 tygodni do 6 miesięcy.
Obraz kliniczny: zakażenie HCV może mieć charakter bezobjawowy, jednak większość (po-
nad 70%) zakażonych staje się przewlekłymi nosicielami wirusa i rozwija się u nich przewlekłe zapa-
lenie wątroby. Objawy WZW typu C są często mało swoiste: brak apetytu, złe samopoczucie, uczucie
zmęczenia, czasem bolesność w prawym łuku podżebrowym, tylko u niektórych pacjentów występuje
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

113
żółtaczka. W badaniu fizykalnym stwierdza się powiększenie wątroby. Występuje bilirubinemia
i podwyższona aktywność aminotransferaz w surowicy krwi oraz ciemne zabarwienie moczu. Powi-
kłania przewlekłego WZW typu C to (podobnie jak w przypadku WZW typu B) marskość wątroby
i rak pierwotny wątroby.
Diagnostyka laboratoryjna obejmuje wykrycie przeciwciał anty-HCV w odczynie immunoen-
zymatycznym lub odczynie rekombinowanego immunoblottingu.
Brak szczepionki zapobiegającej zakażeniu.
Wirus zapalenia wątroby typu D (HDV)
Określany jest jako wirus ułomny (zakażenie wirusem HDV wymaga obecności wirusa HBV).
Przenosi się przez krew i produkty krwiopochodne. Najczęściej dochodzi do jednoczesnego zakażenia
wirusami HBV i HDV, rzadziej do nadkażenia wirusem HDV nosiciela wirusa HBV.
Diagnostyka laboratoryjna obejmuje wykrycie przeciwciał anty-HDV klasy IgM i anty-HDV
klasy IgG.
Wirus zapalenia wątroby typu E (HEV)
Szerzy się drogą fekalno-oralną i może być przyczyną endemicznego i epidemicznego zapale-
nia wątroby (Indie, kraje Afryki i Ameryki Południowej). Głównym źródłem epidemicznego szerzenia
się wirusa jest woda (woda zanieczyszczona kałem osoby zakażonej HEV).
Okres wylęgania wynosi 2–6 tygodni. Nie stwierdza się przewlekłego nosicielstwa HEV.
Obraz kliniczny: brak apetytu, nudności, wymioty, złe samopoczucie, żółtaczka, bolesność
w prawym łuku podżebrowym. W badaniach laboratoryjnych występuje podwyższona aktywność
enzymów wątrobowych w surowicy krwi.
2.4. Pozostałe choroby wirusowe
Wirus świnki
Jest czynnikiem etiologicznym nagminnego zapalenia ślinianek przyusznych, czyli świnki.
Wirus atakuje głównie ślinianki przyuszne. Przenosi się drogą kropelkową, najczęściej poprzez bliskie
kontakty z osobą zakażoną.
Okres wylęgania wynosi 2–3 tygodnie.
Obraz kliniczny świnki: na początki pojawiają się złe samopoczucie, stan podgorączkowy lub
gorączka. Objawy prodromalne (zwiastunowe) poprzedzają na około 1–2 dni klasyczne objawy, czyli
bolesny obrzęk gruczołów ślinowych (ból występuje przy przełykaniu i podczas mówienia), najczę-
ściej ślinianek przyusznych jedno- lub obustronny. Jednorazowe zachorowanie daje trwałą odporność.
Powikłania zakażenia wirusem świnki to: zapalenie gruczołów wydzielania wewnętrznego –
– najczęściej zapalenie jąder i najądrzy u mężczyzn, znacznie rzadziej zapalenie jajników u kobiet
oraz zapalenie wątroby i trzustki. Zdarzają się również powikłania ze strony układu nerwowego w po-
staci zapalenia opon mózgowo-rdzeniowych bądź mózgu.
Dostępna jest skuteczna szczepionka.
Wirus wścieklizny
Należy do rabdowirusów. Jest czynnikiem etiologicznym wścieklizny. Wirus ten atakuje
głównie dzikie ssaki, natomiast człowiek i zwierzęta domowe ulegają zakażeniu przypadkowo. Do
zakażenia dochodzi na skutek ukąszenia przez chore zwierzę, a czasem wirus może się przenieść rów-
nież poprzez zadrapanie lub drogą kropelkową w wyniku wdychania zakażonego materiału od zwie-
rzęcia. Wirus znajduje się w ślinie zakażonych zwierząt już kilka dni przed wystąpieniem objawów
chorobowych. Wyróżniamy dwie postacie wścieklizny: leśną, którą stwierdza się u zwierząt dzikich:
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

114
nietoperzy, lisów, wilków, skunksów, szopów, jenotów i łasic, oraz miejską, która rozwija się u zwie-
rząt domowych: psów, kotów, koni i bydła.
Okres inkubacji wynosi średnio 1–3 miesiące (ale może trwać krócej – 1 tydzień – lub znacz-
nie dłużej – do 1 roku) i zależy od wrót zakażenia (im dalej od mózgu, tym okres wylęgania dłuższy)
oraz dawki wirusa. Po namnożeniu się w komórkach mięśniowych w miejscu ukąszenia wirus wnika
do włókien nerwów obwodowych i wzdłuż nerwów przechodzi do rdzenia kręgowego i mózgu, po-
nownie namnaża się w istocie szarej mózgu i szerzy się wzdłuż włókien nerwów autonomicznych do
tkanek obwodowych, także do ślinianek, z których jest wydalany.
Obraz kliniczny wścieklizny: uczucie dyskomfortu w miejscu ukąszenia, ból głowy, uczucie
niepokoju; w miarę postępu choroby dochodzi do zaburzeń połykania, uogólnionych drgawek
i śpiączki. Profilaktyka ponarażeniowa wścieklizny polega na podaniu ludzkiej immunoglobuliny
przeciw wściekliźnie, aby zapewnienić odporność bierną, oraz szczepionki w dniach 0, 3, 7, 14 i 18 po
ekspozycji na wirusa, w celu indukcji odporności czynnej, zanim pojawią się objawy chorobowe.
Ludzkie wirusy upośledzenia odporności: HIV-1 i HIV-2
Należą do retrowirusów. HIV-1 występuje na całym świecie i wywołuje AIDS, natomiast
HIV-2 szerzy się głównie w Afryce, jest mniej wirulentny i rzadko wywołuje pełnoobjawowy AIDS.
Drogi zakażenia: przez kontakt płciowy, krew i produkty krwiopochodne (w tym poprzez igły i strzy-
kawki zakażone krwią) oraz przez przeszczepianie narządów i tkanek. Zakażenie szerzy się również
przez łożysko lub okołoporodowo z matki na dziecko. Wirus HIV atakuje komórki posiadające na
swojej powierzchni cząsteczkę CD4: limfocyty T pomocnicze (Th), monocyty, makrofagi, komórki
dendrytyczne, komórki mikrogleju należące do ośrodkowego układu nerwowego. Zakażeniu mogą
również ulec komórki błony śluzowej jelit oraz szyjki macicy.
Zespół nabytego upośledzenia odporności (AIDS)
Czynnikiem etiologicznym jest wirus HIV-1.
Patogeneza zakażenia wirusem HIV:
wczesna faza wiremii – wirus jest wykrywany we krwi po 5–10 dniach od zakażenia i utrzymuje
się do serokonwersji, czyli do pojawienia się przeciwciał,
faza bezobjawowa (bez objawów klinicznych) trwa średnio 5–10 lat, namnażanie wirusa pozostaje
pod kontrolą układu odpornościowego,
faza późna – następuje ponowna wiremia i spadek liczby limfocytów CD4; rozwój AIDS jest zwią-
zany z utratą immunologicznych mechanizmów obronnych, a zwłaszcza postępującym spadkiem
limfocytów T CD4, czemu towarzyszy wzmożona replikacja wirusa HIV.
W rutynowym rozpoznawaniu zakażenia wirusem HIV stosuje się diagnostykę serologiczną,
czyli wykrywa się obecność swoistych przeciwciał przeciwko antygenom tego wirusa (przeciwko
białku p24). Metody PCR lub hodowli wirusa, stosowane przy wykrywaniu wiremii, czyli obecności
wirusa HIV we krwi, uznaje się za techniki alternatywne lub doświadczalne.
Diagnostyka rutynowa zakażenia wirusem HIV obejmuje:
Wykonanie odczynu immunoenzymatycznego ELISA, wykrywającego swoiste przeciwciała prze-
ciwko antygenom wirusa HIV. Odczyn ten stosowany jest jako test przesiewowy. Wykonuje się go
w przypadku podejrzenia zakażenia, bezpośrednio po ekspozycji na wirusa. Dalszą kontrolę krwi
przeprowadza się po 6 tygodniach, a następnie po 3, 6 i 12 miesiącach. W przypadku dodatniego
odczynu ELISA test powtarza się, a gdy wynik pozytywny zostanie potwierdzony, wykonuje się
odczyn Western blot.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

115
Odczyn Western blot służy do potwierdzenia zakażenia wirusem HIV. W surowicy pacjenta wy-
krywa się swoiste przeciwciała przeciwko poszczególnym antygenom wirusa (przeciwko białkom
p24, p31, gp21, gp120).
Przeprowadzając rutynowe badania wykrywające zakażenie wirusem HIV, należy pamiętać
o istnieniu okienka immunologicznego. Testy ELISA i Western blot opierają się na serologii, czyli
stwierdzeniu w surowicy pacjenta swoistych przeciwciał przeciwko antygenom wirusa HIV. Wykrywa
się je średnio po 6–8 tygodniach od zakażenia, a w niektórych przypadkach nawet do 6 miesięcy.
Wyróżniamy 5 klinicznych faz zakażenia wirusem HIV:
Okres wylęgania. Trwa od 2 do 4 tygodni, występuje wiremia, wirus może być przeniesiony na
inną osobę.
Ostra choroba związana z serokonwersją. Ostra choroba retrowirusowa trwa od 2 do 3 tygodni
i charakteryzuje się objawami podobnymi do mononukleozy zakaźnej lub grypy, takimi jak: go-
rączka, ból gardła, głowy, mięśni, wysypka grudkowo-plamista, powiększenie węzłów chłonnych.
Serokonwersja, czyli obecność przeciwciał przeciwko białkom wirusa HIV, jest stwierdzana śred-
nio po 6 tygodniach od zakażenia. Osoba serologicznie ujemna należąca do grupy ryzyka zakażenia
wirusem HIV powinna być powtórnie zbadana po 6 tygodniach, ze względu na możliwość wystą-
pienia ujemnych wyników badań serologicznych podczas zakażenia pierwotnego. Zjawisko to na-
zywamy okienkiem serologicznym, tzn. pacjent jest zakażony wirusem HIV, ale testy serologiczne
na obecność swoistych przeciwciał są jeszcze ujemne. Okres ten wynosi średnio 6 tygodni.
Bezobjawowe zakażenie wirusem HIV. Pacjent jest serologicznie dodatni, pomimo braku objawów
klinicznych. Mogą utrzymywać się niewielkie dolegliwości, takie jak bóle głowy i powiększenie
węzłów chłonnych.
Wczesna faza objawowego zakażenia wirusem HIV. Pojawiają się następujące objawy: gorączka,
nocne poty, osłabienie, biegunka, uogólnione powiększenie węzłów chłonnych, bóle głowy. W ba-
daniach laboratoryjnych stwierdza się stopniowy spadek liczby limfocytów CD4, co zwiększa ry-
zyko zakażeń oportunistycznych. Do najczęstszych tego typu infekcji zaliczamy: kandydozę jamy
ustnej – zakażenie wywołane przez grzyby z rodzaju Candida oraz zakażenia górnych i dolnych
dróg oddechowych o różnej etiologii. Mogą pojawić się również choroby nowotworowe, na przy-
kład mięsak Kaposiego.
Późna faza objawowego zakażenia wirusem HIV – postępujący spadek liczby limfocytów CD4
zwiększa ryzyko rozwoju zakażeń oportunistycznych – grzybiczych, bakteryjnych, wirusowych
i pierwotniakowych. Najbardziej charakterystyczne zakażenia to: zapalenie płuc wywołane przez
pierwotniaka Pneumocystis carinii, kandydoza jamy ustnej, przełyku, oskrzeli i płuc, kryptokokoza
– zakażenie grzybicze wywołane przez Cryptococcus neoformans przebiegające pod postacią zapa-
lenia płuc i zapalenia opon mózgowo-rdzeniowych, inwazyjna nokardioza, histoplazmoza, gruźlica
płuc i pozapłucna postać gruźlicy (zakażenie wywołane przez prątek gruźlicy – Mycobacterium tu-
berculosis), zakażenia wywołane przez prątki atypowe (takie jak prątek ptasi – Mycobacterium
avium-intracellulare), nawracająca bakteriemia wywołana przez pałeczki z rodzaju Salmonella,
rozsiana postać zakażenia wirusem cytomegalii, rozsiana postać i nawrotowe zakażenia wirusem
opryszczki pospolitej, półpasiec (reaktywacja wirusa ospy wietrznej-półpaśca) z częstymi nawro-
tami, toksoplazmoza przebiegająca z zajęciem ośrodkowego układu nerwowego, przewlekła kryp-
tosporydioza lub izosporoza wywołujące przewlekłą biegunkę, postępująca wieloogniskowa leuko-
encefalopatia (wywołana przez wirusa JC). Pojawiają się również choroby nowotworowe: mięsak
Kaposiego, chłoniak nieziarniczy, a u kobiet inwazyjny rak szyjki macicy.
Zaawansowana choroba związana z zakażeniem wirusem HIV. Drastycznie spada liczba limfocy-
tów CD4 (poniżej 50/mm
3
). W tym stadium dochodzi do głębokiego upośledzenia odporności
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

116
(anergia – brak odpowiedzi ze trony układu odpornościowego), mogą pojawić się wszystkie posta-
cie zakażeń oportunistycznych, wzrasta ryzyko śmierci.
AIDS
Występują zakażenia oportunistyczne oraz postępujący zespół wyniszczenia. Rozpoznawane
są swoiste dla późnej fazy objawowego zakażenia wirusem HIV choroby nowotworowe. Dochodzi do
rozwoju postępującej wieloogniskowej leukoencefalopatii oraz encefalopatii (demencji).
ARC
Jest to zespół związany z AIDS. Występuje znaczna wiremia i limfopenia z objawami klinicz-
nymi pod postacią limfadenopatii, gorączki, biegunki, utrata masy ciała, ale nie stwierdza się charakte-
rystycznych dla AIDS nowotworów i zakażeń oportunistycznych.
2.5. Zakażenia pracowników medycznych w związku z wykonywanym
zawodem
Potencjalnym źródłem infekcji HIV, HBV czy HCV jest każdy materiał biologiczny mogący
zawierać ilość wirusa wystarczającą do zakażenia. Najbardziej niebezpiecznym źródłem wirusów
w szpitalu i w przychodni jest krew.
Drogi zakażenia w miejscu pracy:
skaleczenia zakażoną igłą lub innymi ostrymi narzędziami,
kontakt zakażonej krwi z powierzchnią otwartych ran, skaleczeń, z pękniętą lub uszkodzoną skórą,
wniknięcie wirusa przez błony śluzowe wyścielające jamę ustną, nos i spojówki oczu (dla wirusów
HBV i HCV ryzyko zakażenia przy kontakcie ze śluzówkami jest wielokrotnie większe).
Najczęstsze ekspozycje:
w 70–75% – zakłucia,
w 27% – usuwanie wkłucia,
w 20% – zakładanie zatyczki,
w 10–27% – śluzówki,
w 3–13% – skaleczenia.
Postępowanie po wypadku, gdy nastąpił kontakt z wirusem:
1. Jeżeli doszło do przekłucia skóry, należy dobrze umyć zranioną okolicę wodą i mydłem, a przy
braku wody można użyć płynów do mycia rąk na bazie alkoholu (60–90% roztwór alkoholu).
2. Jeżeli na skórze znajduje się krew, niezależnie od tego, czy skóra jest uprzednio skaleczona (czy są
na niej zmiany, otarcia itp.), należy umyć ją dobrze wodą i mydłem.
3. Jeżeli skażone są oczy, należy delikatnie, lecz dokładnie przepłukać okolicę oczu wodą lub 0,9-
-procentowym roztworem NaCl przy otwartych powiekach.
4. Jeżeli krew dostanie się do ust, należy wypluć ją i przepłukać jamę ustną wodą kilkanaście razy.
5. Należy bezzwłocznie udać się osoby odpowiedzialnej za profilaktykę zakażeń krwiopochodnych
(lekarz zakładowy) lub do przełożonego:
− wypełnić kartę zgłoszenia wypadku w pracy, uwzględniając datę, godzinę i czas ekspozycji,
okoliczności zajścia,
− podać dane osoby będącej źródłem zakażenia – formularz.
6. Należy poinformować swojego przełożonego o zaistniałym incydencie.
7. Konieczne jest (jeśli to możliwe) zbadanie krwi osoby będącej potencjalnym źródłem zakażenia,
by stwierdzić, czy materiał od niej pobrany był zakaźny. Wyniki tego badania powinny być zano-
towane i podane do wiadomości osoby eksponowanej.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

117
8. Jeżeli osoba będąca potencjalnym źródłem zakażenia była uprzednio testowana i jest zakażona
HIV, HBV lub HCV, osoba eksponowana powinna być niezwłocznie zbadana przez lekarza mają-
cego doświadczenie w postępowaniu z zakażeniami krwiopochodnymi (specjalista chorób zakaź-
nych, wyznaczony lekarz).
9. Pracownikowi po narażeniu przysługuje bezpłatnie poufne orzecznictwo i obserwacja stanu zdro-
wia po ekspozycji.
10. Zaleca się wykonanie badań krwi poszkodowanego pracownika medycznego w kierunku obecno-
ści wirusów HIV, HBV, i HCV, by uzyskać następnie wynik porównawczy.
11. W przypadku wirusów HIV i HCV badanie krwi pozwoli na ustalenie, czy doszło w przeszłości do
zakażenia poszkodowanego pracownika. Dalsza kontrola krwi po 6 tygodniach, a następnie po 3, 6
i po 12 miesiącach wykaże, czy w wyniku ekspozycji nastąpiło zakażenie.
12. Po wypadku pracownik medyczny ma prawo do profilaktyki poekspozycyjnej, o ile jest to uzasad-
nione z lekarskiego punktu widzenia. Profilaktyka ma na celu niedopuszczenie do rozwoju choro-
by.
Profilaktyka poekspozycyjna zakażenia wirusem HIV:
1. Po ekspozycji na wirusa HIV należy rozpocząć jak najszybciej postępowanie profilaktyczne.
2. W przypadku wątpliwości, czy konieczne jest wdrożenie profilaktyki, osoba eksponowana powinna
otrzymać doraźnie 200–300 mg zydowudyny (AZT) lub wyjątkowo jednorazową dawkę innego le-
ku antyretrowirusowego, który jest dostępny i może być podany jak najszybciej.
3. Należy przetransportować poszkodowanego pracownika medycznego do najbliższego ośrodka spe-
cjalistycznego (kliniki lub oddziału chorób zakaźnych bądź ośrodka diagnozowania i leczenia
AIDS), w celu dokonania końcowej oceny ryzyka zakażenia i podjęcia decyzji odnośnie prowadze-
nia profilaktyki poekspozycyjnej.
Profilaktyka poekspozycyjna zakażenia wirusem HBV lub HCV:
1. W przypadku wirusa HBV, o ile pracownik nie został uprzednio zaszczepiony, należy w ciągu
24 godzin rozpocząć stosowanie przeciwciał odpornościowych (immunoglobuliny anty-HBs).
Równocześnie rozpoczyna się podawanie szczepionki przeciw wirusowi HBV.
2. W przypadku zakażenia wirusem HCV, należy oznaczyć stężenie przeciwciał anty-HCV.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

V. GRZYBY
(Mariola Kunicka)
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

121
Zakażenia grzybicze, zwane grzybicami, występują często i dotyczą głównie skóry. Wyróżnia
się:
powierzchowne zakażenia grzybicze,
skórne zakażenia grzybicze,
podskórne zakażenia grzybicze,
układowe zakażenia grzybicze.
Grzyby to drobnoustroje tlenowe, które posiadają ścianę komórkową i mają zdolność wzrasta-
nia na podłożu organicznym. Wzrastając tworzą kolonie. Mogą się rozmnażać zarówno drogą płciową,
jak i bezpłciową. Nie wytwarzają chlorofilu, nie są więc samożywne, co różni je od roślin. Należą do
grupy heterofitów. Ich klasyfikacja jest bardzo złożona. Grzybem o najprostszej budowie jest komórka
drożdży, która rozmnaża się przez pączkowanie. Niektóre gatunki w sprzyjających warunkach mogą
rozmnażać się przez zarodniki. Z klinicznego punktu widzenia ważnym gatunkiem drożdży są Candi-
da i Cryptococcus, nie wytwarzające zarodników, ale odgrywające istotną rolę w patogenezie wielu
chorób. Grzyby mogą występować w postaci pojedynczej komórki zdolnej do pączkowania, strzępek
lub w postaci bimorficznej. Grzybnia jest strukturą składającą się z wielu strzępek i jeśli wyrasta z
pojedynczej komórki, określa się ją mianem plechy. Pseudogrzybnia, charakterystyczna dla Candida,
ma strukturę nitkowatą.
Klasyfikacja grzybów opiera się na cechach morfologicznych oraz sposobie rozmnażania.
Grzyby właściwe Eumycota mają zdolność do rozmnażania płciowego. Grzyby niedoskonałe Deute-
romycota (fungi imperfecti) nie zostały do tej pory sklasyfikowane. Często w praktyce stosuje się po-
dział na:
dermatofity (wyróżnia się trzy rodzaje: Trichophyton, Microsporum oraz Epidermophyton),
drożdże (wśród grzybów drożdżopodobnych wyróżnia się głównie: Candida albicans oraz Mala-
ssezia furfur),
pleśnie (istotną rolę odgrywają: Aspergillus oraz Piedraia hortae).
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

122
1. Diagnostyka mykologiczna
W wielu przypadkach zakażenia grzybicze rozpoznaje się na podstawie obrazu klinicznego
schorzenia, które dany grzyb wywołuje. Ze względu na łatwy dostęp do leków przeciwgrzybiczych,
obraz kliniczny może być zafałszowany, dlatego w celu potwierdzenia rozpoznania stosuje się dodat-
kowe badania diagnostyczne. Materiałem diagnostycznym, w zależności od lokalizacji procesu choro-
bowego, mogą być zeskrobiny skórne, krosta, pęcherzyk, fragment paznokcia, włosy, wymazy pobie-
rane z powierzchni błon śluzowych, a nawet próbki kału. Materiał należy pobierać bardzo starannie,
ponieważ może to mieć istotny wpływ na wiarygodność wyniku. Każdorazowo należy uwzględnić
wcześniej stosowane leki przeciwgrzybicze, które mogą mieć wpływ na uzyskanie fałszywie ujemne-
go wyniku.
Badanie mikroskopowe
Dobrą i szybką metodą identyfikacji grzybów jest standardowe badanie KOH. Na szkiełko
podstawowe z fragmentami grzybni nakrapla się 1–2 krople 15–20% roztworu KOH (wodorotlenek
potasu) i odstawia na około godzinę do komory wilgotnej. KOH rozpuszcza keratynę, nie naruszając
strzępek grzybni. Dodając do roztworu 40-procentowy dwumetylosulfotlenek (DMSO), uzyskuje się
rozjaśnienie preparatu. Połączenie preparatu z tuszem lub błękitem bawełnianym daje możliwość
obserwacji strzępek grzybni. Można oglądać strzępki rzekome, formy drożdżowe i zarodniki. Do ob-
serwacji używa się również mikroskopu fluorescencyjnego.
Posiewy
Do identyfikacji grzyba niezbędne jest założenie hodowli. Zwykle używa się podłoża agaro-
wego Sabourauda. Można stosować dodatkowo cyklohesamid, wówczas zahamowany zostanie wzrost
patogenów zanieczyszczających badaną próbkę. Dodatek antybiotyku hamuje wzrost bakterii, które
również mogą stanowić zanieczyszczenie próbki. Dla większości dermatofitów optymalne warunki
wzrostu to temperatura 25ºC, a dla drożdży 37ºC. Grzyby drożdżopodobne i pleśniowe wzrastają
szybko, w ciągu kilku dni, zaś dermatofity potrzebują około 3 tygodni.
Inne badania
Badanie w świetle lampy Wooda (promieniowanie około 365 nm) umożliwia identyfikację gatun-
ków, które wykazują fluorescencję zieloną lub bladożółtą. Negatywny wynik badania za pomocą
lampy nigdy nie wyklucza zakażenia grzybiczego.
Biopsja skóry odgrywa istotną rolę w zakażeniach dermatofitami oraz w przypadku zmian hiperke-
ratotycznych. Przy podejrzeniu grzybicy głębokiej materiał można dodatkowo barwić metodą Go-
moriego lub Schiffa (PAS).
Badania serologiczne nie mają znaczenia w diagnostyce dermatofitów, natomiast są niezbędne
w przypadku rozpoznania grzybic głębokich. PCR i test ELISA są pomocne w różnicowaniu der-
matofitów.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

123
2. Zakażenia grzybicze
Zakażenia dermatofitowe (tinea) wywoływane są głównie przez:
Trichophyton – zakażenia skóry, włosów i paznokci,
Microsporum – zakażenia skóry i włosów,
Epidermophyton – zakażenia skóry i paznokci.
Dermatofity wnikają do warstwy rogowej, a produkty metaboliczne produkowane przez grzy-
by wywołują stan zapalny. Objawy i przebieg kliniczny zależą od szczepu grzybów oraz miejsca ich
wniknięcia.
Postacie kliniczne zakażeń
Grzybica stóp (stopa atlety)
Jest to najczęstsza postać zakażenia grzybiczego występująca u ludzi. Predysponują do niej
wspólne sanitariaty, baseny, obuwie gumowe itd. Objawy kliniczne mają postać złuszczania i macera-
cji skóry w przestrzeniach międzypalcowych, szczególnie 3 i 4 (grzybica międzypalcowa stóp). Mogą
przybierać formę suchego złuszczania skóry na powierzchni podeszwowej stóp (grzybica złuszczająca
stóp) oraz postać nawracających epizodów pęcherzyków zlokalizowanych na skórze (grzybica potni-
cowa stóp).
Grzybica paznokci
Powiązana jest często z grzybicą stóp. Zmiany dotyczą wolnego brzegu paznokcia, który staje
się żółty i kruchy. Chorobowo może być zajęty jeden lub kilka paznokci. Najczęściej zmiana poprze-
dzona jest mechanicznym urazem lub uszkodzeniem paznokcia. Dochodzi do hiperkeratozy podpa-
znokciowej, pogrubienia płytki i jej oddzielania się od łożyska. Zmiany w obrębie rąk wyglądają kli-
nicznie bardzo podobnie.
Grzybica rąk
Najczęściej jest to postać jednostronna, często współistnieje z grzybicą stóp oraz/lub paznokci.
Po stronie dłoniowej ręki skóra może mieć postać sypiącej, suchej łuski.
Grzybica pachwin
Częściej dotyczy mężczyzn niż kobiet. Zmiany są jedno- lub dwustronne. Mają postać szerzą-
cej się różowo-czerwonej blaszki z pęcherzykami lub krostami. Dodatkowo zmianom towarzyszy
świąd, pieczenie, objaw ściągania skóry, rzadko występuje bez objawów towarzyszących.
Grzybica tułowia i kończyń
Klinicznie jest to grzybica skóry gładkiej. Ma postać licznych, rozsianych, rumieniowych bla-
szek, ze złuszczaniem na brzegach, szerzących się obwodowo z ustępowaniem w części centralnej.
Grzybica skóry owłosionej głowy
Grzybica skóry owłosionej głowy występuje najczęściej u dorosłych oraz dzieci w wieku szkol-
nym. Może ją wywołać każdy gatunek Microsporum oraz Trichophyton. Microsporum odpowiada
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

124
za zakażenie typu ectothrix (grzyby rosną wzdłuż mieszka włosowego), zaś Trichophyton zarówno
za ecto- jak i endothrix (grzyby rosną wewnątrz włosa). Typowym objawem klinicznym jest plama
rumieniowa ze złuszczaniem i utratą włosów.
Grzybica drobnozarodnikowa to niezapalna grzybica owłosionej skóry głowy wywoływana przez
Microsporum głównie canis i dotyczy epidemii szerzących się wśród dzieci (domy dziecka, przed-
szkola, szkoły). Klinicznie charakteryzuje się występowaniem drobnych ognisk wyłysienia z mi-
nimalną utratą włosów. Ogniska mogą zlewać się, tworząc większe obszary pozbawione włosów.
Grzybica woszczynowa wywoływana jest przez Trichophyton i występuje głównie u dzieci, cha-
rakteryzuje się obecnością siarkowożółtych strupów, wypadaniem włosów i prowadzi do łysienia
bliznowaciejącego, bez możliwości odrostu utraconych włosów. Leczenie obejmuje zarówno leki
doustne, jak i stosowane miejscowo, które głownie hamują syntezę ściany komórkowej i wykazują
działanie przeciwzapalne.
Drożdżyca (kandydoza)
Występuje na powierzchniach śluzówkowo-skórnych. Drożdżaki wnikają do głębszych tka-
nek. Jest powszechną przyczyną grzybicy jamy ustnej. Gatunkami wywołującymi są Candida albi-
cans, tropicalis, glabrata, parapsilosis, krusei. Nosicielstwo kandydozy stwierdza się u 50% popula-
cji. Candida albicans bytuje na tylnej części języka, częściej u kobiet, u osób posiadających grupę
krwi O, przy diecie wysokowęglowodanowej, w kserostomii, u osób stosujących w leczeniu antybio-
tyki, palaczy, u osób z obniżoną odpornością, niedożywionych, diabetyków, u pacjentów hospitalizo-
wanych, narażonych na wilgoć i działanie wody (maceracja skóry i błon śluzowych).
Postaci kliniczne kandydozy:
Kandydoza jamy ustnej ma postać rumienia, nadżerki, białego, serowatego nalotu zlokalizowanego
na śluzówkach jamy ustnej, dającego łatwo się usunąć.
Kandydoza narządów płciowych dotyczy głównie kobiet i przyjmuje postać kandydozy pochwy
i sromu. Dotyczy około 30% kobiet ciężarnych. Często jest pierwszym objawem cukrzycy. Wyka-
zuje cechy stanu zapalnego, z serowatymi upławami.
Kandydoza międzypalcowa to rzadki typ drożdżycy, który lokalizuje się między 3 i 4 palcem ręki
lub stopy. Zmiana ma charakter bolesnej nadżerki otoczonej przez obrzękniętą i zmacerowaną
tkankę.
Wyprzenie drożdżakowe. W obrębie zmacerowanych tkanek często dochodzi do nadkażenia droż-
dżakami. Typowa lokalizacja to: pachwiny, pachy i fałdy pod sutkami.
Kandydoza pieluszkowa. Pieluszkowe zapalenie skóry dotyczy małych dzieci, u których czynni-
kiem sprawczym jest podrażnienie i maceracja wywoływane przez stosowane pieluszki.
Zanokcica drożdżakowa. Wywołuje bolesne, ropne zakażenie wałów paznokciowych i łożyska
paznokcia. Zakażenie ostre drożdżakowe często trudno jest odróżnić od zakażenia bakteryjnego.
Pojawia się w następstwie zabiegów kosmetycznych, stanowi chorobę zawodową piekarzy, wystę-
puje u osób narażonych na wilgoć i działanie wody.
Grzybice układowe
Grzybice układowe, zwane głębokimi, są wywoływane przez grzyby dimorficzne i dotyczą
głównie osób z niewydolnym układem odpornościowym. Chorobie towarzyszy wiele objawów kli-
nicznych. Zakażenia mogą dotyczyć wszystkich narządów wewnętrznych, jednak najczęściej rozpo-
czynają się od dróg oddechowych, zwłaszcza płuc. Do tej grupy chorób zaliczamy głównie: kryptoko-
kozę, blastomykozę, histoplazmozę i kokcydiodomikozę. Wiele z omówionych drobnoustrojów zaka-
ża osoby o obniżonej odporności, wywołując zakażenia tzw. oportunistyczne. W dobie HIV, prze-
szczepów, agresywnej chemioterapii każdy drobnoustrój, w tym grzyby, mogą wywołać zakażenie
oportunistyczne.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

VI. PODSTAWY IMMUNOLOGII
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

127
1. Odporność nieswoista
(Bogdan Mazur)
Odporność to zespół reakcji obronnych, których celem jest neutralizowanie lub/i eliminowanie
obcych dla organizmu substancji. Zadania te realizuje układ odpornościowy zwany też immunologicz-
nym. Nauką zajmującą się tym zagadnieniem jest immunologia (Immunitas – atis – przywilej, niety-
kalność), a pojęcie „odporność” – z punktu widzenia historycznego – rozumiane jest jako zabezpie-
czenie przed chorobami zakaźnymi (immunitet). Układ odpornościowy stanowi zintegrowaną sieć
narządów, tkanek i komórek, które w ewolucyjnym procesie rozwoju gatunku wykształciły mechani-
zmy rozpoznawania struktur własnych i eliminowania obcych. W proces ten zaangażowane są krążące
leukocyty, naczynia limfatyczne oraz narządy limfatyczne, takie jak: grasica, szpik kostny, śledziona,
węzły chłonne oraz tkanka limfatyczna związana ze skórą oraz błonami śluzowymi. Skuteczna odpo-
wiedź organizmu na zakażenia czy uszkodzenie tkanek zależy od systemu rozpoznania oraz umiejęt-
ności szybkiego zainicjowania odpowiedzi, która prowadzi do neutralizacji czynników szkodliwych.
W procesie ewolucji wykształciły się dwa rodzaje odporności: odporność nieswoista (wrodzona), sta-
nowiąca pierwszą linię obrony organizmu, oraz odporność swoista (nabyta), gdzie odpowiednie limfo-
cyty rozpoznają antygeny charakterystyczne dla określonych drobnoustrojów (tab. I).
Tabela I. Różnice pomiędzy odpornością nieswoistą a swoistą
Odporność nieswoista
Odporność swoista
Bardzo szybka, nie wymaga wstępnej aktywacji
rozwija się powoli, wymaga kontaktu z antygenem
Receptory rozpoznające antygen są niezmienne,
dziedziczone z pokolenia na pokolenie
receptory rozpoznające antygen wykształcają się na
nowo w każdej pierwotnej reakcji immunologicznej, nie
są dziedziczone
Celem ataku nie są własne struktury organizmu
może dojść do autoagresji
Nie pozostawia trwałej pamięci immunologicznej pozostawia trwałą pamięć immunologiczną
Rozwija się niezależnie od odporności swoistej
do rozwinięcia prawie zawsze wymaga odporności nie-
swoistej
Odporność nieswoista jest uniwersalnym mechanizmem obrony organizmu przed infekcją.
Działa ona, opierając się na istnieniu określonej i ograniczonej liczby receptorów PRR (receptory roz-
poznające wzorce) rozpoznających stałe struktury drobnoustrojów zwane PAMP (cząsteczki rozpo-
znające wzorce). Dzięki PRR organizm ludzki jest w stanie odróżnić antygeny własne od obcych.
Jednym z przedstawicieli PRR są receptory Toll-podobne, które odgrywają podstawową rolę w rozpo-
znawaniu zagrożenia i inicjacji odpowiedzi immunologicznej. Stanowią również ogniwo łączące od-
porność nieswoistą ze swoistą, umożliwiając sprawną walkę z czynnikami patogennymi. Wśród ko-
mórek rozpoznających patogeny za pomocą receptorów TLR (receptory Toll-podobne) wyróżnia się
komórki układu immunologicznego (makrofagi, komórki śródbłonka, dendrytyczne, tuczne, eozynofi-
le, neutrofile oraz limfocyty B) oraz komórki nabłonkowe, śródbłonka, kardiomiocyty i adipocyty.
Pobudzenie receptorów TLR przez produkty drobnoustrojów stanowi sygnał aktywujący mechanizmy
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

128
odporności nieswoistej, powodując wzmożoną syntezę czynników przeciwbakteryjnych, cytokin pro-
zapalnych oraz dojrzewanie komórek dendrytycznych, które uzyskują większą zdolność prezentacji
antygenów. Odporność nieswoistą tworzą bariery anatomiczne, fizjologiczne przystosowane do roz-
poznawania i eliminowania antygenów, a także obecność substancji o działaniu bakteriobójczym lub
bakteriostatycznym, działających na powierzchni nabłonków, w tkankach i w płynach tkankowych lub
występujących wewnątrzkomórkowo. Dzięki temu atak licznych mikroorganizmów może zostać po-
wstrzymany, zanim zdążą wniknąć do wnętrza organizmu. Elementy odporności nieswoistej, zapobie-
gające wtargnięciu patogenów do organizmu, to m.in.:
Skóra:
− nieustanne złuszczanie się martwych komórek;
− kwaśna powłoka hydrolipidowa – wydzielina gruczołów łojowych (wolne kwasy tłuszczowe,
cholesterol, związki woskowe, kwasy tłuszczowe i kwas mlekowy zapewniają niskie pH skóry
oraz mają działanie grzybo- i bakteriostatyczne) oraz potowych (woda, mocznik, kwas moczo-
wy, NaCl, śladowe ilości białka, np. defensyny, kwasów tłuszczowych, kwasu mlekowego);
− flora fizjologiczna – nieszkodliwe bakterie komensalne (zajmują miejsca wiązania na po-
wierzchni komórek gospodarza, wydzielają różne substancje);
− wyspecjalizowana tkanka limfatyczna skóry (SALT) – część układu immunologicznego.
Błony śluzowe przewodu pokarmowego:
− jama ustna – nabłonek wielowarstwowy i warstwa śluzu oraz ślina zawierająca lizozym (enzym
bakteriobójczy);
− kwas solny żołądka – niskie pH ~ 1 uniemożliwiające przeżycie drobnoustrojów;
− perystaltyka jelit oraz złuszczający się nabłonek jelit;
− bakteryjna flora fizjologiczna – wydzielanie bakteriocyn (np. kolicyna), substancji przeciw-
grzybiczych, naturalna konkurencja w kolonizacji z patogenami;
− tkanka limfatyczna związana z błonami śluzowymi, czyli MALT; za odporność błon śluzowych
odpowiadają immunoglubuliny IgA, występujące w błonach śluzowych w postaci sekrecyjnych
sIgA.
Drogi oddechowe:
− aparat rzęskowy dróg oddechowych, kichanie, kaszel – zapobiegają przyczepianiu się patoge-
nów i w sposób mechaniczny usuwają je z układu oddechowego;
− wydzieliny śluzowo-surowicze – przemywanie oraz sklejanie zanieczyszczeń w pęcherzykach,
które są pochłaniane przez makrofagi;
− tkanka limfatyczna związana z błonami śluzowymi (BALT), z układem oddechowym, głównie
z oskrzelami.
Spojówki:
− mruganie i wydzielane łez – mechaniczne oczyszczanie;
− lizozym – ma działanie bakteriobójcze, jeden z najważniejszych komponentów nieswoistej od-
powiedzi immunologicznej, jest enzymem destabilizującym strukturę ściany komórki bakterii.
Drogi moczowo-płciowe:
− cewka moczowa – oddawany mocz przemywa drogi moczowo-płciowe oraz zapewnia niskie
pH;
− pochwa – produkowana wydzielina działa bakteriobójczo, panuje kwaśne środowisko, dzięki
obecności flory fizjologicznej rozkładającej glikogen do kwasu mlekowego (Lactobacillus sp.).
Mechanizmy nieswoiste są filogenetycznie starsze niż swoiste. Są mało precyzyjne, ale za to
reagują szybko, stanowiąc pierwszą linię obrony. Biorą w nich udział przede wszystkim bariery me-
chaniczne, komórki żerne (zarówno makrofagi, jak i granulocyty), komórki NK (natural killer), układ
dopełniacza, lizozym, interferon, transferyna, białko C-reaktywne i inne białka ostrej fazy, komórki
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

129
zdolne do cytotoksyczności spontanicznej. Omawiając nieswoiste mechanizmy odporności, należy
przypomnieć, że równolegle działające mechanizmy swoiste – zainicjowane przez połączenie się prze-
ciwciał lub receptorów limfocytów T ze swoistym antygenem – ściśle kooperują z odpornością nie-
swoistą w walce z infekcjami.
Podstawowymi elementami odporności nieswoistej są: zdolność do odczynu zapalnego, opso-
nizacja i fagocytoza, których działanie opiera się na wykształconych w organizmie noworodka ukła-
dach komórek żernych, dopełniacza oraz komórek NK. Układy te stanowią pomost łączący je z odpo-
wiedzią swoistą. Fagocytoza jest szczególnie ważnym mechanizmem immunologicznym służącym do
zabijania mikroorganizmów, a przy tym bardzo wydajnym. Przeprowadzają go granulocyty i makro-
fagi.
1.1. Etapy procesu fagocytozy
Rozpoznanie odpowiednimi receptorami przez komórkę żerną cząsteczki lub komórki, która ma
ulec fagocytozie.
Otoczenie jej wypustkami cytoplazmatycznymi komórki żernej.
Powstanie fagosomu pierwotnego – obniżenie zjadliwości drobnoustroju poprzez wydzielane przez
komórkę fagocytującą wolnych rodników szeregu tlenowego.
Powstanie fagosomu wtórnego poprzez fuzję fagosomu pierwotnego z lizosomem – śmierć komór-
ki (niszczenie enzymami lizosomalnymi).
Powstanie niepatogennych ciałek resztkowych i determinanty antygenowej, która będzie prezen-
towana limfocytom T i służyła do produkcji przeciwciał.
Zabijanie poprzez fagocytozę zachodzi w dwóch procesach za pomocą:
mechanizmów tlenowych,
mechanizmów pozatlenowych.
Granulocyty obojętnochłonne (neutrofile) stanowią pierwszą linię obrony przed zakażeniami.
Neutrofile we krwi obwodowej występują jako pula krążącą i brzeżna. Pod wpływem zakażenia, gli-
kokortykosteroidów czy adrenaliny neutrofile przechodzą z puli brzeżnej do krążącej. Podobnie dzieje
się w pierwszej dobie po urodzeniu, czego odzwierciedleniem jest fizjologicznie zwiększona liczba
krwinek białych. W przebiegu zakażenia następuje migracja neutrofili z krwi do tkanek objętych pro-
cesem zapalnym i adhezja do zapalnie zmienionej powierzchni śródbłonka. Komórki odpowiadające
za odporność nieswoistą, oprócz neutrofili, to:
komórki dendrytyczne – posiadają długie, wąskie, drzewiasto rozgałęzione wypustki; komórki
prezentujące antygen;
limfocyty NK – komórki żerne;
komórki tuczne, bazofile – udział w odpowiedzi typu wczesnego, anafilaksji;
eozynofile – zdolne do fagocytozy i zabicia niektórych pasożytów, wydzielają czynniki hamujące
anafilaksje;
monocyty, makrofagi – zdolne do fagocytozy i zabicia mikroorganizmów oraz innych obcych ko-
mórek, zawierają liczne lizosomy i wakuole.
1.2. Układ dopełniacza
Składowe dopełniacza pobudzają miejscową odpowiedź zapalną oraz mogą indukować i mo-
dulować odpowiedź swoistą. Synteza składników dopełniacza rozpoczyna się już w 6–14 tygodniu
życia płodowego i wyprzedza syntezę immunoglobulin, a dopiero w 3–6 miesiącu po urodzeniu
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

130
wszystkie komponenty C3, C4, C5 osiągają stężenie prawidłowe. Układ dopełniacza jest układem
ochronnym występującym u wszystkich kręgowców. Należy do odporności nieswoistej, gdyż sam nie
rozpoznaje precyzyjnie antygenów. Nazwa pochodzi od tego, że stanowi on uzupełnienie (czyli dopeł-
nienie) roli przeciwciał. Jest to jeden z przykładów ścisłych powiązań między swoistymi a nieswoi-
stymi mechanizmami odporności. U człowieka składa się, wliczając czynniki regulujące, z około 30
białek surowicy i płynów tkankowych oznaczonych najczęściej literą C (complement) i odpowiednimi
cyframi.
Do głównych składników układu dopełniacza należą:
C1 (C1q, C1r, C1s), C2, C3, C4, C5, C6, C7, C8, C9. Białka te były nazywane w kolejności od-
krywania, dlatego cyfry arabskie przy literze „C" nie oddają kolejności udziału w reakcji dopełnia-
cza;
czynniki B, D, H, I – białka związane z alternatywną drogą aktywacji.
Przy odpowiednim pobudzeniu składniki te reagują ze sobą kaskadowo i wywierają odpo-
wiedni efekt, głównie w stosunku do błony komórkowej. Dopełniacz może doprowadzić nie tylko do
zniszczenia komórek bakteryjnych, pasożytniczych i nowotworowych przez uszkodzenie ich błony
komórkowej, ale dzięki licznym receptorom na komórkach żernych, może przyciągnąć te ostatnie do
miejsca infekcji i ułatwić fagocytozę bakterii. Dopełniacz może być aktywowany bezpośrednio przez
przeciwciała związane z bakterią bądź jakimkolwiek antygenem (droga klasyczna) lub przez czynniki,
takie jak B, D, H, I, properdynę (droga alternatywna). Składnik C3 obecny w surowicy w dużym stę-
żeniu jest niezbędny do prawidłowego przebiegu obu szlaków aktywacji, a jego przemiana w C3a
i C3b stanowi najważniejszy etap aktywacji całego układu. Istnieje trzecia droga aktywacji dopełnia-
cza, tzw. lektynowa, inicjowana przez białko wiążące mannozę, zwane również lektyną wiążącą man-
nozę (MBL).
Rola układu dopełniacza:
opsonizacja (opłaszczenie komórek lub cząsteczek składowymi białek dopełniacza), ułatwia fago-
cytozę (uczestniczą tu cząsteczki C3b, C4b),
chemotaksja i aktywacja komórek żernych (C3a i C5a),
liza komórek bakteryjnych oraz zakażonych komórek gospodarza,
usuwanie kompleksów immunologicznych,
eliminacja komórek apoptotycznych.
Ważnym elementem łączącym procesy odporności wrodzonej i nabytej, między innymi po-
przez kontakt z komórkami dendrytycznymi, są naturalne komórki cytotoksyczne NK. Opisywane są
jako duże ziarniste limfocyty, które pełnią funkcje cytotoksyczne i immunoregulatorowe. Komórki
NK mają zdolność zabijania komórek docelowych, między innymi nowotworowych i zakażonych
wirusem, taktyczną wobec neutrofilów.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

131
2. Odporność swoista
(Bogdan Mazur)
Aby odpowiedź immunologiczna była efektywna, konieczna jest wzajemna współpraca mię-
dzy wrodzonymi a nabytymi mechanizmami odporności. Mechanizmy swoiste charakteryzują się dużą
selektywnością, zwracają się precyzyjnie przeciwko określonym antygenom. Do osiągnięcia pełnej
aktywności wymagają jednak odpowiedniego czasu. Komórkami efektorowymi mechanizmów swoi-
stych są limfocyty z ich receptorami wiążącymi antygen oraz przeciwciała. Najważniejszą rolę we
wszystkich nabytych odpowiedziach immunologicznych, spośród elementów komórkowych, odgry-
wają limfocyty T i B. Rozpoznają one zarówno wewnątrz-, jak i zewnątrzkomórkowe patogeny krążą-
ce we krwi i płynach tkankowych. Proces dojrzewania immunologicznego rozpoczyna się w 2 miesią-
cu życia wewnątrzmacicznego, kiedy powstają centralne i obwodowe narządy limfatyczne.
2.1. Pierwotne narządy limfatyczne
Grasica jest w pełni rozwinięta w momencie urodzenia, otacza ją torebka łącznotkankowa. Składa
się z dwóch płatów, a każdy z nich z wielu płacików, w których można wyróżnić cześć rdzenną
i korową. W grasicy zachodzi intensywna proliferacja i różnicowanie limfocytów T, a konkretnie
komórek prekursorowych. Należy zaznaczyć, że grasica utrudnia kontakt antygenu obcego z tymo-
cytami (komórki opiekuńcze, bariera krew-grasica). Zachodzi tu także selekcja negatywna i pozy-
tywna powstałych limfocytów T. W narządzie tym wytwarzane są także liczne czynniki wpływa-
jące na różnicowanie i proliferację limfocytów. Są to hormony grasicy (tymozyna, grasiczy czyn-
nik humoralny, tymopoetyna, tymulina, tymopentyna i tymostymulina). Grasica osiąga swój pełny
rozwój pod koniec życia płodowego, w przeciwieństwie do innych narządów limfatycznych, które
rozwijają się po urodzeniu. Sama grasica nie zanika z wiekiem, lecz tkanka limfoidalna. Początko-
wo zanika około 1% tkanki rocznie, po 50 r.ż. – 0,8%, zaś całkowity zanik występuje po 100 r.ż.
Kaletka Fabrycjusza występuje tylko u ptaków, ssaki jej nie posiadają. Stwarza właściwe środo-
wisko do różnicowania limfocytów B.
Szpik kostny spełnia funkcję krwiotwórczą. Wytwarzane są tu wszystkie elementy morfotyczne
krwi.
2.2. Wtórne narządy limfatyczne
Do wtórnych narządów limfatycznych należą nieotorbione grudki limfatyczne (m.in. plamki
mleczne, migdałki, tkanka limfatyczna związana z błonami śluzowymi), węzły limfatyczne, śledziona,
naczynia limfatyczne.
Grudki limfatyczne występują pojedynczo lub w grupach w tkance łącznej wiotkiej, najczęściej
w ścianie przewodu pokarmowego, dróg oddechowych i narządów moczowo-płciowych.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

132
Plamki mleczne są to skupiska limfocytów i makrofagów obecne w błonie surowiczej pokrywa-
jącej jamę otrzewnową i opłucnową.
Migdałki są to grudki limfatyczne ułożone pojedynczo lub w skupiskach tuż pod nabłonkiem
w miejscu krzyżowania się górnego odcinka dróg oddechowych z przewodem pokarmowym. Jest
to miejsce strategiczne dla obrony organizmu przed zakażeniami.
Tkanka limfatyczna związana ze ścianą jelita stanowi rozproszone limfocyty i grudki limfatycz-
ne, które obejmują: samotne grudki limfatyczne (rozrzucone wzdłuż całego jelita) oraz skupione
grudki limfatyczne (zwane również kępkami Peyera; występują przede wszystkim w jelicie krę-
tym).
Węzły limfatyczne leżą na przebiegu naczyń limfatycznych, które uchodzą do węzła. Można je
porównać do filtrów leżących na drodze limfy. Do zasadniczych czynności węzłów chłonnych na-
leżą filtracja limfy i zatrzymywanie zawartych w niej antygenów, a także drobnoustrojów i ko-
mórek nowotworowych.
Śledziona to największy narząd limfatyczny, w którym zachodzi aktywowanie limfocytów przez
antygeny oraz ich różnicowanie w komórki efektorowe. Przy czym śledziona jest pobudzania nie
tylko przez antygeny, które dostały się bezpośrednio do krwi, ale także przez te, które przedostały
się do krwi po tym, jak były obecne w limfie i nie zostały zatrzymane przez węzły chłonne.
Centralne narządy limfatyczne, do których należą grasica i szpik kostny są głównymi miej-
scami limfopoezy. W narządach tych powstają m.in. limfocyty T i B o różnych receptorach dla anty-
genu. Początek rozwoju grasicy przypada na koniec 4 tygodnia życia płodowego, w 6 tygodniu ma
budowę nabłonkową, a w 7 staje się gruczołem. W połowie 8 tygodnia życia płodowego ulega dal-
szemu zróżnicowaniu. Główną rolą grasicy jest wytwarzanie antygenowo swoistych limfocytów T,
które migrują do obwodowych narządów limfatycznych i zapewniają ochronę przeciwko patogennym
mikroorganizmom. Pierwsze tymocyty (prekursory limfocytów T) zasiedlają grasicę około 10 tygo-
dnia życia wewnątrzmacicznego, wędrują do niej z wątroby, a następnie ulegają intensywnej prolife-
racji i różnicowaniu w limfocyty T. Szpik kostny od 5 miesiąca życia płodowego spełnia funkcje
krwiotwórcze i jest głównym narządem, w którym powstają wszystkie komórki krwi multipotencjalnej
komórki macierzystej. Z jej podziału tworzą się komórki różnicujące się na dwie główne linie rozwo-
jowe: mielopoetyczną, z której powstają krwinki czerwone, płytki krwi, granulocyty i monocyty, oraz
limfopoetyczną, z której powstają limfocyty T i B oraz naturalne komórki cytotoksyczne. Rycina 1.
przedstawia schemat prawidłowej hematopoezy.
Komórki limfoidalne migrują drogą krążenia do narządów limfatycznych, a te, które zasiedla-
ją grasicę, dają początek limfocytom T (tymocytom). Na powierzchni limfocytów T znajduje się wiele
receptorów, przy czym najważniejszy to TCR. Receptory limfocytów T rozpoznają antygeny pepty-
dowe, związane z autologicznymi cząsteczkami głównego układu zgodności tkankowej MCH (major
histocompatibility complex) klas I lub II. Takie kompleksy są prezentowane limfocytom T na po-
wierzchni komórek zdolnych do ukazania antygenu APC, którymi najczęściej są komórki dendrytycz-
ne, makrofagi oraz limfocyty B. Na powierzchni limfocytów T receptory te są związane z komplek-
sem CD3, który odgrywa istotną rolę w ekspresji TCR oraz przekazywaniu sygnałów do komórki.
W zależności od budowy receptora wyróżnia się dwa fenotypy komórek T: TCR1 zbudowany z łańcu-
chów
i
oraz TCR2 zbudowany z łańcuchów
i
Około 90–95% limfocytów krwi obwodowej
posiada receptor TCR
a tylko niewielka część (5–10%) posiada ekspresję TCR
. Limfocyty T
z receptorem
/
można podzielić na subpopulacje, które są nośnikiem markera CD4+ i głównie
wspomagają lub indukują odpowiedź immunologiczną (Th) oraz regulatorową (Treg), a także subpo-
pulację, będącą nośnikiem markera CD8+, który jest przeważnie supresorowo-cytotoksyczny (Ts/Tc).
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż
133
Pro-
erytroblast
Erytroblast
Erytrocyt
Mieloblast
Pro-
mielocyt
Mielocyt
Meta-
mielocyt
Neutrofil
Mega-
karioblast
Mega-
kariocyt
Płytka
Prekursor
tymocyta
Wczesny
tymocyt
Tymocyt
Dojrzały
limfocyt T
Komórka
pro B
Komórka
pre- pre- B
Komórka
pre - B
Niedojrzała
komórka B
Dojrzała
komórka B
Komórka
plazmatyczna
Multipotencjalna
komórka macierzysta
CD34+
CD10-
CD13-
CD19-
CD71-
Pro-
monocyt
Monocyt
Makrofag
Monoblast
Prekursor
komórki
NK
Kom. NK
we krwi
obwod.
Komórka
NK
w węźle
Ryc. 1. Schemat prawidłowej hematopoezy.
2.3. Limfocyty T i ich subpopulacje
Limfocyty T biorą udział w bezpośrednim niszczeniu komórek gospodarza zarażonych wiru-
sami lub innymi pasożytami wewnątrzkomórkowymi, współdziałają z limfocytami B i fagocytami
jednojądrzastymi, wzmacniając lub osłabiając odpowiedź immunologiczną. Poszczególne etapy doj-
rzewania i aktywacji limfocytów T charakteryzują się ekspresją ściśle określonych cząsteczek CD.
Tradycyjny podział limfocytów T obejmuje limfocyty T CD4+, określane jako pomocnice (Th) rozpo-
znające antygeny MHC klasy II, oraz limfocyty T CD8+, nazywane limfocytami cytotoksyczno-
-supresorowymi (Ts/Tc), rozpoznające antygeny MHC klasy I.
Limfocyty T
cytotoksyczne pomocnicze supresorowe
Tc Th Ts
Th1 Th2 Th0
Ryc. 2. Schemat różnicowania limfocytów T.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

134
Th1 – wytwarzają IL-2 (stymulacja cytotoksyczności limfocytów) oraz IFN
(aktywacja makrofa-
gów), mają udział w odpowiedzi typu komórkowego. Czynnikami ich wzrostu i różnicowania są
IL-12, IL-18 i IFN
Th2 – wytwarzają IL-4, IL-5, IL-10, IL-13 (wzrost i różnicowanie limfocytów), wspomagają
głównie odpowiedź humoralną. Autokrynowym czynnikiem ich wzrostu i różnicowania jest IL-4.
Antagonizm między Th1 i Th2 (tzw. dewiacja immunologiczna): IFN
(wydzielany przez Th1)
hamuje proliferację i czynność Th2, IL-10 hamuje wytwarzanie cytokin przez Th1, a IL-4 i IL-13
hamują odpowiedź typu komórkowego.
Ts
− Hamują aktywność autoreaktywnych limfocytów T (zabezpieczają przed autoagresją).
− Tolerancja pokarmowa (tolerancja na antygeny podane doustnie).
− Tolerancja na zmienione ligandy peptydowe (zmienione antygeny nabierające cech antagoni-
stów).
− Tolerancja transplantacyjna (tolerancja na przeszczepy allogeniczne).
− Tolerancja infekcyjna – indukują powstawanie innych regulatorowych limfocytów T, co umoż-
liwia przenoszenie tolerancji z jednego osobnika na drugiego.
Tc
− Niszczenie komórek zakażonych przez wirusy i inne mikroorganizmy.
− Niszczenie komórek nowotworowych.
− Mogą leczyć komórkę zakażoną przez wirusy, nie zabijając jej. Limfocyty Tc zdolne są do zabi-
jania komórek na skutek uwalniania enzymów (perforyny, granzyny, granulizyny) oraz na sku-
tek interakcji cząsteczek z nadrodziny TNF (w błonie komórki efektorowej) i TNFR (w błonie
komórki docelowej).
Limfocyty T można również podzielić, w zależności od stopnia kompetencji immunologicznej
i pełnionych czynności, na dwie subpopulacje noszące różne izoformy. Komórki nazywane „naiwny-
mi” lub „dziewiczymi” są pozbawione zdolności pełnienia funkcji pomocniczych wobec limfocytów
B, mogą natomiast pobudzać limfocyty CD8+ do hamowania syntezy IgG. Uważa się, że najważniej-
szymi limfokinami wydzielanymi przez limfocyty dziewicze są IL-2 i INF-
. Tak zwane „komórki
pamięci” reagują na antygen przypominający, ułatwiają syntezę IgG przez komórki B, ponadto cha-
rakteryzują się wysoką produkcją i wydzielaniem IL-4 oraz IL-12, IL-18, a także INF-
, oraz wzro-
stem ekspresji receptora dla IL-2. Wraz z wiekiem zwiększa się liczba komórek T CD4+/CD45RO+
(komórek pamięci), co wiąże się także ze zwiększonym wytwarzaniem IL-4 i proliferacją limfocytów T.
2.4. Limfocyty B i ich subpopulacje
Limfocyty B stanowią 5–15% krążących limfocytów. Ich charakterystyczną cechą jest obec-
ność antygenu CD19. Dzielą się na subpopulacje zgodnie z klasą immunoglobulin, które produkują.
W odróżnieniu od limfocytów T limfocyty B rozpoznają antygeny w formie natywnej, używając
w tym celu immunoglobuliny związanej z błoną komórki.
Limfocyty B
B1 B2
(mają CD5)
Ryc. 3. Schemat różnicowania limfocytów B.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż
135
Receptor limfocytów B jest zbudowany z cząsteczki immunoglobuliny zakotwiczonej w bło-
nie limfocytu oraz dwóch heterodimerów: Ig-
i Ig-
Po stymulacji antygenem limfocyty B prze-
kształcają się w komórki plazmatyczne zaangażowane w odpowiedź pierwotną oraz produkcję prze-
ciwciał klasy IgM, a w mniejszym stopniu IgG. Limfocyty B syntetyzują liczne cytokiny, na przykład
IL-6, IL-10, które wpływają na ich aktywność i dojrzewanie, aktywują komórki dendrytyczne, ukie-
runkowują odpowiedź immunologiczną, a także mają silne działanie chemotaktyczne (IL-16, chemo-
kiny). Oprócz konwencjonalnych limfocytów B2 istnieją również prymitywne limfocyty B1 wykazu-
jące ekspresję powierzchniowej cząsteczki CD5+. Istnieje przypuszczenie, że limfocyty B CD5+ są
pozostałością prymitywnych komórek, które powstały w życiu płodowym i były pierwszą linią obrony
przeciwbakteryjnej. Stanowią one u osób dorosłych około 20% limfocytów B krwi obwodowej, nato-
miast we krwi pępowinowej i śledzionie jest ich 2–3-krotnie więcej. Jest ich również dużo w wątrobie
płodowej. Po urodzeniu odsetek limfocytów B CD5+ obniża się. Produkują głównie przeciwciała IgM,
mniej IgA i IgG o szerokim spektrum swoistości, reagujące krzyżowo z różnymi antygenami bakteryj-
nymi. Znaczny odsetek tych komórek wykrywany jest w jamie otrzewnej i w tkance właściwej błony
śluzowej. Uczestniczą w szybkiej, aczkolwiek mało specyficznej obronie przeciw mikroorganizmom
chorobotwórczym. Immunoglobuliny (przeciwciała) to najważniejsze cząstki układu odpornościowe-
go. Wytwarzane są przez pobudzone limfocyty B (odpowiedź typu humoralnego) pod wpływem anty-
genów, mają zdolność do swoistego wiązania się z nimi, przez co powodują ich inaktywację.
Występują w płynach ustrojowych wszystkich kręgowców. Cząsteczka immunoglobuliny
zbudowana jest z 4 łańcuchów polipeptydowych; 2 lekkich L i 2 ciężkich H połączonych wiązaniem
dwusiarczkowym.
1. Fragment Fab
2. Fragment Fc
3. Łańcuch ciężki
4. Łańcuch lekki
5. Części zmienne łańcuchów (V) – miejsca wiązania antygenu
6. Regiony zawiasowe
Ryc. 4. Schemat budowy przeciwciała.
Fragment Fab przeciwciała zawiera miejsce wiążące antygen, tzw. paratop, i jest on prze-
strzennie dopasowany do determinanty antygenowej – epitopu (fragment antygenu). Region zawiaso-
wy umożliwia ustawienie się fragmentów Fab pod różnym kątem względem siebie i fragmentu Fc. Tu
znajdują się wiązania dwusiarczkowe, które łączą obydwa łańcuchy ciężkie.
We fragmencie FC znajdują się odcinki odpowiadające za aktywację dopełniacza, a także za
wiązanie się z komórkowymi receptorami do fragmentu Fc przeciwciała.
Podstawą klasyfikacji przeciwciał są różnice w budowie ich łańcuchów:
Ciężkich: α, δ, ε, γ, μ,
Lekkich: κ, λ.
Drobne różnice w budowie łańcuchów ciężkich w obrębie tej samej klasy są podstawą różni-
cowania u człowieka podklas, np. IgG1-4. W analogicznych odmianach występują łańcuchy lekkie λ.
Te różnice to tzw. odmiany izotypowe przeciwciał. Przeciwciała występują nie tylko w formach mo-
nomerycznych (4 łańcuchy), lecz mogą także tworzyć formy polimeryczne (posiadają dodatkowy po-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

136
lipeptydowy łańcuch łączący J „joing”). IgA jako monomer występuje w surowicy, a w wydzielinach
śluzowo-surowiczych jako dimer.
Swoistość przeciwciał wynika z konfiguracji przestrzennej w części zmiennej łańcuchów
ciężkich i lekkich, tzn. zależy od kolejności w nich aminkowasów. Części zmienne fragmentu Fab są
różne dla przeciwciał wiążących różne epitopy, a części stałe są identyczne dla wszystkich przeciwciał
danej klasy, ewentualnie podklasy. Wśród przeciwciał, które wiążą ten sam epitop, mogą jeszcze wy-
stępować różnice pod względem dopasowania, czyli tzw. powinowactwo przeciwciała do antygeu.
Krótka charakterystyka immunoglobulin różnych klas:
1. IgA
jest ich więcej niż innych przeciwciał razem wziętych,
większość IgA jest wytwarzana miejscowo w sąsiedztwie odpowiedniego nabłonka i wydalana
wraz z wydzielinami śluzowo-surowiczymi,
wydzielnicze IgA stanowi główny element obrony błon surowiczych i śluzowych przed inwazją
mikroorganizmów,
w osoczu człowieka 80–95% występuje w formie monomerycznej, reszta to formy polimerycz-
ne,
w wydzielinach, tj. łzy, pot, wydzieliny gruczołów przewodu pokarmowego, dróg oddechowych
i dróg moczowych, występują w formie dimerów i są związane z fragmentem wydzielniczym
(s-IgA),
istnieją 2 podklasy: IgA1 (region zawiasowy ma 20 aminokwasów) i IgA2 (region zawiasowy
ma 7 aminokwasów); IgA2 jest odporny na działanie proteaz bakteryjnych i występuje w prze-
wodzie pokarmowym,
fragmenty Fab są bardziej do siebie zbliżone, a ich ruchliwość wobec siebie jest ograniczona.
2. IgD
występują dość licznie wraz z IgM na powierzchni limfocytów B, które nie zetknęły się jeszcze
z antygenem,
region zawiasowy ma 64 aminokwasy, co pozwala na dużą ruchliwość fragmentów Fab wobec
siebie,
mają udział w indukowaniu dojrzewania powinowactwa przeciwciał.
3. IgE
posiadają 4 domeny w częściach stałych łańcuchów ciężkich, ale nie mają regionu zawiasowego,
przeciwciała te, wiążąc się z odpowiednimi receptorami FcR na komórkach tucznych, wywołują
po związaniu antygenu degranulację,
biorą udział w reakcjach alergicznych.
4. IgG
wszystkie podklasy mają region zawiasowy w IgG3, który posiada 62 aminokwasy,
fragmentem Fc łączą się wszystkie klasy z białkiem G paciorkowca, a klasy IgG1, IgG2, IgG4
z białkiem A gronkowca złocistego,
opłaszczając komórki, umożliwiają komórkom NK ich zabicie (cytotoksyczność komórkowa
zależna od przeciwciał), a komórkom żernym fagocytozę (immunofagocytoza),
w największym stężeniu są obecne w surowicy,
u człowieka występują w 4 podklasach,
inicjują klasyczną drogę aktywacji dopełniacza,
przechodzą przez łożysko do organizmu płodu (przechodzą wszystkie podklasy).
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

137
5. IgM
są syntezowane w początkowej fazie odpowiedzi immunologicznej,
w pierwotnej odpowiedzi immunologicznej zostają uwolnione jako pierwsze (ale ich powino-
wactwo jest niewielkie),
są pentamerami (płatek śniegu),
efektywniej aktywują dopełniacz niż IgG.
Cechy antygenu
Antygeny to związki chemiczne, najczęściej wielkocząsteczkowe, które są rozpoznawane
przez komórki układu immunologicznego jako składniki nie własne. Prowadzi to do produkcji kom-
plementarnych przeciwciał lub uczulonych komórek, które w sposób swoisty reagują z tymi przeciw-
ciałami. Głównymi cechami antygenów są immunogenność i antygenowość.
Immunogenność to znaczy zdolność do wywołania przeciw sobie swoistej odpowiedzi im-
munologicznej. Zależy ona od wielu czynników, m.in. wielkości cząsteczki (za małe nie wywołują
reakcji), budowy chemicznej, degradowalności, stężenia (za mała i zbyt duża dawka nie wywołują
odpowiedzi) i drogi wniknięcia do ustroju. W zależności od sposobu podania antygenu, jego degrada-
cja zachodzi w różnych narządach (śledziona, wątroba, płuca, węzły chłonne i inne). Reakcja ta może
być wzmocniona przez związki zwane adjuwantami, które zwiększają zdolność do odpowiedzi immu-
nologicznej.
Antygenowość jest to zdolność do swoistego łączenia się z immunoglobulinami (zarówno
wolnymi, jak i stanowiącymi receptory limfocytów B) i receptorami limfocytów T. Antygen wykazu-
jący tylko antygenowość nazywamy haptenem. Haptenami mogą być proste związki chemiczne, np.
glukoza lub trinitrofenol. Immunogenność zyskują one dopiero po połączeniu z nośnikiem, którym
może być np. cząsteczka białka.
W immunologii transplantacyjnej, przy przeszczepianiu narządów różnice genetyczne między
dawcą a biorcą sprawiają, że układ odpornościowy biorcy rozpoznaje antygeny przeszczepu jako obce
i uruchamia reakcję (odrzucanie) dążącą do jego zniszczenia.
Antygeny przeszczepu dzielimy na:
autogeniczne – dawcą i biorcą jest ten sam osobnik,
syngeniczne – między identycznymi osobnikami tego samego gatunku (identyczna struktura), np.
bliźnięta jednojajowe,
alogeniczne – najistotniejsze przy przeszczepach; dawca i biorca są różnymi genetycznie osobni-
kami tego samego gatunku,
ksenogeniczne – między osobnikami odmiennych gatunków.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

138
3. Rola cytokin w odpowiedzi immunologicznej
(Bogdan Mazur)
Cytokiny jest to duża grupa białek i glikoprotein produkowanych i wydzielanych w niewiel-
kich ilościach przez aktywowane komórki układu odpornościowego (po spotkaniu z antygenem). Są
one zatem nośnikami informacji o toczącej się reakcji obronnej, a działanie ich ma z reguły niewielki
zasięg. Receptory cytokin znajdują się nie tylko w komórkach odpornościowych, ale także poza tym
układem, co oznacza, że informacja przez nie niesiona może być odbierana w wielu miejscach organi-
zmu. Cytokiny działają zazwyczaj w stężeniu pikomolowym.
Cytokiny odgrywają ważną rolę w odpowiedzi immunologicznej:
1. Odpowiedź typu humoralnego. Cytokiny wydzielane są przez limfocyty Th. Na każdym z etapów
tej odpowiedzi na limfocyt B działają inne czynniki, choć żaden z nich nie ogranicza się wyłącznie
do limfocytów B i reguluje najczęściej więcej niż jeden etap. W trakcie tej odpowiedzi cytokiny:
indukują aktywację limfocytów B – IL-4,
stymulują proliferację – IL-4, IL-5, IL-2,
pobudzają różnicowanie: IL-5, IL-6, IL-10, IL-2, IL-4.
Limfocyt B również jest zdolny do wytwarzania cytokin, jednak mogą one pełnić istotną rolę w
odpowiedzi humoralnej na antygeny grasiczozależne.
2. Odpowiedź typu komórkowego. Limfocyty Th oraz wydzielane przez nie cytokiny spełniają w tej
odpowiedzi większą rolę. Cytokiny wydzielane przez limfocyty Th bezpośrednio naciekają miejsce
podania antygenu lub wtargnięcia mikroorganizmów. Są to np.: IFN–
, TNF, MIF, które aktywują
makrofagi, zwiększając ich właściwości fagocytarne. Umożliwiają im także zabicie rozwijających
się w nich bakterii i pasożytów. Makrofagi i limfocyty wytwarzają również czynniki indukujące
uwolnienie histaminy przez komórki tuczne.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

139
4. Typy reakcji nadwrażliwości
(Bogdan Mazur)
Nadwrażliwością nazywamy stan spaczonej odpowiedzi immunologicznej, który prowadzi do
uszkodzenia tkanek i zapoczątkowania procesu zapalnego. Jest to silna reakcja immunologiczna na
niezbyt szkodliwy czynnik, nadmiernie aktywująca układ immunologiczny.
Wyróżniamy cztery typy nadwrażliwości. W przypadku trzech pierwszych typów za nadwraż-
liwość odpowiedzialne są czynniki humoralne, natomiast za typ IV czynniki komórkowe.
Nadwrażliwość typu I
U jej podłoża leżą reakcje antygenu z przeciwciałami klasy IgE, które łączą się z receptorami
powierzchniowymi komórek tucznych i bazofilów. Efekt kliniczny związany jest głównie z wydziela-
niem przez te komórki różnych mediatorów. Nazwa „nadwrażliwość typu I” jest często zamiennie
stosowana z terminem „alergia”, którą definiujemy na podstawie obecności swoistych przeciwciał IgE
w surowicy, dodatnich prób skórnych i objawów klinicznych, takich jak np. astma. Na wystąpienie
alergii mogą mieć wpływ czynniki genetyczne oraz środowiskowe. W przypadku czynników dzie-
dzicznych, poszukiwania genów odpowiedzialnych za jej wystąpienie obejmują:
1. Badania nad korelacją występowania określonych antygenów MHC z odpowiedzią na dany anty-
gen.
2. Badania nad dziedziczeniem predyspozycji do alergii. Dowodzą one, że za wystąpienie alergii od-
powiada nie jeden, ale interakcja kilku genów odpowiedzialnych za kodowanie białek uczestniczą-
cych w reakcjach immunologicznych (bardzo duże znaczenie mają tutaj geny kodujące, np. IL-4,
IL-5, IL-13).
W przypadku czynników środowiskowych istotną rolę odgrywają tutaj tzw. czynniki infekcyj-
ne. W dzisiejszych czasach czystość i umiejętność obrony przed drobnoustrojami sprawiają, że kon-
takt z mikroorganizmami jest ograniczony. Uważa się, że brak takiego „treningu” immunologicznego
może prowadzić do spaczenia niektórych mechanizmów obrony i rozwoju alergii. Jest to tak zwana
koncepcja higieny. Poza czynnikami infekcyjnymi wpływ na rozwój nadwrażliwości typu I mają
czynniki toksyczne i zanieczyszczenia środowiska. Alergie częściej występują w krajach rozwiniętych
niż uboższych, w których co prawda jest mniej zanieczyszczeń, ale ludzie przechodzą bardziej inten-
sywny „trening” immunologiczny (brak szczepionek, higiena).
Nadwrażliwość typu II – reakcje cytotoksyczne
Główną rolę odgrywają tutaj IgM i IgG. Uszkodzenie narządów jest wynikiem zabijania ko-
mórek obcych lub posiadających na powierzchni nowe antygeny (np. po przebyciu infekcji bakteryjnej
lub wirusowej fragmenty struktur tych drobnoustrojów pozostają w organizmie i są opsonizowane, co
może prowadzić do uszkodzeń narządów). Wyróżniamy następujące mechanizmy uszkadzania tkanek.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

140
Reakcje cytotoksyczne:
1. Reakcje potransfuzyjne – następują po przetoczeniu krwi niezgodnej w układzie AB0. Dochodzi
tutaj do wewnątrznaczyniowego niszczenia przetaczanych erytrocytów pod wpływem działalności
dopełniacza.
2. Cytopenie polekowe – lek lub jego zanieczyszczenia mogą osadzać się na powierzchni krwinek
bądź łączyć się z białkami ich błony komórkowej. Prowadzi to do wytwarzania swoistych przeciw-
ciał i przy długotrwałym stosowaniu leku do uszkodzenia komórek szpiku i krwi. Do takich leków
zaliczmy: sulfonamidy, piramidon, fenacetyna. Objawami tych reakcji są granulocytopenia, trom-
bocytopenia, niedokrwistość hemolityczna.
3. Konflikt serologiczny – niezgodność w zakresie układu Rh, gdy matka ma krew grupy Rh-, a płód
Rh+. Własne erytrocyty płodu niszczone są przez matczyne przeciwciała klasy IgG, które przecho-
dzą do płodu przez łożysko. Indukcja pierwotnej odpowiedzi na antygen D wynika z przedostania
się krwi Rh+ do krwiobiegu matki. Jeśli w następnej ciąży płód jest Rh+, to jego erytrocyty będą
niszczone. Aby tego uniknąć, podaje się matce przeciwciała anty-D do 48 godz. po urodzeniu
dziecka, w celu neutralizacji erytrocytów płodu.
Nadwrażliwość typu III – reakcje z udziałem kompleksów immunologicznych
Kompleksem immunologicznym nazywane są cząsteczki składające się z antygenów połączo-
nych z przeciwciałami oraz niekiedy ze składnikami dopełniacza. Kompleksy te w pewnych warun-
kach mogą odkładać się w tkankach i inicjować miejscowo proces zapalny. Ma na to wpływ wiele
czynników, m.in. wielkość kompleksu. Wyróżniamy małe, średnie i duże kompleksy. Małe są usuwa-
ne w wątrobie i nerkach, duże niszczone przez komórki żerne wątroby i śledziony, natomiast średnie
wykazują silne działanie patogenne, np.:
Odczyn Arthusa – antygen wprowadza się podskórnie; odpowiednie przeciwciała łączą się z anty-
genem, formuje się kompleks; immunokompleksy aktywują płytki krwi i komórki tuczne oraz wy-
twarzanie histaminy; następuje zwiększenie przepuszczalności naczyń i rozwija się proces zapalny.
Objawia się obrzękiem, zaczerwienieniem lub nawet martwicą skóry.
Zewnątrzpochodne alergiczne zapalenie pęcherzyków płucnych: płuco farmera, płuco hodowcy
pieczarek, płuco hodowcy gołębi. W tym przypadku antygeny dostają się do organizmu drogą
wziewną.
Możemy również wskazać na sytuację, w której kompleksy krążą po organizmie i odkładają się
w różnych tkankach – choroba posurowicza (podanie obcogatunkowego białka).
Nadwrażliwość typu IV (późnego) – dominacja odpowiedzi typu komórkowego
Reakcje wynikają tutaj z pierwotnego zaangażowania limfocytów typu T. Odpowiedź ta wy-
stępuje po kilku godzinach. Duże znaczenie odgrywa w zakażeniach bakteryjnych, wirusowych, grzy-
biczych. Typowym przykładem jest śródskórne podanie tuberkuliny – do reakcji dochodzi dlatego, że
osoba miała już wcześniej kontakt z prątkami, tzn. została uczulona. Najczęstszą formą nadwrażliwo-
ści typu IV jest nadwrażliwość kontaktowa, np. kontaktowe zapalenie skóry. Zaburzenia funkcjono-
wania układu odpornościowego mogą wynikać z zaburzeń wrodzonych, często genetycznie uwarun-
kowanych, lub wtórnych, nabytych wskutek działania wielu niekorzystnych czynników na nasz orga-
nizm. Zarówno wtórne niedobory odporności, jak i wrodzone zaburzenia dojrzewania i różnicowania
się narządów oraz komórek układu odpornościowego, a także zaburzenia aktywacji i funkcji poszcze-
gólnych linii komórkowych prowadzą do upośledzenia humoralnej lub komórkowej odpowiedzi im-
munologicznej, a więc do stałego lub okresowego upośledzenia bądź braku odporności. Na skutek
tego dochodzi do zwiększonej predyspozycji na zakażenia wirusowe, bakteryjne, grzybicze i pasożyt-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

141
nicze. Należy również pamiętać o tym, że wiele zespołów pierwotnych zaburzeń odporności charakte-
ryzuje się wysoką częstotliwością występowania rozrostów nowotworowych i procesów autoimmuno-
logicznych. Do wczesnego wykrycia zaburzeń odpornościowych, monitorowania ich i wdrażania dzia-
łań leczniczych bądź profilaktycznych niezbędna jest nowoczesna diagnostyka immunologiczna.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

142
5. Szczepionki – wiadomości ogólne
(Mariola Kunicka)
Bardzo często w przypadkach klinicznych zakażeń bakteryjnych, kiedy celowana antybiotyko-
terapia okazuje się z różnych powodów nieskuteczna, lekarz sięga po leczenie tzw. swoiste, czyli
szczepionki. Pod pojęciem szczepionek bakteryjnych rozumie się antygeny bakterii, które po podaniu
stymulują układ odpornościowy do produkcji przeciwciał odpornościowych. Antygeny najczęściej
wprowadza się do organizmu pacjenta na drodze pozajelitowej – podskórnej. W ostatnich czasach
dużą popularnością cieszą się szczepionki podawane doustnie. Oprócz swojego swoistego działania
stymulują również układ immunologiczny poprzez aktywację własności żernych komórek biorących
udział w fagocytozie. Istnieją różne ich podziały, np. ze względu na zawartość antygenów, sposób ich
otrzymywania czy drogę podania. Ze względu na liczbę patogenów bakteryjnych w szczepionce, dzie-
limy je na mono- i poliwalentne (tzw. wieloważne), natomiast biorąc pod uwagę zawartość antygeno-
wą na: żywe (zjadliwe), żywe atenuowane (odzjadliwione), zabite pełnokomórkowe, zabite zawierają-
ce oczyszczone frakcje antygenowe oraz zawierające anatoksyny.
Szczepionki żywe (zjadliwe)
Preparatów tych obecnie rzadko się używa, ze względu na niebezpieczeństwo wywołania in-
fekcji bakteryjnej. Przykładem jest tu szczepionka przeciwko cholerze.
Szczepionki żywe atenuowane
Są to szczepionki zawierające szczepy bakterii odzjadliwione. Atenuacja, czyli odzjadliwienie
szczepów bakterii użytych do produkcji szczepionek, może być przeprowadzona różnymi metodami,
w każdym jednak przypadku właściwości antygenu są zachowane. Obecnie, oprócz pasażowania, do
produkcji tego typu szczepionek używa się metod genetycznych, np. naświetlania bakterii lub hodowli
z dodatkiem substancji o właściwościach mutagennych. Szczepionek atenuowanych używa się do
szczepień profilaktycznych, np. przeciw BCG, brucelozie, tularemii, dżumie, wąglikowi.
Szczepionki zabite pełnokomórkowe
Zawierają najczęściej jeden lub kilka szczepów bakterii wyizolowanych z terenów endemicz-
nych lub epidemicznych ognisk chorobowych. Jeżeli szczep bakterii użyty do produkcji szczepionki
jest jednolity pod względem antygenowym, do produkcji używa się szczepu wzorcowego. Szczepionki
takie przygotowuje się ze szczepów zabitych bakterii (inaktywacja cieplna, chemiczna, promienie
nadfioletowe, metody kombinowane cieplno-chemiczne), pozbawionych substancji balastowych dla
układu odpornościowego. Coraz częściej używa się również pełnokomórkowych szczepionek w stanie
suchym, utworzonych poprzez oczyszczanie bakterii, dodawanie acetonu i zamrażanie. Cechują się
one wieloletnim okresem trwałości. Do tej grupy zalicza się szczepionki przeciwko durom brzusznym,
krztuścowi, cholerze.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

143
Szczepionki zawierające oczyszczone frakcje antygenowe
Powstają poprzez poddawanie oczyszczonych komórek bakteryjnych autolizie lub frakcjono-
waniu chemicznemu. Dzięki rozbiciu bakterii, można wykorzystać frakcje najbardziej czynne antyge-
nowo. Eliminuje to występowanie częstych odczynów poszczepiennych, które są odpowiedzią organi-
zmu na pozostały „balast” komórkowy. Przykładem są szczepionki przeciw durowi brzusznemu, du-
rom rzekomym A i B.
Anatoksyny
Są elementem składowym szczepionek składających się ze zinaktywowanych egzotoksyn bak-
teryjnych. Anatoksyny te otrzymuje się najczęściej poprzez wymiareczkowanie egzotoksyny np. for-
maliną i działaniem temperatury około 37°C przez 6 tygodni. Na skutek różnych reakcji chemicznych
otrzymuje się toksoid, który jest dobrym antygenem całkowicie pozbawionym swojej toksyczności.
Przykładem szczepionek tego rodzaju są używane do szczepień: anatoksyny tężcowa i błonicza zawar-
te w szczepionce Di-Te-Per.
Autoszczepionki
Należą do szczepionek zabitych pełnokomórkowych, wykonanych ze szczepów własnych bak-
terii chorego. Materiał pobrany od pacjenta w postaci wymazu bakteriologicznego jest posiewany na
odpowiednie podłoża bakteriologiczne: wybiórczo-namnażające i wybiórczo-różnicujące. Następnie
wykonuje się identyfikację szczepów bakterii. Badania bakteriologiczne przeprowadza się zgodnie
z metodami stosowanymi w diagnostyce bakteriologicznej, z uwzględnieniem zaleceń Państwowego
Zakładu Higieny w Warszawie oraz producentów odczynników i testów. Po uzyskaniu wyizolowa-
nych szczepów bakterii, zwłaszcza wielolekoopornych, takich jak: MRSA, MRCNS, VRE, VISA,
VRSA, ESβL i HLAR, pomijając szczepy paciorkowców, wykonuje się autoszczepionkę. Podobnie
jak inne szczepionki, może być monowalentna (z jednego, ściśle określonego szczepu bakterii) lub
poliwalentna (z kilku szczepów bakterii). Pacjent po otrzymaniu autoszczepionki, która jest przygoto-
wana i może być wykorzystana tylko przez niego, w celu leczenia ściśle określonego schorzenia bak-
teryjnego, udaje się do lekarza kierującego, który wykonuje i odczytuje próbę uczuleniową na prepa-
rat. Odczytu próby uczuleniowej może dokonać jedynie lekarz, który próbę wykonał.
Próba ta składa się z próby wczesnej oraz późnej i określa nadwrażliwość typu wczesnego
i późnego na preparat. Dodatni wynik jest bezwzględnym przeciwwskazaniem do podania autoszcze-
pionki, gdyż może on wywołać wstrząs anafilaktyczny lub inny obraz chorobowy alergii, np. ostrą
pokrzywkę. Jeżeli próba uczuleniowa jest ujemna, czyli w miejscu jej założenia po 30 minutach i 24
godzinach nie występuje zaczerwienienie lub jego średnica jest mniejsza niż 10 mm, preparat podaje
się pod kontrolą lekarza, według dołączonego do autoszczepionki schematu dawkowania. Do leczenia
autoszczepionką zakwalifikowani mogą być pacjenci z przewlekłymi schorzeniami o etiologii bakte-
ryjnej. Nie wykonuje się preparatu z paciorkowców oraz innych bakterii o dużym zróżnicowaniu sero-
logicznym (antygenowym), gdyż uzyskana odporność dla określonego serotypu nie chroni przed wy-
stąpieniem zakażenia bakteryjnego, wywołanego przez inny serotyp tego samego gatunku. Autoszcze-
pionka jest wykorzystywana w przypadkach opornych na wcześniej podawane antybiotyki. Nie może
być to pierwsza metoda lecznicza stosowana w zakażeniach bakteryjnych, wywołanych szczepami
lekowrażliwych bakterii. Ze względu na patomechanizm działania, leczenie tym preparatem musi być
decyzją przemyślaną przez lekarza, z uwzględnieniem wskazań i przeciwwskazań. Autoszczepionki
nie stosuje się w ostrym okresie chorobowym. Wskazaniem są przewlekłe zakażenia o etiologii bakte-
ryjnej (z wyjątkiem etiologii paciorkowcowej), oporne na dotychczas stosowane leczenie antybioty-
biotykami i chemioterapeutykami. Szczepy bakterii, z których wykonywana jest autoszczepionka po-
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

144
winny być potwierdzone bakteriologicznie co najmniej trzykrotnie, aby wyeliminować możliwości
wykonania preparatu z bakterii „nałożonych” lub stanowiących tzw. zanieczyszczenie.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż

145
Bibliografia
1.
Bannister B.A., Begg N.T., Gillespie S.H. Choroby zakaźne. Urban & Partner, Wrocław 1998.
2.
Błażejak S., Gientka I. Wybrane zagadnienia z mikrobiologii żywności. Wydawnictwo SGGW, Warszawa
2010.
3.
Chapel H., Haeney M., Misgah S., Snowden N. Immunologia kliniczna. Wyd. I pol. Red. G. Senatorski.
Czelej, Lublin 2009.
4.
Dubos R. Człowiek, środowisko, adaptacja. PZWL, Warszawa 1970.
5.
Immunologia. Red. J. Gołąb, M. Jakóbisiak, W. Lasek, T. Stokłosa. PWN, Warszawa 2012.
6.
Kayser F.H., Bienz K.A., Eckert J., Zinkernagel R.M. Mikrobiologia lekarska. PZWL, Warszawa 2007.
7.
Kunicki-Goldfinger W.J.H. Życie bakterii. PWN, Warszawa 2007.
8.
Lasek W. Immunologia. Podstawowe zagadnienia i aktualności. PWN, Warszawa 2009.
Lydyard P.M., Whelan A., Fanger M.W.
Immunologia. Krótkie wykłady. PWN, Warszawa 2012.
10.
Male D., Brostoff J., Roth D.B., Roitt I. Immunologia. Urban & Partner, Wrocław 2008.
11.
Mikrobiologia i choroby zakaźne. Red. G. Virella. Wyd. I pol. Red. P.B. Heczko. Urban & Partner, Wrocław
2000.
12.
Murray P.R., Rosenthal K.S., Pfaller M.A. Mikrobiologia. Wyd. I pol. Red. A. Przondo-Mordarska, G. Mar-
tirosian, A. Szkradkiewicz. Urban & Partner, Wrocław 2011.
13.
Podstawy mikrobiologii lekarskiej. Red. L. Jabłoński. PZWL, Warszawa 1986.
14.
Ptak W., Ptak M., Szczepaniak M. Podstawy Immunologii. PZWL, Warszawa 2008.
15.
Salyers A.A., Whitt D.D. Mikrobiologia. Różnorodność, chorobotwórczość i środowisko. PWN, Warszawa
2010.
16.
Zaremba M.L, Borowski J. Mikrobiologia lekarska. PZWL, Warszawa 1997.
Podręcznik został zakupiony przez K. Czekaja - nr zamówienia 1709
Dzieło może być wykorzystywane tylko na użytek własny, do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja, redystrybucja lub odsprzedaż
Wyszukiwarka
Podobne podstrony:
MIKROBIOLOGIA OGÓLNA- zestaw 1i2, mikrobiologia
Ściąga - Systematyka i Mikrobiologia ogólna, Inżynieria Środowiska, Biologia i ekologia
kubica, biologia z elementami mikrobiologii, Ogólna charakterystyka komórek nowotworowychx
Mikrobiologia ogólna test - odpowiedzi
Produkcja antybiotyków MIKROBIOLOGIA OGÓLNA Hans G Schlegel
MIKROFLORA GLEBY, biologia, 3 semestr, mikrobiologia, mikrobiologia ogólna. kolokwium 2
mikrobiologia-ogolna-egzamin-2012-pierwszy-termin
MIKROBIOLOGIA OGÓLNA I ŻYWNOŚCI
wykłady, Mikrobiologia ogólna
Mikrobiologia ogólna skrypt
egzamin MIKROBIOLOGIA OGÓLNA- zestaw 1i2 poprzednie lata, TŻ 2, Mikrobiologia, Egzamin-OGÓLNA
MIKROBIOLOGIA OGÓLNA I ŻYWNOŚCI
ĆWICZENIE X, biologia, 3 semestr, mikrobiologia, mikrobiologia ogólna. kolokwium 2
Mikroflora powietrza, biologia, 3 semestr, mikrobiologia, mikrobiologia ogólna. kolokwium 2
mikrobiologia ogolna sciaga 97, Studia Biologia, Mikrobiologia
Mikrobiologia ogólna, Mikrobiologia
więcej podobnych podstron