Chemia organiczna
Jacek Młynarski
Zakład Chemii Organicznej

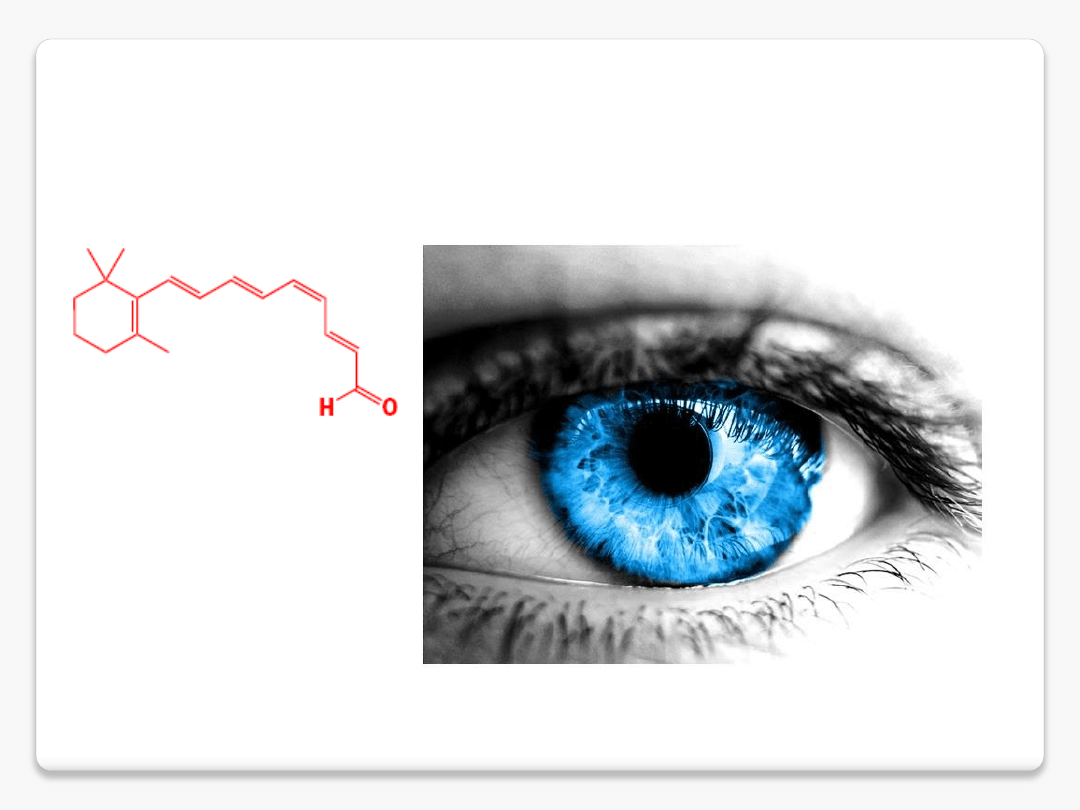
naturalne barwniki
likopen
karoten

naturalne barwniki
E161b
Luteina
– żółty barwnik roślinny należący do ksantofili (podgrupa karotenoidów). Alkoholowa
pochodna
α-karotenu. W lecie maskowana przez chlorofil, widoczna jest w naturze głównie jesienią,
gdy nadaje
liściom żółty kolor. Występuje również w żółtku jaja kurzego oraz komórkach
tłuszczowych. Do zastosowań przemysłowych otrzymuje się ją z traw.
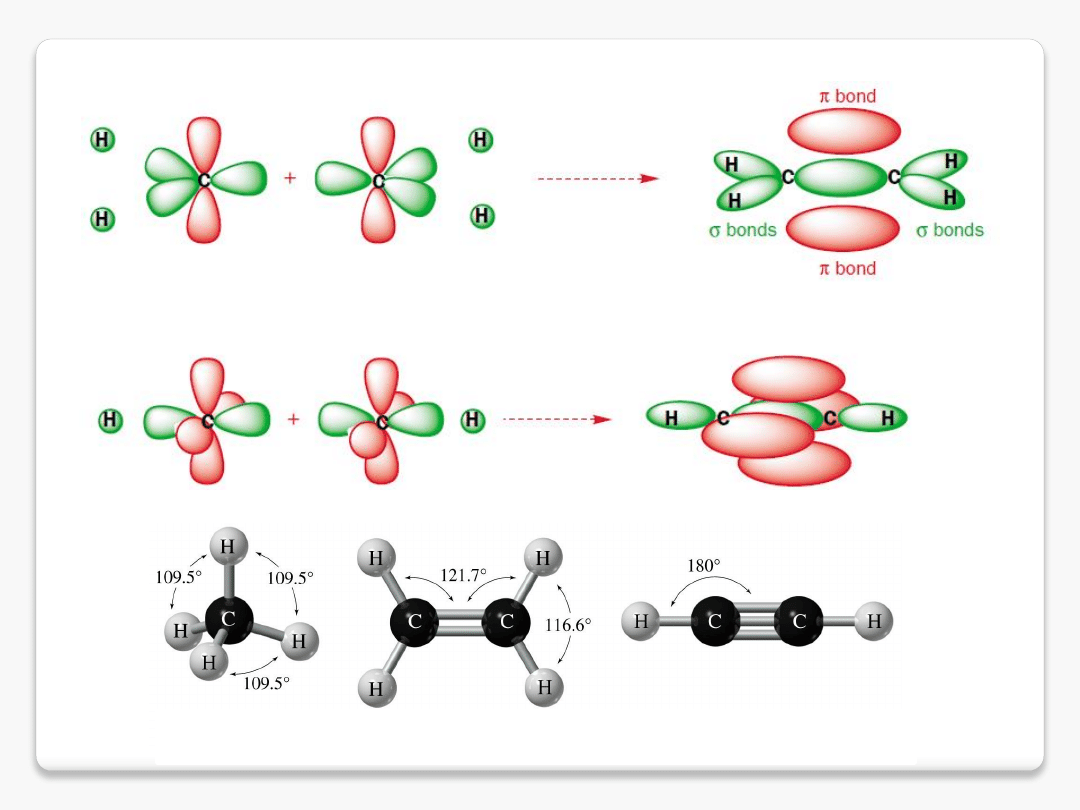
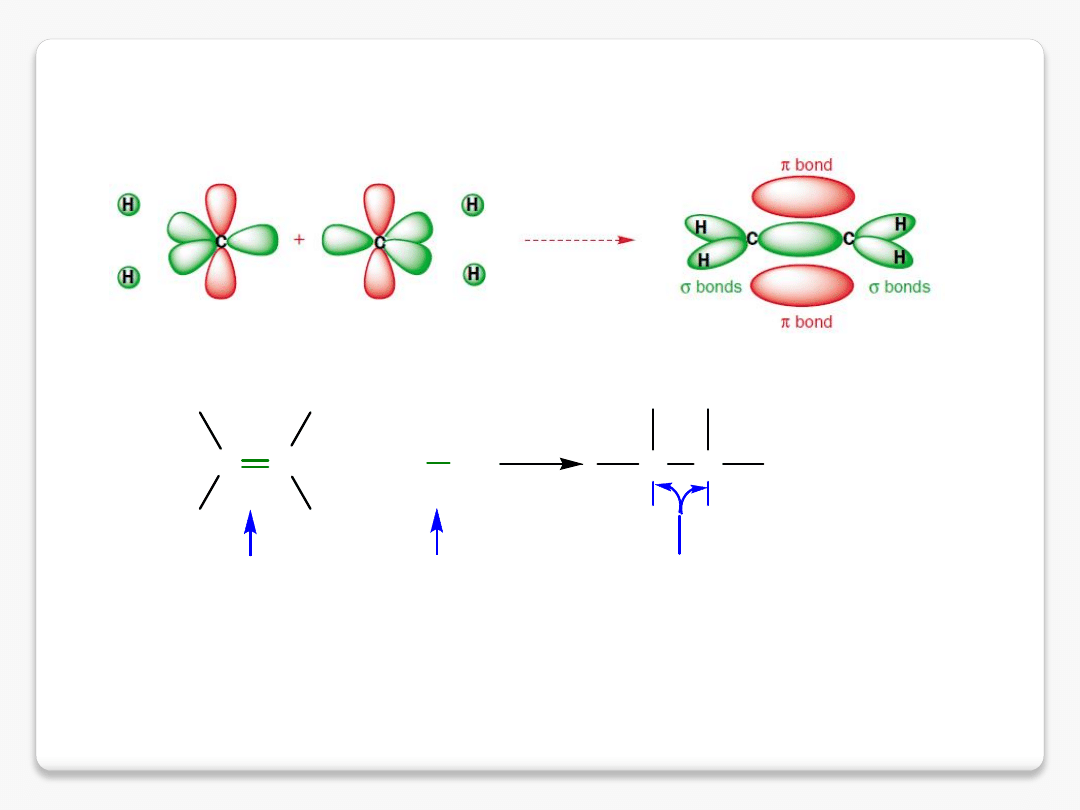
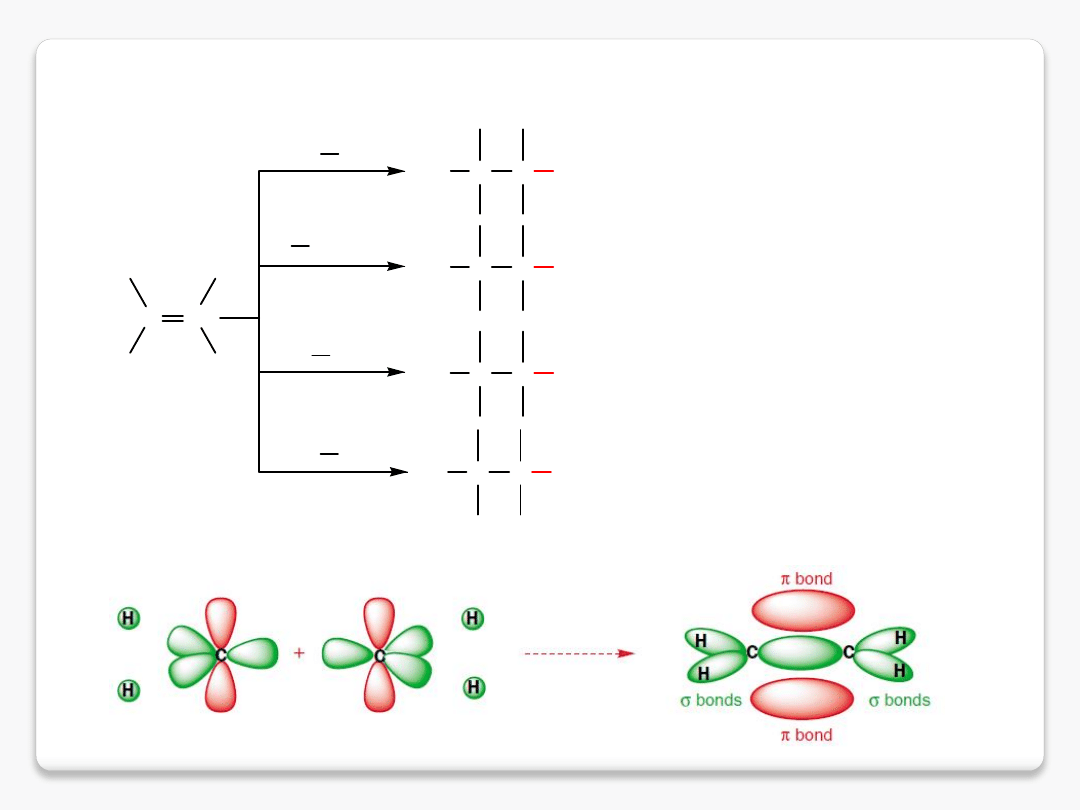
hybrydyzacja sp
2
hybrydyzacja sp
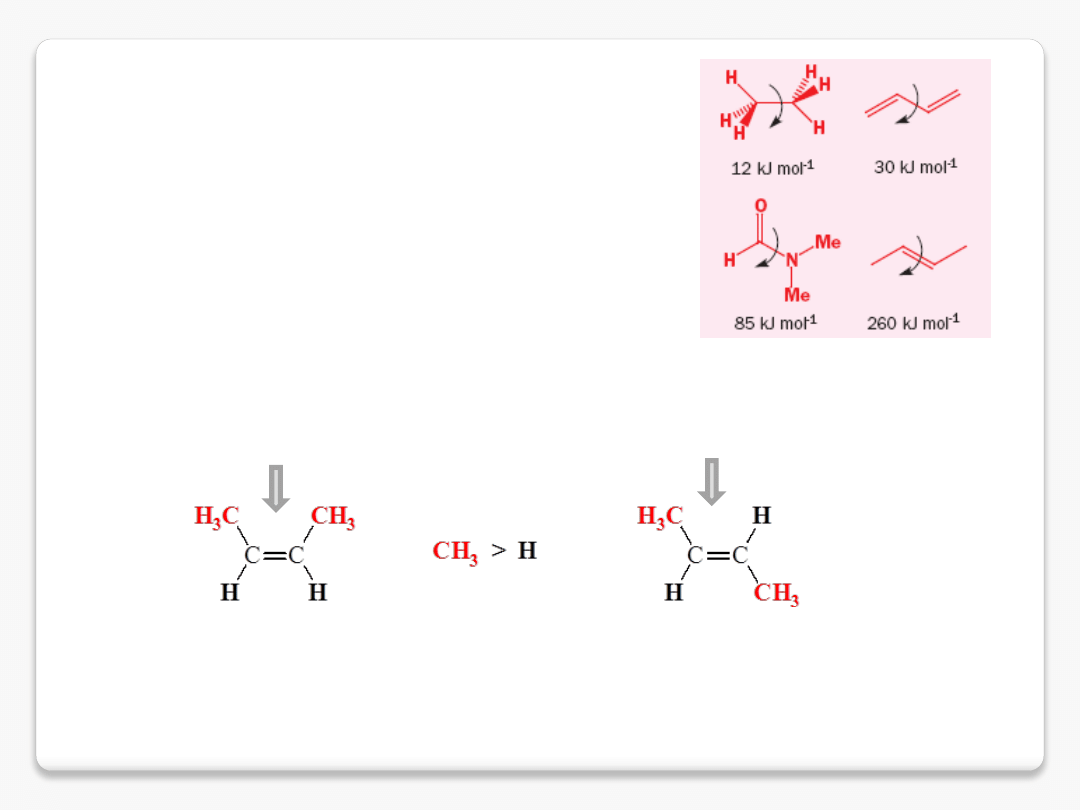
izomeria cis-trans
izomeria Z-E
(Z)-but-2-en
(E)-but-2-en
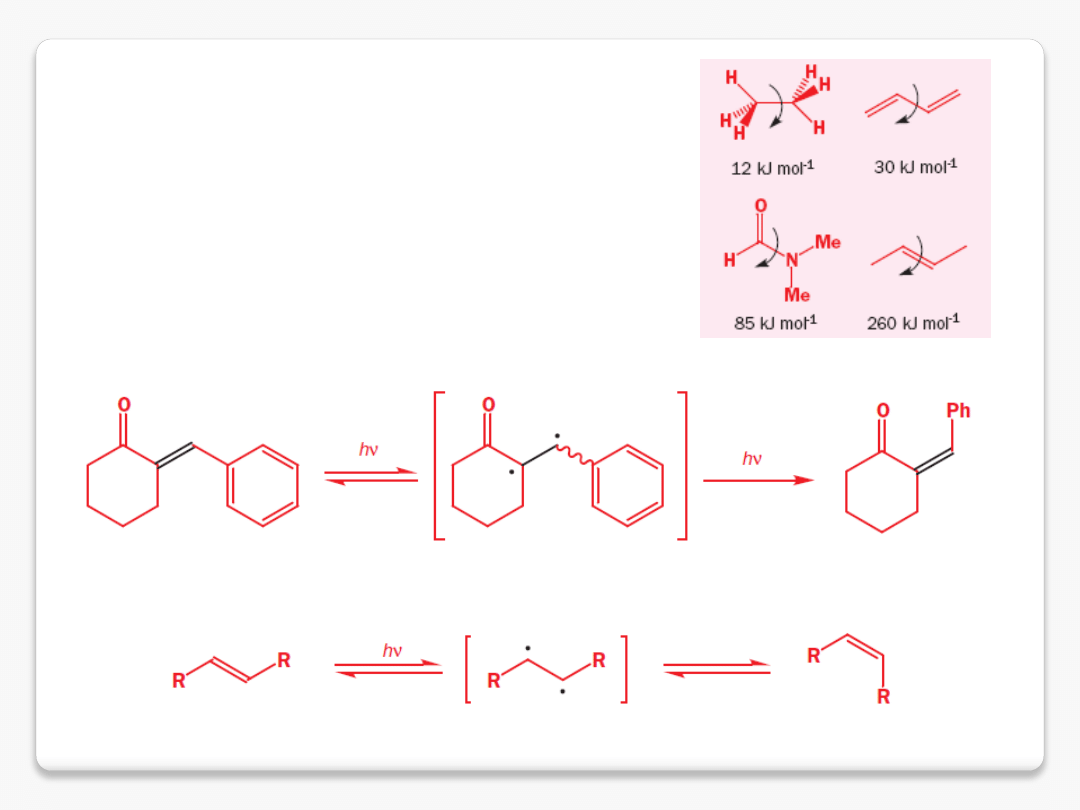
izomeryzacja wiązań podwójnych
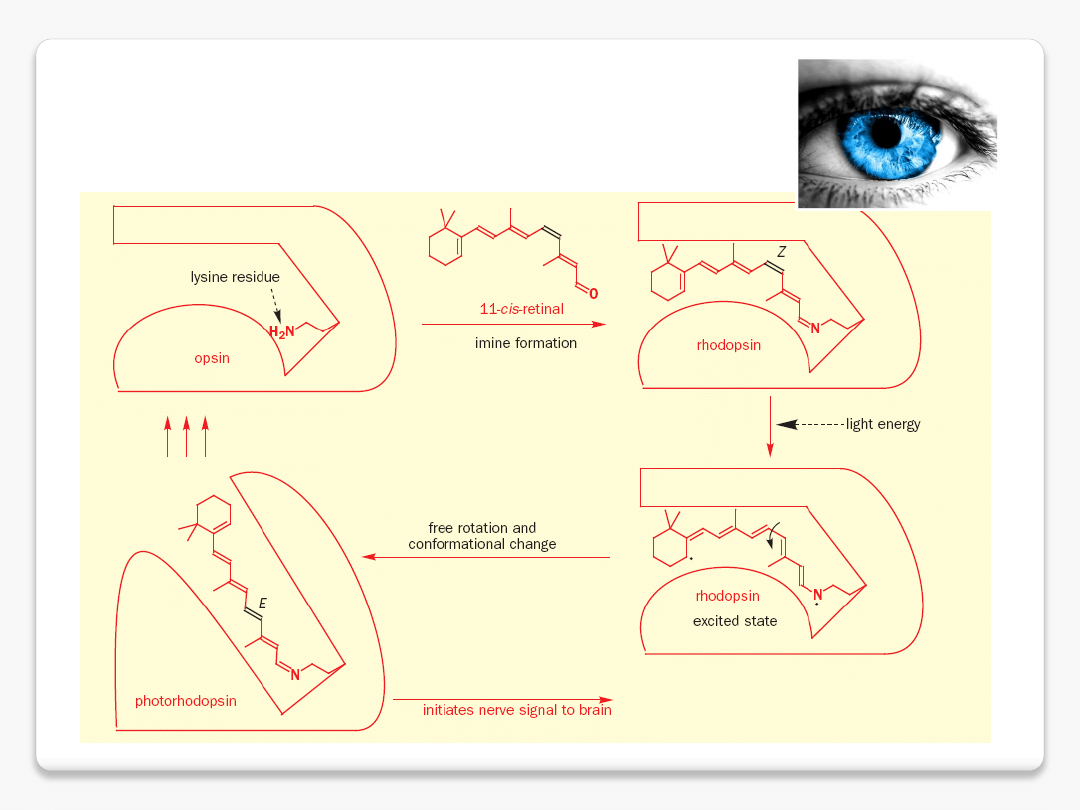
izomeryzacja wiązań podwójnych
C
C
+
X
Y
C
C
Y
X
2
reakcja addycji
sp
2
sp
3
CH
2
=CH
2
+ H
2
Ni, Pd lub Pt
CH
3
–CH
3
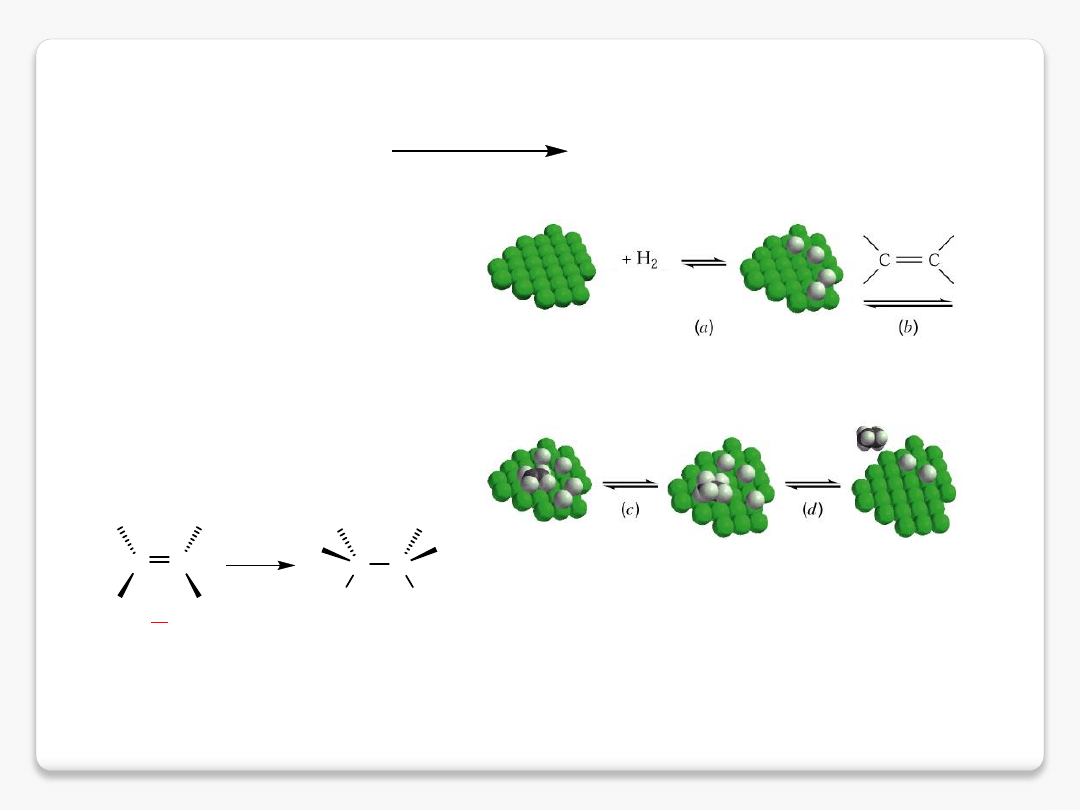
uwodornienie alkenów – reakcja addycji
C
C
C
C
H
H
+
H
H
Pt
katalityczne uwodornienie to addycja syn

H
2
CH
3
CH
2
CH
2
CH
3
+
Pt
H
o
=
127 kJ mol
-1
butan
1-buten (C
4
H
8
)
CH
3
CH
2
CH
CH
2
H
2
CH
3
CH
2
CH
2
CH
3
+
Pt
H
o
=
120 kJ mol
-1
butan
C
C
H
CH
3
H
H
3
C
H
2
CH
3
CH
2
CH
2
CH
3
+
Pt
H
o
=
115 kJ mol
-1
butan
C
C
CH
3
H
H
H
3
C
uwodornienie alkenów – trwałość alkenów
R
–CH=CH–R + H
2
uwodornienie
R
–CH
2
–CH
2
–R + ciepło
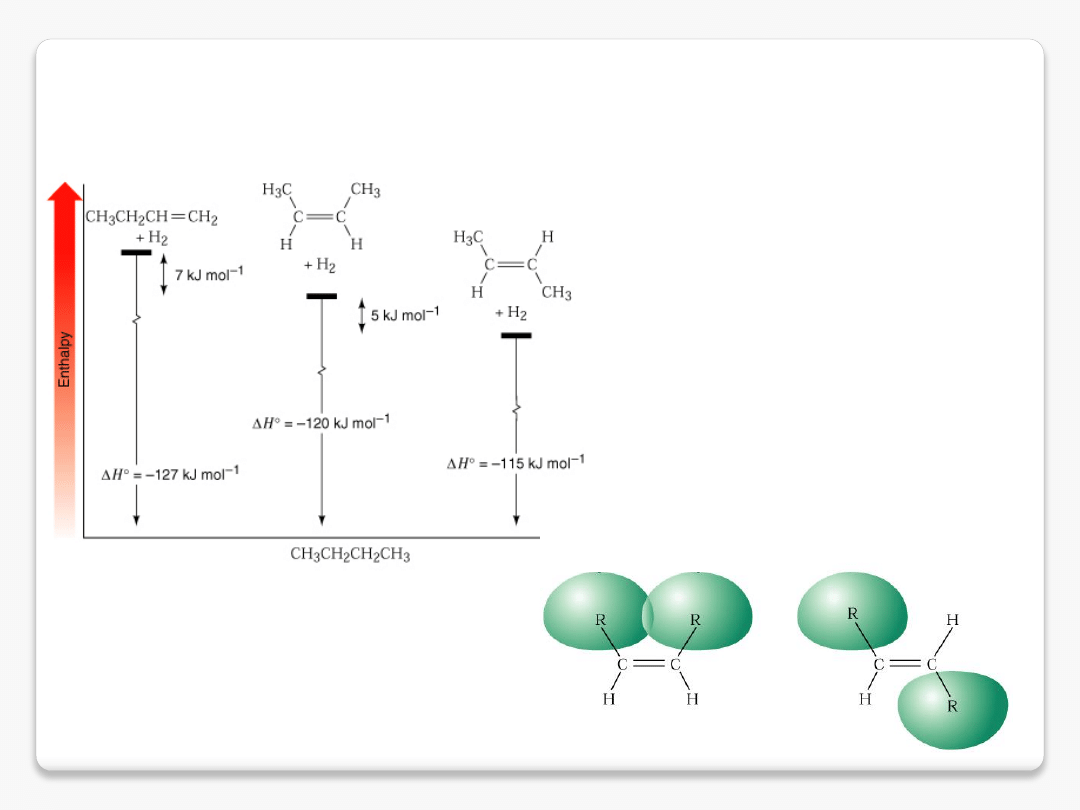
uwodornienie alkenów
stabilność alkenów: trans(E)>cis(Z)
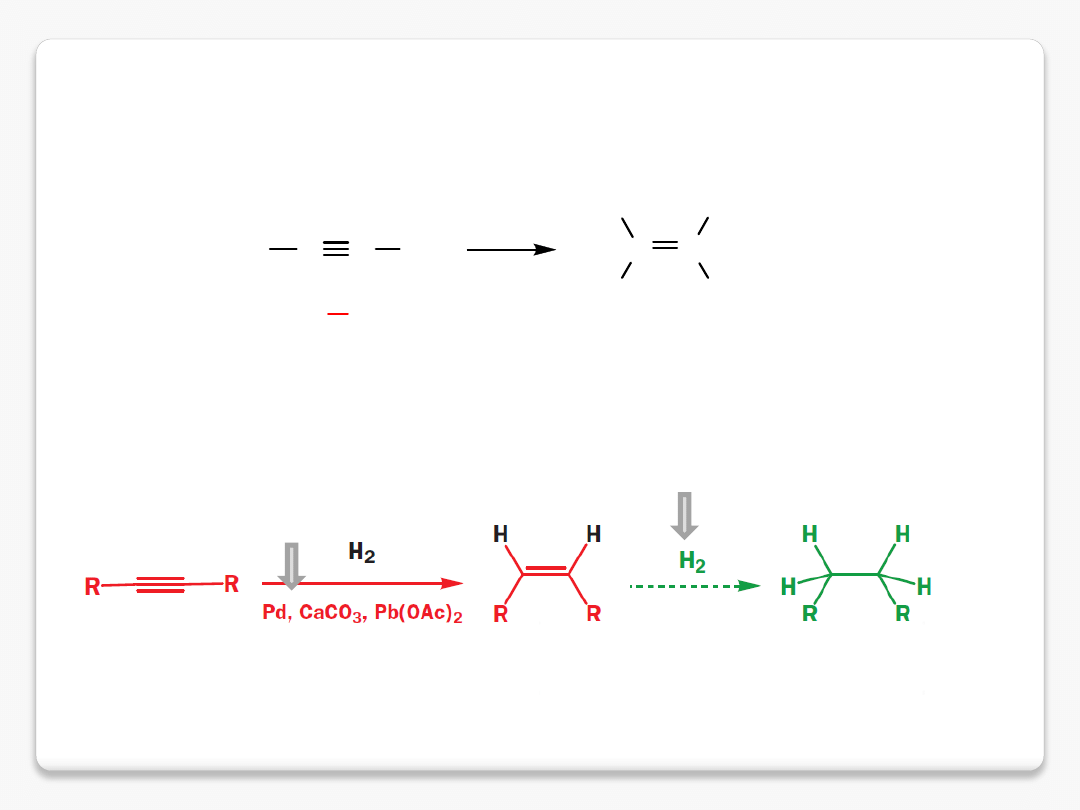
uwodornienie alkinów
addycja syn
C
C
C
C
H
H
+
H
H
Pt
CH
3
CH
3
CH
3
H
3
C
but-2-en
katalizator
Lindlara
bardzo wolno
katalizator Lindlara może zawierać
sole baru, lub chinolinę osadzone na
miejscach aktywnych katalizatora Pd
addycja elektrofilowa do wiązań podwójnych
C
C
H
C
C
X
H
C
C
OSO
3
H
H
C
C
OH
X
C
C
X
X
X
H
OH
H
OSO
3
H
H
X
alken
chlorki alkilowe
wodorosiarczany
alkilowe
alkohole
dihaloalkany
H
A (kat.)
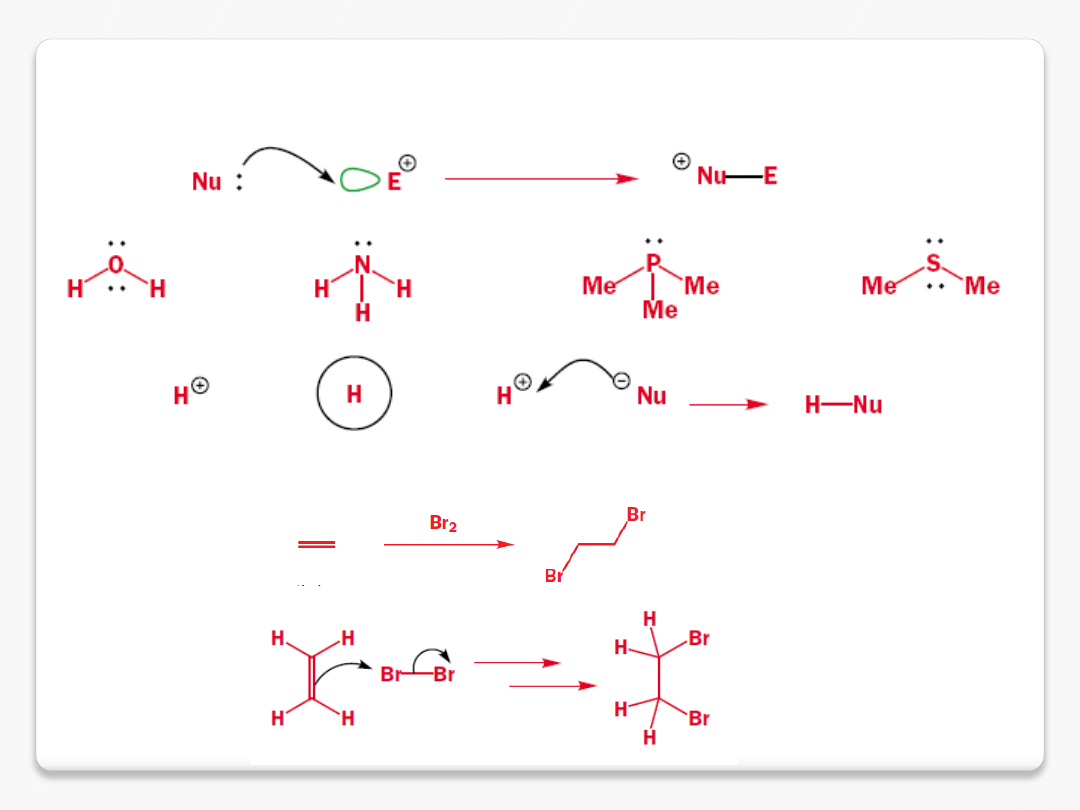
elektrofile i nukleofile
elektrofile: H
+
, Br
2
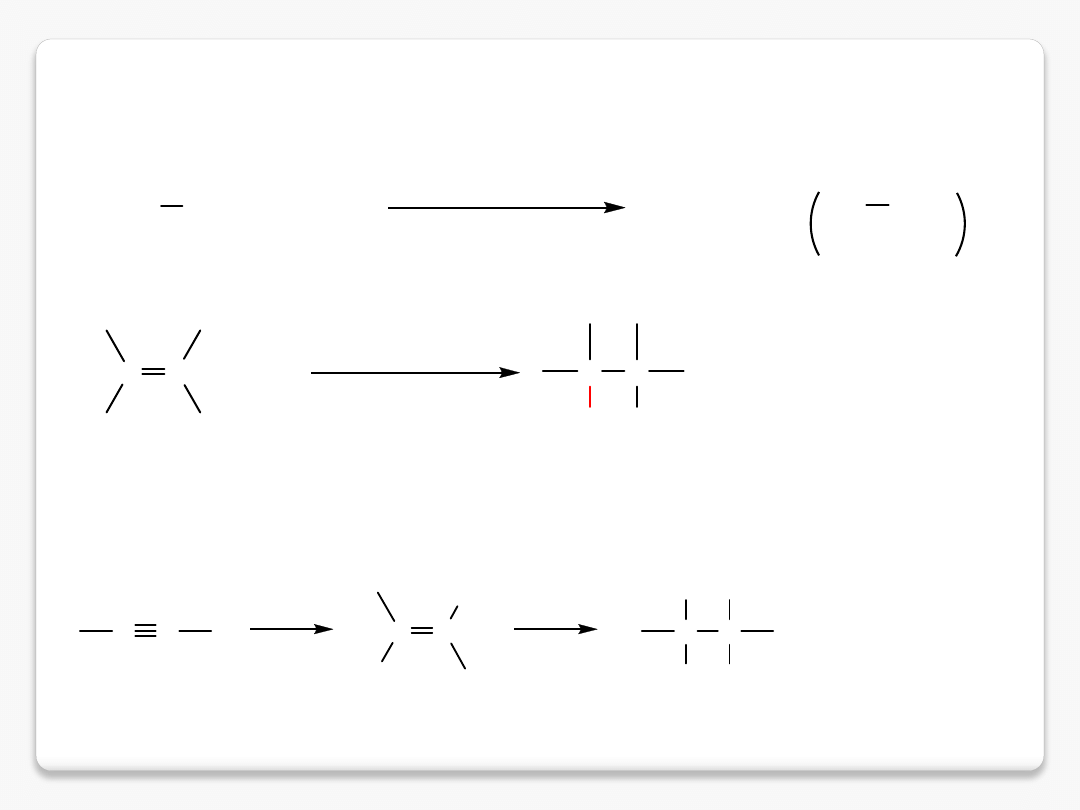
reakcja substytucji i addycji
R
H
+
Br
2
temperatura pokojowa
bez swiatla, CCl
4
brak reakcji
alkan
brom
R
Br
bromoalkan
C
C
+
Br
2
temperatura pokojowa
bez swiatla, CCl
4
C
C
Br Br
vic-dibromoalkan
szybkie odbarwienie
mieszaniny reakcyjnej
test na wiazania
wielokrotne
alken
brom
C
C
Br
2
CCl
4
C
C
Br
Br
C
C
Br
Br
Br
Br
tetrabromoalkan
dibromoalken
Br
2
CCl
4
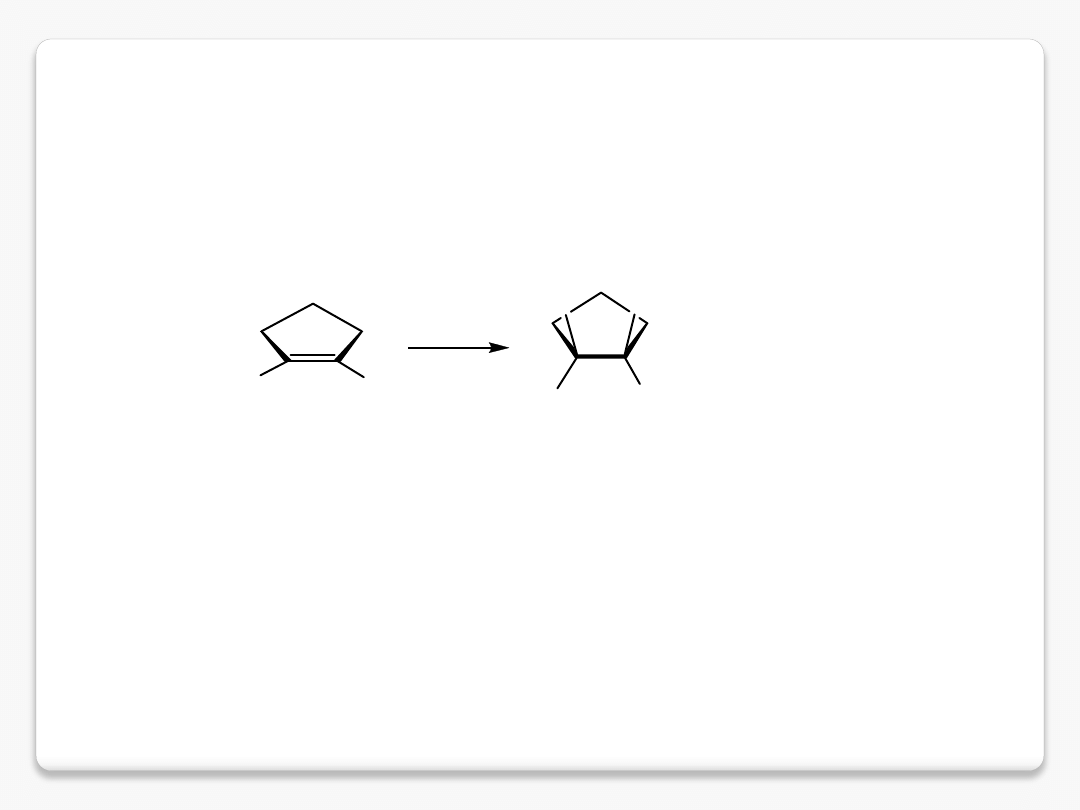
Br
2
CCl
4
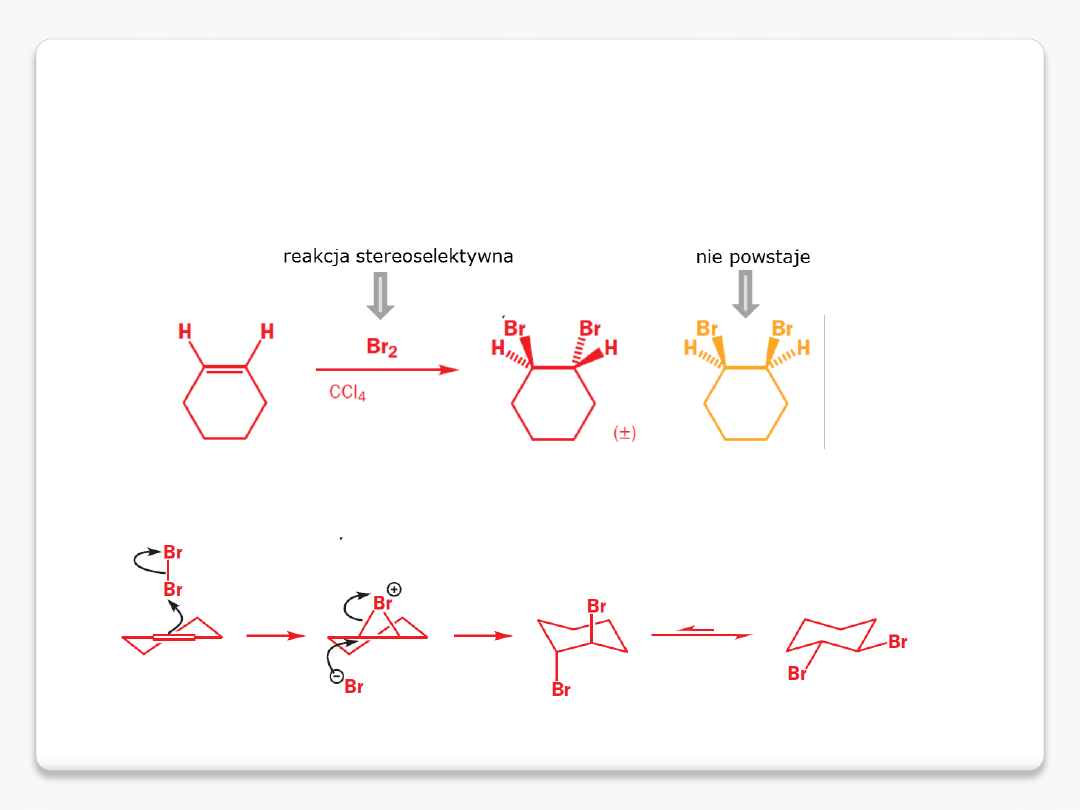
trans-1,2-dibromocyklopentan
H
H
H
Br
H
Br
stereochemia reakcji
reakcja addycji anti
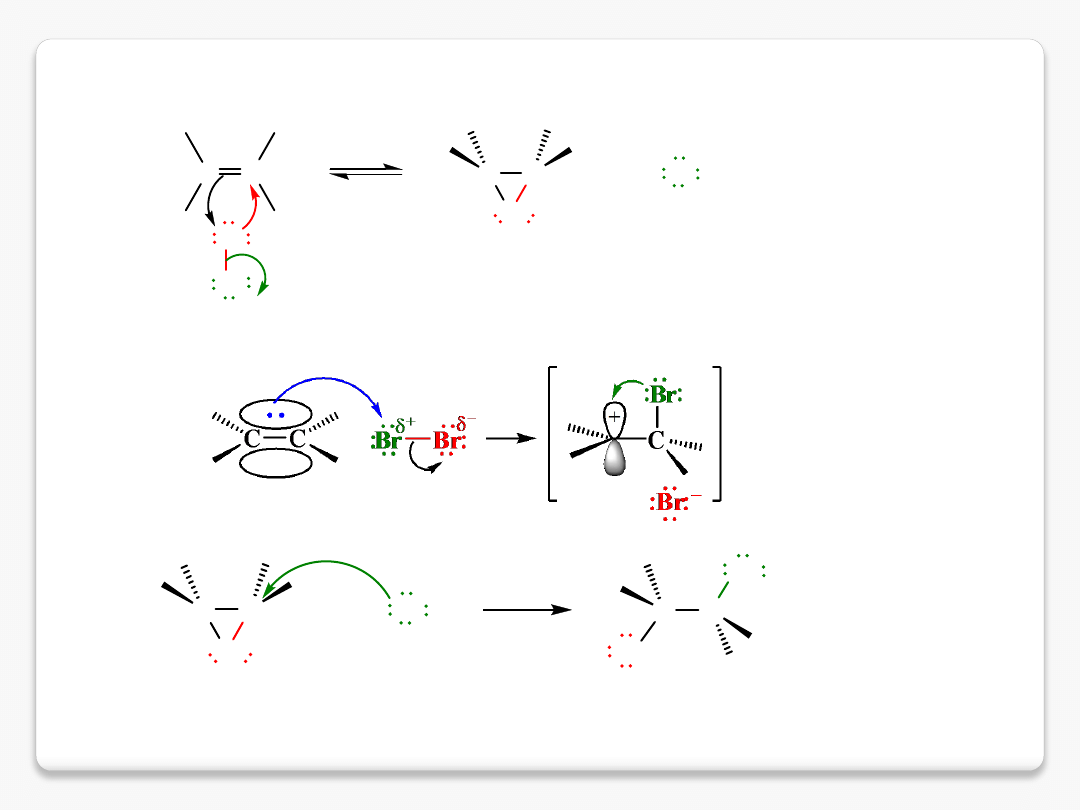
C
C
C
C
Br
Br
+
Br
Br
jon bromoniowy
jon bromkowy
+
mechanizm reakcji
C
C
Br
Br
vic-anti-dibromoalkan
C
C
Br
Br
+
+
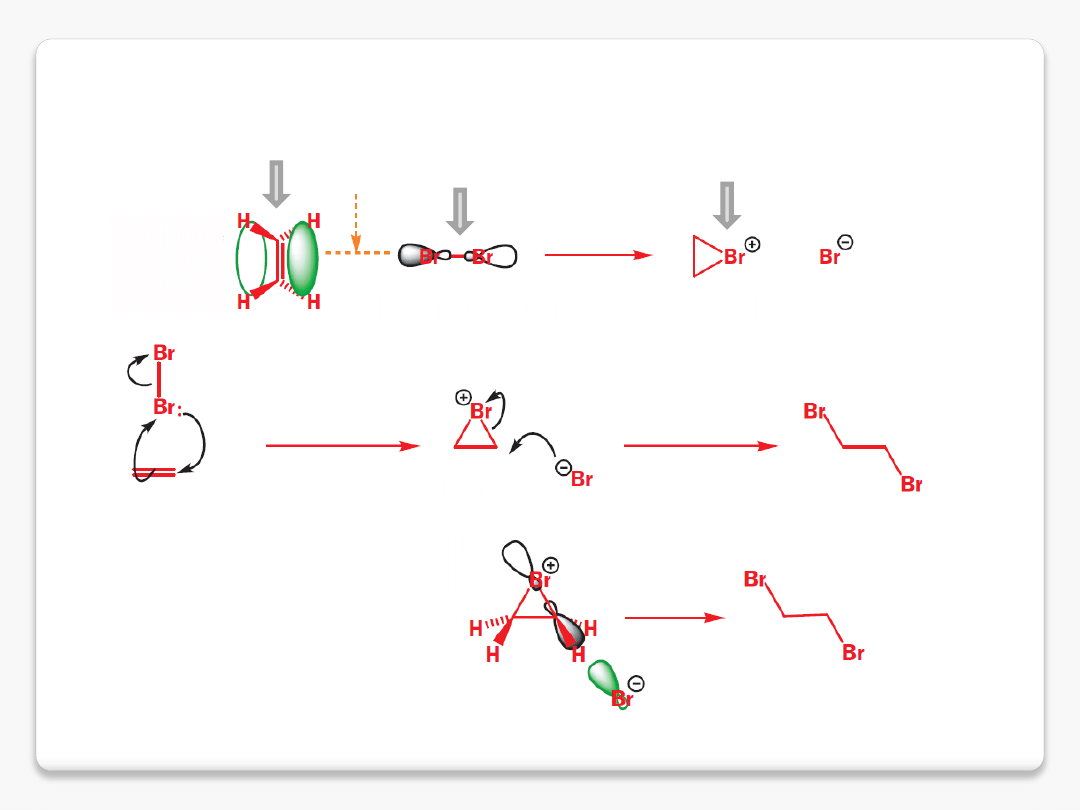
mechanizm reakcji
HOMO
obsadzony
LUMO
pusty
*
jon
bromoniowy
C
C
+
H
X
C
C
H
X
addycja reagentów niesymetrycznych
regioselektywność reakcji
reguła Markownikowa
CH
2
CHCH
3
CH
2
CHCH
3
Br
H
Br
H
H
2
C
CHCH
3
+
HBr
CH
3
CHCH
3
Br
2-bromopropan
praktycznie nie powstaje
1-bromopropan
(BrCH
2
CH
2
CH
3
)
więcej przyłączonych atomów wodoru
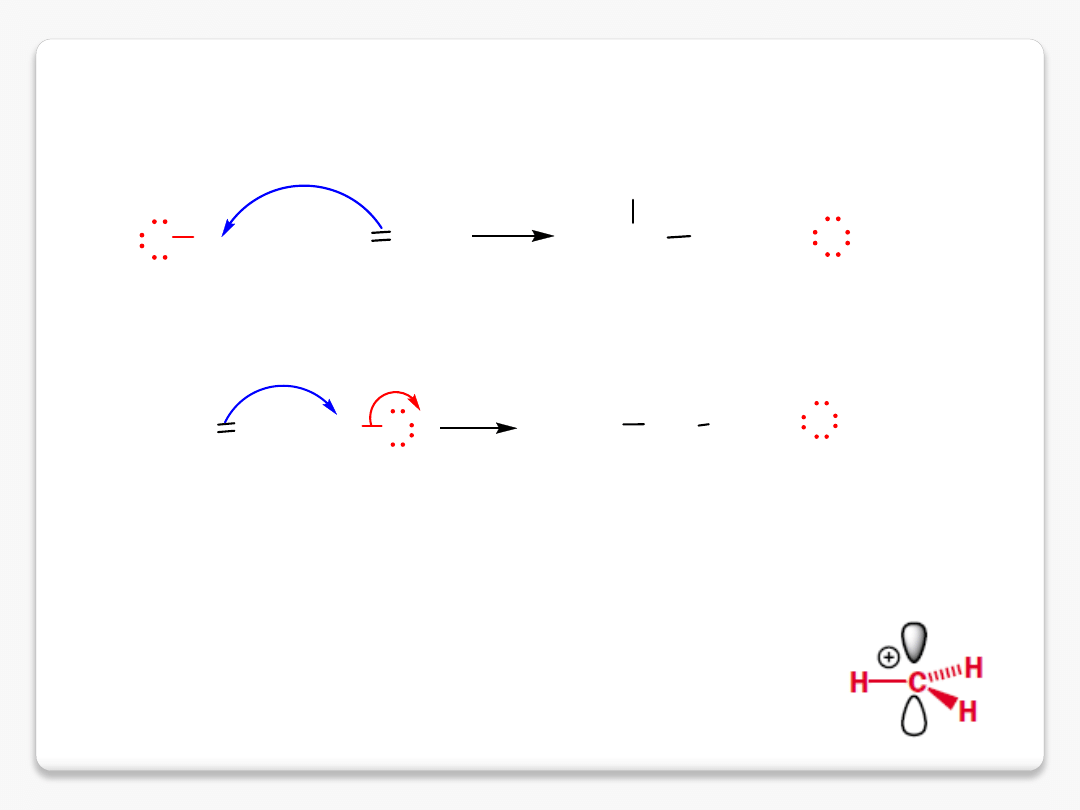
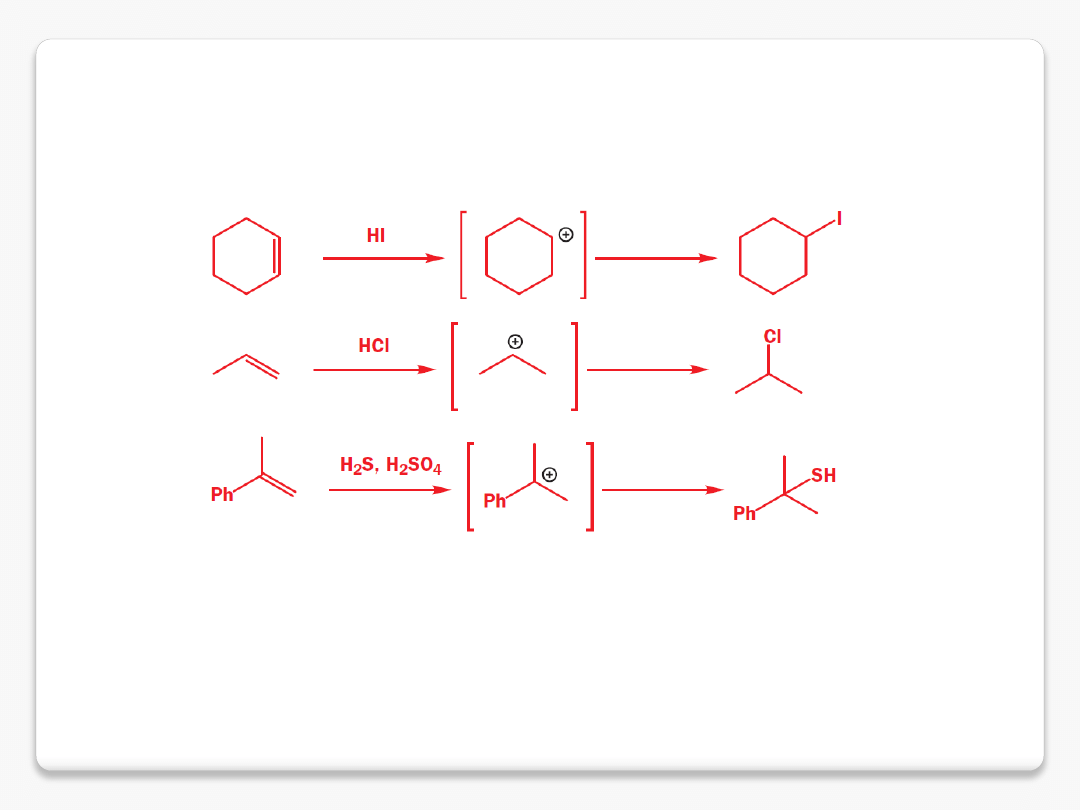
wyjaśnienie mechanizmu: karbokationy
X
H
CH
3
CH CH
2
+
CH
3
CH
H
CH
2
+
+
1
o
karbokation
X
(mniej stabilny)
CH
3
CH CH
2
+
+
CH
3
CH
CH
2
H
+
H
X
X
2
o
karbokation
(bardziej stabilny)
stabilność karbokationów:
3˚ > 2˚ > 1˚
addycja elektrofilowa niesymetrycznego reagenta do
niesymetrycznie podstawionego wiązania podwójnego
zachodzi poprzez utworzenie bardziej stabilnego karbokationu
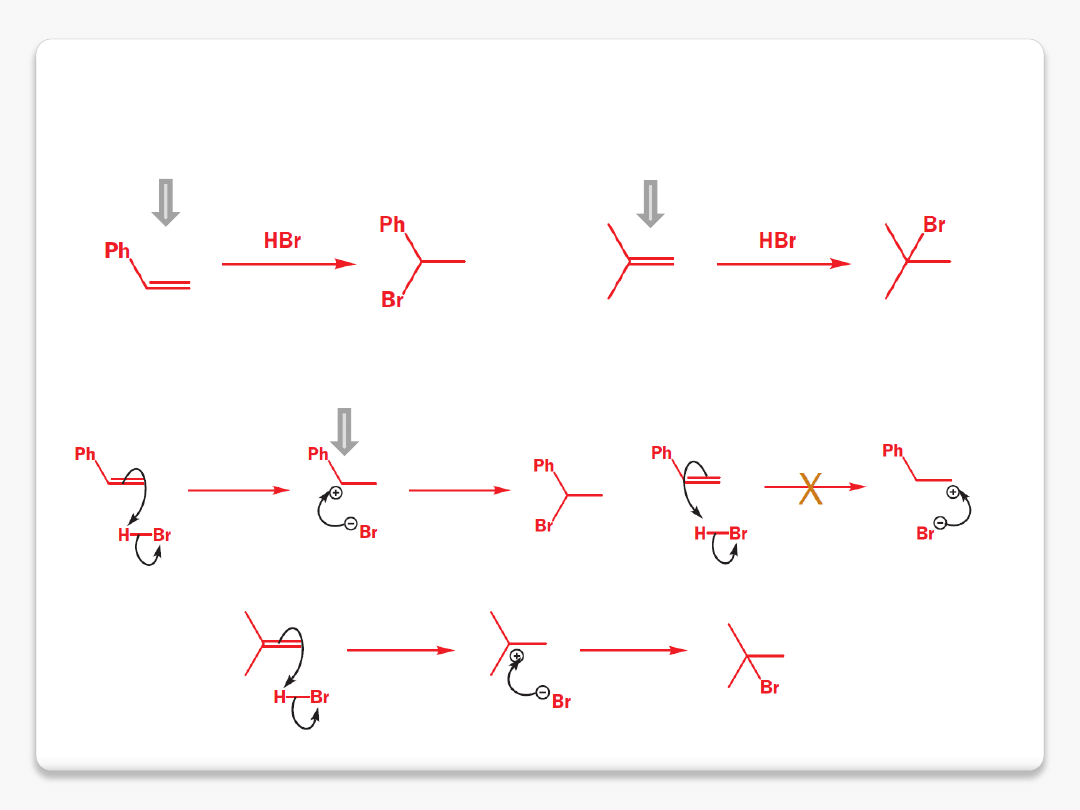
styren
izobuten
stabilizowany
karbokation benzylowy
wyjaśnienie mechanizmu: karbokationy
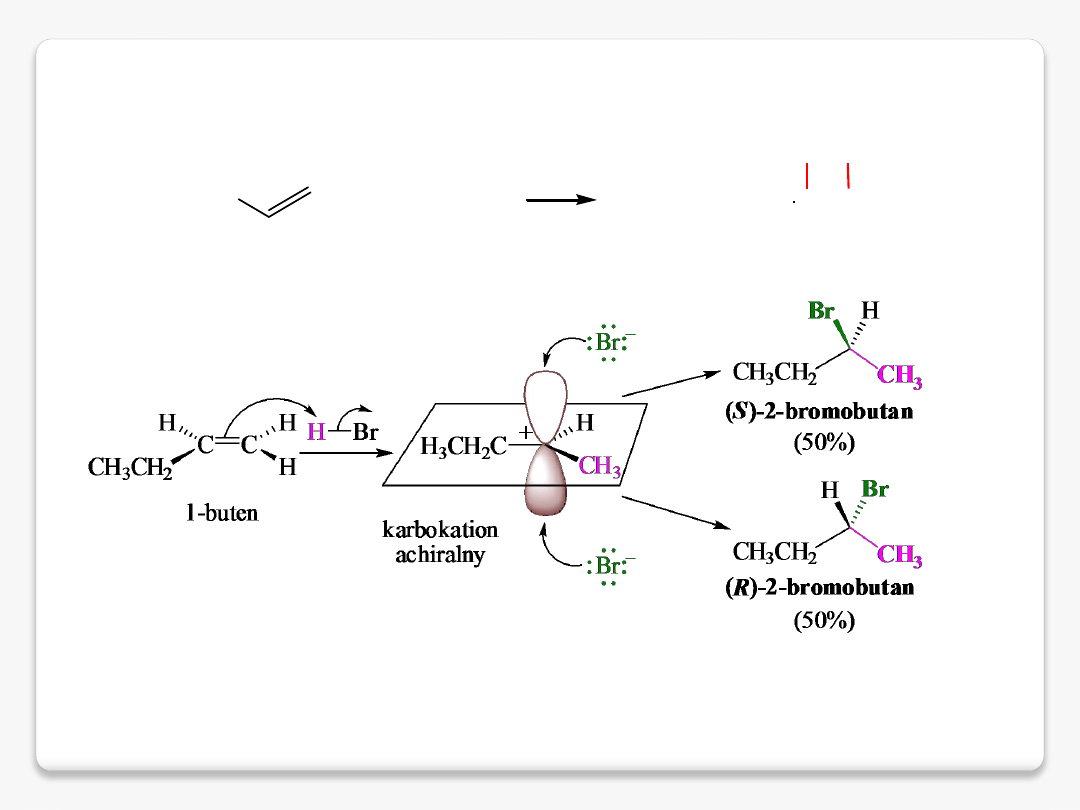
stereochemia reakcji
CH
3
CH
2
+
*
CH
3
CH
2
CHCH
2
Br H
HBr
stereochemia reakcji
reakcje stereoselektywne
to reakcje w których powstaje głównie jeden
stereoizomer
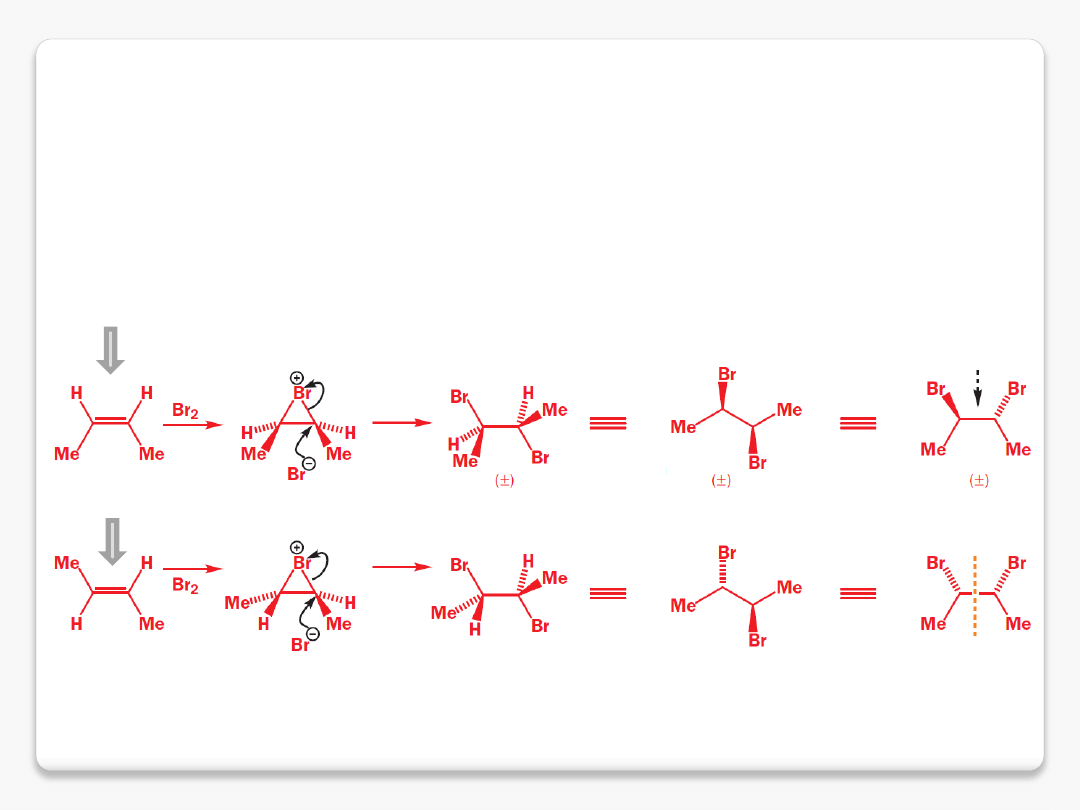
stereochemia reakcji
reakcje stereospecyficzne
to reakcje których mechanizm wskazuje, że stereochemia
produktu
zostaje określona przez stereochemię substratu
Z-but-2-en
E-but-2-en
mezo
addycja innych nukleofili
UWAGA: możliwe
przegrupowania karbokationów
będą
omówione na kolejnych wykładach
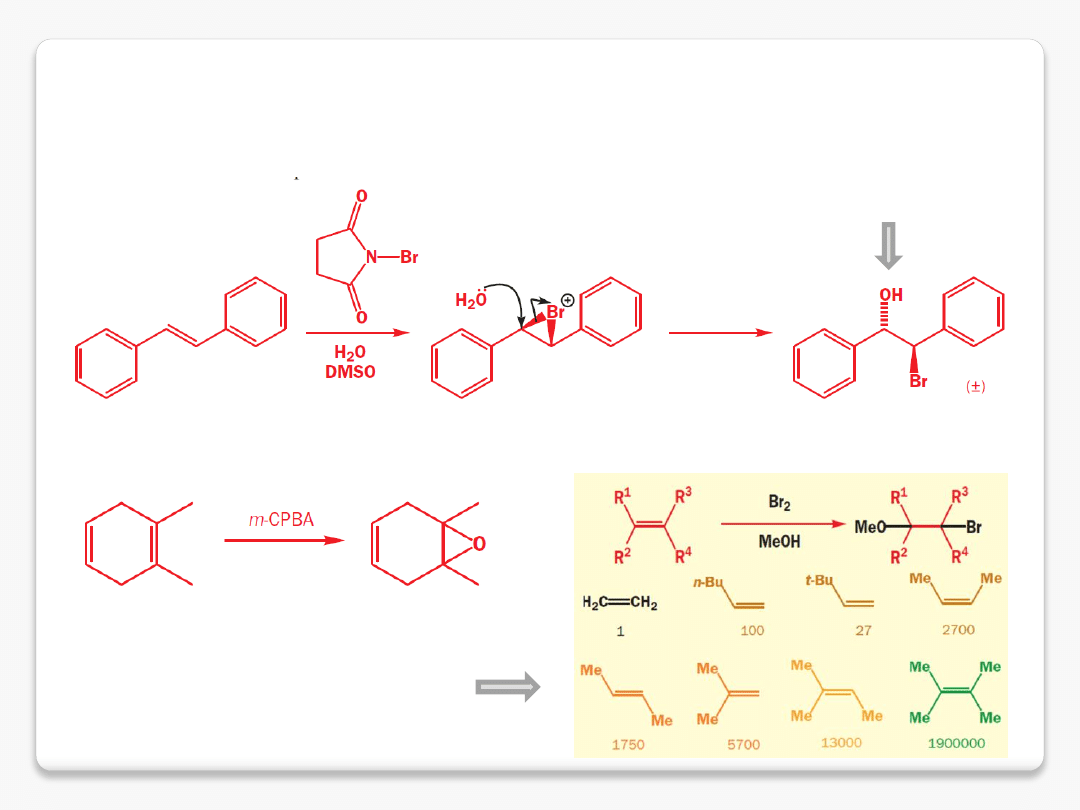
addycja innych nukleofili
bromohydryna
wiązanie podwójne jest nie tylko bardziej
trwałe w bardziej podstawionym alkenie,
ale też bardziej nukleofilowe
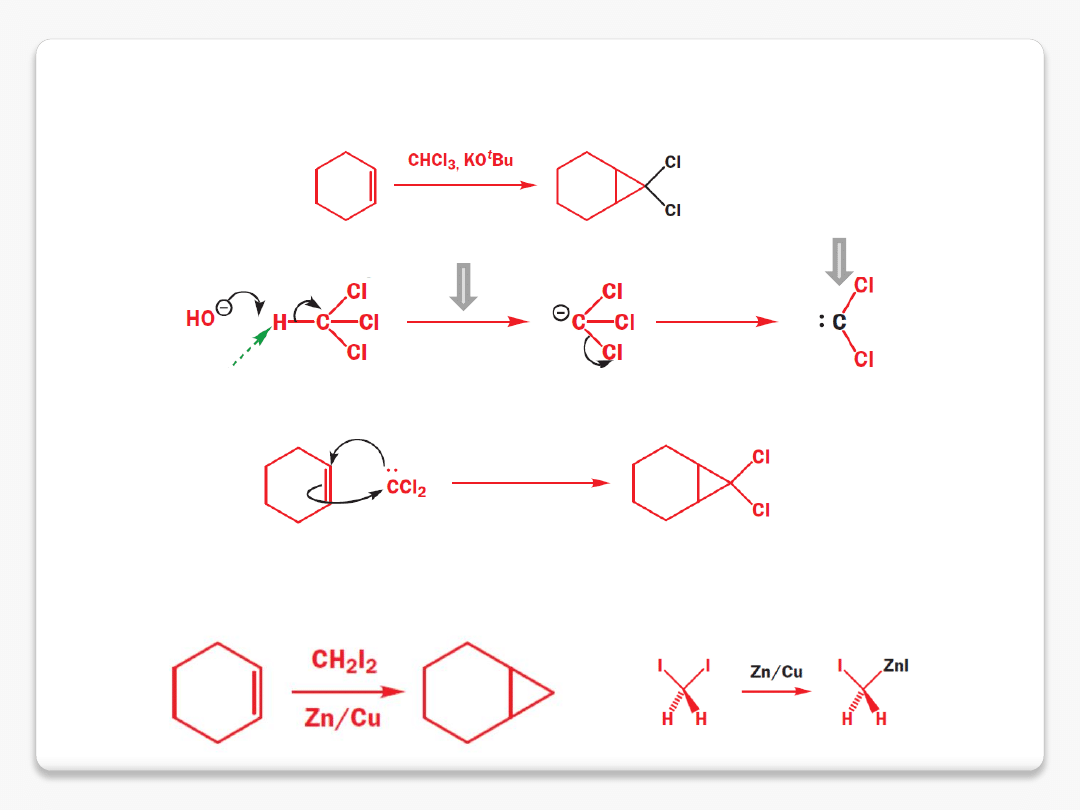
addycja karbenów
reakcja Simmonsa-Smitha
dichlorokarben
kwaśny proton
a
eliminacja
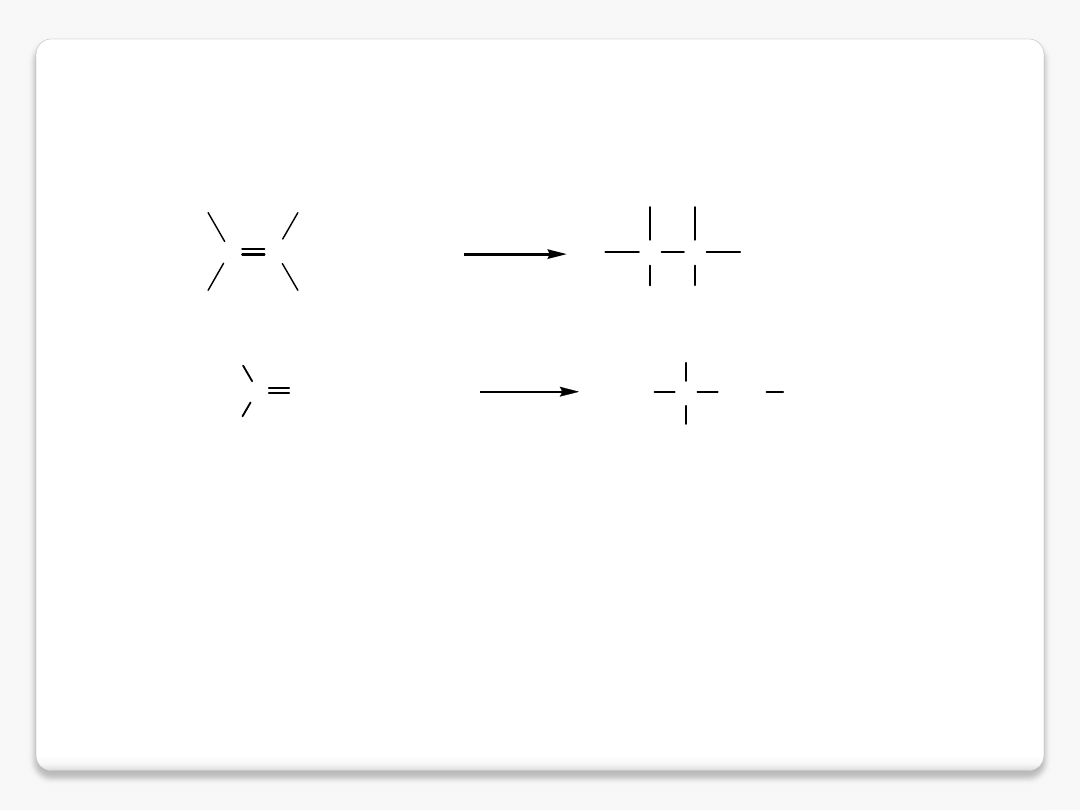
C
C
+
HOH
H
3
O
+
C
H
C
OH
C
CH
2
H
3
C
H
3
C
+
HOH
H
3
O
+
25
o
C
H
3
C
C
CH
3
OH
CH
2
H
alkohol tert-butylowy
2-metylopropen
addycja innych nukleofili
woda
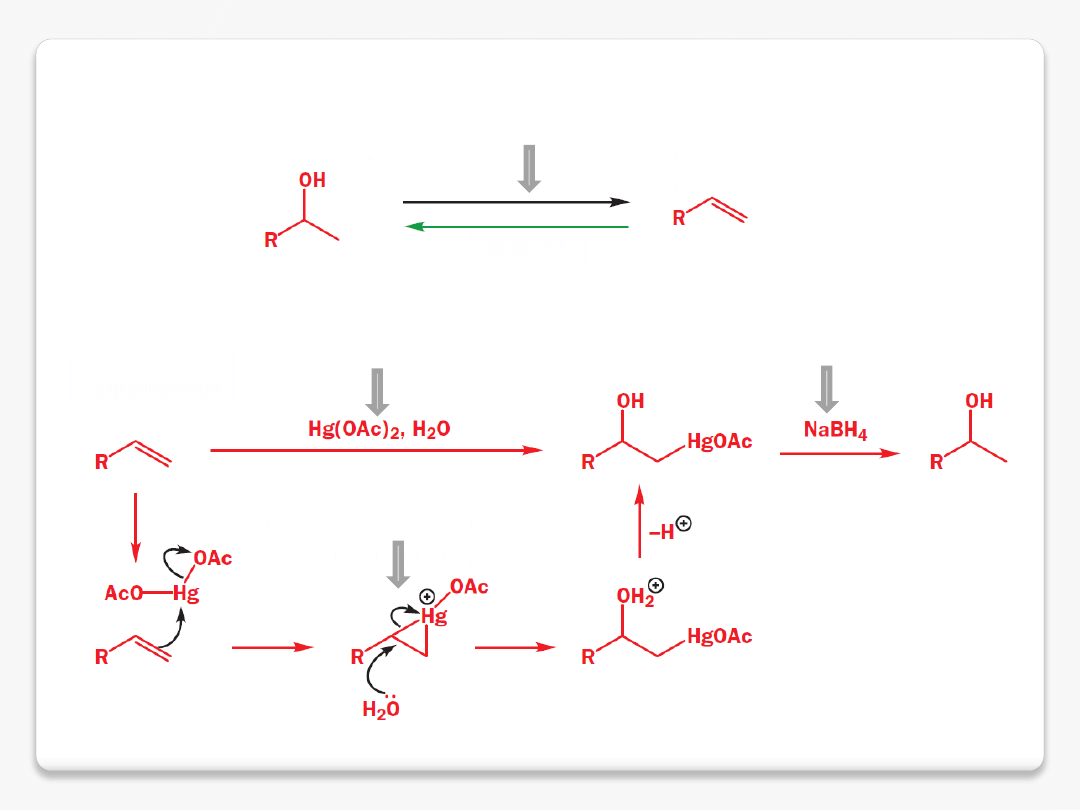
hydratacja alkenów
eliminacja wody w
obecności kwasu
hydroksyrtęciowanie
redukcja
kation
merkurioniowy
zgodnie z regułą
Markownikowa
zgodnie z regułą
Markownikowa
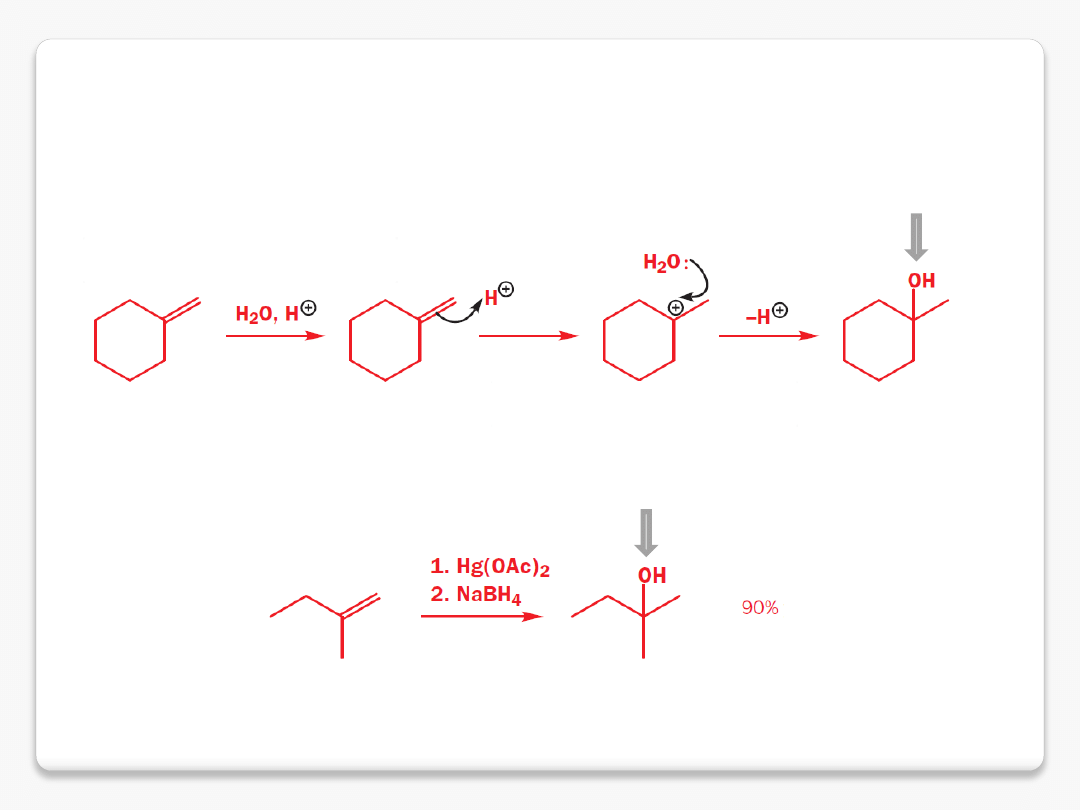
hydratacja alkenów
‘addycja wody’ niezgodna z regułą Markownikowa
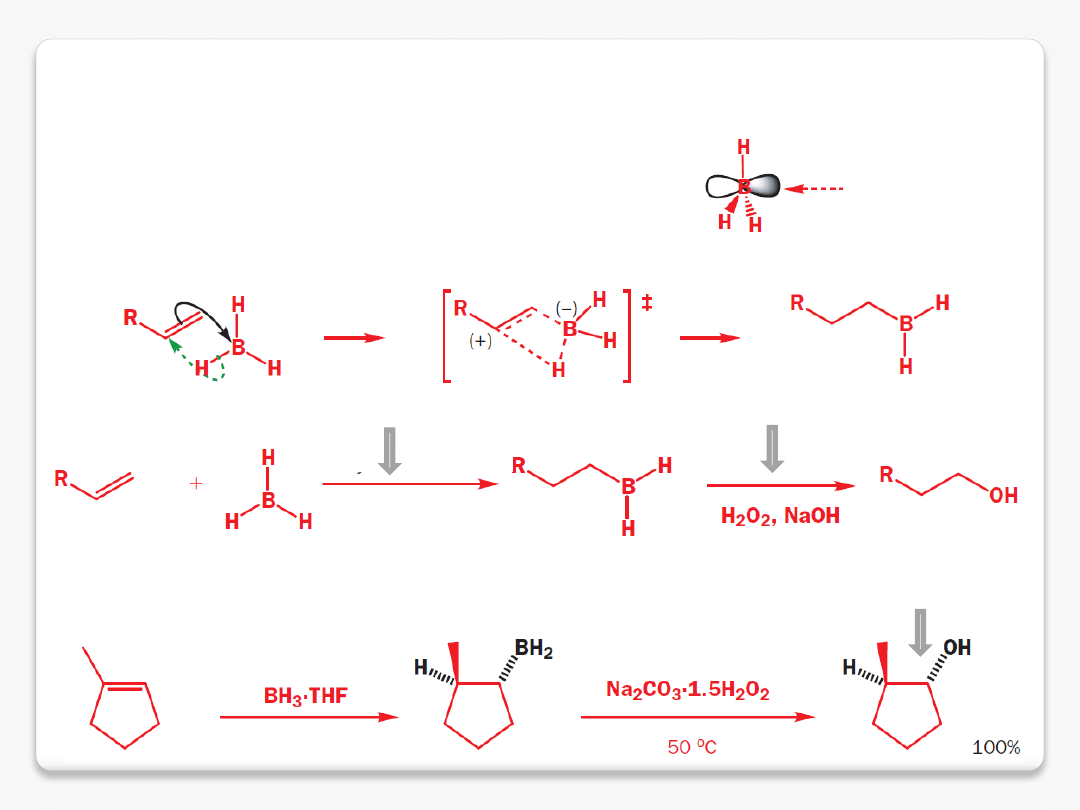
borowodorowanie alkenów
boran
pusty orbital p
niezgodnie z regułą
Markownikowa
borowodorowanie
utlenianie
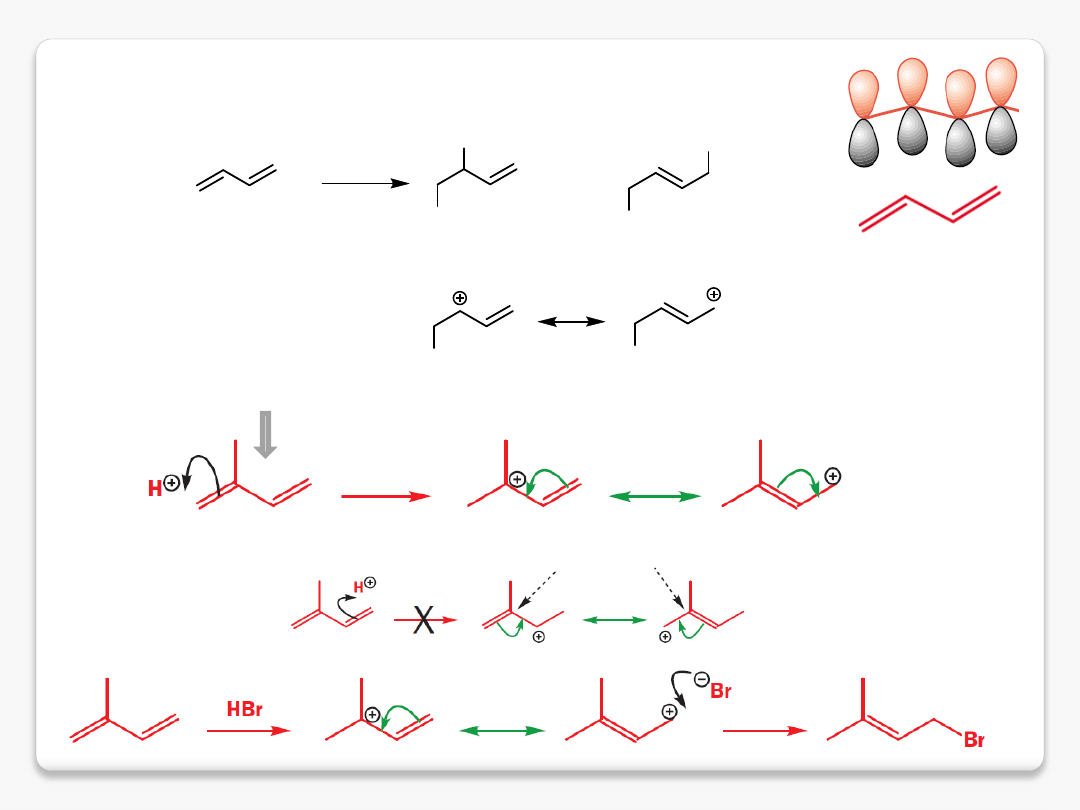
szczególny przypadek
addycja 1,2 vs. addycja 1,4
HBr
H
Br
H
Br
ad dycja-1,2
ad dycja-1,4
H
H
1,3-butadien
izopren
brak stabilizacji
poprzez grupę Me
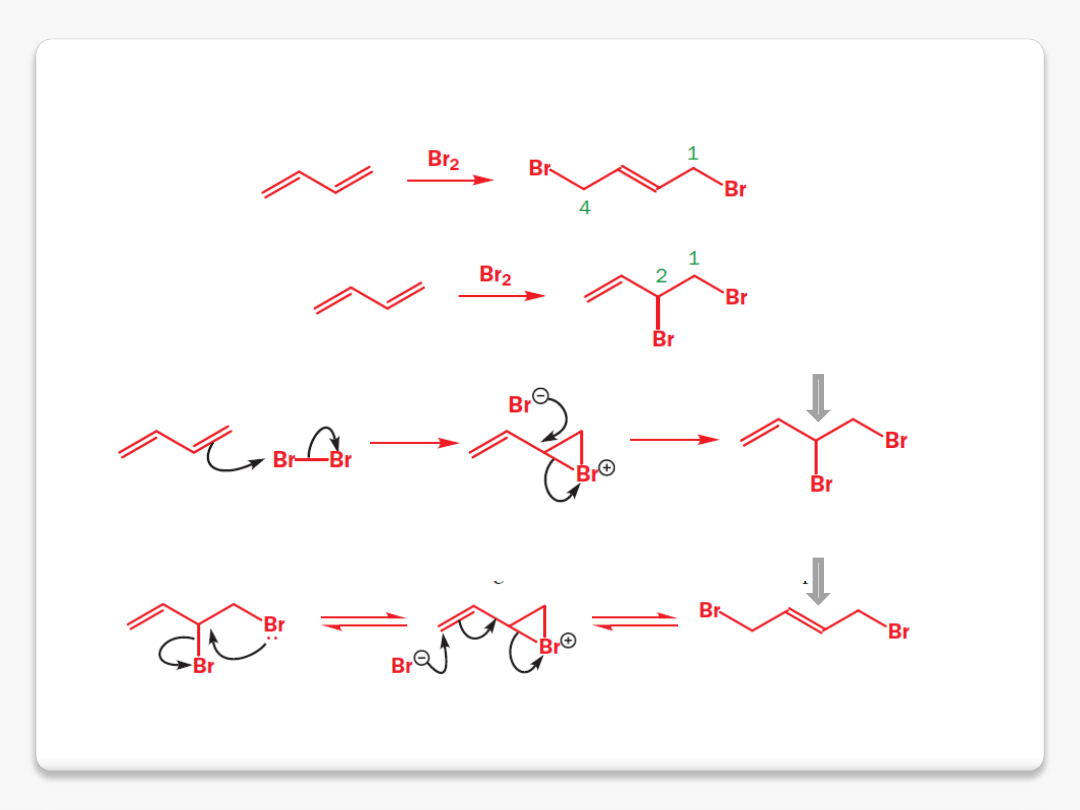
addycja 1,2 vs. addycja 1,4
ogrzewanie
produkt kinetyczny
produkt
termodynamiczny
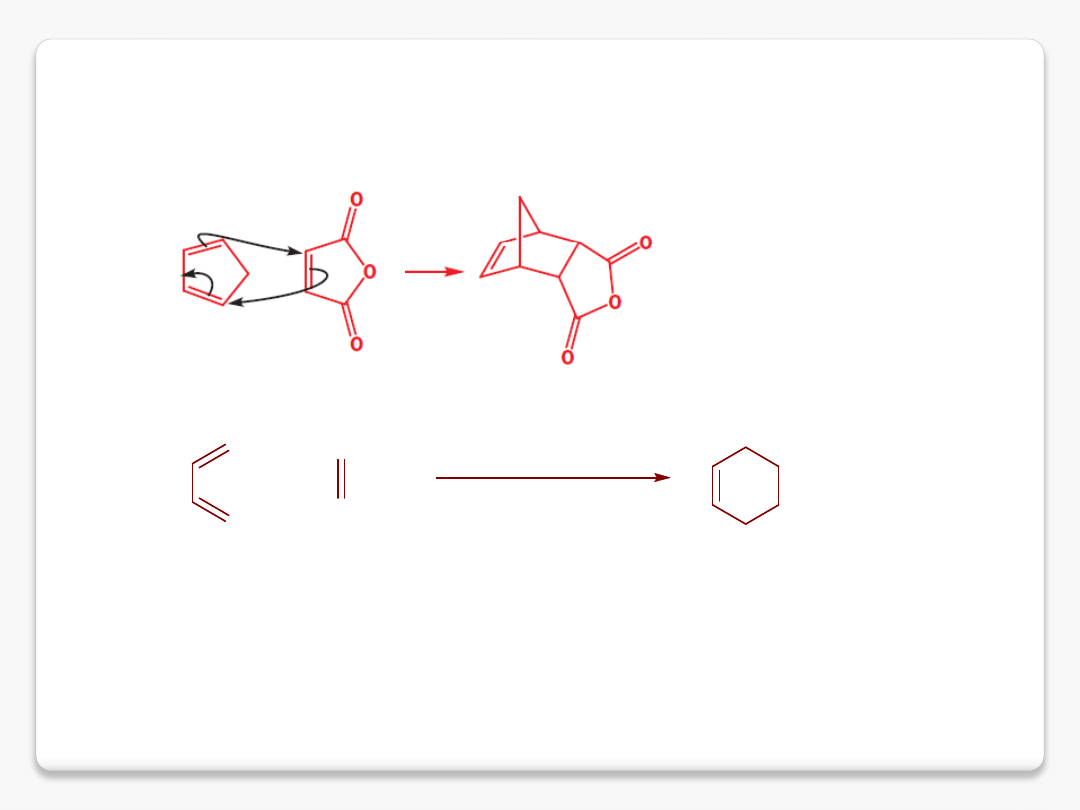
reakcja cykloaddycji Dielsa-Aldera
dien
dienofil
4+2 cykloaddycja
więcej na wykładzie dotyczącym cykloaddycji
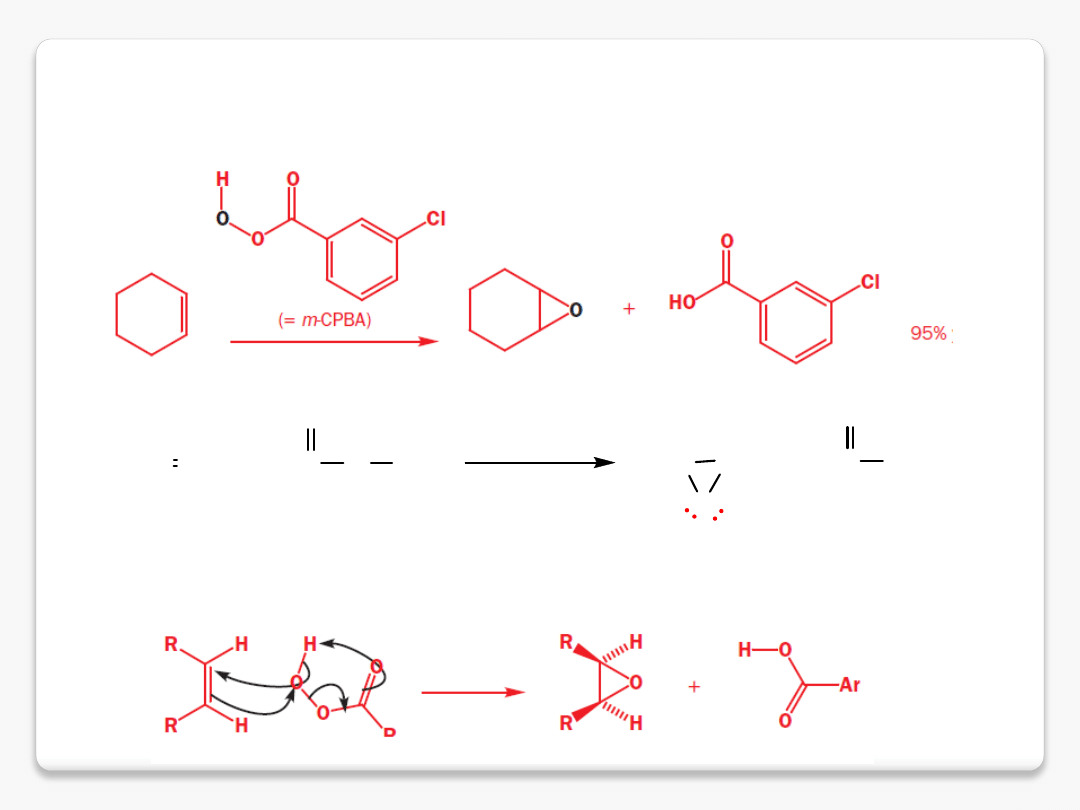
epoksydy
synteza – kwas meta-chloronadbenzoesowy
RCH CHR + R'C
O
O
O
H
RHC
CHR
O
+ R'C
O
OH
alken
nadtlenokwas
epoksyd
(oksiran)
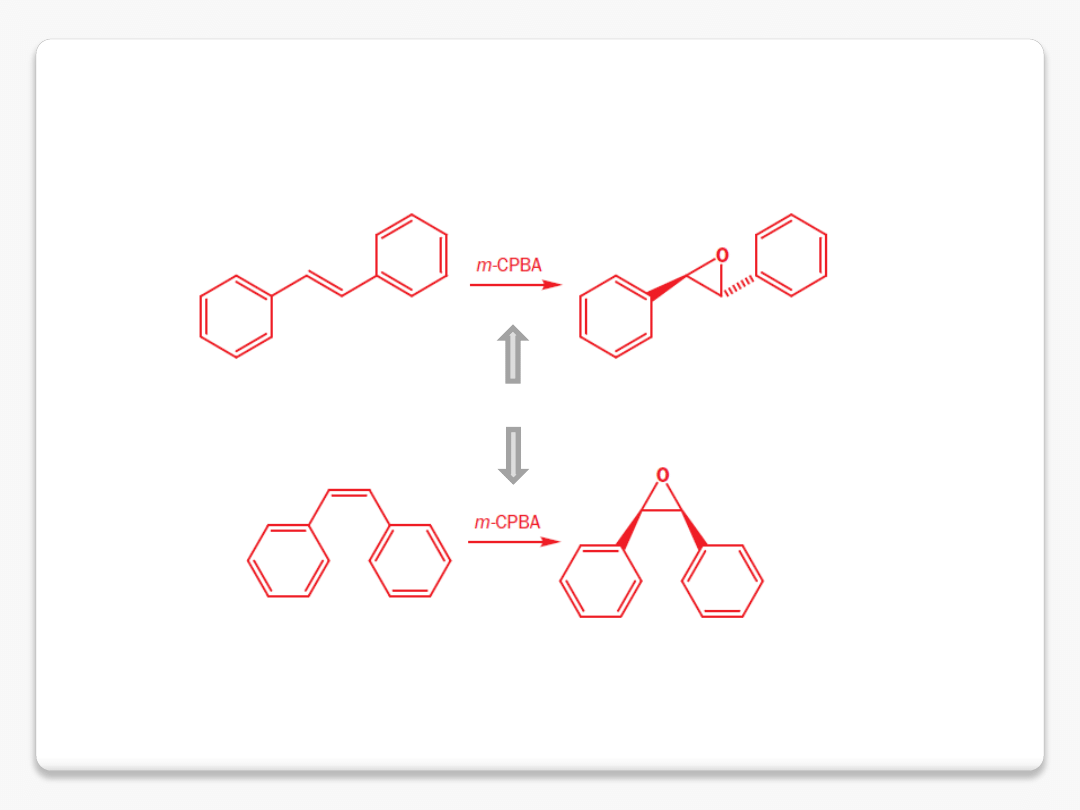
epoksydy ze stilbenu
reakcje stereospecyficzne
to reakcje których mechanizm wskazuje, że stereochemia
produktu zostaje określona przez stereochemię substratu
reakcja stereospecyficzna
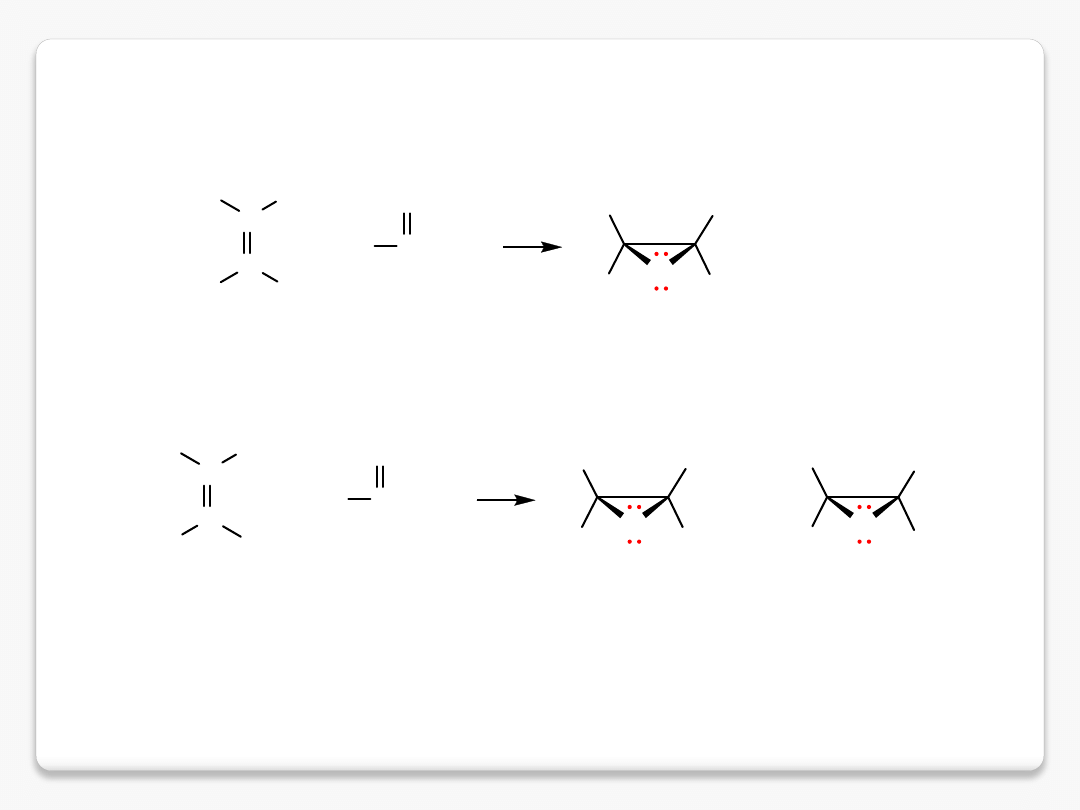
C
C
H
3
C
H
H
3
C
H
+
O
CO
O
H
R
(Z)-but-2-en
cis-2,3-dimetylooksiran
O
H
3
C
CH
3
H
H
(mezo)
epoksydy
synteza – kwas meta-chloronadbenzoesowy
+
(E)-but-2-en
C
C
H
3
C
H
H
CH
3
+
O
CO
O
H
R
O
H
CH
3
H
H
3
C
O
H
3
C
H
CH
3
H
enancjomerczne trans-2,3-dimetylooksirany
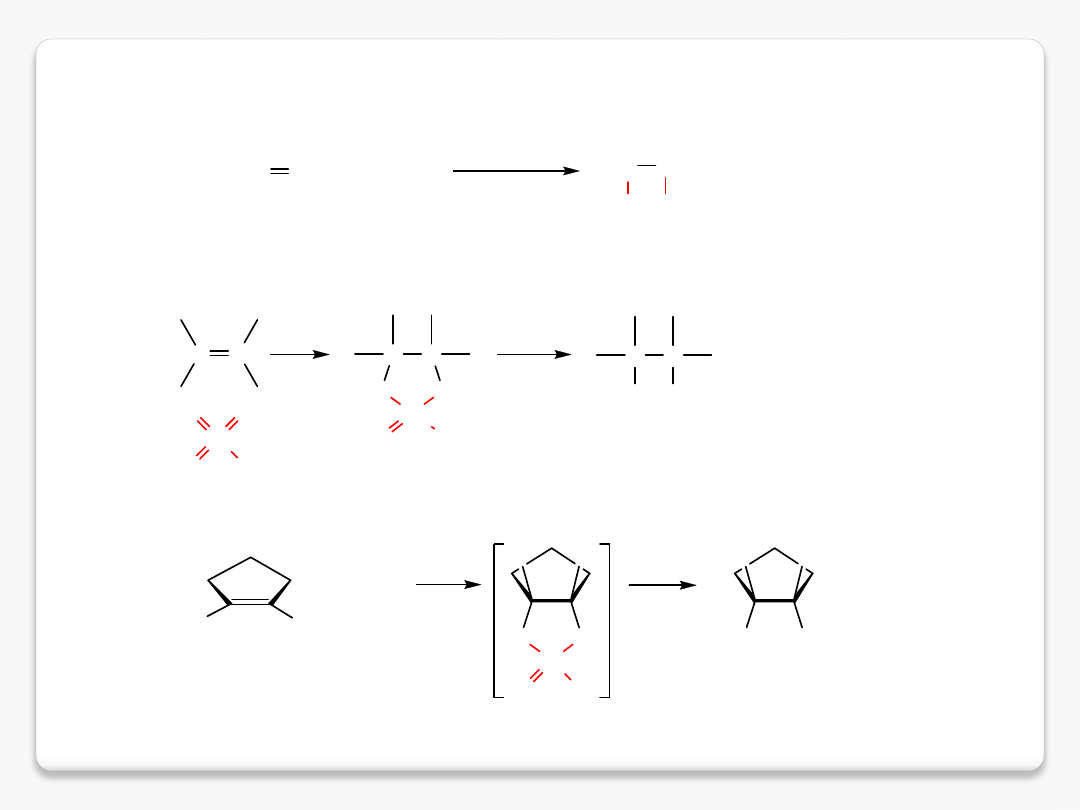
utlenianie alkenów
syn-dihydroksylacja: KMnO
4
,
OsO
4
H
2
C
CH
2
H
2
C
CH
2
OH
OH
KMnO
4
OH
2
O
+
etan
etano-1,2-diol
(glikol etylenowy)
C
C
C
C
O
Mn
O
O
O
OH
H
2
O
C
C
OH OH
MnO
2
+
+
Mn
O
O
O
O
MnO
4
cis-cyklopentano-1,2-diol
H
H
H
H
O
Mn
O
O
O
+
H
2
O
OH
H
H
HO
OH
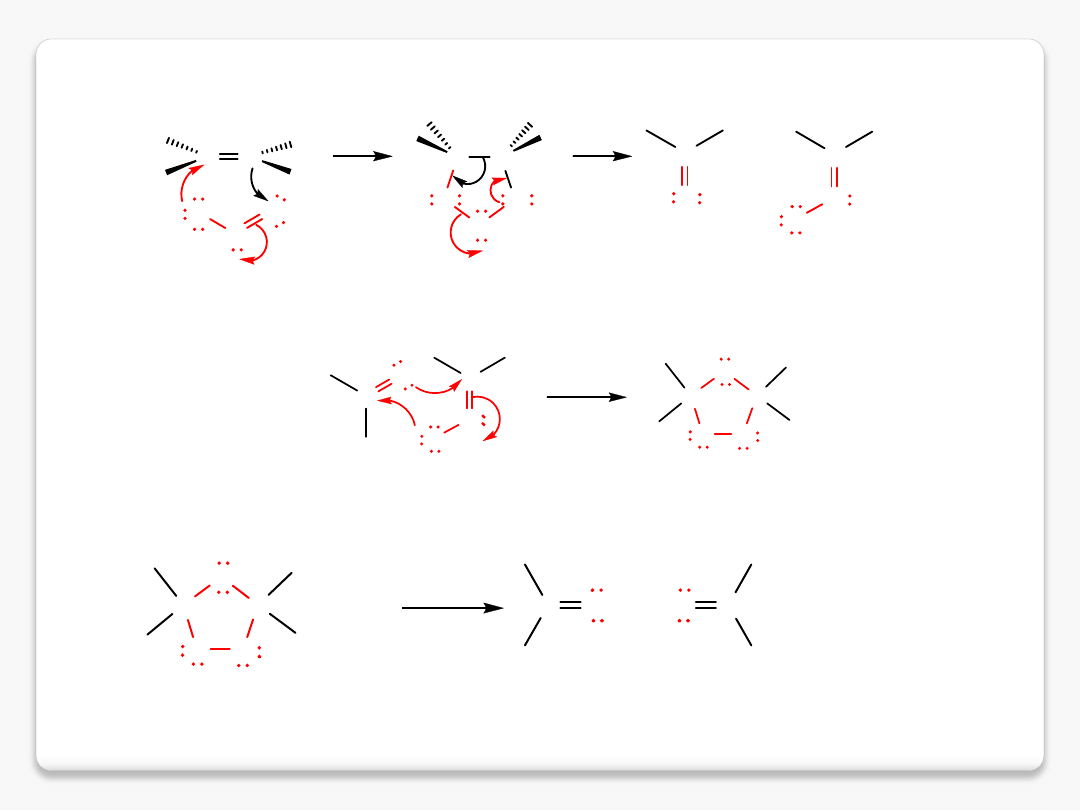
ozonoliza
C
O
C
O
O
+
+
molozonek
ozon
fragmentacja
C
C
C
C
O
O
O
O
O
O
O
C
O
C
O
ozonek
rekombinacja fragmentów
C
O
C
O
O
+
O
C
O
C
O
ozonek
+ Zn
HOAc
C
O
+
C
O
+ Zn(OAc)
2
aldehyd/keton
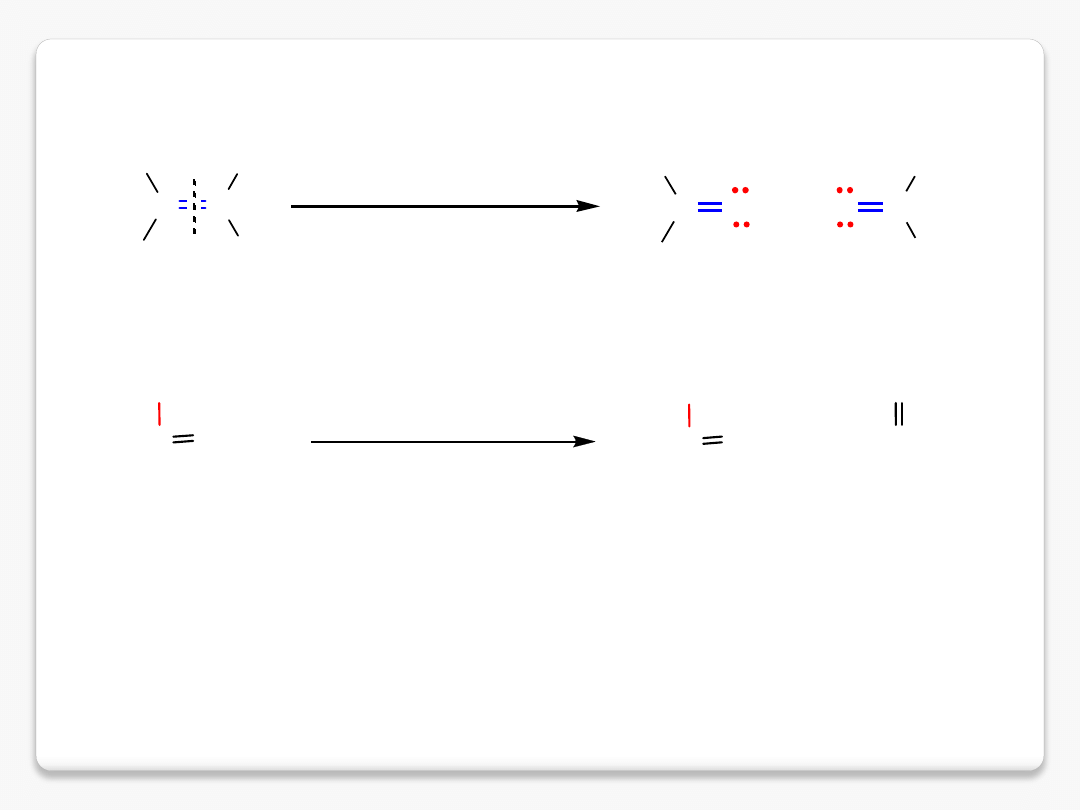
ozonoliza
C
C
H
R"
R'
R
C
O
R'
R
+
C
O
H
R"
1. O
3
, CH
2
Cl
2
,
78
o
C
2. Zn/HOAc
CH
3
C
CH
3
CHCH
3
1. O
3,
CH
2
Cl
2,
78
o
C
2. Zn/HOAc
CH
3
C
CH
3
O
CH
3
CH
O
+
aceton
aldehyd octowy
(acetaldehyd)
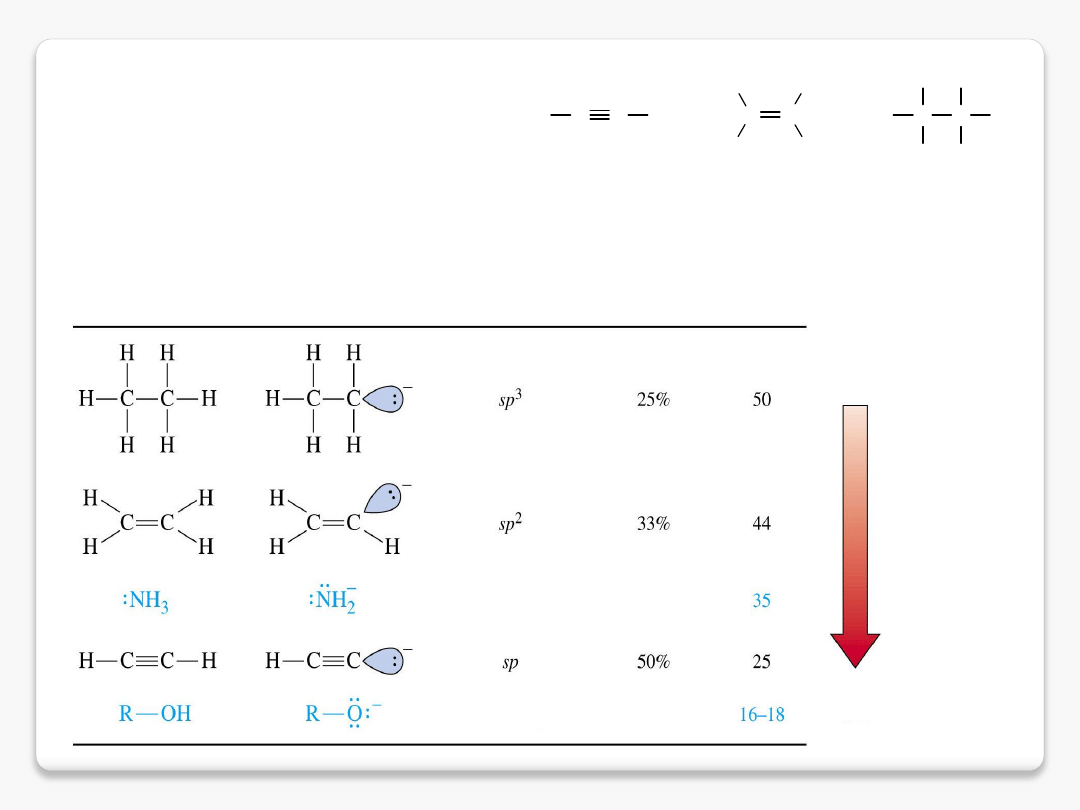
kwasowość alkinów
H
C
C
H
C
C
H
H
H
H
H
C
C
H
H
H
H
H
pK
a
= 25
pK
a
= 44
pK
a
= 50
silniejszy
kwas
słabszy
kwas
kwas
sprzężona zasada
udział orbitalu s
pK
a
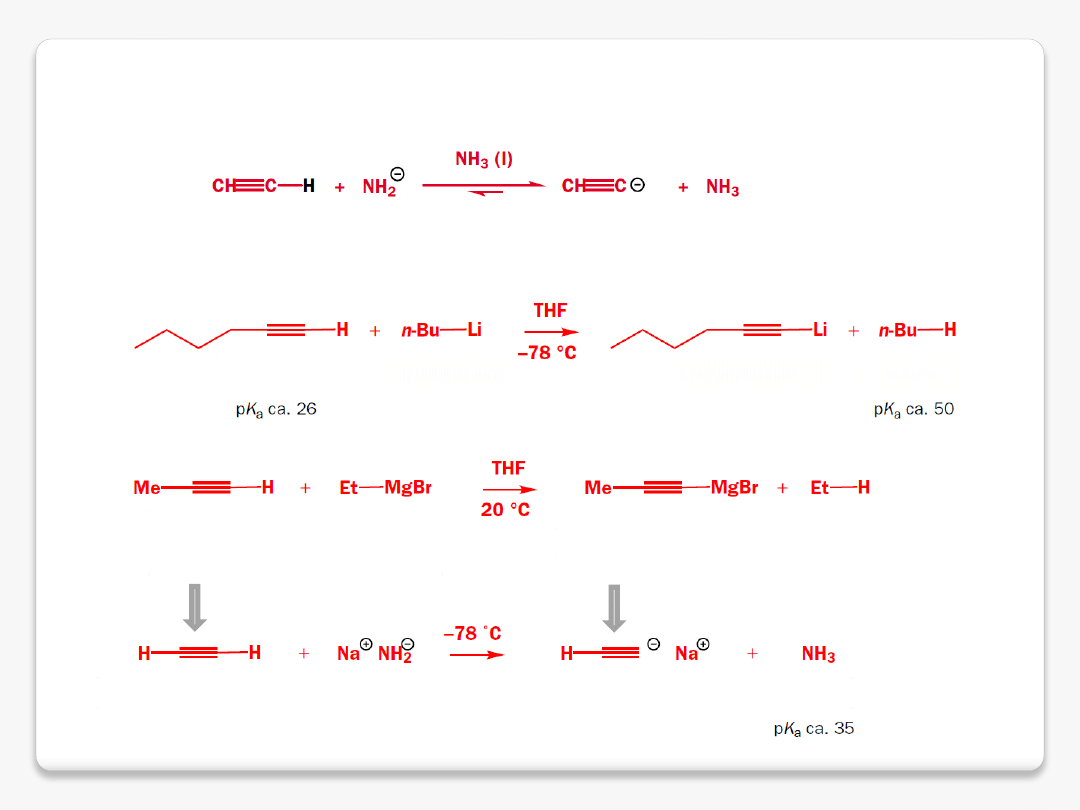
kwasowość alkinów
acetylen
acetylenek sodu
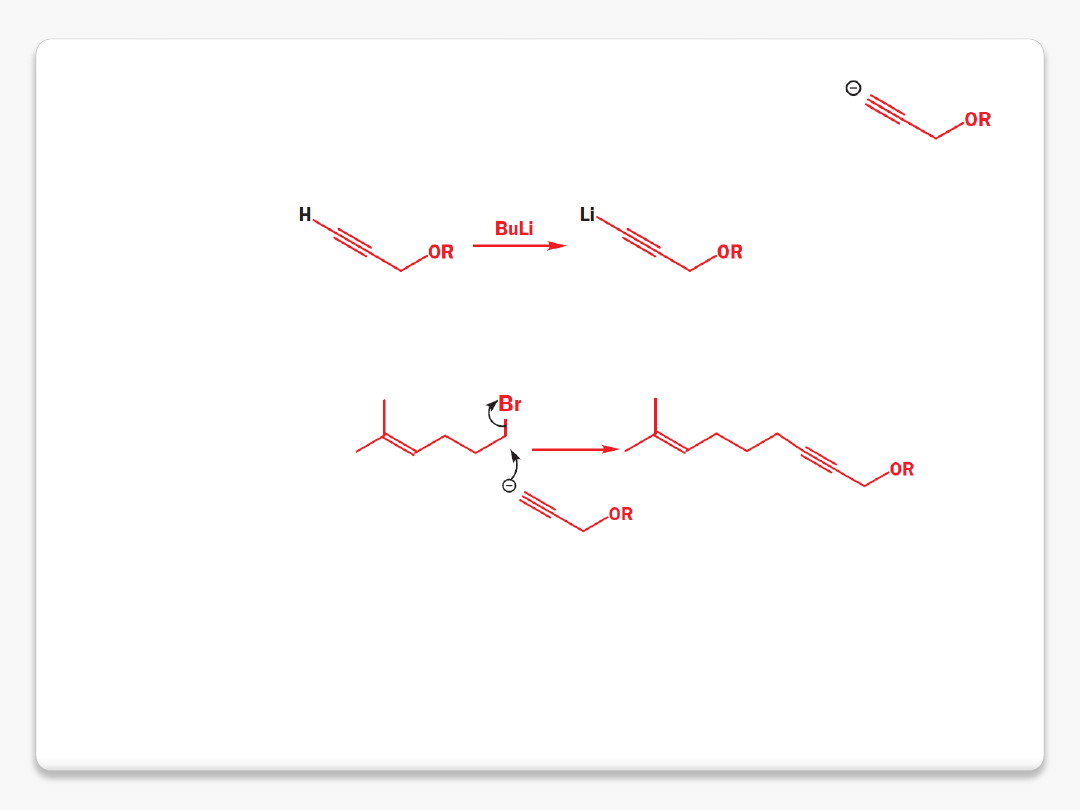
zastosowanie alkinów w syntezie
więcej na wykładzie dotyczącym substytucji nukleofilowej
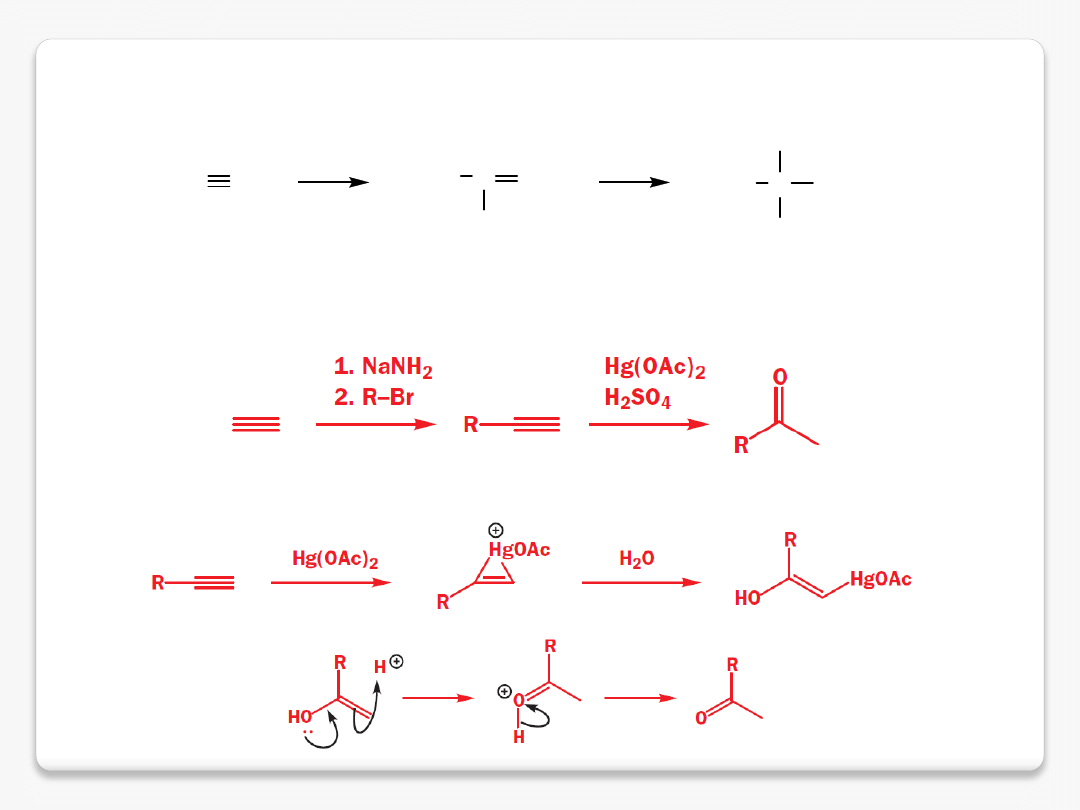
C
4
H
9
C
CH
2
Br
H
Br
C
4
H
9
C
CH
3
Br
Br
2-bromo-heks-1-en
2,2-dibromoheksan
H
Br
C
4
H
9
C
CH
syntezy z zastosowaniem alkinów
Wyszukiwarka
Podobne podstrony:
Ch organiczna wykład 1d
Ch organiczna wykład 1e
Ch organiczna wykład 1c
Ch organiczna wykład 1d
dyd k3a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
dyd e2b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
chemia fizyczna 1-1, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, chem org,
dyd k2a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
dyd kzb, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd kza r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
dyd e1c, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd tech11, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
dyd k3a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd e2a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
dyd k3b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd k1c r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
9 Ch organiczna WĘGLOWODANY
więcej podobnych podstron