1
Niespecyficzne wskaźniki redoks
Należy jednak wspomnieć, że w procesie redukcji wielu
wskaźników zachodzi uwalnianie protonów, czyli zakres
potencjałów wymagany do zmiany barwy wskaźnika (tzw.
potencjał przejścia) jest zależny od pH układu
Specyficzne wskaźniki redoks
Specyficzne wskaźniki redoks są to wskaźniki, których
zmiana barwy nie jest bezpośrednio wynikiem zmiany
potencjału układu miareczkowanego, lecz efektem
procesu następczego w stosunku do reakcji redoks
będącej podstawą oznaczenia.
Przykłady specyficznych wskaźników redoks
Najbardziej znanym specyficznym wskaźnikiem redoks
jest skrobia, która tworzy z jodem addycyjny związek o
intensywnym zabarwieniu. Barwa tego związku zależy od
długości łańcucha. Amylaza daje z jodem barwę niebieską,
amylopektyna-fioletową a amylodekstryny czerwoną.
Właściwie działający wskaźnik skrobiowy powinien w
rozcieńczonych roztworach tworzyć niebieskie
zabarwienie kompleksu z jodem.
Przykłady specyficznych wskaźników redoks
Innym specyficznym wskaźnikiem jest KSCN, który
może być zastosowany na przykład w
miareczkowaniu Fe(III) roztworem siarczanu
tytanu(III). W PK miareczkowania zanika czerwona
barwa rodankowego kompleksu Fe(III) jako wynik
redukcji Fe(III) do Fe(II)
2
Wskaźniki redoks
Oprócz wskaźników redoks odwracalnych, w których
przejścia między różnie zabarwioną postacią zredukowaną
i utlenioną są odwracalne, stosowane są również wskaźniki
redoks nieodwracalne. Przy określonym potencjale redoks
ulegają one nieodwracalnej reakcji utleniania z
równoczesną zmianą barwy. Przykładem takiego
wskaźnika może być oranż metylowy, który służy jako
wskaźnik do miareczkowania Sb
3+
za pomocą KBrO
3
;
nadmiar bromianu powoduje nieodwracalne odbarwienie
wskaźnika.
Wybór odpowiedniego dla danej reakcji
niespecyficznego wskaźnika redoks
Potencjał prawidłowo dobranego wskaźnika (jeśli jest to
wskaźnik niespecyficzny) powinien znajdować się w
zakresie potencjałów skoku miareczkowania.
Przykładowe niespecyficzne wskaźniki redoks
Wskaźnik
Barwa formy
utlenionej
Barwa formy
zredukowanej
E°
przy pH = 0
Błękit metylenowy
zielono-
niebieska
bezbarwna
0,36 V
Difenylobenzydyna
fioletowa
bezbarwna
0,77 V
Ferroina
jasnoniebieska
czerwona
1,11 V
Benzydyna
niebieska
bezbarwna
0,92 V
Manganometria
Manganometrią nazywa się dział analizy
miareczkowej, obejmujący oznaczenia reduktorów za
pomocą miareczkowania mianowanym roztworem
manganianu(VII) potasu.
3
Manganometria
Manganian(VII) potasu (nadmanganian potasu) należy do
najsilniejszych utleniaczy stosowanych w metodach
oksydymetrycznych.
Formalny potencjał utleniający KMnO
4
w roztworze o pH bliskim 0 wynosi ok.
1,5 V; ze zmniejszaniem się
kwasowości potencjał ten maleje.
Manganometria
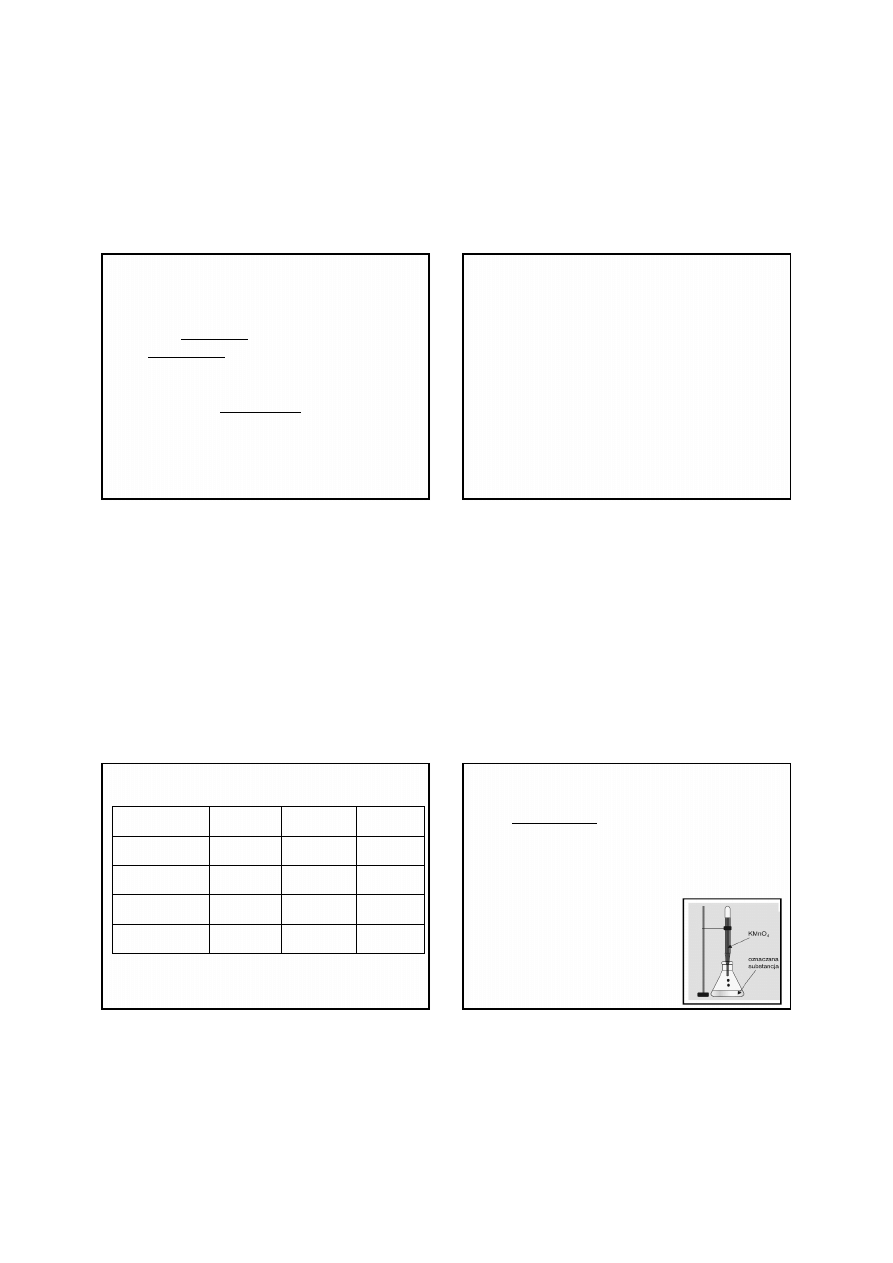
Manganian(VII) potasu jest substancją łatwo dostępną, o
stosunkowo niskiej cenie. Jego roztwory posiadają silne
zabarwienie, co sprawia, że w większości przypadków nie
jest konieczne stosowanie wskaźników redoks.
Może być stosowany do
oznaczania związków
nieorganicznych i organicznych
zarówno w środowisku
kwaśnym, jak i alkalicznym.
Manganometria
Przebieg reakcji redukcji manganianu(VII) zależy od pH
środowiska
W środowisku kwaśnym (stężenie H
2
SO
4
0,05 mol/L lub
większe) redukcja manganianu(VII) przebiega do jonu
Mn
2+
, w reakcji bierze udział 5 elektronów:
O
H
Mn
e
H
MnO
2
2
4
4
5
8
Manganometria
Reakcję tę stosuje się w analizie do oznaczania m.in.
Fe
2+
, As
3+
, Sb
3+
, C
2
O
4
2-
, NO
2
-
, Fe(CN)
6
4-
, nadtlenku
wodoru i sodu oraz do oznaczeń pośrednich,
polegających na redukcji nadmiarem roztworu FeSO
4
lub
NaAsO
2
i odmiareczkowaniu nadmiaru reduktora
roztworem KMnO
4
4
Manganometria
W środowisku obojętnym lub słabo kwaśnym redukcja
manganianu(VII) przebiega do Mn
4+
(MnO
2
), w reakcji
bierze udział 3 elektrony:
OH
MnO
e
O
H
MnO
4
3
2
2
2
4
O
H
MnO
e
H
MnO
2
2
4
2
3
4
Manganometria
Redukcja jonu MnO
4
-
do MnO
2
może być stosowana do
oznaczania m.in. cyjanków, siarczków, siarczynów,
tiosiarczanów. Jak również do oznaczania Mn
2+
metodą
Volharda-Wolffa.
Manganometria
W środowisku mocno zasadowym (stężenie NaOH
1 mol/L lub większe) redukcja manganianu(VII)
przebiega do manganianu(VI), w reakcji bierze udział 1
elektronów:
2
4
4
MnO
e
MnO
Manganometria
Istnieje wiele ważnych analitycznych reakcji utleniania,
które przebiegają w środowisku zasadowym. W ten
sposób można oznaczać np. jodki obok bromków,
aldehyd mrówkowy oraz wiele substancji organicznych,
które utleniają się do węglanów i szczawianów.
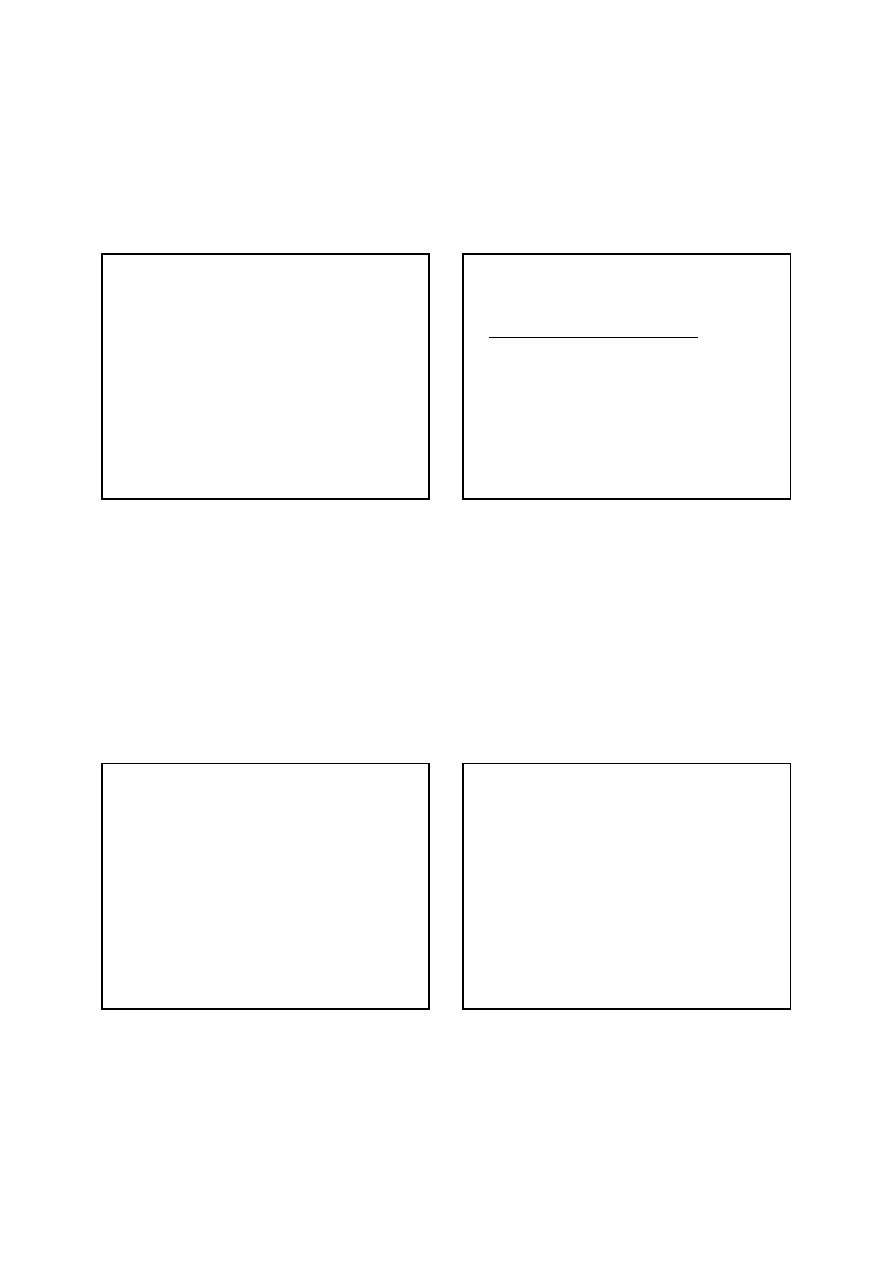
5
Manganometria
W praktyce laboratoryjnej używa się
najczęściej KMnO
4
o stężeniu 0,02 mol/L
lub 0,002 mol/L.
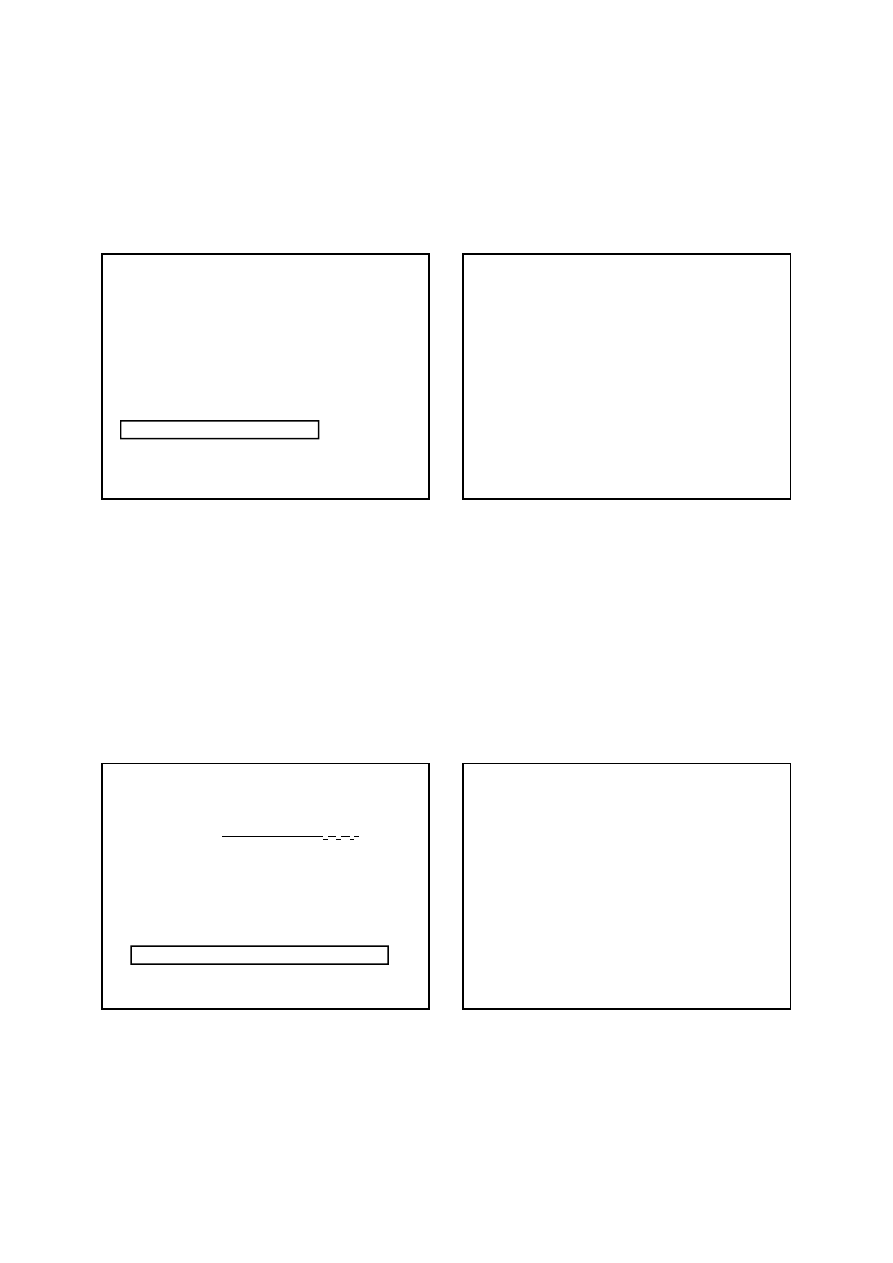
Mianowanego roztworu manganianu(VII) potasu nie
można otrzymać przez zwykłe rozpuszczenie ściśle
odważonej ilości soli w znanej objętości wody.
Dzieje się tak z następujących powodów:
1) trudno jest uzyskać zupełnie czysty KMnO
4
i nawet
najczystsze jego preparaty handlowe zawierają pewną
ilość domieszek, głównie MnO
2
;
2) w wodzie destylowanej znajdują się zwykle
zanieczyszczenia organiczne (bakterie itp.), które
redukując KMnO
4
do MnO
2
zmieniałyby miano
roztworu.
W celu sporządzenia mianowanego roztworu KMnO
4
:
1) rozpuszcza się w wodzie ilość KMnO
4
nieco większą od
teoretycznie potrzebnej;
2) a)
butelkę z ciemnego szkła zamyka się, wstrząsa w celu
całkowitego rozpuszczenia manganianu(VII), a
następnie pozostawia się na kilkanaście dni, aby
wszystkie zanieczyszczenia obecne w wodzie uległy
utlenieniu lub
b)
roztwór w kolbie stożkowej ogrzewa się do wrzenia i
utrzymuje się w tym stanie przez 1h, aby utlenić ślady
obecnych w roztworze zanieczyszczeń organicznych;
3) w obu przypadkach (2 a i b) zimny roztwór przesącza
się przez tygiel szklany z dnem porowatym, ma to na
celu całkowite usunięcie MnO
2
;
4) przesączony roztwór zlewa się do czystej butelki z
ciemnego szkła i wstrząsa w celu wyrównania stężeń;
5) miano roztworu nastawia się na odpowiednią
substancję podstawową.
6
Tlenek manganu(IV) usuwa się z 2 powodów:
1) znajduje się on w roztworze manganianu(VII) w
postaci bardzo drobnej zawiesiny; podczas
miareczkowania manganianem(VII) w kwaśnym
środowisku MnO
2
wchodzi również w reakcję z
reduktorem, zwiększając tym samym miano roztworu;
2) MnO
2
przyspiesza katalitycznie samorzutny rozkład
KMnO
4
na MnO
2
i tlen:
2
2
2
4
3
4
4
2
4
O
OH
MnO
O
H
MnO
Rozkład KMnO
4
1) w roztworach obojętnych proces rozkładu przebiega
bardzo powoli, lecz przyspieszają go znacznie jony
Mn
2+
oraz MnO
2
;
2) szybkość rozkładu KMnO
4
zwiększa się wraz ze
zwiększaniem stężenia jonów wodorowych;
3) proces ten przebiega znacznie szybciej w podwyższonej
temperaturze;
4) czynnikiem przyspieszającym rozkład
KMnO
4
jest również światło; dlatego
należy przechowywać roztwory
manganianu(VII) w butelkach z
ciemnego szkła.
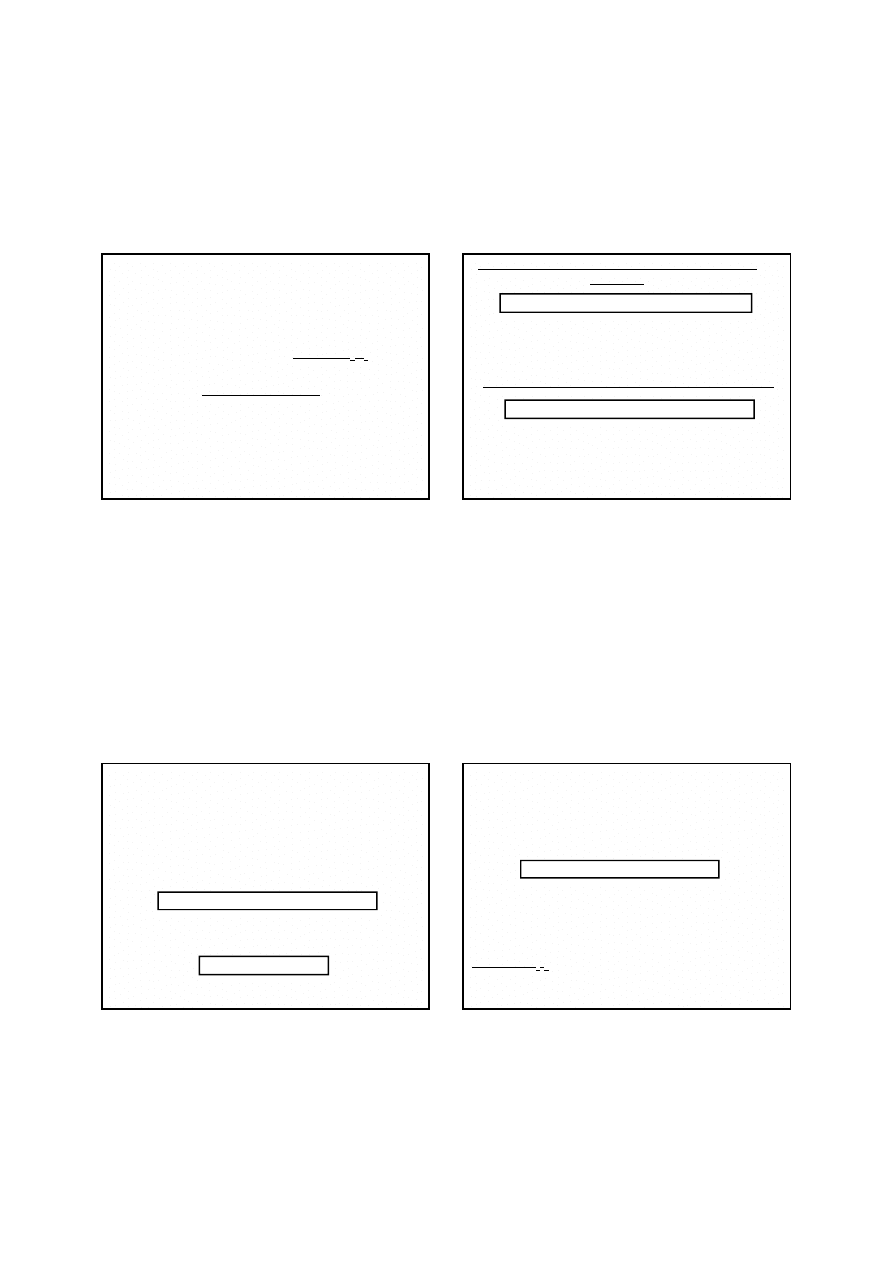
Nastawianie miana roztworu manganianu(VII) potasu
Najlepszą substancją podstawową do nastawiania miana
roztworu KMnO
4
jest szczawian sodu (Na
2
C
2
O
4
), jako sól
bezwodna, niehigroskopijna i łatwa do otrzymania w
czystej postaci; należy ją tylko przed użyciem wysuszyć w
temperaturze 105-110°C.
2
2
2
2
4
2
4
10
8
2
5
16
2
CO
O
H
Mn
O
C
H
MnO
Nadmanganian utlenia jony szczawianowe do dwutlenku
węgla. Przebieg reakcji przedstawia równanie:
1) na początku, po dodaniu nadmanganianu do roztworu
szczawianu sodu nie obserwuje się szybkiego
odbarwienia roztworu;
2) dalsze porcje nadmanganianu redukowane są coraz
szybciej;
3) wytwarzane w wyniku reakcji jony manganu(II)
katalizują reakcję utleniania jonów szczawianowych;
4) w celu przyspieszenia reakcji roztwór przed
miareczkowaniem się ogrzewa.
7
Nastawianie miana na As
2
O
3
Trójtlenek arsenu jest substancją podstawową, często
stosowaną w metodach oksydymetrycznych. Związek
ten otrzymuje się w stanie wysokiej czystości. Miano
roztworu KMnO
4
nastawia się na odważki As
2
O
3
lub na
przygotowany z większej odważki trójtlenku arsenu
roztwór arsenianu(III).
Manganian(VII) utlenia tlenek arsenu(III) do tlenku
arsenu(V)
O
H
Mn
O
As
H
MnO
O
As
2
2
5
2
4
3
2
6
4
5
12
4
5
Miareczkowanie prowadzi się na gorąco w obecności
śladów jodanu(V) lub jodku jako katalizatora, przy czym
do zakwaszenia roztworu używa się kwasu solnego.
Manganian(VII) utlenia arsenian(III) do arsenianu(V)
O
H
Mn
AsO
H
MnO
AsO
2
2
3
4
4
3
3
3
2
5
6
2
5
Miareczkowanie prowadzi się na zimno w środowisku
kwasu solnego w obecności katalizatora (jony jodanowe
lub jodkowe).
Nastawianie miana na 0,1 mol/L roztwór Na
2
S
2
O
3
Do ustalenia lub sprawdzenia miana roztworu
manganianu(VII) potasu wykorzystuje się niekiedy roztwór
tiosiarczanu sodu o dokładnie znanym stężeni.
Metoda ta opiera się na reakcji nadmanganianu z jonami
jodkowymi w środowisku kwaśnym:
O
H
I
Mn
H
I
MnO
2
2
2
4
8
5
2
16
10
2
Następnie wydzielony jod odmiareczkowuje się roztworem
tiosiarczanu sodu o znanym mianie:
2
6
4
2
3
2
2
2
2
O
S
I
O
S
I
Manganometryczne oznaczanie manganu
Manganometryczna metoda oznaczania manganu
wykorzystuje reakcję utleniania jonów Mn(II)
manganianem(VII) w środowisku obojętnym:
H
MnO
O
H
MnO
Mn
4
5
2
2
3
2
2
4
2
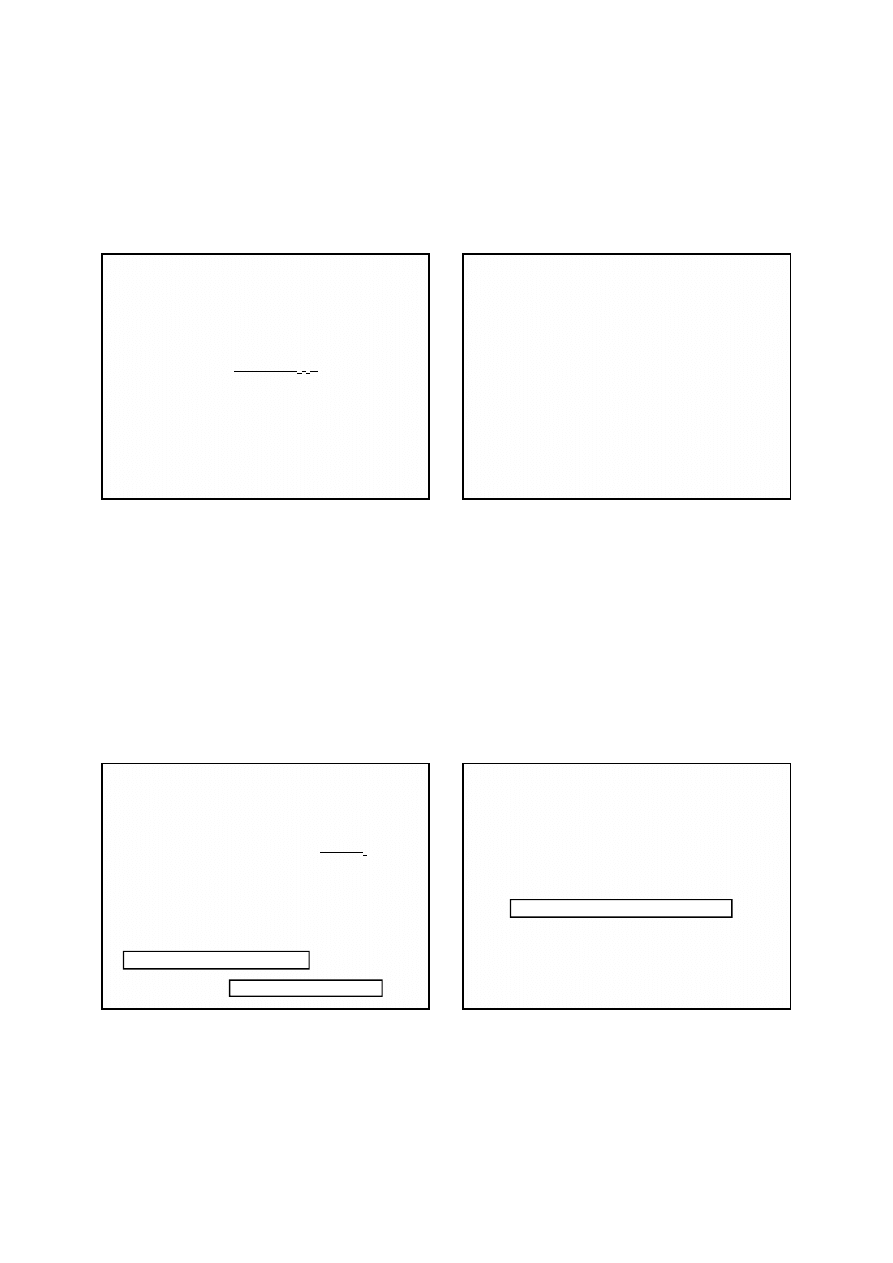
Powyższa reakcja nie odzwierciedla rzeczywistego
przebiegu procesu zachodzącego podczas miareczkowania
manganu. W rzeczywistości w tych warunkach powstaje
mieszanina manganianów(IV) manganu(II), np.
Mn(HMnO
3
)
2
o zmiennym składzie, w wyniku czego część
jonów Mn
2+
pozostaje nie utleniona, co powoduje zaniżenie
wyników analizy.
8
Manganometryczne oznaczanie manganu
W celu uniknięcia powyższego efektu należy prowadzić
miareczkowanie na gorąco, wprowadzając do badanego
roztworu znaczne ilości Zn(II), które wytrącają
manganian(IV) cynku (Zn(HMnO
3
)
2
), w ten sposób cały
mangan znajduje się w osadzie w postaci
czterowartościowej.
Manganometryczne oznaczanie manganu
1. Miareczkowanie manganu należy prowadzić w
temperaturze co najmniej 80°C, gdyż tylko wtedy jest
możliwa całkowita koagulacja manganianu(IV)
2. Wynik oznaczania zależy w pewnym stopniu od
sposobu wprowadzenia KMnO
4
; doświadczenie
wykazuje, że do zlewki z roztworem soli manganu(II)
należy dodać od razu prawie całą potrzebną ilość
manganianu(VII), a następnie dokończyć
miareczkowanie, wprowadzając roztwór KMnO
4
kroplami
Oznaczanie manganu obok żelaza metodą
Volharda i Wolffa
Metoda ta pozwala na oznaczanie manganu w obecności
żelaza trójwartościowego. Zasada oznaczenia jest wtedy
następująca: wytrąca się żelazo w postaci Fe(OH)
3
za pomocą
niewielkiego nadmiaru zawiesiny tlenku cynku, a następnie
miareczkuje Mn
2+
na gorąco mianowanym roztworem
manganianu(VII). Tlenek cynku wytrąca żelazo
trójwartościowe dzięki temu, że zobojętnia obecny w
roztworze kwas, łącznie z kwasem tworzącym się w wyniku
hydrolizy soli żelaza(III).
HCl
OH
Fe
HOH
FeCl
6
)
(
2
6
2
3
3
O
H
ZnCl
ZnO
HCl
2
2
3
3
3
6
Manganometryczne oznaczanie żelaza opiera się na
reakcji utleniania jonów żelaza(II) do żelaza(III) podczas
miareczkowania mianowanym roztworem KMnO
4
w
środowisku kwaśnym.
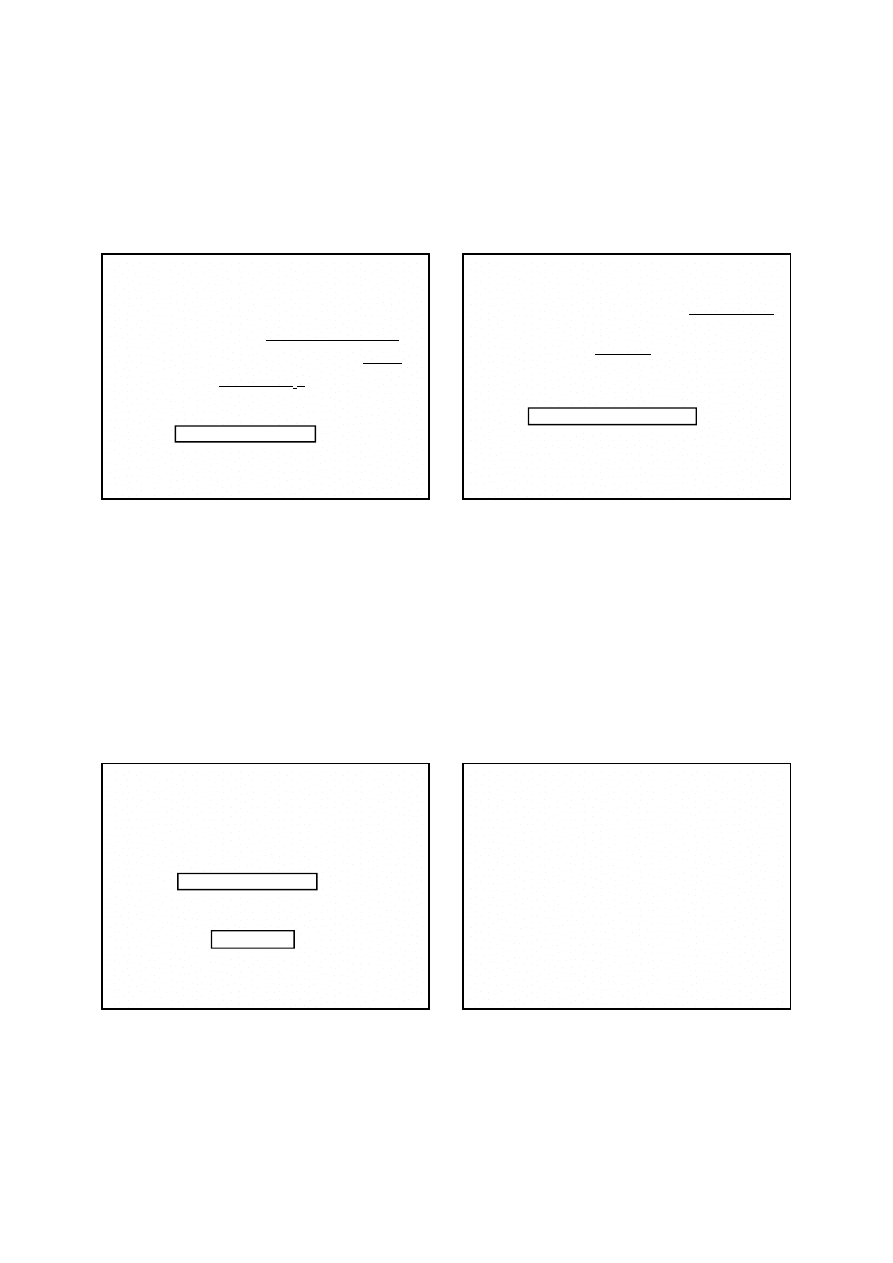
Manganometryczne oznaczanie żelaza
O
H
Fe
Mn
H
Fe
MnO
2
3
2
2
4
4
5
8
5
9
Oznaczanie całkowitej zawartości żelaza w badanym
roztworze musi poprzedzić redukcja Fe(III) do Fe(II).
Najczęściej redukuje się żelazo(III) za pomocą chlorku
cyny(II) (SnCl
2
).
Manganometryczne oznaczanie żelaza
Jony Sn
2+
redukują Fe
3+
zgodnie z reakcją
4
2
2
3
2
2
Sn
Fe
Sn
Fe
Nadmiar reduktora usuwa się za pomocą chlorku rtęci(II),
który utlenia SnCl
2
do SnCl
4
, a sam przy tym redukuje się do
dwuchlorku dwurtęci (kalomelu) – związku praktycznie
nierozpuszczalnego w wodzie i nie reagującego w widoczny
sposób z manganianem(VII).
Manganometryczne oznaczanie żelaza
2
2
4
2
2
2
Cl
Hg
SnCl
HgCl
SnCl
1. redukcję jonów żelaza(III) chlorkiem cyny(II) należy
prowadzić na gorąco;
2. należy unikać nadmiaru SnCl
2
, gdyż redukcja HgCl
2
może zajść częściowo do rtęci metalicznej
Manganometryczne oznaczanie żelaza
Hg
SnCl
HgCl
SnCl
4
2
2
która podczas miareczkowania redukowałaby
manganian(VII) zgodnie ze schematem:
e
Hg
Hg
2
2
W celu zapobiegania redukcji chlorku rtęci(II) do Hg
przeprowadza się reakcję między HgCl
2
i SnCl
2
jak
najszybciej i na zimno.
3. użycie zbytniego nadmiaru chlorku cyny(II) jest
szkodliwe również z tego powodu, że powstaje z niego
duża ilość kalomelu, który może częściowo redukować
manganian(VII) lub jony żelaza(III);
4. reakcja między chlorkiem rtęci(II) a chlorkiem cyny(II)
nie przebiega momentalnie (gdyż HgCl
2
jest słabo
zdysocjowany na jony), dlatego stosuje się duży
nadmiar roztworu HgCl
2
, a miareczkowanie żelaza
powinno się rozpoczynać po kilku minutach.
Manganometryczne oznaczanie żelaza
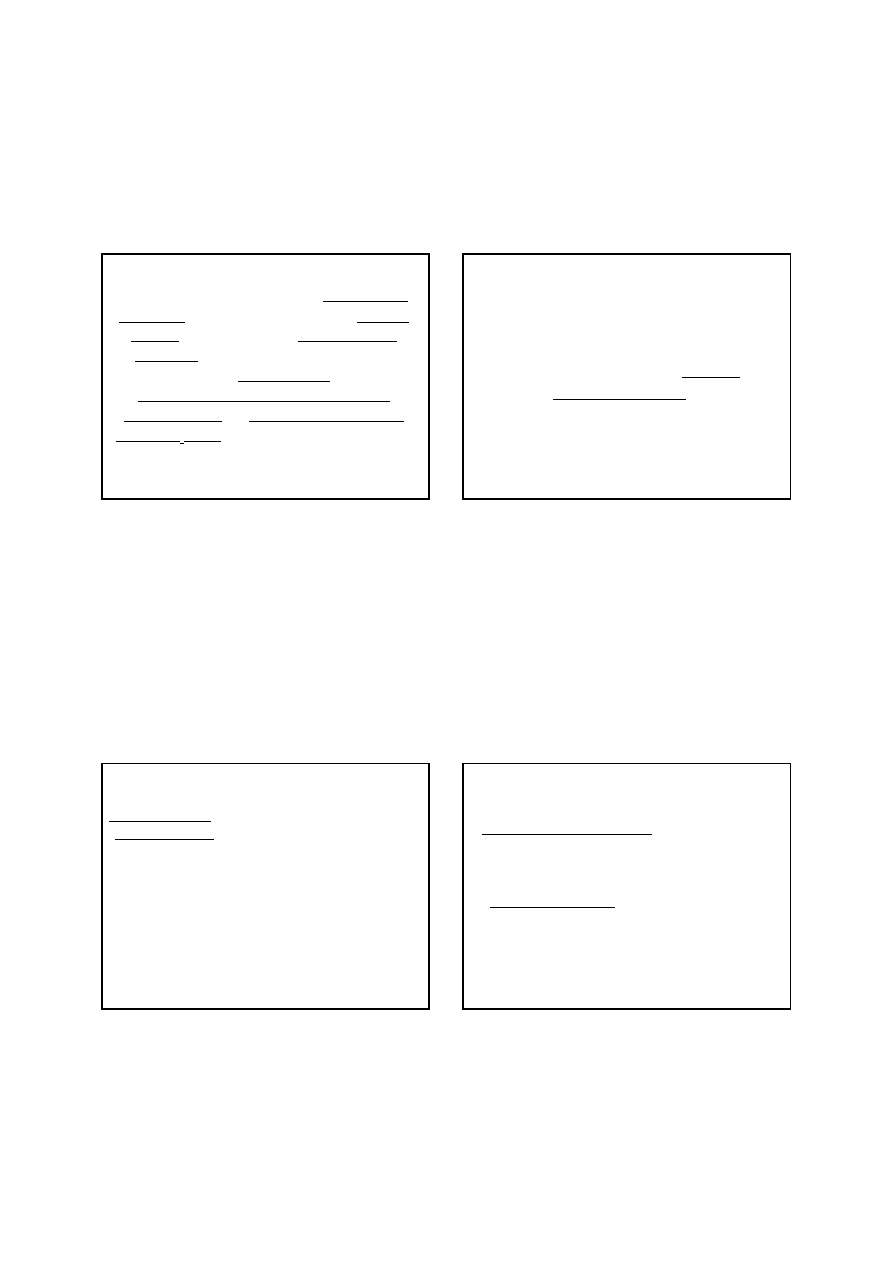
10
Podczas miareczkowania jonów Fe
2+
w obecności jonów
chlorkowych może zachodzić uboczna reakcja utleniania
chlorków roztworem KMnO
4
do wolnego chloru lub
chloranu(I). Aby temu zapobiec wprowadza się do
roztworu nadmiar soli manganu(II). Jony Mn
2+
przyspieszają katalitycznie reakcję jonów Fe(II) z
manganianem(VII) oraz obniżają potencjał utleniający
układu MnO
4
-
/Mn
2+
, skutkiem czego zmniejsza się bardzo
możliwość utleniania jonów Cl
-
.
Manganometryczne oznaczanie żelaza
Manganometryczne oznaczanie żelaza
Manganometryczne oznaczanie żelaza w roztworze
zawierający duże ilości jonów chlorkowych może
prowadzić do błędnych wyników, aby temu zapobiec do
badanego roztworu wprowadza się mieszaninę
Zimmermana-Reinhardta.
Mieszanina ta zawiera: MnSO
4
, H
2
SO
4
i H
3
PO
4
Manganometryczne oznaczanie żelaza
Kwas fosforowy(V), jak również – choć w mniejszym stopniu
– kwas siarkowy(VI), tworzą z żelazem trójwartościowym jony
kompleksowe, prawdopodobnie Fe(PO
4
)
2
3-
i Fe(SO
4
)
2
-
.
Dodatek tych kwasów zmniejsza więc w miareczkowanym
roztworze stężenie jonów Fe(III) i zmniejsza potencjał
utleniający układu Fe(III)/Fe(II), ułatwiając utlenianie jonów
Fe(II). Poza tym dzięki tworzeniu się bezbarwnych jonów
kompleksowych nie występuje w roztworze żółte zabarwienie
jonów Fe(III), a więc łatwiej można zaobserwować punkt
końcowy miareczkowania
Manganometryczne oznaczanie żelaza
Manganometrycznemu oznaczeniu żelaza przeszkadzają
wanadany, chromiany i uran(VI), gdyż podczas redukcji
żelaza(III) chlorkiem cyny(II) redukują się one do V(IV),
Cr(III) i U(IV), a w tych postaciach pierwiastki te reagują
z nadmanganianem podczas miareczkowania. Również
antymon(III) i arsen(III) przeszkadzają w oznaczaniu
żelaza.
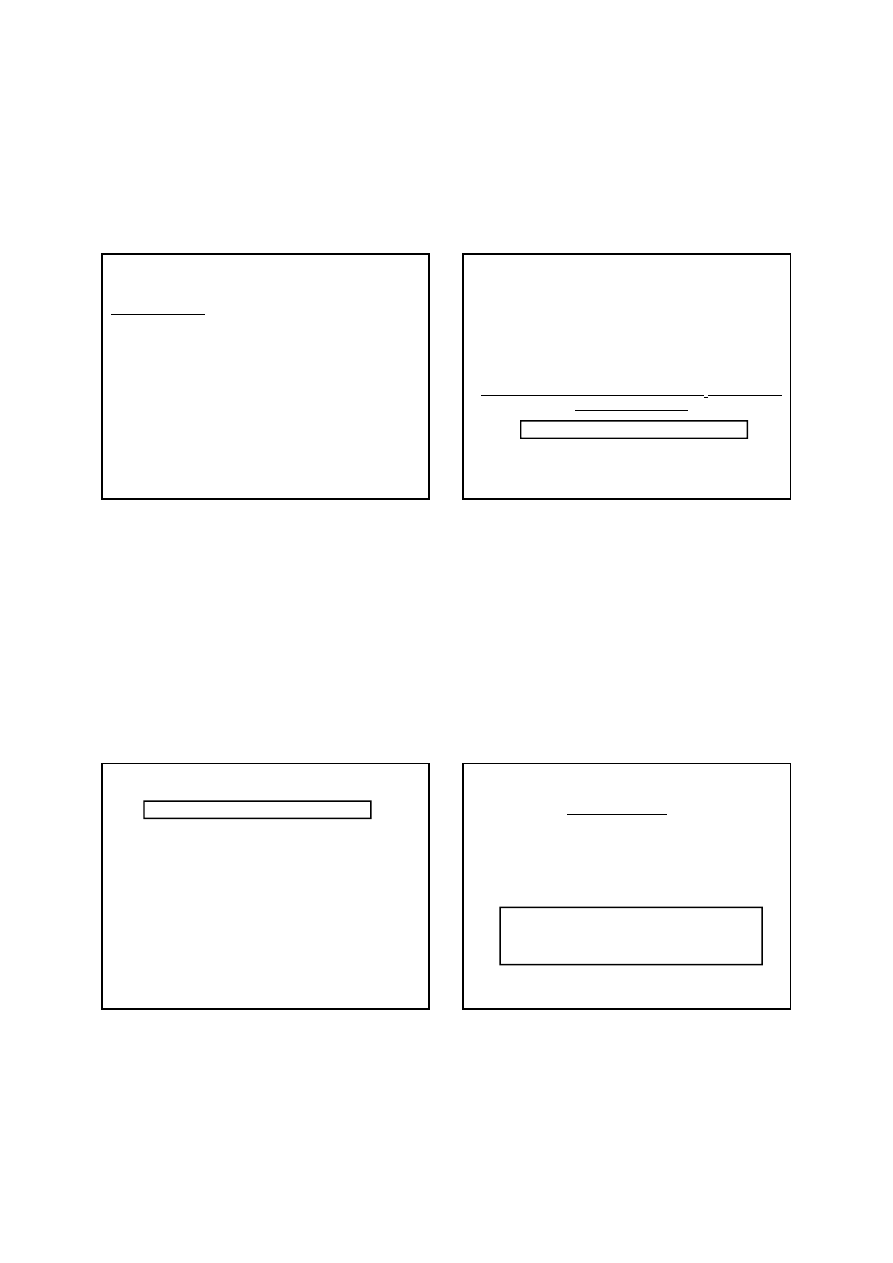
11
Nadtlenek wodoru ma właściwości zarówno utleniające jak i
redukujące. Nadtlenek wodoru utlenia w środowisku kwaśnym
wiele jonów o właściwościach redukujących, jak Fe
2+
, Sn
2+
, I
-
.
Na tej właściwości nadtlenku wodoru opiera się jego
jodometryczne oznaczanie. Jeszcze silniejsze właściwości
utleniające wykazuje nadtlenek wodoru w roztworze
alkalicznym, utleniając np. mangan(II) do tlenku
managanu(IV).
Manganometryczne oznaczanie H
2
O
2
W stosunku do silnych utleniaczy, takich jak manganian(VII)
potasu, nadtlenek wodoru zachowuje się w środowisku
kwaśnym jak reduktor.
Manganometryczne oznaczanie H
2
O
2
W kwaśnym środowisku redukuje on KMnO
4
do Mn
2+
, przy
czym uwalnia się tlen:
O
H
Mn
O
H
MnO
O
H
2
2
2
4
2
2
8
2
5
6
2
5
Manganometryczne oznaczanie H
2
O
2
O
H
Mn
O
H
MnO
O
H
2
2
2
4
2
2
8
2
5
6
2
5
1. Reakcję tę katalizują jony manganu(II)
2. Ze zwiększeniem rozcieńczenia maleje trwałość
roztworu nadtlenku wodoru
3. W celu zwiększenia trwałości roztworów nadtlenku
wodoru dodaje się do nich pewne ilości tzw.
stabilizatorów, np. mocznika, kwasu moczowego
Oznaczanie wapnia
Inne przykładowe oznaczenia manganometryczne
Wapń wytrąca się w postaci szczawianu, osad CaC
2
O
4
rozpuszcza się w kwasie siarkowym(VI) i miareczkuje
roztworem manganianu(VII) potasu powstały kwas
szczawiowy, wydzielony w ilości równoważnej ilości
wapnia:
O
H
Mn
CO
H
MnO
O
C
H
O
C
H
CaSO
SO
H
O
CaC
O
CaC
O
C
Ca
2
2
2
4
4
2
2
4
2
2
4
4
2
4
2
4
2
2
4
2
2
8
2
10
6
2
5

12
Oznaczanie azotanów(III)
Inne przykładowe oznaczenia manganometryczne
Azotany(III) w roztworach kwaśnych ulegają pod wypływem
KMnO
4
ilościowemu utlenieniu, zwłaszcza na gorąco
O
H
Mn
NO
H
NO
MnO
2
2
3
2
4
3
2
5
6
5
2
Oznaczanie azotanów(V)
Inne przykładowe oznaczenia manganometryczne
Azotan(V) redukuje się na gorąco, w środowisku kwaśnym,
do NO odmierzonym nadmiarem mianowanego roztworu
siarczanu(VI) żelaza(II)
O
H
Fe
NO
H
NO
Fe
2
3
3
2
2
3
4
3
Nadmiar reduktora odmiareczkowuje się mianowanym
roztworem manganianu(VII) potasu.
Wyszukiwarka
Podobne podstrony:
Fizjologia Cwiczenia 11 id 1743 Nieznany
Biologia Cwiczenia 11 id 87709 Nieznany (2)
moje wykresy 11 id 306777 Nieznany
G2 PB 02 B Rys 3 11 id 185401 Nieznany
Materialy pomocnicze 4 id 28534 Nieznany
III CZP 33 11 id 210275 Nieznany
mat bud cwicz 10 11 id 282450 Nieznany
grupa 11 id 441853 Nieznany
24 11 id 30514 Nieznany (2)
mnozenie do 25 11 id 304283 Nieznany
cwiczenie 11 id 125145 Nieznany
ort wiosna 11 id 340445 Nieznany
K 118 11 id 229276 Nieznany
Chemia 11 3 id 111768 Nieznany
cw2 11 id 123042 Nieznany
dialog zn 11 id 135614 Nieznany
P 11 id 343562 Nieznany
IMG 11 id 210984 Nieznany
cw 11 id 122151 Nieznany
więcej podobnych podstron