
KOROZJA METALI
Korozja jest jednym z najpowa
ż
niejszych czynników powoduj
ą
cych destrukcj
ę
konstrukcji metalowych, która mo
ż
e prowadzi
ć
do awarii lub katastrofy.
1.Rodzaje korozji ze wzgl
ę
du na przyczyn
ę
powstania
Rozró
ż
nia si
ę
trzy podstawowe rodzaje korozji metali ze wzgl
ę
du
na przyczyn
ę
powstania:
a)
Korozja chemiczna
b)
Korozja elektrochemiczna
c) Korozja kontaktowa

Ad. a) Korozja chemiczna
Korozja chemiczna metali nast
ę
puje w wyniku działania suchych
gazów lub cieczy nie przewodz
ą
cych pr
ą
du elektrycznego.
Przykładem korozji chemicznej mo
ż
e by
ć
działanie tlenu na metale w
podwy
ż
szonej temperaturze w rezultacie którego na powierzchni
metalu powstaje warstwa tlenku. Utlenianie metalu do jego tlenków
metalu powstaje warstwa tlenku. Utlenianie metalu do jego tlenków
nie zawsze jest procesem szkodliwym. Je
ż
eli warstwa tlenku jest
dostatecznie zwarta i mocno zwi
ą
zana z powierzchni
ą
metalu, chroni
ona (pasywuje) metal przed dalszym utlenianiem. ( Przykład:
elementy aluminiowe lub cynkowe pokryte tlenkiem –
zabezpieczenie, spirala w piecyku elektrycznym-uszkodzenie).
.
Ad. b)
Korozja elektrochemiczna
Korozja elektrochemiczna powstaje wskutek działania krótkozwartych
ogniw na styku metalu z elektrolitem. Ogniwa te powstaj
ą
w rezultacie
niejednorodno
ś
ci chemicznej (lub fizycznej) metalu np. na styku
ró
ż
nych metali, b
ą
d
ź
wskutek niejednorodno
ś
ci krystalicznej w
strukturze metalu.
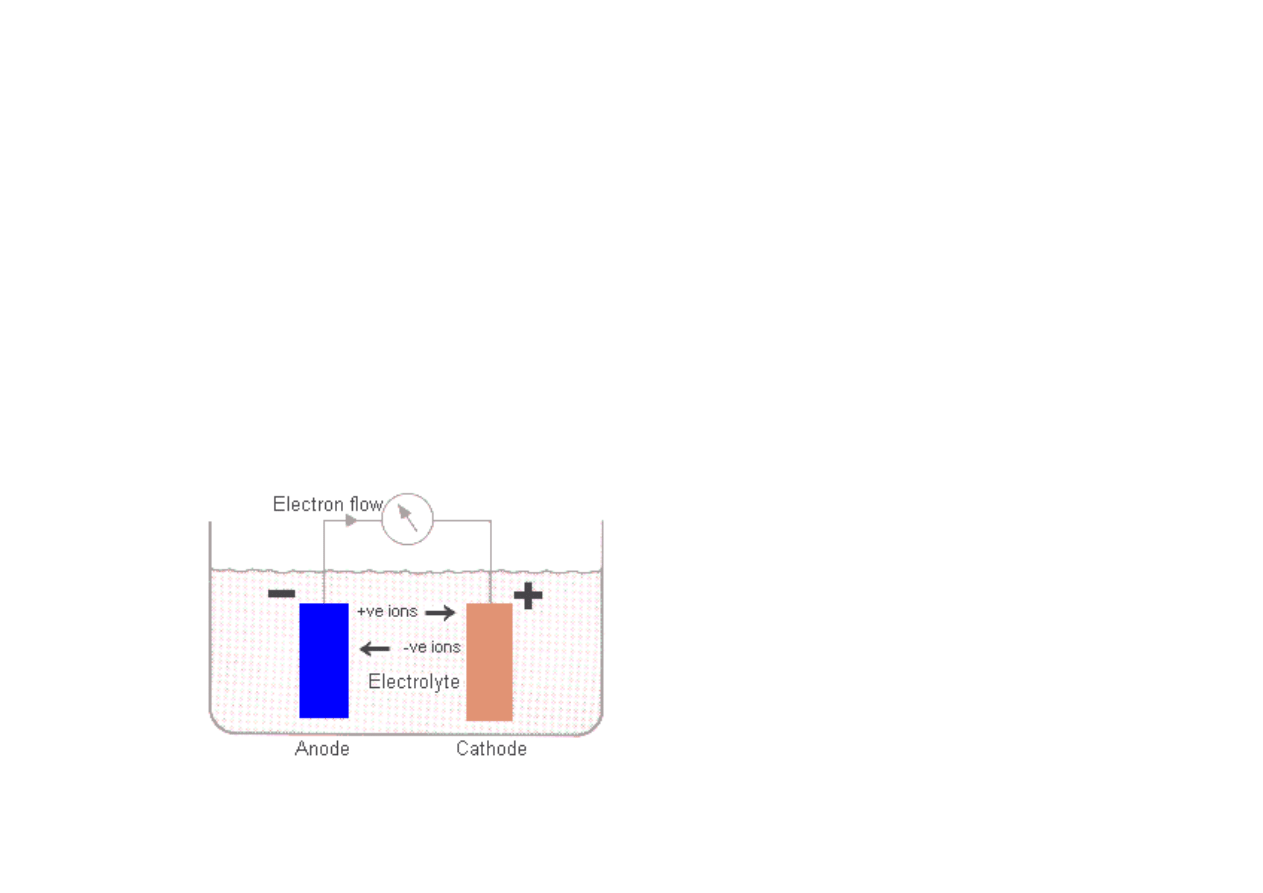
Model ogniwa galwanicznego
Model ogniwa galwanicznego
Po stronie anody metal koroduje.
Metal po stronie katody nie koroduje
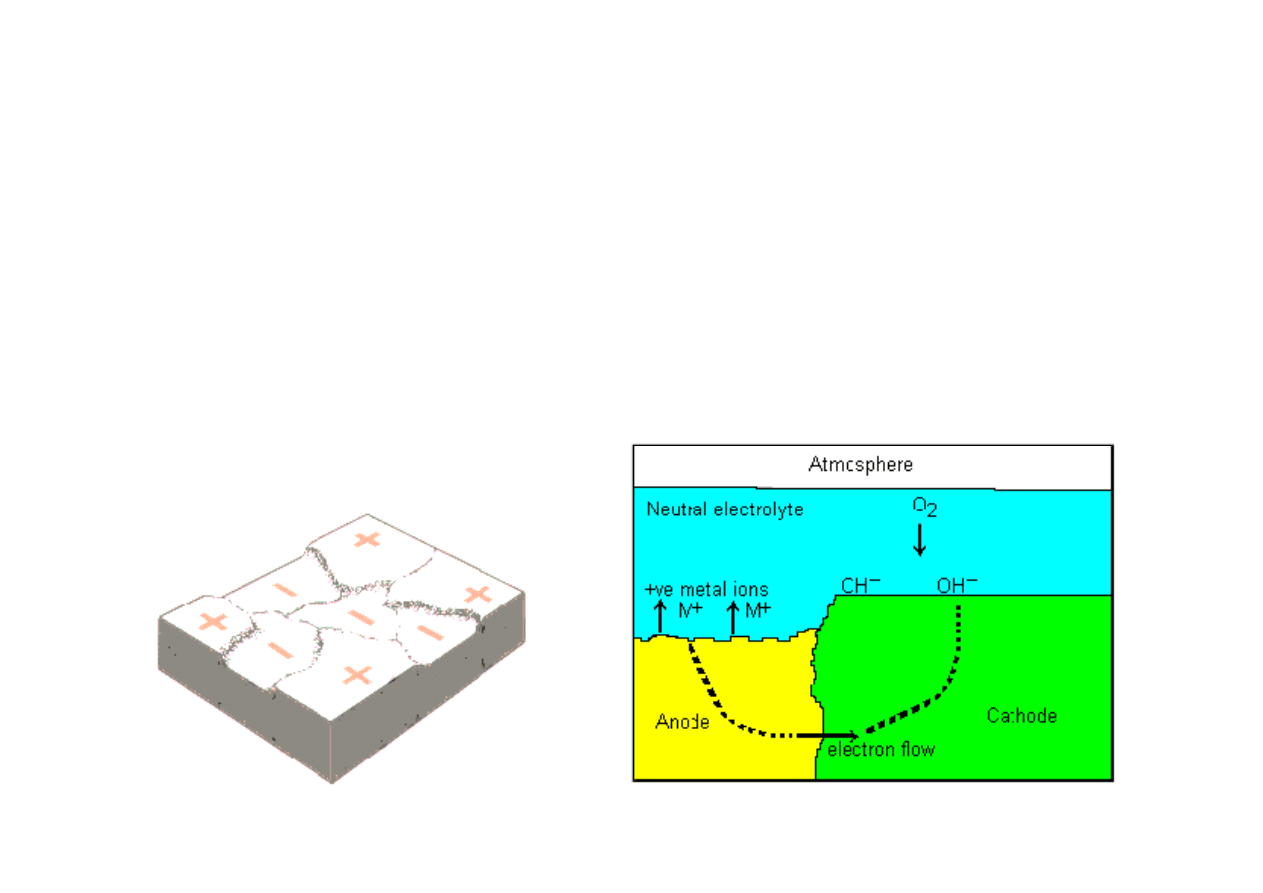
W skutek zmienno
ś
ci struktury stali na powierzchni elementu wyst
ę
puj
ą
obszary o ró
ż
nym potencjale elektrycznym. Oznacza to,
ż
e pewne fragmenty
powierzchni mog
ą
utworzy
ć
anod
ę
a inne katod
ę
. W przypadku pojawienia si
ę
wody tworz
ą
cej elektrolit-powstaje ogniwo i zaczyna si
ę
proces
elektrochemiczny.
Przebieg reakcji na anodzie:
Fe + 1/2 O
2
+ H
2
O = Fe(OH)
2
4 Fe(OH)
2
+ O
2
= 2 Fe
2
O
3
x H
2
O + 2 H
2
O

• Ka
ż
dy metal tego szeregu wypiera nast
ę
pne metale z roztworu ich soli.
• Wszystkie metale wyst
ę
puj
ą
ce w szeregu przed wodorem posiadaj
ą
ujemne
potencjały normalne. S
ą
to metale “nieszlachetne”, które wypieraj
ą
wodór z
kwasów czyli rozpuszczaj
ą
si
ę
w kwasach z wydzieleniem wodoru.
•
Wszystkie metale wyst
ę
puj
ą
ce w szeregu napi
ę
ciowym za wodorem
Na< Mg< Al< Zn< Fe<Cd<Co<Ni<Pb<
H
<Cu<Hg<Ag<Au
Szereg napi
ę
ciowy metali
•
Wszystkie metale wyst
ę
puj
ą
ce w szeregu napi
ę
ciowym za wodorem
posiadaj
ą
dodatnie potencjały normalne. S
ą
to metale “szlachetne”, które nie
wypieraj
ą
wodoru z kwasów.
• Poło
ż
enie metalu w szeregu napi
ę
ciowym a posiada bardzo istotne
znaczenie dla podatno
ś
ci metalu na korozj
ę
elektrochemiczn
ą
. Im bardziej
ujemna jest warto
ść
potencjału normalnego metalu tym wi
ę
ksz
ą
posiada on
tendencj
ę
do przechodzenia do roztworu a wi
ę
c do korodowania.

Ad. c) Korozja kontaktowa
Powstaje w przypadku bezpo
ś
redniego kontaktu metali o ró
ż
nym
potencjale elektrycznym ( szereg napi
ę
ciowy metali) w
ś
rodowisku
wilgotnym. Im wi
ę
ksza ró
ż
nica w potencjałów elektrycznych stykaj
ą
cych
si
ę
metali tym wi
ę
kszy przepływ ładunków w srodowisku wilgotnym i
intensywniejsza
korozja.
Mechanizm
tej
korozji
jest
wi
ę
c
elektrochemiczny.
Najcz
ęś
ciej spotykane w kontakcie
stali (Fe) i aluminium (Al)
miedzi (Cu)-i stali nierdzewnej (Fe + Ni)
w konstrukcjach budowlanych i instalacjach sanitarnych i przemysłowych
2
. Zapobieganie korozji i ochrona przed korozj
ą
2.1. Zapobieganie korozji
Zapobieganie korozji polega na:
a) odpowiednim kształtowaniu konstrukcji i poł
ą
cze
ń
na etapie
projektowania
b) dobór najkorzystniejszego gatunku stali ze wzgl
ę
du
przewidywane zagro
ż
enia korozyjne- tj. stali odpornej na
korozj
ę
.
Ad. a) Kształtowanie konstrukcji
Ad. a) Kształtowanie konstrukcji
- dobór przekrojów ( zalecane przekroje otwarte masywne (min
U/A) lub zamkni
ę
te zabezpieczone przed dost
ę
pem powietrza
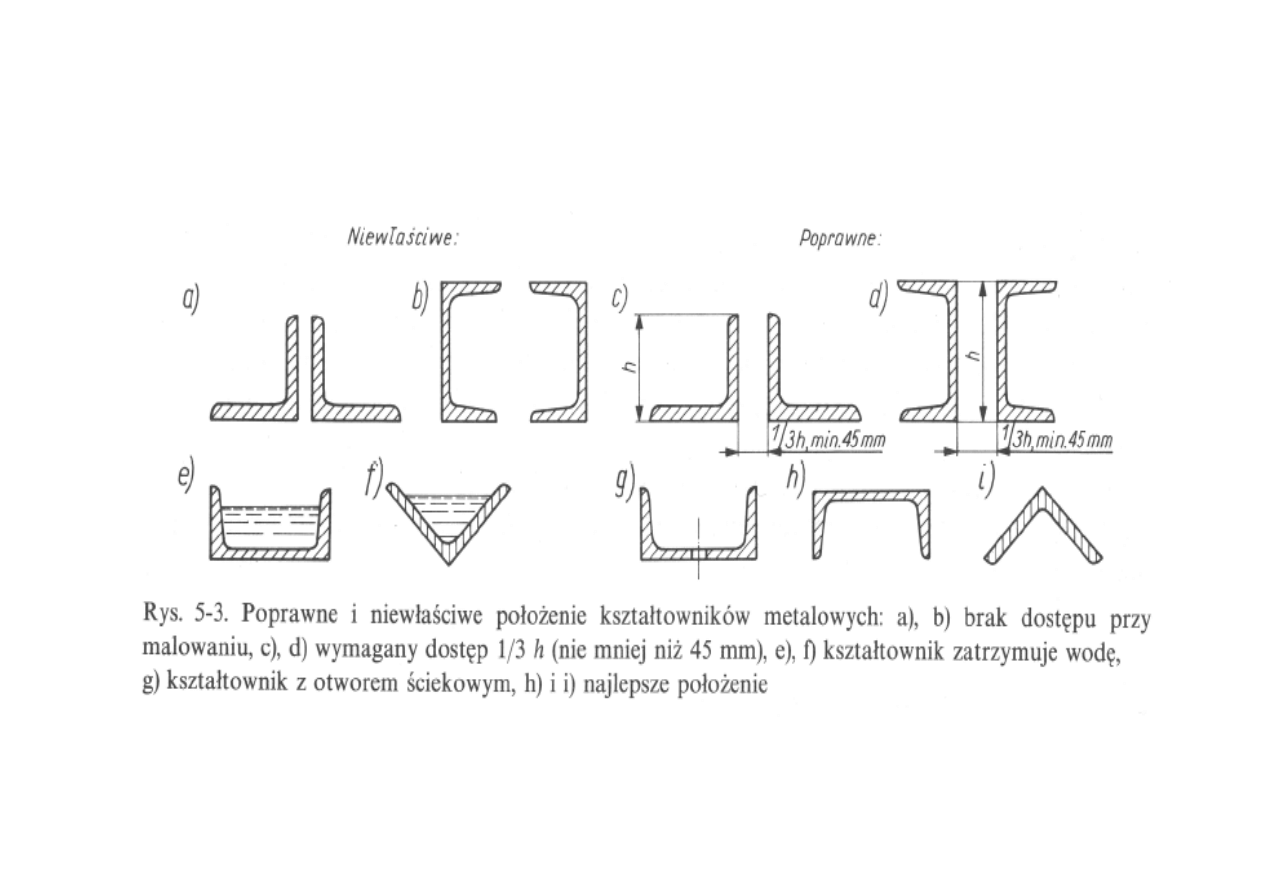
- unikanie zakamarków, na których mog
ą
gromadzi
ć
si
ę
woda lub
zanieczyszczenia
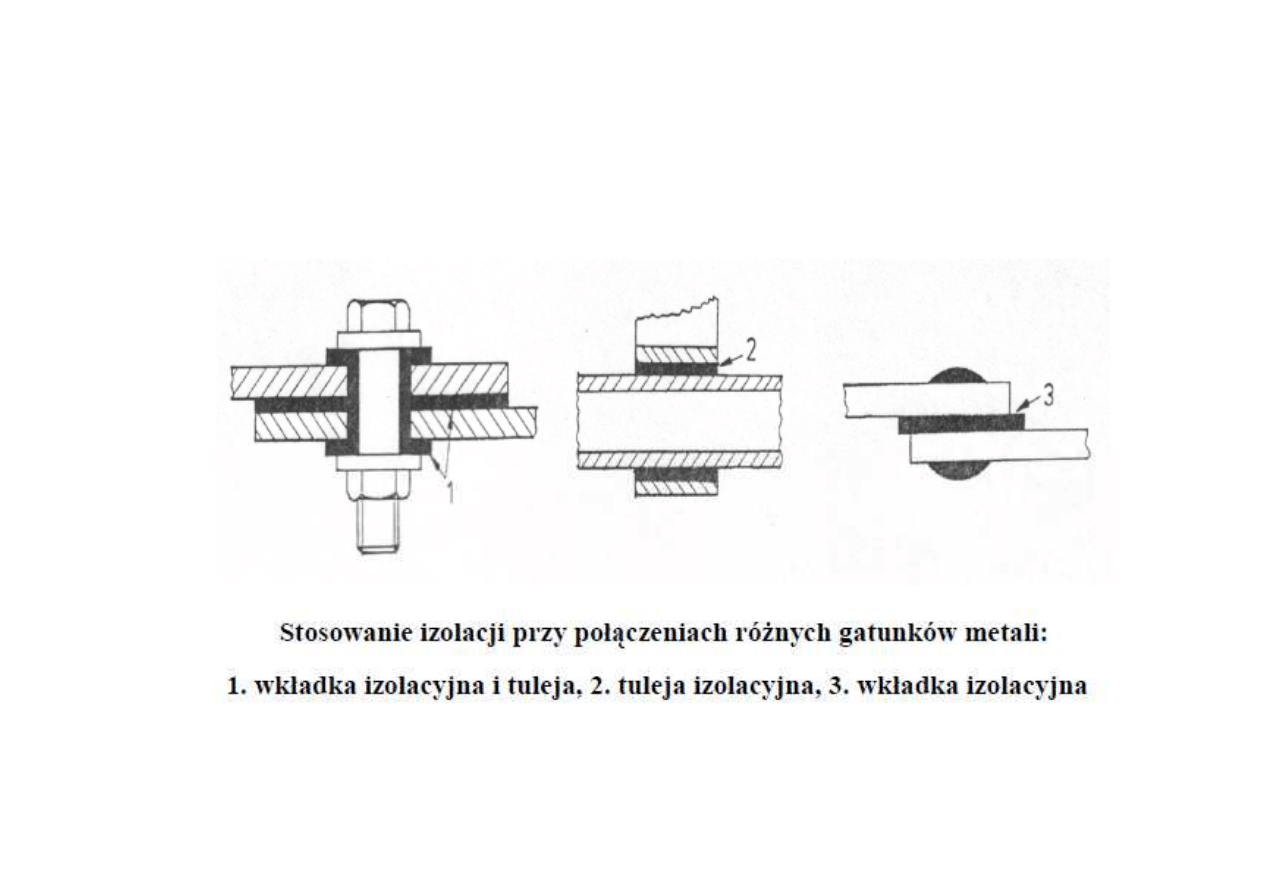
- unikanie bezpo
ś
redniego kontaktu stali o ró
ż
nym potencjale
elektrycznym

Ad. b) Stale odporne na korozj
ę
, stale nierdzewne
•
Podwy
ż
szenie odporno
ś
ci na korozj
ę
stali uzyskuje si
ę
przez
dodanie pierwiastków stopowych Cu, Ni, Cr, Mo
•
Stale o podwy
ż
szonej odporno
ś
ci na korozj
ę
atmosferyczn
ą
(stale Cor-Ten ) powstaj
ą
przez dodanie odpowiedniej ilo
ś
ci miedzi
w procesie wytopu. Stale te stosuje si
ę
na stalowe konstrukcje
budowlane ( kominy, estakady, pomosty itp)
Du
żą
odporno
ść
na korozj
ę
uzyskuje si
ę
przez dodanie co najmniej
10,5% chromu do stali. Wy
ż
sza zawarto
ść
chromu i dalsze składniki
stopowe, jak nikiel i molibden, jeszcze bardziej podwy
ż
szaj
ą
stopowe, jak nikiel i molibden, jeszcze bardziej podwy
ż
szaj
ą
odporno
ść
korozyjn
ą
( stale nierdzewne).
•
Stale nierdzewne mo
ż
na podzieli
ć
metalograficznym na
odpowiednio przygotowanej próbce PN dzieli je na:
•
stale kwasoodporne (odporne na działanie kwasów słabszych ni
ż
siarkowy, stosowane w przemy
ś
le chemicznym (zbiorniki rury)
•
stale nierdzewne ( odporne na działanie słabszych kwasów i
zasad) stosowane w przemy
ś
le spo
ż
ywczym i na elementy
galanterii stalowej

2.2.Ochrona przed korozj
ą
.
2.2.1.Powłoki ochronne
a) Powłoki organiczne
Jest to tradycyjna metoda ochrony przed korozj
ą
stali. Polega na
nanoszeniu na powierzchni
ę
stali warstw:
• olejów
• smarów
• bitumów (smoły, asfaltów)
• gumy
• polimerów
ż
ywicznych
• farb i lakierów
Powłoki te stosuje si
ę
w przemy
ś
le maszynowym i chemicznym,
budownictwie wodnym,, gospodarstwach. S
ą
one cz
ę
sto najta
ń
szym
sposobem zabezpieczenia elementów przed korozj
ą
.
b) Malowanie ochronne (farby i lakiery)
Zasady dobierania i projektowania pokryć malarskich określa norma
PN-EN-ISO 12944-1do5 „Farby i Lakiery. Ochrona przed korozją
konstrukcji stalowych za pomocą ochronnych systemów malarskich”
Czystość powierzchni do pokrywania
Rozró
ż
nia si
ę
trzy stopnie czysto
ś
ci powierzchni 1,2,3 ( od najczystszej do
najmniej oczyszczonej) przeznaczonej do pokrywania
ś
rodkami ochrony.
Metody przygotowania powierzchni
Metody przygotowania powierzchni
Oczyszczenie strumieniowo-
ś
cierne – za pomoc
ą
ś
rutowania lub
piaskowania. Uzyskuje si
ę
1 lub 2 st. czysto
ś
ci
Ś
rutowanie- czyszczenie pneumatyczne za pomoc
ą
kulek metalowych o
du
ż
ej twardo
ś
ci. Stosowane do cz
ęś
ci mechaniczneych i galanterii
budowlanej.
Piaskowanie - czyszczenie pneumatyczne za pomoc
ą
drobin kwarcu (
piasku) lub rozdrobnionego
ż
u
ż
la pohutniczego
.
Stosowane w wi
ę
kszo
ś
ci
przypadków do elementów konstrukcyjnych.
Czyszczenie r
ę
czno-mechaniczne – przy u
ż
yciu urz
ą
dze
ń
mechanicznych, jak : młotki pneumatyczne, szczotki mechaniczne,
szlifierki, skrobaki pneumatyczne. Uzyskuje si
ę
stopie
ń
czysto
ś
ci 2 i
3. Stosuje si
ę
przy renowacji istniej
ą
cych powłok.
Czyszczenie płomieniowe – opalanie powierzchni
zanieczyszczonych farbami, smarami lub olejami i usuwanie lu
ź
nych
zanieczyszcze
ń
za pomoc
ą
szczotek. Stosuje si
ę
przy renowacji
istniej
ą
cych powłok.
Czyszczenie r
ę
czne szczotkami – przy u
ż
yciu szczotek stalowych.
Mało skuteczne. Trudno uzyska
ć
nawet 3 stopie
ń
czysto
ś
ci. Stosuje
si
ę
przy renowacji istniej
ą
cych powłok w trudnodost
ę
pnych
miejscach.
Czyszczenie chemiczne- za pomoc
ą
specjalnych rozpuszczalników.
Stosuje si
ę
w sytuacjach gdzie nie mo
ż
na zastosowa
ć
innych
metod.

Zestawy malarskie
Zestaw malarski jest to pokrycie wielowarstwowe składaj
ą
ce si
ę
z 1
- 2 warstw podkładowych o dobrej przyczepno
ś
ci do podło
ż
a i
dobrych wła
ś
ciwo
ś
ciach ochronnych oraz 2-3 warstw
nawierzchniowych barierowych ( zapobiegaj
ą
cych przenikaniu
czynników agresywnych).
Jako pierwsz
ą
warstw
ę
nale
ż
y stosowa
ć
pokrycie tzw. gruntem
aktywnym lub
ś
rodkami przetwarzaj
ą
cymi rdz
ę
( minia ołowiowa,
minia cynkowa). Mo
ż
na stosowa
ć
tu równie
ż
powłoki malarskie
przeznaczone na powierzchnie pokryte rdz
ą
nalotow
ą
( Epirust,
Hammerite). Grubo
ść
tych warstw w zale
ż
no
ś
ci od powłoki powinna
Hammerite). Grubo
ść
tych warstw w zale
ż
no
ś
ci od powłoki powinna
wynosi
ć
20 do 80
µ
m
Warstwy nawierzchniowe powinny by
ć
dobrane z uwzgl
ę
dnieniem
warstw gruntuj
ą
cych. Najcz
ęś
ciej w konstrukcjach stalowych stosuje
si
ę
farby:
alkilowe (ftalowe),chlorokauczukowe, poliwinylowe,
epoksydowe, silikonowe, ( rzadziej: olejne, bitumiczne). Grubo
ść
tych warstw w zale
ż
no
ś
ci od powłoki powinna wynosi
ć
40 do 180
µ
m.
Dobór farb w zestawie oraz grubo
ś
ci powłok uzgodni
ć
z
instrukcj
ą
producenta.
b) Powłoki nieorganiczne
Emalie szkliste: cechuje du
ż
a odporno
ść
na alkalia, kwasy,
ś
cieranie, temperatur
ę
. Stosuje si
ę
w naczyniach spo
ż
ywczych,
zbiornikach na wod
ę
itp..
wady: du
ż
a krucho
ść
Powłoki tlenkowe:
Anodowanie Al. - sztuczne utlenianie powierzchni aluminiowych.
Stosowane dla celów ozdobnych lub do dalszego procesu
pokrywania blach aluminiowych
Czernienie (oksydowanie) stali. Jest to metoda chemiczna
pokrywania tlenkiem metalu. Stosowana w narz
ę
dziach, ł
ą
cznikach
(
ś
rubach), elementach ozdobnych (okuciach)
Powłoki fosforanowe: uzyskiwanie na powierzchni stali i/lub metali
nie
ż
elaznych
ś
ci
ś
le przylegaj
ą
cych warstw nierozpuszczalnych
fosforanów poprzez zanurzenie w k
ą
pieli zawieraj
ą
cej zwi
ą
zki
fosforu. Stosowane w procesach pokrywania metali.
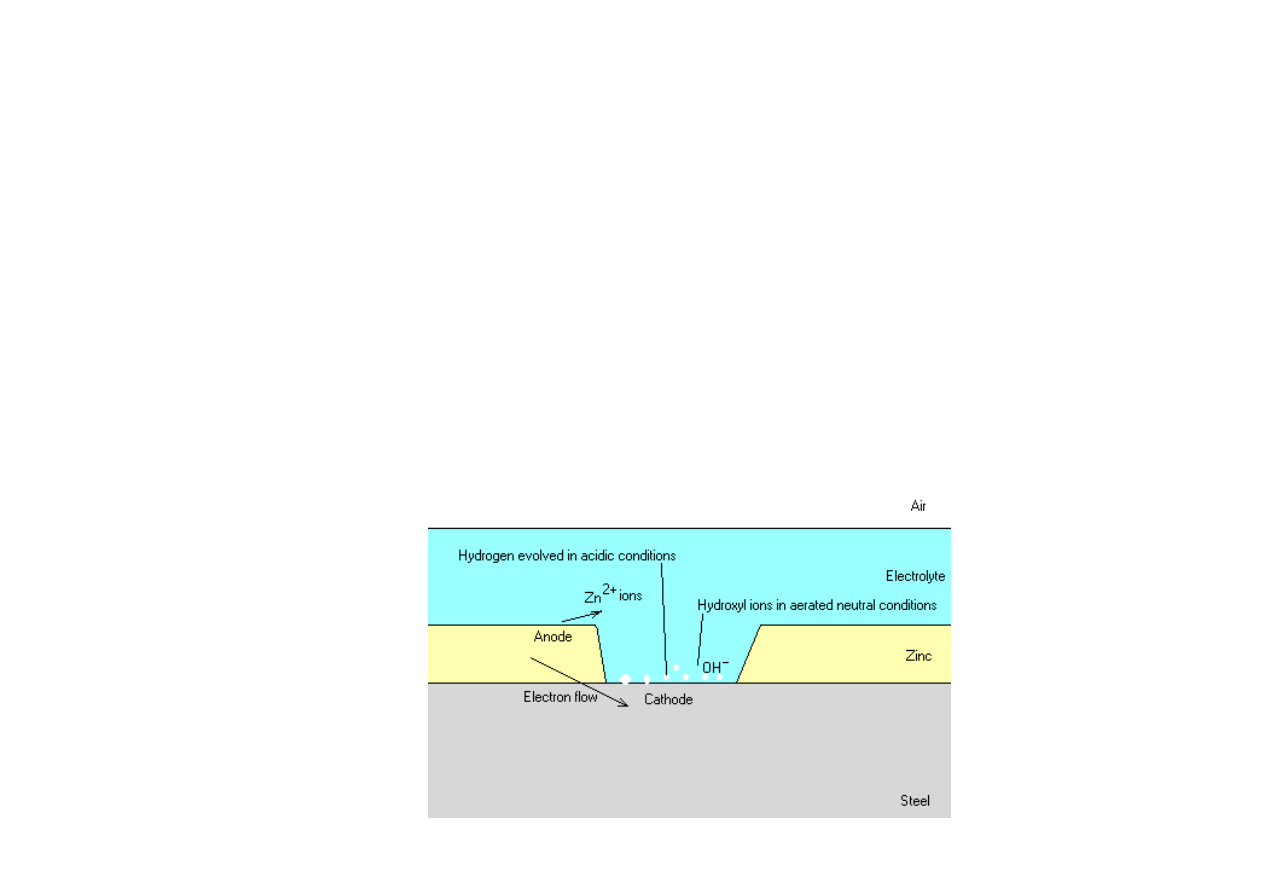
Powłoki metalowe
Powłoki anodowe s
ą
wykonane z metali o bardziej ujemnym
potencjale elektrochemicznym (mniej szlachetnych) ni
ż
metal
chroniony.
Pokrywanie metali powłokami anodowymi zapewnia chronionemu
metalowi ochron
ę
katodow
ą
, gdy
ż
powłoka z metalu mniej
szlachetnego działa w charakterze anody jako protektor. Jako
przykład powłok anodowych mo
ż
na wymieni
ć
cynk i kadm.
Najwa
ż
niejszym, praktycznym zastosowaniem powłok anodowych
Najwa
ż
niejszym, praktycznym zastosowaniem powłok anodowych
jest pokrywanie stali powłok
ą
cynkow
ą
(blachy ocynkowane).
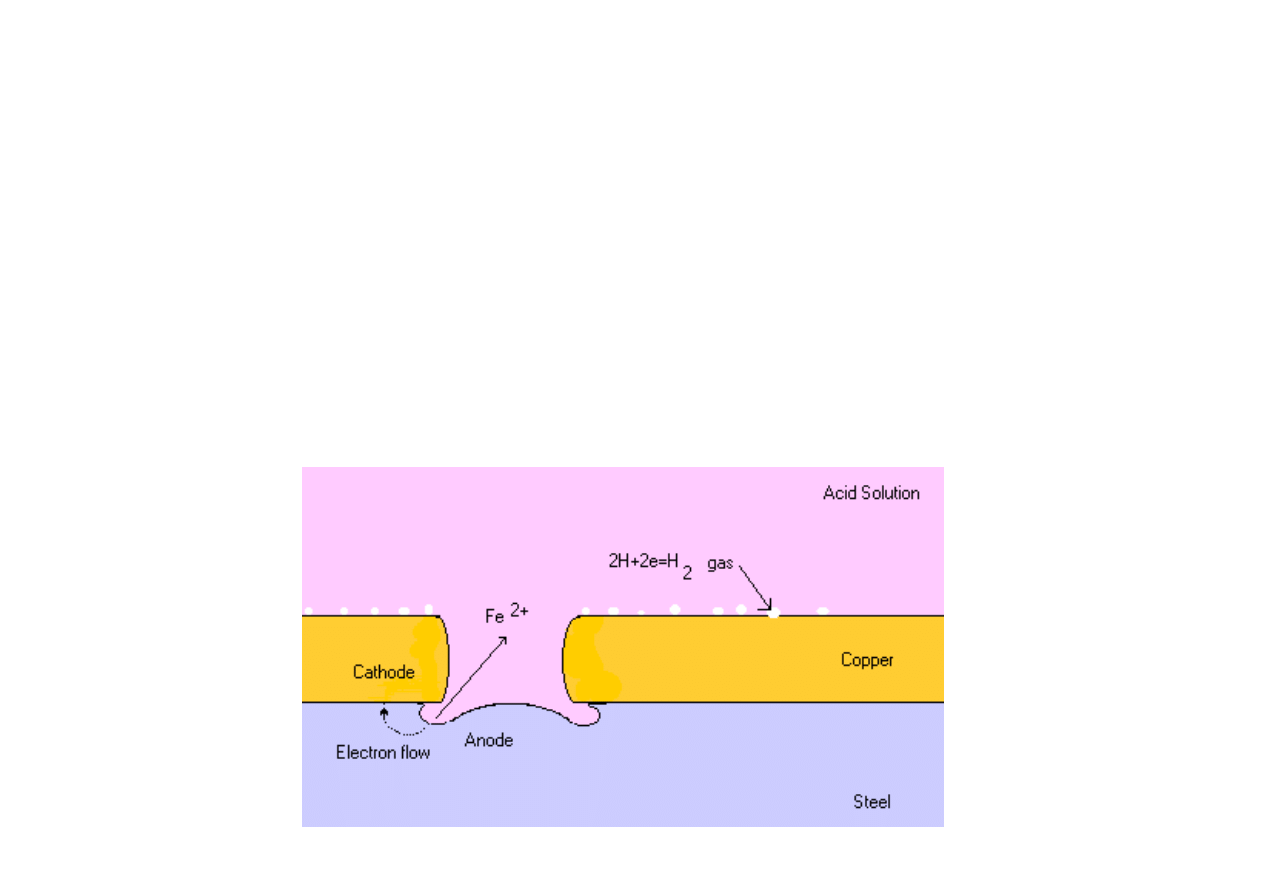
Powłoki katodowe s
ą
wykonane z metali bardziej szlachetnych ni
ż
metal chroniony. Przykładem powłok katodowych s
ą
np. powłoki z
miedzi, niklu, chromu, cyny lub srebra.
Powłoka katodowa jest skuteczna tylko wówczas, kiedy cała
powierzchnia stalowa jest ni
ą
szczelnie pokryta. Po utworzeniu
szczeliny powstaje mikroogniwo w którym
ż
elazo jest anod
ą
i ono
ulega rozpuszczeniu, co przyspiesza korozj
ę
, a metal szlachetny
staje si
ę
katod
ą
ogniwa. W rezultacie uszkodzenia powłoki
katodowej szybko
ść
korozji w miejscu uszkodzenia jest wi
ę
ksza ni
ż
w przypadku braku powłoki anodowej.
w przypadku braku powłoki anodowej.

Metaliczne powłoki ochronne mog
ą
by
ć
nakładane przez:
-zanurzenie w ciekłym metalu ( cynkowanie ogniowe) – stosowane
w konstrukcjach stalowych i ró
ż
nego typu blachach cienkich
-platerowanie (zwalcowanie na gor
ą
co)- stosowane dla celów
ozdobnych
-natryskiwanie roztopionego metalu na powierzchni
ę
chronion
ą
(aluminiowanie) – np. zabezpieczanie zbiorników stalowych na
(aluminiowanie) – np. zabezpieczanie zbiorników stalowych na
wod
ę
du
ż
ych pojemno
ś
ci
-elektroliz
ę
( powłoki galwaniczne ; chromowanie, niklowanie,
miedziowanie, posrebrzanie)

c) Inhibitory korozji
Inhibitory (opó
ź
niacze korozji) tworz
ą
zwykle na powierzchni metalu
warstewki ochronne hamuj
ą
ce szybko
ść
korozji. Dla korozji w
ś
rodowisku alkalicznym jako inhibitory korozji stosowane s
ą
sole
cyny, arsenu, niklu i magnezu, za
ś
w
ś
rodowisku kwa
ś
nym: krochmal,
klej lub białko. Inhibitory dodaje si
ę
do cieczy np. w ruroci
ą
gach sieci
cieplnych lub płynów chłodz
ą
cych w maszynach i urz
ą
dzeniach.
d) Ochrona elektrochemiczna
ZASADA: Przesuni
ę
cie potencjału elektrodowego chronionego
metalu do zakresu pasywnego
Ochrona katodowa polega na poł
ą
czeniu chronionej konstrukcji z
metalem mniej szlachetnym, tworz
ą
cym anod
ę
(protektor) ogniwa,
natomiast katod
ą
jest obiekt chroniony. Poł
ą
czenie takiej anody z
konstrukcj
ą
chronion
ą
wykonuje si
ę
przez bezpo
ś
redni styk ( tzw.
powłoki anodowe) lub za pomoc
ą
przewodnika.
Wyszukiwarka
Podobne podstrony:
Część 6a SŁUPY MIMOSRODOWO ŚCISKANE skrót
Dla studentów, Wykład 6
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
asm skrot prezentacji
guzy część szczegółowa rzadsze
Stomatologia czesc wykl 12
S II [dalsza część prezentacji]
wyklad 12nowy procesy elektrodowe i korozja
(65) Leki przeciwreumatyczne (Część 1)
Teoria organizacji i kierowania w adm publ prezentacja czesc o konflikcie i zespolach dw1
więcej podobnych podstron