
Druga zasada termodynamiki
odwracalność procesów
możliwość zamiany ciepła na pracę
entropia
prawo wzrostu entropii
śmierć cieplna wszechświata

Procesy odwracalne i
nieodwracalne
• zetknięcie ciał o różnej temperaturze
– ogrzewanie jednych ciał przez drugie
• połączenie zbiorników o różnym ciśnieniu.
– wiatry
• przejście układu do niższego stanu
energetycznego
– spalanie i wiele innych reakcji fizycznych.
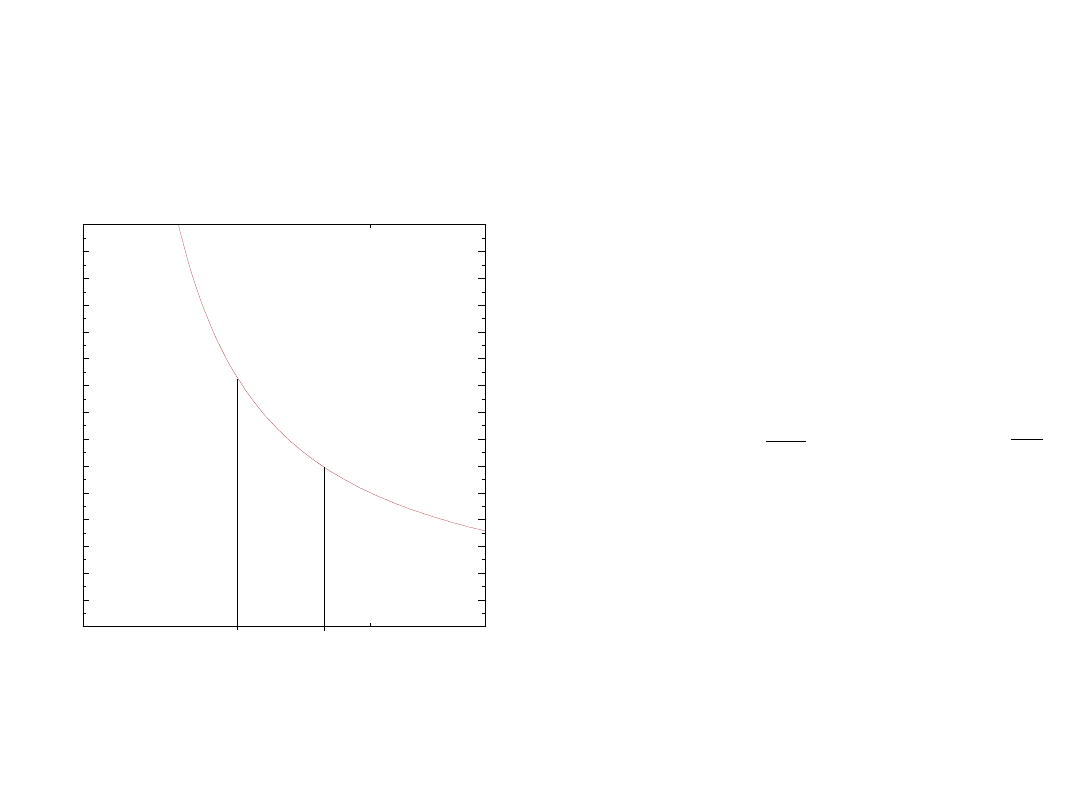
I zasada i równanie stanu gazu
przemiana izotermiczna
0
<-
--
V
2
<-
--
V
1
i
z
o
t
e
r
m
a
T
=
c
o
n
s
t
C
iś
ni
en
ie
, p
O
b
j
ę
t
o
ś
ć
,
V
2
2
1
1
V
p
V
p
nRT
pV
=
=
równanie stanu gazu
∫
∫
=
=
2
1
2
1
V
V
V
V
V
dV
nRT
pdV
W
praca wykonana przez gaz
W
Q
=
pobrane ciepło
0
=
∆
U
energia wewnętrzna
1
2
ln
V
V
nRT
W
=
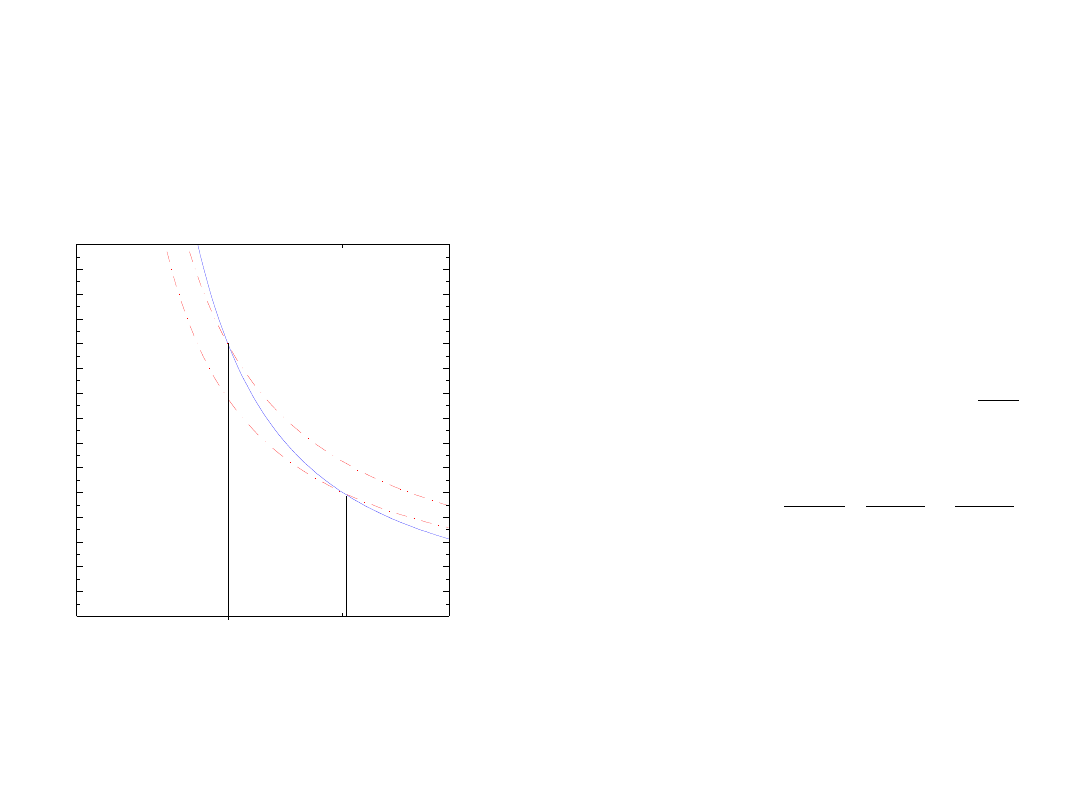
I zasada i równanie stanu gazu
przemiana adiabatyczna
0
T
2
V
1
i
z
o
t
e
r
m
a
T
1
C
iś
ni
en
ie
, p
O
b
j
ę
t
o
ś
ć
,
V
Q
=
0
a
d
i
a
b
a
t
a
p
=
1
/
V
κ
V
2
nRT
pV
=
równanie stanu gazu
∫
∫
=
=
2
1
2
1
V
V
V
V
V
dV
nRT
pdV
W
κ
praca wykonana przez gaz
0
=
Q
pobrane ciepło
W
U
−
=
∆
energia wewnętrzna
−
+
=
+
+
1
2
1
1
1
1
1
κ
κ
κ
V
V
nRT
W
κ
κ
2
2
1
1
V
p
V
p
=
równanie adiabaty
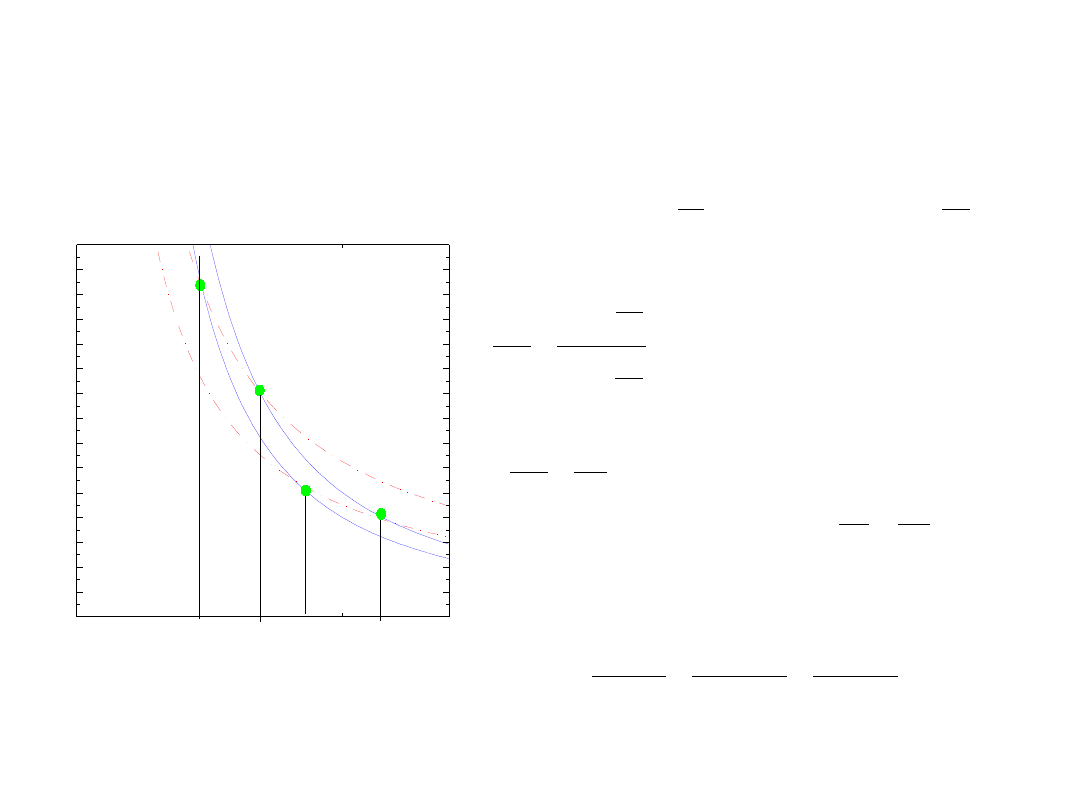
Cykl Carnota
0
V
d
V
c
d
c
b
T
2
V
a
i
z
o
t
e
r
m
a
T
1
C
iś
ni
en
ie
, p
O
b
j
ę
t
o
ś
ć
,
V
Q
=
0
a
d
i
a
b
a
t
a
p
=
1
/
V
κ
V
b
a
praca wykonana przez gaz
w przemianie izotermicznej
współczynnik sprawności
a
b
ab
ab
V
V
nRT
W
Q
ln
=
=
d
c
cd
cd
V
V
nRT
W
Q
ln
=
=
d
c
cd
a
b
ab
cd
ab
V
V
T
V
V
T
Q
Q
ln
ln
=
(
)
(
)
d
c
a
b
c
a
d
b
d
c
b
a
d
c
b
a
a
a
d
d
c
c
b
b
d
d
c
c
b
b
a
a
V
V
V
V
V
V
V
V
V
V
V
V
V
V
V
V
V
p
V
p
V
p
V
p
V
p
V
p
V
p
V
p
=
=
=
=
=
=
=
−
−
1
1
κ
κ
κ
κ
κ
κ
κ
κ
κ
κ
cd
ab
cd
ab
T
T
Q
Q
=
ab
cd
ab
ab
cd
ab
pobrane
T
T
T
Q
Q
Q
Q
W
−
=
−
=
≡
η

II zasada termodynamiki
(I sformułowanie)
do zamiany ciepła na pracę potrzebna
jest grzejnica i chłodnica
Sprawność zamiany jest nie większa niż:
dla procesów nieodwaracalnych jest
mniejsza
ab
cd
ab
ab
cd
ab
pobrane
T
T
T
Q
Q
Q
Q
W
−
=
−
=
≡
η
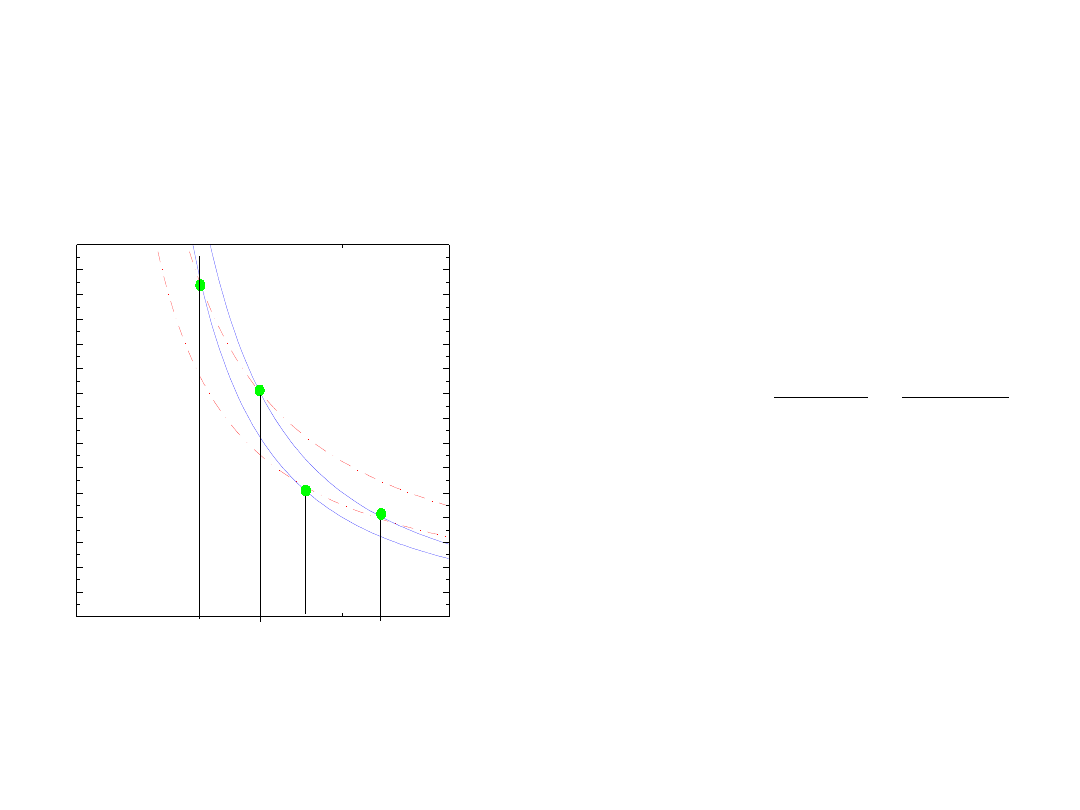
Współczynnik sprawności
proces nieodwracalny
0
V
d
V
c
d
c
b
T
2
V
a
i
z
o
t
e
r
m
a
T
1
C
iś
ni
en
ie
, p
O
b
j
ę
t
o
ś
ć
,
V
Q
=
0
a
d
i
a
b
a
t
a
p
=
1
/
V
κ
V
b
a
współczynnik sprawności
ab
cd
ab
pobrane
odwr
y
rzeczywist
T
T
T
Q
W
−
=
≡
≤
η
η
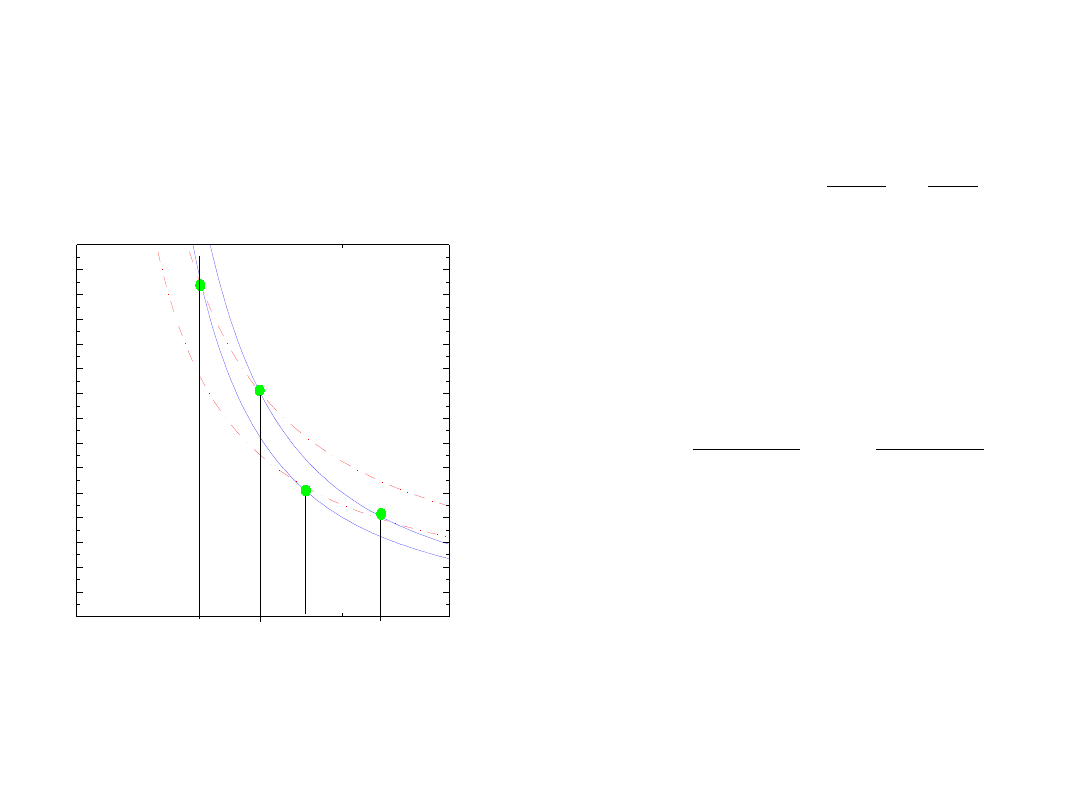
Cykl Carnota
0
V
d
V
c
d
c
b
T
2
V
a
i
z
o
t
e
r
m
a
T
1
C
iś
ni
en
ie
, p
O
b
j
ę
t
o
ś
ć
,
V
Q
=
0
a
d
i
a
b
a
t
a
p
=
1
/
V
κ
V
b
a
W odwracalnej
przemianie izotermicznej
w cyklu Carnota
cd
ab
cd
ab
T
T
Q
Q
=
cd
cd
ab
ab
T
Q
T
Q
=
ciekawa funkcja!!!
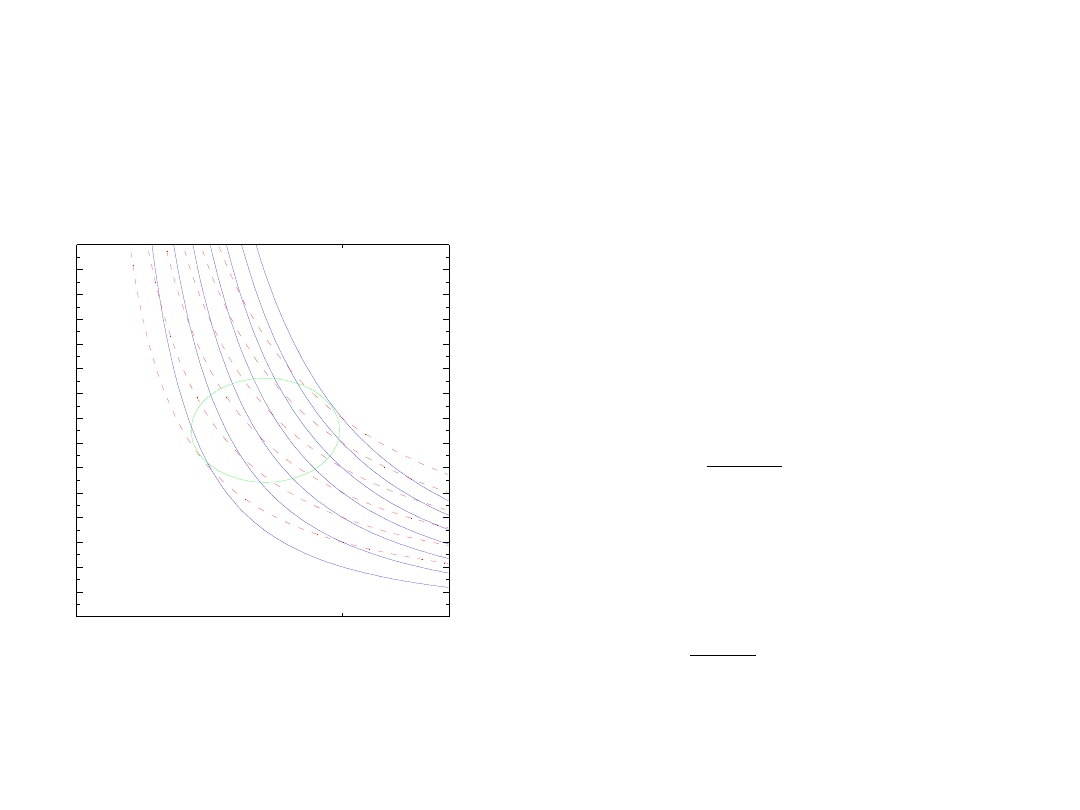
Cykl Carnota
i inne cykle odwracalne
0
C
iś
ni
en
ie
, p
O
b
j
ę
t
o
ś
ć
,
V
współczynnik sprawności
temperatura zmienia się w sposób ciągły
pobrane
Q
W
≡
η
• pojęcie cyklu
• każdy cykl odwracalny
może być traktowany jako
suma cyklów Crnota
dS
T
dQ
≡
entropia
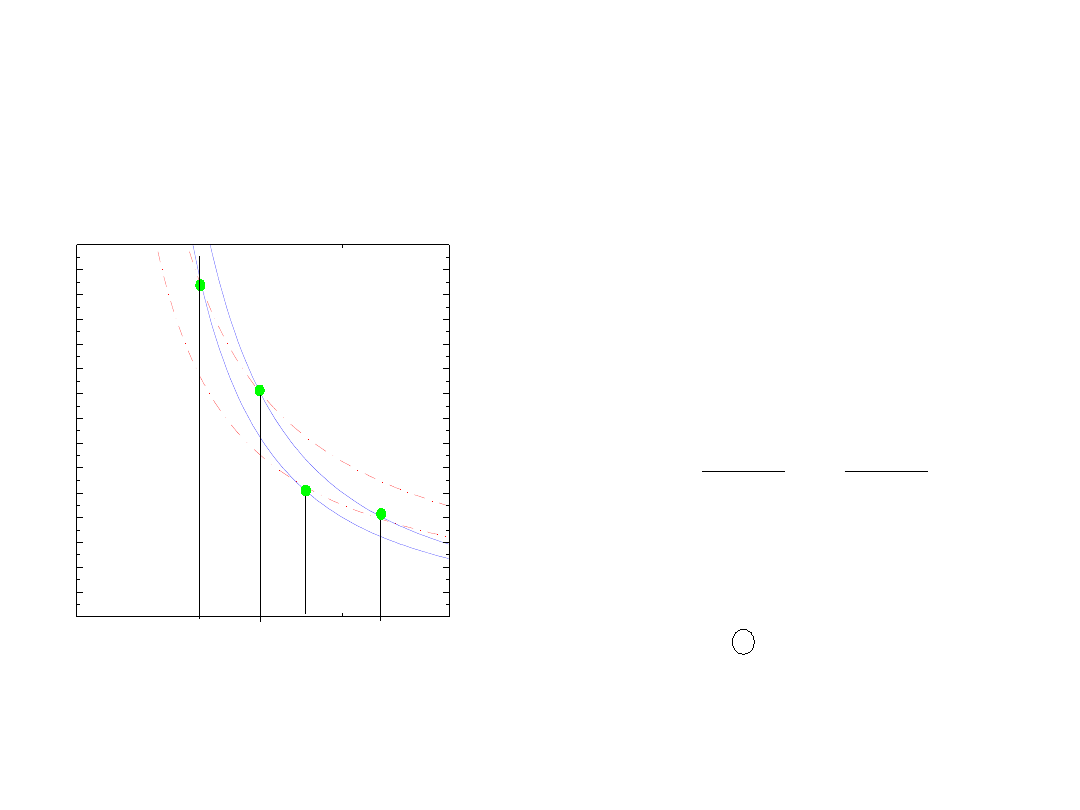
Entropia w cyklu Carnota
(cykl odwracalny)
0
V
d
V
c
d
c
b
T
2
V
a
i
z
o
t
e
r
m
a
T
1
C
iś
ni
en
ie
, p
O
b
j
ę
t
o
ś
ć
,
V
Q
=
0
a
d
i
a
b
a
t
a
p
=
1
/
V
κ
V
b
a
cd
cd
ab
ab
T
Q
T
Q
=
w przemianach adiabatycznych
0
0
=
∆
⇒
=
S
Q
w przemianach izotermicznych
0
=
∫
dS
funkcja stanu !!!
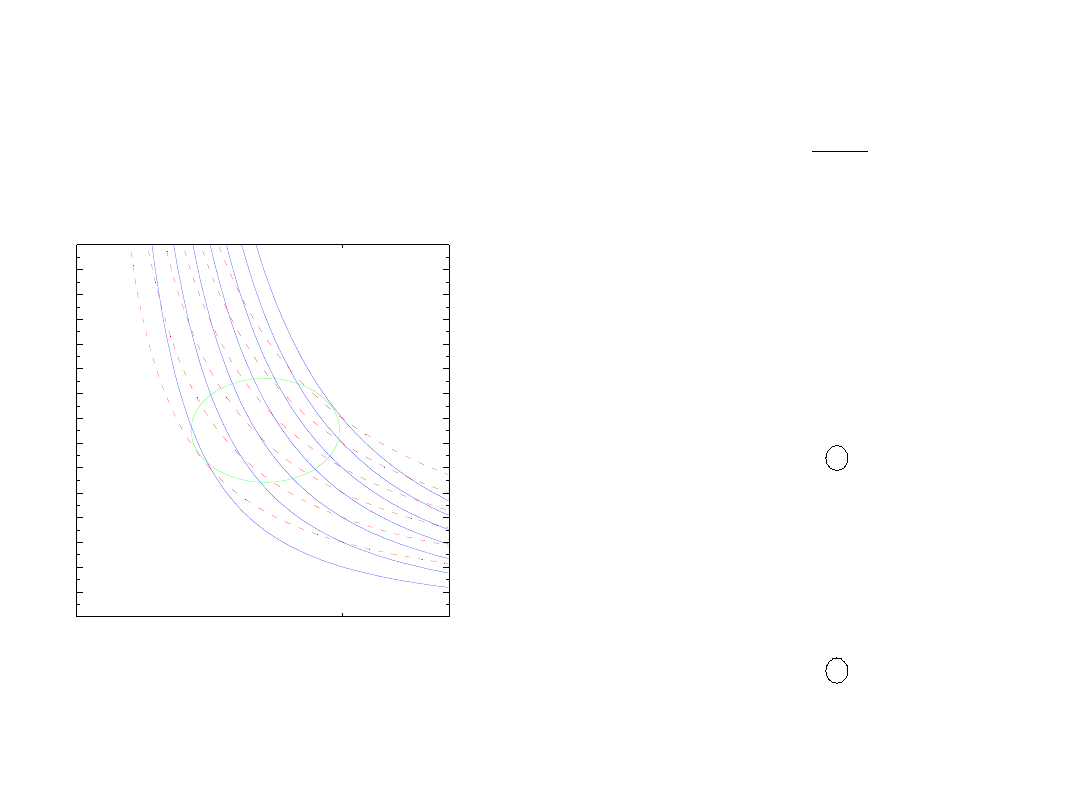
Prawo wzrostu entropii
śmierć cieplna
0
C
iś
ni
en
ie
, p
O
b
j
ę
t
o
ś
ć
,
V
• znak entropii (jak ciepło)
• w każdym cyklu odwracalnym
zmiana entropii =0
•
w cyklu nieodwracalnym
dS
T
dQ
=
entropia rośnie
0
=
∫
dS
0
≥
∫
dS
Entropia w przemianie
(np.. izotermicznej, odwracalnej)
0
b
V
a
i
z
o
t
e
r
m
a
C
iś
ni
en
ie
, p
O
b
j
ę
t
o
ś
ć
,
V
V
b
a
ab
ab
ab
T
Q
S
=
∆
0
.
=
∆
+
∆
otoczenia
ukł
S
S
a
b
ab
ab
V
V
nRT
W
Q
ln
=
=

Lepkość płynów:
*
opory związane z ruchem (tarcie)
*silnie zależy od szybkości
-
pomijalnie mała przy bardzo wolnych procesach
*lepkość potrzebuje:
- energii
- entropii

Entropia:
miara nieporządku
miara prawdopodobieństwa
P
k
S
B
ln
=
• procesy samorzutne dążą do układów bardziej prawdopodobnych
• rośnie nieporządek
•prawo wzrostu entropii

II zasada termodynamiki
do zamiany ciepła na pracę potrzebna jest grzejnika i chłodnica
Sprawność zamiany jest nie większa niż:
Ciepło nie może samorzutnie przejść od ciała chłodnego do ciepłego
Nie można w pełni odwrócić przemiany, w której występuje tarcie
Prawo wzrostu entropii
ab
cd
ab
ab
cd
ab
pobrane
T
T
T
Q
Q
Q
Q
W
−
=
−
=
≡
η

Funkcja stanu a potencjał termodynamiczny
Funkcja stanu: U,S
-
Zmiany funkcji zależą jedynie od stanu
początkowego i końcowego
P
otencjał termodynamiczny:
wielkość, która
osiąga minimum w równowadze termodynamicznej.
Energia wewnętrzna
Energia swobodna
Entalpia
( )
const
S
p
gdy
Vdp
TdS
dH
pV
U
H
const
T
V
gdy
pdV
SdT
dF
S
T
U
F
const
S
V
gdy
pdV
TdS
dU
W
Q
U
=
+
=
∆
+
∆
=
∆
=
−
−
=
∆
−
∆
=
∆
=
−
=
+
=
∆
,
,
,
Wyszukiwarka
Podobne podstrony:
Ściągi z fizyki-2003 r, Druga zasada dynamiki Newtona
03 Druga zasada dynamiki & Rown Nieznany (2)
I zasada dynamiki Newtona, 1
I ZASADA DYNAMIKI NEWTONA
I ZASADA DYNAMIKI NEWTONA, I rok, I rok, gieldy, Materiały od Anny, biofizyka
zasada Dynamiki newtona
druga zasada id 142854 Nieznany
fiz I zasada dynamiki Newtona
2 IMIR przyklady dynamikaid 203 Nieznany (2)
Pierwsza i druga zasada termodynamiki (entropia, zjawiska odwracalne)
a MOJA SCIAGA DO Wojciechowsiego sciaga-sformułowanie pierwszej zasady dynamiki Newtona, Egzamin
,fizyka 1, Zasady dynamiki Newtona
mechanika, sciaga mechana(2), 1 zasada dynamiki-jeśli na ciało nie działa żadna siła lub siły działa
fizyka, 3 zasady dynamiki Newtona, 3 zasady dynamiki Newtona
Zasady dynamiki Newtona
Zasady Dynamiki Newtona
więcej podobnych podstron