
USUWANIE JONÓW ŻELAZA I MANGANU
Z WODY
26.10.2012 r.
Grupa I
I. Cel ćwiczenia
Zapoznanie się z metodami usuwania jonów żelaza i manganu z wody oraz metodami
oznaczania zawartości tych jonów w wodzie.
II. Wykonanie ćwiczenia
1. Usuwanie żelaza i manganu z wody
a. Pobranie próbki wody surowej - Z butelki zawierającej ok. 5 dm
3
badanej wody
pobrano próbkę o objętości ok 0,5 dm
3
b. Uzdatnianie - Za pomocą papierka uniwersalnego sprawdzono pH wody
przeznaczonej do uzdatniania., używając wodorotlenku sodu doprowadzono pH do
wartości 8. Następnie przez zalkalizowaną wodę przepuszczono powietrze w celu
wytrącenia trudno rozpuszczalnego wodorotlenku żelaza (III).
Reakcja:
4Fe(OH)
2
+ 2H
2
O + O
2
= 4 Fe(OH)
3
↓
c. Kolumna filtracyjna została przygotowana wcześniej
d. Przez kolumnę filtracyjną przepuszczono wodę surową z szybkością - 9,68 m/h
Obliczenia:
masa pustej zlewki: 179,5 g
masa zlewki z wodą: 334,3 g
masa wody: 154,8 g
t= 1 min = 1/60 h
S= 0,00096 m
2
V =
m
d
=
154,8 g
1
g
cm
3
=
154,8cm
3
=
1,548⋅10
−
4
m
3
v =
V
S⋅t
=
1,548⋅10
−
4
m
3
0,00096 m
2
⋅
1
60
h
=
9,675
m
h
2. Oznaczanie stężenie żelaza w wodzie metodą spektrofotometryczną
z 2,2'-bipirydylem
Absorbancję zmierzono przy długości fali λ=510 nm, użyto kuwet o drodze optycznej
wynoszącej 5 cm.
Roztwór roboczy o stężeniu 0,01 mg Fe
2+
/cm
3
przygotowano przez rozcieńczenie
roztworu podstawowego o stężeniu 0,2 mg Fe
2+
/cm
3
.
1
a. Przygotowano skalę wzorców oraz krzywą wzorcową zgodnie z PN-73/C-04586/03
nr kolby
objętość roztworu
roboczego [cm
3
]
masa Fe
2+
[mg]
A
1
0,0
0,00
0,000
2
1,0
0,01
0,091
3
2,0
0,02
0,180
4
5,0
0,05
0,427
5
10,0
0,10
0,876
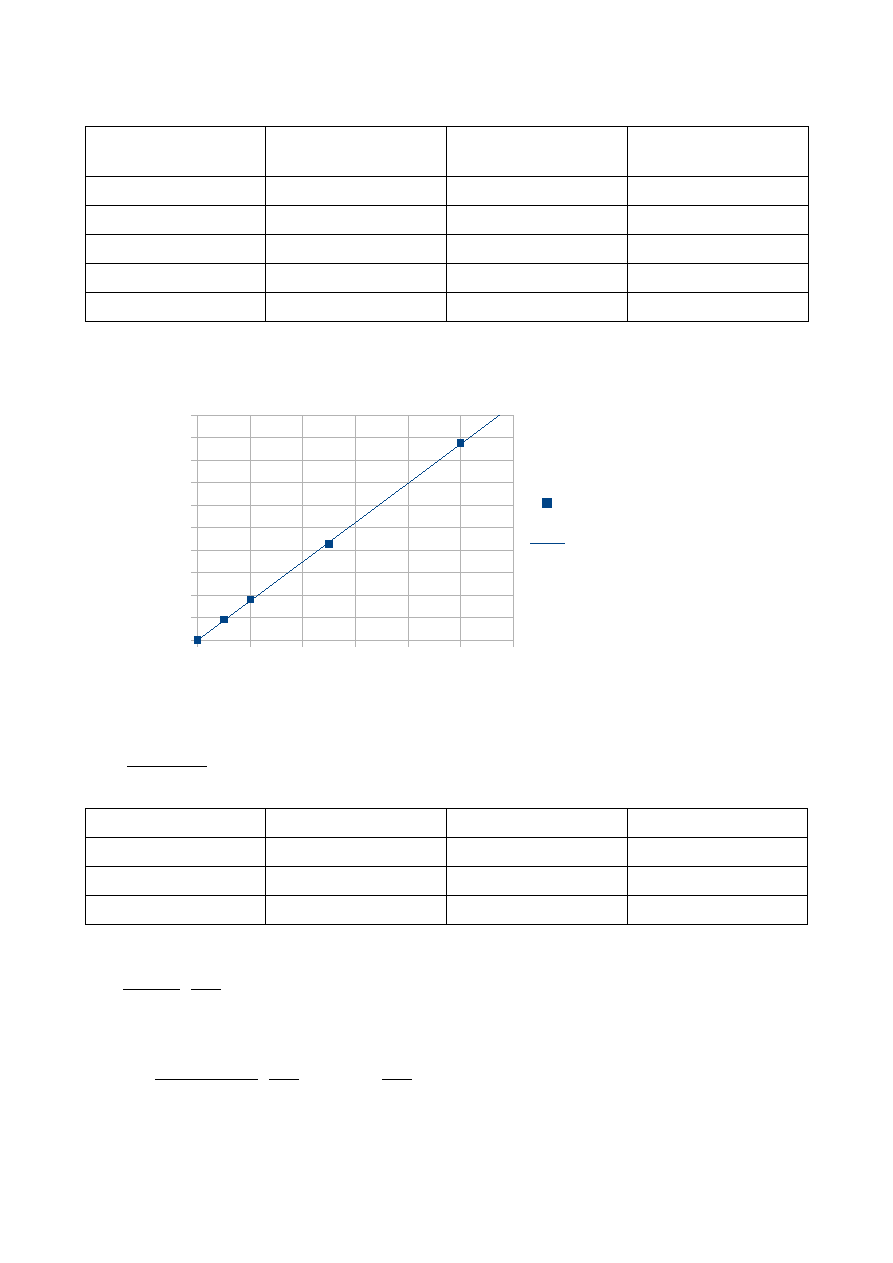
A = 8,7110 m + 0,0012
m=
A−0,0012
8,7110
[
mg ]
woda
A
m Fe
2+
[mg]
c [mg/dm
3
]
surowa
0,230
0,02627
1,3135
uzdatniona
0,001
-
-
teoretyczna
0,123
0,01398
0,6990
Obliczenie stężenia jonów żelaza (II) w wodzie
c=
m⋅1000
V
[
mg
dm
3
]
m - zawartość żelaza w badanej próbce odczytana z krzywej wzorcowej w mg
V - objętość badanej próbki wzięta do analizy w cm
3
c
surowa
=
0,02627⋅1000
20
[
mg
dm
3
]
=
1,3135
[
mg
dm
3
]
2
0
0,02
0,04
0,06
0,08
0,1
0,12
0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
0,9
1
f(x) = 8,7110x + 0,0012
R² = 0,9997
Zależność absorbancji od masy jonów żelaza (II)
Zależność absorbancji od
masy jonów żelaza
Liniowa (Zależność absorbancji
od masy jonów żelaza)
masa jonów żelaza (II) [mg]
A
b
s
o
rb
a
n
cj
a
[1
]
c
teoretyczna
=
0,01398⋅1000
20
[
mg
dm
3
]
=
0,6990
[
mg
dm
3
]
Uzdatnianie wody przeprowadzono bardzo dokładnie i z bardzo dobrym rezultatem. Według
krzywej wzorcowej masa żelaza zawarta w wodzie uzdatnionej wynosi mniej niż zero, co jest
fizycznie niemożliwe. Przyjęto zatem, że usunięto wszystkie jony żelaza z wody surowej. Norma
zawartości jonów żelaza w wodzie do picia wynosi 0,2 mg/dm
3
zatem ani w przypadku wody
surowej ani teoretycznej nie została ona przekroczona.
3. Oznaczanie stężenia manganu metodą spektrofotometryczną
(według PN-92/C-04590/02)
Absorbancję zmierzono przy długości fali λ=525 nm, użyto kuwet o drodze optycznej
wynoszącej 5 cm.
Roztwór roboczy o stężeniu 0,01 mg Mn
2+
/cm
3
przygotowano przez rozcieńczenie
roztworu podstawowego o stężeniu 0,1 mg Mn
2+
/cm
3
.
a. Przygotowanie skali wzorców i sporządzenie krzywej wzorcowej
nr kolby
objętość roztworu
roboczego [cm
3
]
masa Mn
2+
[mg]
A
1
0,0
0,00
0
2
0,5
0,005
0,012
3
1,0
0,010
0,023
4
2,5
0,025
0,058
5
5,0
0,050
0,117
6
10,0
0,100
0,248
7
25,0
0,250
0,625
8
50,0
0,500
1,131
3
0
0,1
0,2
0,3
0,4
0,5
0,6
0
0,2
0,4
0,6
0,8
1
1,2
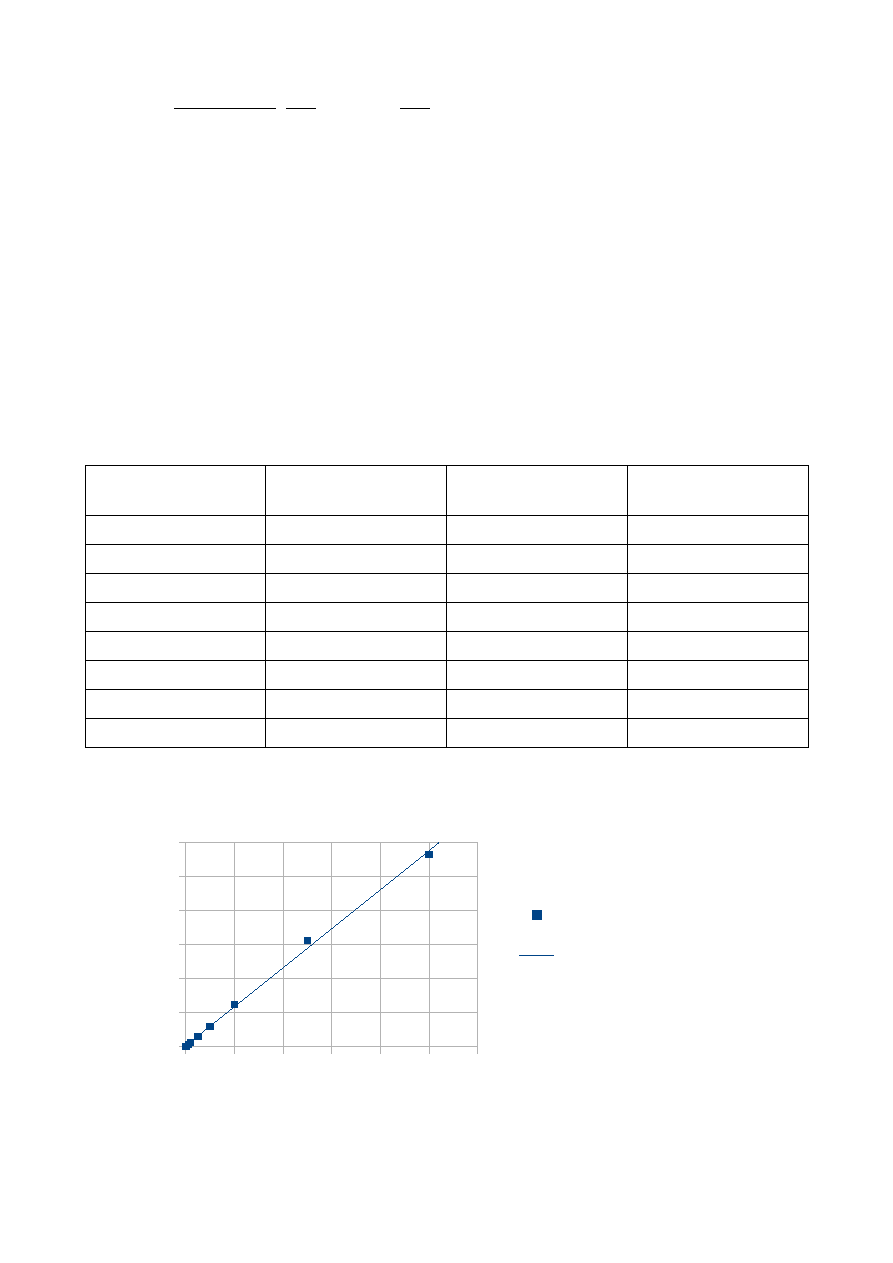
f(x) = 2,2944x + 0,0072
R² = 0,9975
Zależność absorbancji od masy jonów manganu (II)
Zależność absorbancji od
masy jonów manganu
Liniowa (Zależność absorbancji
od masy jonów manganu)
masa jonów manganu (II) [mg]
A
b
s
o
rb
a
n
cj
a
[1
]
A = 2,2944 m + 0,0072
m=
A−0,0072
2,2944
[
mg ]
woda
A
m Mg
2+
[mg]
c [mg/dm
3
]
surowa
0,097
0,03914
0,3914
uzdatniona
0,002
-
-
teoretyczna
0,321
0,1368
1,368
Obliczenie stężenia jonów manganu (II) w wodzie
c=
m⋅1000
V
[
mg
dm
3
]
m - zawartość manganu w badanej próbce odczytana z krzywej wzorcowej w mg
V - objętość badanej próbki wzięta do analizy w cm
3
= 100 cm
3
Uzdatnianie wody przeprowadzono bardzo dokładnie i z bardzo dobrym rezultatem. Według
krzywej wzorcowej masa manganu zawarta w wodzie uzdatnionej wynosi mniej niż zero, co jest
fizycznie niemożliwe. Przyjęto zatem, że usunięto wszystkie jony żelaza z wody surowej. Norma
zawartości jonów manganu w wodzie do picia wynosi 0,05 mg/dm
3
zatem woda surowa
i teoretyczna zostały przekroczone.
4
Wyszukiwarka
Podobne podstrony:
Żelazo i mangan
Spr - Zelazo i Mangan, IŚ Tokarzewski 27.06.2016, IV semestr ISiW, TUW, LAB
5 żelazo ogólne i mangan
zelazo chrom mangan, Nauka, CHEMIA, Szkoła, Chemia Nieorganiczna
zelazo chrom mangan, chemia
MANGAN I ŻELAZO-AZOTANY-POTENCJOMETRIA-HAŁAS-CHZT-SURFAKTANTY, ANALITYCZNE METODY INSTRUMENTALNE
krzem, mangan, zelazo
Hem i żelazo
Żelazo
wykres zelazo cementyt, Studia, nauka o materiałach
żelazo węgiel, techniki wytwarzania z materiałoznawstwem
sprawko 7 żelazo
manganometria mail Nieznany
Żelazo
Okres rzymski, Archeologia, Zelazo
1300 zaparcia nied tarcz,żelazo
więcej podobnych podstron