
ROZPORZ
ĄDZENIE KOMISJI (WE) NR 205/2006
z dnia 6 lutego 2006 r.
zmieniaj
ące załączniki I i II do rozporządzenia Rady (EWG) nr 2377/90 ustanawiającego
wspólnotow
ą procedurę określania maksymalnego limitu pozostałości weterynaryjnych
produktów leczniczych w
środkach spożywczych pochodzenia zwierzęcego w odniesieniu do
toltrazurilu,
eteru
monoetylowego
glikolu
dietylenowego
oraz
monooleinianu
polioksyetylenosorbitolu
(Tekst maj
ący znaczenie dla EOG)
KOMISJA WSPÓLNOT EUROPEJSKICH,
uwzgl
ędniając Traktat ustanawiający Wspólnotę Europejską,
uwzgl
ędniając rozporządzenie Rady (EWG) nr 2377/90 z dnia
26 czerwca 1990 r. ustanawiaj
ące wspólnotową procedurę
okre
ślania maksymalnego limitu pozostałości weterynaryjnych
produktów leczniczych w
środkach spożywczych pochodzenia
zwierz
ęcego (
1
), w szczególno
ści jego art. 2 i 3,
uwzgl
ędniając opinie Europejskiej Agencji Leków wydane przez
Komitet ds. Weterynaryjnych Produktów Leczniczych,
a tak
że mając na uwadze, co następuje:
(1)
Wszystkie substancje czynne farmakologicznie, które s
ą
stosowane we Wspólnocie w produktach leczniczych
przeznaczonych do podawania zwierz
ętom hodowanym
w celu produkcji
żywności, powinny być oceniane
zgodnie z rozporz
ądzeniem (EWG) nr 2377/90.
(2)
Toltrazuril jest uj
ęty w załączniku I do rozporządzenia
(EWG) nr 2377/90 w odniesieniu do mi
ęśni, skóry,
t
łuszczu, wątroby i nerek kurcząt i indyków
z wyj
ątkiem zwierząt, których jaja są przeznaczone do
spo
życia przez ludzi, oraz w odniesieniu do mięśni,
skóry, t
łuszczu, wątroby i nerek świń. Toltrazuril został
równie
ż ujęty w załączniku III do tego rozporządzenia
w odniesieniu do mi
ęśni, tłuszczu, wątroby i nerek bydła
z wyj
ątkiem zwierząt, których mleko przeznaczone jest
do spo
życia przez ludzi, do czasu zakończenia badań
naukowych. Poniewa
ż badania te zostały zakończone,
wpis dotycz
ący toltrazurilu w załączniku I do rozporzą-
dzenia (EWG) nr 2377/90 nale
ży rozszerzyć poprzez
uwzgl
ędnienie zwierząt z gatunku bydła. We wpisie
tym nale
ży również uwzględnić mięśnie, tłuszcz, wątrobę
i nerki wszystkich gatunków ssaków hodowanych w celu
produkcji
żywności z wyjątkiem zwierząt, których mleko
przeznaczone jest do spo
życia przez ludzi, oraz mięśnie,
skór
ę, tłuszcz, wątrobę i nerki drobiu, z wyjątkiem zwie-
rz
ąt, których jaja przeznaczone są do spożycia przez
ludzi.
(3)
Eter monoetylowy glikolu dietylenowego jest uj
ęty
w za
łączniku II do rozporządzenia (EWG) nr 2377/90
w odniesieniu do byd
ła i świń. Wpis dotyczący eteru
monoetylowego glikolu dietylenowego powinien zosta
ć
rozszerzony na wszystkie prze
żuwacze.
(4)
Polisorbat 80 jest uj
ęty w załączniku II do rozporzą-
dzenia (EWG) nr 2377/90 w odniesieniu do wszystkich
gatunków zwierz
ąt hodowanych w celu produkcji
żywności. Nazwę substancji w tym wpisie należy zastąpić
bardziej ogóln
ą nazwą monooleinian polioksyetylenosor-
bitolu, która obejmuje zarówno polisorbat 80 jak
i polisorbat 81 w odniesieniu do wszystkich gatunków
zwierz
ąt hodowanych w celu produkcji żywności.
(5)
Nale
ży zatem odpowiednio zmienić rozporządzenie
(EWG) nr 2377/90.
(6)
Uwzgl
ędniając przepisy niniejszego rozporządzenia,
nale
ży przewidzieć odpowiedni okres przed stosowaniem
niniejszego
rozporz
ądzenia w celu umożliwienia
pa
ństwom członkowskim dostosowania zezwoleń na
wprowadzenie do obrotu omawianych weterynaryjnych
produktów leczniczych wydanych zgodnie z dyrektyw
ą
2001/82/WE Parlamentu Europejskiego i Rady z dnia
6 listopada 2001 r. w sprawie wspólnotowego kodeksu
odnosz
ącego się do weterynaryjnych produktów leczni-
czych (
2
), które mo
że okazać się konieczne w świetle
niniejszego rozporz
ądzenia.
(7)
Środki przewidziane w niniejszym rozporządzeniu są
zgodne z opini
ą Stałego Komitetu ds. Weterynaryjnych
Produktów Leczniczych,
PL
7.2.2006
Dziennik Urz
ędowy Unii Europejskiej
L 34/21
(
1
) Dz.U. L 224 z 18.8.1990, str. 1. Rozporz
ądzenie ostatnio zmie-
nione rozporz
ądzeniem Komisji (WE) nr 6/2006 (Dz.U. L 3
z 6.1.2006, str. 3).
(
2
) Dz.U. L 311 z 28.11.2001, str. 1. Dyrektywa ostatnio zmieniona
dyrektyw
ą 2004/28/WE (Dz.U. L 136 z 30.4.2004, str. 58).

PRZYJMUJE NINIEJSZE ROZPORZ
ĄDZENIE:
Artykuł 1
Za
łączniki I i II do rozporządzenia (EWG) nr 2377/90 zmienia
si
ę zgodnie z Załącznikiem do niniejszego rozporządzenia.
Artykuł 2
Niniejsze rozporz
ądzenie wchodzi w życie trzeciego dnia po
jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporz
ądzenie stosuje się od dnia 8 kwietnia 2006 r.
Niniejsze rozporz
ądzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich
Pa
ństwach Członkowskich.
Sporz
ądzono w Brukseli, dnia 6 lutego 2006 r.
W imieniu Komisji
Günter VERHEUGEN
Wiceprzewodniczący
PL
L 34/22
Dziennik Urz
ędowy Unii Europejskiej
7.2.2006
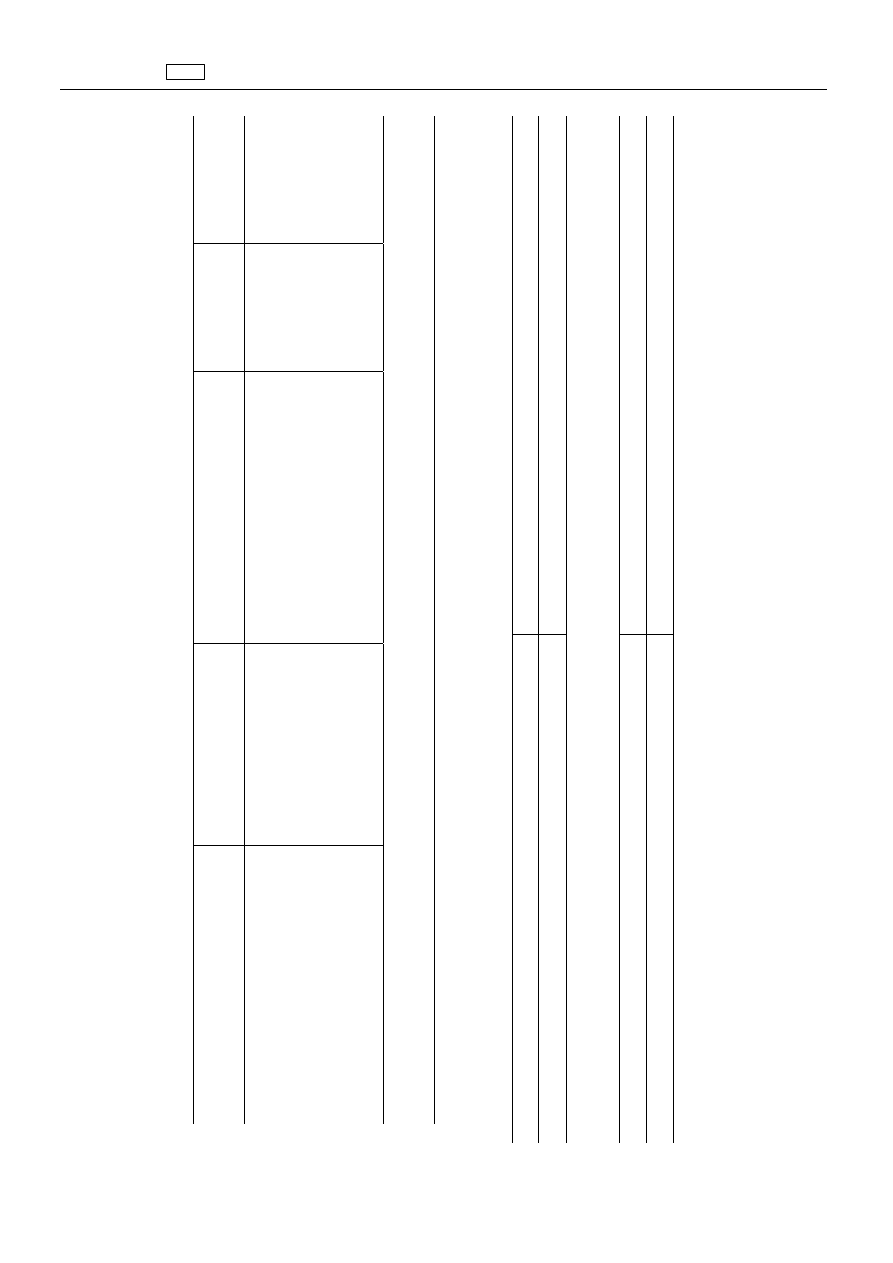
ZA
ŁĄ
CZNIK
A.
Nast
ępuj
ąca
substancja
zostaje
dodana
w
za
łą
czniku
I
do
rozporz
ądzenia
(EWG)
nr
2377/90:
2.
Środki
przeciwpaso
żytnicze
2.4.
Środki
dzia
łaj
ące
przeciw
pierwotniakom
2.4.1.
Pochodne
triazinetrionu
Substancja(-e
)
czynna(-e)
farmakologicznie
Pozosta
ło
ść
znacznikow
a
Gatunki
zwierz
ąt
Najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
Tkanki
docelowe
„Toltrazuril
Sulfon
toltrazurilu
Wszystkie
gatunki
ssaków
hodowanych
w
celu
produkcji
żywno
ści
(
1
)
100
μg/kg
Mi
ęś
nie
150
μg/kg
Tł
uszcz
(
2
)
500
μg/kg
W
ątroba
250
μg/kg
Nerki
Drób
(
3
)
100
μg/kg
Mi
ęś
nie
200
μg/kg
Skóra
+
tł
uszcz
600
μg/kg
W
ątroba
400
μg/kg
Nerki
(
1
)
Nie
stosowa
ć
u
zwierz
ąt,
których
mleko
jest
przeznaczone
do
spo
życia
przez
ludzi.
(
2
)
W
przypadku
świ
ń
najwy
ższy
dopuszczalny
poziom
pozosta
ło
ści
odnosi
si
ę
do
»skóry
i
tł
uszczu
w
naturalnych
proporcjach«.
(
3
)
Nie
stosowa
ć
u
zwierz
ąt,
których
jaja
są
przeznaczone
do
spo
życia
przez
ludzi.
”
B.
Nast
ępuj
ąca
substancja
zostaje
dodana
w
za
łą
czniku
II
do
rozporz
ądzenia
(EWG)
nr
2377/90:
2.
Zwi
ązki
organiczne
Substancja(-e)
czynna(-e)
farmakologiczn
ie
Gatunki
zwierz
ąt
„Eter
monoetylowy
glikolu
dietylenowego
Wszystkie
prze
żuwacze
i
świnie
”
3.
Substancje
ogólnie
uwa
żane
za
bezpieczne
Substancja(-e)
czynna(-e)
farmakologiczn
ie
Gatunki
zwierz
ąt
„Monooleinian
polioksyetylenosorbitolu
Wszystkie
gatunki
zwierz
ąt
hodowanych
w
celu
produkcji
żywno
ści
”
PL
7.2.2006
Dziennik Urz
ędowy Unii Europejskiej
L 34/23
Wyszukiwarka
Podobne podstrony:
zlote mysli katalog ebookow 2006 02 07 YXT2ABGTCVB5RSPIVIA5NHCXE4NFLNF7Y3KKCYI
2006 02 07 zajecia 1 2 06
2006 02 Terapia manualna w leczeniu zmian zwyrodnieniowych cz 1
test 09 02 07, studia, II semestr, Psychologia rozwojowa
ODL I sem termin2 14 02 07
2006 02 Czy udar mozgu mozna mierzycid 25445
GIge zal 06 02 07 Przekroj geo inz
02 07 azbestid 3506 Nieznany (2)
2006 02 Wyposażamy od A do Z
praca mgr 02.07, Studia, Prawo
MIS-KLI 23 26.02.07, SEMESTRY, Sem 8, Podstawy Zarzadzania
Projektowanie baz danych Wykłady Sem 5, pbd 2006.01.07 wykład03, Podstawy projektowania
TPL WYK 14 02 07 Czopki
Zał 1 pakiet 2, Przegrane 2012, Rok 2012, poczta 02.07 Drawno tablice drewniane
Podstawy zarządzania - wyk - 2006-02-18, Egzamin:
Podstawy zarządzania - wyk - 2006-02-18, Egzamin:
2006 02 06 Egzamin
więcej podobnych podstron