
KONKURS CHEMICZNY DLA GIMNAZJALISTÓW 2006/2007
zadania etapu rejonowego – 15 lutego 2007r
Zadanie I Zaznacz jedną odpowiedź:
1.Związkiem o budowie jonowej jest :
A) SO
2
B ) CO
2
C ) Na
2
O D ) Cl
2
O
2.Izotop promieniotwórczy fosforu ma okres połowicznego rozpadu 14 dni. Po 70 dniach
pozostanie tego pierwiastka około:
A) 1,5% B ) 3% C ) 6% D) 12%
3. Jaką substancję należy wprowadzić do wody, aby pH roztworu wzrosło:
A) chlorek sodu, B ) etanol C ) tlenek sodu D) tlenek siarki(IV)
4.Spośród wodorotlenków o wzorach Ca(OH)
2
, Mg(OH)
2
, NaOH, KOH najsłabszą zasadą jest:
A) KOH B ) NaOH C ) Mg(OH)
2
D) Ca(OH)
2
5. Tworzywem, z którego wytwarza się m.in. stoliki ogrodowe jest związek, którego fragment
przedstawiono poniżej
....
CH
2
-CHCl - CH
2
- CHCl - CH
2
- CHCl-
............
Związkiem, z którego wytwarza się ten polimer jest:
A) chloroeten, B) chlorometan, C) dichloroeten, D) dichloroetan.
6. W medycynie do usztywniania złamanych kończyn stosuje się opatrunki gipsowe. Dla chemika
jest to przykład zastosowania gipsu palonego - związku o wzorze (CaSO
4
)
2
.
H
2
O. Określ, czy
twardnienie zaprawy gipsowej następuje na skutek:
A) przyłączania wody,
B) odłączania wody,
C) przyłączania tlenku węgla(IV),
D) przyłączania tlenku węgla(IV) i wody.
7. Podczas jednej przemiany α i jednej przemiany β z jądra atomu uranu
235
92
U
powstaje:
A)
231
90
Th
B)
237
94
Pu C)
235
93
Np D)
231
91
Pa
8. Wykonano doświadczenie zilustrowane rysunkiem:
NaOH HCl NaOH HCl
I II III IV
HCl
aq
FeCl
3
aq
CuCl
2
aq
Na
2
CO
3
aq
W której probówce zaobserwowano zmiany:
A) we wszystkich, B) I i II C) II i III D) III i IV
9. Wodorotlenek żelaza(III) można otrzymać metodą opisaną równaniem:
A) FeCl
3
+3NaOH Æ Fe(OH)
3
+3NaCl
B) Fe
2
O
3
+ 3H
2
O Æ 2Fe(OH)
3
C) 2Fe
+ 6H
2
O Æ 2Fe(OH)
3
+ 3H
2
D) 2Fe
+ 3H
2
+ 3O
2
Æ 2Fe(OH)
3
1
1
1
1
1
1
1
1
1
kod

10. Anion S
2-
różni się od atomu siarki tym, że:
A) zawiera o 2 protony mniej niż atom,
B) zawiera o 2 elektrony więcej niż atom,
C) zawiera o 2 elektrony mniej niż atom,
D) zawiera o 2 protony więcej niż atom.
Zadanie II
Korzystając z tablicy rozpuszczalności wybierz z poniższych równań reakcji te, które można
przeprowadzić korzystając z wodnych roztworów soli i napisz dla nich równania jonowe.
A) FeSO
4
+BaCl
2
Æ FeCl
2
+ BaSO
4
B) CuS + Na
2
CO
3
Æ CuCO
3
+ Na
2
S
C) AgI + KCl Æ AgCl + KI
D) ZnSO
4
+ Pb(NO
3
)
2
Æ PbSO
4
+ Zn (NO
3
)
2
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
Zadanie III
Mieszaninę HCl i HNO
3
zobojętniono za pomocą NaOH, zużywając do tego celu 50cm
3
roztworu
wodorotlenku o gęstości 1,05g/ cm
3
i stężeniu 3,81%. Następnie do zobojętnionego roztworu
dodano nadmiar AgNO
3
. Powstały osad odsączono i zważono otrzymując masę 1,435g.
A) Napisz równania odpowiednich reakcji w formie cząsteczkowej.
B) Oblicz masę HCl oraz masę HNO
3
zawartych w analizowanej próbce.
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
8
1
3

Zadanie IV
Pan Roman jeździ samochodem o napędzie benzynowym spalając 7kg oktanu na 100 km.
Pan Jarosław jeździ samochodem o napędzie gazowym, który spala 6,4kg butanu na 100 km.
A) Oblicz, jaką objętość CO
2
( w warunkach normalnych) emituje do atmosfery każdy z tych
samochodów po przejechaniu 100 km.
B) Oceń, który z samochodów jest mniej szkodliwy dla środowiska. Dlaczego?
C) Odpowiedz, czy emisja CO
2
do atmosfery jest odpowiedzialna za efekt cieplarniany czy
dziurę ozonową.
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
Zadanie V
Spalono 40dm
3
SO
2
(warunki normalne) w tlenie w obecności katalizatora. Powstałą substancję
rozpuszczono w 500g wody.
A) Napisz cząsteczkowe równania omawianych reakcji.
B) Oblicz stężenie procentowe otrzymanego roztworu kwasu.
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
7
5
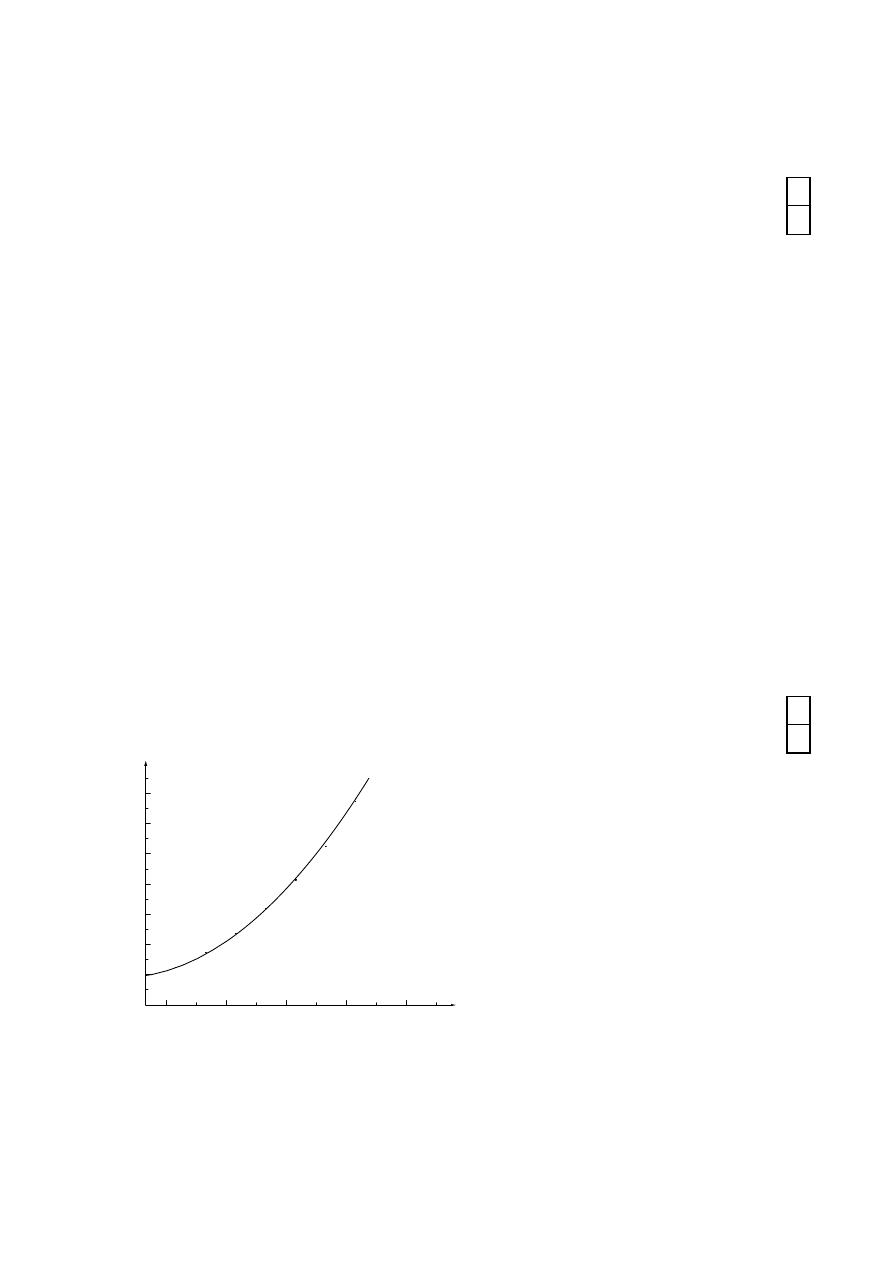
Zadanie VI
Stwierdzono doświadczalnie, że przepuszczenie 0,405g alkinu przez wodę bromową zawierającą
2,4 g bromu powoduje całkowite jej odbarwienie i uzyskanie związku nasyconego.
A) Wyznacz wzór sumaryczny alkinu.
B) Podaj wzór strukturalny i nazwę systematyczną najbliższego homologu tego związku.
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
Zadanie VII
Określ do jakiej temperatury należy ogrzać wodę, aby otrzymać roztwór nasycony, jeżeli
rozpuszczasz 10g KNO
3
w10g H
2
O. Odpowiedź uzasadnij.
280
300
320
340
360
0
20
40
60
80
100
120
140
ro
zpu
szcza
lno
ść
, g/1
00
g wody
temperatura, K
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
5
3
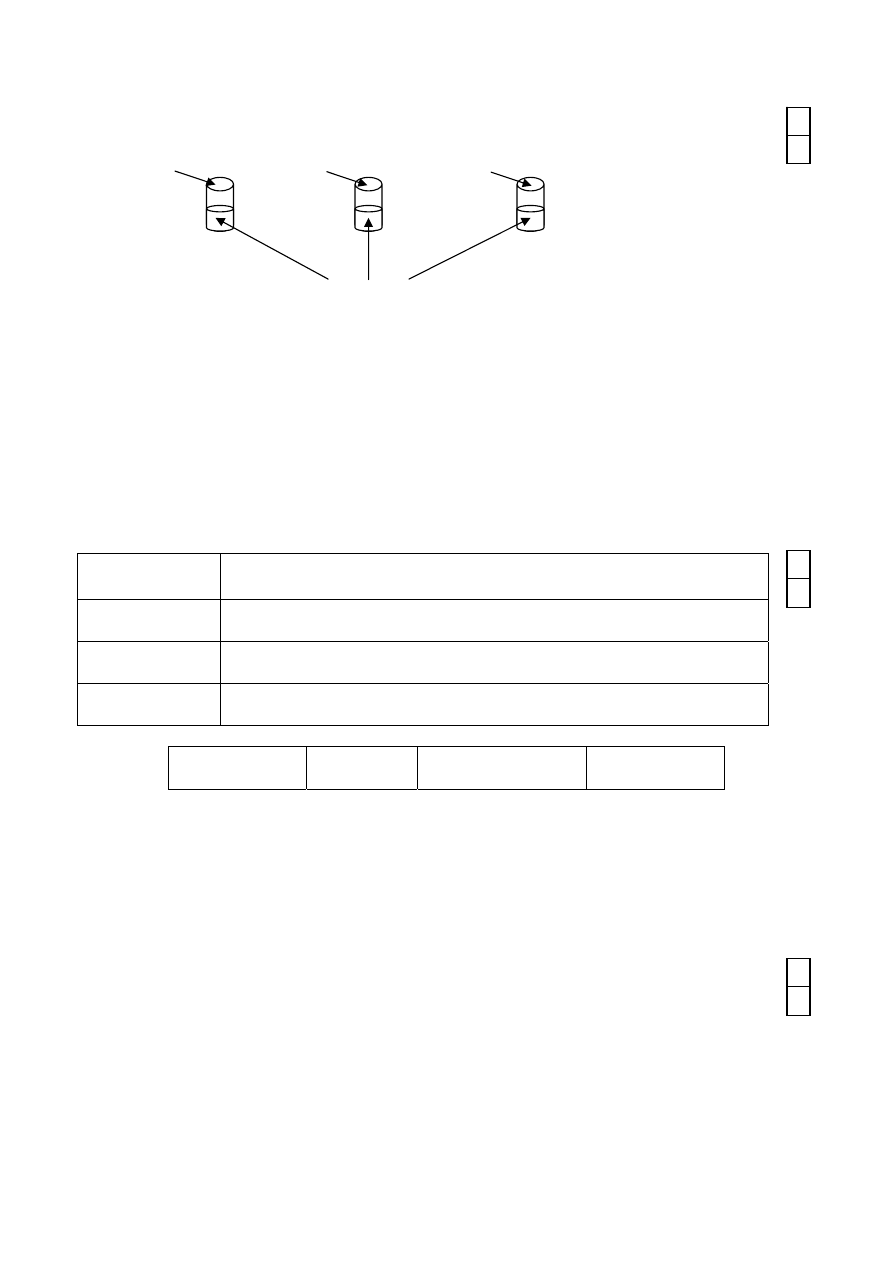
Zadanie VIII
Świeżo sporządzony Cu(OH)
2
umieszczono w trzech probówkach i przeprowadzono
doświadczenie zilustrowane rysunkiem:
glicerol etanol heksan
A B C
wodna zawiesina Cu(OH)
2
Napisz, co zaobserwowano w każdej probówce:
probówka A - …………………………………………………………………………………
…………………………………………………………………………………………………..
probówka B - …………………………………………………………………………………
…………………………………………………………………………………………………..
probówka C - …………………………………………………………………………………
…………………………………………………………………………………………………..
Zadanie IX
W dwóch kolumnach zestawiono informacje dotyczące kolejnych substancji. Przyporządkuj po
dwie informacje do podanych niżej wzorów.
A ) arszenik
1 - odmiana alotropowa pierwiastka odkryta pod koniec XX wieku
B ) kwarc
2 - składnik trucizny na szczury
C ) fulleren
3 - główny składnik glinki służącej do wytwarzania porcelany
D) kaolin
4 - jedna z form nosi nazwę kryształu górskiego
C
60
..........................
SiO
2
.....................
Al
2
O
3
.
SiO
2
.
2H
2
O
............................
As
2
O
3
........................
Zadanie X
Wymieszano w zlewce krystaliczny PbJ
2
z krystalicznym KJ. Zaprojektuj doświadczenie
pozwalające na rozdzielenie tej mieszaniny w celu uzyskania związków w postaci krystalicznej
w oddzielnych naczyniach.
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
…………………………………………………………………………………………………..
3
3
3
Wyszukiwarka
Podobne podstrony:
2006-07-lodz-IIetap
1 zaburzenia krążenia 1 2006 07 III
Egzamin zawodowy 2006 07
Materiał wyłożony zima 2006 07, materiały
2006 07 podkarpackie IIIetapid Nieznany (2)
Kwaśniewski J , 2006 07 26 dr kwasniewski pl, Jak długo O zaleceniach dietetycznych
2006 07 Kompukser
zadania egzaminacyjne zaoczne 2006 07 (PTM), elektro, 1, Podstawy Techniki Mikroprocesorowej
LM 2006 07
Wykłady MSG 2006-07, Ekonomia UWr WPAIE 2010-2013, Semestr IV, Miedzynarodowe stosunki gosp, MSG
Blazek wyklady z ub roku (2006-07), Społeczno-poznawcze podejście do osobowości, Koncepcja zadań życ
2006, 2006-07-10
Blazek wyklady z ub roku (2006-07), J.Kuhl- mechanizmy kontroli działania, Dr Magdalena Błażek
2006-07-04 Czetwertynscy v rzad USA, materiały, Z PRASY
Wstęp do prawoznawstwa 2006-07
więcej podobnych podstron