135
BERYLOWCE - grupa 2. (II A)
Metale ziem alkalicznych
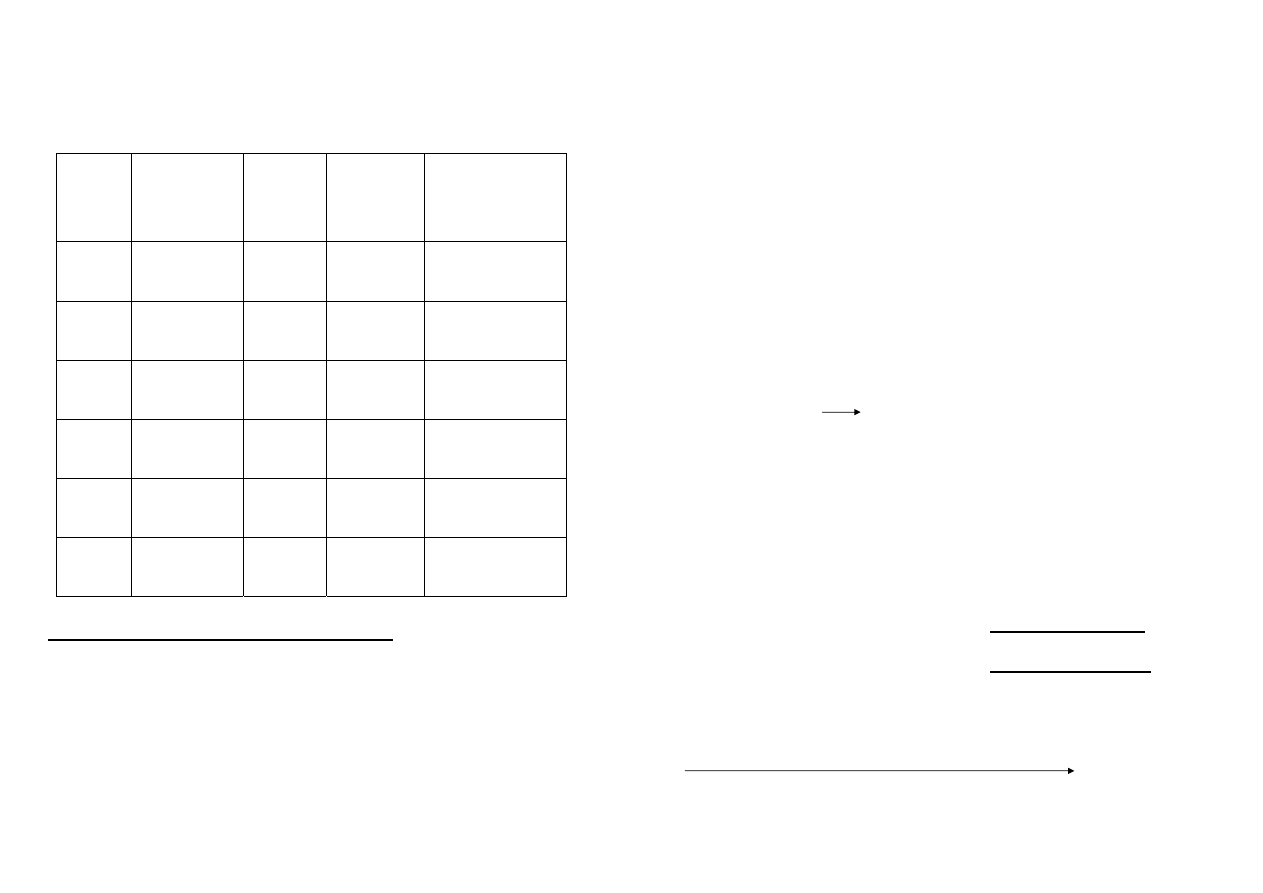
Symbol Nazwa
Walenc.
Konfig.
Elektr.
Elektro-
ujemność
(Alfreda-
Rochowa)
Potencjał
standardowy
M
2+
/M [V]
Be
beryl
2s
2
1,47
-1,85
Mg
magnez 3s
2
1,23
-2,37
Ca
wapń
4s
2
1,04
-2,87
Sr
stront
5s
2
0,99
-2,90
Ba
bar
6s
2
0,97
-2,91
Ra
rad
7s
2
0,97
-2,8
Charakterystyczne cechy wspólne:
- metale o barwie srebrzystej
- gęstość i twardość większa niż litowców
- występują tylko na +2 stopniu utlenienia
- silnie ujemne potencjały standardowe (metale
nieszlachetne)
136
- jony M
2+
w roztworach wodnych są bezbarwne
- związki cięższych berylowców są lotne w wysokich
temperaturach i barwią płomień gazu:
Ca
2+
–
c
c
e
e
g
g
l
l
a
a
s
s
t
t
o
o
c
c
z
z
e
e
r
r
w
w
o
o
n
n
y
y
, Sr
2+
–
k
k
a
a
r
r
m
m
i
i
n
n
o
o
w
w
y
y
,
Ba
2+
–
z
z
i
i
e
e
l
l
o
o
n
n
y
y
,
- tworzą tlenki MO
- ponadto Ca, Sr i Ba tworzą nadtlenki MO
2
- tlenki MO (z wyjątkiem BeO) tworzą silne zasady
MO + H
2
O = M(OH)
2
silnie egzotermiczna
reakcja
M(OH)
2
M
2+
+ 2OH
-
- reakcje berylowców z wodą:
Be – nie reaguje z H
2
O
pozostałe: M + 2H
2
O = M
2+
+ 2OH
-
+ H
2
(Mg reaguje z H
2
O „na gorąco”, pozostałe bez ogrzewania)
wodny roztwór Ca(OH)
2
= woda wapienna
zawiesina wodna Ca(OH)
2
= mleko wapienne
Be(OH)
2
Mg(OH)
2
Ca(OH)
2
Sr(OH)
2
Ba(OH)
2
najsłabsza zasada
najmocniejsza
wzrost mocy zasady
i wzrost rozpuszczalności wodorotlenków

137
Be
wykazuje nieco odrębne cechy chemiczne
z powodu małych rozmiarów atomu przy stosunkowo
dużej elektroujemności
Be tworzy wiązania o charakterze kowalencyjnym
Pozostałe metale (o większych rozmiarach i mniejszej
elektroujemności) występują głównie
w związkach jonowych).
podobieństwo diagonalne!
Właściwości chemiczne Be zbliżone są do Al:
Wodorotlenek berylu jest amfoteryczny !
Be
3+
⇔ Be(OH)
2
⇔ Be(OH)
3
-
⇔ [Be(OH)
4
]
2
-
tetrahydroksoberylan
⇐ wzrost stężenia H
+
⇒ wzrost stężenia OH
-
Występowanie w przyrodzie i otrzymywanie
Rozpowszechnienie: Be 6 · 10
-4
%
Mg 2,3 %
Ca 4,2 %
Sr, Ba, ~ 10
-2
%
Ra 0,14 g/100 kg blendy smolistej
138
Minerały:
Be Beryl 3BeO · Al
2
O
3
· 6SiO
2
(glinokrzemian)
Mg Dolomit CaCO
3
· MgCO
3
Magnezyt MgCO
3
Azbest 3MgO
·
SiO
2
·
2H
2
O
Ca Gips CaSO
4
·
2H
2
O
Anhydryt CaSO
4
Kalcyt, Aragonit CaCO
3
(2 odmiany krystaliczne)
Kalcyt w skałach:
wapienie, marmur
kreda (poch. zwierz.)
CaCO
3
Fosforyt Ca
3
(PO
4
)
2
Apatyty Ca
3
(PO
4
)
2
· Ca(Cl,F)
2
Fluoryt CaF
2
Otrzymywanie
w stanie metalicznym utrudnione –
najczęściej elektroliza stopionych soli
Be: elektroliza BeCl
2
+ NaCl
(stopiona mieszanina)

139
Mg: a) elektroliza MgCl
2
+ NaCl
b) MgO + C = Mg + CO ( 2300 K)
Ca, Sr: elektroliza stopionych chlorków
Ba: 3BaO + 2 Al = Al
2
O
3
+ 3Ba
metoda aluminotermiczna
Zastosowanie
Beryl:
1) przy konstrukcji pojazdów kosmicznych (mała gęstość
i duża wytrzymałość)
2) folia berylowa jako okienka w lampach rentgenowskich
(słabo pochłania prom. X)
3) do produkcji moderatorów w reaktorach atomowych
(silnie pochłania neutrony)
Magnez: najlżejszy metal użytkowy ( d = 1,7 g/cm
3
)
Składnik lekkich stopów (stop elektron 90 % Mg)
140
Związki berylowców z wodorem: wodorki MH
2
BeH
2
, MgH
2
→ charakter kowalencyjny
CaH
2
, SrH
2
, BaH
2
→ charakter jonowy
(zawierają jon wodorkowy H
-
)
CaH
2
+ 2H
2
O = Ca(OH)
2
+ 2H
2
Sole berylowców:
Be: sole o charakterze kowalencyjnym
Mg, Ca, Sr, Ba, - charakter jonowy
Sole z Cl
-
, Br
-
, I
-
, NO
3
-
dobrze rozpuszczalne w H
2
O
inne sole słabo rozpuszczalne
Siarczan
MgSO
4
CaSO
4
SrSO
4
BaSO
4
Rozpuszcz.
temp. 20
0
C
g MSO
4
/l dm
3
roztworu
35,6
0,202
0,014
0,00022
Rozpuszczalność siarczanów berylowców maleje ze
wzrostem masy atomowej pierwiastka
BaSO
4
stosowany jako materiał kontrastowy w badaniach
rtg. żołądka i jelit
(duża masa atomowa Ba --silnie absorbuje prom. X)
141
Węglany i wodorowęglany:
Ca
2+
+ CO
3
2-
= CaCO
3
(osad)
Wszystkie węglany berylowców są trudno rozpuszczalne
w H
2
O
W obecności CO
2
przechodzą do roztworu jako
rozpuszczalne wodorowęglany
CaCO
3
+ CO
2
+ H
2
O
⇔
Ca
2+
+ 2HCO
3
-
Reakcja odwracalna - zachodzi ustawicznie w
przyrodzie: wody wapienne zawierające CO
2
rozpuszczają skały wapienne Ca(HCO
3
)
2
powstają narastające warstwy CaCO
3
stalaktyty (nacieki zwisające)
stalagmity (nacieki rosnące)
Twardość wody:
- spowodowana jest obecnością soli Ca
2+
i Mg
2+
:
wodorowęglanów (HCO
3
-
), siarczanów (SO
4
2-
) i
chlorków (Cl
-
) wapnia i magnezu
142
Twardość przemijająca:
- pochodzi od Ca(HCO
3
)
2
Można ją usunąć przez gotowanie wody → CaCO
3
gotowanie
Ca(HCO
3
)
2
CaCO
3
+ CO
2
+ H
2
O
kamień kotłowy
Twardość trwała:
- pochodzi głównie od CaSO
4
usuwa się dodając Na
2
CO
3
(sól rozpuszczalna)
CO
3
2-
+ Ca
2+
= CaCO
3
(osad – wytrącanie jonów Ca
2+
)
Inne metody usuwania twardości wody:
1) dodatek polifosforanu Na
5
P
3
O
10
–
(w proszkach do prania)
[P
3
O
10
]
5-
+ Ca
2+
= Ca[P
3
O
10
]
3-
2)
wymiana jonowa
(na jonitach – syntetycznych żywicach organicznych
2 [~ SO
3
-
H
+
] + Ca
2+
= [(~ SO
3
-
)
2
Ca
2+
] + 2H
+
143
Zaprawa murarska:
a) otrzymywanie wapna palonego
Węglan wapnia ulega rozkładowi termicznemu (piece wapienne)
1100 - 1200 K
CaCO
3
CaO + CO
2
wapno palone
b) gaszenie wapna:
CaO + H
2
O = Ca(OH)
2
wapno gaszone
c) twardnienie zaprawy murarskiej: Ca(OH)
2
i SiO
2
Ca(OH)
2
+ CO
2
= CaCO
3
+ H
2
O
CaCO
3
+ SiO
2
= CaSiO
3
+ CO
2
-----------------------------------------------------------------------------------------------------------------------------------------------
Cement:
np. cement portlandzki: CaO 58 – 66 %
SiO
2
18 – 26 %
MgO, Al
2
O
3
, Fe
2
O
3
Otrzymuje się prażąc wapień (CaCO
3
) z gliną w temp. 1400 K
Tężenie cementu - reakcja z wodą:
3CaO · SiO
2
+ nH
2
O = 3CaO · SiO
2
· nH
2
O
--------------------------------------------------------------------------------------------------------------------------------------------------
300 K
Gips: CaSO
4
· 2H
2
O CaSO
4
· ½H
2
O
Tężenie gipsu:
CaSO
4
· ½H
2
O + 3/2 H
2
O = CaSO
4
· 2H
2
O
Wyszukiwarka
Podobne podstrony:
litowce, berylowce oraz glin zadania
berylowce
Zastosowanie berylowców, Chemia
Wykład 8 Berylowce CHC13005w, VII BERYLOWCE
Berylowce, chemia
ISE powtorka z chemii, ISE charakterystyka litowców i berylowców, Charakterystyka litowców i berylow
Berylowce(1), Chemia, Chemia nieorganiczna
Litowce i berylowce
Węgliki i węglany berylowców, charakterystyka poszczególnych grup układu okresowego
reakcje+litowce+i+berylowce1
Berylowce
4 berylowce
Berylowce, WAT chemia zaocznie, chemia nieorganiczna wyklady
18-berylowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
berylowce id 82860 Nieznany (2)
BERYLOWCE
Berylowce 2
więcej podobnych podstron