
1
BUDOWA I WŁASNOŚCI CZĄSTECZKOWE GAZÓW
ATOMY I CZĄSTECZKI
• Jednostka masy
1 u (unit) =
12
1
masy izotopu
kg
C
27
12
6
10
66
.
1
−
⋅
=
• Masa atomowa lub cząsteczkowa
µ = (masa atomu lub molekuły) / 1u, wielkość bezwymiarowa
• Gramoatom lub gramocząsteczka (inaczej mol): µ wyrażone w gramach
• Stała Avogadro = liczba atomów lub cząsteczek w 1 molu substancji
1
23
1
27
1
10
023
.
6
10
66
.
1
12
012
.
0
12
12
−
−
−
−
⋅
=
⋅
⋅
=
=
mol
mol
kg
kg
mol
u
g
N
A
• Masa 1 mola substancji wyrażona w kg
u
N
m
A
⋅
⋅
=
µ
µ
• Koncentracja molekuł
n = liczba molekuł w jednostce objętości
µ
ρ
=
m
N
n
A
w jednostkach cm
-3
, m
-3
ρ = gęstość masowa substancji w jednostkach
3
cm
g
,
3
m
kg
• Siły międzyatomowe w cząsteczkach oraz międzycząsteczkowe są siłami
elektromagnetycznymi. Atomy, cząsteczki oddziaływują poprzez trwałe lub
indukowane elektryczne momenty dipolowe. Są to tzw. siły van der Waalsa

2
(siły odpychające przy małych odległościach między atomami, cząsteczkami
oraz przyciągające na odległościach dużych).
CIŚNIENIE GAZU NA ŚCIANKI NACZYNIA
(MODEL GAZU DOSKONAŁEGO)
• Gaz idealny jest modelowym przybliżeniem gazu doskonałego. W gazie
idealnym atomy (molekuły) zachowują się jak ciała doznające nieustannie
zderzeń sprężystych ze sobą i ściankami naczynia. W jednorodnym gazie
wszystkie molekuły posiadają tę sama masę m.
• Ciśnienie p jest równe liczbowo sile działającej na jednostkę powierzchni
naczynia, ciała.
Jednostki ciśnienia:
1 Pa (pascal) = 1N/m
2
(1 N = 1 niuton)
1 atm (atmosfera techniczna) = 1 Atm = 10
5
Pa = 1000 hPa (zależność
przybliżona)
U (r)
0
r
SIŁY ODPYCHAJĄCE
SIŁY PRZYCIĄGAJĄCE
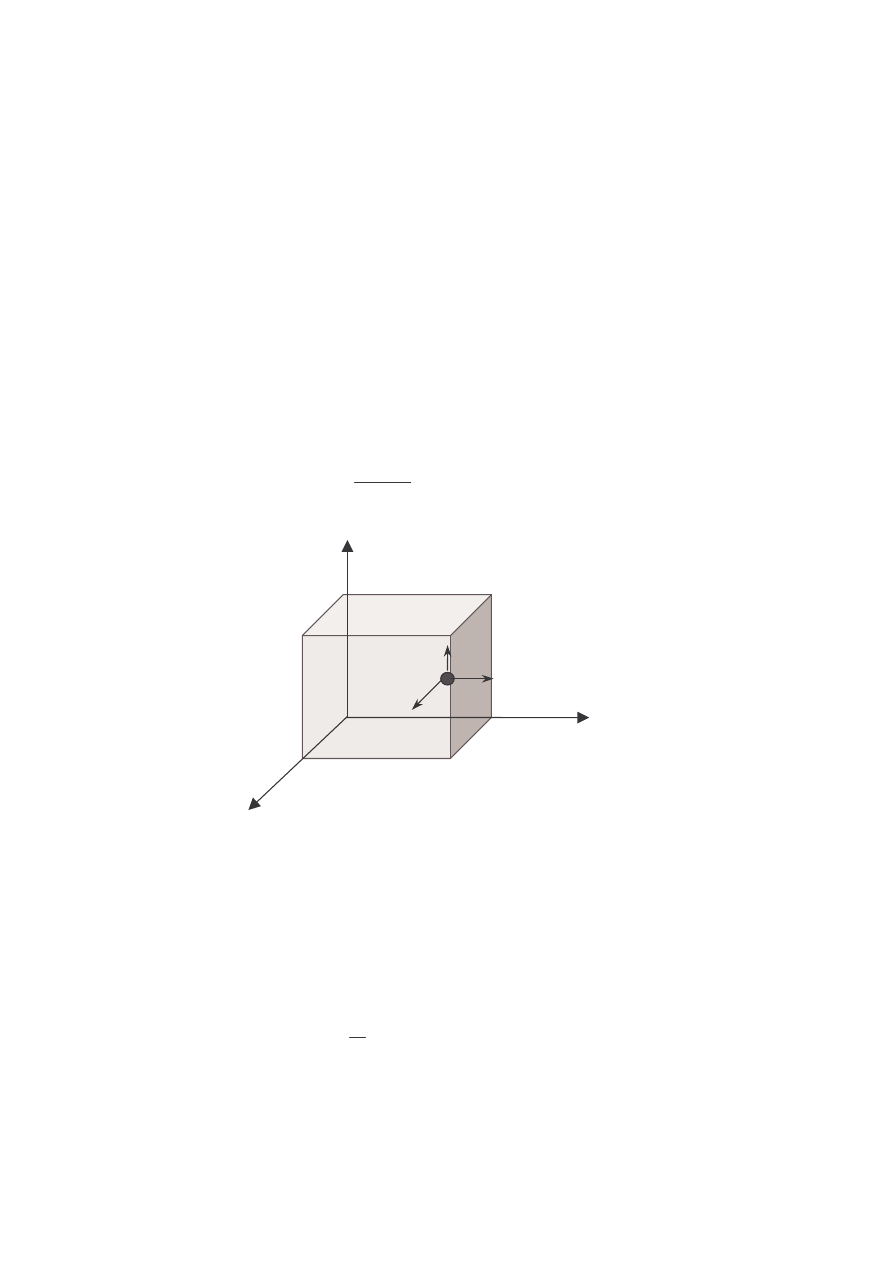
3
1 Atm (atmosfera normalna) = ciśnienie hydrostatyczne słupa rtęci o
wysokości h = 760 mm = 0.76 m
gh
p
ρ
=
ρ = 13.6 g/cm
3
= 13 600 kg/m
3
gęstość rtęci
g = 9.81 m/s
2
przyspieszenie ziemskie
• Podczas zderzenia ze ścianką naczynia i – ta molekuła posiadająca pęd (mv
i
)
oddziałuje na ściankę siłą doznając zmiany pędu w czasie ∆t
t
)
mv
(
F
i
i
∆
∆
=
• Ciśnienie p wywierane przez gaz na ścianki naczynia, zawierający liczbę N
molekuł, jest równe sumie ciśnień cząstkowych p
i
wywieranych przez
pojedyncze molekuły. Koncentracja molekuł wynosi
V
N
n
=
0
x
y
z
v
x
v
y
v
z
N

4
• Można udowodnić, że
N
v
N
v
v
nm
3
1
N
3
v
N
nm
S
F
p
p
i
i
2
2
2
i
i
i
i
N
1
i
i
∑
>=
<
>
<
=
∑
=
∆
∑
=
∑
=
=
N
i
liczba molekuł o prędkościach v
i
<v
2
>
średnia kwadratu prędkości
>
<
2
v
średnia prędkość kwadratowa ruchu postępowego molekuł
• Ciśnienie można wyrazić poprzez średnią energię kinetyczną pojedynczej
molekuły gazu
>
<
>=
<
⋅
=
>
<
>=
<
=
ε
n
mv
n
v
m
n
v
nm
p
3
2
2
1
3
2
2
3
2
3
1
2
2
2
>
<
ε
średnia energia kinetyczna ruchu postępowego
pojedynczej molekuły
RÓWNANIE STANU GAZU DOSKONAŁEGO
• Dla 1 mola gazu
pV = RT
p – ciśnienie gazu na ścianki naczynia
V – objętość gazu (naczynia)
T – temperatura gazu (w K)
R – uniwersalna stała gazowa R = 8.31 J · K
-1
mol
-1

5
• Dla masy M gazu (liczby molekuł N)
kT
2
3
k
N
R
N
3
2
RT
N
N
N
3
2
nV
3
2
pV
RT
N
N
RT
M
pV
A
A
A
>=
ε
<
=
>
ε
<
=
>
ε
<
>=
ε
<
=
=
µ
=
Stała Boltzmanna
A
N
R
k
=
ZASADA EKWIPARTYCJI ENERGII
(ZASADA RÓWNEGO PODZIAŁU ENERGII POMIĘDZY STOPNIE
SWOBODY MOLEKUŁ)
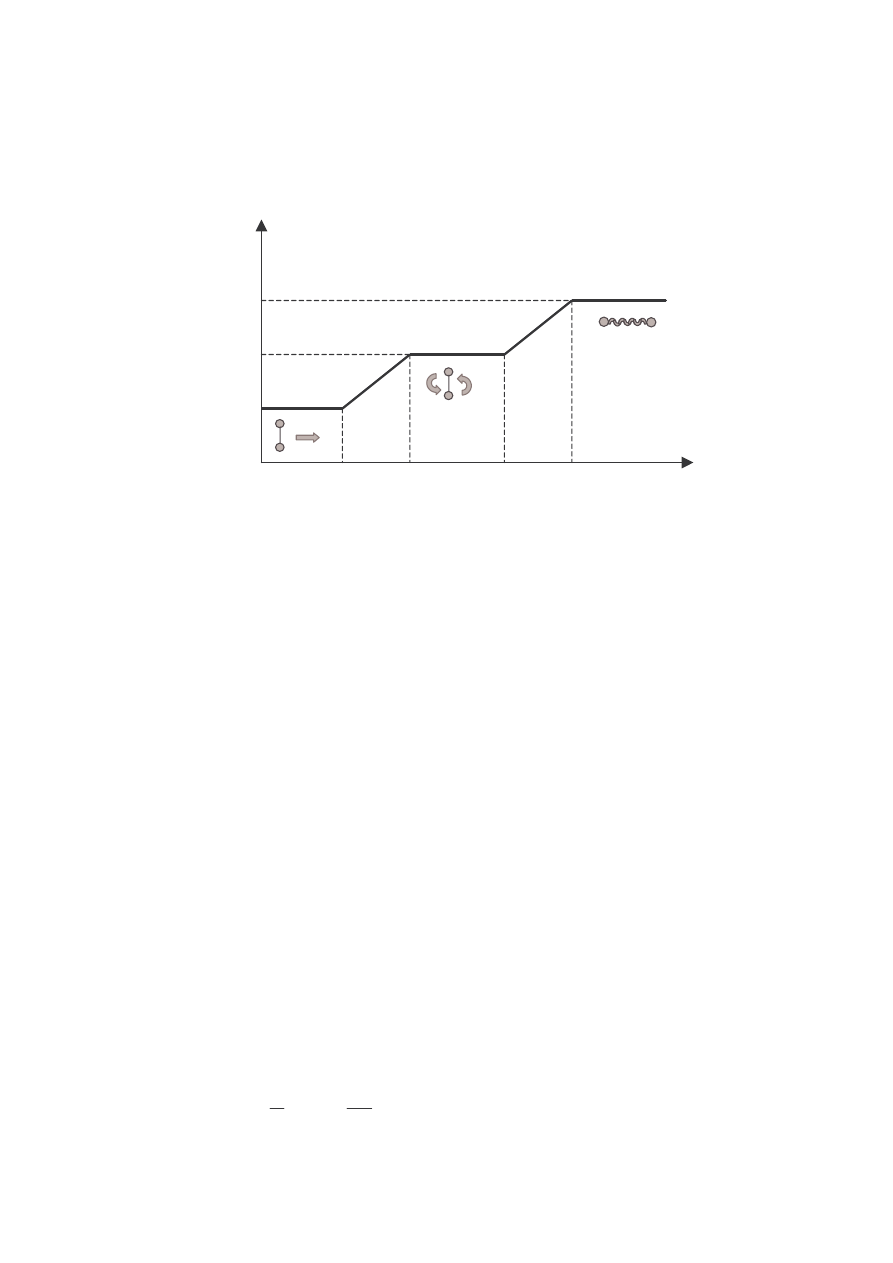
• Stopnie swobody – sposoby magazynowania energii przez molekułę
• Gaz 1 – atomowy (cząsteczka 1-atomowa).
x
y
z
PUNKT MATERIALNY
(GAZ 1- ATOMOWY)

6
Cząsteczka gazu przedstawia sobą punkt materialny, który wykonuje ruch
postępowy w trzech kierunkach przestrzeni: x, y, z i posiada w tych kierunkach
trzy składowe prędkości. Ze składowymi tymi związane są odpowiednio 3
wartości energii kinetycznej ruchu postępowego. Cząsteczka taka posiada 3
stopnie swobody ruchu postępowego (i = 3).
• Gaz 2 – atomowy. Cząsteczka prezentuje sobą układ dwóch punktów
materialnych (bryła sztywna), które oprócz ruchu postępowego mogą
wykonywać ruch obrotowy wokół dwóch, wzajemnie prostopadłych, osi
obrotu. Z ruchem tym związane są 2 wartości energii ruchu obrotowego, 2
stopnie swobody ruchu obrotowego.
Gaz 2 – atomowy posiada
i = 3 + 2 = 5
stopni swobody
• Gaz 3- lub więcej atomowy (układ 3 lub więcej punktów materialnych)
Molekuła gazu (bryła sztywna) posiada 3 stopnie swobody ruchu
postępowego oraz 3 stopnie swobody ruchu obrotowego, związane z
możliwością ruchu obrotowego wokół trzech osi obrotu.
2 MOśLIWE OSIE OBROTU
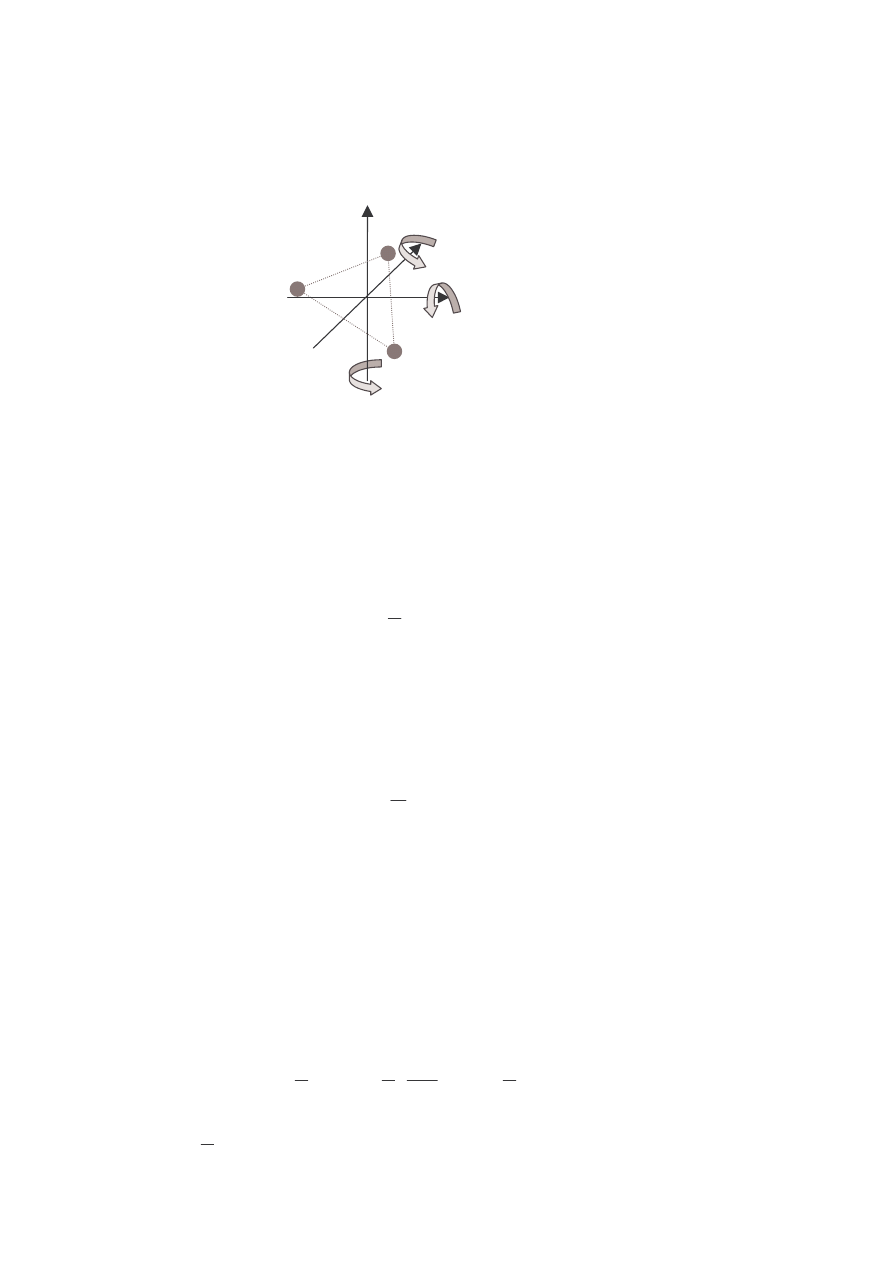
7
Gaz 3- lub więcej atomowy posiada
i = 3 + 3 = 6
stopni swobody
• Zasada ekwipartycji brzmi: na każdy, pojedynczy stopień swobody molekuły
przypada jednakowa wartość energii, wynosząca
kT
2
1
1
>=
ε
<
• Całkowita energia kinetyczna ruchu postępowego (ruchu cieplnego)
pojedynczej molekuły wynosi
kT
2
i
>=
ε
<
i – liczba stopni swobody
ENERGIA WEWNĘTRZNA GAZU DOSKONAŁEGO
(ENERGIA RUCHÓW CIEPLNYCH WSZYSTKICH MOLEKUŁ GAZU)
• Energia wewnętrzna 1 mola gazu
RT
i
U
RT
i
T
N
N
R
i
kTN
i
N
U
A
A
A
A
2
2
2
2
=
=
⋅
=
>=
<
=
ε
3 MOśLIWE OSIE OBROTU

8
• Energia wewnętrzna dowolnej masy gazu
RT
m
2
i
U
µ
=
m – masa wszystkich molekuł
µ – masa 1 mola gazu (gramocząsteczka, gramoatom)
PRZEMIANY GAZU DOSKONAŁEGO
???????????????????????????????????????
CIEPŁO WŁAŚCIWE MOLOWE GAZÓW
(CIEPŁO POTRZEBNE DO OGRZANIA 1 MOLA GAZU)
• Ciepło właściwe molowe w stałej objętości
R
2
i
dT
dU
C
V
=
=
• Ciepło właściwe przy stałym ciśnieniu
R
2
2
i
R
C
C
V
p
+
=
+
=
• C
p
i C
V
gazu doskonałego nie zależą od temperatury
CIEPŁO WŁAŚCIWE GAZÓW WIELOATOMOWYCH
• W miarę wzrostu temperatury gazu molekuły wykonują coraz bardziej
złożone ruchy cieplne. Oznacza to zwiększanie się liczby stopni swobody
9
i w związku z tym, wzrost wartości ciepła właściwego gazu przy stałym
ciśnieniu i w stałej objętości.
Doświadczenie: zależność C
V
od temperatury dla wodoru cząsteczkowego H
2
(najprostsze molekuły gazu)
• Widmo energii molekuł dla ruchu postępowego jest widmem ciągłym, dla
ruchu rotacyjnego i drgającego – widmem dyskretnym. Oznacza to, że
energia tych dwóch ostatnich ruchów podlega kwantowaniu (inaczej –
molekuły posiadają kwantowe stopnie swobody. W miarę wzrostu
temperatury wodoru rośnie liczba stopni swobody molekuł.
KWANTOWANIE ENERGII ROTACJI MOLEKUŁ
• Energia rotacji molekuly
)
I
J
(
I
2
J
I
2
1
E
2
2
R
ω
=
=
ω
=
3/2 R
5/2 R
7/2 R
H
2
GAZ
10
∼50
∼200
∼2000
5000
30
20
10
C
v
[J/(mol
.
K)]
T
[K]
DOŚWIADCZALNA ZALEśNOŚĆ C
v
OD TEMPERATURY DLA H
2
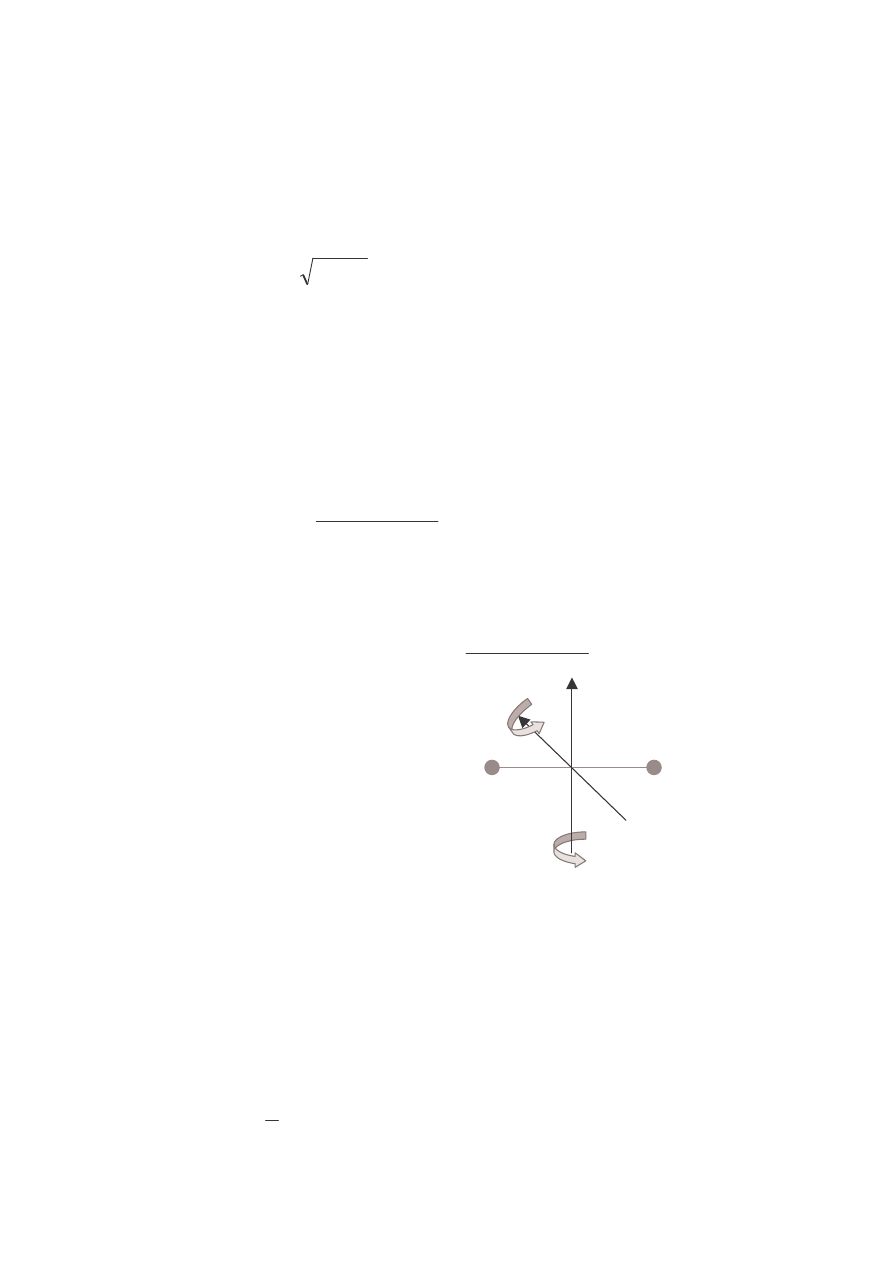
10
I – moment bezwładności molekuły ; J- moment pędu (kręt)
ω – prędkość kątowa rotacji
• Kwantowa wartość momentu pędu J
n
,...,
2
,
1
,
0
l
2
/
h
)
1
l
(
l
J
=
π
+
=
h – stała Plancka
l – liczba kwantowa rotacji
• Kwantowe wartości energii rotacji wynoszą
I
2
)
2
/
h
)(
1
l
(
l
E
2
R
π
+
=
• Odległość poziomów energetycznych (zmiana energii rotacji)
I
)
2
/
h
)(
1
l
(
)
l
(
E
)
1
l
(
E
E
2
R
π
+
=
−
+
=
∆
Układ rotacyjnych
poziomów energetycznych molekuły
TERMICZNE WZBUDZENIA STANÓW ROTACYJNYCH MOLEKUŁ
• Molekuła 2 – atomowa posiada i =2 stopnie swobody ruchu rotacyjnego
(oraz 3 stopnie swobody ruchu postępowego). Energia rotacji molekuły
wynosi
kT
kT
2
i
E
R
=
=
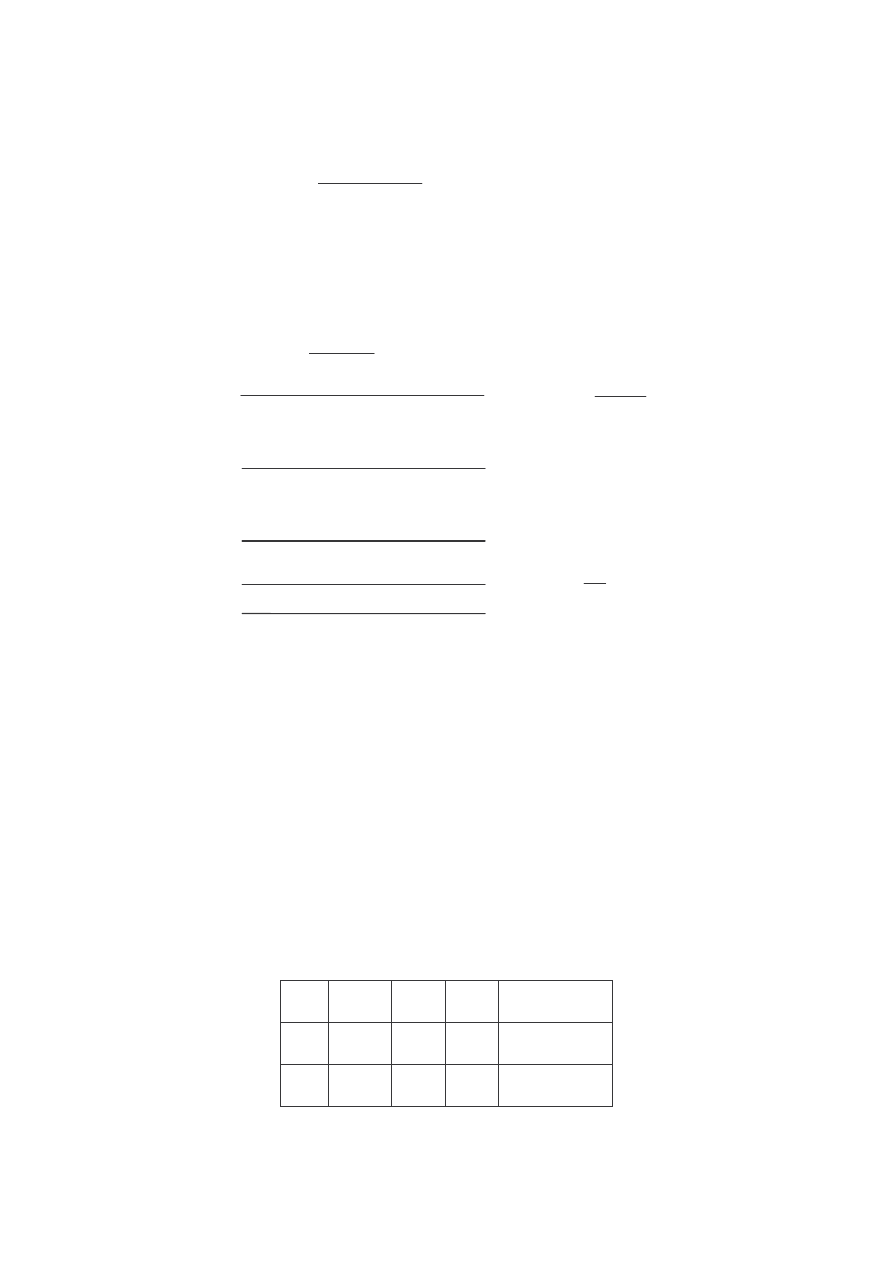
11
• Zmiana energii rotacji
I
)
2
/
h
)(
1
l
(
T
k
E
2
R
π
+
=
∆
=
∆
Przejście między stanami energetycznymi o l = 0 i l = 1 wymaga zmiany energii
cieplnej, tj. Zmiany temperatury gazu o
kI
)
2
/
h
(
T
2
π
=
∆
Wymagana zmiana temperatury zależy od różnicy wartości liczb kwantowych
oraz momentu bezwładności molekuły. Dla molekuł o różnych momentach
bezwładności kolejne zmiany stanu energetycznego wymagają dostarczenia
różnej ilości ciepła, tj. Różnej zmiany temperatury gazu.
H
2
HCl
O
2
I
4.72
26.8
194
[10
-45
kg*m
2
]
∆T
170
30
4
[K]
4
3
2
1
0
I
E
2
10 h
=
I
E
2
h
=
E
N
E
R
G
I
A
ROTACYJNE POZIOMY ENERGETYCZNE MOLEKUŁY

12
KWANTOWANIE ENERGII DRGAŃ (ENERGII OSCYLACJI)
• Kwantowa wartość energii drgań oscylatora harmonicznego prostego wynosi
ν
+
=
h
)
2
1
n
(
E
osc
n = 0, 1, 2, ... – liczba kwantowa drgań
h – stała Plancka
ν – częstość drgań
• Różnica energii kolejnych stanów oscylacyjnych
ν
=
+
ν
−
+
+
ν
=
∆
h
)
2
1
n
(
h
)
1
2
1
n
(
h
E
osc
Poziomy oscylacyjne są jednakowo odległe o wartość hν (Inaczej: różnica
energii kolejnych stanów ruchu drgającego oscylatora harmonicznego wynosi
zawsze hν).
Widmo stanów oscylacyjnych molekuły
n
3
2
1
0
E
7/2
.
h
ν
1/2
.
h
ν
13
TERMICZNE WZBUDZENIE STANÓW OSCYLACYJNYCH MOLEKUŁ
• Molekuła 2-atomowa posiada i = 3 stopnie swobody
K
1000
k
3
h
2
T
T
k
2
3
h
E
osc
≈
ν
=
∆
∆
=
ν
=
∆
RUCHY CIEPLNE MOLEKUŁ GAZU
• Molekuły gazu wykonują chaotyczne (nieuporządkowane) ruchy cieplne
doznając nieustannych zderzeń
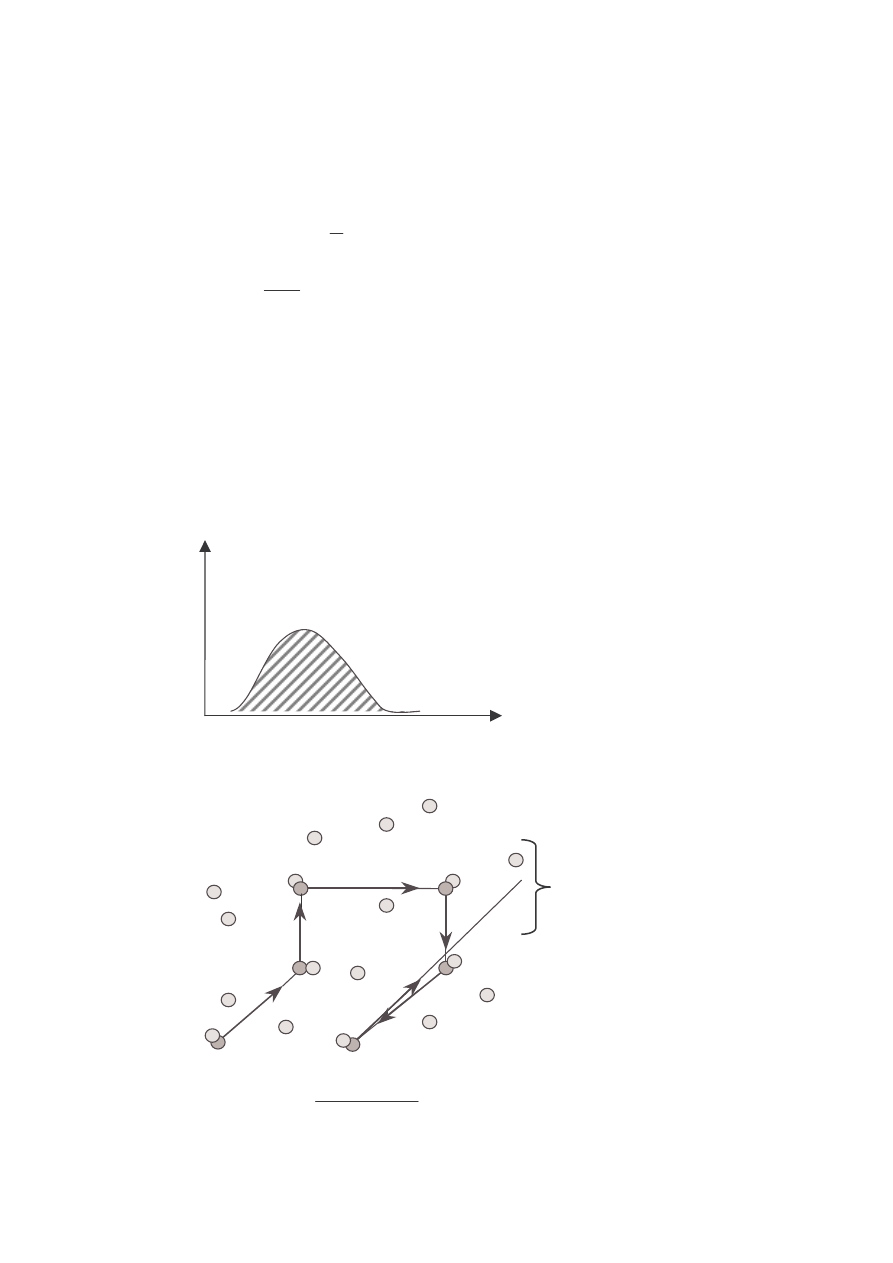
ŚREDNIA DROGA SWOBODNA MOLEKUŁ
• Średnia droga swobodna molekuły jest równa średniej odległości między
zderzeniami
k
...
l
l
l
l
3
2
1
+
+
+
>=
<
k – liczba zderzeń w pewnym przedziale czasu
n
i
v
i
l
1
l
2
l
3
KOLEJNE ZDERZENIA
WYBRANEJ MOLEKUŁY
GAZU
14
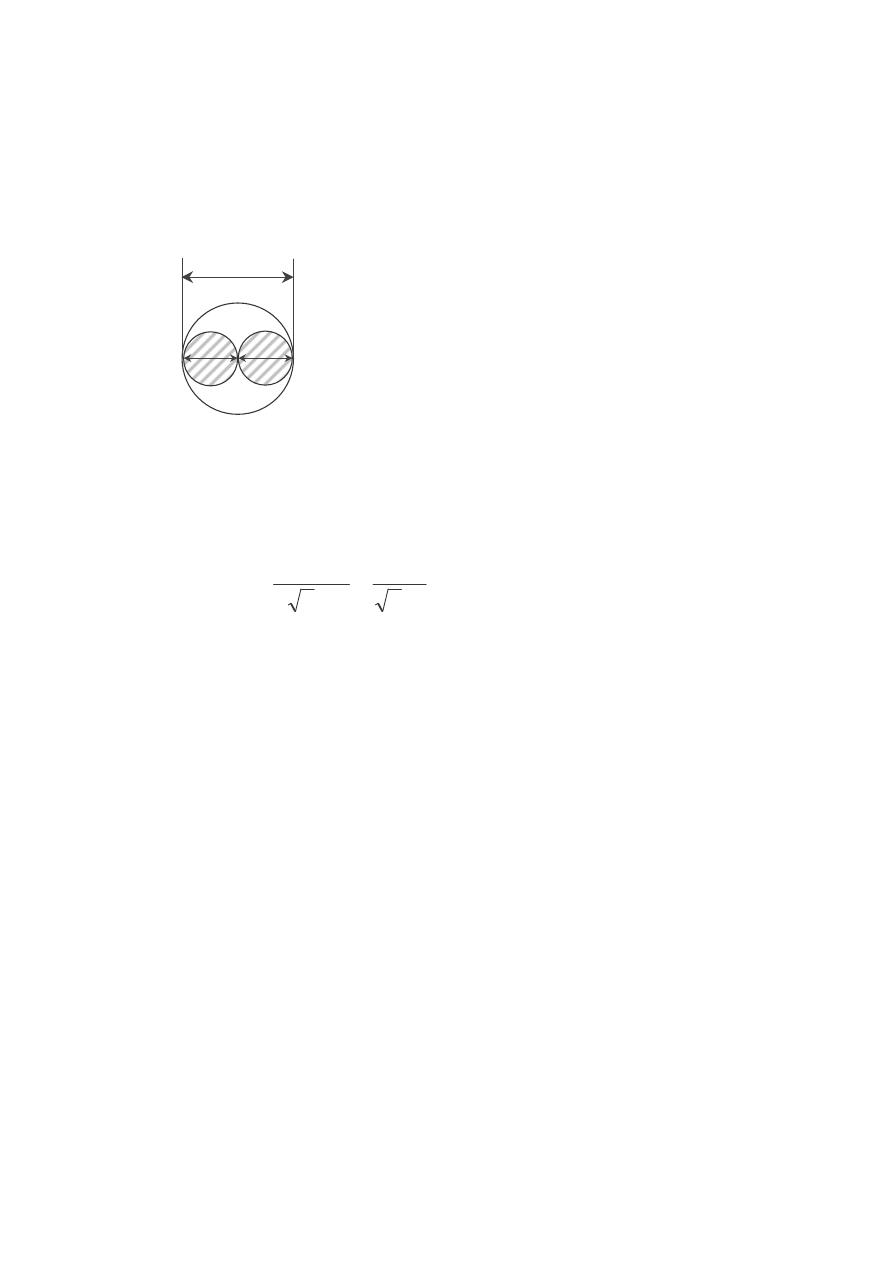
• Prawdopodobieństwo zderzenia dwóch molekuł określone jest poprzez tzw.
przekrój czynny na zderzenie σ. Molekuła w czasie zderzenia przedstawia
sobą tarczę o średnicy d równej średnicy molekuły
2
d
π
=
σ
• Z rozważań statystycznych dla dużej liczby zderzeń wynika wzór na średnią
drogę swobodną
σ
=
π
>=
<
n
2
1
nd
2
1
l
2
n – koncentracja molekuł
• Przykład: średnia droga swobodna molekuł powietrza (praktycznie azotu
cząsteczkowego N
2
)
T = 273 K, p = 1 atm, co odpowiada n = 3·10
19
cm
-3
d = 2·10
-10
m
typowy rozmiar prostych molekuł
<l> = 2·10
-7
m
• Przekrój czynny na zderzenie
σ = 1.2·10
-19
m
2
Jednostka przekroju czynnego
1 barn = 1 b = 10
-24
cm
2
= 10
-28
m
2
; σ (N
2
) = 10
9
b
• Częstość zderzeń (liczba zderzeń w jednostce czasu, np. w ciągu 1 sekundy)
d
d
2 d
MOLEKUŁA
„TARCZA” O ŚREDNICY
d
15
N
v
v
n
2
l
v
i
∑
>=
<
σ
=
>
<
>
<
=
ν
<v> - prędkość średnia (średnia arytmetyczna)
N - całkowita liczba molekuł
ν = 5·10
9
s
-1
(pięć miliardów zderzeń w ciągu 1 sekundy doznają molekuły
powietrza w warunkach normalnych)
• średni czas między zderzeniami
s
10
10
2
1
−
⋅
=
>=
<
ν
τ
ATMOSFERA ZIEMSKA
• Zmiany własności atmosfery ziemskiej z wysokością nad poziomem morza
h[m]
P[atm]
<l> [m]
N [cm
-3
]
0
1
10
-7
3·10
19
100
10
-6
1
3·10
13
300
10
-9
10
3·10
10
Duże h – pojęcie średniej drogi swobodnej traci sens. Działanie pola
grawitacyjnego powoduje, że molekuły poruszają się po torach
balistycznych i mogą uciekać z atmosfery
16
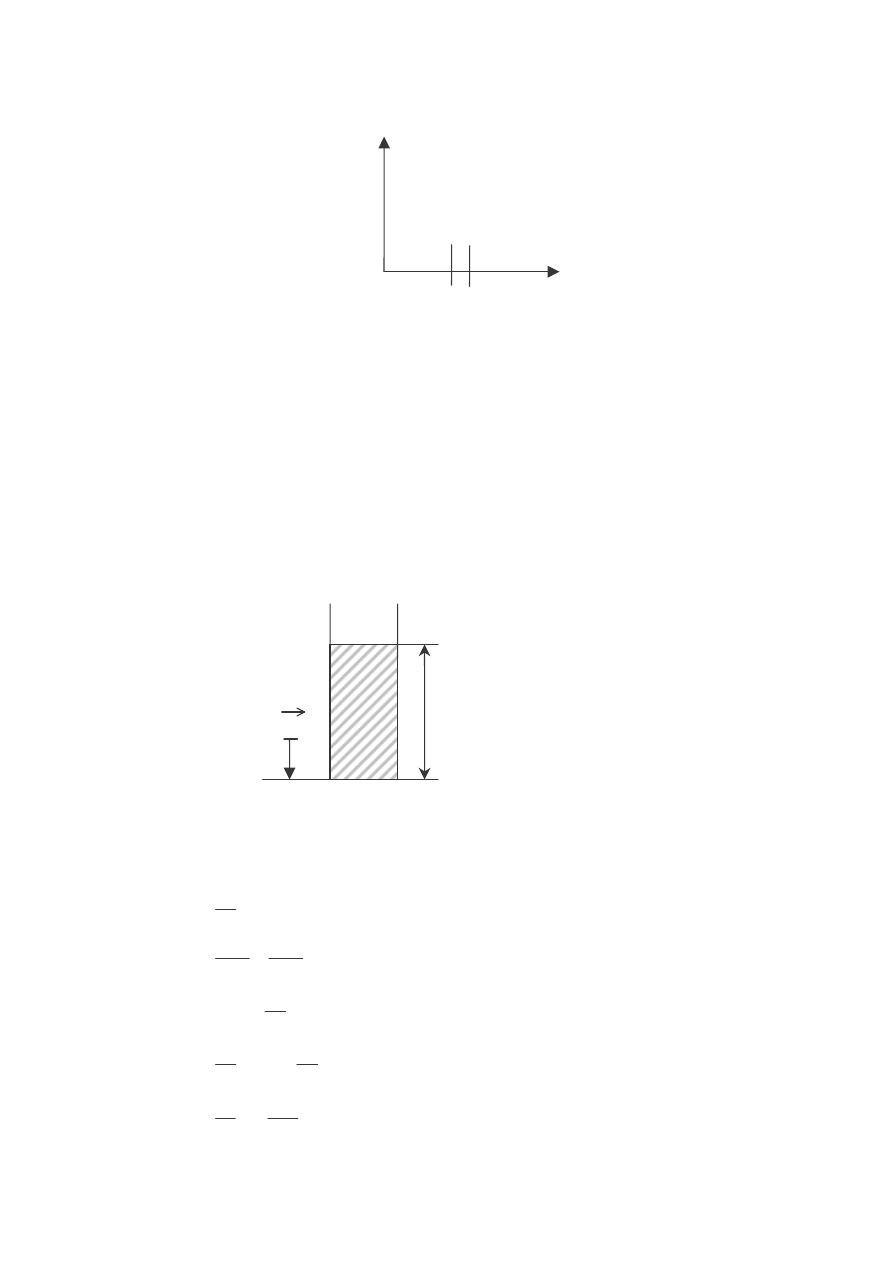
ZMIANA CIŚNIENIA Z WYSOKOŚCIĄ W ATMOSFERZE ZIEMSKIEJ
Poziom morza x = 0
• Ciśnienie hydrostatyczne gazu, cieczy o gęstości ρ i wysokości słupa h, g –
przyspieszenie ziemskie. Dla wysokości h = 0 (na poziomie morza) ciśnienie
wynosi p
0
, a gęstość powietrza ρ
0
dx
p
g
p
dp
p
p
g
dx
dp
p
p
p
)
x
(
p
)
x
(
g
dx
dp
gdx
)
x
(
)
x
(
dp
gh
p
0
0
0
0
0
0
0
0
ρ
−
=
ρ
−
=
ρ
=
ρ
=
ρ
ρ
ρ
−
=
ρ
−
=
ρ
=
p
x
dx
x = 0
POZIOM MORZA
ρρρρ
p
h

17
Powyższe równanie różniczkowe jest równaniem o zmiennych rozdzielonych,
które całkujemy w granicach od p
0
do p(x) i od 0 do x
1
1
4
2
5
0
3
0
2
0
0
0
0
0
0
0
0
0
0
0
0
116
.
0
10
16
.
1
/
10
01
.
1
20
/
2
.
1
/
81
.
9
exp
ln
0
−
−
−
−
=
⋅
=
⋅
=
=
=
=
≡
=
−
=
−
=
−
=
∫
∫
km
m
m
N
p
C
t
m
kg
s
m
g
p
g
e
p
x
p
g
p
p
x
p
g
p
p
p
g
p
dp
o
x
x
p
p
α
ρ
ρ
α
ρ
ρ
ρ
α
GŁĘBOKOŚĆ [km]
WYSOKOŚĆ [km]
5 10 15 20 25 30
15 10 5
1,0
0,5
100
500
p [atm]
POZIOM
MORZA
p (x) =
ρρρρgx
p (x) = p
o
e
-dx
WZÓR BAROMETRYCZNY
UWZGLĘDNIA ZMIANY g i T z WYSOKOŚCIĄ
dx
o
e
p
g
dx
dp
−
⋅
=
⋅
−
=
α
ρ
x
g
p
const
g
dx
dp
⋅
⋅
=
=
⋅
=
ρ
ρ

18
ROZKŁAD PRĘDKOSCI MOLEKUŁ W GAZIE
FUNKCJA ROZKŁADU PRĘDKOŚCI
• Funkcja rozkładu prędkości pozwala określić ile molekuł posiada prędkości
zawarte w przedziale (v, v+dv)
• Funkcja rozkładu oznacza prawdopodobieństwo tego, że w układzie
złożonym z bardzo dużej liczby molekuł znajdziemy molekułę o prędkości z
przedziału (v, v+dv)
• Funkcja rozkładu pozwala wyznaczać wartości średnie, np. <v>, <v
2
>
• Postać funkcji rozkładu jest określany na gruncie fizyki statystycznej
ROZKŁAD MAXWELLA
• Gaz składa się z cząsteczek o różnych prędkościach w danej temperaturze i
danym ciśnieniu. Stan taki jest spowodowany nieustającymi zderzeniami
molekuł i przekazem pędu.
• Najbardziej prawdopodobny rozkład prędkości wielkiej liczby cząstek
• Funkcja rozkładu Maxwella ma postać
kT
2
mv
2
2
3
2
e
v
kT
2
m
N
4
)
v
(
N
−
π
π
=
N – całkowita liczba cząsteczek w próbce gazu
k – stała Boltzmanna
T – temperatura gazu
19
m – masa pojedynczej cząsteczki
N(v)dv – liczba cząsteczek w próbce gazu o prędkościach z przedziału
(v, v+dv)
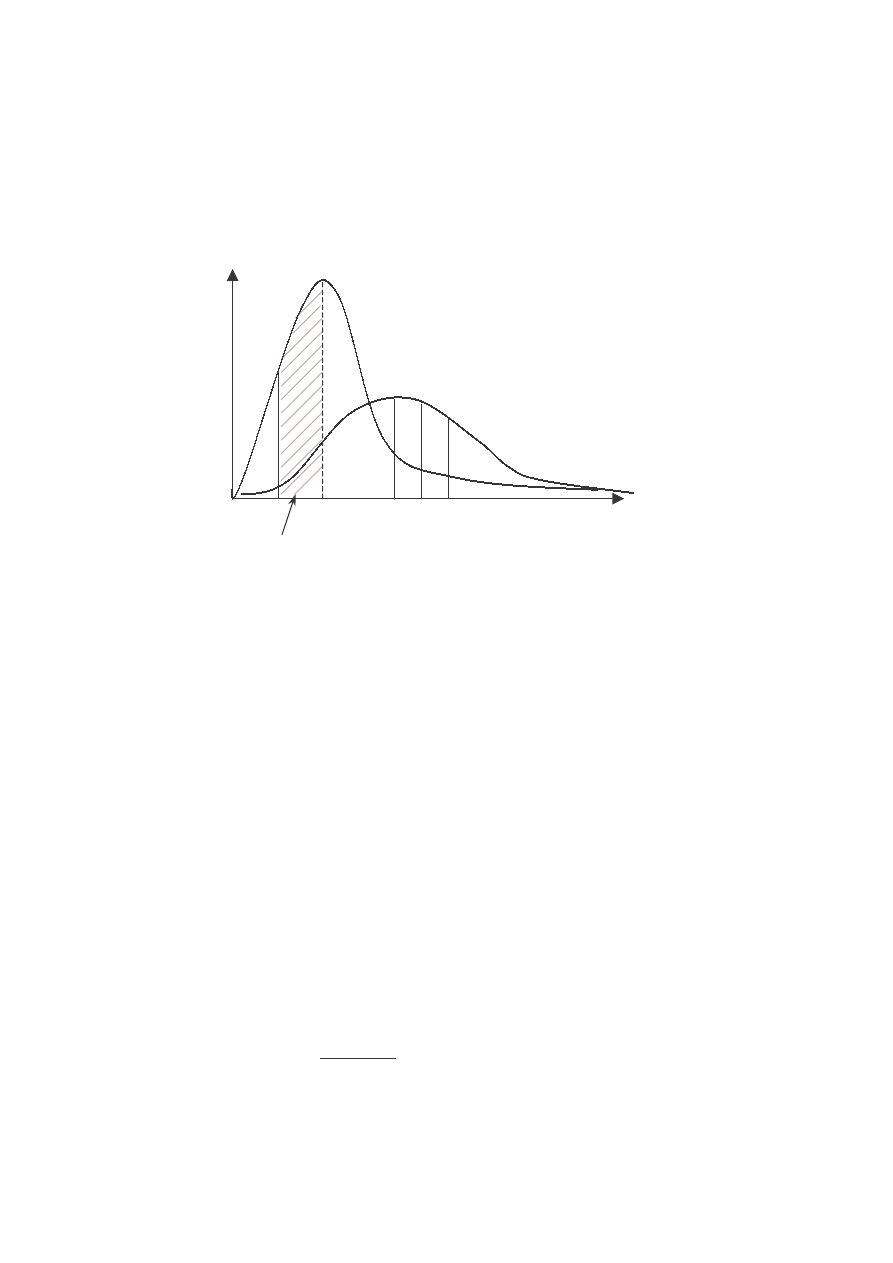
Kształt funkcji Maxwella dla dwóch różnych temperatur gazu T
1
< T
2
.
N(v ) oznacza liczbę cząsteczek przypadających na jednostkowy przedział
prędkości.
• Pole powierzchni pod krzywą jest równe całkowitej liczbie cząsteczek
∫
=
∞
0
dv
)
v
(
N
N
• Funkcja rozkładu prędkości pozwala wyznaczyć wartości średnie prędkości
Prędkość średnia (arytmetyczna)
N
vdv
)
v
(
N
v
0
∫
>=
<
∞
T
2
N(v)
N(v)dv
v
T
1
v
p
<v> v
kw

20
Prędkość średnią kwadratową
N
dv
v
)
v
(
N
v
0
2
2
∫
=
>
<
∞
oraz prędkość najbardziej prawdopodobną v
p
, która oznacza położenie
maksimum funkcji rozkładu na osi prędkości
• Relacje liczbowe między poszczególnymi prędkościami
m
kT
m
kT
v
59
.
1
8
=
>=
<
π
,
m
kT
v
73
.
1
2
=
>
<
,
m
kT
m
kT
v
p
41
.
1
2
=
=
v
p
< <v> <
>
<
2
v
inaczej
(v
p
< <
v
> <
>
<
2
v
)
>
≡<
>
≡<
l
v
v
λ
• Im mniejsza masa, tym większa liczba molekuł o dużych prędkościach w
danej temperaturze, np.:
H
2
, N
2
, O
2
w górnych warstwach atmosfery
Ucieka łatwiej z górnych warstw niż O
2
i N
2
21
n
0
z
dz
dn
j
D
= grad n
z
ZJAWISKA TRANSPORTU W GAZACH
- DYFUZJA
- TRANSPORT MASY
- PRZEWODNICTWO CIEPLNE
- TRANSPORT ENERGII
- LEPKOŚĆ
- TRANSPORT PĘDU
DYFUZJA
• Samorzutnie przebiegający proces wyrównywania koncentracji molekuł
na skutek ich ruchu cieplnego
• Układ (gaz) nie jest w stanie równowagi, ale do niej dąży
• (może być TERMODYFUZJA = przemieszczanie się molekuł
spowodowane różnicą temperatur objętości gazu)
Możliwe zjawiska dyfuzyjne:
- autodyfuzja (samodyfuzja)
- dyfuzja wzajemna
- termodyfuzja
n - koncentracja molekuł
dz
dn
- gradient koncentracji
D
j
- gęstość prądu dyfuzji
(liczba molekuł na jednostkę
powierzchni prostopadłej do
D
j
na sekundę)

22
• |
D
j
|=
dz
dn
D
j
D
−
=
równanie dyfuzji
v
D
⋅
=
λ
3
1
współczynnik dyfuzji D~10
-5
2
s
m
, w gazach
(model gazu doskonałego)
(
λ
,
v
- średnia droga swobodna, średnia prędkość)
• równanie dyfuzji inaczej
dz
d
D
mn
dz
d
D
j
M
ρ
−
=
−
=
)
(
gęstość strumienia masy
(m = masa molekuły)
• współczynnik dyfuzji
m
kT
p
kT
D
π
σ
8
2
3
1
⋅
⋅
⋅
=
T = const, D~
p
1
p = const, D~
2
3
T
np.: H
2
D=6.6·10
-5
m
2
/s
O
2
D=0.93·10
-5
m
2
/s
dla danego gazu
współczynnik samodyfuzji
w warunkach normalnych
23
PRZEWODNICTWO CIEPLNE
• ρ=const, zmienne T w objętości gazu
T=T(z)
dZ
dT
j
Q
κ
−
=
[j
Q
]=J/(m
2
s), [κ]=W/(mK)
2
3
1
f
k
v
n
⋅
⋅
⋅
⋅
=
λ
κ
k - stała Boltzmana, f - liczba stopni swobody
V
c
v
⋅
⋅
=
λ
κ
3
1
)
~
(
2
1
T
v
,
2
1
~ T
κ
κ - nie zależy od n a więc i p
j
Q
z
T
0
z
dz
dT
= grad T;
dz
dT
> 0
równanie transportu ciepła (energii)
= gęstość prądu energii
współczynnik przewodnictwa cieplnego
(model gazu doskonałego)
c
V
- odniesione do jednostki objętości
24
np.:
H
2
κ=16.8·10
-2
W/(m/K)
O
2
κ=2.4·10
-2
W/(m/K)
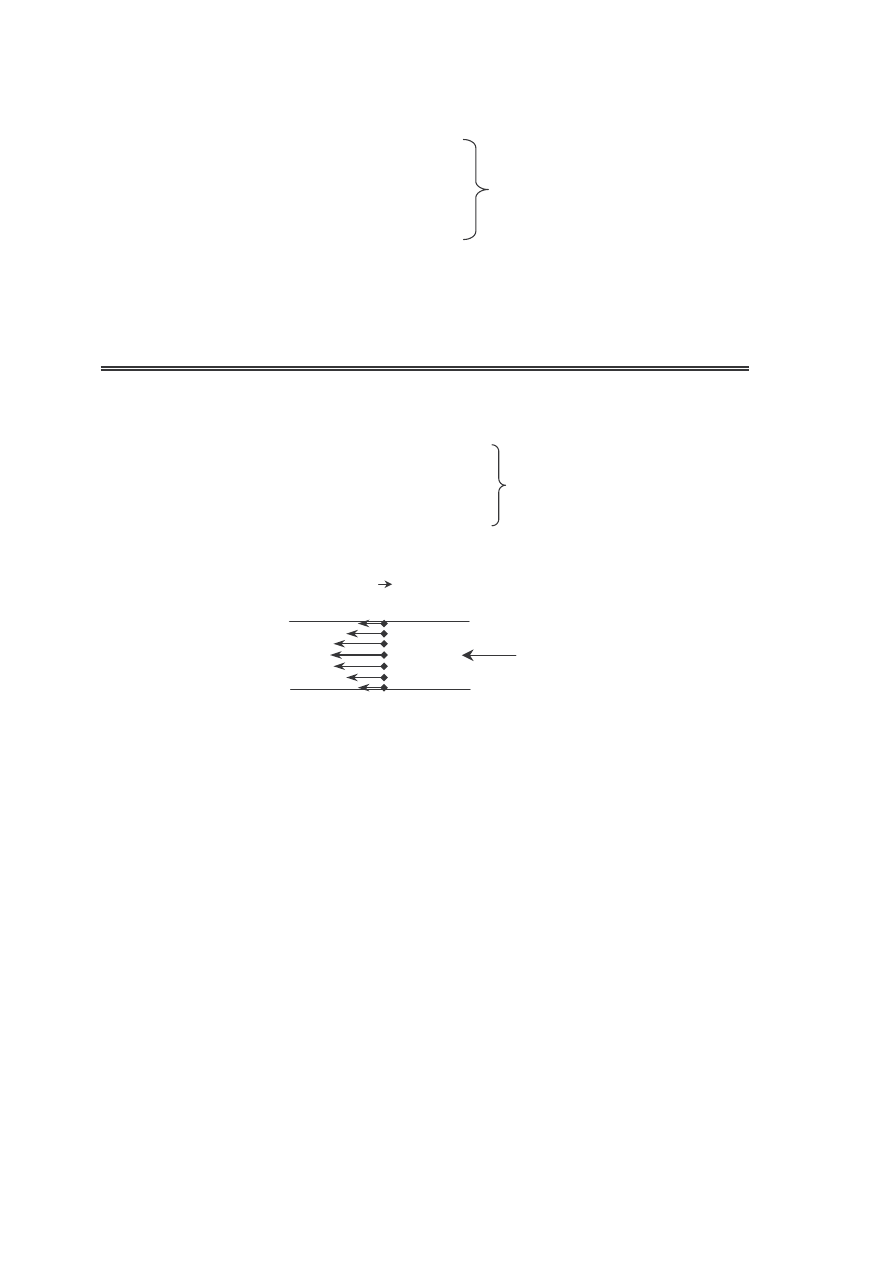
TRANSPORT PĘDU (LEPKOŚĆ, TARCIE WEWNĘTRZNE)
Przekaz pędu między warstwami gazu o różnej prędkości
(w ruchu uporządkowanym)
)
(
2
1
u
u
m
p
−
=
2
1
, u
u
- prędkości warstw
)
(
2
1
u
u
m
p
−
=
- zmiana pędu molekuły
p
j
- gęstość strumienia pędu ( pęd/(m
2
s) )
dz
du
j
p
η
−
=
λ
ρ
λ
η
v
v
nm
3
1
3
1
=
=
współczynnik lepkości
2
1
~ T
η
; η- nie zależy od p
u
0
z
j
p
dz
du
= grad u
z
u
1
u
2
równanie lepkości
[η]=kg/(ms)
25
np
.:
H
2
η=0.84·10
-5
kg/(ms)
O
2
η=1.40·10
-5
kg/(ms)
UWAGA:
Pomiar współczynnika lepkości cieczy
Pomiar współczynnika lepkości powietrza
Ćwiczenia
na pracowni fizycznej
v
GAZ, CIECZ
w warunkach
normalnych
Wyszukiwarka
Podobne podstrony:
Budowa i wlasnosci czasteczkowe gazow
oko budowa i wlasnosci (1)
ćw 19 - Badanie własności cząstek alfa za pomocą detektora półprzewodnikowego
1 Materiałoznawstwo mechatronika budowa i własnoścwłasności
budowa atomow i czasteczek , Budowa atomów i cząsteczek
budowa atomów i cząsteczek sprawdzian, VIII L.O
budowa atomów i cząsteczek sprawdzian VIII L O
Budowa atomów i cząsteczek, LICEUM różne, CHEMIA
lab19, MIBM WIP PW, fizyka 2, laborki fiza(2), 53-Badanie własnosci cząstek alfa za pomoca detektora
Budowa i wlasnosci wody
budowa atomów i czasteczek sprawdzian
budowa atomów i cząsteczek
oko budowa i wlasnosci (1)
budowa atomu i cząsteczek
więcej podobnych podstron