2009-11-11
1
Podstawowe obliczenia stechiometryczne.
WYKŁAD II
WYKŁAD II
Reakcje chemiczne
są to procesy polegające na przegrupowaniu atomów
wchodzących w skład cząsteczki substancji wyjściowych (substraty reakcji) i
wytworzeniu substancji o odmiennym składzie i właściwościach (produkty
reakcji).
Reakcje
chemiczne
przedstawimy
za
pomocą
odpowiedniego
zapisu
chemicznego – równań reakcji. Zapis ten przedstawia jakościowo i ilościowo
przebieg reakcji.
3 H
2
O + P
2
O
5
→ 2 H
3
PO
4
17:30
Reakcje chemiczne przebiegają zgodnie z podstawowymi
prawami chemicznymi:
1. Prawo zachowania masy
stanowi, że suma mas reagentów nie
ulega zmianie podczas reakcji chemicznej (masa substratów jest równa
masie produktów reakcji )
2. Prawo stosunków stałych
podaje, że związek chemiczny ma stały
skład
ilościowy
(stały
stosunek
mas
atomów
poszczególnych
pierwiastków w cząsteczce), a zatem pierwiastki reagują ze sobą w
stałych,
ściśle
określonych
stosunkach
ilościowych,
nazywanych
stosunkami stechiometrycznymi.
17:30
3. Prawo stosunków wielokrotnych
stwierdza, że jeżeli dwa
pierwiastki tworzą ze sobą kilka różnych związków chemicznych, to w
związkach tych na tę samą ilość jednego pierwiastka przypadają ściśle
określone ilości drugiego pierwiastka, pozostające do siebie w
stosunku niewielkich liczb całkowitych
4. Prawo
stosunków
objętościowych:
objętości
gazowych
substratów i produktów reakcji, mierzone w jednakowych warunkach,
mają się do siebie, jak niewielkie liczby całkowite. W warunkach
normalnych (p = 101325 Pa, T = 273,15 K) jeden mol gazu doskonałego
zajmuje objętość 22,41 dm
3
17:30
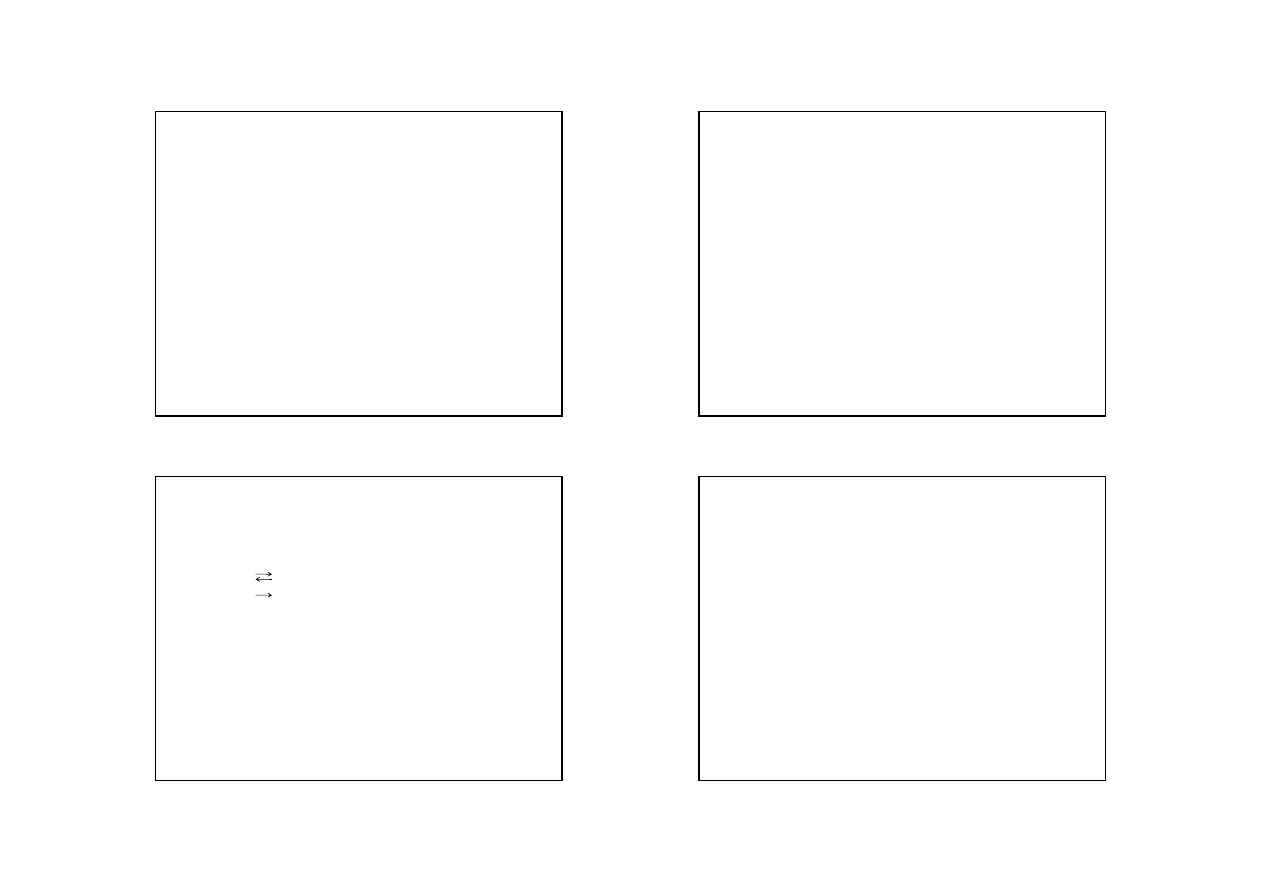
2009-11-11
2
Reakcje można klasyfikować na bardzo wiele sposobów,
np. ze względu na:
a) Charakter przemian, jakim ulegają reagujące substancje:
A + B = C
reakcja syntezy
C = A + B
reakcja rozkładu
AB + CD = AD + CB
reakcja wymiany
b) Efekty energetyczne, które towarzyszą przemianą chemicznym:
A + B = C – Q
reakcja endotermiczna
A + B = C + Q
reakcja egzotermiczna
17:30
d) Stan fazowy substratów i produktów reakcji (reakcje jednofazowe –
homogeniczne i wielofazowe – heterogeniczne)
A
(g)
+ B
(g)
= C
(g)
reakcja jednofazowa
A
(s)
+ B
(g)
= C
(g)
reakcja wielofazowa
c) Przeniesienie elektronów między reagującymi cząsteczkami, którym
towarzyszy zmiana stopnia utlenienia pierwiastków biorących udział w reakcji
(reakcje utleniająco-redukcyjne) i reakcje bez przeniesienia elektronów, bez
zmiany stopnia utlenia pierwiastków
17:30
e) Odwracalność reakcji:
A + B C
reakcja odwracalna
A + B C
reakcja nieodwracalna
Reakcję nazywamy odwracalną lub równowagową, jeżeli jej wyniku ustala się stan
równowagi , w którym współistnieją produkty i substraty.
Reakcje nieodwracalne to takie, w których nie osiąga się stanu równowagi
pomiędzy substratami a produktami, np. wtedy, gdy jeden z produktów opuszcza
środowisko reakcji.
17:30
Utlenianie i redukcja
Istota reakcji utleniania i redukcji (reakcje redoksowe) polega na wymianie
elektronów pomiędzy reagentami ze zmianą stopnia utlenienia. Utlenianie
związane jest z oddawaniem elektronów (podwyższanie stopnia utlenienia).
Procesem przeciwnym jest redukcja – przyjęcie elektronów (obniżenie stopnia
utleniania).
- powstawanie warstewki ochronnej na aluminium pod wpływem tlenu z
atmosfery (pasywacja aluminium)
4 Al + 3 O
2
→ 2 Al
2
O
3
- jeden z etapów korozji żelaza
4 Fe + 3 O
2
+ 2 H
2
O → 4 FeO(OH)
- powstawanie zielonej patyny na powierzchni miedzi pod wpływem atmosfery
2 Cu + CO
2
+ H
2
O + O
2
→ Cu
2
(OH)
2
CO
3
17:30
2009-11-11
3
Reakcje strąceniowe
Przez reakcje strąceniowe rozumie się reakcje prowadzące do powstania
związków trudno rozpuszczalnych w wodzie , które zwykle wytrącają się w
postaci osadu, aczkolwiek mogą też utrzymywać się w wodzie w postaci
koloidalnej zawiesiny (zol). Reakcję strącania można traktować jako
odwrotność rozpuszczania.
Powstawanie nacieków wapiennych na betonie pod wpływem działania
dwutlenku węgla z powietrza
Ca(OH)
2
+ CO
2
→ CaCO
3
↓ + H
2
O
W atmosferze przemysłowej powstawanie wykwitów gipsowych na betonie
Ca(OH)
2
+ H
2
SO
4
→ CaSO
4
∙ 2 H
2
O ↓
17:30
Reakcje kompleksowe
W wyniku reakcji kompleksowych (reakcje koordynacyjne lub zespolone)
powstają związki, w których występują tzw. jony lub atomy centralne,
otoczone przez cząsteczki lub jony zwane ligandami.
Hydratacja glinianu trójwapniowego – tworzy się kompleksowy jon [Al(OH)
6
]
3-
sześciohydroksy glinianu; reakcja zachodząca podczas wiązania cementu
portlandzkiego
3 CaO ∙ Al
2
O
3
+ 6 H
2
O → Ca
3
[Al(OH)
6
]
2
17:30
Reakcje heterogeniczne; reakcje ciał stałych
Wszystkie reakcje ciał stałych, w tym większości reakcji związanych z
budownictwem (np. tworzenie klinkieru cementu portlandzkiego, wiązanie
cementu itp.), reakcjami heterogenicznymi .
Podczas wypalania klinkieru cementowego
CaO + SiO
2
→ Ca SiO
3
W tym przypadku jony Ca
2+
i Si
4+
dyfundują w dwóch przeciwnych
kierunkach. W skutek szybszej dyfuzji jonów Ca
2+
powstaje najpierw
Ca
2
SiO
4
, który następnie przechodzi w produkt końcowy
17:30
Reakcje endotermiczne i egzotermiczne
Wszystkim reakcjom towarzyszy efekt cieplny.
Reakcje endotermiczne:
-Wypalanie kamienia wapiennego
CaCO
3
+ 178,5 kJ → CaO + CO
2
-Wypalanie kamienia gipsowego
CaSO
4
∙ 2 H
2
O + 16,4 kJ → CaSO
4
∙ ½ H
2
O + 1,5 H
2
O
CaSO
4
∙ 2 H
2
O + 19,9 kJ → CaSO
4
+ 2 H
2
O
17:30
2009-11-11
4
Przykłady reakcji egzotermicznych
- Gaszenie wapna palonego
CaO + H
2
O → Ca(OH)
2
+ 67,0 kJ
- Uwodnienie gipsu
CaSO
4
∙ ½ H
2
O + 1,5 H
2
O → CaSO
4
∙ 2 H
2
O + 16,4 kJ
- Powstawanie minerałów cementowych podczas klinkieryzacji
36 CaO + 8 SiO
2
+ 4 Al
2
O
3
+ 2 Fe
2
O
3
→ 6 (3 CaO ∙ SiO
2
) + 2 (2 CaO ∙ SiO
2
) +
+ 2 (3 CaO ∙ Al
2
O
3
) + 2 (4 CaO ∙ Al
2
O
3
∙ Fe
2
O
3
) + 1371,4 kJ
- Hydroliza alitu (jedna z reakcji hydratacji cementu)
2 (3 CaO ∙ SiO
2
) + 6 H
2
O → 2 (1,5 CaO ∙ SiO
2
∙ 1,5 H
2
O) + 3 Ca(OH)
2
+ 918 kJ
17:30
Stechiometria równań chemicznych
Substancje reagują ze sobą w ściśle określonym stosunku ilościowym,
charakterystycznym dla danej reakcji. Również powstające produkty pozostają
do siebie i do substratów w ściśle określonych stosunkach. Stosunki ilościowe
między reagentami, tzw. stosunki stechiometryczne, oblicza się na podstawie
równania chemicznego. Najczęściej wykorzystuje się trzy sposoby określania
stosunku stechiometrycznego: molowy, masowy (wagowy) i objętościowy.
Stosunek objętościowy tylko dla gazów jest taki sam jak stosunek molowy, co
wynika z zasady Avogadra, np.:
Równanie chemiczne: 3H
2
+ N
2
→ 2NH
3
Molowy stosunek stechiometryczny: 3 mole : 1 mola : 2 mole
Masowy stosunek stechiometryczny: 6 g : 28 g : 34 g
Objętościowy stosunek stechiometryczny: 3 obj. : 1 obj. : 2 obj.
Schemat obliczeń stechiometrycznych jest następujący:
Schemat obliczeń stechiometrycznych jest następujący:
a) Należy poprawnie napisać wzory związków stechiometrycznych po stronie
substratów i produktów
b) Dobrać współczynniki stechiometryczne w równaniu reakcji chemicznej
c) Na podstawie stosunków molowych, wynikających ze wzoru lub równania
reakcji, należy określić stosunki masowe,
d) Ze stosunków masowych i danych zadania, za pomocą proporcji należy obliczyć
masę składnika związku lub masę reagenta
Zadanie
W wyniku reakcji metalicznego sodu z wodą otrzymano 2 g NaOH. Obliczyć, ile
sodu użyto w reakcji i jaką objętość zajmie wydzielający się wodór w warunkach
normalnych?
16
Stosunki liczbowe i procenty.
Często w zadaniach o mieszaninach lub mieszankach dwuskładnikowych,
podaje się, że stosunek jednej wielkości składniowej do drugiej równy jest
stosunkowi dwóch liczb.
Przykład zmiany stosunku na procenty:
Stosunek mas dwóch składników mieszanki jest równy 2,5:5,5
Ile procent mieszanki stanowi każdy składnik?
Rozwiązanie:
Masa mieszanki to 8 części wagowych.
Pierwszy składnik to części, czyli 31,25% masy mieszanki.
Drugi składnik to części, czyli 68,75% masy mieszanki.
2 5
8
,
5 5
8
,
Odpowiedź
Składniki mieszanki stanowią 31,5% i 68,75%.
Odpowiedź
Składniki mieszanki stanowią 31,5% i 68,75%.
2009-11-11
5
17
Stężenie procentowe.
Jednym ze sposobów wyrażania stężeń roztworów jest
stężenie procentowe. Stężenie procentowe roztworu
jest to liczba gramów substancji rozpuszczonej w 100g
roztworu.
Stężenie procentowe wyrażamy za pomocą wzoru
Cp
– stężenie procentowe
ms
- masa substancji rozpuszczonej
mr
- masa roztworu
mw
- masa wody
mr-=ms+mw
Cp
ms
mr
=
⋅100%
Wyszukiwarka
Podobne podstrony:
3 Obliczenia stechiometryczne klucz
OBLICZENIA STECHIOMETRYCZNE
stechimertia2, Obliczenia stechiometryczne
obliczenia-stechiometryczne
4.Obliczenia stechiometryczne, Zad
OBL2, Obliczenia stechiometryczne
Obliczenia stechiometryczne
Obliczenia stechiometryczne id Nieznany
obliczenia stechimetryczne przykładowe zadania(1)
3 Obliczenia stechiometryczne
ZADANIA OBLICZENIOWE PRZY WYKORZYSTANIU STECHIOMETRII REAKCJI
Podstawy obliczeń chemicznych stechiometria reakcji chemicznych
Prezentacja JMichalska PSP w obliczu zagrozen cywilizacyjn 10 2007
3 ANALITYCZNE METODY OBLICZANIA PŁYWÓW
Obliczanie masy cząsteczkowej
więcej podobnych podstron