
Podstawy korozji
1 Definicja
2 Wprowadzenie
3 Formy korozji
4 Metody ochrony przed korozją
5 Monitorowanie korozji

Definicja
Niszczenie materiałów, w tym metali,
będące wynikiem ich oddziaływania ze
środowiskiem.
Wprowadzenie
Korozja jest zjawiskiem naturalnym
Całkowite jej zahamowanie jest trudne
Tworzywa sztuczne korodują powoli
Procesy korozyjne są często
pożyteczne: trawienie metali, elektrody
w ogniwach (baterie), tworzenie warstw
pasywnych

Przykłady zaatakowań korozyjnych

Przykłady zaatakowań korozyjnych

Czynniki wpływające na korozję
Wewnętrzne
z
Rodzaj metalu
z
Sk
ład chemiczny
z
Struktura
z
Stan powierzchni
z
Obróbka cieplna
z
Obróbka mechaniczna
z
Naprężenia w
łasne
Zewnętrzne
z
Rodzaj środowiska
z
Sk
ład środowiska
z
Temperatura
z
Prędkość przep
ływu
z
Ciśnienie atmosferyczne
z
Polaryzacja zewnętrzna

Rodzaje korozji
Zależnie od mechanizmu
korozja
elektrochemiczna
(chemiczna)
Zależnie od środowiska
korozja wodna
korozja atmosferyczna
korozja wysoko temperaturowa

Mechanizm korozji elektrochemicznej
Na powierzchni metalu można zlokalizować
miejsca mające charakter
anod
i
katod
Na anodach zachodzi proces utleniania:
Fe
→ Fe
+2
+ 2e
Na katodach zachodzi proces redukcji:
1/2 O
2
+ H
2
O + 2e = 2 OH
-
2H
+
+ 2e = H
2

Rodzaje ogniw korozyjnych
Dwa różne metale
Ogniwa stężeniowe
Ogniwo zmiennego
napowietrzenia
Ogniwo tworzone
przez działające
prądy błądzące
Ogniwo naprężeniowe
Nowy metal – stary
metal
Ogniwo
temperaturowe

Formy korozji
Rodzaje korozji
Korozja ogólna
Korozja galwaniczna
Korozja wżerowa
Korozja szczelinowa
Korozja międzykrystaliczna (i transkrystaliczna)
Korozja selektywna
Erozja – korozja
Korozja naprężeniowa

Formy korozji-
ogólna

Formy korozji - galwaniczna
Czynniki wpływające na korozję galwaniczną:
Różnica potencjałów pomiędzy metalami
Stosunek powierzchni anody do katody
Rezystancja w utworzonym ogniwie
galwanicznym
Formy korozji - galwaniczna
stal
mosiądz
żeliwo
miedź

Formy korozji - galwaniczna
Szereg napięciowy metali
Uszeregowanie metali w zależności od
wartości ich potencjałów korozyjnych
względem elektrody wodorowej (NEW)
Wskazuje na tendencję do korozji
Metale o potencjałach wyższych od NEW–
metale szlachetne
Metale o potencjałach niższych od NEW –
metale nieszlachetne (aktywne
elektrochemicznie)
Mg, Mg
2+
Mg <=> Mg
2+
+ 2e
- 2,37
Al, Al
3+
Al <=> Al
3+
+ 3e
- 1,66
Zn, Zn
2+
Zn <=> Zn
2+
+ 2e
- 0,76
Cr, Cr
3+
Cr <=> Cr
3+
+ 3e
- 0,71
Fe, Fe
2+
Fe <=> Fe
2+
+ 2e
- 0,44
Ni, Ni
2+
Ni <=> Ni
2+
+ 2e
- 0,24
H
2
, H
+
H
2
<=> 2H
+
+ 2e
- 0,00
Cu, Cu
2+
Cu
2+
+ 2e <=> Cu
+ 0,345
Au, Au
+
Au
+
+ e <=> Au
+ 1,420
Formy korozji - galwaniczna
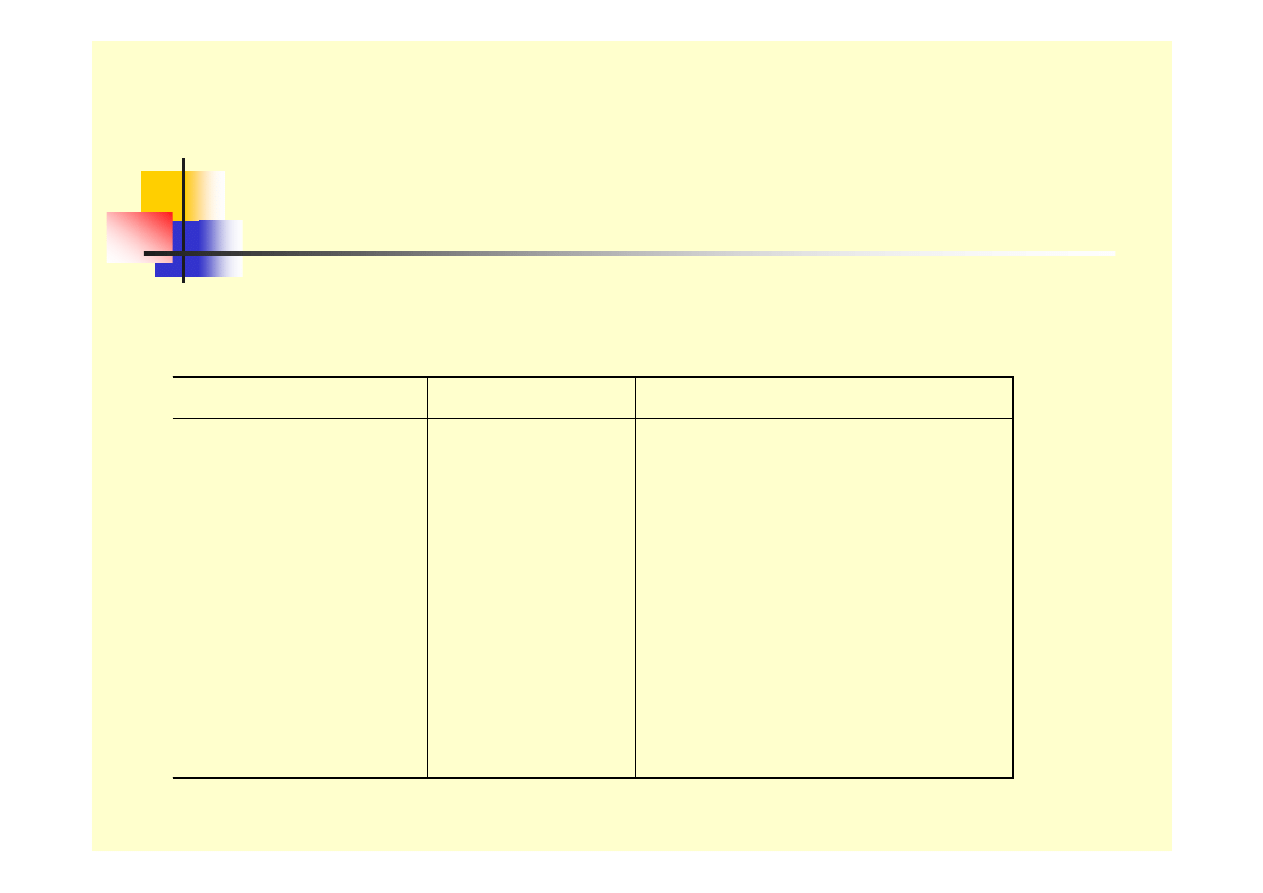
Tablica 1. Praktyczny szereg napięciowy
wybranych metali w 3 % NaCl
Metal Symbol
Potencjał względem NEW
Platyna
Tytan
Srebro
Miedź
Nikiel
Ołów
Żelazo
Glin
Cynk
Pt
Ti
Ag
Cu
Ni
Pb
Fe
Al.
Zn
+ 0,47 V
+ 0,37 V
+ 0,30 V
+ 0,04 V
- 0,03 V
- 0,27 V
- 0,40 V
- 0,53 V
- 0,76 V

Formy korozji - galwaniczna
Problem:
stalowa
śruba łącząca konstrukcję
wykonaną z
brązu
śruba z brązu
łącząca konstrukcję
stalową
.
Stal w układzie jest
anodą
,
brąz jest
katodą
.
Formy korozji - galwaniczna
c
Mała katoda z brązu w
niewielkim stopniu
wpływa na szybkość
korozji dużej anody
(stal).
Mała stalowa anoda
(śruba) będzie ulegała
wzmożone korozji w
połączeniu z dużą
powierzchnią brązu.
Formy korozji
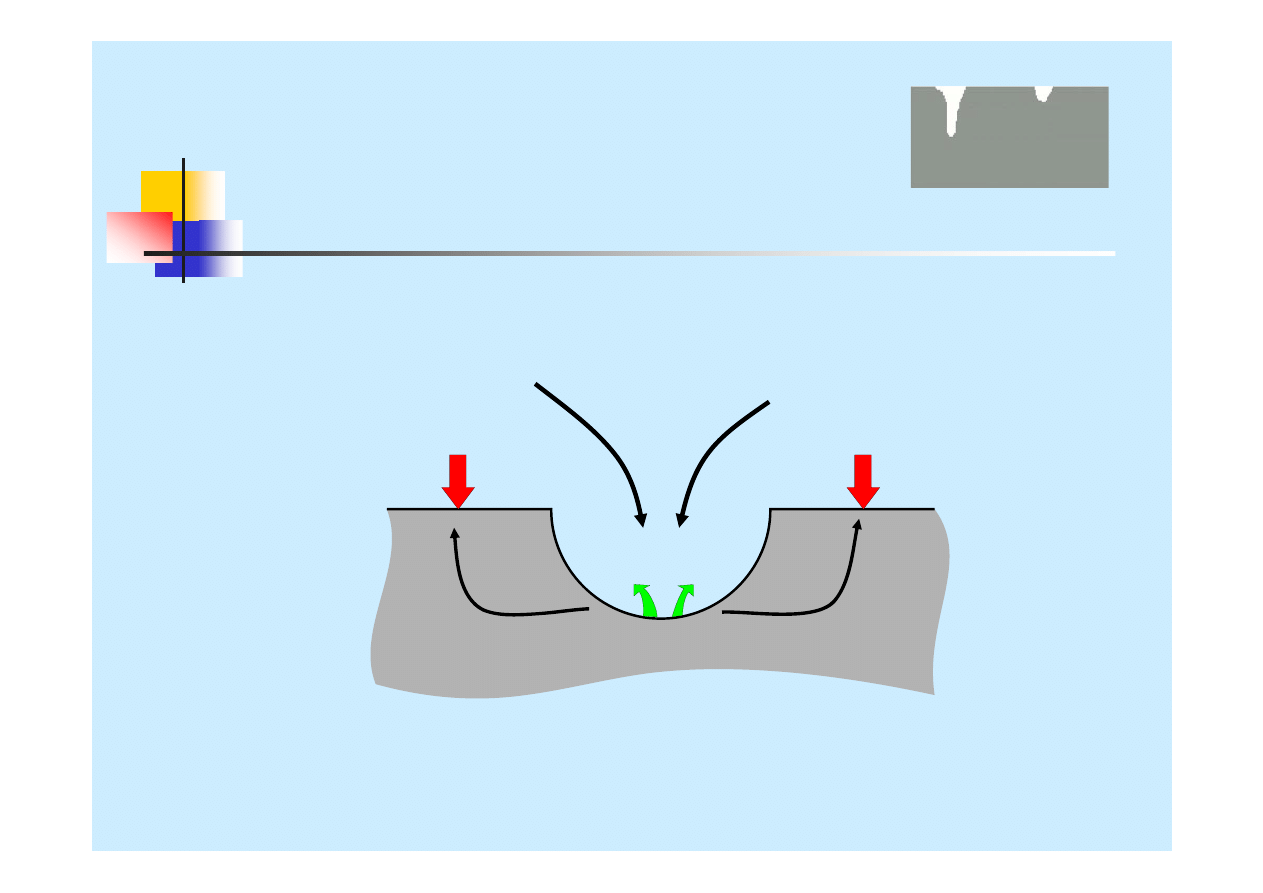
Korozja wżerowa
Korozja wżerowa jest jedną z postaci
korozji lokalnej.
Charakteryzuje się tym, że atak zlokalizowany jest na
niewielkich, dyskretnych miejscach na powierzchni metalu.
Korozja wżerowa ma miejsce głównie w obojętnych i kwaśnych
roztworach zawierających
chlorki lub inne halogenki.
Miejscami
inicjacji korozji wżerowej mogą być
wtrącenia niemetaliczne
, lub
mikro-szczeliny
powstające podczas obróbki mechanicznej.
Korozja wżerowa
O
2
O
2
Cr
3+
Cr
3+
3e
3e
Cl
-
Cl
-

Korozja wżerowa
Korozja wżerowa
stali odpornych na korozję
i stopów niklu
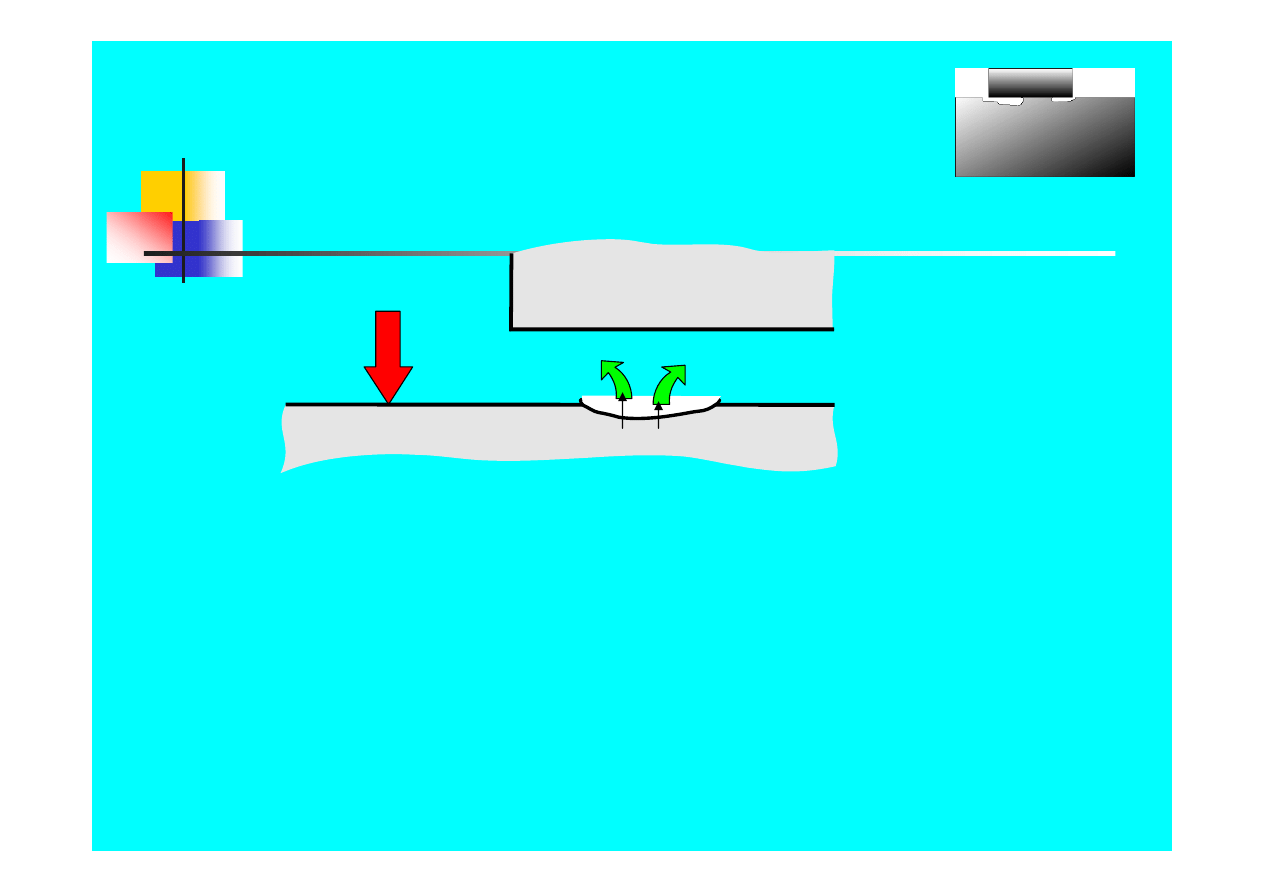
Formy korozji - szczelinowa
Metal
O
2
Cr
3+
Metal
Cr
3+
1.
Tlen jest zużywany
w elektrolicie w szczelinie w procesie
korozji; stan pasywny występuje wokół szczeliny
2. Wartość
pH spada
w wyniku hydrolizy CrCl
3
wewnątrz
wżeru
3.
Niszczenie warstwy pasywnej
w kwasie wewnątrz wżeru
4. Dalsze
zakwaszenie środowiska
wewnątrz wżeru
i rozwój korozji szczelinowej

Korozja szczelinowa

Korozja szczelinowa w środkowej części wyparki od
strony wylotu aminy

Formy korozji
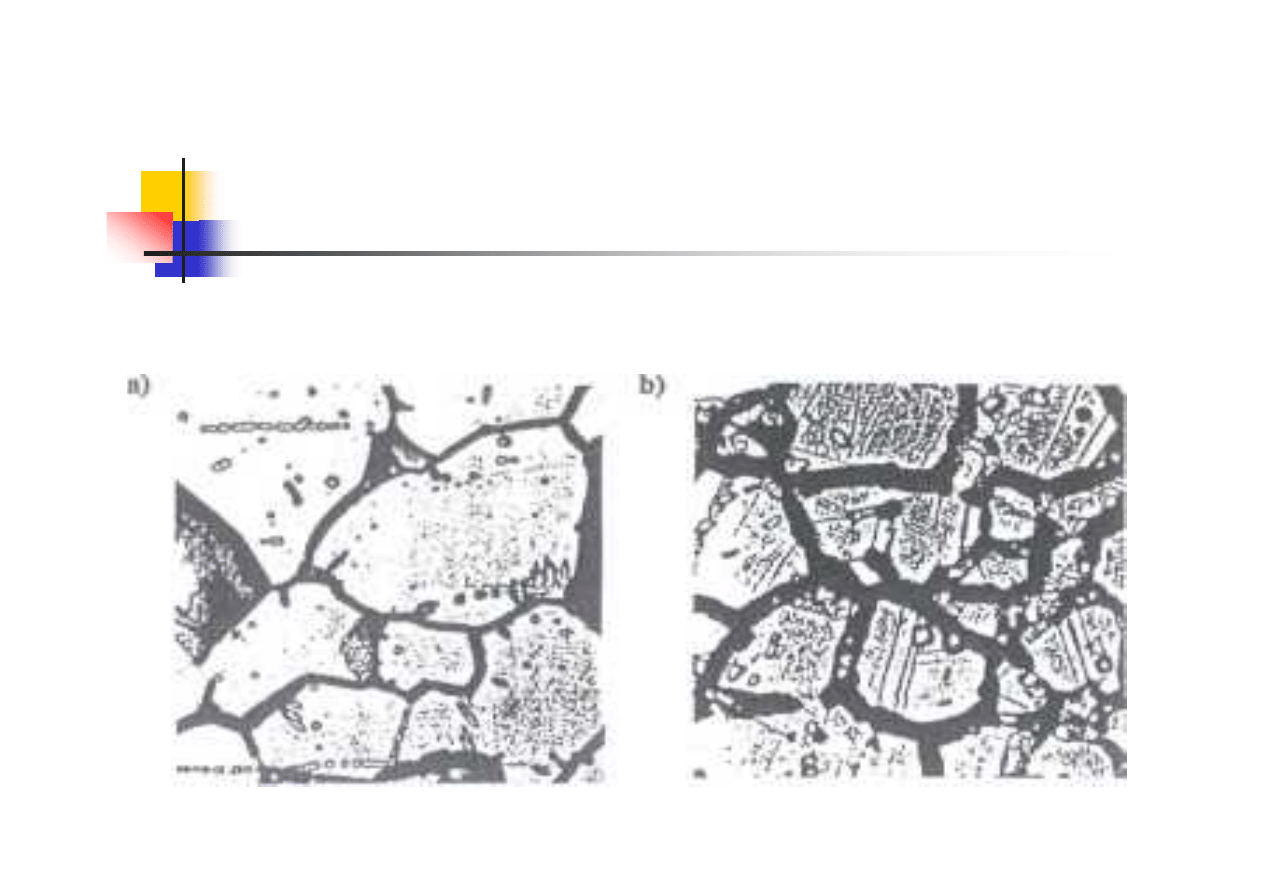
Korozja
międzykrystaliczna
Przyczyną występowania podatności na korozję międzykrystaliczną
są najczęściej zmiany strukturalne w stopie zachodzące na
granicach ziaren, głównie pod wpływem obróbki termicznej. Jeżeli
węgliki chromu
wytrącają się na granicy ziaren to oznacza, że stal
uległa uczuleniu
w strefie oddziaływania ciepła.
Zubożenie
przygranicznych obszarów ziaren austenitu w chrom wynika ze
zmiany rozpuszczalności węgla w austenicie
w
zależności od
temperatury oraz z wyższego powinowactwa chemicznego węgla
do chromu niż do żelaza.
W temperaturze uczulenia 400 - 850 °C wydzielający się z roztworu
stałego węgiel dyfunduje do granic ziaren, gdzie łączy się głównie z
chromem tworząc węgliki chromu. Z powodu małych rozmiarów
szybkość dyfuzji atomów węgla jest znacznie większa niż atomów
chromu
.
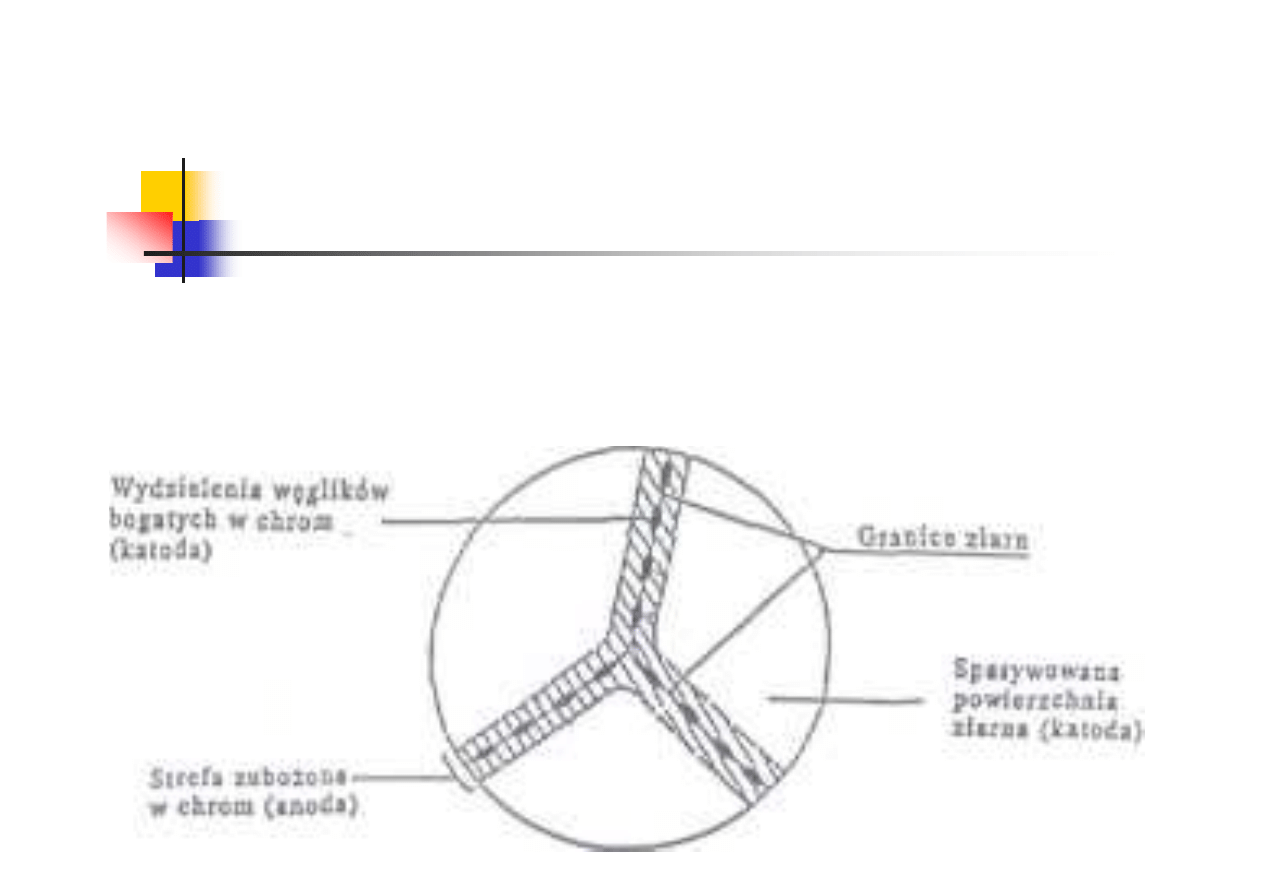
W reakcji tworzenia węglików bierze udział cały rozpuszczony w
austenicie węgiel. Chrom migruje z obszarów znajdujących się
najbliżej granic ziaren. Zubożone w chrom przygraniczne strefy
ziaren są w ogniwie anodami, natomiast katodami pozostaną
spasywowane powierzchnie ziaren z nienaruszoną zawartością
chromu oraz powierzchnie wydzielonych węglików bogatych w
chrom. Powierzchnia anod jest znacznie mniejsza od powierzchni
katod, dlatego efektem jest szybka korozja stopu postępująca wzdłuż
granic ziaren.

Jeżeli stal ogrzaną do temperatury powyżej 1100
o
C bardzo
szybko ochłodzimy (na przykład przez zanurzenie w
wodzie), to nie zostanie ona uczulona na korozję
międzykrystaliczną. Czas przebywania w uczulającym
zakresie temperatur będzie zbyt krótki, aby węgiel mógł
przedyfundować do granic ziaren i przereagować z
chromem. Poważny wpływ na rozwój korozji miedzy
krystalicznej ma rozmiar ziarna w stali. Mniej korzystna
jest struktura gruboziarnista. Wzrost ziarna występuje pod
wpływem przekroczenia temperatury hartowania oraz zbyt
długiego przetrzymywania w zakresie wysokich temperatur
(1100 do 1200°C). Praktyczne zastosowanie znalazły trzy
sposoby eliminowania korozji międzykrystalicznej:
przesycanie, obniżanie zawartości węgla, oraz stabilizacja.


Stal 304 L z niską zawartością węgla
(0,03%)

Formy korozji - selektywna
Stopy metalu szlachetnego i aktywnego (na
przykład
brąz: Cu + Zn)
Jeden ze składników stopu może ulegać roztwarzaniu
pozostawiając osnowę wykonaną z metalu szlachetnego
Odcynkowanie mosiądzów
Grafityzacja żeliwa
Korozja duraluminium ( AL + Cu )
Powoduje utratę właściwości mechanicznych bez widocznych zmian
kształtu

Formy korozji – erozja korozja
Korozja przyspieszana przez
uderzenia cząstek stałych lub
pęcherzy gazów znajdujących
się w strumieniu cieczy

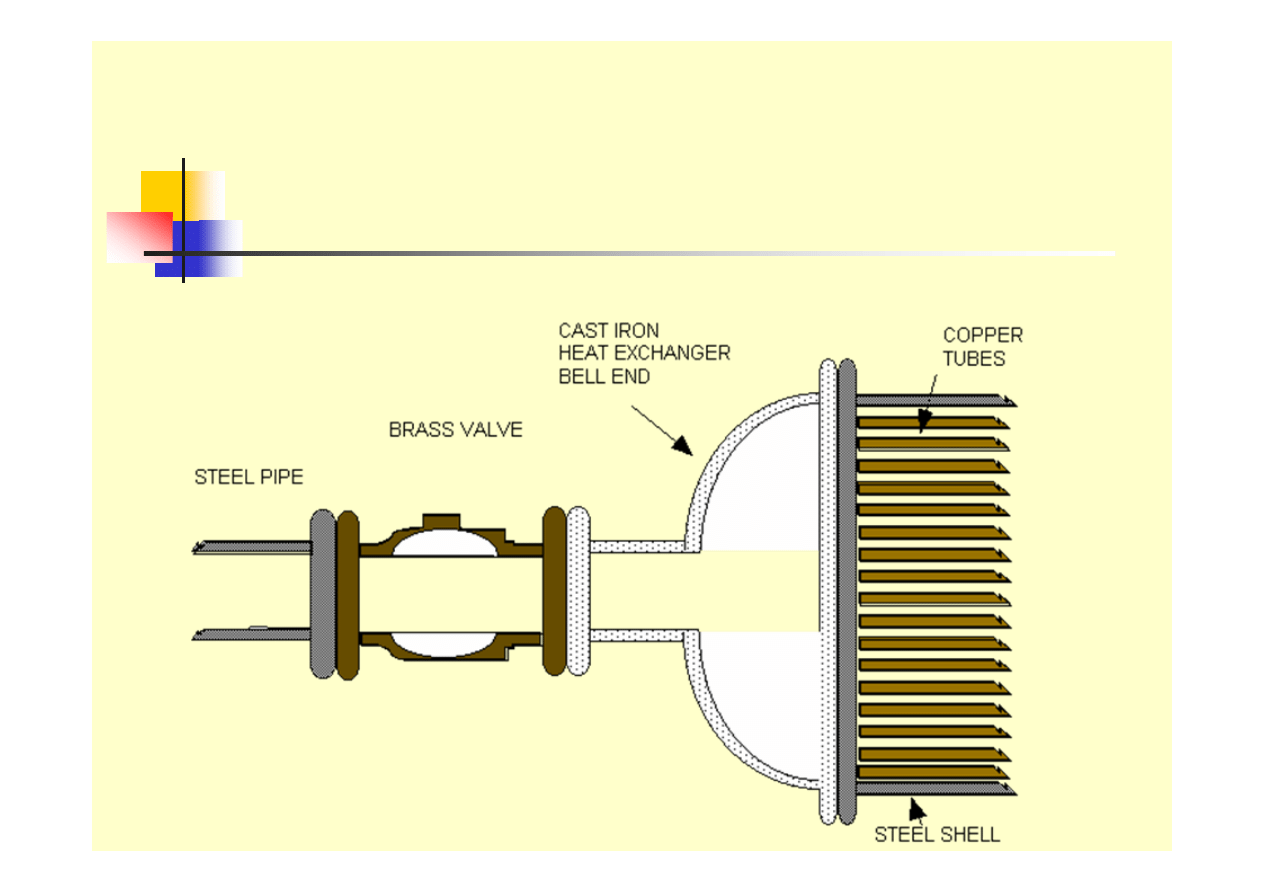
Chłodnica wodna refluksu regeneratora w rafinerii –
erozja płaszcza przy króćcu wylotowym

Korozja-erozja w górnej części płaszcza wyparki
regeneratora aminy w rafinerii

Erozja
kawitacyjna
wymiennika
ciepła
w rafinerii

Formy korozji
Korozja
naprężeniowa
Specyficzne współdziałanie
środowiska
korozyjnego i
naprężeń
.

Ochrona przed korozją
Podstawowym celem ochrony przed
korozją jest
zmniejszenie szybkości
korozji do akceptowalnego poziomu.

Metody ochrony przed korozją
z
Ochrona powłokowa
(uniwersalna, powszechna
– ponad 80% zabezpieczeń)
z
Ochrona elektrochemiczna
(w zanurzeniu,
zwykle uzupełnienie ochrony powłokowej)
Ochrona katodowa (protektorowa lub zewnętrzne
zasilanie prądem stałym
Ochrona anodowa.
z
Modyfikacja środowiska
(inhibitory, odtlenianie,
klimatyzacja, opakowania, osuszanie)

Metody ochrony przed korozją
z
Dobór materiałów
Stopy metali
Kompozyty
Nanowarstwy
z
Odpowiednie projektowanie konstrukcji
Projekt konstrukcji powinien uwzględniać
przygotowanie powierzchni, nakładanie powłok lub
wykładzin, nadzór i renowację systemu ochronnego.

Ochrona powłokowa
Zadaniem ochrony powłokowej jest
oddzielenie środowiska korozyjnego
od konstrukcji podlegającej
ochronie



Ochrona elektrochemiczna
Zmiana potencjału w kierunku wartości
aktywnych
Zmniejszenie różnic potencjałów w ogniwie
korozyjnym (zwykle o 150-300 mV)
Zastosowanie: konstrukcje pod wodą, lub
osadzone w gruncie
Zwykle ochrona kombinowana, stosowana łącznie
z powłokami ochronnymi
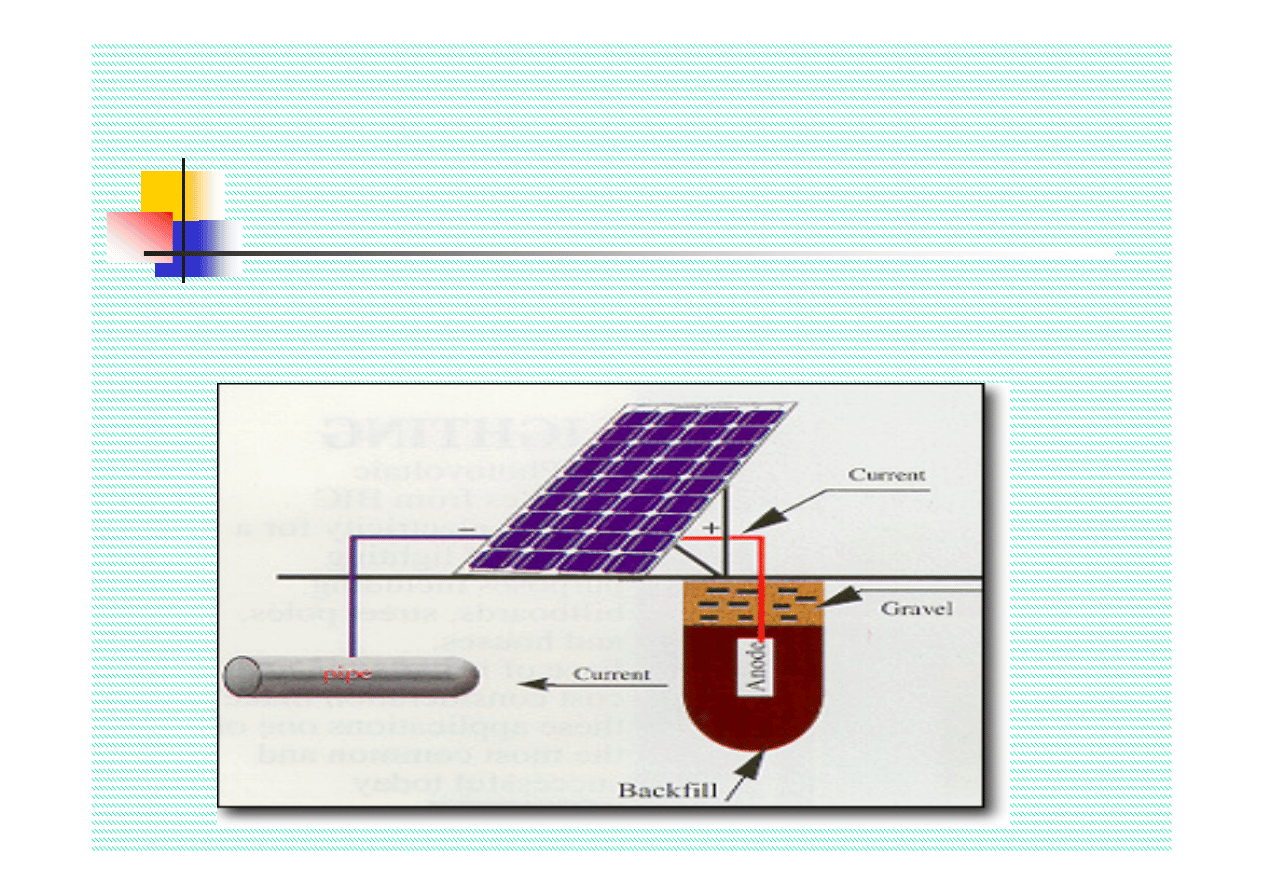
Ochrona elektrochemiczna
Dwa sposoby realizacji ochrony katodowej
:
1. Polaryzacja z zewnętrznego źródła prądu
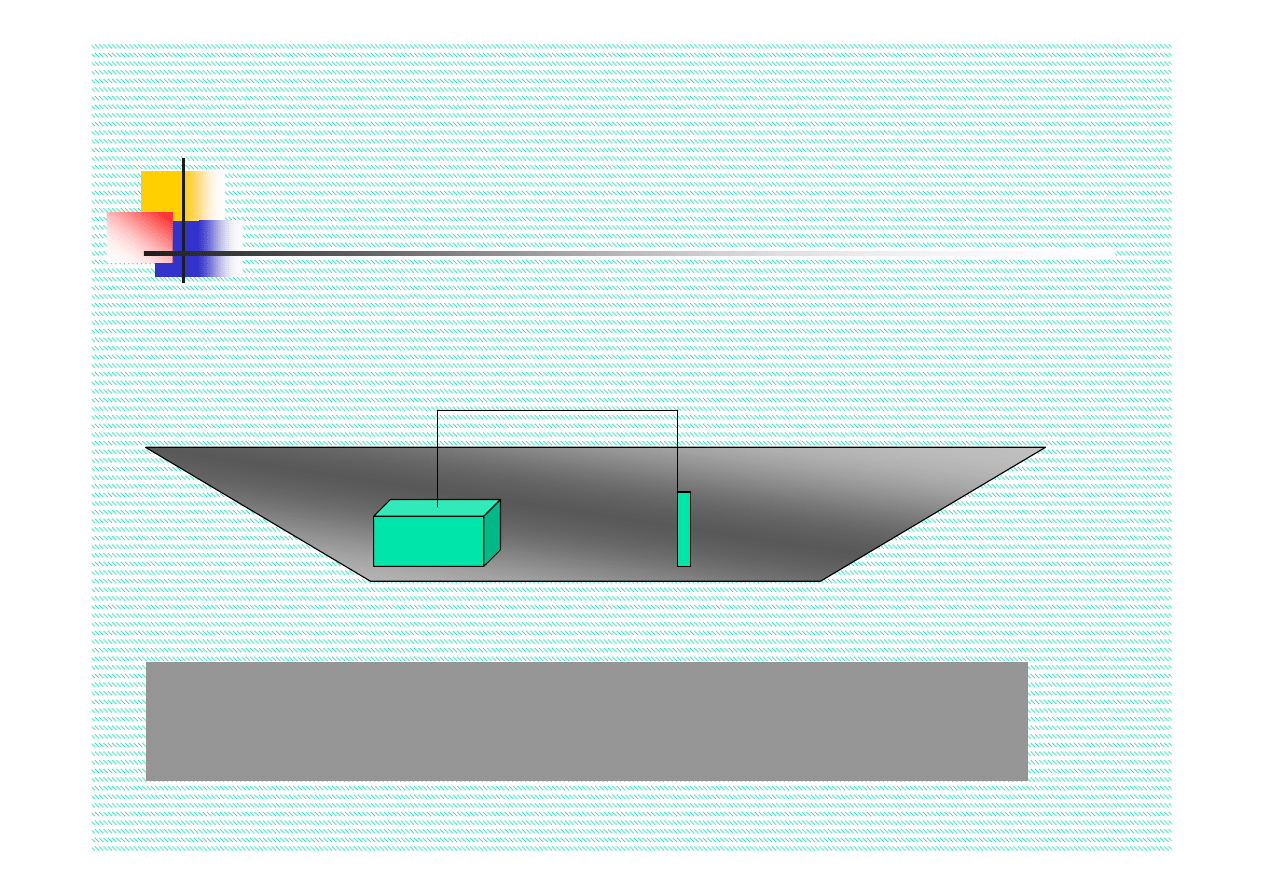
Ochrona elektrochemiczna
2. Podłączenie konstrukcji do roztwarzalnych anod
Typowe anody roztwarzalne:
Cynk, magnez i aluminium
Modyfikacja środowiska
Ograniczanie wilgotności atmosfery
Zmniejszenie zawartości tlenu
Dodatek inhibitorów korozji
Korekta pH (głównie alkalizacja)
Zmniejszenie temperatury
Dodatek biocydów

Dobór materiałów
Katalogi danych dotyczących szybkości korozji
większości metali technologicznych w różnych
środowiskach korozyjnych.

Monitorowanie korozji
W celu kontroli procesów korozyjnych
monitorujemy
Czynniki powodujące korozję
Parametry korodującego obiektu
Document Outline
- Podstawy korozji
- Definicja
- Wprowadzenie
- Przykłady zaatakowań korozyjnych
- Przykłady zaatakowań korozyjnych
- Czynniki wpływające na korozję
- Rodzaje korozji
- Mechanizm korozji elektrochemicznej
- Rodzaje ogniw korozyjnych
- Formy korozji
- Formy korozji-ogólna
- Formy korozji - galwaniczna
- Formy korozji - galwaniczna
- Formy korozji - galwaniczna
- Formy korozji - galwaniczna
- Formy korozji - galwaniczna
- Formy korozji - galwaniczna
- Formy korozji
- Korozja wżerowa
- Korozja wżerowa
- Formy korozji - szczelinowa
- Korozja szczelinowa
- Formy korozji
- Stal 304 L z niską zawartością węgla (0,03%)
- Formy korozji - selektywna
- Formy korozji – erozja korozja
- Formy korozji
- Ochrona przed korozją
- Metody ochrony przed korozją
- Metody ochrony przed korozją
- Ochrona powłokowa
- Ochrona elektrochemiczna
- Ochrona elektrochemiczna
- Ochrona elektrochemiczna
- Modyfikacja środowiska
- Dobór materiałów
- Monitorowanie korozji
Wyszukiwarka
Podobne podstrony:
2 15 Podstawy korozji (v4)
2 16 podstawy korozji(1)
15 Podstawy automatyki Matlabid 16181 ppt
2 15 Laboratorium spawalnictwo (v4 )
2.15 Laboratorium spawalnictwo (v4 )
15.Podstawy modelowania, Semestr VII, Semestr VII od Grzesia, Technologie informatyczne w El-En. Lab
2 15 1 badania korozji spoin (v Nieznany (2)
Fitopato 15 podstawa
2 16 podstawy korozji(1)
15 Podstawowych Zasad Kreacji Witold
10 15 Podstawa programowa program nauczania
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
2 15 3 chemikaliowiec (v4 )
Podstawy Marketingu 15.11.2009
więcej podobnych podstron