WPROWADZENIE
DO KOROZJI
IWE III
temat 2.15
4 godz.
2 godz.
pokazy

Podstawy korozji
1 Definicja
2 Wprowadzenie
3 Formy korozji
4 Metody ochrony przed korozją
5 Monitorowanie korozji

Definicja
Niszczenie materiałów, w tym metali,
będące wynikiem ich oddziaływania ze
środowiskiem.

Wprowadzenie
Korozja jest zjawiskiem naturalnym
Całkowite jej zahamowanie jest trudne
Tworzywa sztuczne korodują powoli
Procesy korozyjne są często
pożyteczne: trawienie metali, elektrody
w ogniwach (baterie), tworzenie warstw
pasywnych

Przykłady zaatakowań korozyjnych

Przykłady zaatakowań korozyjnych

Czynniki wpływające na korozję
Wewnętrzne
z
Rodzaj metalu
z
Skład chemiczny
z
Struktura
z
Stan powierzchni
z
Obróbka cieplna
z
Obróbka mechaniczna
z
Naprężenia własne
Zewnętrzne
z
Rodzaj środowiska
z
Skład środowiska
z
Temperatura
z
Prędkość przepływu
z
Ciśnienie atmosferyczne
z
Polaryzacja zewnętrzna

Rodzaje korozji
Zależnie od mechanizmu
korozja
elektrochemiczna i
chemiczna
Zależnie od środowiska
korozja wodna
korozja atmosferyczna
korozja wysoko temperaturowa

Mechanizm korozji elektrochemicznej
Na powierzchni metalu można zlokalizować
miejsca mające charakter
anod
i
katod
Na anodach zachodzi proces utleniania:
Fe
→ Fe
+2
+ 2e
Na katodach zachodzi proces redukcji:
1/2 O
2
+ H
2
O + 2e = 2 OH
-
2H
+
+ 2e = H
2

Rodzaje ogniw korozyjnych
Dwa różne metale
Ogniwa stężeniowe
Ogniwo zmiennego
napowietrzenia
Ogniwo tworzone
przez działające
prądy błądzące
Ogniwo naprężeniowe
Nowy metal – stary
metal
Ogniwo
temperaturowe

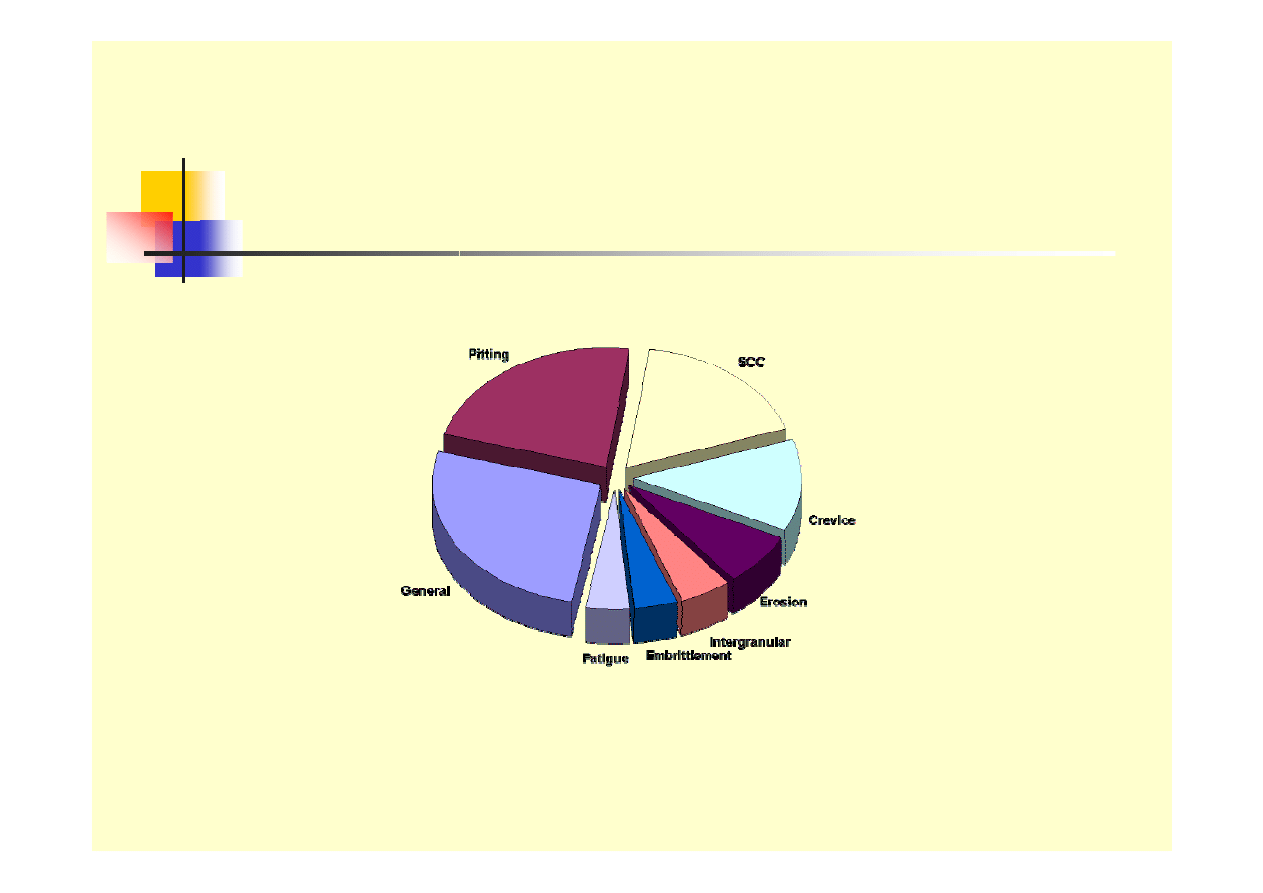
Formy korozji
Rodzaje korozji
Korozja ogólna
Korozja galwaniczna
Korozja wżerowa
Korozja szczelinowa
Korozja międzykrystaliczna (i transkrystaliczna)
Korozja selektywna
Erozja – korozja
Korozja naprężeniowa
Formy korozji

Formy korozji-
ogólna

Formy korozji - galwaniczna
Czynniki wpływające na korozję galwaniczną:
Różnica potencjałów pomiędzy metalami
Stosunek powierzchni anody do katody
Rezystancja w utworzonym ogniwie
galwanicznym
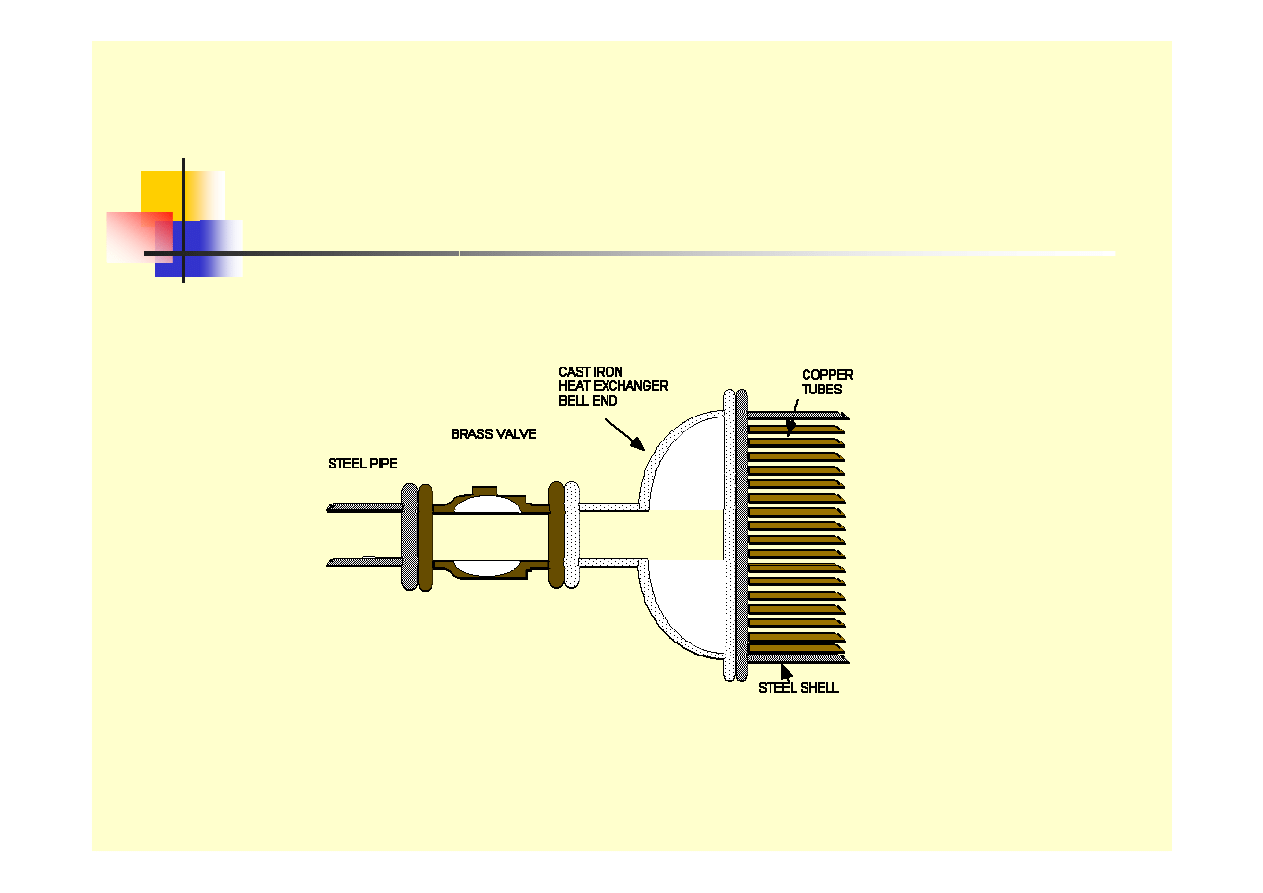
Formy korozji - galwaniczna
stal
mosiądz
żeliwo
miedź

Formy korozji - galwaniczna
Szereg napięciowy metali
Uszeregowanie metali w zależności od
wartości ich potencjałów korozyjnych
względem elektrody wodorowej (NEW)
Wskazuje na tendencję do korozji
Metale o potencjałach wyższych od NEW–
metale szlachetne
Metale o potencjałach niższych od NEW –
metale nieszlachetne (aktywne
elektrochemicznie)
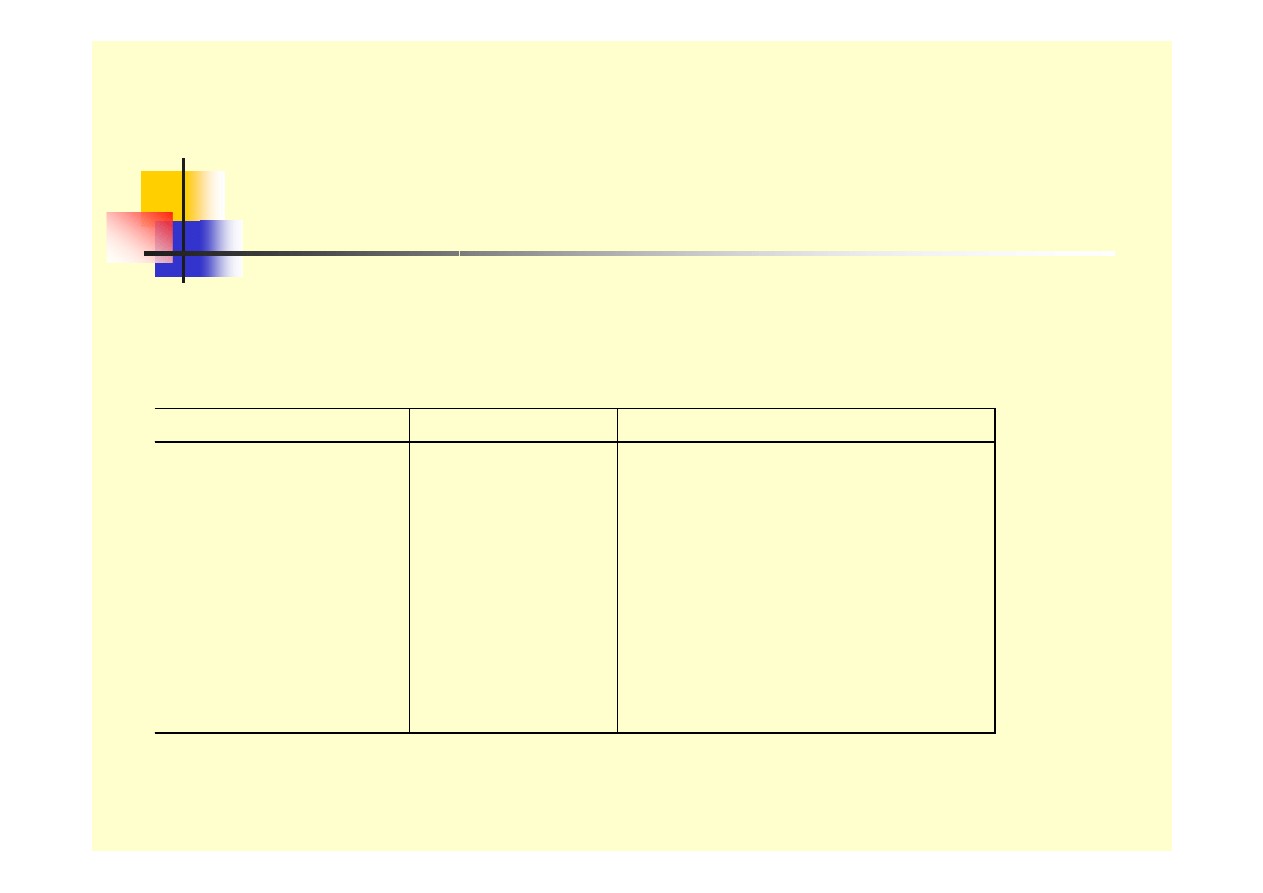
Formy korozji - galwaniczna
Tablica 1. Praktyc zny s zereg napięciow y
w ybranyc h me tali w 3 % NaCl
Metal Symbol
Pote ncjał w zględe m NE W
Platyna
Tyta n
Srebro
Miedź
Nikiel
Ołów
Żelazo
Glin
Cynk
Pt
Ti
Ag
Cu
Ni
Pb
Fe
Al.
Zn
+ 0,47 V
+ 0,37 V
+ 0,30 V
+ 0,04 V
- 0,03 V
- 0,27 V
- 0,40 V
- 0,53 V
- 0,76 V

Formy korozji - galwaniczna
Problem:
stalowa
śruba łącząca konstrukcję
wykonaną z
brązu
śruba z brązu
łącząca konstrukcję
stalową
.
Stal w układzie jest
anodą
,
brąz jest
katodą
.
Formy korozji - galwaniczna
c
Mała katoda z brązu w
niewielkim stopniu
wpływa na szybkość
korozji dużej anody
(stal).
Mała stalowa anoda
(śruba) będzie ulegała
wzmożone korozji w
połączeniu z dużą
powierzchnią brązu.
Formy korozji
Korozja wżerowa
Korozja wżerowa jest jedną z postaci
korozji lokalnej.
Charakteryzuje się tym, że atak zlokalizowany jest na
niewielkich, dyskretnych miejscach na powierzchni metalu.
Korozja wżerowa ma miejsce głównie w obojętnych i kwaśnych
roztworach zawierających
chlorki lub inne halogenki.
Miejscami
inicjacji korozji wżerowej mogą być
wtrącenia niemetaliczne
, lub
mikro-szczeliny
powstające podczas obróbki mechanicznej.
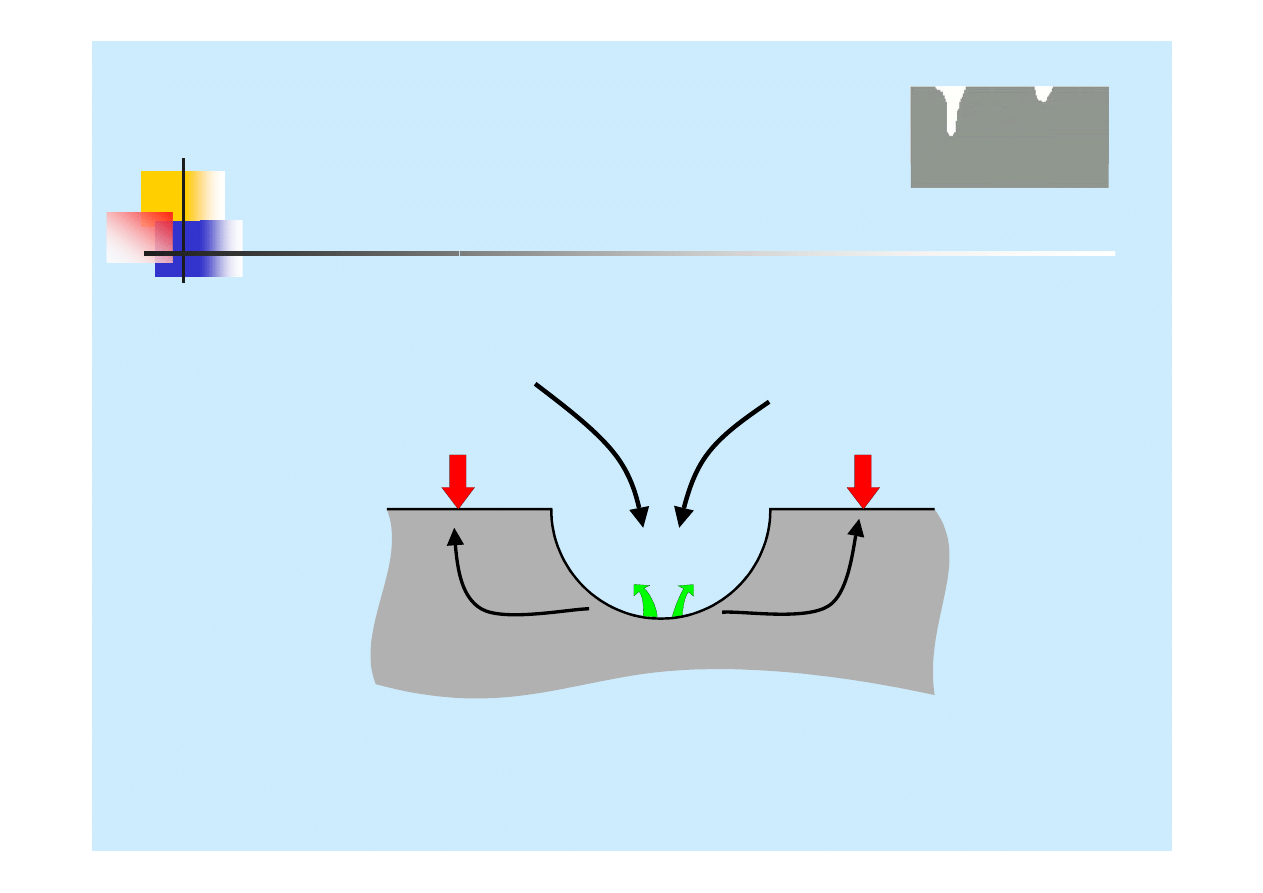
Korozja wżerowa
Cl
-
Cl
-
O
2
O
2
Cr
3+
Cr
3+
3e
3e

Korozja wżerowa
Korozja wżerowa
stali odpornych na korozję
i stopów niklu
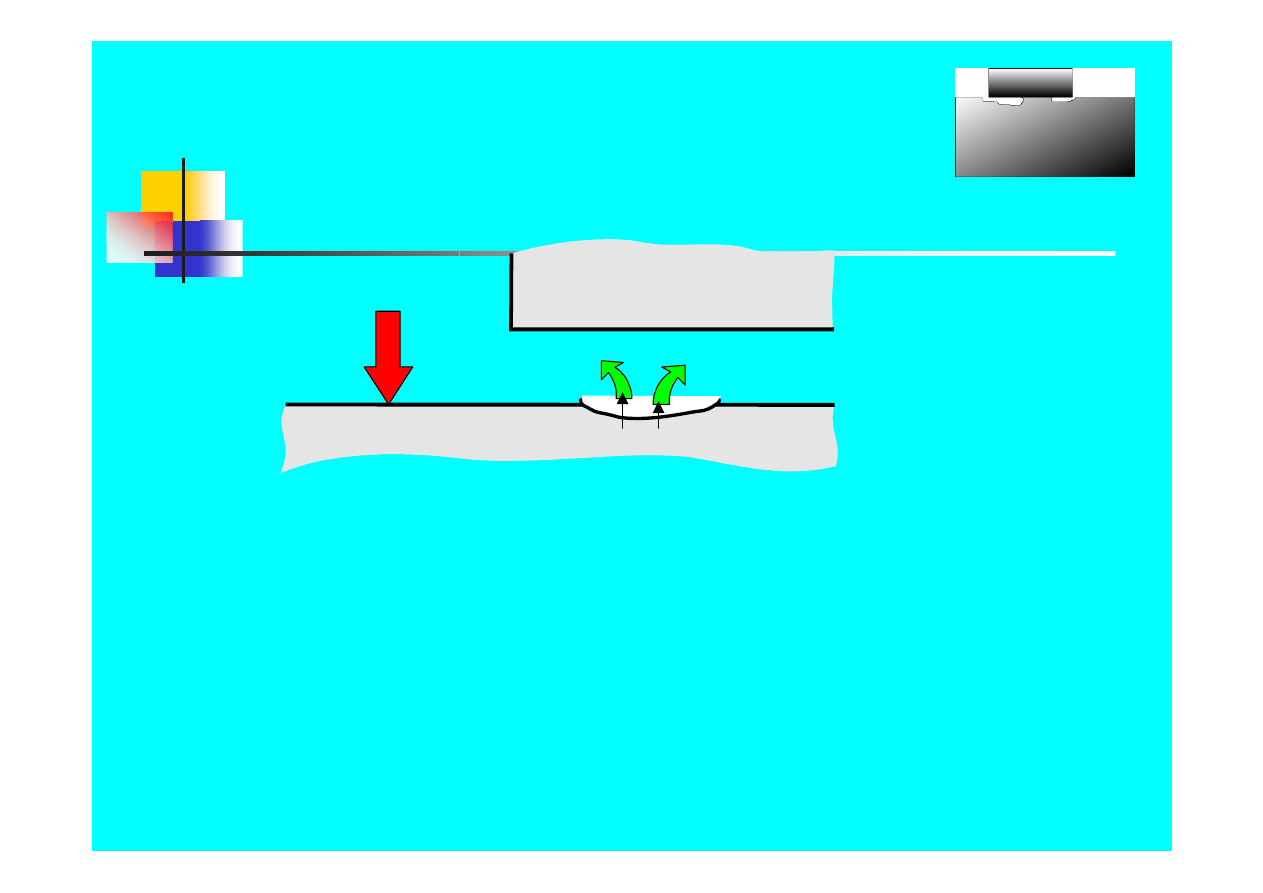
Formy korozji - szczelinowa
Metal
O
2
Cr
3+
Metal
Cr
3+
1.
Tlen jest zużywany
w elektrolicie w szczelinie w procesie
korozji; stan pasywny występuje wokół szczeliny
2. Wartość
pH spada
w wyniku hydrolizy CrCl
3
wewnątrz
wżeru
3.
Niszczenie warstwy pasywnej
w kwasie wewnątrz wżeru
4. Dalsze
zakwaszenie środowiska
wewnątrz wżeru
i rozwój korozji szczelinowej

Korozja szczelinowa

Kolumna destylacyjna, 316 SS, 120 C, kilka lat
kwas octowy + mrówkowy i propionowy

Korozja szczelinowa w środkowej części wyparki od
strony wylotu aminy

Formy korozji
Korozja
międzykrystaliczna
Jeżeli
węgliki chromu
wytrącają
się na granicy ziaren to
oznacza, że stal uległa
uczuleniu.
W warunkach rzeczywistych
uczulenie
następuje
w strefie
oddziaływania ciepła
podczas
prac spawalniczych.


Stal 304 L z niską zawartością węgla
(0,03%)

Formy korozji - selektywna
Stopy metalu szlachetnego i aktywnego (na
przykład
brąz: Cu + Zn)
Jeden ze składników stopu może ulegać roztwarzaniu
pozostawiając osnowę wykonaną z metalu szlachetnego
Odcynkowanie mosiądzów
Grafityzacja żeliwa
Korozja duraluminium ( AL + Cu )
Powoduje utratę właściwości mechanicznych bez widocznych zmian
kształtu

Formy korozji – erozja korozja
Korozja przyspieszana
przez uderzenia cząstek
stałych lub pęcherzy gazów
znajdujących się w
strumieniu cieczy
Usuwanie tlenków, usuwanie metalu, korozja
spowodowana przepływem, kawitacja

Korozja erozja
H
2
S + NH
3
Strumień dwufazowy:
*woda nasycona H
2
S +3-6% NH
3
*gaz - H
2
S nasycony parą wodną
Chłodnica wodna refluksu regeneratora
60
→45 C
gaz 2000 Nm3/h
ciecz 3000 kg/h
erozja płaszcza przy króćcu wlotowym
wżerki (pin points na rurkach 1H18N10T)
inicjacja korozji szczelinowej rurek
Monitorowanie grubości ścianek
Symetryczne układy

Chłodnica wodna refluksu regeneratora - erozja płaszcza
przy króćcu wylotowym

Korozja-erozja w górnej części płaszcza wyparki
regeneratora aminy


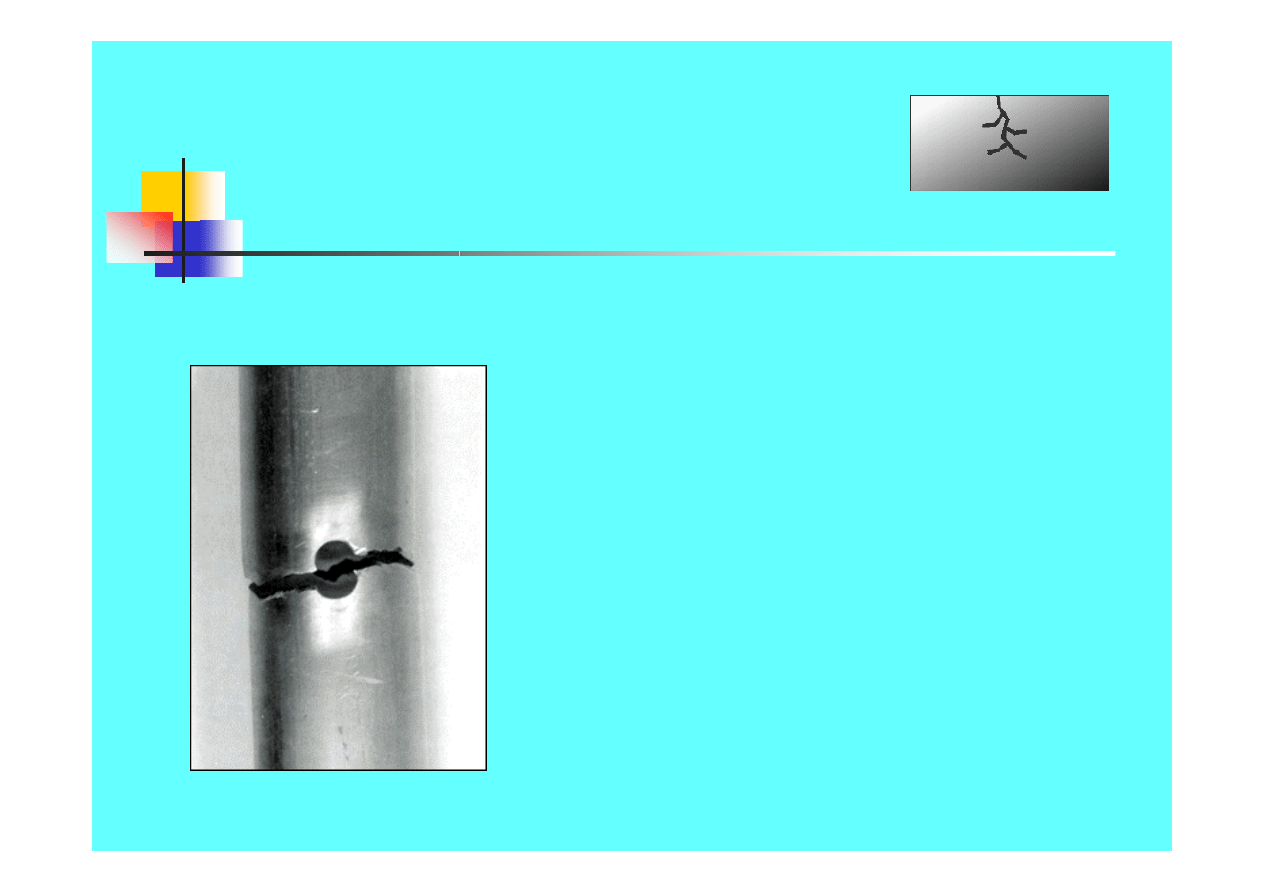
Formy korozji
Korozja
naprężeniowa
Specyficzne współdziałanie
środowiska
korozyjnego i
naprężeń
.

Ochrona przed korozją
Podstawowym celem ochrony przed
korozją jest
zmniejszenie szybkości
korozji do akceptowalnego poziomu.

Znaczenie ochrony przed korozją
Straty do
3 tys. $
na mieszkańca
ok. 30% strat –
brak wiedzy
Ochrona ma duże znaczenie
proekologiczne
-
pozwala unikać skażeń i chroni instalacje
ochrony środowiska (IOS, oczyszczalnie)
Ochrona przeciwkorozyjna jest ciągle
niedoceniana
przez decydentów,
projektantów i wykonawców

Metody ochrony przed korozją
z
Ochrona powłokowa
(uniwersalna, powszechna
– ponad 80% zabezpieczeń)
z
Ochrona elektrochemiczna
(w zanurzeniu,
zwykle uzupełnienie ochrony powłokowej)
Ochrona katodowa (protektorowa lub zewnętrzne
zasilanie prądem stałym
Ochrona anodowa.
z
Modyfikacja środowiska
(inhibitory, odtlenianie,
klimatyzacja, opakowania, osuszanie)

Metody ochrony przed korozją
z
Dobór materiałów
Stopy metali
Kompozyty
Nanowarstwy
z
Odpowiednie projektowanie konstrukcji
Projekt konstrukcji powinien uwzględniać
przygotowanie powierzchni, nakładanie powłok lub
wykładzin, nadzór i renowację systemu ochronnego.

Ochrona powłokowa
Zadaniem ochrony powłokowej jest
oddzielenie
środowiska korozyjnego od
konstrukcji
podlegającej ochronie.

Ochrona elektrochemiczna
z
Zmiana potencjału w kierunku wartości
aktywnych, poniżej potencjału mikro-anod
(zwykle o 150-300 mV)
z
Zastosowanie: konstrukcje
pod wodą,
lub osadzone
w gruncie
z
Zwykle ochrona kombinowana, stosowana łącznie z
powłokami ochronnymi
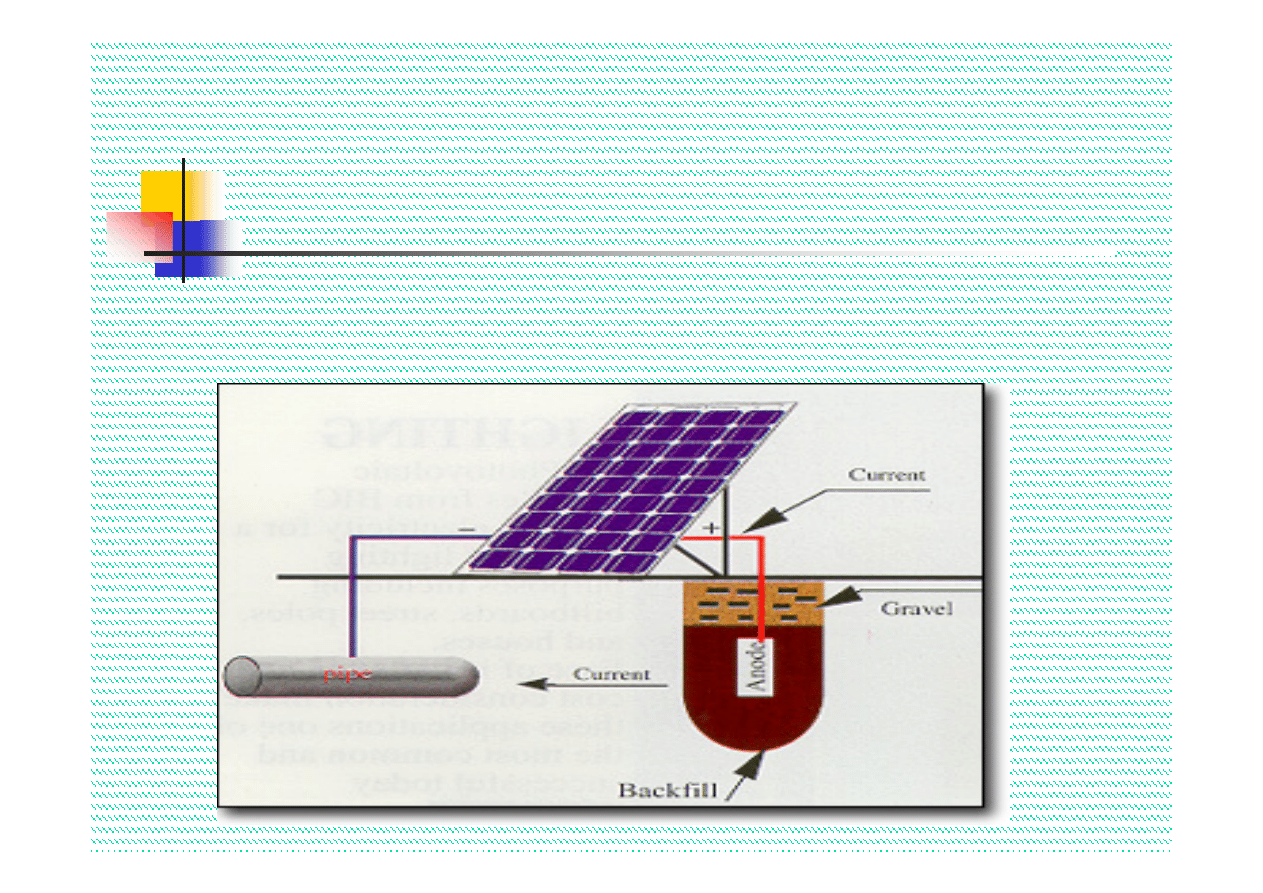
Ochrona elektrochemiczna
Dwa sposoby realizacji ochrony katodowej
:
1. Polaryzacja z zewnętrznego źródła prądu

Ochrona elektrochemiczna
2. Podłączenie konstrukcji do roztwarzalnych anod
Typowe anody roztwarzalne:
Cynk, magnez i aluminium

Modyfikacja środowiska
Ograniczanie wilgotności atmosfery
Zmniejszenie zawartości tlenu
Dodatek inhibitorów korozji
Korekta pH (głównie alkalizacja)
Zmniejszenie temperatury
Dodatek biocydów

Dobór materiałów
Katalogi danych dotyczących szybkości
korozji większości metali technologicznych w
różnych środowiskach korozyjnych.

Monitorowanie korozji
W celu kontroli procesów korozyjnych
monitorujemy
Czynniki powodujące korozję
Parametry korodującego obiektu
Wyszukiwarka
Podobne podstrony:
2 15 podstawy korozji (v4 )
2 16 podstawy korozji(1)
15 Podstawy automatyki Matlabid 16181 ppt
2 15 Laboratorium spawalnictwo (v4 )
2.15 Laboratorium spawalnictwo (v4 )
15.Podstawy modelowania, Semestr VII, Semestr VII od Grzesia, Technologie informatyczne w El-En. Lab
2 15 1 badania korozji spoin (v Nieznany (2)
Fitopato 15 podstawa
2 16 podstawy korozji(1)
15 Podstawowych Zasad Kreacji Witold
10 15 Podstawa programowa program nauczania
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
2 15 3 chemikaliowiec (v4 )
Podstawy Marketingu 15.11.2009
więcej podobnych podstron