WPROWADZENIE
DO KOROZJI
EWE III
temat 2.16
4 godz.

Podstawy korozji
1 Definicja
2 Wprowadzenie
3 Formy korozji
4 Metody ochrony przed korozją
5 Monitorowanie korozji

Definicja
Niszczenie materiałów, w tym metali,
będące wynikiem ich oddziaływania ze
środowiskiem.
Wprowadzenie
Korozja jest zjawiskiem naturalnym
Całkowite jej zahamowanie jest trudne
Tworzywa sztuczne korodują powoli
Procesy korozyjne są często
pożyteczne: trawienie metali, elektrody
w ogniwach (baterie), tworzenie warstw
pasywnych

Przykłady zaatakowań korozyjnych

Przykłady zaatakowań korozyjnych

Czynniki wpływające na korozję
Wewnętrzne
z
Rodzaj metalu
z
Sk
ład chemiczny
z
Struktura
z
Stan powierzchni
z
Obróbka cieplna
z
Obróbka mechaniczna
z
Naprężenia w
łasne
Zewnętrzne
z
Rodzaj środowiska
z
Sk
ład środowiska
z
Temperatura
z
Prędkość przep
ływu
z
Ciśnienie atmosferyczne
z
Polaryzacja zewnętrzna

Rodzaje korozji
Zależnie od mechanizmu
korozja
elektrochemiczna i
chemiczna
Zależnie od środowiska
korozja wodna
korozja atmosferyczna
korozja wysoko temperaturowa

Mechanizm korozji elektrochemicznej
Na powierzchni metalu można zlokalizować
miejsca mające charakter
anod
i
katod
Na anodach zachodzi proces utleniania:
Fe
→ Fe
+2
+ 2e
Na katodach zachodzi proces redukcji:
1/2 O
2
+ H
2
O + 2e = 2 OH
-
2H
+
+ 2e = H
2

Rodzaje ogniw korozyjnych
Dwa różne metale
Ogniwa stężeniowe
Ogniwo zmiennego
napowietrzenia
Ogniwo tworzone
przez działające
prądy błądzące
Ogniwo naprężeniowe
Nowy metal – stary
metal
Ogniwo
temperaturowe

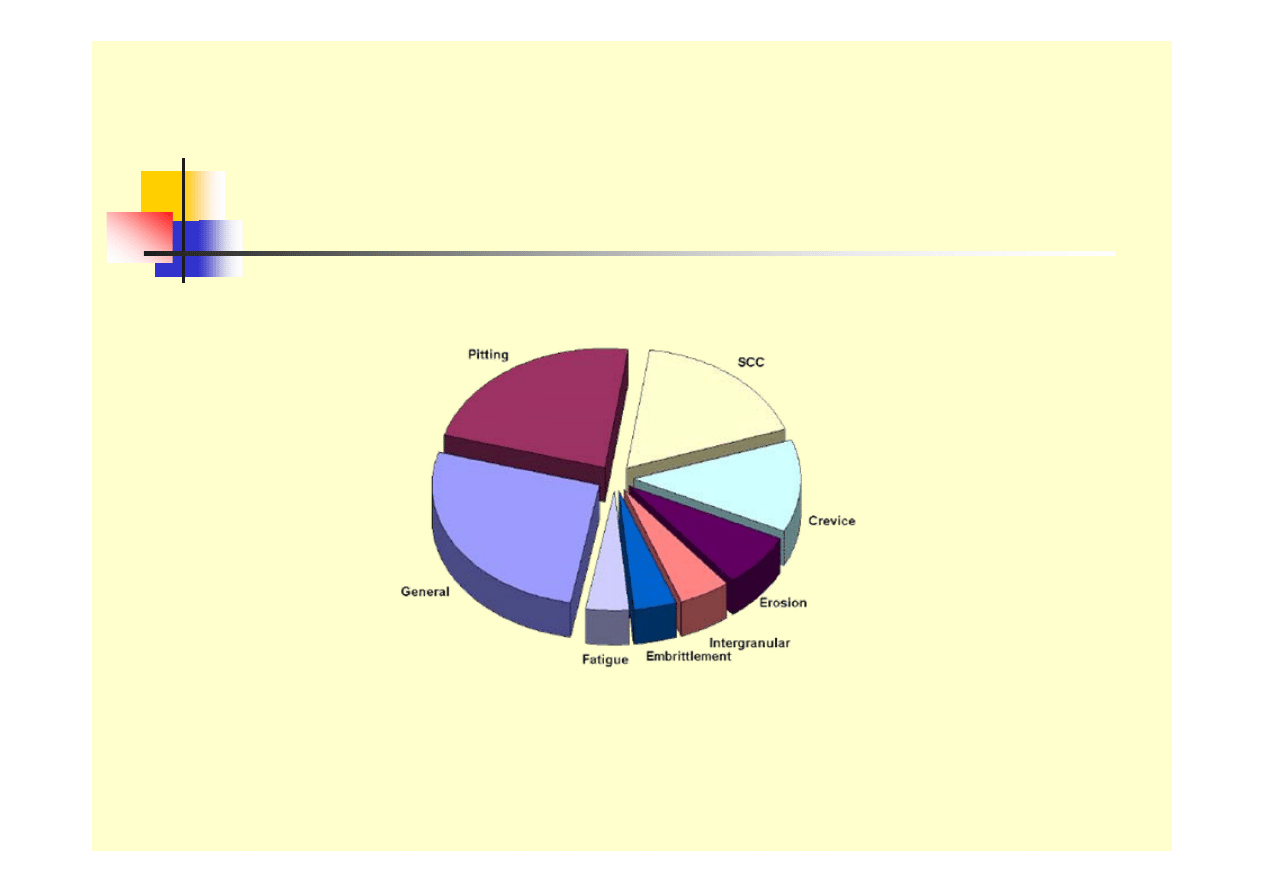
Formy korozji
Rodzaje korozji
Korozja ogólna
Korozja galwaniczna
Korozja wżerowa
Korozja szczelinowa
Korozja międzykrystaliczna (i transkrystaliczna)
Korozja selektywna
Erozja – korozja
Korozja naprężeniowa
Formy korozji

Formy korozji-
ogólna

Formy korozji - galwaniczna
Czynniki wpływające na korozję galwaniczną:
Różnica potencjałów pomiędzy metalami
Stosunek powierzchni anody do katody
Rezystancja w utworzonym ogniwie
galwanicznym
Formy korozji - galwaniczna
stal
mosiądz
żeliwo
miedź

Formy korozji - galwaniczna
Szereg napięciowy metali
Uszeregowanie metali w zależności od
wartości ich potencjałów korozyjnych
względem elektrody wodorowej (NEW)
Wskazuje na tendencję do korozji
Metale o potencjałach wyższych od NEW–
metale szlachetne
Metale o potencjałach niższych od NEW –
metale nieszlachetne (aktywne
elektrochemicznie)
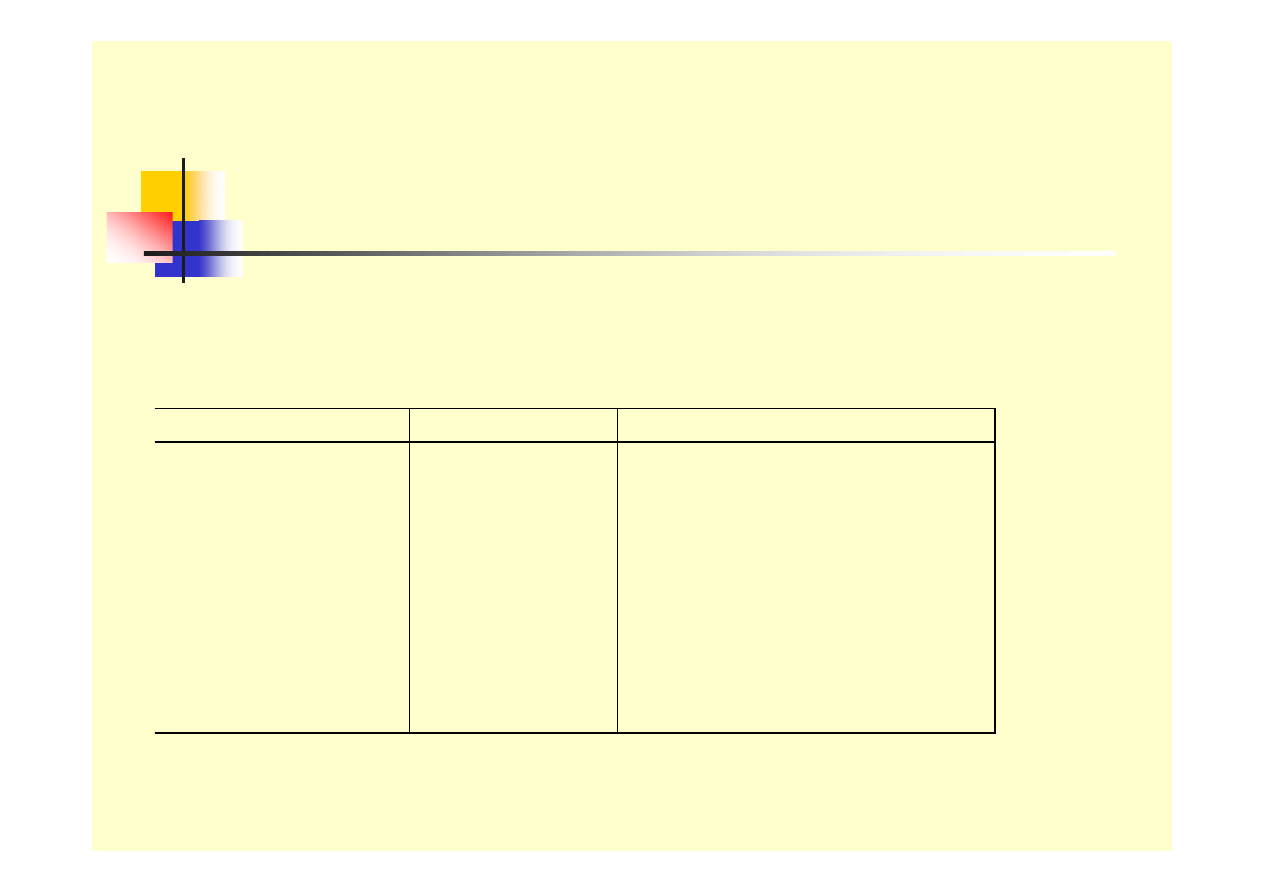
Formy korozji - galwaniczna
Tablica 1. Praktyc zny s zereg napięciow y
w ybranyc h me tali w 3 % NaCl
Metal Symbol
Pote ncjał w zględe m NE W
Platyna
Tyta n
Srebro
Miedź
Nikiel
Ołów
Żelazo
Glin
Cynk
Pt
Ti
Ag
Cu
Ni
Pb
Fe
Al.
Zn
+ 0,47 V
+ 0,37 V
+ 0,30 V
+ 0,04 V
- 0,03 V
- 0,27 V
- 0,40 V
- 0,53 V
- 0,76 V

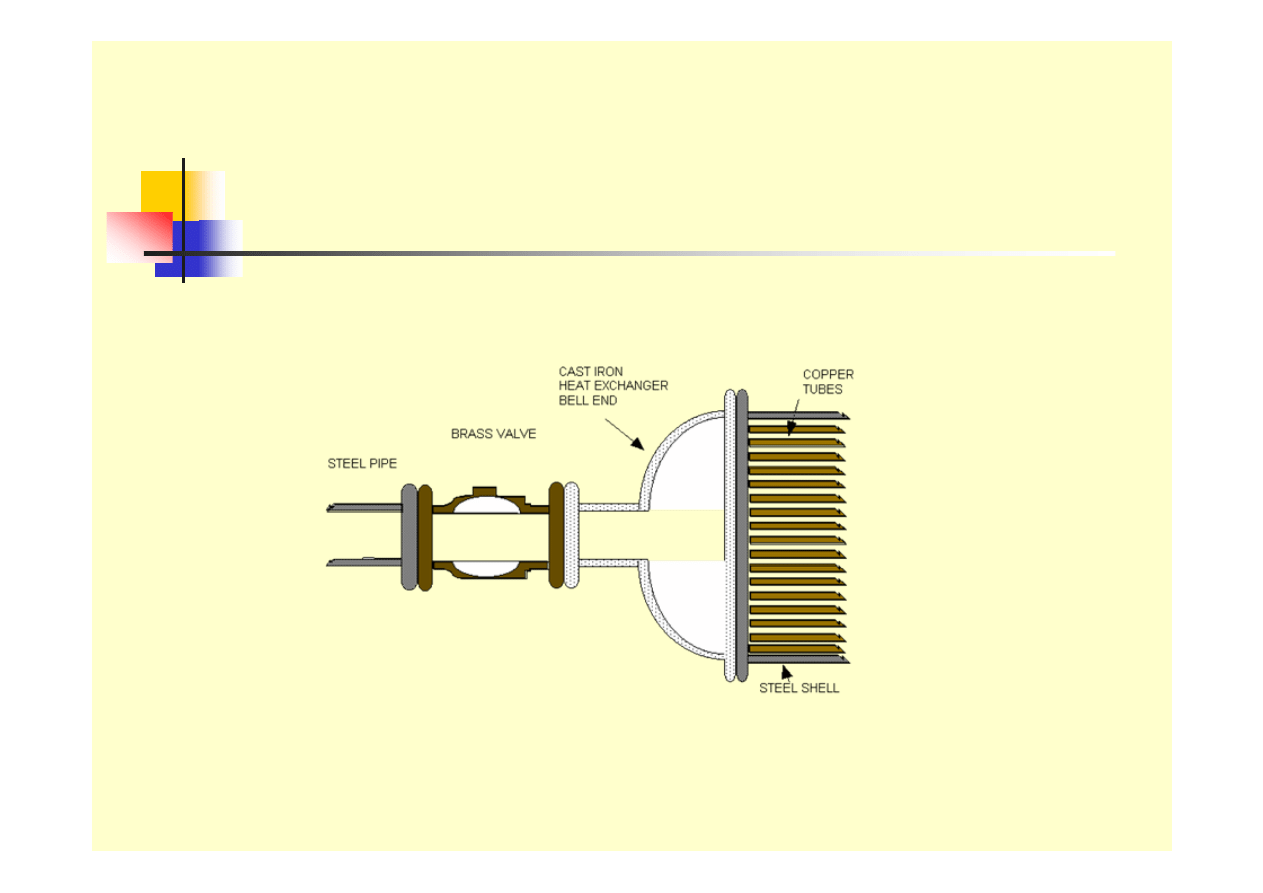
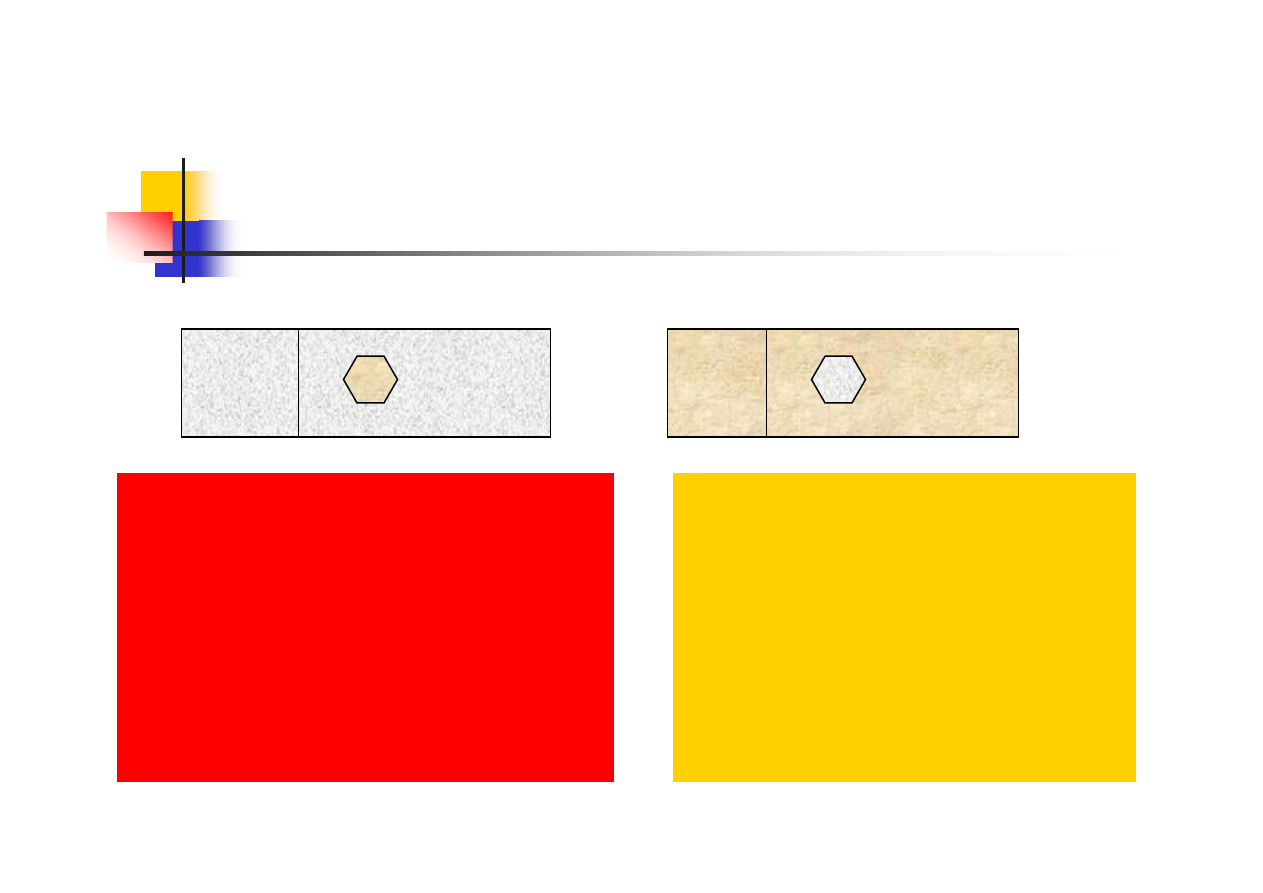
Formy korozji - galwaniczna
Problem:
stalowa
śruba łącząca konstrukcję
wykonaną z
brązu
śruba z brązu
łącząca konstrukcję
stalową
.
Stal w układzie jest
anodą
,
brąz jest
katodą
.
Formy korozji - galwaniczna
c
Mała katoda z brązu w
niewielkim stopniu
wpływa na szybkość
korozji dużej anody
(stal).
Mała stalowa anoda
(śruba) będzie ulegała
wzmożone korozji w
połączeniu z dużą
powierzchnią brązu.
Formy korozji
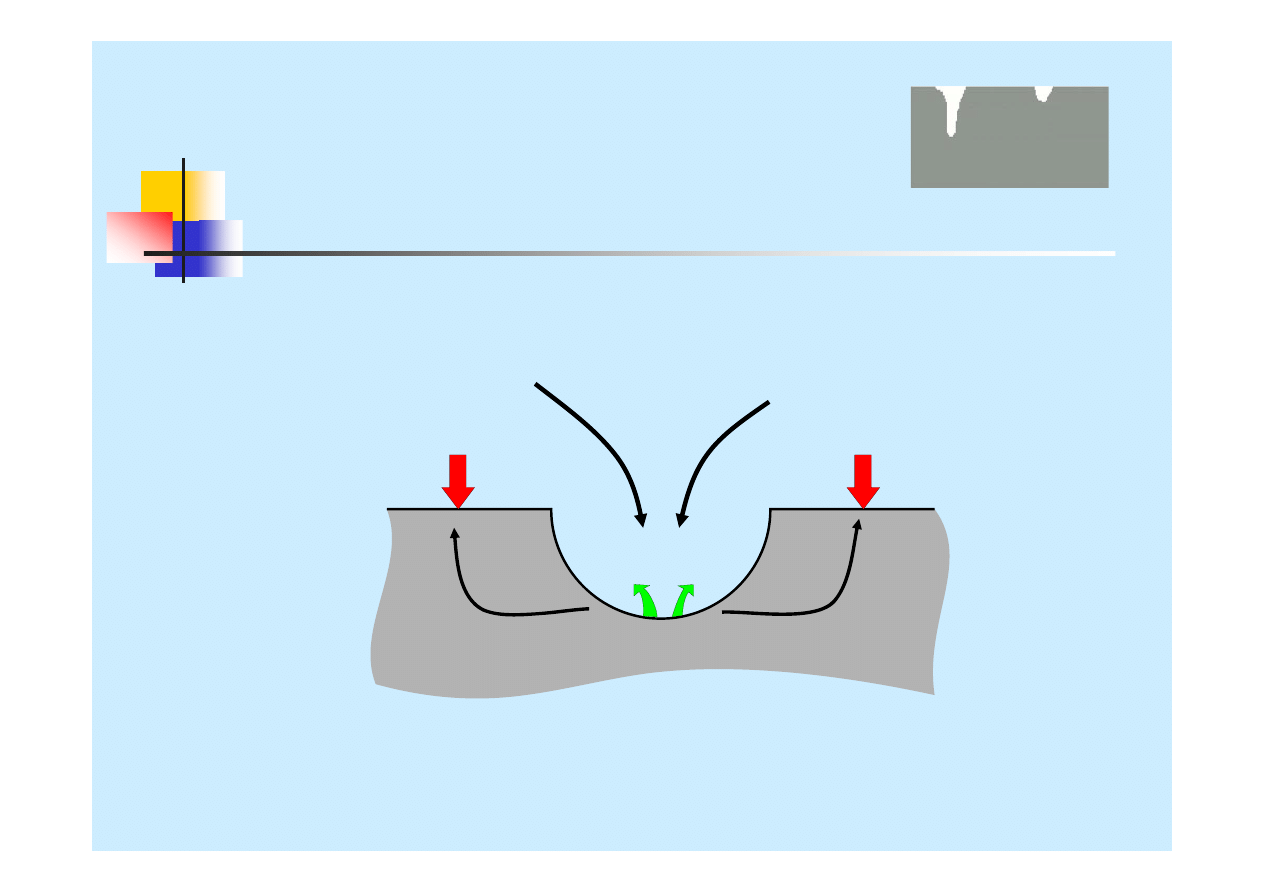
Korozja wżerowa
Korozja wżerowa jest jedną z postaci
korozji lokalnej.
Charakteryzuje się tym, że atak zlokalizowany jest na
niewielkich, dyskretnych miejscach na powierzchni metalu.
Korozja wżerowa ma miejsce głównie w obojętnych i kwaśnych
roztworach zawierających
chlorki lub inne halogenki.
Miejscami
inicjacji korozji wżerowej mogą być
wtrącenia niemetaliczne
, lub
mikro-szczeliny
powstające podczas obróbki mechanicznej.
Korozja wżerowa
O
2
O
2
Cr
3+
Cr
3+
3e
3e
Cl
-
Cl
-

Korozja wżerowa
Korozja wżerowa
stali odpornych na korozję
i stopów niklu
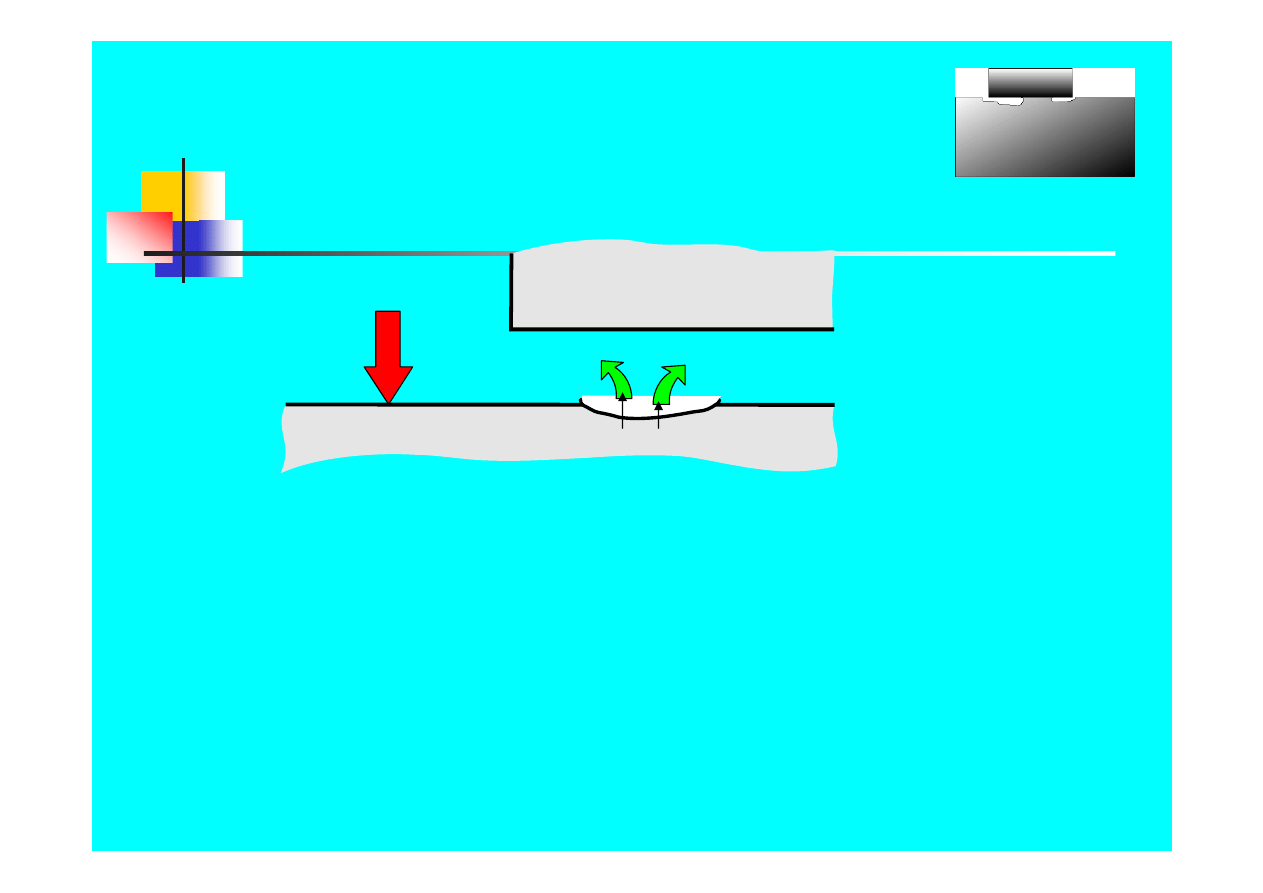
Formy korozji - szczelinowa
Metal
O
2
Cr
3+
Metal
Cr
3+
1.
Tlen jest zużywany
w elektrolicie w szczelinie w procesie
korozji; stan pasywny występuje wokół szczeliny
2. Wartość
pH spada
w wyniku hydrolizy CrCl
3
wewnątrz
wżeru
3.
Niszczenie warstwy pasywnej
w kwasie wewnątrz wżeru
4. Dalsze
zakwaszenie środowiska
wewnątrz wżeru
i rozwój korozji szczelinowej

Korozja szczelinowa

Kolumna destylacyjna, 316 SS, 120 C, kilka lat
kwas octowy + mrówkowy i propionowy

Korozja szczelinowa w środkowej części wyparki od
strony wylotu aminy

Formy korozji
Korozja
międzykrystaliczna
Jeżeli
węgliki chromu
wytrącają
się na granicy ziaren to
oznacza, że stal uległa
uczuleniu.
W warunkach rzeczywistych
uczulenie
następuje
w strefie
oddziaływania ciepła
podczas
prac spawalniczych.


Stal 304 L z niską zawartością węgla
(0,03%)

Formy korozji - selektywna
Stopy metalu szlachetnego i aktywnego (na
przykład
brąz: Cu + Zn)
Jeden ze składników stopu może ulegać roztwarzaniu
pozostawiając osnowę wykonaną z metalu szlachetnego
Odcynkowanie mosiądzów
Grafityzacja żeliwa
Korozja duraluminium ( AL + Cu )
Powoduje utratę właściwości mechanicznych bez widocznych zmian
kształtu

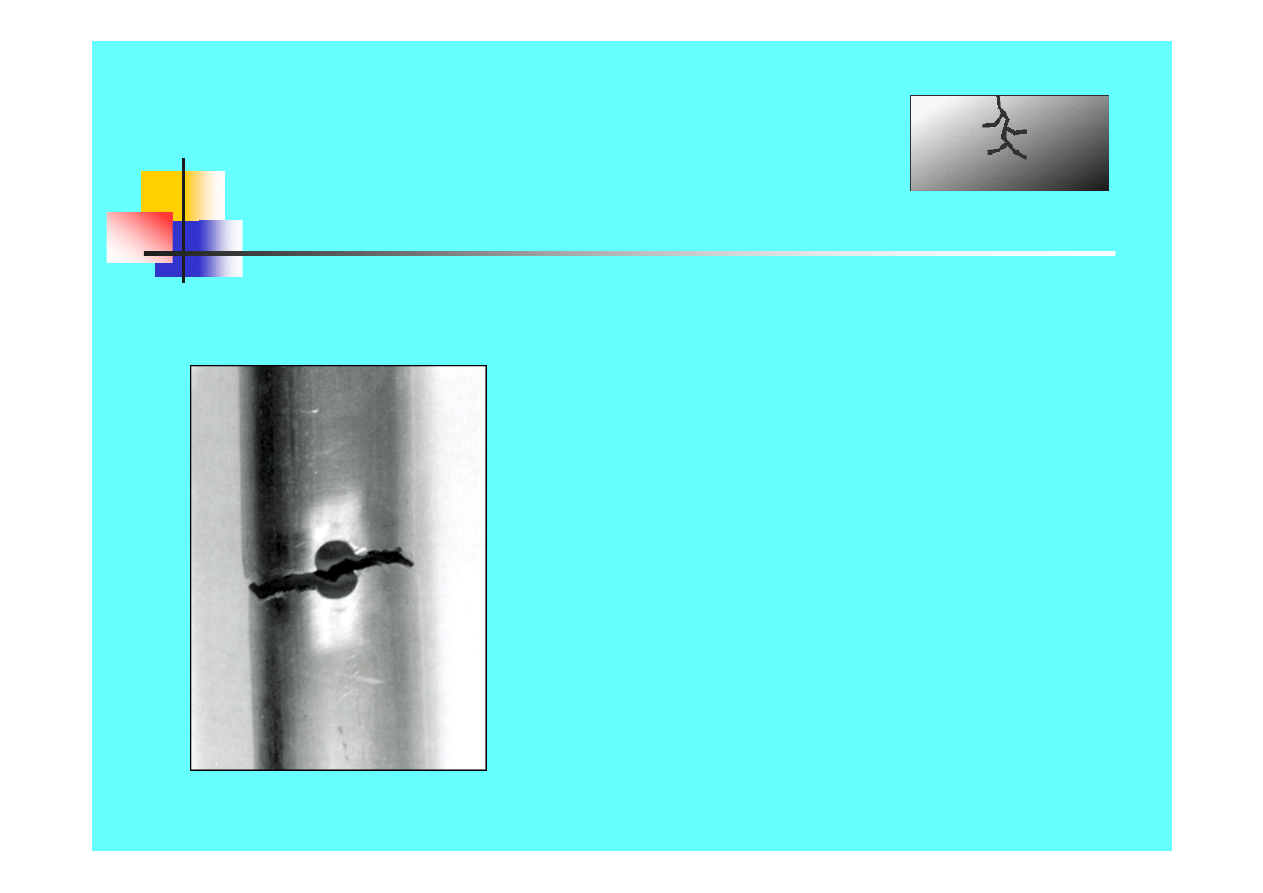
Formy korozji – erozja korozja
Korozja przyspieszana
przez uderzenia cząstek
stałych lub pęcherzy gazów
znajdujących się w
strumieniu cieczy
Usuwanie tlenków, usuwanie metalu, korozja
spowodowana przepływem, kawitacja
Korozja erozja
H
2
S + NH
3
Strumień dwufazowy:
*woda nasycona H
2
S +3-6% NH
3
*gaz - H
2
S nasycony parą wodną
Chłodnica wodna refluksu regeneratora
60
→45 C
gaz 2000 Nm3/h
ciecz 3000 kg/h
erozja płaszcza przy króćcu wlotowym
wżerki (pin points na rurkach 1H18N10T)
inicjacja korozji szczelinowej rurek
Monitorowanie grubości ścianek
Symetryczne układy

Chłodnica wodna refluksu regeneratora - erozja płaszcza
przy króćcu wylotowym

Korozja-erozja w górnej części płaszcza wyparki
regeneratora aminy


Formy korozji
Korozja
naprężeniowa
Specyficzne współdziałanie
środowiska
korozyjnego i
naprężeń
.

Ochrona przed korozją
Podstawowym celem ochrony przed
korozją jest
zmniejszenie szybkości
korozji do akceptowalnego poziomu.

Znaczenie ochrony przed korozją
Straty do
3 tys. $
na mieszkańca
ok. 30% strat –
brak wiedzy
Ochrona ma duże znaczenie
proekologiczne
-
pozwala unikać skażeń i chroni instalacje
ochrony środowiska (IOS, oczyszczalnie)
Ochrona przeciwkorozyjna jest ciągle
niedoceniana
przez decydentów,
projektantów i wykonawców

Metody ochrony przed korozją
z
Ochrona powłokowa
(uniwersalna, powszechna
– ponad 80% zabezpieczeń)
z
Ochrona elektrochemiczna
(w zanurzeniu,
zwykle uzupełnienie ochrony powłokowej)
Ochrona katodowa (protektorowa lub zewnętrzne
zasilanie prądem stałym
Ochrona anodowa.
z
Modyfikacja środowiska
(inhibitory, odtlenianie,
klimatyzacja, opakowania, osuszanie)

Metody ochrony przed korozją
z
Dobór materiałów
Stopy metali
Kompozyty
Nanowarstwy
z
Odpowiednie projektowanie konstrukcji
Projekt konstrukcji powinien uwzględniać
przygotowanie powierzchni, nakładanie powłok lub
wykładzin, nadzór i renowację systemu ochronnego.

Ochrona powłokowa
Zadaniem ochrony powłokowej jest
oddzielenie
środowiska korozyjnego od
konstrukcji
podlegającej ochronie.

Ochrona elektrochemiczna
z
Zmiana potencjału w kierunku wartości
aktywnych, poniżej potencjału mikro-anod
(zwykle o 150-300 mV)
z
Zastosowanie: konstrukcje
pod wodą,
lub osadzone
w gruncie
z
Zwykle ochrona kombinowana, stosowana łącznie z
powłokami ochronnymi
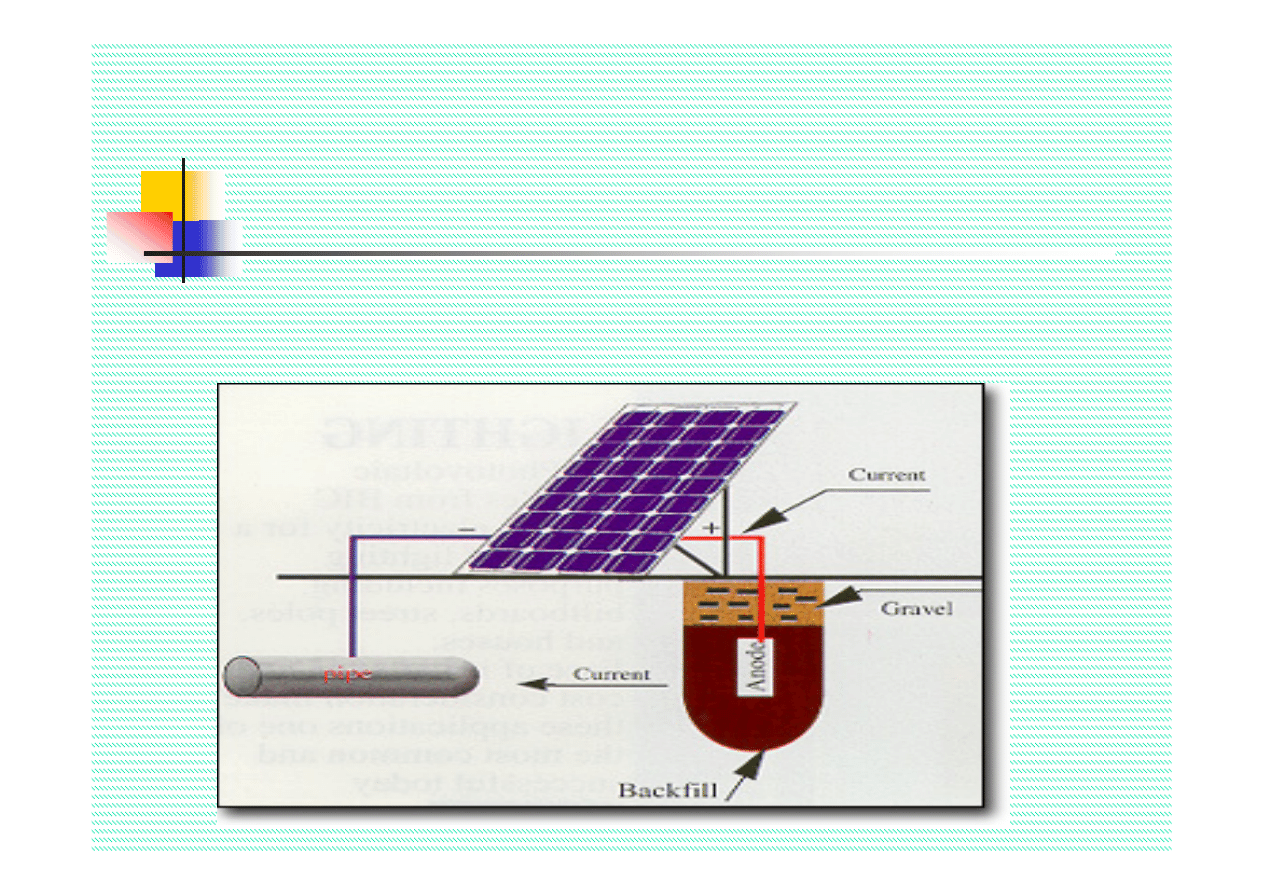
Ochrona elektrochemiczna
Dwa sposoby realizacji ochrony katodowej
:
1. Polaryzacja z zewnętrznego źródła prądu
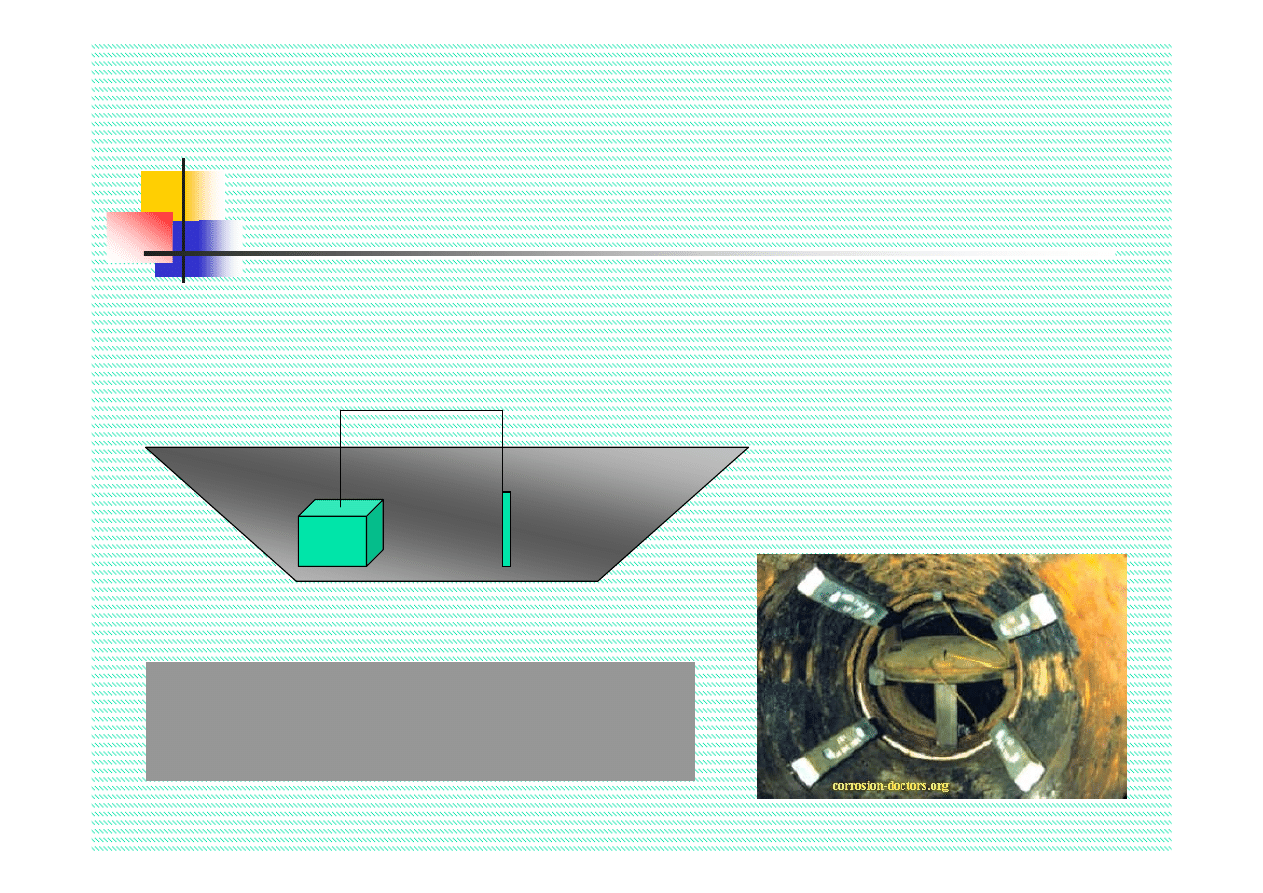
Ochrona elektrochemiczna
2. Podłączenie konstrukcji do roztwarzalnych anod
Typowe anody roztwarzalne:
Cynk, magnez i aluminium
Modyfikacja środowiska
Ograniczanie wilgotności atmosfery
Zmniejszenie zawartości tlenu
Dodatek inhibitorów korozji
Korekta pH (głównie alkalizacja)
Zmniejszenie temperatury
Dodatek biocydów

Dobór materiałów
Katalogi danych dotyczących szybkości
korozji większości metali technologicznych w
różnych środowiskach korozyjnych.

Monitorowanie korozji
W celu kontroli procesów korozyjnych
monitorujemy
Czynniki powodujące korozję
Parametry korodującego obiektu
Document Outline
- WPROWADZENIE DO KOROZJI EWE III temat 2.16
- Podstawy korozji
- Definicja
- Wprowadzenie
- Przykłady zaatakowań korozyjnych
- Przykłady zaatakowań korozyjnych
- Czynniki wpływające na korozję
- Rodzaje korozji
- Mechanizm korozji elektrochemicznej
- Rodzaje ogniw korozyjnych
- Formy korozji
- Formy korozji-ogólna
- Formy korozji - galwaniczna
- Formy korozji - galwaniczna
- Formy korozji - galwaniczna
- Formy korozji - galwaniczna
- Formy korozji - galwaniczna
- Formy korozji - galwaniczna
- Formy korozji
- Korozja wżerowa
- Korozja wżerowa
- Formy korozji - szczelinowa
- Korozja szczelinowa
- Formy korozji
- Stal 304 L z niską zawartością węgla (0,03%)
- Formy korozji - selektywna
- Formy korozji – erozja korozja
- Formy korozji
- Ochrona przed korozją
- Znaczenie ochrony przed korozją
- Metody ochrony przed korozją
- Metody ochrony przed korozją
- Ochrona powłokowa
- Ochrona elektrochemiczna
- Ochrona elektrochemiczna
- Ochrona elektrochemiczna
- Modyfikacja środowiska
- Dobór materiałów
- Monitorowanie korozji
Wyszukiwarka
Podobne podstrony:
16 Podstawy automatyki regulatory optymalne
2 15 Podstawy korozji (v4)
2 15 podstawy korozji (v4 )
16 podstawowe funkcje matematyczne 3id 16802 ppt
16 Podstawowe badanie przedmiotowe (fizykalne) pacjenta
15 16 Podstawy obróbki cieplnej metali
15 16 Podstawy obrobki cieplnej metali
Rozdz. 16., PODSTAWY AUTOMATKI
02 16 podstawy statyki zadanie 16
16 PODSTAWOWE TYPY PLANU URBANISTYCZNEGO MIAST ZAKLADANYCH NA TERENIE PANSTWA ZAKONNEGO EWELINA GOL
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
12 - 16 z WIZYTĄ W SADZIE, EDUKACJA, Plany pracy - wg. nowej podstawy programowej
więcej podobnych podstron