
PODRĘCZNIK POBIERANIA PRÓBEK
do laboratoryjnych badań diagnostycznych
chorób zakaźnych zwierząt
Opracowanie: Główny Inspektorat Weterynarii
PROJEKT WSPÓŁFINANSOWANY ZE ŚRODKÓW UNII EUROPEJSKIEJ
I BUDŻETU PAŃSTWA
Warszawa 2008

PODRĘCZNIK POBIERANIA PRÓBE K
1
Spis treści
Spis użytych skrótów ................................................................................ 3
I.
Wstęp .................................................................................................. 4
II.
Część ogólna ..................................................................................... 5
a. Ogólna procedura pobierania próbek................................ ............ 6
b. Zasady pobierania poszczególnych rodzajów materiału
biologicznego ................................ ................................ .................. 8
i. Próbki od zwierząt żywych ................................ ................. 8
ii. Próbki od zwierząt martwych (próbki post-mortem) ......... 9
iii. Próbki środowiskowe ................................ .......................... 10
c. Procedury dodatkowe związane z pobieraniem próbek
od zwierząt w stadzie podejrzanym ................................ .............. 10
d. Zestaw do pobierania materiału biologicznego do
laboratoryjnych badań w zakresie chorób zakaźnych
zwierząt (ilości minimalne) ................................................................12
III. Wytyczne pobierania próbek do diagnostyki określonych
chorób zakaźnych zwierząt z zastosowaniem właściwej
metody badawczej ........................................................................... 13
a. Bydło ................................ ................................ .............................. 14
i. Enzootyczna białaczka bydła................................ .............. 14
ii. Gąbczasta encefalopatia bydła ................................ ........... 16
iii. Gruźlica bydła ................................ ................................ ..... 18
iv. Zakaźne zapalenie nosa i tchawicy / otręt bydła ............... 20
v. Zaraza płucna bydła ................................ ........................... 21
b. Zwierzęta świniowate ................................ ................................ .... 23
i. Afrykański pomór świń ................................ ...................... 23
ii. Choroba Aujeszkyego u świń ................................ .............. 24
iii. Choroba pęcherzykowa świń ................................ .............. 27
iv. Klasyczny pomór świń ................................ ........................ 32
c. Zwierzęta jednokopytne ................................ ................................ 36
i. Afrykański pomór koni ................................ ....................... 36
ii. Niedokrwistość zakaźna koni ................................ ............. 38
iii. Nosacizna ................................ ................................ ............ 39
iv. Wirusowe zapalenie tętnic koni ................................ ......... 40
v. Zaraza stadnicza ................................ ................................ . 42
d. Małe przeżuwacze ................................ ................................ .......... 43
i. Trzęsawka owiec ................................ ................................ . 43
e. Ptaki ................................ ................................ ............................... 45
i. Chlamydioza ptaków ................................ .......................... 45
ii. Grypa ptaków ................................ ................................ ...... 46
iii. Mykoplazmy drobiu ................................ ............................ 48
iv. Rzekomy pomór drobiu ................................ ....................... 50
f. Pszczoły ................................ ................................ .......................... 52
i. Zgnilec amerykański pszczół ................................ .............. 52

PODRĘCZNIK POBIERANIA PRÓBE K
2
ii. Zgnilec europejski ................................ ............................... 54
g. Zwierzęta akwakultury ................................ ................................ . 55
i. Bonamioza ................................ ................................ ........... 55
ii. Marteilioza ................................ ................................ .......... 57
iii. Wiosenna wiremia karpi ................................ .................... 59
iv. Wirusowa posocznica krwotoczna ................................ ...... 61
v. Zakaźna anemia łososi................................ ........................ 63
vi. Zakaźna martwica układu krwiotwórczego ....................... 65
h. Różne gatunki zwierząt ................................ ................................ . 67
i. Bruceloza ................................ ................................ ............. 67
ii. Gorączka Q ................................ ................................ .......... 70
iii. Listerioza................................ ................................ ............. 72
iv. Pęcherzykowe zapalenie jamy ustnej................................ . 74
v. Pryszczyca ................................ ................................ ........... 75
vi. Wąglik ................................ ................................ ................. 81
vii. Wścieklizna ................................ ................................ ......... 83
IV.
Dane adresowe laboratoriów weterynaryjnych ....................... 85
V.
Aktualizacja i zgłaszanie uwag do Podręcznika ...................... 89
VI.
Bibliografia ....................................................................................... 90
VII. Załączniki .......................................................................................... 94
a. Załącznik 1 – Pismo przewodnie do próbek przekazywanych
do laboratoryjnych badań diagnostycznych................................ .. 95
b. Załącznik 2 – Protokół pobrania prób ................................ ........... 96
c. Załącznik 3 – Zalecany sposób pakowania materiałów
biologicznych z podejrzeniem pryszczycy i/lub choroby
pęcherzykowej świń ................................ ................................ ....... 98
d. Załącznik 4 – Protokół pobrania prób krwi od świń do badań
kontrolnych w kierunku choroby Aujeszkyego............................. 100
e. Załącznik 5 – Arkusz wyników badań w kierunku brucelozy
u bydła/kóz/owiec/świń ................................ ................................ .. 102
f. Załącznik 6 – Arkusz wyników badań w kierunku enzootycznej
białaczki bydła ................................ ................................ ............... 103
g. Załącznik 7 – Opis prawidłowo pobranej próbki do badań w
kierunku BSE z wykorzystaniem szybkich testów ...................... 104
h. Załącznik 8 – Przygotowanie płynów utrwalających ................... 105

PODRĘCZNIK POBIERANIA PRÓBE K
3
Spis użytych skrótów
SKRÓT
ZNACZENIE
AGID
Test immunodyfuzji w żelu agarowym - Agar gel immunodiffusion
c-ELISA
Kompetencyjny test immunoenzymatyczny - competitive ELISA
ELISA
Test immunoenzymatyczny - Enzyme-linked immunosorbent assay
ELISA gB
Test immunoenzymatyczny - test ELISA IBR-IPV Serum gB Blocking
HA
Hemaglutynacja
IF
Odczyn immunofluorescencji
IFAT
Metoda immunofluorescencji - Indirect Immunofluorescence Antibody Test
MIT
Test izolacji wirusa na białych myszkach
NPLA
Odczyn seroneutralizacji - Neutralising peroxidase-linked assay
OA
Odczyn aglutynacji probówkowej
OKAP
Odczyn kwaśnej aglutynacji płytowej
OWD
Odczyn wiązania dopełniacza
PCR
Reakcja polimeryzacji łańcuchowej - Polymerase chain reaction
RT-PCR
Reakcja polimeryzacji łańcuchowej z odwróconą transkrypcją - Reverse-
transcription polymerase chain reaction
SN
Test seroneutralizacji

PODRĘCZNIK POBIERANIA PRÓBE K
4
I.
Wstęp
Podręcznik pobierania próbek do laboratoryjnych badań diagnostycznych
chorób zakaźnych zwierząt, zwany dalej Podręcznikiem, jest adresowany do
wszystkich jednostek i osób pobierających próbki od zwierząt w celu:
1. diagnostyki określonych chorób zakaźnych zwierząt,
2. sprawowania nadzoru nad zdrowiem zwierząt,
3. wystawiania certyfikatów poświadczających zdrowie zwierząt,
4. monitoringu skuteczności leczenia lub szczepień.
Celem Podręcznika jest ujednolicenie postępowania jednostek i osób
pobierających wyżej wskazane próbki w zakresie:
-
procedury pobierania próbek,
-
stosowania odpowiedniego sprzętu,
-
pakowania pobranych próbek,
-
zapewnienia
odpowiednich
warunków
termicznych
przy
przechowywaniu i transporcie próbek,
-
opisu pobranych materiałów i informacji, które powinny być
przekazane do laboratorium,
-
terminowego dostarczania próbek do odpowiednich laboratoriów
diagnostycznych.
Podręcznik nie jest dokumentem prawnie wiążącym i nie może stanowić
podstawy prawnej decyzji administracyjnych.
Wersje elektroniczne załączników niniejszego Podręcznika są dostępne na
stronie internetowej Głównego Inspektoratu Weterynarii (www.wetgiw.gov.pl).

PODRĘCZNIK POBIERANIA PRÓBE K
5
II. Część ogólna
Przy podejmowaniu decyzji dotyczących próbek, które będą przekazane do
laboratorium, niezbędne jest posiadanie znaczącego zasobu wiedzy o chorobach
zakaźnych oraz odpowiednich umiejętności pobierania próbek, gdyż badanie
laboratoryjne rozpoczyna się już w momencie próbkobrania, a pobierający próbkę w
ten sposób w badaniu tym uczestniczy. Źle pobrana, niewłaściwie przechowywana
lub źle przesłana próbka może być powodem fałszywie dodatnich lub ujemnych
wyników badań laboratoryjnych lub może nie nadawać się w ogóle do analizy.
Próbki mogą być pobierane od zwierząt żywych, zwierząt padłych, poddanych
ubojowi lub zabitych, jak również ze środowiska, w celach, które podano we
Wstępie.
Próbki powinny być pobierane z uwzględnieniem celu, kierunku badania
i metody, którą będą badane, a ich wielkość i liczba powinny pozwalać na uzyskanie
statystycznie ważnych wyników.
W przypadku chorób o przebiegu klinicznym pobrane próbki powinny być
reprezentatywne dla stanu zdrowia i stwierdzonych zmian. Wskazane jest pobranie
próbek od kilku zwierząt, co stwarza większe szanse na wykrycie czynnika
zakaźnego (wirusów, bakterii).
W programach nadzoru i monitoringu zdrowia zwierząt, przy braku
klinicznych przypadków chorób, liczba próbek powinna być adekwatna do
częstotliwości występowania poszukiwanego czynnika w populacji. Ta częstotliwość
może być różna dla różnych jednostek chorobowych i różnych stad.
Pobieranie próbek powinno przebiegać z zachowaniem ostrożności
i należytej uwagi, tak, aby unikać niepotrzebnego stresu lub zranienia zwierzęcia
jak również zagrożenia dla osoby/osób zaangażowanych w procedurę próbkobrania.
Ponadto, próbki powinny być pobierane w taki sposób, aby uniknąć ich skażenia
krzyżowego.
W każdym przypadku manipulacja materiałem biologicznym pochodzącym
od zwierząt żywych lub martwych wymaga zachowania ostrożności w celu
uniknięcia potencjalnego ryzyka zakażenia chorobami odzwierzęcymi, skażenia
środowiska lub rozprzestrzenienia się choroby. W związku z powyższym, należy
właściwie zabezpieczać zwierzęta i tkanki generujące niebezpieczeństwo
skażenia.
Wszystkie pobrane próbki powinny być starannie opakowane, oznakowane
i przekazane do laboratorium w najkrótszym możliwym czasie z zachowaniem
odpowiednich wymagań termicznych.
Specyficzne wymagania w zakresie pobierania próbek do badania w kierunku
określonej choroby z zastosowaniem określonej procedury badawczej są podane w
Części III niniejszego Podręcznika.
Szczegółowe procedury pobierania próbek (postępowanie zabezpieczające,
liczba próbek, częstotliwość badania, itp.) w ramach realizacji programów

PODRĘCZNIK POBIERANIA PRÓBE K
6
zwalczania chorób lub planów gotowości, zawarte są w opracowanych
i zatwierdzonych planach i programach i powinny być przestrzegane przy
wykonywaniu czynności związanych z ich wdrażaniem.
a. Ogólna procedura pobierania próbek
Przed pobraniem próbek należy starannie przeanalizować cel, dla
którego będą one pobrane, gdyż wpłynie on zarówno na ich rodzaj i liczbę,
jak i warunki, które będą musiały być zapewnione aby uzyskać wiarygodne
wyniki.
Materiał od żywych zwierząt należy pobierać bez zadawania zwierzęciu
zbędnego bólu oraz z zachowaniem szczególnej ostrożności w celu uniknięcia
niepotrzebnego stresu lub zranienia zwierzęcia, jak również zagrożenia dla
pobierającego próbkę lub innych osób uczestniczących w próbkobraniu.
Koniecznym może być mechaniczne poskromienie zwierzęcia, zastosowanie
środków uspokajających lub narkozy.
Miejsca, z których pobierane są próby, nie mogą być odkażane, ponieważ
nawet nieznaczna ilość środka odkażającego może inaktywować zarazek.
Należy takie miejsca oczyścić lub opłukać wodą bez detergentów i środków
dezynfekcyjnych. Próbki materiału biologicznego pobiera się czystymi
jałowymi narzędziami najlepiej jednokrotnego użycia.
Pobrane próbki powinny być oznaczone liczbą bieżącą, pod którą badane
zwierzę zostało wpisane na listę w protokole pobierania próbek (Załącznik 2, 4, 5
lub 6). Pobierający próbki każdorazowo powinien sprawdzać zgodność ich
oznakowania z oznakowaniem zwierząt, tak aby nie doszło do zamiany kolejności
w protokole.
Zużyty sprzęt i odzież ochronna jednorazowego użytku powinny być
wyrzucone do wyznaczonego do tego celu, szczelnie zamykanego pojemnika i
przekazane wyspecjalizowanej jednostce do utylizacji lub zutylizowane pod
urzędowym nadzorem w gospodarstwie. Miejsce, w którym pobierano materiał
zakaźny, po zakończeniu tych czynności oczyszcza się i odkaża, a pozostały
materiał
biologiczny
i/lub
części
zwłok
zwierząt
usuwa
się
w sposób uniemożliwiający szerzenie się choroby, zgodnie z obowiązującymi
przepisami.
Z uwagi na to, że materiał biologiczny może zawierać niebezpieczne
czynniki zakaźne, każda próbka pobranego materiału powinna być
odpowiednio opakowana i transportowana z zachowaniem szczególnych
środków ostrożności. Opakowanie musi zapewniać:
- dobre zabezpieczenie próbki, tak aby w czasie transportu nie
zmieniła ona swoich cech w stopniu uniemożliwiającym otrzymanie
prawidłowego wyniku,
- całkowitą ochronę przed zakażeniem ludzi zaangażowanych
w transport próbki.

PODRĘCZNIK POBIERANIA PRÓBE K
7
Każda pobrana próbka powinna być umieszczona w mocnym szklanym
lub plastikowym sterylnym, szczelnie zamykanym pojemniku (w miarę
możliwości zakręcanym korkiem z gumową podkładką lub uszczelką)
zabezpieczającym przed wyciekiem zawartości. Zamknięcie to należy okleić
dookoła wodoodporną taśmą samoprzylepną. Powierzchnię zewnętrzną
pojemnika należy po zamknięciu starannie zdezynfekować, a następnie
opłukać czystą wodą.
Każdy pojemnik należy zaopatrzyć w etykietę zawierającą:
- numer identyfikacyjny i opis zwierzęcia,
- rodzaj i numer próbki,
- datę i miejsce pobrania.
Przekazywanym próbkom powinno towarzyszyć pismo przewodnie
wskazujące m. in. nadawcę, pochodzenie przekazywanego materiału
biologicznego wraz ze stosowną informacją na jego temat, identyfikacją zwierząt,
od których pobrano próbki oraz
wskazaniem
kierunku badania,
w celu wykonania którego próbki są przekazywane (wzór pisma przewodniego
zawarto w Załączniku 1; wzór protokołu badania, zawierającego informacje na
temat zwierząt, rodzaju próbek, terminu ich pobrania, itp., zawarty jest w
Załącznikach 2, 4, 5 i 6).
Po starannym zapakowaniu próbki, pojemnik z próbką i załączonym
pismem przewodnim umieszcza się w kontenerze, mocnym kartonie lub
pudełku drewnianym i transportuje do właściwego laboratorium zgodnie z
zachowaniem odpowiednich wymagań czasowych, temperaturowych, itp.,
zawartych w Części IV Podręcznika.
Na opakowaniu zewnętrznym kontenera (pudełka), w którym przewozi
się pobrany materiał biologiczny, należy zamieścić następujące napisy
ostrzegawcze i informacje:
Materiał biologiczny zakaźny! Nie otwierać podczas transportu!
W sytuacjach szczególnych kontaktować się z
*
.......................................................
......................................................................................................................................
......................................................................................................................................
*
Podać imiona i nazwiska lub nazwy oraz adresy i telefony nadawcy i odbiorcy.
Wskazane jest, aby osoba odpowiedzialna za pobrane próbki (Powiatowy
Lekarz Weterynarii lub osoba przez niego upoważniona), zgłosiła w laboratorium
przewidywaną datę i godzinę dostarczenia próbki, aktualne swoje dane (imię
nazwisko, adres, telefony itp.), umożliwiające nawiązanie kontaktu, jeśli okaże
się to konieczne.

PODRĘCZNIK POBIERANIA PRÓBE K
8
b. Zasady pobierania poszczególnych rodzajów materiału biologicznego
i. Próbki od zwierząt żywych
Pobieranie próbek krwi
Krew jest materiałem biologicznym najczęściej poddawanym
badaniom
laboratoryjnym:
hematologicznym,
serologicznym,
wirusologicznym, bakteriologicznym, parazytologiczn ym. W każdym
przypadku próbki powinny być pobierane jałowo, a używany sprzęt
powinien być sterylny.
Do testów serologicznych krew pobiera się „na skrzep” (probówka bez
antykolagulantów). W celu pozyskania surowicy, krew pobraną
pozostawia się w temperaturze pokojowej na około 2 godziny. Po
wydzieleniu się surowicy skrzep można oddzielić od ścian probówk i
sterylną długą igłą, a następnie próbki umieścić w lodówce w
temperaturze 4°C. Po kilku godzinach lub następnego dnia próbki można
odwirować – 1000g/10-15min., surowicę zdekantować lub przenieść pipetą
do probówek typu Ependorf.
Do pozostałych wymienionych wyżej rodzajów badań krew pobiera się
do probówek z dodatkiem środków zapobiegających krzepnięciu takich jak
sole heparyny czy kwas etyleno-dwuamino 4-octowy (EDTA). Próbki
pobrane na antykoagulant należy delikatnie wymieszać. Do wykonania
reakcji PCR preferowany jest EDTA.
U dużych zwierząt krew pobiera się z żyły jarzmowej, u świń najlepiej
z żyły czczej przedniej, a u drobiu z żyły skrzydłowej.
Pobieranie próbek kału
Kał do badań powinien być świeżo oddany lub pobrany bezpośrednio z
prostnicy.
Próbka kału nie powinna być mniejsza niż 10g. Kał do badań
parazytologicz nych
powinien
wypełniać
cały
pojemnik.
Czas
przechowywania i transportu nie powinien przekraczać 24 godzin, a
próbki należy przechowywać i transportować w temperaturze około 4°C.
Alternatywną i często zalecaną metodą jest pobieranie wymazów z
prostnicy (albo kloaki u drobiu). Wymazówka w czasie pobierania musi
mieć kontakt z błoną śluzową, a jej powierzchnia powinna być pokryta
kałem. Pobrane wymazy najlepiej przechowywać i transportować w
temperaturze 4°C.
Pobieranie próbek ze skóry
W chorobach, które powodują powstanie zmian pęcherzowych należy
pobrać z zachowaniem zasad aseptyki, o ile to możliwe, 2g tkanki
nabłonkowej, nie mniej jednak niż 1g lub o powierzchni 2 cm
2
i umieścić w 5ml buforu fosforanowego z gliceryną w równych częściach,
albo buforu tris o pH 7,2 – 7,6, najlepiej 7,4. Z pęcherzy nieuszkodzonych
należy pobrać płyn aspirując go strzykawką i przenieść do sterylnych
probówek. Transportować w temperaturze 4°C.

PODRĘCZNIK POBIERANIA PRÓBE K
9
Pobieranie próbek z układu rozrodczego
Próbki można pobierać w dwojaki sposób: płucząc pochwę lub worek
napletkowy albo poprzez pobranie wymazów. Te ostatnie można pobierać
również z szyjki macicy, jak i z samej macicy. Nasienie pobiera się za
pomocą sztucznej pochwy lub przez sztuczną stymulację prącia. Do badań
przesyła się frakcję bogatą w plemniki. Do przesyłania wymagane są
specjalne podłoża transportowe.
Pobieranie próbek z oka (worka spojówkowego) i jamy nosowej
Próbki pobiera się w sposób delikatny z powierzchni spojówki.
Wymazó wki powinny być mocowane na elastycznych aplikatorach. Ze
względów bezpieczeństwa nie używa się wymazówek z aplikatorem
drewnianym (uchwytem, rękojeścią).
Wydzielinę z nosa pobiera się wymazówką zwilżoną w podłożu
transportowym, a kontakt wymazówki z wydzieliną powinien trwać około
1 minuty.
Pobieranie próbek mleka
Przed pobraniem próbek mleka należy dokładnie oczyścić
i wysuszyć strzyk i ujście kanału strzykowego bez używania środków
dezynfekcyjnych.
Pierwsze
strumienie
mleka
należy
usunąć,
a następne pobrać do pojemnika (probówki).
Do wykonania niektórych testów można pobierać z jednego
gospodarstwa mleko zbiorcze.
Mleko do testów serologicznych nie może być zamrażane,
podgrzewane, czy też gotowane jak też poddawane gwałtownemu
wytrząsaniu. Jeżeli przesłanie próbek do laboratoriu m opóźni się, można
dodać środek konserwujący.
Próbki do badań bakteriologicznych, jeżeli jest to konieczne, można
zamrażać.
ii. Próbki od zwierząt martwych (próbki post-mortem)
Po śmierci zwierząt można pobierać próbki tkanek do
przeprowadzania badań laboratory jnych w różnych kierunkach.
Szczegółowe procedury przeprowadzania sekcji zwłok są opisane w wielu
podręcznikach z zakresu anatomii patologicznej. Lekarz przeprowadzający
sekcję powinien legitymować się dużym zasobem wiedzy z obszaru chorób
zakaźnych i patologii, która pozwoli mu dokonać właściwego wyboru
tkanek i narządów do badań.
Sprzęt niezbędny do sekcji zależy od wielkości i gatunku zwierzęcia,
ale zazwycza j niezbędne są: nóż, piła, topór, skalpele, kleszcze, pęsety,
nożyczki, w tym również z jednym ramieniem tępym do otwierania jelit.
Narzędzia do pobierania próbek powinny być jałowe.
Przeprowadzający badanie musi posiadać wystarczającą ilość
kontenerów, pojemników z podłożami transportowymi dla określonych
próbek i kierunków badań. Niezbędne jest posiadanie i używanie w czasie
sekcji odzieży ochronnej takiej jak: kombinezony, fartuchy, rękawice i buty
gumowe, a także maski ochronne na twarz i oczy. Te ostatnie są

PODRĘCZNIK POBIERANIA PRÓBE K
10
szczególnie ważne, jeżeli u zwierzęcia podejrzewamy chorobę odzwierzęcą i
istnieje potencjalne ryzyko zakażenia.
Wykaz niezbędnego sprzętu i odzieży ochronnej przedstawiony jest na
stronie 12 niniejszego Podręcznika.
iii. Próbki środowiskowe
Próbki środowiskowe mogą być pobierane w celu monitorowania
higieny w miejscu przebywania zwierząt albo mogą stanowić element
nadzoru nad drogami rozprzestrzeniania się choroby. Pobieranie próbek
środowiskowych jest szczególnie ważne w zakładach wylęgowych, stacjach
unasienniania oraz rzeźniach.
Najczęściej pobieranym materiałem jest pomiot albo ściółka, świeży
kał. Wymazy pobierane są też z powierzchni przewodów wentylacyjnych,
urządzeń do karmienia i pojenia zwierząt. Pasza może być pobierana z
urządzeń do karmienia, jak również z silosów (zbiorników).
c. Procedury dodatkowe związane z pobieraniem próbek od zwierząt
w stadzie podejrzanym
Członkowie zespołu pobierającego próbki, przed przystąpieniem do
próbkobrania, powinni omówić plan czynności, ubrać odzież ochronną,
przeprowadzić dezynfekcję osobistą, a następnie rozpocząć przegląd stada
i badanie kliniczne zwierząt podejrzanych oraz pobrać próbki. Wykonując
powyższe czynności należy zachować szczególną staranność w celu uniknięcia
rozprzestrzenienia czynnika zakaźnego.
W podejrzanym stadzie przegląd zwierząt gatunków podatnych
przeprowadza się na podstawie aktualnej księgi rejestracji znajdującej się
w każdej siedzibie stada, odrębnie dla poszczególnych gatunków zwierząt
oznakowanych i ich numerów identyfikacyjnych (jeżeli zwierzęta posiadają
indywidualne oznakowanie).
Podczas przeglądu sporządza się wykaz zwierząt chorych, podejrzanych
o chorobę lub o zakażenie, a także zapisuje się wszystkie objawy chorobowe,
które mogą świadczyć o zakażeniu. Określa się również miejsca lokalizacji
poszczególnych zwierząt w gospodarstwie.
Przegląd zwierząt rozpoczyna się w pierwszej kolejności od części,
w której znajdują się zwierzęta uznawane przez właściciela lub przedstawiciela
właściciela za zdrowe. Zwierzęta chore, podejrzane o chorobę lub zakażenie bada
się na końcu przeglądu. Jeśli zalecenia tego nie można spełnić, szczególnie gdy
stado jest liczne a pomoc niewystarczająca, przegląd z konieczności rozpoczyna
się od zwierząt podejrzanych o zakażenie, chorobę lub od chorych.
Zwierzęta przebywające na pastwisku w pobliżu gospodarstwa zapędza się
do pomieszczeń inwentarskich. Zwierzęta przebywające na pastwisku z dala od
gospodarstwa, gromadzi i bada się na pastwisku, szczególnie, gdy zachodzi
obawa, że w czasie ich przemieszczania do obór mogłoby zwiększyć się ryzyko

PODRĘCZNIK POBIERANIA PRÓBE K
11
rozprzestrzeniania czynnika zakaźnego, zainfekowania innych zwierząt lub
środowiska.
W celu zmniejszenia stresu zwierząt możliwe jest zastosowanie środków
uspokajających oraz, jeżeli jest to wskazane, miejscowego znieczulenia.
Uspokojenie i znieczulenie korzystnie wpływa zarówno na bezpieczeństwo
obsługi jak i zwierząt. Zmniejsza również zagrożenie dla obsługi podczas badania
klinicznego, a przede wszystkim umożliwia: dokładne badanie i ocenę zmian
chorobowych, ocenę i wybór materiału biologicznego do badań oraz właściwe
pobranie próbek. Uspokojenie jest szczególnie ważne przy osobnikach trudnych
do poskromienia oraz sprawiających problemy podczas badania. Zwierzętom,
których nie można schwytać, środek uspokajający w iniekcji należy podać przy
użyciu lotek wyrzucanych z broni pneumatycznej.
Jeżeli przed badaniem i pobieraniem próbek wymagane jest oczyszczenie
miejsc niezbędnych do przeprowadzenia badania lub pobrania próbek (np. racic),
należy obmyć je czystą zimną wodą i miękkim kawałkiem tkaniny lub gąbki.
Nie należy stosować mydła, detergentów, chemicznych środków
dezynfekcyjnych lub dezynfekcyjno-myjących, gdyż środki te mogą inaktywować
czynniki chorobotwórcze w materiale biologicznym i spowodować, że próbka
będzie nieprzydatna do badania laboratoryjnego (wynik może być fałszywie
ujemny).
Narzędzia do pobierania próbki i pojemniki na próbki również nie mogą
mieć kontaktu ze środkami dezynfekcyjnymi, aż do chwili szczelnego zamknięcia
próbki w pojemniku.
Poza sporządzeniem protokołu pobrania próbek (Załącznik 2, 4, 5 lub 6),
każde zwierzę, od którego została pobrana próbka należy oznaczyć łatwo
dostrzegalnym znakiem np. farbą w aerozolu, aby można było je łatwo odszukać,
jeśli konieczne będzie powtórne pobranie próbek.
Po zakończonym badaniu klinicznym i pobraniu próbek wszyscy, którzy
brali w tych działaniach udział, powinni dokładnie zdezynfekować ręce,
narzędzia, najbliższe otoczenie i odzież ochronną. Odzież po zdjęciu należy
umieścić w podwójnych workach foliowych, worki dokładnie zamknąć, a ich
powierzchnie zewnętrzne zdezynfekować i przekazać wyspecjalizowanej firmie
do
utylizacji
lub
zutylizować
pod
urzędowym
nadzorem
w gospodarstwie.
Uwaga! Jeśli podejrzenie choroby zostanie potwierdzone, zaleca się aby
członkowie zespołu pobierającego próbki przez trzy dni unikali kontaktów ze
zwierzętami podatnymi oraz nie przebywali w miejscach gromadzenia się takich
zwierząt.

PODRĘCZNIK POBIERANIA PRÓBE K
12
d. Zestaw do pobierania materiału biologicznego do laboratoryjnych
badań rozpoznawczych chorób zakaźnych zwierząt (ilości minimalne)
W skład zestawu do pobierania materiału biologicznego do laboratoryjnych
badań rozpoznawczych dla chorób zakaźnych zwierząt wchodzi:
1. Kombinezon ochronny z kapturem ................................ .. 2 szt.
2. Fartuch gumowy ................................ ................................ 2 szt.
3. Pokrowce ochronne na buty lub buty gumowe .............. 2 pary
4. Rękawice gumowe ................................ .............................. 2 pary
5. Okulary ochronne lub maska na twarz ........................... 2 szt.
6. Środki przeciwbólowe i uspokajające
7. Pęseta ................................ ................................ ................... 2 szt.
8. Nożyczki chirurgiczne z ostrym końcem .......................... 2 szt.
9. Nożyczki z jednym końcem tępym ................................................ 2 szt.
10. Łyżeczki z ostrymi krawędziami ................................ ...... 2 szt.
11. Skalpele ................................ ................................ ............... 2 szt.
12. Strzykawki jednorazowe ................................ ................... 5 szt.
13. Igły do strzykawek ................................ ............................ 100 szt.
14. Probówki z igłą do pobierania krwi (min. 10 ml):
a) dla bydła ................................ ................................ .. 50 szt.
b) dla świń ................................ ................................ ... 40 szt.
15. Kleszcze donosowe dla bydła ................................ ............ 1 szt.
16. Kleszcze donosowe dla świń ................................ ............. 1 szt.
17. Zgłębnik do pobierania próbek śluzu w przypadku
podejrzenia o nosicielstwo ................................ ............... 1 szt.
18. Pałeczki do wymazów z nosa dla świń, jałowe
w probówce z podłożem transportowym .......................... 10 szt.
19. Probówki ze środkiem przeciwkrzepliwym (heparyna
lub sól potasowa EDTA) ................................ ................... 10 szt.
20.Pojemnik na próbki mały (20—30 ml) odporny na
rozbicie z zakręcanym korkiem ................................ ....... 4 szt.
21.Pojemnik na probówki duży (100—200 ml) wyłożony
materiałem amortyzacyjnym i resorbującym z
zakręcanym korkiem ................................ ......................... 2 szt.
22. Kontener do transportu, chłodzony ................................ 2 szt.
23. Roztwór 10% formaliny ................................ .....................
24. Soda kaustyczna w płatkach (0,5 kg) lub inne środki
dezynfekcyjne
25. Pisak wodoodporny ................................ ........................... 2 szt.
26. Naklejki samoprzylepne ................................ ................... 100 szt.
27. Taśma uszczelniająca ................................ ......................... 5 szt.
28. Worki foliowe na zużyte materiały ................................ . 100 szt.
Ponadto, wskazane jest, aby w czasie pobierania prób posiadać:
1. termometr lekarski,
2. notes i pisak,
3. kolorowy mazak lub farbę w aerozolu do znaczenia zwierząt,
4. latarkę, zapasowe baterie,
5. formularze druków oficjalnych (pismo przewodnie, listy zwierząt).
PODRĘCZNIK POBIERANIA PRÓBE K
13
III. Wytyczne pobierania próbek do diagnostyki określonych
chorób zakaźnych zwierząt z zastosowaniem właściwej
metody badawczej
Uwagi ogólne
Część III Podręcznika zawiera wytyczne w zakresie pobierania,
przechowywania i transportu próbek materiału biologicznego pobranego w celu
diagnostyki określonych chorób zakaźnych zwierząt przy zastosowaniu właściwej
metody badawczej.
Wytyczne uporządkowane są według zwierząt, od których pobierany jest
materiał biologiczny, i tak:
- Część zielona zawiera wytyczne pobierania próbek do diagnostyki
chorób zakaźnych bydła;
- Część różowa zawiera wytyczne pobierania próbek do diagnostyki
chorób zakaźnych zwierząt świniowatych;
-
Część granatowa
zawiera wytyczne pobierania próbek do diagnostyki
chorób zakaźnych
zwierząt jednokopytnych
;
-
Część fioletowa
zawiera wytyczne pobierania próbek do diagnostyki
chorób zakaźnych
małych przeżuwaczy
;
- Część pomarańczowa zawiera wytyczne pobierania próbek do
diagnostyki chorób zakaźnych ptaków;
- Część żółta zawiera wytyczne pobierania próbek do diagnostyki
chorób zakaźnych pszczół;
- Część niebieska zawiera wytyczne pobierania próbek do diagnostyki
chorób zakaźnych zwierząt akwakultury;
-
Część brązowa
zawiera wytyczne pobierania próbek do diagnostyki
chorób zakaźnych wspólnych dla
różnych gatunków zwierząt
.
Choroby przenoszone przez zwierzęta, które stanowią zagrożenie również dla
zdrowia ludzkiego (zoonozy) i w związku z tym wymagające szczególnej ostrożności,
zostały wskazane poprzez umieszczenie w punkcie UWAGI SPECJANE
następującej informacji: „Ze względu na
potencjalne ryzyko zakażenia osób
zaangażowanych w próbkobranie należy zachować szczególnie surowe środki
ostrożności.”

PODRĘCZNIK POBIERANIA PRÓBE K
14
BYDŁO
KIERUNEK BADANIA
ENZOOTYCZNA BIAŁACZKA BYDŁA
Enzootic bovine leucosis - EBL
METODA / TEST
AGID
ELISA
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Krew zwierząt podatnych.
REPREZENTATYWNA
LICZBA PRÓBEK
W zależności od statusu epizootycznego regionu, liczba pobieranych próbek
powinna być zgodna z programem zwalczania lub kontroli EBL.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
· jałowa igła
· próbówka bez antykoagulantu
PROCEDURA
POBRANIA PRÓBKI
Krew należy pobierać jałową igłą z żyły jarzmowej. Probówkę bez
antykoagulantu po napełnieniu krwią do 2/3 objętości (około 7 ml) należy
zamknąć szczelnie korkiem.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Świeżo pobraną krew należy odstawić na około 2 godziny w temperaturze
pokojowej, a następnie (najlepiej tego samego dnia) dostarczyć do
laboratorium. W czasie transportu próbki krwi chronić przed
przemarznięciem lub nadmiernym przegrzaniem, gdyż powoduje to
hemolizę.
Próbki surowicy można przechowywać w lodówce( w temperaturze +5°C ±
3°C) do 7 dni lub zamrażarce (temperatura - 20°C ± 3°C).
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 6 – Arkusz wyników badania w kierunku enzootycznej
białaczki bydła
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Najlepiej w dniu pobrania próbki.
W razie trudności w dostarczeniu próbek krwi do laboratorium w dniu ich
pobrania, można po uformowaniu się skrzepu w temperaturze pokojowej
przechować je do dnia następnego w temperaturze 2-8ºC.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
· ZHW w Warszawie, TP w
Ostrołęce
· PIWet-PIB w Puławach
· ZHW w Bydgoszczy
· ZHW w Bydgoszczy, OT we
Włocławku
· ZHW w Łodzi
· ZHW w Krakowie
· ZHW w Warszawie, TP w
Siedlcach
· ZHW w Warszawie, TP w
Ostrołęce
· ZHW w Opolu
· ZHW w Krośnie
· ZHW w Białymstoku
· ZHW w Białymstoku Oddz. w
Łomży
· ZHW w Gdańsku
· ZHW w Katowicach
· ZHW w Kielcach
· ZHW w Poznaniu
· ZHW w Poznaniu Prac. w Lesznie
· ZHW w Poznaniu Prac. w
Koninie
· ZHW w Szczecinie
· ZHW w Szczecinie Oddz. w
Koszalinie
· PIWet-PIB w Puławach

PODRĘCZNIK POBIERANIA PRÓBE K
15
PRAWODAWSTWO UE Dyrektywa Rady 64/432/EWG z dnia 26 czerwca 1964 r. w sprawie
problemów zdrowotnych zwierząt wpływających na handel wewnątrz
wspólnotowy bydłem i trzodą chlewną
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 27 czerwca
2005 r. w sprawie szczegółowych wymagań weterynaryjnych
niezbędnych do uzyskania i zachowania uznania stada lub
gospodarstwa za urzędowo wolne lub wolne od chorób zakaźnych
zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Rady Ministrów z dnia 30 maja 2007 r. w sprawie
wprowadzenia programu zwalczania enzootycznej białaczki bydła,
gruźlicy bydła, brucelozy u bydła, wścieklizny, gąbczastej
encefalolopatii oraz programu zwalczania i kontroli zakażeń wirusami
wysoce zjadliwej grypy ptaków dawny pomór drobiu w drobiu i ptaków
dzikich
· Rozporządzenie Rady Ministrów z dnia 18 grudnia 2007 r. w sprawie
wprowadzenia programu zwalczania enzootycznej białaczki bydła
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 5 marca
2008 r. w sprawie zwalczania enzootycznej białaczki bydła

PODRĘCZNIK POBIERANIA PRÓBE K
16
BYDŁO
KIERUNEK BADANIA
GĄBCZASTA ENCEFALOPATIA BYDŁA
Bovine spongiform encephalopathy - BSE
METODA / TEST
Szybki test
ELISA.
Szybki test Bio-
Rad.
Szybki test
Enfer TSE.
Szybki test
IDEXX.
UWAGI SPECJALNE
Ze względu na
potencjalne ryzyko zakażenia osób
zaangażowanych w
próbkobranie należy zachować szczególnie surowe środki ostrożności.
Przedmiotem badania jest wykrywanie patologicznej formy białka
prionowego (PrP
Sc
) szybkimi testami w próbkach pobranych z rdzenia
przedłużonego.
MATERIAŁ DO
BADANIA
Rdzeń przedłużony z regionem zasuwki (Załącznik 7 – Opis prawidłowo
pobranej próbki do badań w kierunku BSE z wykorzystaniem szybkich
testów).
REPREZENTATYWNA
LICZBA PRÓBEK
Zgodnie z programem zwalczania.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Specjalna łyżeczka (szpatułka).
PROCEDURA
POBRANIA PRÓBKI
Do badania należy pobrać rdzeń przedłużony z rejonem zasuwki. Każdą
pobraną próbkę wkłada się do odrębnego pojemnika (patrz również
Załącznik 7)
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Nie zamrażać, przechowywać w temperaturze 2-8°C.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Jak najszybciej.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
· ZHW w
Warszawie
· ZHW w
Warszawie
TP w
Siedlcach
· ZHW w
Gdańsku
· ZHW w
Poznaniu
Prac. w
Lesznie
· PIWet-PIB w
Puławach
· ZHW w
Gdańsku
· ZHW w
Krakowie
· PIWet-PIB w
Puławach
PRAWODAWSTWO UE
· Rozporządzenie Parlamentu Europejskiego i Rady nr 999/2001 z dnia
22 maja 2001 r. ustanawiające zasady dotyczące zapobiegania, kontroli
i zwalczania niektórych przenośnych gąbczastych encefalopatii
· Rozporządzenie Komisji (WE) nr 21/2008 z dnia 11 stycznia 2008 r.
zmieniające załącznik X do rozporządzenia (WE) nr 999/2001
Parlamentu Europejskiego i Rady w odniesieniu do wykazów szybkich
testów
PRAWODAWSTWO
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz

PODRĘCZNIK POBIERANIA PRÓBE K
17
POLSKIE
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Rady Ministrów z dnia 30 maja 2007 r. w sprawie
wprowadzenia programu zwalczania enzootycznej białaczki bydła,
gruźlicy bydła, brucelozy u bydła, wścieklizny, gąbczastej
encefalolopatii oraz programu zwalczania i kontroli zakażeń wirusami
wysoce zjadliwej grypy ptaków dawny pomór drobiu w drobiu i ptaków
dzikich
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
18
BYDŁO
KIERUNEK BADANIA
GRUŹLICA BYDŁA
Bovine tuberculosis
METODA / TEST
Wykrywanie drobnoustrojów z rodzaju Mycobacterium w materiale
biologicznym. Obejmuje następujące etapy:
· wstępne badanie anatomopatologiczne próby tkankowej
· badanie mikroskopowe
· badanie hodowlane
· badanie biologiczne na zwierzętach laboratoryjnych
· identyfikację genotypową izolatów Mycobacterium.
UWAGI SPECJALNE
Ze względu na
potencjalne ryzyko zakażenia osób
zaangażowanych w
próbkobranie należy zachować szczególnie surowe środki ostrożności.
MATERIAŁ DO
BADANIA
Do badań diagnostycznych pobiera się:
· wycinki chorobowo zmienionych narządów i organów miąższowych,
takich jak: płuca, wątroba, śledziona wraz z okolicznymi węzłami
chłonnymi – w przypadku uboju, padnięcia lub zabicia bydła, które
wykazywało dodatni wynik w teście tuberkulinowym;
· węzły chłonne: okołogardzielowe, oskrzelowe, śródpiersiowe,
nadwymieniowe, kąta żuchwy, krezkowe oraz wnęki
wątroby – w przypadku braku zmian chorobowych oraz w przypadku
zabicia bydła, które wykazywało dodatni wynik w teście
tuberkulinowym;
· inne próby, w epizootycznie uzasadnionych przypadkach:
- kał,
- mleko,
- wydzielina narządów rodnych,
- wykrztusina,
- nasienie,
- mocz.
REPREZENTATYWNA
LICZBA PRÓBEK
Badana laboratoryjnie jest każda sztuka bydła tuberkulinododatniego
poddanego ubojowi lub zabiciu oraz każde zwierzę padłe, u którego w czasie
sekcji stwierdzono zmiany anatomo-patologiczne nasuwające podejrzenie
gruźlicy.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Próby pobiera się czystymi, jałowymi narzędziami, najlepiej jednorazowego
użytku:
- wydzielina narządów rodnych, pobierana jest jałowym tamponem
lub kateterem;
- wyksztusina, pobierana jest pędzelkiem dotchawicowym;
- nasienie, pobierane jest za pomocą sztucznej pochwy;
- mocz od samic, pobierany jest kateterem.
Dodatkowo:
· mocny, sterylny, szklany lub plastikowy pojemnik, zamykany
szczelnym przykryciem zabezpieczającym przed wyciekiem zawartości;
· wodoodporna taśma samoprzylepna.
Do zapakowania wszystkich pobranych prób:
· kontener, mocny karton lub drewniane pudełko.
PROCEDURA
POBRANIA PRÓBKI
Miejsca, z których są pobierane próby nie powinny być odkażane, ze
względu na możliwość inaktywowania czynnika zakaźnego nawet przez
nieznaczną ilość produktu biobójczego. Miejsca te oczyszcza się lub płucze
wodą bez detergentów i produktów biobójczych.
Próby inne:
- Kał, pobierany bezpośrednio z prostnicy. Wielkość próbki – 2-5 g.
- Próby mleka, pobierane są jałowo w końcowej fazie udoju, w
objętości około 25-50 cm
3
z każdej ćwiartki. W okresie letnim do
próby mleka możemy dodać kwas borny, do uzyskania końcowego
stężenia w próbce 0,5%.
- Wydzielina narządów rodnych - objętość próbki 2-10 cm
3
.

PODRĘCZNIK POBIERANIA PRÓBE K
19
- Wyksztusina, pobierana jest pędzelkiem dotchawicowym.
- Nasienie - objętość próbki 10-50 cm
3
.
- Mocz - objętość próby około 100 cm
3
.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Każdą próbę umieszcza się w mocnym, sterylnym, szklanym lub
plastikowym pojemniku, zamykanym szczelnym przykryciem
zabezpieczającym przed wyciekiem zawartości. Przykrycie okleja się
dookoła wodoodporną taśmą samoprzylepną. Powierzchnię zewnętrzną
pojemnika po jego zamknięciu odkaża się, a następnie płucze się czystą
wodą i osusza. Każdy pojemnik zaopatruje się w etykietę zawierającą opis
zwierzęcia i jego numer identyfikacyjny, rodzaj próby, datę i miejsce jej
pobrania, imię i nazwisko oraz adres posiadacza zwierzęcia.
Próby zapakowane w sposób określony powyżej umieszcza się w
kontenerze, mocnym kartonie lub drewnianym pudełku i transportuje do
laboratorium w temperaturze 4-8°C. Dopuszcza się transport zamrożonych
prób, bez rozmrażania ich w trakcie transportu.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Próby przesyła się bezpośrednio do laboratorium, w możliwie najkrótszym
terminie.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PRAWODAWSTWO UE
· Dyrektywa Rady 64/432/EWG z dnia 26 czerwca 1964 r. w sprawie
problemów zdrowotnych zwierząt wpływających na handel wewnątrz
wspólnotowy bydłem i trzodą chlewną
· Rozporządzenie Komisji (WE) nr 1226/2002 z dnia 8 lipca 2002 r.
zmieniające załącznik B do dyrektywy Rady 64/432/EWG
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 23 listopada
2004 r. w sprawie zwalczania gruźlicy bydła
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zakażeń zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 27 czerwca
2005 r. w sprawie szczegółowych wymagań weterynaryjnych niezbędnych
do uzyskania i zachowania uznania stada lub gospodarstwa za urzędowo
wolne lub wolne od chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania informacji
o występowaniu chorób zakaźnych zwierząt podlegających obowiązkowi
zwalczania i rejestracji oraz o wynikach monitorowania chorób
odzwierzęcych i odzwierzęcych czynników chorobotwórczych a także
związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Rady Ministrów z dnia 30 maja 2007 r. w sprawie
wprowadzenia programu zwalczania enzootycznej białaczki bydła,
gruźlicy bydła, brucelozy u bydła, wścieklizny, gąbczastej encefalolopatii
oraz programu zwalczania i kontroli zakażeń wirusami wysoce zjadliwej
grypy ptaków dawny pomór drobiu u drobiu i ptaków dzikich
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
20
BYDŁO
K
IERUNEK BADANIA
ZAKAŹNE ZAPALENIE NOSA I TCHAWICY / OTRĘT BYDŁA
Infectious bovine rhinotracheitis / infetious pustular vulvovaginitis
IBR/IPV
METODA / TEST
ELISA gB
SN
Test izolacji.
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Krew zwierząt podatnych.
Wycinki narządów
wewnętrznych płodu,
łożysko, wymazy z
worka spojówkowego,
nosa i układu
rozrodczego.
REPREZENTATYWNA
LICZBA PRÓBEK
Do określenia w przypadku przyjęcia programu
zwalczania.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Sterylna próbówka.
Sprzęt używany do
sekcji.
PROCEDURA
POBRANIA PRÓBKI
Krew pobierać do sterylnych probówek z
zachowaniem zasad aseptyki.
Próbki pobiera się do
sterylnych naczyń,
szczelnie zamykanych,
każdy narząd
oddzielnie.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Nie zamrażać.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Jak najszybciej.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
· ZHW w Bydgoszczy
· ZHW w Krośnie
· ZHW w Poznaniu
· ZHW w Szczecinie
Oddz. w Koszalinie
· PIWet-PIB w
Puławach
PRAWODAWSTWO UE Dyrektywa Rady 64/432/EWG z dnia 26 czerwca 1964 r. w sprawie
problemów zdrowotnych zwierząt wpływających na handel wewnątrz
wspólnotowy bydłem i trzodą chlewną
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
21
BYDŁO
KIERUNEK BADANIA
ZARAZA PŁUCNA BYDŁA
Contagious bovine pleuropneumonia - CBPP
METODA / TEST
c-ELISA
OWD
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Krew zwierząt podatnych.
REPREZENTATYWNA
LICZBA PRÓBEK
Od każdego zwierzęcia podejrzanego o chorobę.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
· jałowa igła
· probówka bez antykoagulantu
Zaleca się stosowanie zestawów jednorazowego użytku, zawierających
wkładkę ułatwiającą wydzielanie się surowicy i hermetycznie zamykanych.
PROCEDURA
POBRANIA PRÓBKI
Krew należy pobierać jałową igłą z żyły jarzmowej. Probówkę bez
antykoagulantu po napełnieniu krwią do 2/3 objętości (ok. 7 ml) należy
zamknąć szczelnie korkiem i niezwłocznie oznakować.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Probówki z krwią dokładnie oznakować i dołączyć pismo przewodnie.
Próbki pełnej krwi, świeżo pobranej, przed transportem, należy odstawić
na około 2 godziny w temperaturze pokojowej.
W czasie transportu próbki krwi chronić przed przemarznięciem lub
nadmiernym przegrzaniem, gdyż powoduje to hemolizę lub przerost florą
bakteryjną.
Transport i przechowywanie surowicy w stanie zamrożenia -20°C. W czasie
transportu surowica nie może ulec rozmnożeniu.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
W dniu pobrania próbki.
W razie trudności dostarczenia próbek krwi do laboratorium w dniu ich
pobrania, można, po uformowaniu się skrzepu w temperaturze pokojowej,
do dnia następnego przechować je w chłodni (4°C ). Zebrane i
przechowywane w chłodni (4ºC) surowice są przydatne do badań w OWD
przez 2 dni.
Próbki surowic, które nie zostaną przebadane w ciągu najbliższych 48
godzin należy zamrozić w temperaturze -20ºC w szczelnie zamkniętych
probówkach.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PRAWODAWSTWO UE
· Dyrektywa Rady 64/432/EWG z dnia 26 czerwca 1964 r. w sprawie
problemów zdrowotnych zwierząt wpływających na handel wewnątrz
wspólnotowy bydłem i trzodą chlewną
· Decyzja Komisji 2008/650/WE zmieniająca Dyrektywę Rady
82/894/EWG w sprawie wykazu zgłaszania chorób zwierząt we
wspólnocie poprzez włączenie niektórych chorób do wykazu chorób
wymagających zgłaszania oraz skreśleniu z tego wykazu
enterowirusowego zapalanie mózgu i rdzenia u świń
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a

PODRĘCZNIK POBIERANIA PRÓBE K
22
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 14 września
2007 r. w sprawie zwalczania zarazy płucnej bydła
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
23
ZWIERZĘTA ŚWINIOWATE
KIERUNEK BADANIA
AFRYKAŃSKI POMÓR ŚWIŃ
African swine fever - ASF
METODA / TEST
ELISA
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Krew zwierząt podatnych.
REPREZENTATYWNA
LICZBA PRÓBEK
Od podejrzanych o chorobę zwierząt.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
· jednorazowa igła
· sterylna probówka bez dodatku środka konserwującego
lub
· tubostrzykawka
PROCEDURA
POBRANIA PRÓBKI
Do badań należy pobrać próbki krwi pełnej od świń chorujących
maksymalnie długo lub od świń podejrzanych, które miały styczność ze
zwierzętami zakażonymi lub podejrzanymi o zakażenie wirusem ASF.
Krew należy pobierać igłą jednorazową do sterylnej probówki (lub
tubostrzykawki) bez dodatku środka konserwującego; z igły krew powinna
wolno spływać do probówki po ścianie wewnętrznej do 2/3 pojemności.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Po pobraniu krew należy stopniowo schłodzić, ale nie zamrażać.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
W ciągu 12 godzin od pobrania.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PIWet-PIB w Puławach
PRAWODAWSTWO UE
· Dyrektywa Rady 64/432/EWG z dnia 26 czerwca 1964 r. w sprawie
problemów zdrowotnych zwierząt wpływających na handel wewnątrz
wspólnotowy bydłem i trzodą chlewną
· Decyzja Komisji 2008/650/WE zmieniająca Dyrektywę Rady
82/894/EWG w sprawie wykazu zgłaszania chorób zwierząt we
wspólnocie poprzez włączenie niektórych chorób do wykazu chorób
wymagających zgłaszania oraz skreśleniu z tego wykazu
enterowirusowego zapalanie mózgu i rdzenia u świń
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 23 czerwca
2004 r. w sprawie zwalczania afrykańskiego pomoru świń
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
24
ZWIERZĘTA ŚWINIOWATE
KIERUNEK BADANIA
CHOROBA AUJESZKYEGO U ŚWIŃ
Aujeszky's disease in pigs
METODA / TEST
Diagnostyka przyżyciowa:
· ELISA
· Izolacja wirusa z wymazów (rzadko)
· IF z wymazów (rzadko)
Diagnostyka pośmiertna:
· Izolacja wirusa z narządów
· IF z narządów (rzadko)
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Przyżyciowo:
· krew – badania serologiczne (świnie, dziki)
· wymazy z części nosowo-gardłowej – izolacja wirusa (warchlaki,
tuczniki)
Pośmiertnie – izolacja wirusa:
· świnie: połowa mózgu pozyskana z cięcia podłużnego, migdałki,
śledziona, płuca od świeżo padłych prosiąt lub warchlaków
(najbardziej polecany materiał to tkanka mózgowa)
· inne zwierzęta: część rdzenia kręgowego odpowiedzialną za
unerwianie części skóry objętej świądem, skóra wraz z tkanką
podskórną w miejscach wykazujących świąd
REPREZENTATYWNA
LICZBA PRÓBEK
Krew – świnie
W badaniach serologicznych krew pobiera się od reprezentatywnej liczby
zwierząt:
a)
liczba próbek ukierunkowanych na wykrycie zakażenia stada przy 95%
prawdopodobieństwa wykrycia
Wielkość
stada
Współczynnik szerzenie się
czynnika zakaźnego
Liczba próbek
1*
2
5
10
20*
50
50
48
35
10
12
100
95
78
45
22
13
150
130
95
49
25
13
200
155
105
51
26
14
300
189
117
54
27
14
500
225
129
56
28
14
750
246
135
57
28
14
1000
258
138
57
28
14
1500
271
142
58
29
14
2000
277
143
58
29
14
5000
290
147
59
29
14
b)
liczba próbek ukierunkowanych na wykrycie zakażenia stada przy 99%
prawdopodobieństwa wykrycia:
Wielkość
stada
Współczynnik szerzenie się
czynnika zakaźnego
Liczba próbek
1*
2
5
10
20*
50
50
50
42
29
17
100
99
90
59
36
19
150
143
117
68
38
20
PODRĘCZNIK POBIERANIA PRÓBE K
25
200
180
136
73
40
20
300
235
160
78
41
20
500
300
183
83
42
21
750
343
197
85
43
21
1000
368
204
86
43
21
1500
395
212
88
44
21
2000
410
216
88
44
21
5000
438
223
89
44
21
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Krew
Świnie – sterylna igłoprobówka, niezawierająca dodatków środków
zapobiegających krzepnięciu krwi.
Dziki – sterylna igła i sterylna próbówka nie zawierająca dodatków
środków zapobiegających krzepnięciu krwi lub probówko-strzykawka o
pojemności co najmniej 7,5 ml.
Wymazy z nosa – sterylny patyczek wymazowy.
Wycinki narządów – sterylny, szczelnie zamykany pojemnik.
PROCEDURA
POBRANIA PRÓBKI
Krew
Świnie – krew należy pobrać z żyły czczej przedniej lub żyły jarzmowej
powierzchownej do 3/4 objętości sterylnej igłoprobówki. Krew z igły
powinna wolno spływać do probówki po ściance wewnętrznej, co zmniejsza
ryzyko wystąpienia hemolizy.
Dziki – krew pobiera się bezpośrednio po odstrzeleniu, podczas
wytrzewiania z jamy klatki piersiowej, dużych żył brzusznych lub komór
serca. Krew pobiera się do 3/4 objętości sterylnej probówki lub do
całkowitego wypełnienia probówko-strzykawki o pojemności co najmniej
7,5ml. Przy pobieraniu krwi probówko-strzykawką jej konus należy
zanurzyć we krwi, po czym powoli odciągać tłoczek do uzyskania oporu, aż
do wyraźnego „kliknięcia”, po czym tłoczek odłamać, a konus strzykawki
zatkać zatyczką. Uważać aby nie zaaspirować powietrza lub innych
elementów.
Wymazy z nosa – w celu pobrania wymazu należy unieruchomić zwierzę,
trzymając za ryj jedną ręką, delikatnie odchylić głowę ku górze, a drugą
ręką umieścić koniec sterylnego patyczka wymazowego w nozdrzu
zwierzęcia, w części dystalnej jamy nosowej i energiczne potrzeć nabłonek
śluzowy, dla pewności, iż wymaz zawiera zarówno śluz jak i komórki z
wnętrza nozdrza.
Wycinki narządów - materiał należy pobrać z zachowaniem zasad
aseptyki, umieścić w oznaczonym pojemniku. W przypadku świń
materiałem preferowanym przy izolacji wirusa jest w pierwszej kolejności
mózg oraz migdałki, a w dalszej kolejności pozostałe wycinki.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Krew
Po napełnieniu probówki krwią należy ją szczelnie zamknąć i czytelnie
oznakować.
Świnie – pozyskaną krew początkowo przechowywać w temperaturze
pokojowej, do czasu wydzielenia się surowicy, jeżeli to nie nastąpi do 12
godzin wówczas w celu przyspieszenia wydzielenia surowicy czystą igłą
oddzielić formujący się skrzep od ścianki probówki. Po wydzieleniu się
surowicy, próbki poddać schłodzeniu do temperatury 2-8°C. Podczas
przechowywania krwi w chłodziarce chronić próbki przed przypadkowym
zamrożeniem prowadzącym do hemolizy.
W czasie transportu próbki zabezpieczać przed nadmiernym wpływem
wysokiej temperatury, bezpośredniego oddziaływania promieni słonecznych
i wstrząsów. Próbki należy transportować w pozycji pionowej.
Dziki – po napełnieniu probówki należy umieścić w pozycji pionowej, w
miarę możliwości chronić przed wstrząsami i możliwie szybko umieścić w
temperaturze pokojowej w celu wydzielenia się surowicy. Po wydzieleniu

PODRĘCZNIK POBIERANIA PRÓBE K
26
się surowicy próbki poddać schłodzeniu do temperatury 2-8°C. Podczas
przechowywania krwi w chłodziarce chronić próbki przed przypadkowym
zamrożeniem prowadzącym do hemolizy.
W czasie transportu próbki zabezpieczać przed nadmiernym wpływem
wysokiej temperatury, bezpośredniego oddziaływania promieni słonecznych
i wstrząsów. Próbki należy transportować w pozycji pionowej.
Wymazy z nosa – wymazówkę umieścić w probówce z podłożem
transportowym dla wirusów i w stanie schłodzenia do temperatury 2-8°C
przesłać do laboratorium.
Wycinki narządów – próbki niezwłocznie poddać schłodzeniu do
temperatury 2-8°C i w takim stanie przesłać do laboratorium. Próbek nie
należy zamrażać.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
oraz, w zależności od pobieranego materiału:
· Załącznik 2 – Protokół pobrania prób
lub
· Załącznik 4 – Protokół pobrania prób krwi od świń do badań
kontrolnych w kierunku choroby Aujeszkyego
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Krew - czas od pobrania próbek do ich dostarczenia do laboratorium nie
może przekraczać 48 godzin.
Wymazy z nosa i wycinki narządów - w czasie nieprzekraczającym 24
godzin dostarczyć do laboratorium.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
Diagnostyka przyżyciowa:
· ZHW w Bydgoszczy (ELISA)
· ZHW w Krośnie (ELISA)
· ZHW w Poznaniu (ELISA)
· ZHW w Poznaniu Prac. w Koninie (ELISA)
· ZHW w Poznaniu Prac. w Lesznie (ELISA)
· ZHW w Szczecinie (ELISA)
· PIWet-PIB w Puławach (ELISA)
PRAWODAWSTWO UE Dyrektywa Rady 64/432/EWG z dnia 26 czerwca 1964 r. w sprawie
problemów zdrowotnych zwierząt wpływających na handel wewnątrz
wspólnotowy bydłem i trzodą chlewną
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Rady Ministrów z dnia 19 marca 2008 r. w sprawie
wprowadzenia programu zwalczania choroby Aujeszkyego u świń
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt
PODRĘCZNIK POBIERANIA PRÓBE K
27
ZWIERZĘTA ŚWINIOWATE
KIERUNEK BADANIA
CHOROBA PĘCHERZYKOWA ŚWIŃ CZĘŚĆ I
Swine vesicular disease - SVD
METODA / TEST
Rozpoznanie wirusologiczne.
RT-PCR
ELISA
Test izolacji.
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
· Nabłonek (materiał najbardziej odpowiedni)
· płynna zawartość pęcherzy
· krew od świń i dzików.
Krew zwierząt
podatnych.
Dodatkowo:
· kał
· wymaz z nosa.
REPREZENTATYWNA
LICZBA PRÓBEK
Liczba próbek powinna być adekwatna do częstotliwości występowania
poszukiwanego czynnika w populacji.
W celu kontroli występowania SVD corocznie bada się, na obszarze
powiatu, próbki krwi pobrane od 10 sztuk świń.
Jeżeli choroba występuje w formie klinicznej pobrać próbkę od 2-4
zwierząt.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Próbki pobiera się czystymi, jałowymi narzędziami, do jałowych naczyń,
najlepiej jednorazowych.
· zawartość pęcherza: strzykawka z igłą,
· krew: probówka z etykietą, w systemie próżniowym,
· kał: łyżeczka, naczynie z szerokim otworem i zakręcą pokrywką,
· wymazy z nosa: jałowy wacik lub wymazówka.
Uwaga! Naczynie na próbkę o pojemności ok. 10ml musi być
przystosowane do ewentualnego zamrażania, szczelnie zamykane, aby
gaz nie przedostał się do jego wnętrza, ponieważ spowoduje obniżenie
pH i inaktywację wirusa (próbka taka jest nieprzydatna do badania).
Zalecany sposób pakowania materiałów biologicznych z podejrzeniem
pryszczycy i/lub choroby pęcherzykowej świń oraz sprzęt niezbędny do
zapakowania są opisane w Załączniku 3.
PROCEDURA
POBRANIA PRÓBKI
Próbkę, każdą oddzielnie, pobiera się od zwierząt
żywych lub martwych, (zabitych lub padłych).
Nabłonek - próbkę ze ścian nieuszkodzonego lub
świeżo rozerwanego pęcherza, nie mniej niż 1g
(wielkość znaczka pocztowego 2 cm
2
).
Zawartość pęcherza - pobrać strzykawką z igłą,
tyle ile tylko możliwe, nie mniej niż 3g.
Krew - 5-10ml zarówno od zwierząt zdrowych,
podejrzanych, chorych i rekonwalescentów.
Próbkę krwi pobrać jałowo. Podczas pobierania
krew powinna powoli spływać po ściance
probówki, do 2/3 objętości, nie dopuścić do
hemolizy krwinek Probówki napełnionej krwią
nie otwierać.
5-10ml zarówno od
zwierząt zdrowych,
podejrzanych, chorych i
rekonwalescentów.
Próbkę krwi pobrać
jałowo. Podczas
pobierania krew
powinna powoli
spływać po ściance
probówki, do 2/3
objętości, nie dopuścić
do hemolizy krwinek
Probówki napełnionej
krwią nie otwierać.
Kał - 20g kału od świń
lub z pomieszczenia, w
którym przebywają lub
przebywały świnie
podejrzane o chorobę
pęcherzykową świń.
Wymazy z nosa -
Pobrać co najmniej
dwa wymazy z nosa.
PODRĘCZNIK POBIERANIA PRÓBE K
28
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Wirus choroby pęcherzykowej świń, oporny jest
zarówno na wahania temperatury w szerokim
zakresie i pH w granicach wartości 2,5-12.
Jednakże, w związku z faktem, że epizootie
chorób świń z objawami pęcherzowymi,
zwłaszcza w początkowej fazie traktuje się jako
podejrzenie pryszczycy, próbkę transportuje się w
warunkach optymalnych dla wirusa pryszczycy,
tj. pH 7,2 -7,6 oraz temp. +5°C(±
3
°C).
Nabłonek - próbkę nabłonka schłodzić, nie
zamrażać. Transport w +5
o
C(±3
°C).
Surowicza zawartość pęcherza - warunki
transportu jak w przypadku nabłonka - pH 7.2 –
7.6, temperatura +5°C(±
3
°C).
Po pobraniu delikatnie
wymieszać krew ze
środkiem
zapobiegającym
krzepnięciu - EDTA
(kwasem etylenodwu-
aminoczterooctowym)
lub solami heparyny, a
następnie schłodzić.
Nie zamrażać.
Krew transportować
schłodzoną +5°C
(±3°C).
Kał - transport w
+5°C(±3°C).
Wymazy z nosa -
pobrany materiał
natychmiast umieszcza
się w buforze (płyn
Eagle`a do hodowli
tkankowej/gliceryna z
antybiotykiem).
Transport w
+5°C(±3°C).
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Przewóz próbki z podejrzeniem pryszczycy i/lub choroby pęcherzykowej
świń nie może być zlecany przedsiębiorstwom spedycyjnym, świadczącym
usługi transportowe.
Próbki musi dostarczyć kurier najszybszym możliwym środkiem
transportu, niezwłocznie po pobraniu, najpóźniej przed upływem 24
godzin od pobrania.
Nabłonek – do laboratorium należy dostarczyć natychmiast (w czasie kilku
godzin) w tym czasie może być przewożony bez buforu.
Jednakże, jeżeli istnieje obawa, że czas transportu może wydłużyć się,
nabłonek należy umieścić w małej ilości buforu 2-5ml, składającego się z
równych części 0,04 M buforu fosforanowego i gliceryny (PBS/gliceryna) lub
innego równoważnego buforu (ważne pH 7,2 -7,6). Transport w +5°C(±3
°C).
Ponadto, dla ochrony przed rozwojem mikroorganizmów do buforu dodaje
się jeden z niżej wymienionych antybiotyków w stężeniu:
(i) penicylina 1 000 IU
(ii) siarczan neomycyny 100 IU
(iii) siarczan polimyksyny B 50 IU
(iv) mykostatyna 100 IU
Wymazy z nosa - do laboratorium należy dostarczyć natychmiast (w czasie
kilku godzin). Jednakże, jeżeli zachodzi obawa, że transport może trwać
powyżej kilku godzin, próbkę należy zamrozić w suchym lodzie lub ciekłym
azocie.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
Zakład PIWet-PIB w
Zduńskiej Woli
Zakład PIWet-PIB w
Zduńskiej Woli
PRAWODAWSTWO UE
· Dyrektywa Rady 64/432/EWG z dnia 26 czerwca 1964 r. w sprawie
problemów zdrowotnych zwierząt wpływających na handel wewnątrz
wspólnotowy bydłem i trzodą chlewną

PODRĘCZNIK POBIERANIA PRÓBE K
29
· Decyzja Komisji 2008/650/WE zmieniająca Dyrektywę Rady
82/894/EWG w sprawie wykazu zgłaszania chorób zwierząt we
wspólnocie poprzez włączenie niektórych chorób do wykazu chorób
wymagających zgłaszania oraz skreśleniu z tego wykazu
enterowirusowego zapalanie mózgu i rdzenia u świń
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
30
ZWIERZĘTA ŚWINIOWATE
KIERUNEK BADANIA
CHOROBA PĘCHERZYKOWA ŚWIŃ CZĘŚĆ II
Swine vesicular disease - SVD
METODA / TEST
SN
ELISA – rozpoznanie serologiczne.
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Krew pełna zwierząt podatnych lub surowica pozyskana z krwi zwierząt
podatnych.
REPREZENTATYWNA
LICZBA PRÓBEK
Liczba próbek powinna być adekwatna do częstotliwości występowania
poszukiwanego czynnika w populacji.
W celu kontroli występowania SVD corocznie bada się, na obszarze
powiatu, próbki krwi pobrane od 10 sztuk świń.
Jeżeli choroba występuje w formie klinicznej pobrać próbkę od 2-4
zwierząt.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
· jednorazowa igła
· sterylna probówka bez dodatku środka konserwującego
lub
· tubostrzykawka
Zalecany sposób pakowania materiałów biologicznych z podejrzeniem
pryszczycy i/lub choroby pęcherzykowej świń oraz sprzęt niezbędny do
zapakowania są opisane w Załączniku 3.
PROCEDURA
POBRANIA PRÓBKI
Do badań należy pobrać próbki krwi pełnej od świń chorych lub
ozdrowieńców, które miały styczność ze zwierzętami zakażonymi lub
podejrzanymi o zakażenie wirusem SVD. Z igły krew powinna wolno
spływać do probówki po ścianie wewnętrznej do 2/3 pojemności, nie
dopuścić do hemolizy krwinek.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Po pobraniu pełną krew należy stopniowo schłodzić, ale nie zamrażać i
transportować schłodzoną +5°C (±3
°C).
Surowicę schłodzić lub zamrozić. Transportować schłodzoną +5°C(±3°C) lub
zamrożoną.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Przewóz próbki z podejrzeniem pryszczycy i/lub choroby pęcherzykowej
świń nie może być zlecany przedsiębiorstwom spedycyjnym, świadczącym
usługi transportowe.
Próbki musi dostarczyć kurier najszybszym możliwym środkiem
transportu, niezwłocznie po pobraniu, najpóźniej przed upływem 24
godzin od pobrania.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
Zakład PIWet-PIB w Zduńskiej Woli
PRAWODAWSTWO UE
· Dyrektywa Rady 64/432/EWG z dnia 26 czerwca 1964 r. w sprawie
problemów zdrowotnych zwierząt wpływających na handel wewnątrz
wspólnotowy bydłem i trzodą chlewną
· Decyzja Komisji 2008/650/WE zmieniająca Dyrektywę Rady
82/894/EWG w sprawie wykazu zgłaszania chorób zwierząt we
wspólnocie poprzez włączenie niektórych chorób do wykazu chorób
wymagających zgłaszania oraz skreśleniu z tego wykazu
enterowirusowego zapalanie mózgu i rdzenia u świń
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania

PODRĘCZNIK POBIERANIA PRÓBE K
31
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
32
ZWIERZĘTA ŚWINIOWATE
KIERUNEK BADANIA
KLASYCZNY POMÓR ŚWIŃ
CZĘŚĆ I
Classical swine fever - CSF, Hog cholera
METODA / TEST
Rozpoznanie wirusologiczne.
Izolacja wirusa klasycznego pomoru
świń w hodowli komórkowej.
PCR
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Najwłaściwszym materiałem do badań laboratoryjnych są migdałki
(pierwszy narząd, w którym dochodzi do namnażania się wirusa,
i w którym utrzymuje się on najdłużej), węzły chłonne żuchwowe, śledziona
i nerki.
W przewlekłych i nietypowych przypadkach choroby wskazanym jest
przesłanie do badań również końcowego odcinka jelita biodrowego oraz
mózgu.
W przypadku, gdy padła świnia uległa autolizie do badań laboratoryjnych
pobrać należy kość długą i/lub mostek.
Do wczesnego wykrywania CSFV bardzo przydatne są próbki pełnej krwi.
REPREZENTATYWNA
LICZBA PRÓBEK
W celu kontroli występowania CSF corocznie bada się próbki w ilości
zgodnej z rozporządzeniem Ministra Rolnictwa i Rozwoju Wsi z dnia 17
grudnia 2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt.
W czasie wystąpienia CSF, liczba pobieranych próbek powinna być zgodna
z Decyzją Komisji 2002/106/WE
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
W zależności od pobieranego materiału:
· igła,
· próbówka,
· sprzęt niezbędny do przeprowadzenia sekcji.
PROCEDURA
POBRANIA PRÓBKI
Narządy: materiał patologiczny przeznaczony do badań laboratoryjnych
pobiera się od zwierząt wykazujących objawy choroby (gorączka) ubitych
diagnostycznie lub świeżo padłych (do 4 godzin).
Krew: do badań należy przesłać około 5ml krwi pobranej, do probówek z
wersenianem potasu (K3EDTA) w proporcji 1,8mg EDTA/ 1ml.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Każda próbka tkanki powinna zostać umieszczona w oddzielnym
plastikowym woreczku, odpowiednio zamknięta, włożona do drugiego
woreczka i opisana.
Próbki należy przechowywać i transportować w szczelnych, odpornych na
zniszczenie pojemnikach.
Próbki nie mogą być zamrażane. Należy je transportować w temperaturze
lodówki.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Próbki należy poddać badaniu w ciągu 24 godzin od pobrania.
Każdorazowo, przed wysyłką próbek, należy o tym powiadomić
laboratorium rozpoznawcze.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PRAWODAWSTWO UE
· Dyrektywa Rady 64/432/EWG z dnia 26 czerwca 1964 r. w sprawie
problemów zdrowotnych zwierząt wpływających na handel wewnątrz
wspólnotowy bydłem i trzodą chlewną
· Decyzja Komisji nr 2002/106/WE zatwierdzająca Podręcznik
Diagnostyczny ustalający procedury diagnostyczne, metody pobierania

PODRĘCZNIK POBIERANIA PRÓBE K
33
próbek oraz kryteria do oceny testów laboratoryjnych służących do
potwierdzenia klasycznego pomoru świń
· Decyzja Komisji 2008/650/WE zmieniająca Dyrektywę Rady
82/894/EWG w sprawie wykazu zgłaszania chorób zwierząt we
wspólnocie poprzez włączenie niektórych chorób do wykazu chorób
wymagających zgłaszania oraz skreśleniu z tego wykazu
enterowirusowego zapalanie mózgu i rdzenia u świń
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania informacji
o występowaniu chorób zakaźnych zwierząt podlegających obowiązkowi
zwalczania i rejestracji oraz o wynikach monitorowania chorób
odzwierzęcych i odzwierzęcych czynników chorobotwórczych a także
związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 18 grudnia
2006 r. w sprawie zwalczania klasycznego pomoru świń
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
34
ZWIERZĘTA ŚWINIOWATE
KIERUNEK BADANIA
KLASYCZNY POMÓR ŚWIŃ
CZĘŚĆ II
Classical swine fever - CSF, Hog cholera
METODA / TEST
Rozpoznanie serologiczne - służy jedynie jako pomoc w przypadkach
podejrzenia klasycznego pomoru świń. Jeśli od świń podejrzanych o CSF
albo z materiału pochodzącego z gospodarstw, które miały kontakt z
przypadkami choroby nie wyizolowano wirusa lub nie wykryto jego
antygenu względnie materiału genetycznego, to celowe jest
przeprowadzenie badań serologicznych.
NPLA
ELISA
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Krew zwierząt podatnych.
REPREZENTATYWNA
LICZBA PRÓBEK
W celu kontroli występowania CSF corocznie bada się próbki w ilości
zgodnej z rozporządzeniem Ministra Rolnictwa i Rozwoju Wsi z dnia 17
grudnia 2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt.
W czasie wystąpienia CSF, liczba pobieranych próbek powinna być zgodna
z Decyzją Komisji 2002/106/WE
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
· Igła,
· próbówka.
PROCEDURA
POBRANIA PRÓBKI
Próbki krwi do badań powinny być pobrane od ozdrowieńców oraz od świń,
które miały styczność z zakażonymi lub podejrzanymi o zakażenie wirusem
CSF zwierzętami. Dla dokładnej oceny sytuacji zdrowotnej w stadzie oraz
określenia dynamiki szerzenia się zakażenia wskazane byłoby pobranie
próbek krwi od zwierząt z różnych grup technologicznych (w różnym
wieku).
Krew, w objętości do 5ml, należy pobrać z żyły czczej przedniej (vena cava
cranialis) lub z żyły jarzmowej (vena jugularis) do odpowiednich probówek.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Probówki z pobraną krwią zostawia się w temperaturze pokojowej na okres
2-3 godzin. Po tym czasie należy oddzielić skrzep od ściany probówki przy
użyciu szklanej bagietki lub długiej, jałowej igły a następnie wstawić
probówki do lodówki na okres 14-18 godzin (na noc). Po tym czasie
uzyskaną surowicę należy przelać do małych, zamykanych szczelnym
kapslem probówek typu Eppendorf o pojemności 1,5ml. Tak przygotowane
próbki należy odpowiednio ponumerować (identyfikacja zwierząt!)
i przesłać, w temperaturze lodówki, do laboratorium.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Jak najszybciej, nie później niż w ciągu 24 godzin.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
· ZHW w Bydgoszczy
· ZHW w Gdańsku
· ZHW w Kielcach
· ZHW w Poznaniu
· PIWet-PIB w Puławach
PRAWODAWSTWO UE
· Dyrektywa Rady 64/432/EWG z dnia 26 czerwca 1964 r. w sprawie
problemów zdrowotnych zwierząt wpływających na handel wewnątrz
wspólnotowy bydłem i trzodą chlewną
· Decyzja Komisji nr 2002/106/WE zatwierdzająca Podręcznik
Diagnostyczny ustalający procedury diagnostyczne, metody pobierania

PODRĘCZNIK POBIERANIA PRÓBE K
35
próbek oraz kryteria do oceny testów laboratoryjnych służących do
potwierdzenia klasycznego pomoru świń
· Decyzja Komisji 2008/650/WE zmieniająca Dyrektywę Rady
82/894/EWG w sprawie wykazu zgłaszania chorób zwierząt we
wspólnocie poprzez włączenie niektórych chorób do wykazu chorób
wymagających zgłaszania oraz skreśleniu z tego wykazu
enterowirusowego zapalanie mózgu i rdzenia u świń
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania informacji
o występowaniu chorób zakaźnych zwierząt podlegających obowiązkowi
zwalczania i rejestracji oraz o wynikach monitorowania chorób
odzwierzęcych i odzwierzęcych czynników chorobotwórczych a także
związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 18 grudnia
2006 r. w sprawie zwalczania klasycznego pomoru świń
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt
PODRĘCZNIK POBIERANIA PRÓBE K
36
ZWIERZĘTA JEDNOKOPYTNE
KIERUNEK BADANIA
AFRYKAŃSKI POMÓR KONI
African horse sickness
METODA / TEST
Badanie wirusologiczne.
Badanie serologiczne.
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Zwierzęta żywe - pełna krew.
Zwierzęta padłe - wycinki śledziony,
płuc, węzłów chłonnych.
Krew zwierząt podatnych.
REPREZENTATYWNA
LICZBA PRÓBEK
Od każdego zwierzęcia podejrzanego o chorobę, od zwierząt padłych z
podejrzeniem choroby.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
W zależności od pobieranego materiału:
- krew: sterylna igła i próbówka,
- wycinki – czyste, jałowe narzędzia, najlepiej jednorazowego użytku.
PROCEDURA
POBRANIA PRÓBKI
Zwierzęta żywe - pełna krew (co
najmniej 10ml) pobrana od zwierząt
chorych w okresie gorączkowym na
antykoagulant (EDTA, heparyna);
Zwierzęta padłe - wycinki pobierać
do 10% zbuforowanego roztworu
glicerolu, pH 7,4.
Od zwierząt, które przeżyły
zakażenie wirusem AHS należy
pobrać po około 20ml krwi.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Próbki należy przechowywać w
temperaturze 4°C. Do laboratorium
należy je dostarczyć jak najszybciej,
najlepiej w termo torbach z
wkładami chłodzącymi, które
utrzymują temp. około 4°C podczas
transportu próbek.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Jak najszybciej.
W przypadku pobierania próbek w związku z podejrzeniem choroby, próbki
należy dostarczyć do Laboratorium Zakładu Wirusologii Państwowego
Instytutu Weterynaryjnego - Państwowego Instytutu Badawczego (ul.
Partyzantów 57, 24-100 Puławy).
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PRAWODAWSTWO UE Decyzja Komisji 2008/650/WE zmieniająca Dyrektywę Rady 82/894/EWG
w sprawie wykazu zgłaszania chorób zwierząt we wspólnocie poprzez
włączenie niektórych chorób do wykazu chorób wymagających zgłaszania
oraz skreśleniu z tego wykazu enterowirusowego zapalanie mózgu i rdzenia
u świń
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 18 maja 2004
r. w sprawie szczegółowego sposobu i trybu zwalczania afrykańskiego
pomoru koni
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe

PODRĘCZNIK POBIERANIA PRÓBE K
37
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
38
ZWIERZĘTA JEDNOKOPYTNE
KIERUNEK BADANIA
NIEDOKRWISTOŚĆ ZAKAŹNA KONI
Equine infectious anaemia
METODA / TEST
AGID
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Krew zwierząt podatnych.
REPREZENTATYWNA
LICZBA PRÓBEK
W przypadku podejrzenia choroby od wszystkich podejrzanych zwierząt.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
· sterylne probówki i igły lub
· tubostrzykawki.
PROCEDURA
POBRANIA PRÓBKI
Krew należy pobierać jałową igłą z żyły jarzmowej. Probówkę bez
antykoagulantu po napełnieniu krwią do około 7ml należy zamknąć
szczelnie korkiem i niezwłocznie oznakować.
Zaleca się stosowanie zestawów jednorazowego użytku zawierających
wkładkę ułatwiającą wydzielanie się surowicy i hermetycznie zamykanych.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Nie zamrażać.
Surowica uzyskana z próbki krwi nie może mieć znamion hemolizy lub być
zanieczyszczona florą bakteryjną.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
W ciągu 24 godzin.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
· ZHW w Łodzi
· ZHW w Krośnie
· ZHW w Poznaniu
· ZHW w Szczecinie
PRAWODAWSTWO UE Decyzja Komisji 2008/650/WE zmieniająca Dyrektywę Rady 82/894/EWG
w sprawie wykazu zgłaszania chorób zwierząt we wspólnocie poprzez
włączenie niektórych chorób do wykazu chorób wymagających zgłaszania
oraz skreśleniu z tego wykazu enterowirusowego zapalanie mózgu i rdzenia
u świń
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
39
ZWIERZĘTA JEDNOKOPYTNE
KIERUNEK BADANIA
NOSACIZNA
Glanders
METODA / TEST
OWD
UWAGI SPECJALNE
Ze względu na
potencjalne ryzyko zakażenia osób
zaangażowanych w
próbkobranie należy zachować szczególnie surowe środki ostrożności.
MATERIAŁ DO
BADANIA
Krew zwierząt podatnych.
REPREZENTATYWNA
LICZBA PRÓBEK
Od każdego zwierzęcia podejrzanego o chorobę.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
· sterylne probówki i igły lub
· tubostrzykawki.
PROCEDURA
POBRANIA PRÓBKI
Krew należy pobierać jałową igłą z żyły jarzmowej. Probówkę bez
antykoagulantu po napełnieniu krwią do około 7ml należy zamknąć
szczelnie korkiem i niezwłocznie oznakować.
Zaleca się stosowanie zestawów jednorazowego użytku zawierających
wkładkę ułatwiającą wydzielanie się surowicy i zamykanych hermetycznie.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Surowica uzyskana z próbki krwi nie może mieć znamion hemolizy lub być
zanieczyszczona florą bakteryjną.
Można przesyłać też surowicę w ilości 2-3ml.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
W ciągu 24 godzin.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
· ZHW w Krośnie
· ZHW w Gdańsku
· ZHW w Szczecinie
· PIWet-PIB w Puławach
PRAWODAWSTWO UE Decyzja Komisji 2008/650/WE zmieniająca Dyrektywę Rady 82/894/EWG
w sprawie wykazu zgłaszania chorób zwierząt we wspólnocie poprzez
włączenie niektórych chorób do wykazu chorób wymagających zgłaszania
oraz skreśleniu z tego wykazu enterowirusowego zapalanie mózgu i rdzenia
u świń
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt
PODRĘCZNIK POBIERANIA PRÓBE K
40
ZWIERZĘTA JEDNOKOPYTNE
KIERUNEK BADANIA
WIRUSOWE ZAPALENIE TĘTNIC KONI
Equine viral arteritis-EVA
METODA / TEST
SN
Test izolacji.
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Krew zwierząt podatnych.
W przypadku podejrzenia
wystąpienia EVA: wymazy z worka
spojówkowego i nosogardzieli lub
próbki krwi.
W przypadku śmierci lub poronienia
źrebiąt: wycinki narządów
wewnętrznych (płuca, śledzina,
wątroba, łożysko) i węzły chłonne
krezkowe.
W celu wykluczenia siewstwa
wirusa z nasieniem do badania
należy przesłać próbki nasienia
pobrane od ogierów serologicznie
dodatnich.
REPREZENTATYWNA
LICZBA PRÓBEK
Od każdego zwierzęcia podejrzanego o chorobę.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Sterylna próbówka i igły.
· wymazówki (przyżyciowo)
· sprzęt niezbędny do sekcji (w
przypadku zwierząt padłych)
PROCEDURA
POBRANIA PRÓBKI
Krew pobierać do sterylnych
probówek z zachowaniem zasad
aseptyki.
Wymazy i próbki krwi – próbki krwi
pobrać na antykoagulant z
wyjątkiem heparyny. Próbki należy
pobrać możliwie jak najwcześniej po
wystąpieniu gorączki u zakażonych
zwierząt.
Nasienie - należy pobrać i przesłać
do badania frakcję nasienia bogatą
w plemniki. Zaleca się pobranie
dwóch ejakulatów pobranych
najlepiej w odstępie kilku godzin lub
dni.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Nie zamrażać.
Przesyłać w temperaturze lodówki
po wcześniejszym uformowaniu
skrzepu w temperaturze pokojowej.
Wycinki - próbki należy schłodzić
lub zamrozić i jak najszybciej wysłać
do laboratorium.
Nasienie należy schłodzić i w stanie
schłodzonym przesłać jak
najszybciej do laboratorium. Jeżeli
nasienie nie może być natychmiast
wysłane do laboratorium należy je
zamrozić w -20°C i przesłać do
laboratorium w stanie zamrożenia.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Jak najszybciej.
Jak najszybciej.
Jeżeli nasienie nie może być
natychmiast wysłane do
laboratorium należy je zamrozić
w -20°C i przesłać do laboratorium
w stanie zamrożenia.
LABORATORIUM

PODRĘCZNIK POBIERANIA PRÓBE K
41
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PRAWODAWSTWO UE
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
42
ZWIERZĘTA JEDNOKOPYTNE
KIERUNEK BADANIA
ZARAZA STADNICZA
Dourine
METODA / TEST
OWD metodą probówkową (metodą
makro).
OWD metodą mikromiareczkową
(mikrometodą, metodą płytkową).
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Krew zwierząt podatnych.
REPREZENTATYWNA
LICZBA PRÓBEK
Od wszystkich zwierząt podejrzanych o chorobę .
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Sterylne igły, probówki.
PROCEDURA
POBRANIA PRÓBKI
Krew pobiera się z żyły jarzmowej w ilości około 7ml.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Świeżo pobrane próbki krwi należy pozostawić na około 2 godziny w
temperaturze pokojowej (od 18ºC do 25ºC), a następnie dostarczyć do
laboratorium. W czasie transportu próbki krwi chronić przed
przemarznięciem lub nadmiernym przegrzaniem, gdyż powoduje to
hemolizę lub przerośnięcie próbek.
Surowice wydzielone z próbek krwi silnie zhemolizowanych lub
zanieczyszczonych florą bakteryjną nie nadają się do badań OWD.
Silnie antykomplementarnie działają także wszystkie związki chemiczne,
które wiążą jony Mg i Ca np. wersenian sodowy, stosowany jako
antykoagulant przy pobieraniu krwi.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
W dniu pobrania.
W razie trudności dostarczenia próbek krwi do laboratorium w dniu ich
pobrania, można, po uformowaniu się skrzepu w temperaturze pokojowej,
do dnia następnego przechować je w chłodni (2-8°C).
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
· ZHW w Krośnie
· ZHW w Białymstoku
· ZHW w Szczecinie
· ZHW w Krośnie
· ZHW w Białymstoku
· ZHW w Szczecinie
· PIWet-PIB w Puławach
PRAWODAWSTWO UE Decyzja Komisji 2008/650/WE zmieniająca Dyrektywę Rady 82/894/EWG
w sprawie wykazu zgłaszania chorób zwierząt we wspólnocie poprzez
włączenie niektórych chorób do wykazu chorób wymagających zgłaszania
oraz skreśleniu z tego wykazu enterowirusowego zapalanie mózgu i rdzenia
u świń
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
43
MAŁE PRZEŻUWACZE
KIERUNEK BADANIA
TRZĘSAWKA OWIEC
Scrapie
METODA / TEST
ELISA
UWAGI SPECJALNE
Ze względu na
potencjalne ryzyko zakażenia osób
zaangażowanych w
próbkobranie należy zachować szczególnie surowe środki ostrożności.
Przedmiotem badania jest wykrywanie patologicznej formy białka
prionowego (PrP
Sc
) szybkimi testami w próbkach pnia mózgu.
MATERIAŁ DO
BADANIA
Rdzeń przedłużony z regionem zasuwki.
REPREZENTATYWNA
LICZBA PRÓBEK
Zgodnie z programem zwalczania.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Łyżeczka (szpatułka).
PROCEDURA
POBRANIA PRÓBKI
Do badania należy pobrać rdzeń przedłużony małych przeżuwaczy, z
rejonem zasuwki. W przypadku podejrzenia postaci atypowej zaleca się
pobieranie dodatkowo próbek móżdżku.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Nie zamrażać, przesyłać w temperaturze lodówki.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Jak najszybciej.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
· ZHW w Krakowie
· ZHW w Gdańsku
· ZHW w Poznaniu Prac. w Lesznie
· PIWet-PIB
PRAWODAWSTWO UE
· Rozporządzenie Parlamentu Europejskiego i Rady nr 999/2001 z dnia 22
maja 2001 r. ustanawiające zasady dotyczące zapobiegania, kontroli i
zwalczania niektórych przenośnych gąbczastych encefalopatii
· Rozporządzenie Komisji (WE) nr 21/2008 z dnia 11 stycznia 2008 r.
zmieniające załącznik X do rozporządzenia (WE) nr 999/2001
Parlamentu Europejskiego i Rady w odniesieniu do wykazów szybkich
testów
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania informacji
o występowaniu chorób zakaźnych zwierząt podlegających obowiązkowi
zwalczania i rejestracji oraz o wynikach monitorowania chorób
odzwierzęcych i odzwierzęcych czynników chorobotwórczych a także
związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Rady Ministrów z dnia 30 maja 2007 r. w sprawie
wprowadzenia programu zwalczania enzootycznej białaczki bydła,
gruźlicy bydła, brucelozy u bydła, wścieklizny, gąbczastej encefalolopatii

PODRĘCZNIK POBIERANIA PRÓBE K
44
oraz programu zwalczania i kontroli zakażeń wirusami wysoce zjadliwej
grypy ptaków dawny pomór drobiu u drobiu i ptaków dzikich
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt
PODRĘCZNIK POBIERANIA PRÓBE K
45
PTAKI
KIERUNEK BADANIA
CHLAMYDIOZA PTAKÓW
Avian chlamydiosis
METODA / TEST
OWD
UWAGI SPECJALNE
Ze względu na
potencjalne ryzyko zakażenia osób
zaangażowanych w
próbkobranie należy zachować szczególnie surowe środki ostrożności.
MATERIAŁ DO
BADANIA
Krew zwierząt podatnych.
REPREZENTATYWNA
LICZBA PRÓBEK
Liczba próbek powinna być adekwatna do częstotliwości występowania
poszukiwanego czynnika w populacji.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
· jałowa igła
· próbówka bez antykoagulantu
Zaleca się stosowanie zestawów jednorazowego użytku, zawierających
wkładkę ułatwiającą wydzielanie się surowicy i hermetycznie
zamykanych.
PROCEDURA
POBRANIA PRÓBKI
Przed pobraniem krwi upoważniony lekarz weterynarii powinien
sporządzić listę zwierząt zgodnie ze wzorem zawartym w Załączniku 2.
Krew należy pobierać jałową igłą z żyły skrzydłowej. Do probówki bez
antykolagulantu pobrać 1 do 2 ml krwi, zamknąć szczelnie korkiem i
niezwłocznie oznakować.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Uzyskana z próbki krwi surowica nie może być zhemolizowana lub
zanieczyszczona florą bakteryjną. Świeżo pobrane próbki krwi należy
pozostawić na około 2 godziny w temperaturze pokojowej.
W czasie transportu próbki krwi chronić przed przemarznięciem lub
nadmiernym przegrzaniem, gdyż powoduje to hemolizę lub przerośnięcie
próbek.
DOKUMENTACJA
TOWARZYSZĄCA
Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
W dniu pobrania próbki (zalecane).
W razie trudności dostarczenia próbek krwi do laboratorium w dniu ich
pobrania, można je do dnia następnego przechować w chłodni (2-8ºC), ale
po kilku godzinach formowania się skrzepu w temperaturze pokojowej.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PRAWODAWSTWO UE
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
46
PTAKI
KIERUNEK BADANIA
GRYPA PTAKÓW
Avian influenza
METODA / TEST
HA
UWAGI SPECJALNE
Ze względu na
potencjalne ryzyko zakażenia osób
zaangażowanych w
próbkobranie należy zachować szczególnie surowe środki ostrożności.
MATERIAŁ DO
BADANIA
Od ptaków padłych do badań pobiera się: tchawicę, płuca, mózg, śledzionę,
serce, wątrobę, nerki oraz jelita z treścią lub kał.
Przyżyciowo pobiera się od ptaków wymazy z tchawicy i szpary
podniebiennej oraz wymazy z kloaki wraz z kałem. Wskazane jest również
pobranie próbki z innych zmienionych narządów.
REPREZENTATYWNA
LICZBA PRÓBEK
Próbki do izolacji wirusa AI powinny pochodzić od co najmniej 5 ptaków
świeżo padłych i/lub chorych, poddanych humanitarnemu ubojowi.
Wymazy z kloaki wraz z kałem należy pobrać od co najmniej 20 ptaków.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
· sterylne plastikowe pojemniki lub podwójne, wodoszczelne, szczelnie
zamykane plastikowe woreczki
· waciki do pobierania wymazów z kloaki
PROCEDURA
POBRANIA PRÓBKI
Ze stada podejrzanego o zakażenie należy pobrać wymazy z kloaki wraz z
kałem (na waciku musi być wyraźnie widoczny kał).
Próbki należy pobierać z zachowaniem zasad aseptyki, do sterylnych
plastikowych pojemników lub podwójnych wodoszczelnych plastikowych
woreczków, szczelnie zamykanych, oddzielnie lub jako próbki zbiorcze, z
wyjątkiem kału i treści jelit, które puluje się oddzielnie.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Przechowywać i transportować w temperaturze 4°C.
DOKUMENTACJA
TOWARZYSZĄCA
Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Natychmiast po pobraniu.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PRAWODAWSTWO UE Decyzja Komisji 2006/437/WE zatwierdzająca podręcznik diagnostyczny
dotyczący grypy ptaków, przewidziany w dyrektywie Rady 2005/94/WE
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Rady Ministrów z dnia 30 maja 2007 r. w sprawie
wprowadzenia programu zwalczania enzootycznej białaczki bydła,
gruźlicy bydła, brucelozy u bydła, wścieklizny, gąbczastej
encefalolopatii oraz programu zwalczania i kontroli zakażeń wirusami

PODRĘCZNIK POBIERANIA PRÓBE K
47
wysoce zjadliwej grypy ptaków dawny pomór drobiu w drobiu i ptaków
dzikich
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 18 grudnia
2007 r. w sprawie zwalczania grypy ptaków
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
48
PTAKI
KIERUNEK BADANIA
MYKOPLAZMY DROBIU
Avian mycoplasmosis
METODA / TEST
· Wykrycie zarazków Mycoplasma poprzez wykazanie wzrostu na
podłożach PPLO charakterystycznych kolonii mykoplazm, a następnie
ich identyfikacja na selektywnych dla mykoplazm podłożach, z
zastosowaniem testów biochemicznych i/lub immunologicznych.
· Odczyn aglutynacji płytowej z użyciem antygenów (zinaktywowanych).
· ELISA.
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Od ptaków żywych należy pobrać próbki krwi i/lub wymaz z tchawicy, ze
szczeliny podniebiennej, kloaki lub prącia. W stadach gdzie prowadzona
jest inseminacja należy pobrać próbki spermy. W zakładzie wylęgowym do
badań pobiera się zamarłe w czasie klucia zarodki (z nie uszkodzoną
skorupą)
Od ptaków padłych lub dobitych należy pobrać próbki z jamy nosowej,
zatok, tchawicy, worków powietrznych, jajnika i z jajowodu, kloaki lub
prącia.
W środowisku kurnika pobrać wymazy z systemów wentylacyjnych, z
poideł i karmideł.
REPREZENTATYWNA
LICZBA PRÓBEK
Zawsze należy pobierać 60 próbek danego materiału.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Sterylne igły, probówki, wymazówki i pęsety.
PROCEDURA
POBRANIA PRÓBKI
Próbki krwi pobrać od ptaków losowo schwytanych (z żyły skrzydłowej lub
po skrwawieniu).
W laboratorium do badania można łączyć (pulować) po 10 próbek
indywidualnych.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Przechowywać w temperaturze od 2 do 8°C.
DOKUMENTACJA
TOWARZYSZĄCA
Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Jak najszybciej.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
· ZHW w Krakowie
- odczyn aglutynacji płytowej z użyciem antygenów (zinaktywowanych)
- ELISA
· ZHW w Warszawie
- odczyn aglutynacji płytowej z użyciem antygenów (zinaktywowanych)
· ZHW w Poznaniu
- odczyn aglutynacji płytowej z użyciem antygenów (zinaktywowanych)
- ELISA
· ZHW w Szczecinie
- odczyn aglutynacji płytowej z użyciem antygenów (zinaktywowanych)
- ELISA
· PIWet-PIB w Puławach
- odczyn aglutynacji płytowej z użyciem antygenów (zinaktywowanych)
- ELISA
PRAWODAWSTWO UE Dyrektywa Rady 90/539/EWG z 15 października 1990 roku w sprawie
warunków zdrowotnych zwierząt, regulujących handel

PODRĘCZNIK POBIERANIA PRÓBE K
49
wewnątrzwspólnotowy i przywóz z państw trzecich drobiu i jaj wylęgowych
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania informacji
o występowaniu chorób zakaźnych zwierząt podlegających obowiązkowi
zwalczania i rejestracji oraz o wynikach monitorowania chorób
odzwierzęcych i odzwierzęcych czynników chorobotwórczych a także
związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
50
PTAKI
KIERUNEK BADANIA
RZEKOMY POMÓR DROBIU
Newcastle disease - ND
METODA / TEST
Izolacja wirusa i jego identyfikacja metodą HA.
UWAGI SPECJALNE
Ze względu na
potencjalne ryzyko zakażenia osób
zaangażowanych w
próbkobranie należy zachować szczególnie surowe środki ostrożności.
MATERIAŁ DO
BADANIA
Od ptaków padłych i/lub chorych poddanych humanitarnemu zabiciu do
badań pobiera się: tchawicę, płuca, mózg, śledzionę, wątrobę, nerki oraz
jelita z treścią lub kał.
Przyżyciowo pobiera się od ptaków wymazy z tchawicy i szpary
podniebiennej oraz wymazy z kloaki wraz z kałem. Wskazane jest również
pobranie próbki z innych zmienionych narządów.
REPREZENTATYWNA
LICZBA PRÓBEK
Próbki do izolacji wirusa ND powinny pochodzić od co najmniej 5 ptaków
świeżo padłych i/lub chorych, poddanych humanitarnemu ubojowi.
Wymazy z kloaki wraz z kałem należy pobrać od co najmniej 20 ptaków.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
· Sterylne plastikowe pojemniki lub podwójne, wodoszczelne, szczelnie
zamykane plastikowe woreczki;
· Waciki do pobierania wymazów z kloaki.
PROCEDURA
POBRANIA PRÓBKI
Ze stada podejrzanego o zakażenie należy pobrać wymazy z kloaki wraz z
kałem (na waciku musi być wyraźnie widoczny kał) i umieścić w podłożu
transportowym (1-2ml PBS z dodatkiem antybiotyków: penicylina 10 tys.
JM/ml, streptomycyna 10mg/ml, gentamycyna 0,25 mg/ml, mykostatyna 5
tys. JM/ml ).
Próbki należy pobierać z zachowaniem zasad aseptyki, do sterylnych
plastikowych pojemników lub podwójnych wodoszczelnych plastikowych
woreczków, szczelnie zamykanych, oddzielnie lub jako próbki zbiorcze, z
wyjątkiem kału i treści jelit, które puluje się oddzielnie.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Transportować w temperaturze od 2 do 8°C.
DOKUMENTACJA
TOWARZYSZĄCA
Załącznik 1 - Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PIWet-PIB w Puławach
PRAWODAWSTWO UE Dyrektywa Rady 92/66/EWG wprowadzająca wspólnotowe środki
zwalczania rzekomego pomoru drobiu
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 29 lipca 2005
r. w sprawie zwalczania rzekomego pomoru drobiu
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia

PODRĘCZNIK POBIERANIA PRÓBE K
51
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt
PODRĘCZNIK POBIERANIA PRÓBE K
52
PSZCZOŁY
KIERUNEK BADANIA
ZGNILEC AMERYKAŃSKI PSZCZÓŁ
American foulbrood
METODA / TEST
Izolacja i identyfikacja bakterii Paenibacillus larvae z badanego materiału
w drodze badań mikrobiologicznych (hodowlanych i mikroskopowych).
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
1. Patologicznie zmieniony czerw
*
- przy stwierdzeniu w rodzinach
pszczelich obecności patologicznie zmienionego czerwiu;
2. Miód lub zapasy pokarmu - z rodzin podejrzanych o zakażenie, w
których nie stwierdza się klinicznych objawów choroby.
REPREZENTATYWNA
LICZBA PRÓBEK
Z kilku pni chorych lub podejrzanych o chorobę.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Metalowa łyżka, duży skalpel albo nóż używany w pasiece lub duży nóż
stołowy.
PROCEDURA
POBRANIA PRÓBKI
Patologicznie zmieniony czerw - z chorych rodzin, z plastra z czerwiem
krytym należy wyciąć fragment o wymiarach 10 x 10 cm (wg OIE około 20
cm
2
). Pobrany wycinek powinien zawierać możliwie dużo komórek ze
zmienionym chorobowo czerwiem, natomiast niepożądana jest w nim
obecność miodu.
Miód lub zapasy pokarmu - metalową łyżką wybrać próbki zapasów
pokarmu z komórek plastrów z czerwiem. Próby można pobrać z
pojedynczych rodzin lub można pobrać próby zbiorcze, wówczas 1 próba
zbiorcza stanowi zapasy pokarmu z 6 rodzin. Wielkość 1 próby powinna
wynosić około 50ml miodu (zapasu pokarmu).
Próby miodu do badań można również pobrać z miodu już odwirowanego
(przeznaczonego do sprzedaży). Jednak w takim przypadku, wykrycie w
próbce obecności przetrwalników nie pozwala na dokładną identyfikację
zakażonych rodzin.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Patologicznie zmieniony czerw - w przypadku wycinków plastrów, pobrane
próby należy luźno opakować w papier i najlepiej umieścić w twardym,
kartonowym lub drewnianym pudełku, zabezpieczającym przed
zgnieceniem. Do pakowania prób nie należy używać materiałów
utrudniających przepływ powietrza (torby plastikowe, folia aluminiowa,
opakowania szklane lub metalowe), które sprzyjają rozwojowi pleśni i
utrudniają wykonanie badań.
Miód lub zapasy pokarmu - próby miodu powinny być umieszczone w
czystych, szklanych opakowaniach, zabezpieczonych dodatkowo przed
stłuczeniem.
Oznakowanie próbek - na papierowym opakowaniu, w który zapakowano
pobrane wycinki plastrów, umieszcza się numer ula. Każdą próbkę (miód i
wycinki) zaopatruje się w etykietę zawierającą opis i numer
identyfikacyjny, rodzaj próbki, datę i miejsce jej pobrania, imię i nazwisko
oraz adres posiadacza pszczół.
Temperatura - czynności przygotowawcze przeprowadza się w
temperaturze pokojowej. Transport i przechowywanie prób w temp. poniżej
0ºC.
DOKUMENTACJA
TOWARZYSZĄCA
Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Jak najszybciej, nie później niż przed upływem 24 godzin od pobrania.
*
Czerw – w pszczelarstwie łączna nazwa stadiów rozwojowych pszczoły miodnej od jaja do poczwarki.

PODRĘCZNIK POBIERANIA PRÓBE K
53
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PRAWODAWSTWO UE
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 14 września
2005 r. w sprawie zwalczania zgnilca amerykańskiego pszczół
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
54
PSZCZOŁY
KIERUNEK BADANIA
ZGNILEC EUROPEJSKI
European foulbrood
METODA / TEST
Izolacja i identyfikacja bakterii Melissococcus plutonius z badanego
materiału w drodze badań mikrobiologicznych (hodowlanych i
mikroskopowych).
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Patologicznie zmieniony czerw
*
.
REPREZENTATYWNA
LICZBA PRÓBEK
Z kilku pni chorych lub podejrzanych o chorobę.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Metalowa łyżka, duży skalpel albo nóż używany w pasiece lub duży nóż
stołowy.
PROCEDURA
POBRANIA PRÓBKI
Z chorych rodzin, z plastra z czerwiem krytym należy wyciąć fragment o
wymiarach 10 x 10 cm (wg OIE około 20 cm
2
). Pobrany wycinek powinien
zawierać możliwie dużo komórek ze zmienionym chorobowo czerwiem,
natomiast niepożądana jest w nim obecność miodu.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
W przypadku wycinków plastrów, pobrane próby należy luźno opakować w
papier i najlepiej umieścić w twardym, kartonowym lub drewnianym
pudełku, zabezpieczającym przed zgnieceniem. Do pakowania prób nie
należy używać materiałów utrudniających przepływ powietrza (torby
plastikowe, folia aluminiowa, opakowania szklane lub metalowe), które
sprzyjają rozwojowi pleśni i utrudniają wykonanie badań.
Czynności przygotowawcze przeprowadza się w temperaturze pokojowej.
Transport i przechowywanie prób w temp. poniżej 0ºC.
DOKUMENTACJA
TOWARZYSZĄCA
Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Jak najszybciej, nie później niż w ciągu 24 godzin.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PRAWODAWSTWO UE
PRAWODAWSTWO
POLSKIE
·
Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
·
Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
·
Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt
*
Czerw – w pszczelarstwie łączna nazwa stadiów rozwojowych pszczoły miodnej od jaja do poczwarki.
PODRĘCZNIK POBIERANIA PRÓBE K
55
ZWIERZĘTA AKWAKULTURY
KIERUNEK BADANIA
BONAMIOZA
Bonamia ostreae
METODA / TEST
Mikroskopowa identyfikacja Bonamia ostreae na podstawie cech
morfologicznych barwionych preparatów odciskowych i histologicznych.
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Do laboratorium należy dostarczyć żywe ostrygi lub prawidłowo pobrane
próbki, zabezpieczone w płynie utrwalającym (Załącznik 8 – Przygotowanie
płynów utrwalających). Materiał do badań stanowią preparaty odciskowe
oraz histologiczne przygotowane z ostryg.
REPREZENTATYWNA
LICZBA PRÓBEK
Liczba ostryg stanowiących próbę zależy od wielkości produkcji danego
obiektu, jednak nie mniej niż 30 sztuk.
Zależność wielkości próby od liczebności produkcji i prawdopodobieństwa
wykrycia patogenu, przy założonym rozpowszechnieniu patogenu w grupie
i stuprocentowej czułości metody badawczej, obrazuje poniższa tabela
autorstwa Ossiander i Wedemeyer, zawarta w podręczniku do diagnostyki
chorób zwierząt wodnych OIE:
Liczebność
produkcji
Przy 2%
rozpowszechnieniu,
wielkość próby
Przy 5%
rozpowszechnieniu,
wielkość próby
Przy 10%
rozpowszechnieniu,
wielkość próby
50
50
35
20
100
75
45
23
250
110
50
25
500
130
55
26
1000
140
55
27
1500
140
55
27
2000
145
60
27
4000
145
60
27
10.000
145
60
27
100.000
lub
więcej
150
60
30
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Skalpel, nożyce i nożyczki, kasetka do badań histologicznych lub probówka,
płyn utrwalający.
PROCEDURA
POBRANIA PRÓBKI
Żywe ostrygi powinny być pobierane z obiektu/strefy hodowli w taki sposób,
aby dana próba umożliwiła przegląd i ocenę stanu zdrowotnego całej
populacji mięczaków, a więc wszystkich grup wiekowych.
Próbki zabezpieczone w płynie utrwalającym - w czasie przeprowadzania
sekcji skalpelem dokonuje się poprzecznego cięcia poprzez tkanki miękkie
ostrygi tak, aby preparat zawierał przekrój przez jak najwięcej narządów.
Próbkę umieszcza się w kasetce do badań histologicznych lub probówce i
utrwala w płynie utrwalającym minimum 2 dni. Stosunek płynu do próbki
powinien wynosić 1:10 (Załącznik 8 – Przygotowanie płynów
utrwalających).
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Ostrygi transportowane do laboratorium muszą być tak zabezpieczone, aby
nie uległy uszkodzeniu ani nie wystąpiły śnięcia.
DOKUMENTACJA
TOWARZYSZĄCA
Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Transport żywych ostryg do laboratorium powinien odbyć się do 24 godzin
od odłowu.

PODRĘCZNIK POBIERANIA PRÓBE K
56
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PRAWODAWSTWO UE
· Dyrektywa Rady 91/67/EWG dotycząca warunków zdrowotnych
zwierząt, obowiązujących przy wprowadzaniu na rynek zwierząt i
produktów akwakultury
· Dyrektywa Rady 95/70/WE wprowadzająca minimalne wspólnotowe
środki zwalczania niektórych chorób małży
· Decyzja Komisji 2002/878/WE ustanawiająca plany pobierania próbek
oraz metody diagnostyczne stosowane w celu wykrywania i
potwierdzania występowania u mięczaków Bonamiosis (Bonami ostreae)
i Marteiliosis (Marteilia refringens)
· Decyzja
Komisji
2008/650/WE
zmieniająca
Dyrektywę
Rady
82/894/EWG w sprawie wykazu zgłaszania chorób zwierząt we
wspólnocie poprzez włączenie niektórych chorób do wykazu chorób
wymagających
zgłaszania
oraz
skreśleniu
z
tego
wykazu
enterowirusowego zapalanie mózgu i rdzenia u świń
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania informacji
o występowaniu chorób zakaźnych zwierząt podlegających obowiązkowi
zwalczania i rejestracji oraz o wynikach monitorowania chorób
odzwierzęcych i odzwierzęcych czynników chorobotwórczych a także
związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 12 kwietnia
2006 r. w sprawie zwalczania niektórych chorób zakaźnych mięczaków
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt
PODRĘCZNIK POBIERANIA PRÓBE K
57
ZWIERZĘTA AKWAKULTURY
KIERUNEK BADANIA
MARTEILIOZA
Marteilia refringens
METODA / TEST
Mikroskopowa identyfikacja Marteilia refringens na podstawie cech
morfologicznych barwionych preparatów odciskowych i histologicznych.
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Do laboratorium należy dostarczyć żywe ostrygi lub prawidłowo pobrane
próbki, zabezpieczone w płynie utrwalającym (Załącznik 8 – Przygotowanie
płynów utrwalających). Materiał do badań stanowią preparaty odciskowe
oraz histologiczne przygotowane z ostryg.
REPREZENTATYWNA
LICZBA PRÓBEK
Liczba ostryg stanowiących próbę zależy od wielkości produkcji danego
obiektu, jednak nie mniej niż 30 sztuk.
Zależność wielkości próby od liczebności produkcji i prawdopodobieństwa
wykrycia patogenu, przy założonym rozpowszechnieniu patogenu w grupie
i stuprocentowej czułości metody badawczej, obrazuje poniższa tabela
autorstwa Ossiander i Wedemeyer, zawarta w podręczniku do diagnostyki
chorób zwierząt wodnych OIE:
Liczebność
produkcji
Przy 2%
rozpowszechnieniu,
wielkość próby
Przy 5%
rozpowszechnieniu,
wielkość próby
Przy 10%
rozpowszechnieniu,
wielkość próby
50
50
35
20
100
75
45
23
250
110
50
25
500
130
55
26
1000
140
55
27
1500
140
55
27
2000
145
60
27
4000
145
60
27
10.000
145
60
27
100.000
lub
więcej
150
60
30
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Skalpel, nożyce, nóż, kasetka do badań histologicznych lub probówka, płyn
utrwalający.
PROCEDURA
POBRANIA PRÓBKI
Żywe ostrygi powinny być pobierane z obiektu/strefy hodowli w taki sposób,
aby dana próba umożliwiła przegląd i ocenę stanu zdrowotnego całej
populacji mięczaków, a więc wszystkich grup wiekowych.
Próbki zabezpieczone w płynie utrwalającym. W czasie przeprowadzania
sekcji skalpelem dokonuje się poprzecznego cięcia poprzez tkanki miękkie
ostrygi tak, aby preparat zawierał przekrój przez jak najwięcej narządów.
Próbkę umieszcza się w kasetce do badań histologicznych lub probówce i
utrwala w płynie utrwalającym minimum 2 dni. Stosunek płynu do próbki
powinien wynosić 1:10 (Załącznik 8 – Przygotowanie płynów
utrwalających).
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Ostrygi transportowane do laboratorium muszą być tak zabezpieczone, aby
nie uległy uszkodzeniu ani nie wystąpiły śnięcia.
DOKUMENTACJA
TOWARZYSZĄCA
Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Transport żywych ostryg do laboratorium powinien odbyć się do 24 godzin
od odłowu.

PODRĘCZNIK POBIERANIA PRÓBE K
58
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PRAWODAWSTWO UE
· Dyrektywa Rady 91/67/EWG dotycząca warunków zdrowotnych
zwierząt, obowiązujących przy wprowadzaniu na rynek zwierząt i
produktów akwakultury
· Dyrektywa Rady 95/70/WE wprowadzająca minimalne wspólnotowe
środki zwalczania niektórych chorób małży
· Decyzja Komisji 2002/878/WE ustanawiająca plany pobierania próbek
oraz metody diagnostyczne stosowane w celu wykrywania i
potwierdzania występowania u mięczaków Bonamiosis (Bonami ostreae)
i Marteiliosis (Marteilia refringens)
· Decyzja
Komisji
2008/650/WE
zmieniająca
Dyrektywę
Rady
82/894/EWG w sprawie wykazu zgłaszania chorób zwierząt we
wspólnocie poprzez włączenie niektórych chorób do wykazu chorób
wymagających
zgłaszania
oraz
skreśleniu
z
tego
wykazu
enterowirusowego zapalanie mózgu i rdzenia u świń
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania informacji
o występowaniu chorób zakaźnych zwierząt podlegających obowiązkowi
zwalczania i rejestracji oraz o wynikach monitorowania chorób
odzwierzęcych i odzwierzęcych czynników chorobotwórczych a także
związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 12 kwietnia
2006 r. w sprawie zwalczania niektórych chorób zakaźnych mięczaków
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt
PODRĘCZNIK POBIERANIA PRÓBE K
59
ZWIERZĘTA AKWAKULTURY
KIERUNEK BADANIA
WIOSENNA WIREMIA KARPI
Spring viraemia of carp - SVC
METODA / TEST
Identyfikacja wirusa (ELISA) wyizolowanego uprzednio w hodowli
komórkowej.
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Ryby (żywe lub martwe).
REPREZENTATYWNA
LICZBA PRÓBEK
Ilość ryb
1. od 30 szt. do 150 szt. ryb dwukrotnie w ciągu roku - w przypadku próbek
pobieranych do badań monitoringowych;
2. 10 szt. ryb z objawami klinicznymi - w przypadku podejrzenia choroby;
3. 150 szt. ryb dwukrotnie w ciągu roku - w przypadku próbek do badań w
ramach realizacji programu zwalczania SVC.
Zasada priorytetów przy doborze ryb w próbce:
1. ryby wykazujące objawy chorobowe oraz ryby o osłabionej kondycji,
2. ryby należące do najbardziej wrażliwych na infekcję wirusów, wg
załączonego wykazu:
a. Karp (Cyprinus carpio) i koi karp
b. Amur (Ctenopharyngodon idella)
c. Tołpyga biała (Hypophthalmichthys molitrix)
d. Tołpyga pstra (Aristichthys nobilis)
e. Karaś srebrzysty (Carassius auratus)
f. Karaś pospolity (Carassius carassius)
g. Karaś „złota rybka” (Carassius auratus)
h. Lin (Tinca tinca)
i. Sum (Silurus glanis).
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Plombownica do zaplombowania próbki oraz:
Żywe ryby - pojemniki (kontenery) zapewniające bezpieczeństwo,
odpowiednią przestrzeń i warunki, a w szczególności: wentylację, właściwą
temperaturę, zaopatrzenie w wodę i tlen.
Uśmiercone ryby:
· worek foliowy (2 szt.),
· papier posiadający właściwości absorpcyjne,
· lód lub wkłady chłodzące,
· pudełko styropianowe.
PROCEDURA
POBRANIA PRÓBKI
Do badań monitoringowych w kierunku SVC, próbki pobiera się, gdy
temperatura wody w ciągu doby nie przekracza 15ºC. Próbki ryb do
badania pobiera się dwa razy w ciągu roku w odstępie minimum 4 miesięcy
(w miesiącach marzec-maj i wrzesień-grudzień).
W przypadku podejrzenia wystąpienia klinicznej postaci SVC nie stosuje
się ograniczeń termicznych, czy też czasowych.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Każda próbka ryb powinna być zaplombowana przez nadzorującego
pobranie urzędowego lekarza (ewentualnie upoważnioną przez niego osobę)
oraz zaopatrzona w pismo przewodnie.
Żywe ryby transportuje się w pojemnikach (kontenerach) zapewniających
bezpieczeństwo, odpowiednią przestrzeń i warunki, a w szczególności:
wentylację, właściwą temperaturę, zaopatrzenie w wodę i tlen.
Uśmiercone ryby umieszcza się w worku foliowym, zawija się w papier
posiadający właściwości absorpcyjne, a następnie układa między
warstwami lodu lub wkładów chłodzących. Całość umieszcza się w worku
foliowym, a następnie w pudełku styropianowym. Temperatura wewnątrz
opakowania na początku transportu powinna wynosić około 4°C, natomiast
na końcu, tj. przy odbiorze w laboratorium, nie powinna przekraczać 10°C.
Ryby nie mogą być zamrożone!
DOKUMENTACJA
TOWARZYSZĄCA
Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych

PODRĘCZNIK POBIERANIA PRÓBE K
60
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Czas transportu próbek do laboratorium może wynosić maksymalnie:
- w przypadku ryb żywych - 6 h.
- w przypadku ryb uśmierconych - 12 h.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
· ZHW w Bydgoszczy
PRAWODAWSTWO UE Decyzja Komisji 2001/183/WE ustanawiająca plany pobierania próbek i
metody diagnostyczne do celów wykrywania i potwierdzania występowania
niektórych chorób ryb oraz uchylająca decyzję 92/532/EWG
PRAWODAWSTWO
POLSKIE
·
Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
·
Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
·
Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
61
ZWIERZĘTA AKWAKULTURY
KIERUNEK BADANIA
WIRUSOWA POSOCZNICA KRWOTOCZNA
Viral haemorrhagic septicaemia - VHS
METODA / TEST
Identyfikacja wirusa (ELISA) wyizolowanego uprzednio w hodowli
komórkowej.
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Ryby (żywe lub martwe).
REPREZENTATYWNA
LICZBA PRÓBEK
Ilość ryb
1. od 30 szt. do 150 szt. ryb dwukrotnie w ciągu roku - w przypadku
próbek pobieranych do badań monitoringowych;
2. 10 szt. ryb z objawami klinicznymi - w przypadku podejrzenia choroby;
3. 150 szt. ryb dwukrotnie w ciągu roku - w przypadku próbek do badań
w ramach realizacji programu zwalczania VHS i IHN.
Zasada priorytetów przy doborze ryb w próbce:
1. ryby wykazujące objawy chorobowe oraz ryby o osłabionej kondycji,
2. ryby należące do najbardziej wrażliwych na infekcję wirusów, wg
załączonego wykazu:
· Pstrąg tęczowy (Oncorhynchus mykiss)
· Pstrąg źródlany (Salvelinus fontinalis)
· Pstrąg potokowy (Salmo trutta)
· Łosoś atlantycki (Salmo salar)
· Szczupak (Esox lucius)
· Lipień (Thymallus thymallus)
· Korygonidy (Corygonus sp.)
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Plombownica do zaplombowania próbki oraz:
Żywe ryby - pojemniki (kontenery) zapewniające bezpieczeństwo,
odpowiednią przestrzeń i warunki, a w szczególności: wentylację, właściwą
temperaturę, zaopatrzenie w wodę i tlen.
Uśmiercone ryby:
· worek foliowy (2 szt.),
· papier posiadający właściwości absorpcyjne,
· lód lub wkłady chłodzące,
· pudełko styropianowe.
PROCEDURA
POBRANIA PRÓBKI
Do badań monitoringowych w kierunku VHS, próbki pobiera się, gdy
temperatura wody w ciągu doby nie przekracza 15ºC. Próbki ryb do
badania pobiera się dwa razy w ciągu roku w odstępie minimum 4 miesięcy
(w miesiącach marzec-maj i wrzesień-grudzień).
W przypadku podejrzenia wystąpienia klinicznej postaci VHS nie stosuje
się ograniczeń termicznych, czy też czasowych.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Każda próbka ryb powinna być zaplombowana przez nadzorującego
pobranie urzędowego lekarza (ewentualnie upoważnioną przez niego osobę)
oraz zaopatrzona w pismo przewodnie.
Żywe ryby transportuje się w pojemnikach (kontenerach) zapewniających
bezpieczeństwo, odpowiednią przestrzeń i warunki, a w szczególności:
wentylację, właściwą temperaturę, zaopatrzenie w wodę i tlen.
Uśmiercone ryby umieszcza się w worku foliowym, zawija się w papier
posiadający właściwości absorpcyjne, a następnie układa między
warstwami lodu lub wkładów chłodzących. Całość umieszcza się w worku
foliowym, a następnie w pudełku styropianowym. Temperatura wewnątrz
opakowania na początku transportu powinna wynosić około 4°C, natomiast
na końcu, tj. przy odbiorze w laboratorium, nie powinna przekraczać 10°C.
Ryby nie mogą być zamrożone!
DOKUMENTACJA
TOWARZYSZĄCA
Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
CZAS NA
DOSTARCZENIE
Czas transportu próbek do laboratorium może wynosić maksymalnie:
- w przypadku ryb żywych - 6 godzin

PODRĘCZNIK POBIERANIA PRÓBE K
62
POBRANEGO
MATERIAŁU DO
LABORATORIUM
- w przypadku ryb uśmierconych - 12 godzin.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
· ZHW w Bydgoszczy
PRAWODAWSTWO UE Decyzja Komisji 2001/183/WE ustanawiająca plany pobierania próbek i
metody diagnostyczne do celów wykrywania i potwierdzania występowania
niektórych chorób ryb oraz uchylająca decyzję 92/532/EWG
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 29 marca
2005 r. w sprawie zwalczania chorób zakaźnych ryb
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
63
ZWIERZĘTA AKWAKULTURY
KIERUNEK BADANIA
ZAKAŹNA ANEMIA ŁOSOSI
Infectious salmon anaemia - ISA
METODA / TEST
Identyfikacja wirusa (IFAT) wyizolowanego uprzednio w hodowli
komórkowej.
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Ryby (żywe lub martwe).
REPREZENTATYWNA
LICZBA PRÓBEK
Ilość ryb
1. od 30 szt. do 150 szt. ryb dwukrotnie w ciągu roku - w przypadku
próbek pobieranych do badań monitoringowych;
2. 10 szt. ryb z objawami klinicznymi - w przypadku podejrzenia
choroby.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Plombownica do zaplombowania próbki oraz:
Żywe ryby - pojemniki (kontenery) zapewniające bezpieczeństwo,
odpowiednią przestrzeń i warunki, a w szczególności: wentylację, właściwą
temperaturę, zaopatrzenie w wodę i tlen.
Uśmiercone ryby:
· worek foliowy (2 szt.),
· papier posiadający właściwości absorpcyjne,
· lód lub wkłady chłodzące,
· pudełko styropianowe.
PROCEDURA
POBRANIA PRÓBKI
Do badań monitoringowych w kierunku IHN próbki pobiera się, gdy
temperatura wody w ciągu doby nie przekracza 15ºC. Próbki ryb do
badania pobiera się dwa razy w ciągu roku w odstępie minimum 4 miesięcy
(w miesiącach marzec-maj i wrzesień-grudzień).
W przypadku podejrzenia wystąpienia klinicznej postaci IHN nie stosuje
się ograniczeń termicznych, czy też czasowych.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Każda próbka ryb powinna być zaplombowana przez nadzorującego
pobranie urzędowego lekarza (ewentualnie upoważnioną przez niego osobę)
oraz zaopatrzona w pismo przewodnie.
Żywe ryby transportuje się w pojemnikach (kontenerach) zapewniających
bezpieczeństwo, odpowiednią przestrzeń i warunki, a w szczególności:
wentylację, właściwą temperaturę, zaopatrzenie w wodę i tlen.
Uśmiercone ryby umieszcza się w worku foliowym, zawija się w papier
posiadający właściwości absorpcyjne, a następnie układa między
warstwami lodu lub wkładów chłodzących. Całość umieszcza się w worku
foliowym, a następnie w pudełku styropianowym. Temperatura wewnątrz
opakowania na początku transportu powinna wynosić około 4°C, natomiast
na końcu, tj. przy odbiorze w laboratorium, nie powinna przekraczać 10°C.
Ryby nie mogą być zamrożone!
DOKUMENTACJA
TOWARZYSZĄCA
Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Czas transportu próbek do laboratorium może wynosić maksymalnie:
- w przypadku ryb żywych - 6 godzin
- w przypadku ryb uśmierconych - 12 godzin.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PRAWODAWSTWO UE
· Decyzja Komisji 2001/183/WE ustanawiająca plany pobierania próbek i
metody diagnostyczne do celów wykrywania i potwierdzania
występowania niektórych chorób ryb oraz uchylająca decyzję
92/532/EWG

PODRĘCZNIK POBIERANIA PRÓBE K
64
· Decyzja Komisji 203/466/WE ustanawiająca kryteria podziału na strefy
i urzędowego nadzoru w następstwie podejrzenia lub potwierdzenia
występowania niedokrwistości zakaźnej łososia (ISA)
PRAWODAWSTWO
POLSKIE
·
Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
·
Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 29 marca
2005 r. w sprawie zwalczania chorób zakaźnych ryb
·
Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
·
Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
65
ZWIERZĘTA AKWAKULTURY
KIERUNEK BADANIA
ZAKAŹNA MARTWICA UKŁADU KRWIOTWÓRCZEGO
Infectious haematopoietic necrosis - IHN
METODA / TEST
Identyfikacja wirusa (RT-PCR) wyizolowanego uprzednio w hodowli
komórkowej.
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Ryby (żywe lub martwe).
REPREZENTATYWNA
LICZBA PRÓBEK
Ilość ryb
1. od 30 szt. do 150 szt. ryb dwukrotnie w ciągu roku - w przypadku
próbek pobieranych do badań monitoringowych;
2. 10 szt. ryb z objawami klinicznymi - w przypadku podejrzenia
choroby;
3. 150 szt. ryb dwukrotnie w ciągu roku - w przypadku próbek do
badań w ramach realizacji programu zwalczania VHS i IHN.
Zasada priorytetów przy doborze ryb w próbce:
1. ryby wykazujące objawy chorobowe oraz ryby o osłabionej kondycji,
2. ryby należące do najbardziej wrażliwych na infekcję wirusów, wg
załączonego wykazu:
· Pstrąg tęczowy (Oncorhynchus mykiss)
· Łosoś atlantycki (Salmo salar)
· Pstrąg potokowy (Salmo trutta)
· Pstrąg źródlany (Salvelinus fontinalis)
· Pstrąg arktyczny (Salvelinus alpinus)
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Plombownica do zaplombowania próbki oraz:
Żywe ryby - pojemniki (kontenery) zapewniające bezpieczeństwo,
odpowiednią przestrzeń i warunki, a w szczególności: wentylację, właściwą
temperaturę, zaopatrzenie w wodę i tlen.
Uśmiercone ryby:
· worek foliowy (2 szt.),
· papier posiadający właściwości absorpcyjne,
· lód lub wkłady chłodzące,
· pudełko styropianowe.
PROCEDURA
POBRANIA PRÓBKI
Do badań monitoringowych w kierunku IHN próbki pobiera się, gdy
temperatura wody w ciągu doby nie przekracza 15ºC. Próbki ryb do
badania pobiera się dwa razy w ciągu roku w odstępie minimum 4 miesięcy
(w miesiącach marzec-maj i wrzesień – grudzień).
W przypadku podejrzenia wystąpienia klinicznej postaci IHN nie stosuje
się ograniczeń termicznych, czy też czasowych.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Każda próbka ryb powinna być zaplombowana przez nadzorującego
pobranie urzędowego lekarza (ewentualnie upoważnioną przez niego osobę)
oraz zaopatrzona w pismo przewodnie.
Żywe ryby transportuje się w pojemnikach (kontenerach) zapewniających
bezpieczeństwo, odpowiednią przestrzeń i warunki, a w szczególności:
wentylację, właściwą temperaturę, zaopatrzenie w wodę i tlen.
Uśmiercone ryby umieszcza się w worku foliowym, zawija się w papier
posiadający właściwości absorpcyjne, a następnie układa między
warstwami lodu lub wkładów chłodzących. Całość umieszcza się w worku
foliowym, a następnie w pudełku styropianowym. Temperatura wewnątrz
opakowania na początku transportu powinna wynosić około 4°C, natomiast
na końcu, tj. przy odbiorze w laboratorium, nie powinna przekraczać 10°C.
Ryby nie mogą być zamrożone!
DOKUMENTACJA
TOWARZYSZĄCA
Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
CZAS NA
DOSTARCZENIE
POBRANEGO
Czas transportu próbek do laboratorium może wynosić maksymalnie:
- w przypadku ryb żywych - 6 godzin
- w przypadku ryb uśmierconych - 12 godzin.

PODRĘCZNIK POBIERANIA PRÓBE K
66
MATERIAŁU DO
LABORATORIUM
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PRAWODAWSTWO UE Decyzja Komisji 2001/183/WE ustanawiająca plany pobierania próbek i
metody diagnostyczne do celów wykrywania i potwierdzania występowania
niektórych chorób ryb oraz uchylająca decyzję 92/532/EWG
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 29 marca
2005 r. w sprawie zwalczania chorób zakaźnych ryb
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt
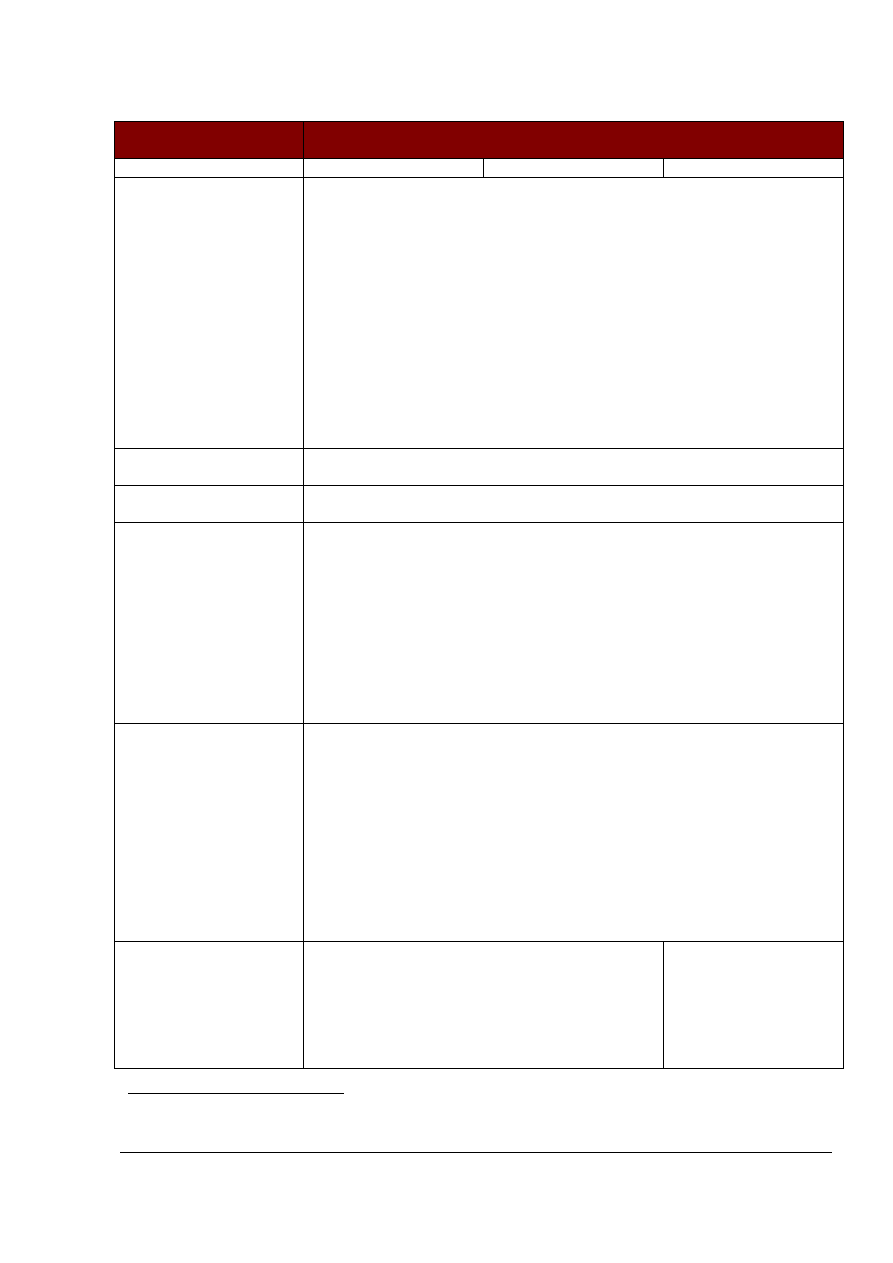
PODRĘCZNIK POBIERANIA PRÓBE K
67
RÓŻNE GATUNKI ZWIERZĄT
KIERUNEK BADANIA
BRUCELOZA
Brucellosis
METODA / TEST
OA
OKAP
OWD
UWAGI SPECJALNE
Ze względu na
potencjalne ryzyko zakażenia osób
zaangażowanych w
próbkobranie należy zachować szczególnie surowe środki ostrożności.
W obrębie rodzaju Brucella wyróżnia się 6 podstawowych gatunków
mających wśród zwierząt swoich głównych żywicieli: B. abortus (bydło), B.
melitensis (kozy, owce), B. suis (świnie), B. canis (psy), B. ovis (owce) i B.
neotomae (szczur pustynny).
Źródłem zakażenia dla ludzi mogą być chore na brucelozę zwierzęta oraz
produkty pochodzące od tych zwierząt, a szczególnie mleko i jego
przetwory.
Największą zjadliwością dla człowieka odznaczają się B. melitensis i B. suis
wywołujące zazwyczaj długo trwającą chorobę o ciężkim przebiegu.
Człowiek wrażliwy jest też na zakażenie pałeczkami B. abortus i B. canis.
Wyjątek stanowi B. suis biotyp 2, który uważany jest za niepatogenny lub
mało patogenny dla człowieka. Nie stwierdzono dotychczas zachorowań u
ludzi wywołanych przez B. ovis i B. neotomae.
MATERIAŁ DO
BADANIA
Krew zwierząt podatnych, pobrana od każdego zwierzęcia.
REPREZENTATYWNA
LICZBA PRÓBEK
Zgodnie z programem zwalczania.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
· jednorazowa igła
· sterylna probówka
lub
· tubostrzykawka,
· antykoagulant - w sytuacji określonej poniżej
· mocny, sterylny, szklany lub plastikowy pojemnik, zamykany
szczelnym przykryciem zabezpieczającym przed wyciekiem
· wodoodporna, samoprzylepna taśma
· środek do odkażania zewnętrznej części pojemnika oraz woda do jego
przemycia
· ręczniki do osuszenia pojemnika
PROCEDURA
POBRANIA PRÓBKI
Krew pobierana jest od zwierząt, z wyjątkiem samic:
- ciężarnych, u których poród powinien nastąpić w terminie 2 tygodni;
- u których poród nastąpił w terminie do 2 tygodni od dnia pobrania
próbki.
W przypadku samic, które poroniły, do badań serologicznych pobiera się, w
terminie od 12 do 20 dni po poronieniu, krew
1
:
- z dodatkiem środka zapobiegającego krzepliwości (antykoagulanta), w
przypadku badań na wykrycie bakterii we krwi (okres bakteremii);
- bez dodatku środka zapobiegającego krzepliwości, w przypadku badań
na wykrycie przeciwciał brucelozy.
Probówkę napełnia się w taki sposób, aby krew spływała wolno po jej
wewnętrznej ścianie, aż do napełnienia probówki w 2/3 jej pojemności.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Pobraną krew stopniowo schładza się.
Niedopuszczalne jest zamrażanie pobranej krwi.
Próbki krwi z antykoagulantem powinny zostać
wymieszane.
Każdą próbkę umieszcza się w mocnym,
sterylnym, szklanym lub plastikowym
pojemniku, zamykanym szczelnym przykryciem
Surowice otrzymane z
próbek krwi silnie
zhemolizowanych lub
zanieczyszczonych florą
bakteryjną nie nadają
się do badań w OWD.
Świeżo pobrane próbki
1
Pobranie krwi do badań bakteriologicznych między 12 a 20 dniem po poronieniu nie zwalnia z obowiązku
wcześniejszego wysłania do laboratorium poronionego płodu w całości lub wycinków narządów wewnętrznych
oraz wycinku łożyska.

PODRĘCZNIK POBIERANIA PRÓBE K
68
zabezpieczającym przed wyciekiem. Przykrycie
okleja się dookoła wodoodporną taśmą
samoprzylepną.
Powierzchnię zewnętrzną pojemnika, po jego
zamknięciu, odkaża się, a następnie płucze się
czystą wodą i osusza.
Na pojemniku umieszcza się etykietę zawierającą
opis zwierzęcia i jego numer identyfikacyjny,
rodzaj próbki, datę i miejsce jej pobrania, imię i
nazwisko oraz adres posiadacza zwierzęcia.
Próbki zapakowane w wyżej opisany sposób,
umieszcza się w mocnym kartonie lub
drewnianym pudełku i transportuje do
laboratorium w temperaturze 4°C.
krwi należy pozostawić
na około 2 godziny w
temperaturze
pokojowej, a następnie
dostarczyć do
laboratorium. W czasie
transportu próbki krwi
należy chronić przed
przemarznięciem lub
nadmiernym
przegrzaniem, gdyż
powoduje to hemolizę
lub przerośnięcie florą
bakteryjną próbek.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 5 – Arkusz wyników badań w kierunku brucelozy
u bydła/kóz/owiec/świń
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Próbki przesyła się bezpośrednio do
laboratorium, przed upływem 24 godzin od ich
pobrania.
O przewidywanym terminie dostarczenia
przesyłki powiadamia się laboratorium.
W dniu pobrania
próbki.
W razie trudności
dostarczenia próbek
krwi do laboratorium w
dniu ich pobrania,
można je po kilku
godzinach formowania
się skrzepu w
temperaturze
pokojowej, przechować
do dnia następnego w
chłodni (2-8
o
C).
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
· ZHW w Bydgoszczy
· ZHW w Krośnie
· ZHW w ZHW w
Białymstoku
· ZHW w ZHW w
Białymstoku Oddz.
w Łomży
· ZHW w Gdańsku
· ZHW w Poznaniu
· ZHW w Poznaniu
Prac. w Koninie
· ZHW w Szczecinie
· PIWet-PIB w
Puławach
· ZHW w Bydgoszczy
· ZHW w Bydgoszczy,
OT we Włocławku
· ZHW w Łodzi
· ZHW w Krakowie
· ZHW w Warszawie
TP w Siedlcach
· ZHW w Warszawie
TP w Ostrołęce
· ZHW w Opolu
· ZHW w Krośnie
· ZHW w ZHW w
Białymstoku
· ZHW w ZHW w
Białymstoku Oddz.
w Łomży
· ZHW w Gdańsku
· ZHW w Katowicach
· ZHW w Kielcach
· ZHW w Poznaniu
Prac. w Lesznie
· ZHW w Poznaniu
· ZHW w Poznaniu
Prac. w Koninie
· ZHW w Szczecinie
· PIWet-PIB w
Puławach
· ZHW w Bydgoszczy
· ZHW w Krośnie
· ZHW w ZHW w
Białymstoku
· ZHW w Gdańsku
· ZHW w Poznaniu
· ZHW w Poznaniu
Prac. w Koninie
· ZHW w Szczecinie
· PIWet-PIB w
Puławach

PODRĘCZNIK POBIERANIA PRÓBE K
69
PRAWODAWSTWO UE
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 20 kwietnia
2005 r. w sprawie zwalczania brucelozy
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zakażeń zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 22 lutego 2006
r. zmieniające rozporządzenie Ministra Rolnictwa i Rozwoju z dnia 17
grudnia 2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zakażeń zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 27 czerwca
2005 r. w sprawie szczegółowych wymagań weterynaryjnych niezbędnych
do uzyskania i zachowania uznania stada lub gospodarstwa za urzędowo
wolne lub wolne od chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania informacji
o występowaniu chorób zakaźnych zwierząt podlegających obowiązkowi
zwalczania i rejestracji oraz o wynikach monitorowania chorób
odzwierzęcych i odzwierzęcych czynników chorobotwórczych a także
związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Rady Ministrów z dnia 30 maja 2007 r. w sprawie
wprowadzenia programu zwalczania enzootycznej białaczki bydła,
gruźlicy bydła, brucelozy u bydła, wścieklizny, gąbczastej encefalolopatii
oraz programu zwalczania i kontroli zakażeń wirusami wysoce zjadliwej
grypy ptaków dawny pomór drobiu w drobiu i ptaków dzikich
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
70
RÓŻNE GATUNKI ZWIERZĄT
KIERUNEK BADANIA
GORĄCZKA Q
Q fever
METODA / TEST
OWD
UWAGI SPECJALNE
Ze względu na
potencjalne ryzyko zakażenia osób
zaangażowanych w
próbkobranie należy zachować szczególnie surowe środki ostrożności.
MATERIAŁ DO
BADANIA
Krew zwierząt podatnych.
REPREZENTATYWNA
LICZBA PRÓBEK
Od wszystkich zwierząt podejrzanych o chorobę.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
· jednorazowa igła
· probówka bez antykoagulantu
Zaleca się stosowanie zestawów jednorazowego użytku, zawierających
wkładkę ułatwiającą wydzielanie się surowicy i hermetycznie
zamykanych.
PROCEDURA
POBRANIA PRÓBKI
Przed pobraniem krwi upoważniony lekarz weterynarii powinien
sporządzić listę zwierząt zgodną z Załącznikiem 2.
Krew należy pobierać jałową igłą z żyły jarzmowej. Probówkę bez
antykoagulantu po napełnieniu krwią do 2/3 objętości (ok. 7 ml) należy
zamknąć szczelnie korkiem i niezwłocznie oznakować. Probówki z krwią
należy oznaczyć liczbą bieżącą, pod którą badane zwierzę zostało wpisane
na listę. Zaleca się stosowanie zestawów jednorazowego użytku,
zawierających wkładkę ułatwiającą wydzielanie się surowicy i
hermetycznie zamykanych.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Surowice wydzielone z próbek krwi silnie zhemolizowanych lub
zanieczyszczonych florą bakteryjną nie nadają się do badań serologicznych.
Silnie antykomplementarnie działają również wszystkie związki
chemiczne, które wiążą jony Mg i Ca, np. wersenian sodowy.
Świeżo pobrane próbki krwi należy odstawić na około 2 godziny w
temperaturze pokojowej, a następnie (najlepiej tego samego dnia)
dostarczyć do laboratorium.
W czasie transportu próbki krwi chronić przed przemarznięciem lub
nadmiernym przegrzaniem, gdyż powoduje to hemolizę lub przerośnięcie
próbek.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
W dniu pobrania próbki.
W razie trudności dostarczenia próbek krwi do laboratorium w dniu ich
pobrania, można je do dnia następnego przechować w chłodni (2-8ºC), ale
po kilku godzinach formowania się skrzepu w temperaturze pokojowej.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PIWet-PIB w Puławach
PRAWODAWSTWO UE
PRAWODAWSTWO
POLSKIE
·
Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
·
Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
·
Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia

PODRĘCZNIK POBIERANIA PRÓBE K
71
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
72
RÓŻNE GATUNKI ZWIERZĄT
KIERUNEK BADANIA
LISTERIOZA
Listeriosis
METODA / TEST
Horyzontalna metoda wykrywania obecności i oznaczania liczby Listeria
monocytogenes; metoda wykrywania obecności – zgodnie z opisem
zawartym w PN-EN ISO 11290-1 oraz PN-EN ISO 11290-1:1999/A1.
UWAGI SPECJALNE
Ze względu na
potencjalne ryzyko zakażenia osób
zaangażowanych w
próbkobranie należy zachować szczególnie surowe środki ostrożności.
MATERIAŁ DO
BADANIA
W zależności od postaci klinicznej choroby do badań diagnostycznych
pobiera się:
- krew
- chorobowo zmienione narządy wewnętrzne
- mózg
- rdzeń kręgowy
- płyn mózgowo-rdzeniowy
- poroniony płód
- mleko.
REPREZENTATYWNA
LICZBA PRÓBEK
Od zwierząt chorych, podejrzanych o chorobę i padłych z podejrzeniem
listeriozy.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Próbki materiału pobiera się czystymi, jałowymi narzędziami, najlepiej
jednorazowego użytku.
Dodatkowo:
· mocny, sterylny, szklany lub plastikowy pojemnik, zamykany
szczelnym przykryciem zabezpieczającym przed wyciekiem,
· wodoodporna, samoprzylepna taśma,
· środek do odkażania zewnętrznej części pojemnika oraz woda do jego
przemycia,
· ręczniki do osuszenia pojemnika.
PROCEDURA
POBRANIA PRÓBKI
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Każdą próbę umieszcza się w mocnym, sterylnym, szklanym lub
plastikowym pojemniku, zamykanym szczelnym przykryciem
zabezpieczającym przed wyciekiem zawartości. Przykrycie okleja się
dookoła wodoodporną taśmą samoprzylepną. Powierzchnię zewnętrzną
pojemnika po jego zamknięciu odkaża się, a następnie płucze się czystą
wodą i osusza. Każdy pojemnik zaopatruje się w etykietę zawierającą opis
zwierzęcia i jego numer identyfikacyjny, rodzaj próby, datę i miejsce jej
pobrania, imię i nazwisko oraz adres posiadacza zwierzęcia.
Próby zapakowane w sposób określony powyżej umieszcza się w
kontenerze, mocnym kartonie lub drewnianym pudełku i transportuje do
laboratorium w temperaturze 4-8°C (do czasu wysłanie próbki należy
przechowywać w temperaturze 4°C. Dopuszcza się transport zamrożonych
prób, bez rozmrażania ich w trakcie transportu.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Próbki przesyła się bezpośrednio do laboratorium, w możliwie najkrótszym
terminie.
O przewidywanym terminie dostarczenia przesyłki powiadamia się to
laboratorium.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
· ZHW w Krakowie
PRAWODAWSTWO UE Dyrektywa 2003/99/WE Parlamentu Europejskiego i Rady z dnia 17

PODRĘCZNIK POBIERANIA PRÓBE K
73
listopada 2003 r. w sprawie monitorowania chorób odzwierzęcych i
odzwierzęcych czynników chorobotwórczych, zmieniająca decyzję rady
90/424/EWG i uchylająca dyrektywę Rady 92/117/EWG
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciwdrobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
74
RÓŻNE GATUNKI ZWIERZĄT
KIERUNEK BADANIA
PĘCHERZYKOWE ZAPALENIE JAMY USTNEJ
Vesicular stomatitis
METODA / TEST
ELISA – rozpoznanie serologiczne;
test w wersji liquid-phase blocking
(LPBE).
ELISA – rozpoznanie
wirusologiczne.
UWAGI SPECJALNE
MATERIAŁ DO
BADANIA
Krew zwierząt podatnych.
REPREZENTATYWNA
LICZBA PRÓBEK
Liczba próbek powinna być adekwatna do częstotliwości występowania
poszukiwanego czynnika w populacji, jeśli choroba występuje w formie
klinicznej, pobrać próbki od 2-4 zwierząt.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
· igła jednorazowa
· sterylna probówka (lub tubostrzykawka) bez dodatku środka
konserwującego
PROCEDURA
POBRANIA PRÓBKI
Do badań należy pobrać próbki krwi pełnej od zwierząt chorych lub
ozdrowieńców, które miały styczność ze zwierzętami zakażonymi lub
podejrzanymi o zakażenie wirusem VS. Z igły krew powinna wolno spływać
do probówki po ścianie wewnętrznej do 2/3 pojemności.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Po pobraniu krew należy stopniowo schłodzić, ale nie zamrażać.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
W ciągu 24 godzin.
W przypadku pobierania próbek w związku z podejrzeniem choroby, próbki
należy dostarczyć do Laboratorium Zakładu Wirusologii Państwowego
Instytutu Weterynaryjnego - Państwowego Instytutu Badawczego (ul.
Partyzantów 57, 24-100 Puławy).
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PRAWODAWSTWO UE Decyzja Komisji 2008/650/WE zmieniająca Dyrektywę Rady 82/894/EWG
w sprawie wykazu zgłaszania chorób zwierząt we wspólnocie poprzez
włączenie niektórych chorób do wykazu chorób wymagających zgłaszania
oraz skreśleniu z tego wykazu enterowirusowego zapalanie mózgu i rdzenia
u świń
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 24 czerwca
2004 r. w sprawie sposobu i trybu zwalczania niektórych chorób
zakaźnych zwierząt podlegających obowiązkowi zwalczania
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
75
RÓŻNE GATUNKI ZWIERZĄT
KIERUNEK BADANIA
PRYSZCZYCA
CZĘŚĆ I
Foot and mouth disease - FMD
METODA / TEST
ELISA – rozpoznanie serologiczne;
test w wersji liquid-phase blocking
(LPBE).
SN - rozpoznanie serologiczne.
UWAGI SPECJALNE
Ze względu na
potencjalne ryzyko zakażenia osób
zaangażowanych w
próbkobranie należy zachować szczególnie surowe środki ostrożności.
MATERIAŁ DO
BADANIA
Krew zwierząt podatnych.
REPREZENTATYWNA
LICZBA PRÓBEK
W celu kontroli występowania pryszczycy corocznie bada się, na obszarze
powiatu, próbki krwi pobrane od 10 sztuk bydła albo świń.
Liczba próbek powinna być adekwatna do częstotliwości występowania
poszukiwanego czynnika w populacji (nie mniej jak od 3 zwierząt chorych).
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
· Igła jednorazowa,
· sterylna probówka (lub tubostrzykawka) bez dodatku środka
konserwującego.
Zalecany sposób pakowania materiałów biologicznych z podejrzeniem
pryszczycy i/lub choroby pęcherzykowej świń oraz sprzęt niezbędny do
zapakowania są opisane w Załączniku 3 Podręcznika.
PROCEDURA
POBRANIA PRÓBKI
Do badań należy pobrać próbki krwi pełnej od zwierząt chorych lub
ozdrowieńców, które miały styczność ze zwierzętami zakażonymi lub
podejrzanymi o zakażenie wirusem FMD. Z igły krew powinna wolno
spływać do probówki po ścianie wewnętrznej do 2/3 pojemności.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Po pobraniu krew należy stopniowo schłodzić, ale nie zamrażać.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Przewóz próbki z podejrzeniem pryszczycy nie może być zlecany
przedsiębiorstwom spedycyjnym, świadczącym usługi transportowe.
Próbki musi dostarczyć kurier najszybszym możliwym środkiem
transportu, niezwłocznie po pobraniu, najpóźniej przed upływem 24 godzin
od pobrania.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
Zakład PIWet-PIB w Zduńskiej Woli
PRAWODAWSTWO UE Decyzja Komisji 2008/650/WE zmieniająca Dyrektywę Rady 82/894/EWG
w sprawie wykazu zgłaszania chorób zwierząt we wspólnocie poprzez
włączenie niektórych chorób do wykazu chorób wymagających zgłaszania
oraz skreśleniu z tego wykazu enterowirusowego zapalanie mózgu i rdzenia
u świń
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe

PODRĘCZNIK POBIERANIA PRÓBE K
76
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 10 lutego
2006 r. w sprawie szczegółowego sposobu i trybu zwalczania pryszczycy
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt
PODRĘCZNIK POBIERANIA PRÓBE K
77
RÓŻNE GATUNKI ZWIERZĄT
KIERUNEK BADANIA
PRYSZCZYCA
CZĘŚĆ II
Foot and mouth disease - FMD
METODA / TEST
RT-PCR - rozpoznanie
wirusologiczne.
ELISA - rozpoznanie
wirusologiczne.
UWAGI SPECJALNE
Ze względu na
potencjalne ryzyko zakażenia osób
zaangażowanych w
próbkobranie należy zachować szczególnie surowe środki ostrożności.
MATERIAŁ DO
BADANIA
Do badania pobiera się:
· nabłonek (materiał najbardziej odpowiedni)
· płynna zawartość pęcherzy
· mleko
· krew
Dodatkowo:
· płyn z jamy gardłowej (probang)
· wymaz z nosa i pyska
· nasienie
REPREZENTATYWNA
LICZBA PRÓBEK
Nie mniej jak od 3 zwierząt chorych.
W celu kontroli występowania pryszczycy corocznie bada się, na obszarze
powiatu, próbki krwi pobrane od 10 sztuk bydła albo świń.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Zalecany sposób pakowania materiałów biologicznych z podejrzeniem
pryszczycy i/lub choroby pęcherzykowej świń oraz sprzęt niezbędny do
zapakowania są opisane w Załączniku 3.
Próbki pobiera się czystymi, jałowymi narzędziami, do jałowych naczyń,
najlepiej jednorazowych.
· zawartość pęcherza: strzykawka z igłą,
· krew: probówka z etykietą, w systemie próżniowym,
· mleko: naczynie z szeroką szyjką i z zakręcanym przykryciem.
· Śluz z cieśni gardłowo–
przełykowej (probang sample) od
bydła, wymaz z nosa od świń:
zgłębnik przełykowy,
· wymazy z nosa: jałowy wacik,
Uwaga! Naczynie na próbkę ok.
10 ml musi być przystosowane do
ewentualnego zamrażania,
szczelnie zamykane, aby gaz nie
przedostał się do jego wnętrza,
ponieważ spowoduje obniżenie
pH i inaktywację wirusa (próbka
taka jest nieprzydatna do
badania).
· nasienie: jałowe naczynie.
PROCEDURA
POBRANIA PRÓBKI
Nabłonek - próbkę ze ścian nieuszkodzonego lub świeżo rozerwanego
pęcherza, nie mniej niż 1g (wielkość znaczka pocztowego 2 cm
2
).
Zawartość pęcherzy - pobrać strzykawką z igłą, tyle ile tylko możliwe.
Mleko - ok. 20ml od bydła w okresie laktacji. Próbkę mleka po kilku
strzyknięciach do przedzdajacza pobiera się do naczyń z szeroką szyjką i z
zakręcanym przykryciem.
Krew - 5-10ml zarówno od zwierząt zdrowych, podejrzanych, chorych i
rekonwalescentów oraz od których trudno pobrać inny materiał w ilości
wystarczającej, szczególnie owiec, kóz i świń.
Próbkę krwi pobrać jałowo. Podczas pobierania krew powinna powoli
spływać po ściance probówki, do 2/3 objętości, nie dopuścić do hemolizy
krwinek.
Śluz z cieśni gardłowo–przełykowej
(probang sample) od bydła, wymaz z

PODRĘCZNIK POBIERANIA PRÓBE K
78
nosa od świń - pobrać co najmniej 2
ml, od dorosłego bydła, cieląt, owiec
i kóz ,wyjątkowo od świń.
Technika pobierania śluzu:
a. Zwierzę poskromić stosownie do
gatunku i wielkości, otworzyć
jamę gębową.
b. Zbiorniczek zgłębnika
przełykowego (rozmiarze
dostosowanym do gatunku i
wielkości zwierzęcia) umieścić za
korzeniem języka w kierunku
przełyku.
c. Zgłębnik przesuwać w dół
przełyku do momentu aż
zbiorniczek będzie wyczuwalny
palcami w grzbietowej części
gardła przed wejściem do krtani.
d. Zgłębnik przesuwać do przodu i
do tyłu w celu zeskrobania śluzu
z komórkami z błony śluzowej
gardła i przełyku, a następnie
wycofać.
Od świń żywych wymazy z nosa,
jamy gębowej pobiera się jałowym
wacikiem i natychmiast umieszcza
w buforze (płyn Eagle`a do hodowli
tkankowej /gliceryna) z
antybiotykiem, jak w punkcie
1).Transport +5ºC (±3ºC).
Nasienie - pobiera się do jałowych
naczyń szczelnie zamykanych.
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Wirus pryszczycy wrażliwy jest zarówno na wahania temperatury jak i pH.
Optymalne warunki dla wirusa: wartość pH 7,2 – 7,6 i temp. stabilna +4ºC.
Nabłonek – próbkę nabłonka schłodzić, nie zamrażać. Transport w +5ºC
(±3ºC).
Zawartość pęcherza - warunki transportu - pH 7.2 – 7.6, temperatura
+5
0
C(±
3
0
C).
Mleko – do pobranej próbki należy dodać bufor (płyn Eagle
`
a do hodowli
tkankowej /gliceryna) i antybiotyk, schładza i transportować w +5ºC
(±3ºC).
Krew – po pobraniu krew i środek zapobiegający krzepnięciu (EDTA -
kwas etylenodwu-aminoczterooctowym) łagodnie wymieszać, schłodzić. Nie
zamrażać. Krew transportować schłodzoną +5ºC (±3ºC).

PODRĘCZNIK POBIERANIA PRÓBE K
79
Śluz z cieśni gardłowo–przełykowej -
śluz ze zbiorniczka - 2ml przelać do
czystego naczynia szklanego,
przezroczystego z szerokim
otworem, upewnić się, że zawiera
tkanki i materiał komórkowy, nie
powinno w nim być widocznych
zanieczyszczeń pokarmem. Dodać
2ml buforu transportowego,
łagodnie wstrząsnąć. Próbki
zanieczyszczone treścią pokarmową
odrzuca się (są nieodpowiednie do
badania w hodowli komórek) i
pobieranie powtarza się po
przepłukaniu jamy gębowej
zwierzęcia czystą wodą lub
roztworem płynu fizjologicznego.
Próbki zanieczyszczone krwią
są nieprzydatne do badania.
U owiec śluzu jest zwykle mało,
ponadto jest gęsty i trudno przelać
go ze zgłębnika, dlatego po pobraniu
(ok.2 ml) śluz wypłukuje się
buforem w objętości 2ml.
Wymazy pobrane od świń
natychmiast umieszcza się w
buforze (płyn Eagle`a do hodowli
tkankowej /gliceryna) z
antybiotykiem. Transport +5ºC
(±3ºC).
Nasienie - do próbki dodać bufor i
antybiotyk. Transportować w +5ºC
(±3
ºC).
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Przewóz próbki z podejrzeniem pryszczycy nie może być zlecany
przedsiębiorstwom spedycyjnym, świadczącym usługi transportowe.
Próbki musi dostarczyć kurier najszybszym możliwym środkiem
transportu, niezwłocznie po pobraniu, najpóźniej przed upływem 24 godzin
od pobrania.
Nabłonek - do laboratorium dostarczyć natychmiast. W czasie do 10 godzin
może być przewożona bez buforu. Jeśli czas transportu może być dłuższy,
nabłonek należy umieścić w małej ilości buforu 2 – 5 ml, składającego się z
równych części 0,04 M buforu fosforanowego i gliceryny (PBS/gliceryna, lub
innego równoważnego buforu (ważne pH), transportować w +5ºC (±3ºC).
Ponadto, dla ochrony próbki przed rozwojem mikroorganizmów do buforu
należy dodać jeden z antybiotyków w stężeniu: penicylina 1 000 IU,
siarczan neomycyny 100 IU, siarczan polimyksyny B 50 IU lub
mykostatyna 100 IU.
Śluz – w ciągu kilku godzin. Gdy
zachodzi obawa, że transport może
trwać powyżej kilku godzin, próbkę
zamraża się w suchym lodzie lub
ciekłym azocie.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
Zakład PIWet-PIB w Zduńskiej Woli

PODRĘCZNIK POBIERANIA PRÓBE K
80
AKREDYTACJĘ
METODY
PRAWODAWSTWO UE Decyzja Komisji 2008/650/WE zmieniająca Dyrektywę Rady 82/894/EWG
w sprawie wykazu zgłaszania chorób zwierząt we wspólnocie poprzez
włączenie niektórych chorób do wykazu chorób wymagających zgłaszania
oraz skreśleniu z tego wykazu enterowirusowego zapalanie mózgu i rdzenia
u świń
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt.
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 10 lutego
2006 r. w sprawie szczegółowego sposobu i trybu zwalczania pryszczycy
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt

PODRĘCZNIK POBIERANIA PRÓBE K
81
RÓŻNE GATUNKI ZWIERZĄT
KIERUNEK BADANIA
WĄGLIK
Anthrax
METODA / TEST
Badanie materiału na wąglik powinno obejmować:
· badanie
mikroskopowe
przesłanych
rozmazów
jak
również
sporządzonych w laboratorium barwionych według metod stosowanych
w celu uwidocznienia otoczek,
· posiew materiału na podłoża bakteriologiczne w celu izolacji i
identyfikacji patogenu,
· próbę biologiczną na myszkach jeżeli uzyskane wyniki innych badań
były ujemne,
· odczyn termoprecypitacyjny Ascoliego,
· testy alternatywne – metoda PCR.
UWAGI SPECJALNE
Ze względu na
potencjalne ryzyko zakażenia osób
zaangażowanych w
próbkobranie należy zachować szczególnie surowe środki ostrożności.
MATERIAŁ DO
BADANIA
Do badań laboratoryjnych pobiera się:
a) od zwierząt żywych krew oraz preparaty mazane na szkiełkach
podstawowych,
b) małżowinę uszną w przypadku, gdy zwłoki wykazują rozkład gnilny
oraz gdy nie przeprowadza się sekcji zwierzęcia,
c) kość długą w przypadku daleko posuniętego rozkładu zwłok,
d) wyjątkowo, od zwierząt poddanych ubojowi lub padłych pobiera się
wycinki śledziony lub chorobowo zmienionego narządu,
e) od świń podejrzanych o postać gardzielowo-językową wąglika (glosso-
anthrax) węzły chłonne okołogardzielowe oraz wycinki galaretowato
obrzękłych tkanek,
f) jeśli zachodzi konieczność badania skór - wycinki o rozmiarach 5x10
cm, a gdy to nie jest możliwe ze względu na wartość skóry, skrawki z
części nieprzedstawiających większych wartości.
REPREZENTATYWNA
LICZBA PRÓBEK
Zwierzęta chore, podejrzane o chorobę, padłe z rozpoznaniem lub
podejrzeniem wąglika.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
Próbki materiału pobiera się czystymi, jałowymi narzędziami, najlepiej
jednorazowego użytku.
Dodatkowo:
· mocny, sterylny, szklany lub plastikowy pojemnik, zamykany
szczelnym przykryciem zabezpieczającym przed wyciekiem,
· wodoodporna, samoprzylepna taśma,
· środek do odkażania zewnętrznej części pojemnika oraz woda do jego
przemycia,
·
ręczniki do osuszenia pojemnika.
PROCEDURA
POBRANIA PRÓBKI
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Każdą próbę umieszcza się w mocnym, sterylnym, szklanym lub
plastikowym pojemniku, zamykanym szczelnym przykryciem
zabezpieczającym przed wyciekiem zawartości. Przykrycie okleja się
dookoła wodoodporną taśmą samoprzylepną. Powierzchnię zewnętrzną
pojemnika po jego zamknięciu odkaża się, a następnie płucze się czystą
wodą i osusza. Każdy pojemnik zaopatruje się w etykietę zawierającą opis
zwierzęcia i jego numer identyfikacyjny, rodzaj próby, datę i miejsce jej
pobrania, imię i nazwisko oraz adres posiadacza zwierzęcia.
Próby zapakowane w sposób określony powyżej umieszcza się w
kontenerze, mocnym kartonie lub drewnianym pudełku i transportuje do
laboratorium w temperaturze 4 - 8°C. Dopuszcza się transport
zamrożonych prób, bez rozmrażania ich w trakcie transportu.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
· Załącznik 2 – Protokół pobrania prób

PODRĘCZNIK POBIERANIA PRÓBE K
82
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Próbki przesyła się bezpośrednio do laboratorium, w możliwie najkrótszym
terminie.
O przewidywanym terminie dostarczenia przesyłki powiadamia się to
laboratorium.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
PRAWODAWSTWO UE
· Dyrektywa Rady 92/117/EWG dotycząca środków ochrony przed
określonymi chorobami odzwierzęcymi i odzwierzęcymi czynnikami
chorobotwórczymi u zwierząt i w produktach pochodzenia zwierzęcego, w
celu zapobieżenia zakażeniom i zatruciom przenoszonym przez żywność
· Dyrektywa Rady 64/432/EWG z dnia 26 czerwca 1964 r. w sprawie
problemów zdrowotnych zwierząt wpływających na handel wewnątrz
wspólnotowy bydłem i trzodą chlewną.
· Dyrektywa Rady 90/426/WE z dnia 26 czerwca 1990 w sprawie
warunków zdrowotnych zwierząt, regulujących przemieszczanie i
przywóz zwierząt z rodziny koniowatych z państw trzecich.
· Dyrektywa Parlamentu Europejskiego i Rady 2003/99/WE z dnia 17
listopada 2003 r. w sprawie monitorowania chorób odzwierzęcych i
odzwierzęcych czynników chorobotwórczych, zmieniająca decyzję rady
90/424/EWG i uchylająca dyrektywę Rady 92/117/EWG
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 5 maja 2005 r.
w sprawie zwalczania wąglika
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania informacji
o występowaniu chorób zakaźnych zwierząt podlegających obowiązkowi
zwalczania i rejestracji oraz o wynikach monitorowania chorób
odzwierzęcych i odzwierzęcych czynników chorobotwórczych a także
związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt
PODRĘCZNIK POBIERANIA PRÓBE K
83
RÓŻNE GATUNKI ZWIERZĄT
KIERUNEK BADANIA
WŚCIEKLIZNA
Rabies
METODA / TEST
Test immunofluorescencji
bezpośredniej.
MIT
UWAGI SPECJALNE
Ze względu na
potencjalne ryzyko zakażenia osób
zaangażowanych w
próbkobranie należy zachować szczególnie surowe środki ostrożności.
MATERIAŁ DO
BADANIA
W zależności od wielkości zwierzęcia do badania przesyła się:
· całe zwłoki – w przypadku małych zwierząt( w tym nietoperzy);
· głowę – w przypadku domowych zwierząt mięsożernych (psy, koty) lub
wolno żyjących zwierząt mięsożernych (lisy, jenoty, borsuki, kuny itp.);
· mózgowie – w przypadku dużych zwierząt; pobrane mózgowie musi
zawierać kompletny pień mózgu oraz móżdżek i róg Ammona.
REPREZENTATYWNA
LICZBA PRÓBEK
W przypadku podejrzenia wścieklizny:
· każde padłe zwierzę z podejrzeniem wścieklizny oraz
· każde podejrzane zwierzę, w przypadku jego kontaktu z
człowiekiem.
W celu kontroli występowania wścieklizny u lisów wolnożyjacych, materiał
pobiera się od 8 lisów odstrzelonych na każdych 100 km
2
obszaru, na
którym lisy zostały objęte szczepieniem ochronnym przeciw wściekliźnie.
SPRZĘT NIEZBĘDNY
DO POBRANIA
POJEDYNCZEJ
PRÓBKI
· czyste, jałowe narzędzia, najlepiej jednorazowego użytku
· papier absorpcyjny nasączony 10% wodnym roztworem formaliny
· plastikowy, mocny, szczelnie zamykany worek lub metalowy pojemnik
hermetycznie zamykany
· duży szczelnie zamykany worek
· polistyrenowy pojemnik
· lód (ew. suchy lód)
· materiał absorbujący (np. lignina)
· samoprzylepna taśma
·
pudełko kartonowe wyściełane folią
PROCEDURA
POBRANIA PRÓBKI
Głowa - głowę zwierzęcia oddziela się od zwłok tak aby pozostały przy niej
dwa pierwsze kręgi szyjne;
Mózgowie - należy otworzyć czaszkę i pobrać mózg i przesłać do
laboratorium. Pobrane mózgowie musi zawierać kompletny pień mózgu,
a także móżdżek i róg Ammona (hippocampus).
WYMAGANIA
ZWIĄZANE Z
PRZECHOWYWANIEM
I TRANSPORTEM
Zwłoki małych zwierząt lub głowy zwierząt dużych są zawijane w papier
absorpcyjny nasączony 10% wodnym roztworem formaliny, a następnie
wkłada się je do plastikowego worka (mocnego, szczelnie
zamkniętego).Jeżeli pobrany został tylko mózg (duże zwierzęta) należy
włożyć go do plastikowego worka lub metalowego pojemnika hermetycznie
zamykanego. Numer kolejny próbki powinien być napisany pisakiem
wodoodpornym na worku lub pojemniku.
Pierwsza paczka wkładana jest do dużego worka, który jest szczelnie
zamykany i umieszczany wewnątrz polistyrenowego pojemnika wraz z
workami z lodem i materiałem absorbującym (np. lignina). Przy
transporcie na większe odległości można użyć suchego lodu do chłodzenia
próbki. Pudełko polistyrenowe oklejane jest mocną taśmą samoprzylepną.
Koperta zawierająca wszystkie potrzebne informacje o próbce jest
dołączana do pudełka, które umieszczone jest wewnątrz pudełka
kartonowego wyściełanego folią. Pudełko powinno posiadać wyraźne
oznaczenia o materiale zakaźnym.
DOKUMENTACJA
TOWARZYSZĄCA
· Załącznik 1 – Pismo przewodnie do próbek przekazywanych do
laboratoryjnych badań diagnostycznych
W punkcie „Uwagi” należy wskazać, czy stwierdzono kontakt zakaźny
z ludźmi/zwierzętami oraz opisać charakter powyższego kontaktu.
· Załącznik 2 – Protokół pobrania prób (ewentualnie)

PODRĘCZNIK POBIERANIA PRÓBE K
84
CZAS NA
DOSTARCZENIE
POBRANEGO
MATERIAŁU DO
LABORATORIUM
Materiał do badania wirusologicznego powinien nadejść do laboratorium w
stanie świeżym.
LABORATORIUM
WETERYNARYJNE
POSIADAJĄCE
AKREDYTACJĘ
METODY
· ZHW w Warszawie TP w
Ostrołęce
· ZHW w Opolu
· ZHW w Krośnie
· ZHW w Katowicach
· ZHW w Poznaniu
· PIWet-PIB w Puławach
· ZHW w Krośnie
PRAWODAWSTWO UE Decyzja Komisji 2008/650/WE zmieniająca Dyrektywę Rady 82/894/EWG
w sprawie wykazu zgłaszania chorób zwierząt we wspólnocie poprzez
włączenie niektórych chorób do wykazu chorób wymagających zgłaszania
oraz skreśleniu z tego wykazu enterowirusowego zapalanie mózgu i rdzenia
u świń
PRAWODAWSTWO
POLSKIE
· Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczaniu chorób zakaźnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia
2004 r. w sprawie określenia jednostek chorobowych, sposobu
prowadzenia kontroli oraz zakresu badań kontrolnych zwierząt
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 7 stycznia
2005 r. w sprawie zwalczania wścieklizny
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada
2005 r. w sprawie zakresu, sposobu i terminów przekazywania
informacji o występowaniu chorób zakaźnych zwierząt podlegających
obowiązkowi zwalczania i rejestracji oraz o wynikach monitorowania
chorób odzwierzęcych i odzwierzęcych czynników chorobotwórczych a
także związanej z nimi oporności na środki przeciw drobnoustrojowe
· Rozporządzenie Rady Ministrów z dnia 30 maja 2007 r. w sprawie
wprowadzenia programu zwalczania enzootycznej białaczki bydła,
gruźlicy bydła, brucelozy u bydła, wścieklizny, gąbczastej
encefalolopatii oraz programu zwalczania i kontroli zakażeń wirusami
wysoce zjadliwej grypy ptaków dawny pomór drobiu w drobiu i ptaków
dzikich
· Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia
2008 r. w sprawie sposobu prowadzenia dokumentacji związanej ze
zwalczaniem chorób zakaźnych zwierząt
PODRĘCZNIK POBIERANIA PRÓBE K
85
IV. Dane adresowe laboratoriów weterynaryjnych
WOJEWÓDZTWO
NAZWA LABORATORIUM
DANE ADRESOWE
DOLNOŚLĄSKIE
Zakład Higieny Weterynaryjnej
we Wrocławiu
50-900 Wrocław, ul. Pułaskiego 52
tel.: 0-71 341-70-67, 071 341-70-68
fax: 0-71 717-45-37
zhw.wroclaw@wroc.wiw.gov.pl
www.wroc.wiw.gov.pl
KUJAWSKO-
POMORSKIE
Zakład Higieny Weterynaryjnej
w Bydgoszczy
85-090 Bydgoszcz,ul. Powstańców Wielkp. 10
tel.: 0-52 349-33-38, 322-83-44
fax: 0-52 349-33-41
bydgoszcz.zhw@wetgiw.gov.pl
bydgoszcz.zhw@wp.pl
www.bydgoszczwiw.neostrada.pl/zhw.htm
Zakład Higieny Weterynaryjnej
w Bydgoszczy, Oddział
Terenowy w Toruniu
87-100 Toruń, ul. Antczaka 39/41
tel.: 0-56 655-30-26 do 29
fax: 0-56 659-85-06
torun.zhw@wetgiw.gov.pl
Zakład Higieny Weterynaryjnej
w Bydgoszczy, Oddział
Terenowy we Włocławku
87-800 Włocławek, ul. Planty 16/18
tel.: 0-54 234-10-38
wiwwloc@neostrada.pl
LUBELSKIE
Zakład Higieny Weterynaryjnej
w Lublinie
20-336 Lublin, ul. Słowicza 2
tel./fax: 0-81 744-36-91, 92
lublin.zhw@wetgiw.gov.pl
www.wiw.lublin.pl
LUBUSKIE
Zakład Higieny Weterynaryjnej
w Gorzowie Wlkp.
66-400 Gorzów Wlkp., ul. Boh. Warszawy 4
tel.: 0-95 720-42-63
fax: 0-95 720-42-64
gorzówwlkp.zhw@wet.zgora.pl
Zakład Higieny Weterynaryjnej
w Gorzowie Wlkp. Pracownia
Badań Serologicznych w
Zielonej Górze
65-358 Zielona Góra, ul. Olbrychta 1
tel.: 0-68 453-73-61
zielonagora.zhw@wet.zgora.pl
ŁÓDZKIE
Zakład Higieny Weterynaryjnej
w Łodzi
93-569 Łódź, ul. Proletariacka 2/6,
tel.: 0-42 635-14-14
fax: 0-42 636-86-24
zhwlodz@wp.pl
Zakład Higieny Weterynaryjnej
w Łodzi Oddział w Piotrkowie
Trybunalskim
97-300 Piotrków Trybunalski,
ul. Rzemieślnicza 26
tel.: 0-44 646-46-76
zhwpiotrkowtryb@om.pl
MAŁOPOLSKIE
Zakład Higieny Weterynaryjnej
w Krakowie
30-695 Kraków 69, ul. Brodowicza 13 b
tel.: 0-12 411-81-22; 411-30-90
fax: 0-12 411-82-18
sekretariat@zhwkrakow.internetdsl.pl
PODRĘCZNIK POBIERANIA PRÓBE K
86
WOJEWÓDZTWO
NAZWA LABORATORIUM
DANE ADRESOWE
MAZOWIECKIE
Zakład Higieny Weterynaryjnej
w Warszawie
02-156 Warszawa, ul. Lechicka 21
tel.: 0-22 846-01-68; 846-30-51 do 55
fax: 0-22 846-30-51
zhw@op.pl
zhw.wawa@wiw.siedlce.com
www.zhw.wawa.eta.pl
ZHW w Warszawie Terenowa
Pracownia w Siedlcach
08-110 Siedlce, ul. Kazimierzowska 29
tel.: 0-25 631-10-85; 644-01-91 w. 24, 25
zhw.siedlce@wiw.siedlce.com
www.wiw.siedlce.com
ZHW w Warszawie Terenowa
Pracownia w Ostrołęce
07-412 Ostrołęka, ul. Składowa 8a
tel.: 0-29 769-01-00; 769-06-26
zhw.ostroleka@wiw.siedlce.com
OPOLSKIE
Zakład Higieny Weterynaryjnej
w Opolu
45 - 836 Opole, ul. Wrocławska 170
tel./fax: 0-77 457-50-10 wew. 317
zhw@wiw.opole.pl
PODKARPACKIE
Zakład Higieny Weterynaryjnej
w Krośnie
38-400 Krosno, ul. Ściegiennego 6/A
tel.: 0-13 432-59-23
fax: 0-13 432-69-33
krosno.zhw@wetgiw.gov.pl
ZHW w Krośnie Pracownia
Mikrobiologii i Immunologii w
Rzeszowie
35-959 Rzeszów, ul. Warszawska 12
tel.: 0-17 852-12-42
ZHW w Krośnie Pracownia
Chorób Ryb i Chorób
Zakaźnych Zwierząt w
Przemyślu
37-700 Przemyśl, ul. Lwowska 7
tel.: 0-16 678-75-93
PODLASKIE
Zakład Higieny Weterynaryjnej
w Białymstoku
15-959 Białystok, ul. Zwycięstwa 26
tel./fax: 0-85 651-62-91
zhw.bial@wiw.bianet.com.pl
sekretariat.zhw@wiw.bianet.com.pl
Zakład Higieny Weterynaryjnej
w Białymstoku Oddział w
Łomży
18-400 Łomża, ul. Nowogrodzka 160
tel.: 0-86 216-34-58
fax: 0-86 216-26-05
zhwlomza@op.pl
POMORSKIE
Zakład Higieny Weterynaryjnej
w Gdańsku
80-316 Gdańsk, ul. Kaprów 10
tel.: 0-58 552-12-68; 552-12-69
fax: 0-58 552-25-63
zhwo@gdansk.wiw.gov.pl
80-125 Gdańsk, ul. Kartuska 249
tel.: 0-58 302-04-04; 322-38-75
zhwgd@gdansk.wiw.gov.pl
LOM Laboratorium Oceny
Mleka
82-200 Malbork, ul. Boczne 8
tel.: 0-55 272-24-35
lom@malbork. com
PODRĘCZNIK POBIERANIA PRÓBE K
87
WOJEWÓDZTWO
NAZWA LABORATORIUM
DANE ADRESOWE
ŚLĄSKIE
Zakład Higieny Weterynaryjnej
w Katowicach
40-585 Katowice, ul. Brynowska 25a
tel.: 0-32 609-16-39; 609-16-31
tel./fax: 0-32 609-16-34
zhw@katowice.wiw.gov.pl
www.katowice.wiw.gov.pl
ŚWIĘTOKRZYSKIE Zakład Higieny Weterynaryjnej
w Kielcach
25-116 Kielce, ul. Ściegiennego 205
tel.: 0-41 361-64-98
fax: 0-41 361-67-54
kielce.zhw@wetgiw.gov.pl
zhw@wiw.kielce.pl
www.wiw.kielce.pl/zhw
WARMIŃSKO-
MAZURSKIE
Zakład Higieny Weterynaryjnej
w Olsztynie
10-702 Olsztyn, ul. Warszawska 109
tel.: 0-89 524-05-07
fax: 0-89 524-05-78
zhw@olsztyn.wiw.gov.pl
zhwkierownik@olsztyn.wiw.gov.pl
www.olsztyn.wiw.gov.pl
Zakład Higieny Weterynaryjnej
w Olsztynie Oddział w
Ostródzie
14-100 Ostróda, ul. Sienkiewicza 13
tel./fax: 0-89 646-63-23
ozhwostroda@olsztyn.wiw.gov.pl
WIELKOPOLSKIE
Zakład Higieny Weterynaryjnej
w Poznaniu
60-166 Poznań, ul. Grunwaldzka 250
tel.: 0-61 868-93-47
fax: 0-61 868-47-00
biuro.zhw@wiw.poznan.pl
www.wiw.poznan.pl
Pracownia ZHW w Kaliszu
62-800 Kalisz, ul. Warszawska 63a
tel.: 0-62 767-20-25
fax: 0-62 767-66-23
zhw.kalisz@wiw.poznan.pl
Pracownia Badań
Serologicznych ZHW w Koninie
Kierownik
62-500 Konin, ul. Kościuszki 37b
tel./fax: 0-63 242-84-94
zhw.konin@wiw.poznan.pl
Pracownia ZHW w Lesznie
64-100 Leszno, ul. Święciechowska 150
tel./fax: 0-65 520-64-98
zhw.leszno@wiw.horyzont.net
Międzywojewódzka Pracownia
Diagnostyki TSE w Lesznie
64-100 Leszno, ul. Święciechowska 150
tel.: 0-65 529-58-01
fax: 0-65 529-27-05
bse.leszno@wiw.poznan.pl
ZACHODNIO-
POMORSKIE
Zakład Higieny Weterynaryjnej
w Szczecinie
71-337 Szczecin, ul. Ostrawicka 2
tel.: 0-91 489-82-25
fax: 0-91 489-82-45
zhwsekretariat@wiw.szczecin.pl
Zakład Higieny Weterynaryjnej
w Szczecinie Oddział ZHW w
Koszalinie
75-816 Koszalin, ul. Połczyńska 70
tel.: 0-94 343-90-48
fax: 0-94 342-62-84
sekretariat@zhwkoszalin.pl
www.zhwkoszalin.pl

PODRĘCZNIK POBIERANIA PRÓBE K
88
WOJEWÓDZTWO
NAZWA LABORATORIUM
DANE ADRESOWE
LUBELSKIE
Państwowy Instytut
Weterynaryjny - Państwowy
Instytut Badawczy w Puławach
24-100 Puławy, Aleja Partyzantów 57
tel.: 0-81 889 30 00
fax: 0-81 886 25 95
sekretariat@piwet.pulawy.pl
www.piwet.pulawy.pl
ŁÓDZKIE
Zakład Pryszczycy
Państwowego Instytutu
Weterynaryjnego -
Państwowego Instytutu
Badawczego w Zduńskiej Woli
98-220 Zduńska Wola, ul. Wodna 7
tel.: 0-43 823 51 34
fax : 0-43 823 52 75
KUJAWSKO-
POMORSKIE
Oddział Państwowego Instytutu
Weterynaryjnego -
Państwowego Instytutu
Badawczego w Bydgoszczy,
Zakład Fizjopatologii Rozrodu i
Gruczołu Mlekowego
85-090 Bydgoszcz, ul. Powstańcowi Wlkp. 10
tel. 0-52-349-31-40

PODRĘCZNIK POBIERANIA PRÓBE K
89
V.
Aktualizacja i zgłaszanie uwag do Podręcznika
Aktualizacja Podręcznika
Zaktualizowane części niniejszego Podręcznika, jak również dodatkowe fragmenty
rozszerzające jego treść, są dostępne na stronie internetowej Głównego Inspektoratu
Weterynarii (www.wetgiw.gov.pl).
Uwagi do Podręcznika
Uwagi do Podręcznika można zgłaszać na adres:
podrecznik@wetgiw.gov.pl
.

PODRĘCZNIK POBIERANIA PRÓBE K
90
VI. Bibliografia
Niniejszy Podręcznik został opracowany w oparciu o następujące dokumenty i
akty prawne:
1.
Zbiór Metod Diagnostycznych 2007
2.
Ustawa z dnia 11 marca 2004 r. o ochronie zdrowia zwierząt oraz
zwalczania chorób zakaźnych zwierząt (Dz. U. Nr 69 p oz. 625 z późn. zm.)
3.
Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2008
4.
Manual of Diagnostic Tests for Aquatic animals 2006
Rozporządzenia:
5.
Rozporządzenie Parlamentu Europejskiego i Rady (WE) nr 999/2001 z dnia
22 maja 2001 r. ustanawiające zasady dotyczące zapobiegania, kontroli i
zwalczania niektórych przenośnych gąbczastych encefalopatii
6.
Rozporządzenie Komisji (WE) nr 1226/2002 z dnia 8 lipca 2002 r.
zmieniające załącznik B do dyrektywy Rady 64/432/EWG
7.
Rozporządzenie Komisji (WE) nr 21/2008 z dnia 11 stycznia 2008 r.
zmieniające załącznik X do rozporządzenia (WE) nr 999/2001 Parlamentu
Europejskiego i Rady w odniesieniu do wykazów szybki ch testów
8.
Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 18 maja 2004 r.
w sprawie szczegółowego sposobu i trybu zwalczania afrykańskiego pomoru
koni (Dz. U. Nr 131 poz. 1408)
9.
Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 23 czerwca 2004
r. w sprawie zwalczania afrykańskiego pomoru świń (Dz. U. Nr 158 poz.
1658)
10. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 24 czerwca 2004
r. w sprawie sposobu i trybu zwalczania niektórych chorób zakaźnych
zwierząt podlegających obowiązkowi zwalczania (Dz. U. Nr 158 poz. 1659)
11. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 23 listopada 2004
r. w sprawie zwalczania gruźlicy bydła (Dz. U. Nr 258 poz. 2585)
12. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 17 grudnia 2004
r. w sprawie określenia jednostek chorobowych, sposobu prowadzenia
kontroli oraz zakresu badań kontrolnych zwierząt (Dz. U. Nr 282, poz. 2813
z późn. zm.)
13. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 7 stycznia 2005 r.
w sprawie zwalczania wścieklizny (Dz. U. Nr 13, poz. 103)
14. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 29 marca 2005 r.
w sprawie zwalczania chorób zakaźnych ryb (Dz. U. Nr 60, poz. 528)
15. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 20 kwietnia 2005
r. w sprawie zwalczania brucelozy (Dz. U. Nr 79 poz. 690)
16. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 5 maja 2005 r. w
sprawie zwalczania wąglika (Dz. U. Nr 88, poz. 750)
17. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 27 czerwca 2005
r. w sprawie szczegółowych wymagań weterynaryjnych niezbędnych do
uzyskania i zachowania uznania stada lub gospodarstwa za urzędowo
wolne lub wolne od chorób zakaźnych zwierząt (Dz. U. Nr 126, poz. 1058)

PODRĘCZNIK POBIERANIA PRÓBE K
91
18. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 29 lipca 2005 r.
w sprawie zwalczania rzekomego pomoru drobiu (Dz. U. Nr 158, poz. 1330)
19. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 14 września 2005
r. w sprawie zwalczania zgnilca amerykańskiego pszczół (Dz. U. Nr 187,
poz. 1574)
20. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 25 listopada 2005
r. w sprawie zakresu, sposobu i terminów przekazywania informacji o
występowaniu chorób zakaźnych zwierząt podlegających obowiązkowi
zwalczania i rejestracji oraz o wynikach monitorowania chorób
odzwierzęcych i odzwierzęcych czynników chorobotwórczych a także
związanej z nimi oporności na środki przeciw drobnoustrojowe (Dz. U. Nr
242, poz. 2045)
21. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 10 lutego 2006 r.
w sprawie szczegółowego sposobu i trybu zwalczania pryszczycy (Dz. U. Nr
28, poz. 205)
22. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 12 kwietnia 2006
r. w sprawie zwalczania niektórych chorób zakaźnych mięczaków (Dz. U.
Nr 73, poz. 512)
23. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 18 grudnia 2006
r. w sprawie zwalczania klasycznego pomoru świń (Dz. U. z 2007 r. Nr 2,
poz. 17)
24. Rozporządzenie Rady Ministrów z dnia 30 maja 2007 r. w sprawie
wprowadzenia programu zwalczania enzootycznej białaczki bydła, gruźlicy
bydła, brucelozy u bydła, wścieklizny, gąbczastej encefalolopatii oraz
programu zwalczania i kontroli zakażeń wirusami wysoce zjadliwej grypy
ptaków dawny pomór drobiu w drobiu i ptaków dzikich (Dz. U. Nr 104 poz.
714)
25. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 14 września 2007
r. w sprawie zwalczania zarazy płucnej bydła (Dz. U. Nr 178 poz. 1261)
26. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 18 grudnia 2007
r. w sprawie zwalczania grypy ptaków (Dz. U. Nr 239 poz. 1752)
27. Rozporządzenie Rady Ministrów z dnia 18 grudnia 2007 r. w sprawie
wprowadzenia programu zwalczania enzootycznej białaczki bydła (Dz. U.
Nr 249 poz. 1852)
28. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 16 stycznia 2008
r. w sprawie sposobu prowadzenia dokumentacji związanej ze zwalczaniem
chorób zakaźnych zwierząt (Dz. U. Nr 17, poz. 107)
29. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 26 lutego 2008 r.
w sprawie sposobu i trybu zwalczania choroby pęcherzykowej świń (Dz. U.
Nr 40 ,poz. 237)
30. Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 5 marca 2008 r.
w sprawie zwalczania enzootycznej białaczki bydła (Dz. U. Nr 47 ,poz. 278)
31. Rozporządzenie Rady Ministrów z dnia 19 marca 2008 r. w sprawie
wprowadzenia programu zwalczania choroby Aujeszkyego u świń (Dz. U.
Nr 64 poz. 397)

PODRĘCZNIK POBIERANIA PRÓBE K
92
Dyrektywy:
32. Dyrektywa Rady 64/432/EWG w sprawie problemów zdrowotnych zwierząt
wpływających na handel wewnątrz wspólnotowy bydłem i trzodą chlewną
33. Dyrektywa Rady 90/426/WE w sprawie warunków zdrowotnych zwierząt,
regulujących przemieszczanie i przywóz zwierząt z rodziny koniowatych z
państw trzecich
34. Dyrektywa Rady 90/539/EWG w sprawie warunków zdrowotnych zwierząt,
regulujących handel wewnątrzwspólnotowy i przywóz z państw trzecich
drobiu i jaj wylęgowych
35. Dyrektywa Rady 91/67/EWG dotycząca warunków zdrowotnych zwierząt,
obowiązujących przy wprowadzaniu na rynek zwierząt i produktów
akwakultury
36. Dyrektywa Rady 92/66/EWG wprowadzająca wspólnotowe środki
zwalczania rzekomego pomoru drobiu
37. Dyrektywa Rady 92/117/EWG dotycząca środków ochrony przed
określonymi chorobami odzwierzęcymi i odzwierzęcymi czynnikami
chorobotwórczymi u zwierząt i w produktach pochodzenia zwierzęcego, w
celu zapobieżenia zakażeniom i zatruciom przenoszonym przez żywność
38. Dyrektywa Rady 95/70/WE wprowadzająca minimalne wspólnotowe środki
zwalczania niektórych chorób małży
39. Dyrektywa Rady 98/46/EC z dnia 24 czerwca 1998 r. nowelizująca
załączniki A,D (Rozdział I) oraz F do Dyrektywy 64?432/EEC o p roblemach
zdrowia zwierząt w handlu bydłem i trzodą chlewną wewnątrz Wspólnoty
40. Dyrektywa Parlamentu Europejskiego i Rady 2003/99/WE z dnia 17
listopada 2003 r. w sprawie monitorowania chorób odzwierzęcych i
odzwierzęcych czynników chorobotwórczych, zmieniająca decyzję rady
90/424/EWG i uchylająca dyrektywę Rady 92/117/EWG
Decyzje:
41. Decyzja Komisji 2001/183/WE ustanawiająca plany pobierania próbek i
metody diagnostyczne do celów wykrywania i potwierdzania występowania
niektórych chorób ryb oraz uchylająca decyzję 92/532/EWG
42. Decyzja Komisji 2001/618WE ograniczająca możliwość obrotu i handlu
świniami między krajami lub regionami różnym statusie epizootycznym w
zakresie choroby Aujeszkyego
43. Decyzja Komisji 2002/106/WE zatwierdzająca Podręcznik Diagnostyczny
ustalający procedury diagnostyczne, metody pobierania próbek oraz
kryteria do oceny testów laboratoryjnych służących do potwierdzenia
klasycznego pomoru świń
44. Decyzja Komisji 2002/878/WE ustanawiająca plany pobierania próbek oraz
metody diagnostyczne stosowane w celu wykrywania i potwierdzania
występowania u mięczaków Bonamiosis (Bonami ostreae) i Marteiliosis
(Marteilia refringens)
45. Decyzja Komisji 203/466/WE ustanawiająca kryteria podziału na strefy i
urzędowego nadzoru w następstwie podejrzenia lub potwierdzenia
występowania niedokrwistości zakaźnej łososia (ISA)

PODRĘCZNIK POBIERANIA PRÓBE K
93
46. Decyzja Komisji 2006/437/WE zatwierdzająca podręcznik diagnostyczny
dotyczący grypy ptaków, przewidziany w dyrektywie Rady 2005/94/WE
47. Decyzja Komisji 2008/185/WE wprowadzająca zakaz handlu świniami dla
krajów, które nie są wolne od choroby Aujeszkyego lub, w których nie jest
realizowany program zwalczania tej choroby
48. Decyzja Komisji 2008/650WE zmieniająca Dyrektywę Rady 82/894/EWG w
sprawie wykazu zgłaszania chorób zwierząt we wspólnocie poprzez
włączenie niektórych chorób do wykazu chorób wymagających zgłaszania
oraz skreśleniu z tego wykazu enterowirusowego zapalanie mózgu i rdzenia
u świń

PODRĘCZNIK POBIERANIA PRÓBE K
94
VII. Załączniki
Wyszukiwarka
Podobne podstrony:
01.Cechy państwa, 12.PRACA W SZKOLE, ZSG NR 4 2008-2009, PG NR 5
2008-12-01 rozporz-UTB, Dźwignice
2008 12 01
2008 01 15 godz 12 LH
2008 01 16 godz 12 LH
2008 01 16 godz 12 HL
2008 01 14 godz 12 LH
2008 01 15 godz 12 HL
2008 01 14 godz 12 HL
2008 12 05 (3)
2008 12 10 (8)
Powiedzmy z dumą Nasz Kościół broni godności człowieka - [2008-12-13], bioetyka
TABELA POLSKIE SUKCESY (MIEJSCA 1-8), IMPREZY SPORTOWE (22), Pekin 2008 (12)
2008 12 15
2008 12 09 Wykaz tytułów prasy wojskowej
DzU 199 2008 12 27 udost inf i OOS
2008 12 05
więcej podobnych podstron