2010-01-22
1
Chemia
Wykład
Elektrochemia
Elektrochemia
Każda
reakcja
redoks
jest
związana
z
przeniesieniem
elektronu
–
elektrony
przechodzą od formy zredukowanej do formy
utlenionej.
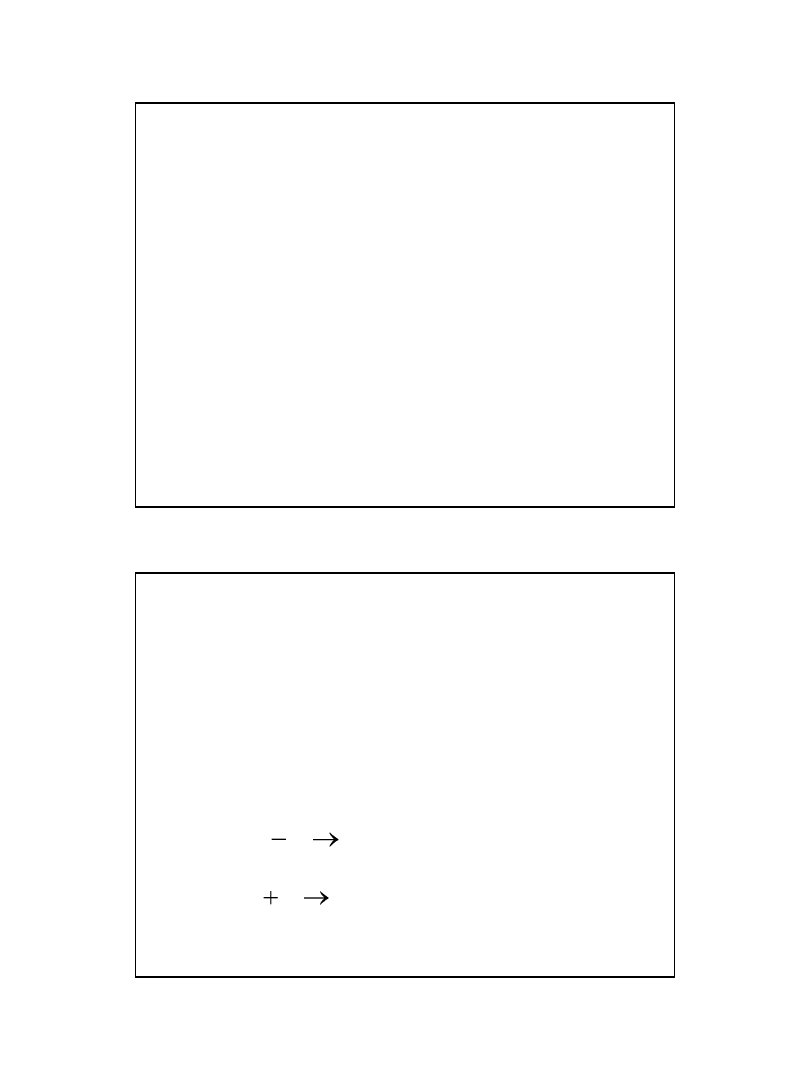
)
utlenienie
(
odukt
Pr
e
d
Re
)
redukcja
(
odukt
Pr
e
Ox
2010-01-22
2
Jeśli procesy utleniania i redukcji zachodzą w tym samym
czasie i miejscu – mamy do czynienia z
procesem
chemicznym.
Jeśli procesy utleniania i redukcji są rozdzielone w czasie i
przestrzeni, a wymiana ładunku następuje poprzez
przewodnik elektronów(np. drut metalowy)– wówczas
mówimy o procesie elektrochemicznym.
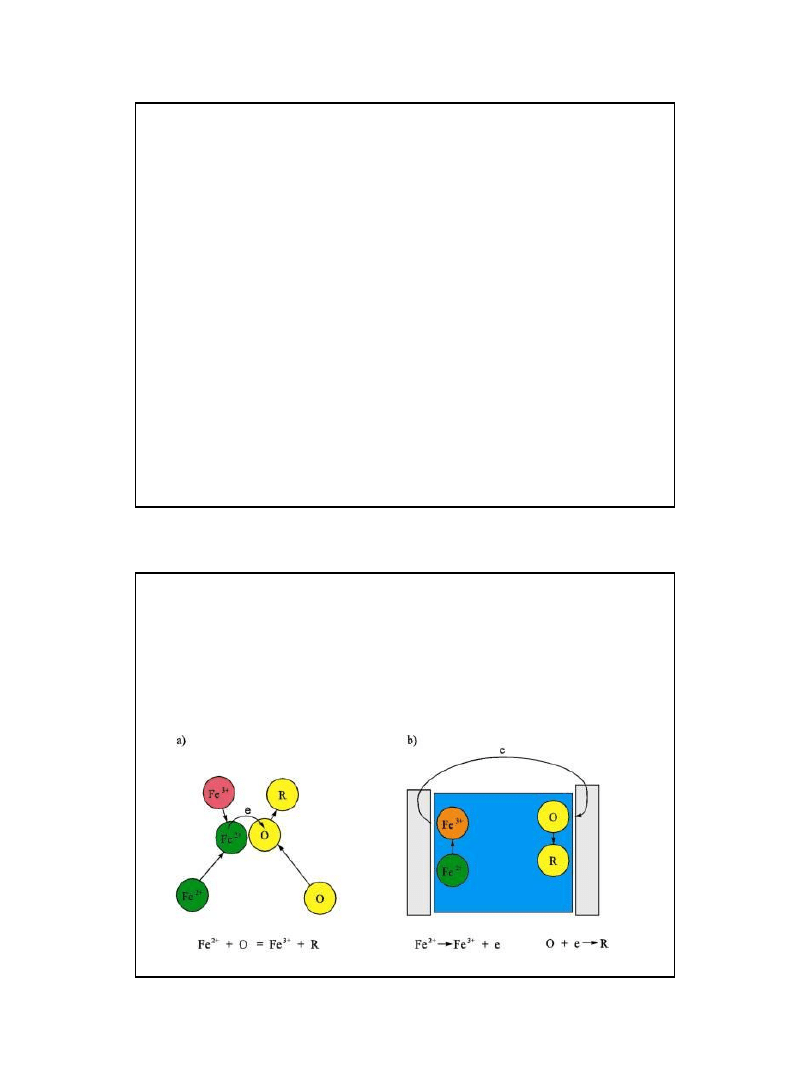
Utlenianie żelaza (2+) może
zachodzić na drodze:
a) chemicznej lub b) elektrochemicznej
O – utleniacz, R - reduktor
2010-01-22
3
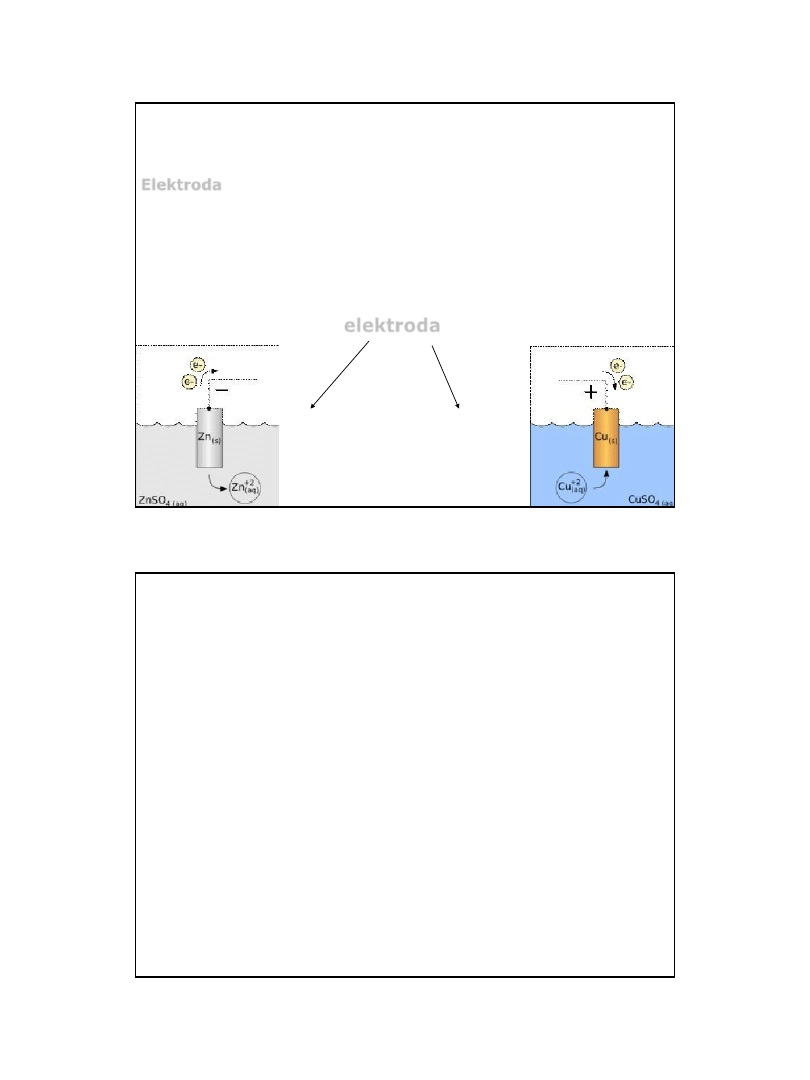
Elektrody
Elektroda – powierzchnia metalu (lub innego przewodnika), na
której zachodzi reakcja wymiany ładunku (utleniania, bądź redukcji).
Jest to układ składający się z przewodnika lub półprzewodnika i graniczącego z
nim ciekłego przewodnika jonowego (roztwór elektrolitu lub elektrolit stopiony)
elektroda
anoda
katoda
utlenianie
redukcja
Zasadniczy układ do oznaczeń
potencjometrycznych składa się
z dwóch elektrod:
a) elektroda
wskaźnikowa
o
potencjale
zależnym od stężenia oznaczanego jonu
b) elektroda porównawcza o stałym potencjale
w warunkach prowadzenia pomiaru
2010-01-22
4
Rodzaje elektrod
1. Elektrody pierwszego rodzaju –
odwracalne względem kationu lub anionu.
Np. srebrowa Ag |Ag
+
,
wodorowa Pt|H
2
|H
+
lub chlorowa Pt|Cl
2
|Cl
+
2. Elektrody drugiego rodzaju
– odwracalne względem anionu. Składają się z
przewodnika metalicznego pokrytego warstwą
soli trudno rozpuszczalnej i zanurzonego w
roztworze zawierający anion wspólny z tą solą.
Np. klalomelowa Hg|Hg
2
Cl
2
|KCl
lub chlorosrebrowa Ag|AgCl
(s)
|KCl.
2010-01-22
5
3. Elektrody trzeciego rodzaju
– odwracalna względem wspólnego kationu.
Np. Pb|PbCO
3(s)
| CaCO
3(s)
|Ca
2+
lub Hg|Hg
2
C
2
O
4(s)
| CaC
2
O
4(s)
| Ca
2+
4. Elektrody redoks
– w rzeczywistości na wszystkich elektrodach
zachodzą procesy redoks. Tą grupę elektuod
wyróżniono ponieważ obie formy – zredukowana i
utleniona – znajdują się w roztworze, a przewodnik
metaliczny służy jedynie do przenoszenia
elektronów.
Np. Pt|Fe
2+
(c)|Fe
3+
(c)
chinohydrynowa
2010-01-22
6
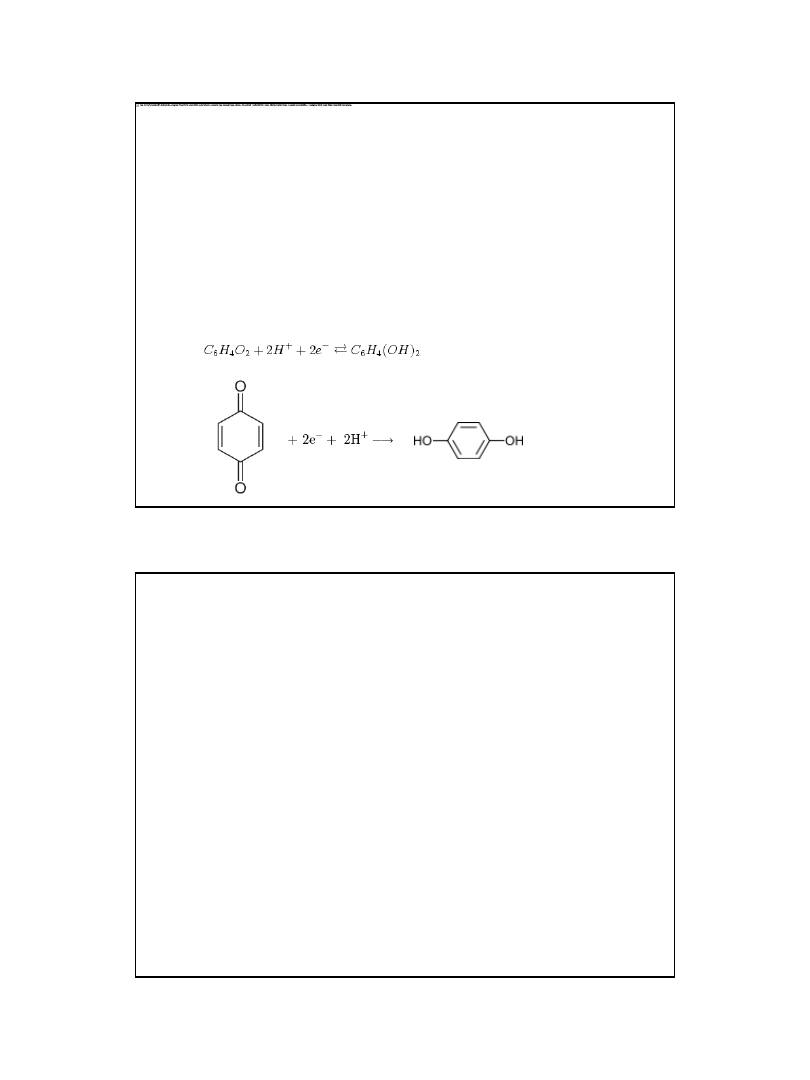
Elektroda chinhydronowa
• - półogniwo zbudowane z elektrody platynowej zanurzonej
wroztworze równomolowym chinonu i hydrochinonu
zwanym chinhydronem.
• Elektroda chinhydronowa jest odwracalna względem jonów
hydroniowych i jest elektrodą redoks, na której cząstkową
reakcją potencjałotwórczą jest wymiana elektronów i
protonów między chinonem a hydrochinonem wg reakcji:
5.
Elektrody tlenowe
zbudowane z metalu pokrytego warstwą
tlenku tego metalu
Sb|Sb
2
O
3
|H
+
2010-01-22
7
6. E
lektrody jonoselektywne
(membranowe)
można wyróżnić dwie konstrukcje: z membraną stałą i
ciekłą. Cechą szczególną jest obecność membrany
selektywnie oddziaływującej z pewnymi jonami
wysoka selektywność pomiaru – potencjał SEM
zależy tylko od aktywności jednego jonu.
-szklana do oznaczania ph
-szklana do oznaczania wybranych jonów (Cl, F)
-membranowe krystaliczne
-membranowe heterogenne
-membranowe z ciekłym wymieniaczem
-membranowe enzymatyczne
Typ elektrod jonoselektywnych
-szklana do oznaczania ph
-szklana do oznaczania wybranych jonów
(Cl, F)
-membranowe krystaliczne
-membranowe heterogenne
-membranowe z ciekłym wymieniaczem
-membranowe enzymatyczne
2010-01-22
8
Metal | membrana | roztwór badany
roztwór
membrana
roztwór
Ag, AgCl |wewnętrzny | czuła na jony | badany
CuCl
2
(c)
Cu
2+
Cu
2+
(C
x
)
Elektrody te zawierają membranę, która połączona jest z
przewodnikiem elektronowym lub z tzw. Roztworem
wewnętrznym, zawierającym jony na które czuła jest
membrana i jony pozostające w równowadze z elektrodą
wprowadzającą.
|
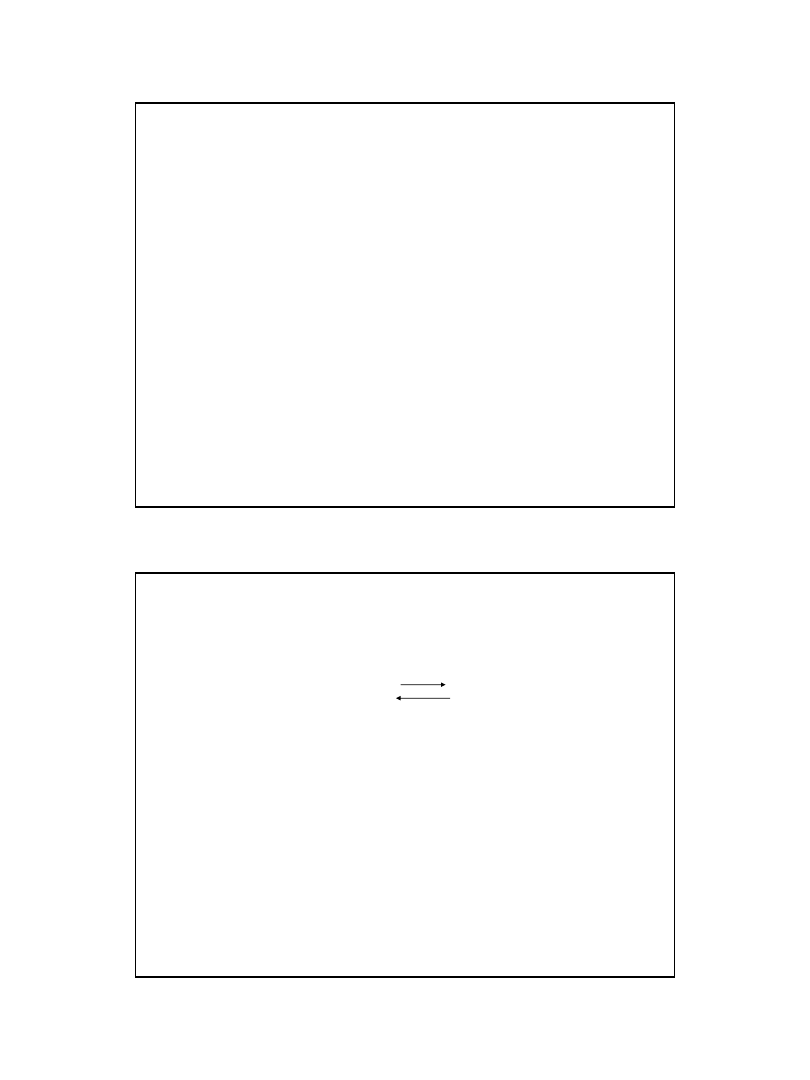
Reakcje elektrochemiczne
a Ox + ne
b Red
W stanie równowagi szybkość obydwu reakcji jest
równa.
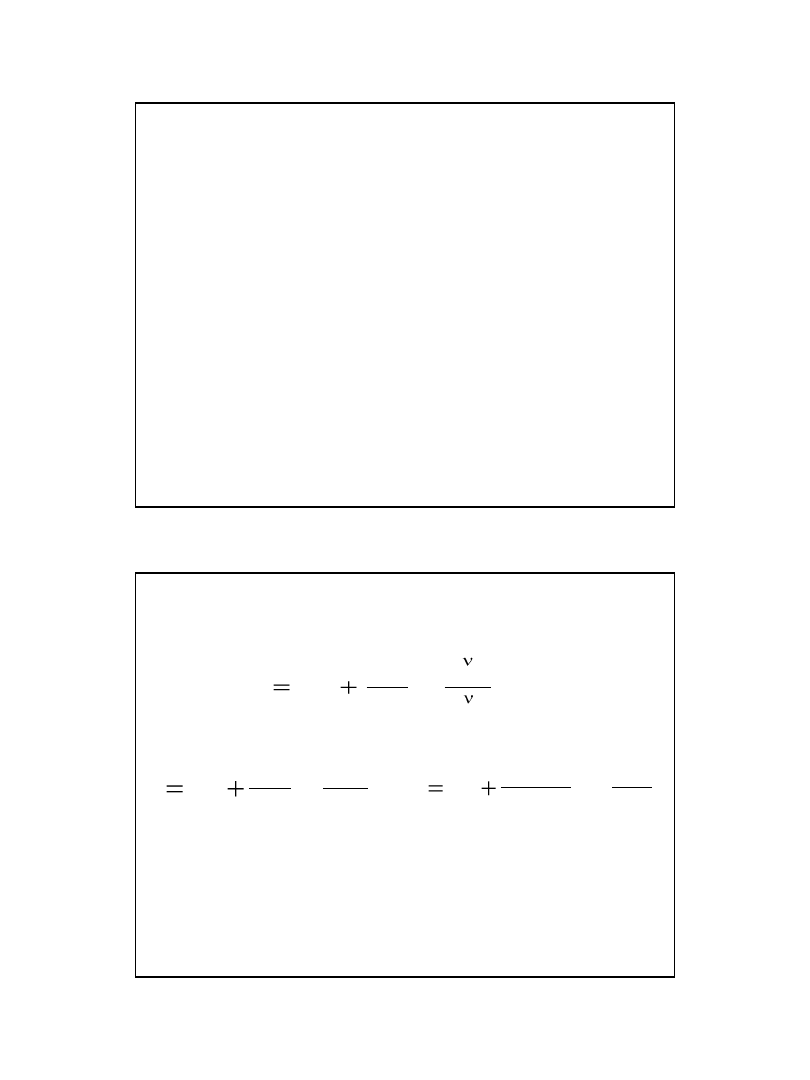
Wiedząc, że v = dC/dt
oraz C = m/MV
Szybkość reakcji można zdefiniować
v = dm/dt
2010-01-22
9
Prawo Faraday’a
m = kIt = MIt/nF
• m – masa substancji
• k – równoważnik elektrochemiczny
• I – natężenie prądu
• t – czas
• M – masa molowa
• n - liczba mili wymienionych elektronów
• F – stała Faraday’a (96 485 C/mol)
Z połączenia dwóch wzorów wynika
v = dm/dt = MI/nF
I = nFv/M
I
k
= I
a
= I
0
Prąd katodowy I
k
równy jest anodowemu I
a
i
osiąga wartość prądu wymiennego I
0
2010-01-22
10
POTENCJAŁ NORMALNY
jest to potencjał występujący na granicy faz metal-roztwór,w którym
Aktywnosć jonów wynosi 1, a temp.298 K.
Przyjęto, że potencjał normalny elektrody wodorowej jest równy 0, a
przy tym założeniu można określić potencjał każdego układu w
stosunku do elektrody wodorowej. Uporządkowane wg wartości
liczbowej normalne potencjały elektrodowe różnych metali tworzą
szereg napięciowy metali.
Szybkość reakcji jest proporcjonalna do stężenia:
a = c f
Równanie Nernst’a
Potencjał normalny E
0
jest to potencjał mierzony względem
normalnej elektrody wodorowej (NEW), której potencjał
przyjęto za 0V
red
utl
nF
RT
E
E
ln
0
R
O
R
O
0
a
a
ln
nF
RT
E
E
red
ox
z
E
E
log
0591
,
0
0

2010-01-22
11
Ogniwa galwaniczne
dwie elektrody zanurzone w elektrolitach,
połączone
przewodnikiem
elektronów
i
mostkiem
elektrolitycznym.
Mostek (klucz) elektrolityczny jest to najczęściej U–rurka
wypełniona neutralnym elektrolitem, pozwalającym na
wymianę ładunku bez mieszania elektrolitów.
Ogniwo galwaniczne – układ dwóch
półogniw połączonych ze sobą
Zn > Zn
2+
+2e
utlenianie
Cu
2+
+2e> Cu
redukcja
Klucz
elektrolityczny
Zn
2+
Cu
2+
Cu
Zn
Anoda (-) Zn|Zn
2+
(aq)
|| Cu
2+
(aq)
| Cu Katoda (+)
2010-01-22
12
Elektroda odniesienia – elektroda wykazująca
potencjał niezmienny w czasie.
Najważniejsze elektrody odniesienia:
• normalna elektroda wodorowa (NEW),
• nasycona elektroda kalomelowa (NEK),
• nasycona elektroda chloro-srebrna (Ag/AgCl/Cl
–
).
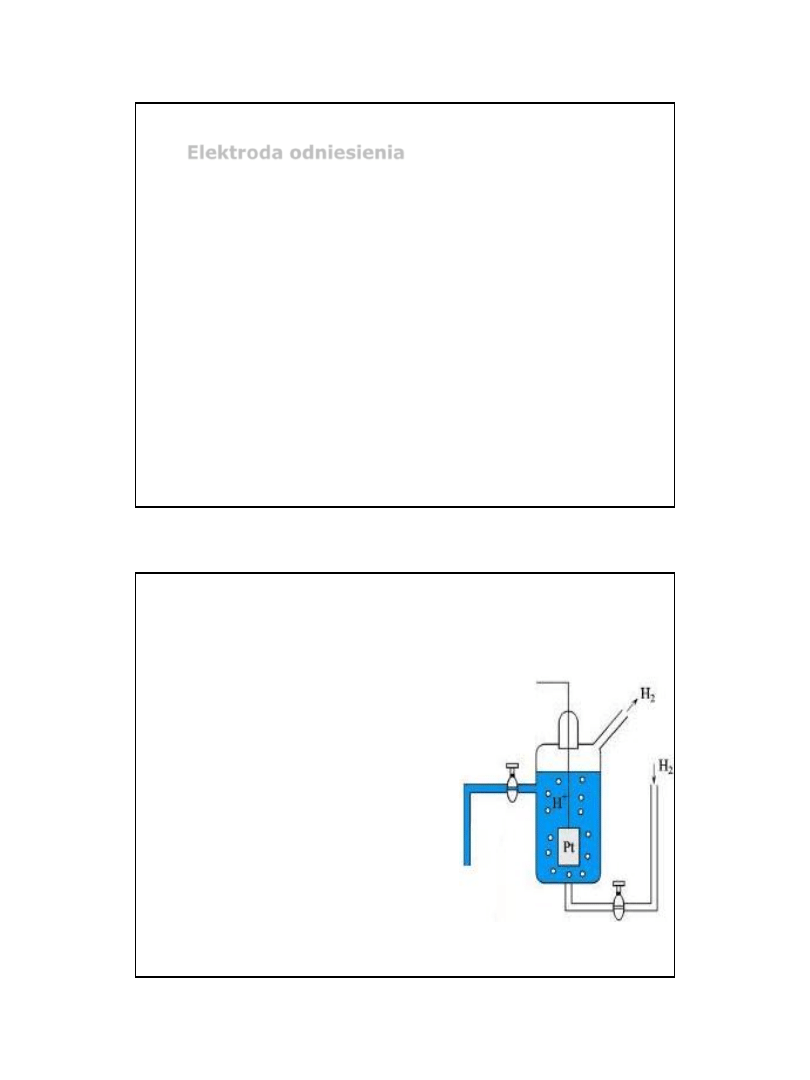
Elektroda wodorowa
Platyna, jako przewodnik,
pokryta czernią platynową
zanurzona w roztworze HCl o
a=cf = 1M nasyconym
gazowym H
2
pod ciśnieniem
1atm (1 atm = 101 325 Pa).
E
0
= 0V
2010-01-22
13
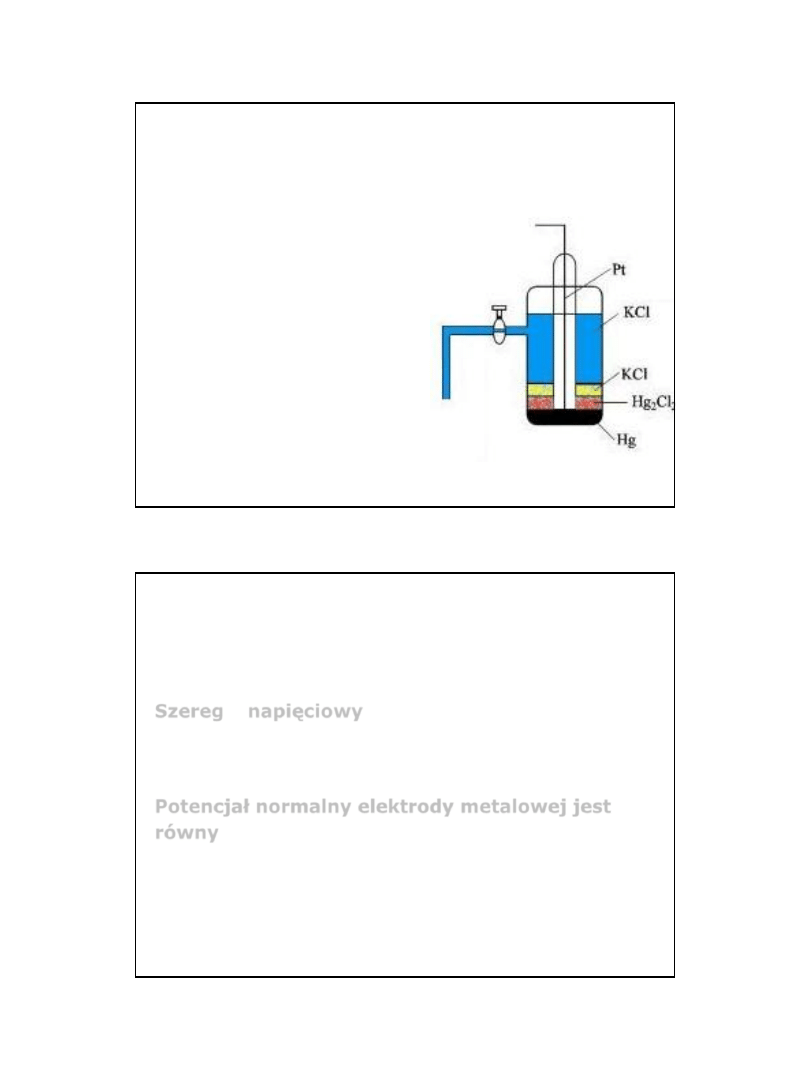
Elektroda kalomelowa
Przewodnik (Pt)połączony
z metaliczną Hg pokrytą
kalomelem (Hg
2
Cl
2
) w
nasyconym roztworze KCl
• E
0
= 0,241V
Szereg napięciowy metali
Szereg
napięciowy
–
metale
ułożone
wg
wzrastającego potencjału normalnego.
Potencjał normalny elektrody metalowej jest
równy potencjałowi metalu zanurzonego w
elektrolicie
zawierającym jony tego metalu zmierzony
względem NEW.
–

2010-01-22
14
Szereg Elektrochemiczny
Wzrost właściwości utleniających kationów
K, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
Wzrost właściwości redukujących atomów
Potencjał normalny w 25
0
C
2010-01-22
15
Ogniwa elektrochemiczne
Dzieli się na:
- galwaniczne - Reakcja redoks w ogniwie
powoduje przepływ prądu w obwodzie
zewnętrznym.
- elektrolityczne - Reakcja redoks w ogniwie jest
wymuszana przez przepływ prądu z zewnętrznego
źródła zasilania.
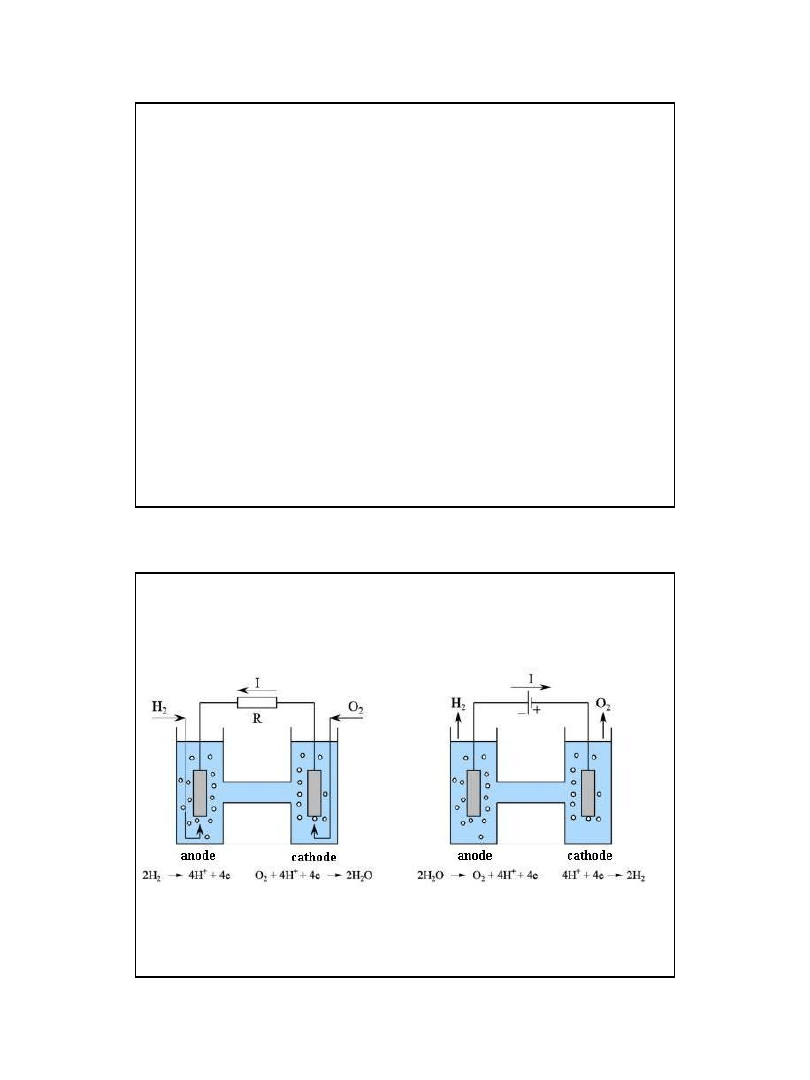
Ogniwo paliwowe
Pt|H
2
| H
2
O |O
2
|Pt
• ogniwo galwaniczne,
ogniwo elektrolityczne.
2010-01-22
16
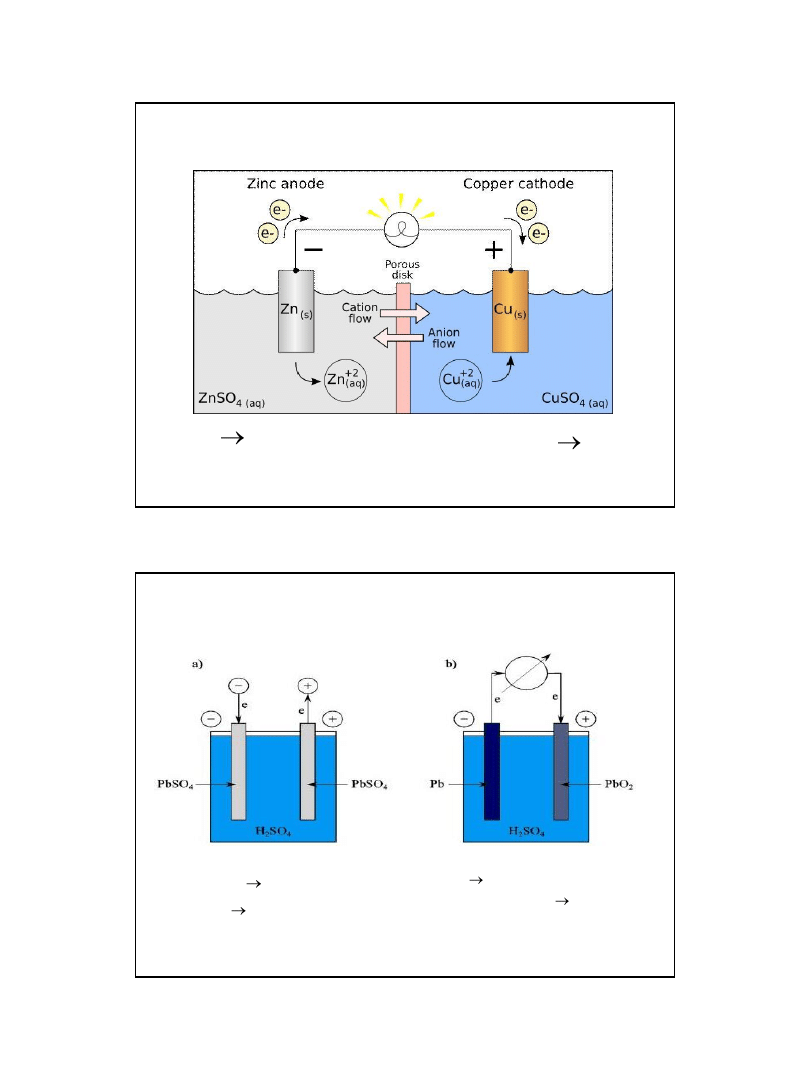
Ogniwo Daniell’a
A: Zn
Zn
2+
+2e
K: Cu
2+
+2e
Cu
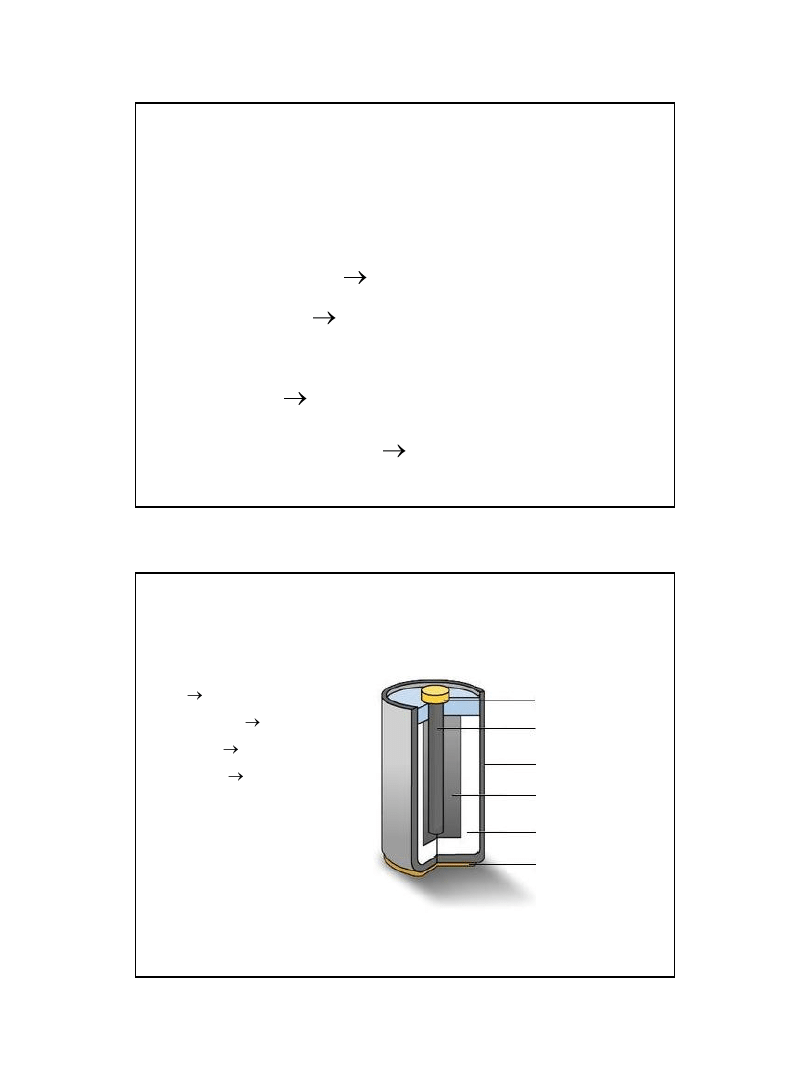
Akumulator ołowiowy
Pb|PbO
2
|H
2
SO
4
| PbSO
4
|Pb
Ładowanie:
A: Pb
2+
+2H
2
O
PbO
2
+4H
+
+ 2e
K: Pb
2+
+2e
Pb
Rozładowanie:
A: Pb
Pb
2+
+2e
K: PbO
2
+4H
+
+ 2e
Pb
2+
+2H
2
O
Pb + PbO
2
+2SO
4
2-
+ 4H
+
= 2PbSO
4
+ H
2
O
2010-01-22
17
Akumulatory niklowo–kadmowe
Cd|Cd(OH)
2
|KOH, H
2
O|NiOOH|Ni
Ładowanie:
A:2Ni(OH)
2
+2OH
-
2NiOOH+2H
2
O+2e
K: Cd(OH)
2
+2e
Cd+2OH
-
Rozładowanie:
A: Cd+2OH
-
Cd(OH)
2
+2e
K: 2NiOOH+2H
2
O+2e
2Ni(OH)
2
+2OH
-
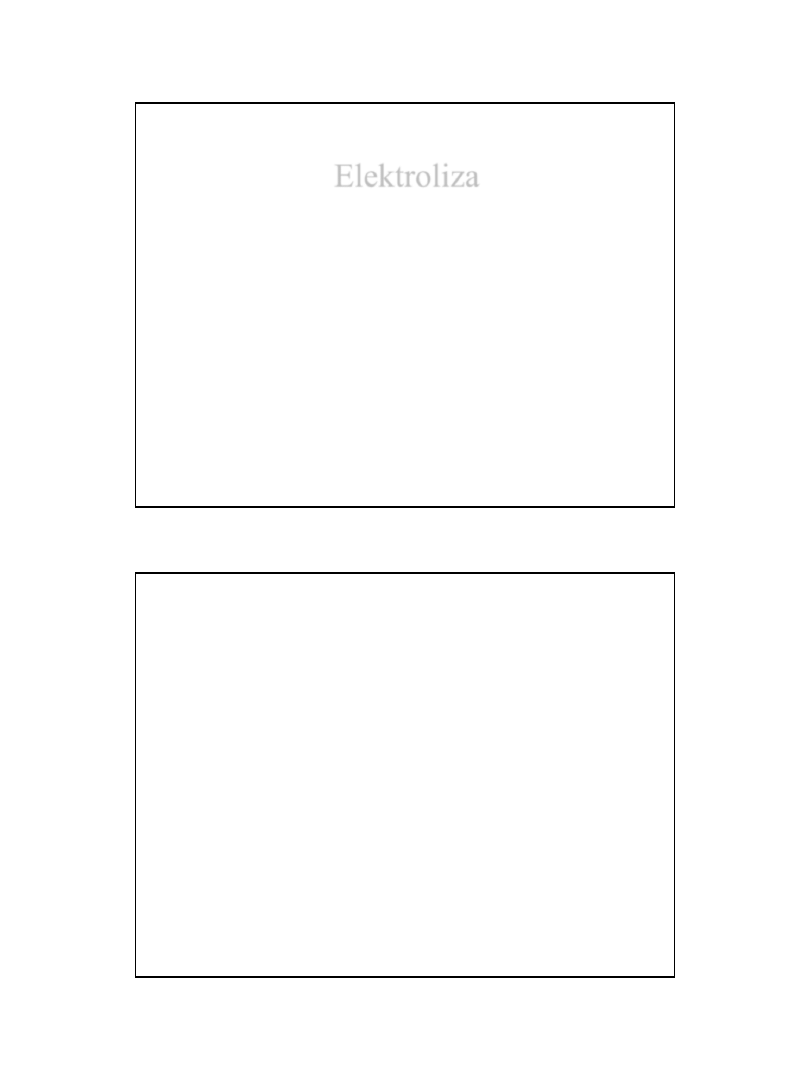
Bateria cynkowo–węglowa – ogniwo Leclanche’go
Zn|Zn
+2
|NH
4
Cl|MnO
2
|C
A: Zn
Zn
2+
+2e
K: 2NH
4
+
+2e
2NH
3
+H
2
H
2
+2MnO
2
Mn
2
O
3
+H
2
O
4NH
3
+Zn
2+
[Zn(NH
3
)
4
]
2+
metalowa zatyczka
pręt węglowy
osłona cynkowa
MnO
2
pasta NH
4
Cl
metalowe dno
Zn + 2NH
4
+
+ 2MnO
2
= [Zn(NH
3
)}
2+
+2MnO(OH)
E = 1.48V
2010-01-22
18
Elektroliza
proces podczas którego prąd elektryczny z
zewnętrznego źródła zasilania powoduje zachodzenie
na elektrodach reakcji utleniania i redukcji.
PRZEWIDYWANIE
PRODUKTÓW ELEKTROLIZY
Kolejność wydzielania się produktów elektrolizy
zależy od wielu czynników:
- rodzaju elektrod,
- stanu ich powierzchni,
- składu przewodnika jonowego,
- temperatury,
- pH itd.
2010-01-22
19
- Jeżeli roztwór zawiera substancje AB w
postaci jonów A
+
i B
-
, zawiera także jony
pochodzące z autodusocjacji wody, które
także mogą brać udział w procesach
elektrodowych. Do każdej z elektrod będą
podążały po dwa rodzaje jonów: do katody
kationy A
+
oraz H
+
, do anody aniony B
-
i
OH
-
.
Uproszczone reguły przewidują
następującą kolejność rozładowywania się
kationów:
1. Kation metalu ciężkiego (metalu stojącego za
glinem w szeregu napięciowym)
2. kation wodorowy H
+
Najważniejsze wyjątki od tych reguł:
1. Rozładowywanie kationu Na
+
na elektrodzie
rtęciowej
2. Równoczesne wydzielanie wodoru i metalu w
środowisku kwaśnym
2010-01-22
20
Reguły dla anionów (dla anody
platynowej lub grafitowej):
1. Anion kwasu beztlenowego
2. Anion OH
-
Reguły
- Jeżeli roztwór zawiera kilka jonów metali ciężkich (np.
Zn
2+
, Fe
2+
, Cu
2+
), to metale te będą się osadzały w
kolejności wynikającej z szeregu napięciowego: najpierw
wydzieli się ten o wyższym potencjale standardowym.
- Jeżeli roztwór poddawany elektrolizie zawiera kilka
kationów M
1
, M
2
, ... i kilka anionów A
1
, A
2
, ..., to
rozładowaniu ulegają:
• na katodzie kation o najwyższym potencjale redukcji
katodowej
• na anodzie anion o najniższym potencjale utleniania
anodowego
2010-01-22
21
• Po wyczerpaniu się kationów jednego
rodzaju rozpoczyna się rozładowywanie
kolejnego jonu o najwyższym potencjale
redukcji katodowej. W niektórych
przypadkach, gdy potencjały są zbliżone,
może następować równoczesne wydzielanie
dwóch substancji. Analogicznie w
przypadku anody.
Elektroliza wody
Wymaga przyłożenia z zewnętrznego źródła napięcia
różnicy potencjałów przekraczającą wartość SEM
Na anodzie (+) zachodzi utlenianie H
2
O
A: 2 H
2
O
O
2
+ 4H
+
+ czyli
2O
2-
O
2
+4e
Na katodzie (-) zachodzi redukcja H
2
O
K: 2 H
2
O + 2e
H
2
+ 2OH
-
czyli
4H
+
+4e
2H
2
Reakcja sumaryczna 2 H
2
O = 2H
2
+O
2
2010-01-22
22
Elektroliza stopionego NaCl.
A: 2Cl
-
Cl
2
+2e
K: 2Na
+
+2e
2Na
Jest to metoda otrzymywania chloru
gazowego i sodu metodą
elektrochemiczna
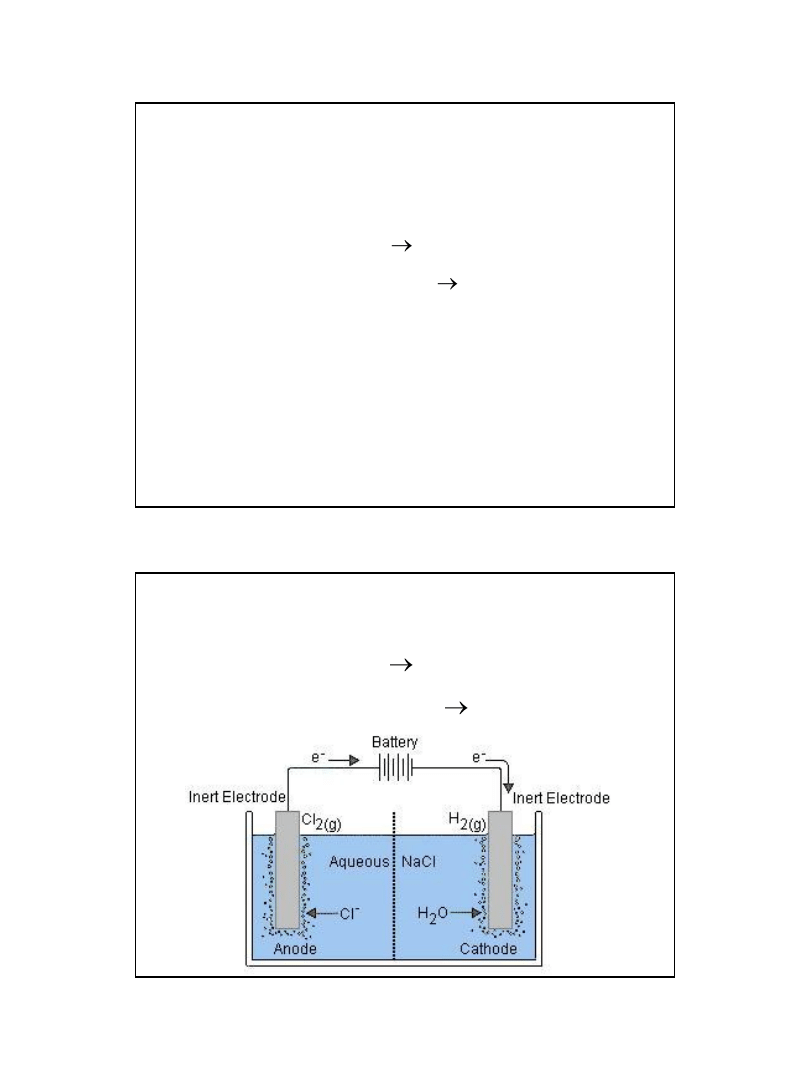
Elektroliza wodnego roztworu NaCl.
A: 2Cl
-
Cl
2
+2e
K: 2H
+
+2e
H
2
2010-01-22
23
Przykład I.
CuCl
2
= Cu
2+
+ 2 Cl
-
K(-) Cu
2+
+ 2 e = Cu
A (+) 2 Cl
-
= Cl
2
+ 2 e
redukcji na katodzie i utleniania na anodzie
Przykład II.
Na
2
SO
4
= 2 Na
+
+ 2 SO4
2-
K (-) 2 H
2
O + 2 e = H
2
+ 2OH
-
A (+) 2 H
2
O = O
2
+ 4 e + 4 H
+
W przypadku elektrolizy wodnych
roztworów kationów metali lekkich
lub anionów kwasów tlenowych na
elektrodach rozkładowi ulega woda
2010-01-22
24
Przykład III.
NaOH= Na
+
+ OH
-
K (-) 2H
2
O + 2 e = H
2
+ 2 OH
-
A (+) 4OH
-
= O
2
+ 4 e + 2 H
2
O
Prawa elektrolizy Faraday`a
I. m= kIt
k = M/zF
I [A], t [s]
F – ładunek elektryczny mola elektronów
F –96 500 C/mol, Nxq = 96 500 C/mol
II. Gdy I·t= const.
m
1
/m
2
= k
1
/k
2
> m
1
/m
2
= M
1
z
1
/M
2
z
2
Przykład:W czasie elektrolizy wodnego roztworu siarczanu(VI)
żelaza(III) na elektrodzie wydzieliło się 5 g Fe. Oblicz objętość gazu,
który wydzielił się na drugiej elektrodzie.
(-) Fe
3+
+ 3 e = Fe
(+) 2 H
2
O = O
2
+ 4 e + 4H
+
4Fe
3+
6H
2
O = 4Fe + 3O
2
+ 12H
+
n
Fe
z
Fe
= n
o2
z
o2
n
o2
=3/4 n
Fe
V
O2
= 22,4x3/4x5/55,8= 1,5 dm
3
2010-01-22
25
Elektrolityczne otrzymywanie glinu
Al
2
O
3
otrzymuje się z boksytu: AlO(OH), Al(OH)
3
,
Fe
2
O
3
w wyniku działania NaOH:
1. AlO(OH) + Al(OH)
3
+2OH
-
+H
2
O= 2 Al(OH)
4
-
,
Fe
2
O
3
–nie rozpuszcza się.
2.Al(OH)
4
-
+ CO
2
= Al(OH)
3
+ HCO
3
-
,
3Al(OH)
3
Al
2
O
3
• K(-) Al
3+
+ 3e = Al.
• A(+) 2O
2-
+ C = CO
2
+ 4e
Prawa elektrolizy Faraday’a
m = kIt
k = M/zF
m =(M/zF) I t = (M/zF) Q
n = Q/zF

2010-01-22
26
Prawa elektrolizy Faraday`a
Wzrost właściwości utleniających kationów
K, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
Przykład:
Roztwór zawierający 0,5 mola ZnCl2i 0,5 mola FeCl
3
poddano
elektrolizie, przepuszczając ładunek Q= 2 F. Określić skład % warstwy
metalicznej osadzonej na elektrodzie.
Fe
3+
+ 3 e = Fe; z
Fe
= 3
Zn
2+
+ 2 e = Zn ; z
Zn
= 2
Q
Fe
= 0,5x3F = 1,5F
Q = Q
Fe
+ Q
Zn
m
Fe
= (56/3F)x1,5F = 28g
m
Zn
= (65/2F)x0,5F = 16,25g
%
Fe
= 28/(28+16,25)x100=63,28
Wyszukiwarka
Podobne podstrony:
Cwiczenie 6a, Chemia UŁ, Elektrochemia
chemia, struktura elektronowa pierwiatkow definicje
CHEMIA FIZYCZNA- Elektrochemia sc, Ochrona Środowiska pliki uczelniane, Chemia
Chromatografia1, chemia, Chromatografia, elektroforeza
CHROMATOGRAFIA, chemia, Chromatografia, elektroforeza
Cwiczenie 5b, Chemia UŁ, Elektrochemia
chemia, chemia - szereg elektrochemiczny metali
Chemia labolatorium, Elektroliza, Elektroliza - uszeregowana wędrówka jonów do elektrod pod wpływem
Chemia 2, Przewodnictwo elektr
Chemia- korozja elektrolityczna, ?WICZENIE NR 7_
chemia ćw 5 ELEKTROLIZA
CAŁOŚĆ elektrodyka, Chemia Fizyczna, Fizyczna - koła, Kolokwium Fizyczna Roszak Lipkowski, 1Kolokwiu
CHEMIA - LABORATORIUM - SPRAWOZDANIE - Wyznaczanie przewodnictwa granicznego elektrolitów, STUDIA
Równowaga w roztworach elektrolitów, NAUKA, chemia, lab
Wyklad 11a. Elektrolity, pwr biotechnologia(I stopień), I semestr, Chemia ogólna
Wyklad 11b. Elektrolity - cd., pwr biotechnologia(I stopień), I semestr, Chemia ogólna
LAB1-ELEKTRO-AK KM, chemia pk rok 2
więcej podobnych podstron