
Materiały wykładowe – do egzaminu
Drobnoustroje w ochronie
środowiska

Wykład 2
• Charakterystyka organizmów uczestniczących
w degradacji ścieków w kontekście metod
oczyszczania ścieków

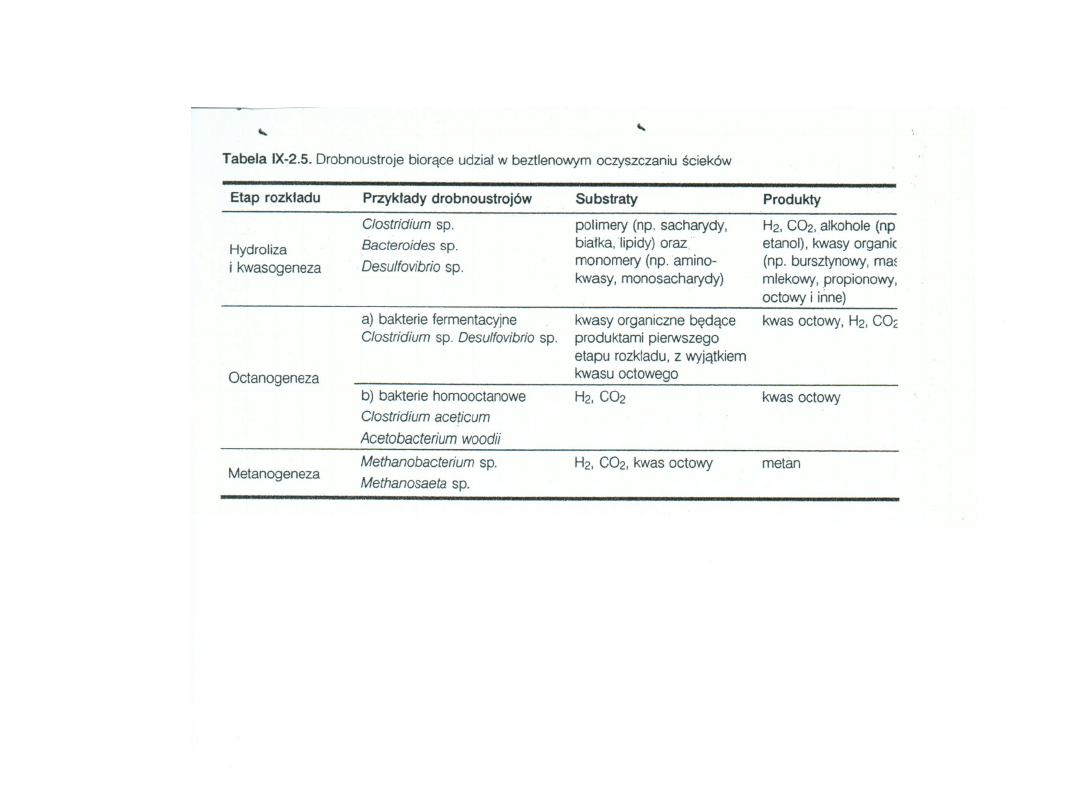
Bakterie nitkowate występujące w osadzie czynnym - przykłady
Typ domeny Bacteria
Nazwa bakterii
γ- Proteobacteria
Thiothrix sp.
Leucothrix mucor
Eikelboom sp.
β-Proteobacteria
Sphaerotilus natans
Leptothrix discophora
Leptothrix mobilis
α-Proteobacteria
Nostocoida limicola –like bacterium
Actionbacteria
Nocardia asteroides
Nocardia brasilliensis
Gardona amarae
Skermania pinensis
Rhodococcus thiodnii
Rhodococcus rhodochrous
Nostocoida limicola II
Microthrix parvicella
Bacteroidetes
Haliscomenobacter hydrossis
Firmicutes
Nostocoida limicola I
Planctomyces
Nostocoida limicola III
Chloroflexi
Herpetosiphon surentiacus
Thermomicrobia
Nostocoida limicola – like bacterium
3

Bakterie usuwające fosfor – przykłady (izolowane klony)
Typ domeny Bacteria
Klon podobny do
α-Proteobacteria
Defluvicoccus vanus
Paracoccus yeeii
Mesorhizobium sp.
β-Proteobacteria
Acidovoranx avenae
Xylophilus ampenilus
Dechloromonas sp.
γ- Proteobacteria
Anaeromyxibacter dehalogenas
Bacteroidetes/Chlorobi
Nostocoida limnicola III
Actinobacteria
Microbacterium nematophilum
Pseudonocardia zijngensis
4

Bakterie usuwające fosfor – przykłady
Oprócz wymienionych w tabeli bakterii do kumulacji polifosforanów
zdolne są bakterie:
• z rodzaju
Acinetobacter
• Gatunki
Microlunatus
• Grupa
Rhodocyclus
A w warunkach tlenowych:
Lampropedia sp.
Micropruina glzcogenica
Accumulibacter phosphatis
Gemmatiomonas aurantiaca
5
6

Wykład 3

Drobnoustroje degradujące węglowodory ropy
naftowej
Bakterie:
Achromobacter sp.,
Acinetobacter sp.,
Actinomyces sp.,
Alcaligenes sp.,
Arthrobacter sp.,
Aeromonas sp.,
Bacillus sp.,
Brevibacterium sp.,
Corynacterium sp.,
Flavobacterium sp.,
Micrococcus sp.,
Mycobacterium sp.,
Nocardia sp.,
Pseudomonas sp.

Drobnoustroje degradujące węglowodory ropy
naftowej
Grzyby:
• Candida sp.,
• Debaromyces sp.,
• Hansenula sp.,
• Pichia sp.,
• Rhodosporidium sp.,
• Rhodotorula sp.,
• Saccharomyces sp.,
• Sporobolomyces sp.,
• Torulopsis sp.,
• Trichosporon sp.,
• Aspergillus sp.,
• Aureobasidium sp.,
• Cladosporium sp.,
• Fusarium sp.,
• Mortierella sp.,
• Mucor sp.,
• Penicillium sp.,
• Sporotrichium sp.,
• Varicospora sp.

Węglowodory ropy naftowej
Żaden z drobnoustrojów nie ma możliwości biodegradacji wszystkich
węglowodorów, a jedynie wybrane związki.
Szerokim spektrum substratowym może pochwalić się
Pseudomonas sp
., także promieniowce jak
Rhodococcus sp.,
Nocardia sp., Gordonia sp., Mycobacterium sp.
i
Dietzia sp
.
Posiadają one uzdolnienia enzymatyczne do transformacji i
degradacji różnych grup węglowodorów.
Wykazują one zdolność
do asymilacji
dodecylocykloheksanu, 2,6,10,14-
tetrametylopentadekanu, fenylodekanu
.
Na uwagę zasługują też grzyby, głównie
Phanaerochaete
chrysosporium
– wytwarzający peroksydazy lignolityczne
atakujące pierścienie węglowodorów aromatycznych.

Węglowodory ropy naftowej
Biodegradacja tych węglowodorów zachodzi zarówno w
warunkach tlenowych jak i beztlenowych. Uzależnione to
jest od typu środowiska (gleba, woda) i typu
zanieczyszczenia. W warunkach beztlenowych rozkładane
są alkany C12 – C20, węglowodory mono –i
poliaromatyczne.
W pierwszej kolejności wykorzystywane są n-alkany
powodujące obfity wzrost drobnoustrojów.
Oporne na biodegradacje są asfalteny – mieszanina
związków aromatycznych i alicyklicznych z krótkimi,
alkilowymi odgałęzieniami. Możliwa jest ich
biodegradacja we frakcji olejowej.

Alkany
• Degradacje
pristanu
prowadzą szczepy
Corynebacterium sp.,
Brevibacterium sp., Alcanvorax sp., Rhodococcus sp,
Nocardia sp.
na drodze β- lub ω-oksydacji.
• Rhodococcus sp
.,
Mycobacterium sp
. jest zdolny także do
degradacji
fytanu
(2,6,10,14-tetrametylokeksadekan),
norpristanu
(2,6,10-trimetylopentadekan),
famesanu
(2,6,10-
trimetylodekan)
• Acinetobacter sp., Brevibacterium sp., Arthrobacter sp
.
degradują
cykloheksan
• Rhodococcus ruber CD1-411
– zdolny jest do degradacji
cyklodekanu

Wykład 4
• Mikroorganizmy w usuwaniu metali ciężkich
• Biodegradacja odpadów organicznych

Składniki osłon drobnoustrojów wiążące metale cięzkie
Drobnoustroje
Składniki osłon komórkowych
Grupy funkcyjne
Bakterie gramdodatnie
peptydoglikan
kwasy tejchojowe
karboksylowe
fosforanowe
Bakterie gramujemne
fosfolipidy i białka osłon
lipopolisacharyd
fosforanowe
grupy anionowe
(karboksylowe,
hydroksylowe, amidowe),
fosforanowe
Grzyby strzępkowe
chityna
chitozan
hydroksylowe
Drożdże
mannan
hydroksylowe
Glony
kwas mannuronowy
karboksylowe
Drobnoustroje
wytwarzającer otoczki lub
warstwy śluzowe
polipeptydy
wielocukry
kwasy: uronowy, pirogronowy
różne grupy anionowe
hydroksylowe
karboksylowe

Wiązanie metali ciężkich przez drobnoustroje w warunkach
laboratoryjnych
Drobnoustrój
Metal
Ilość związanego
metalu [mg/g s.m.]
B
ak
te
ri
e
Bacillus subtilis
Cynk
137
Bacillus subtilis
Ołów
189
Brevibacterium sp.
Ołów
52,9-65,9
G
rz
yby
Paecilomyces marquandii
Cynk
84/206 (warunki
głodowe)
Absidia coerulea
Ołów
351
Rhizomucor miehei, Apergillus niger
Cynk
54-55
Amylomyces rouxii
Miedź
62
Rhizopus sp.
Kobalt
190
G
lo
n
y
Fucus vesiculosus, Ascophyllum nodosum
Ołów
210-360

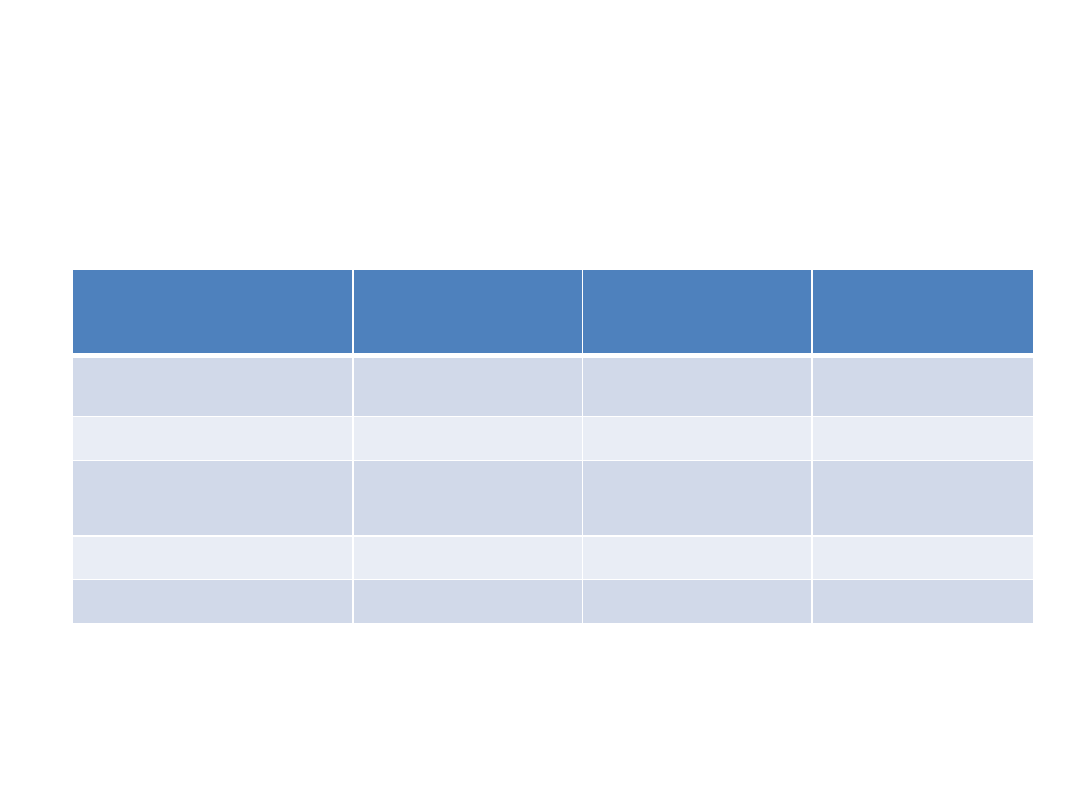
Przykłady mikroorganizmów biorących udział w kompostowaniu –
domena Bacteria
Typ/domena
Nazwa rodzajowa/gatunkowa
α-Proteobacteria
Agrobacterium sp., Agrobacterium tumefaciens,
Bradyrhizobium elkanii, Mesorhizobium lotti, Methylobacterium sp.,
Rhizobium sp., Sphingomonas sp.
β-Proteobacteria
Acidovorax delafieldii, Alcaligenes sp., Burkholderia cepacia,
Comomonas sp., Variovorax paradoxus
γ-Proteobacteria
Acinetobacter sp., Enterobacter sp., Klebsiella pneumoniae,
Pseudomonas sp., Salmonella sp.
Firmicutes
Bacillus sp., Clostridium sp., Enterococcus sp., Lactobacillus sp.,
Staphylococcus sp., Wesella sp.
Bacteroidetes
Chryseobacterium sp., Flacobacterum sp., Flexibacter sp.
Deinococcus-Thermus
Thermus sp.
Aquificae
Hydrogenobacter sp.

Przykłady mikroorganizmów biorących udział w kompostowaniu –
typ Actinobacteria
Actinobifida chromogena
Arthrobacter sp.
Brevibacterium lutescens
Corynebacterium sp. (np. C. aquaticum, C. amycolatum)
Cytophaga fucicola
Isoptericola sp.
Micrococcus sp.
Microbispora bispora
Nocardia sp.
Oerskovia sp.
Propionibacterium acnes
Rhodococcus sp.
Streptomyces sp.
Thermoactinomycetes sp.
Thermomonospora sp.

Przykłady mikroorganizmów biorących udział w kompostowaniu –
domena Archea
Głównie oznaczono w fazie temofilnej Methanobacterium thermoautotroficum oraz
Methylocaldum szegediense.

Przykłady mikroorganizmów biorących udział w kompostowaniu –
grzyby
•Absidia sp.
•Acremonium sp.
•Aspergillus sp.
•Candida sp.
•Cladosporium sp.
•Coprinus sp.
•Cryptococcus sp.
•Dactylomyces sp.
•Ganoderma colossum
•Geotrichum sp.
•Hamigera sp.
•Melanocarpus sp.
•Mycena sp.
•Neurospora sp.
•Pichia sp.
•Rhizomucor sp.
•Rhodospiridium sp.
•Scopulariopsis sp.
•Talaromyces sp.
•Thermoascus sp.
•Torula sp.
Mikroorganizmy biorące udział w kompostowaniu – zmiany
ilościowe
Zmiany te zależą głównie od temperatury i od dostępności materii organicznej.
Grupa mikroorganizmów
Faza mezofilna (<40
o
C)
Faza termofilna (40-
70
o
C)
Faza schładzania (70
o
C
– zimno)
Bakterie mezofilne
10
8
10
8
10
11
Bakterie termofilne
10
4
10
9
10
7
Promieniowce
termofilne
10
4
10
8
10
6
Grzyby mezofilne
10
5
10
3
10
5
Grzyby termofilne
10
3
10
7
10
6

Sukcesja mikroorganizmów
• Sukcesja to następujące po sobie zmiany ilościowe i jakościowe w składzie
mikroflory, zależy od temperatury.
• W
fazie mezofilnej
dominują rezydenci roślin i odpadów roślinnych, m.in.
Lactobacillus sp., Pediococcus sp., Leuconostoc
sp. (bakterie mlekowe),
Streptomyces sp.
(promieniowce),
drożdże
, degradując głównie cukry i białka
do kwasów organicznych. Czasami rozwijają się
Propionibacterium sp.
oraz
Methylobacterium sp.
degradując kwasy organiczne do CO2 i H2O.
• W
fazie termofilnej
dominują bakterie gram dodatnie oraz promieniowce. W
temp 49-69
o
C dominują
Bacillus sp.,
Thermus sp., Streptomyces sp.,
Thermoactinomyces sp
., a z grzybów
Aspergillus sp.
• W
fazie schładzania
dominują różne gatunki promieniowców i grzybów
pleśniowych. Materiał kompostowy pokrywa grzybnia, np. grzybów
Candida
sp
. oraz promieniowców:
Microbispora sp. Streptomyces sp
. czy
Streptosporangium sp
. Są też bakterie zarodnikujące –
Bacillus sp., Clostridium
sp
.

Bakterie w kompoście
W fazie mezofilnej dominują:
•
Pseudomonas sp. (P. aureofaciens, P. fluorescens, P. putida, P. stutzeri, P. paucimobilis,
P. trivialis)
•
Achromobacter sp.
•
Acinetobacter sp. (A. junii, A. lwofii)
•
Bacillus sp. (B.badius, B. coagulans, B. subtilis, B. pumilis)
•
Cellulomonas sp.
•
Commomonas acidovorans
•
Clostridium sp.
•
Flavobacterium mutlivorum
•
Luteimonas mephitis
•
Staphylococcus sp. (S. sciuri)
•
Cytophaga fucicola
•
Bakterie nitryfikacyjne
Wykazują one aktywność proteolityczną, wydzielając do środowiska m.in.. alkaliczną proteazę
serynową – trawienie białek

Bakterie w kompoście
W fazie termofilnej (49-65
o
C)
dominują:
• Bacillus
(B.)
sp
. (ok. 85% populacji bakterii)
W temp. 45-50
o
C za degradację, głównie cukrów, odpowiadają:
• B. licheniformis, B. thermoamylovorans, B. thermospaericus
• B. circulans
– rozkłada celulozę i pektyny
W temp. 58
o
C stwierdzono:
B. coagulans, B. badius, Virdibacillus proomii,
Gracibacillus halotolerans
W temp. 65
o
C:
B. badius, B. brevis, B. caldoxylolyticus, N. coagulans, B.
spgericus, B. thermoamylovorans, B. thermoacetlutanus, B. thermocloacae,
B. thermooleovorans, Geobacillus stearthermophilus
W temp. 70
o
C dominuje
Caldibacillus cellulovorans
Wyizolowano także
Hydrogenobacter sp
. i
Bacillus schlegelli.

Bakterie w kompoście
W fazie schładzania (52-30
o
C)
występują:
• Sphingobacterium multivorum
• Alloicoccus oitis
• Clostridium fervidus
• Clostridium filamentosum
• Alcaligenes sp.
• Arthrobacter sp.
(promieniowiec) - resynteza humusu

Bakterie w kompoście
• Alcaligenes sp.
• Pseudomonas sp.
• Nitrosospira sp.
• Vibrio sp.
• Rhodothermus sp.
• Flavobacterium sp.
• Cytophaga sp.
• Streptomyces sp.
• Actinomyces sp.
• Agromyces sp.
• Corynebacterium sp.
• Propionibacterium sp.
• Arthrobacter sp.
• Ruinococcus sp.
• Clostridium sp.
• Thermoanaerobacterium sp.
• Bacillus so.
• Sachcarococcus sp.
• Virgibacillus sp.
• Gracibacillus sp.
• Lactobacillus sp.
• Strpetococcus sp.
• Staphylococcus sp.
• Alloiococcus sp.
Niezależnie od fazy termicznej zawsze występują w kompoście

Grzyby w kompoście
• W kompoście zidentyfikowano ponad 300
gatunków grzybów, głównie pleśniowych i
drożdży.
• Wiele termofilnych grzybów wytwarza
ektoenzymy
(amylazy, lipazy, celulazy,
ksylanazy, pektynazy, proteazy, fosfatazy).
• Wiele gatunków grzybów pleśniowych
produkuje
lakkazy
– utlenianie fenolu w
procesie humifikacji.
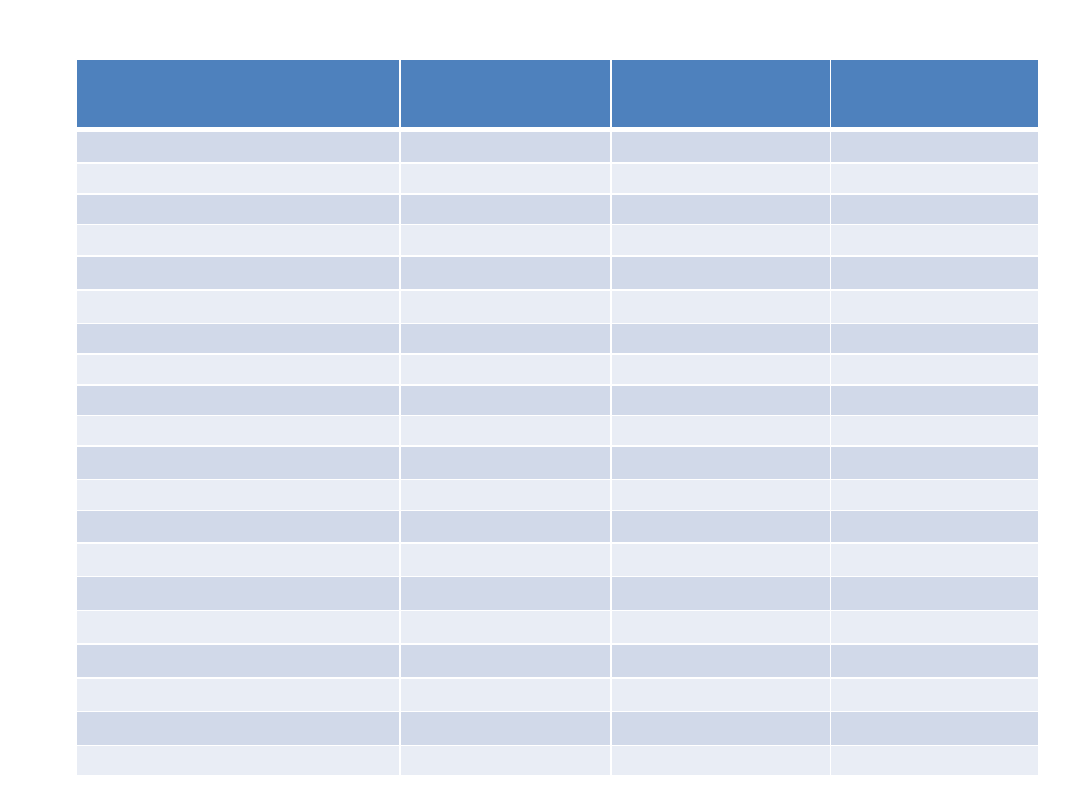
Gatunek grzyba
Temperatura minimalna
[
o
C]
Temperatura optymalna [
o
C]
Temperatura maksymalna
[
o
C]
Absidia corymbifera
14
40
50
Absidia ramosa
10-13
40
52
Aspergillus fumigatus
12-20
37-45
55-57
Chaetomium thermophilum
27
50
58-61
Coonemeria crustacea
20-25
40
<60
Corynascus thermophilus
20
28-40
60
Dactylomyces thermophilus
25
40-45
?
Malbranchella pulchella
26-30
45-46
57
Myriococcum thermophilum
28
45
53
Rhizomucor pusillis
20-27
35-55
55
Scytalidium thermophilum
23
40
58
Stibella thermophila
25
35-50
55
Talaromyces dupontii
25-30
45-53
57-60
Talaromyces emersonii
30
40-45
55
Talaromyces thermopilus
25-30
45-50
60
Thermoascus thermophilus
20-35
45-50
55-60
Thermoascus aurantiacus
31
44-46
55-62
Thermomyces lanuginosus
30
45-50
60
Thielavia terrestris
22
42-45
52
Torula thermophila
23
40
58
Dominujące grzyby w kompoście

Wykład 5
• Udział bakterii w bioremediacji gleb i wód
gruntowych oraz w usuwaniu zanieczyszczeń
powietrza

Drobnoustroje degradujące węglowodory ropy
naftowej - bakterie
Achromobacter sp.,
Acinetobacter sp.,
Actinomyces sp.,
Alcaligenes sp.,
Arthrobacter sp.,
Aeromonas sp.,
Bacillus sp.,
Brevibacterium sp.,
Corynebacterium sp.,
Flavobacterium sp.,
Micrococcus sp.,
Mycobacterium sp.,
Nocardia sp.,
Pseudomonas sp.

Drobnoustroje degradujące węglowodory ropy
naftowej - grzyby
• Candida sp.,
• Debaromyces sp.,
• Hansenula sp.,
• Pichia sp.,
• Rhodosporidium sp.,
• Rhodotorula sp.,
• Saccharomyces sp.,
• Sporobolomyces sp.,
• Torulopsis sp.,
• Trichosporon sp.,
• Aspergillus sp.,
• Aureobasidium sp.,
• Cladosporium sp.,
• Fusarium sp.,
• Mortierella sp.,
• Mucor sp.,
• Penicillium sp.,
• Sporotrichium sp.,
• Varicospora sp.
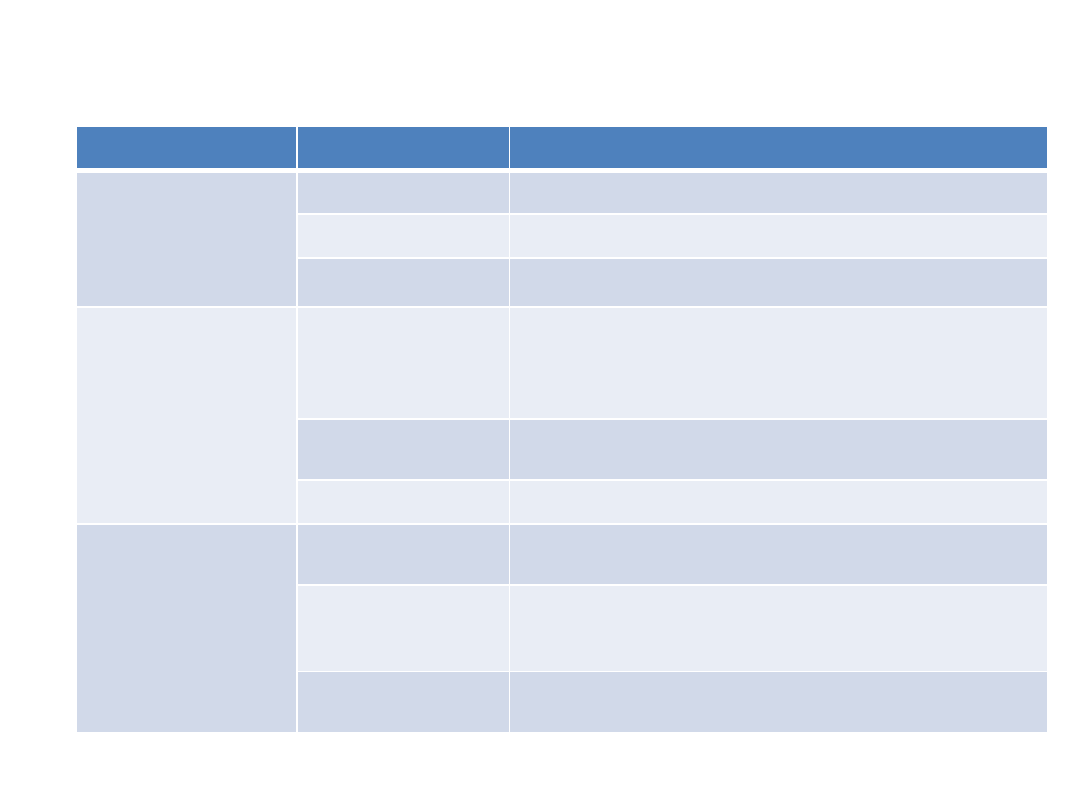
Mikroflora degradująca odory w warunkach tlenowych
Grupa odorów
Klasa
Rodzaj/gatunek mikroorganizmu
Węglowodory
alifatyczne i
aromatyczne
Bacteroides
Planococcus sp., Cytophaga sp., Flavobacterium sp.
γ-Proteobacteria
Psychrobacter sp., Moraxella sp.
Actinobacteria
Gordona alkanivorans, Gordona paraffinivorans
Węglowodory
alifatyczne
γ-Proteobacteria
Acinetobacter sp. (szczep ADP1 i M1),
Alcanivorax sp. (szczep MBIC4326),
Pseudomonas putida GPO1, Pseudomonas sp. (szczep C12B),
Stenotrophomonas maltophilia
β-Proteobacteria
Burkholderia cepacia
Actinobacteria
Rhodococcus sp.
Węglowodory
aromatyczne
β-Proteobacteria
Burkholderia sp. (szczep Rp007)
Actinobacteria
Mycobacterium sp. , Mycobacterium szczep PYR1, Nocardia
sp.,
Rhodococcus sp.
γ-Proteobacteria
Pseudomonas sp. (szczep U2)

Mikroflora biofiltrów i biopłuczek
Do usuwania odorów z bioprzemysłu, emitującego
związki organiczne siarkowe wykorzystywane są:
1. Autotrofy:
Thiobacillus sp
.
2. Metylotrofy:
Hyphomicrobium sp.,
Methylophaga sulfidovorans, Pseudomonas
acidovorans, Xanthomonas sp.
3. Grzyby:
Cephalosporium s
p. i liczne
niezidentyfikowane szczepy z klasy
Basidiomycetes

Mikroflora biofiltrów i biopłuczek
Badania molekularne wykazały, że wśród bakterii dominują gatunki
należące do typu
Proteobacteria (α-, β- i γ-Proteobacteria),
Actinobacteria, Cytophaga-Flavobacterium i Firmicutes.
Z niższej rangi taksonomicznej dominują bakterie należące do
Alcaligenes/Bordetella, rodzaje Methylobacillus i Methylophilus oraz
Sphingomonas spp., Acinetobacter sp., Xanthomonas sp.
Także stwierdza się w przypadku oczyszczania gazów z zakładów
przerabiających tłuszcze zwierzęce promieniowców:
Corynebacterium
sp., Gordona (G. hirsuta, G. hydrophobica), Mycobacterium sp.,
Arthrobacter sp.

Mikroflora biofiltrów
• Za degradacje odorów ze styrenem odpowiadają:
Psedudomonas sp., Sphingomonas sp., Tsukamurella sp.,
Xanthomonas sp.
Z grzybów spotyka się:
• Degradujące węglowodory alifatyczne:
Acremonium sp.,
Graphium sp., Cladosporium resinae, Scedosporium sp.,
Trichosporon veenhuisii
• Związki fenolowe:
Aspergillus japonicus, Penicillium sp.,
Trichosporon (T.) cutaneum, T. guehoae, T. veenhuisii,
Aspergillus fumigatus, Penicillium frequentas
• Inne związki jednowęglowe (np. metanol czy formaldehyd):
Gliocladium deliquescens, paecilomyces variotti, Graphium
spp.

Wykład 6
• Metody i techniki stosowane w badaniach
wykorzystujących drobnoustroje w ochronie
środowiska

Przykłady mikroorganizmów stosowanych w bioaugmentacji gleb
skażonych związkami aromatycznymi
Mikroorganizm
Substancja zanieczyszczająca
Pseudomonas sp. ADP
Atrazyna
Agrobacterium radiobacter J14a
Atrazyna
Escherichia coli eAtzA
Atrazyna
Alcaligenes eutrophus TCP
2,4,6-trichlorofenol
Desulfitobacterium frappieri PCP-1
Pentachlorofenol
Ralstonia eutropha JMP134
Kwas 2,4-dichlorofenoksyoctowy
Pseudomonas sp. P51
1,2,4-trichlorobenzen
Pseudomonas pseudoalcaligenes POB310
Kwas 3-fenoksybenzoesowy
Desulfomonile tiedjei
3-chlorobenzoesan
Arthrobacter sp. B1B
Polichlorowane bifenyle
Ralstonia basilensis RK1
2,6-dichlorofenol
Wyszukiwarka
Podobne podstrony:
OCHRONA ŚRODOWISKA-wykłady do egzaminu, inżynieria ochrony środowiska kalisz, Rok 1 IOS, Ochrona ś
OCHRONA SRODOWISKA-wyklady do egzaminusciaga cała sciaga, Pwsz Kalisz
Ochrona Srodowiska wyklady do egzaminu
OCHRONA ŚRODOWISKA-wykłady do egzaminu sciaga, inżynieria ochrony środowiska kalisz, Rok 1 IOS, Oc
PON materiały uzupełniajace do egzaminu
materiały pomocnicze do egzaminu z rynku kapitałowego 4IPMRFN64Z4YSLYX3Z5PMXWFHYJWRHJ6LZFJ5TY
materialy pomocnicze do egzaminu z psychologii
Zakres materialu obowiazujacego do egzaminu ze Wstepu do Matematyki, Matematyka stosowana, Logika
szkolyikierunki, Kierunki psych. klin. materiały uzupełniajace do egzaminu
Materiałoznawstwo – zagadnienia do egzaminu 2011, Stomatologia UMED, Materiałoznawstwo, egzamin 2011
Chemia Materiałów Notatki do egzaminu
BO materiały pomocnicze do egzaminu198
PON-materiały uzupełniajace do egzaminu, ►PSYCHOLOGIA OSÓB NIEPEŁNOSPRAWNYCH ═══════════════
KARTA EGZAMINACYJNA aktual, Materiały na podoficerke, MATERIAŁY - przygotowanie do egzaminów do SP
Teoria pomocy spolecznej WYKLADY do egzaminu
Zakres materiału obowiązującego do egzaminu z patofizjologii
więcej podobnych podstron