
Ogłoszenia:
e-portal
W.2
Podstawy chemii fizycznej
(biotechnologia)
prof. Ludwik Komorowski
pok. 315 A-3. wt., czw. 14-16

Energia wewnętrzna U(T,V)
I Zasada termodynamiki
∆U =W + Q
dU = W
el
+ Q
el
V
≠ const
W
≠ 0
Q
≠ 0
Q+W = const
W + Q =
∆U
U - funkcja stanu
U(T,V)
Jednoznacznie
określona
Doświadczenie
Joule’a
Gaz doskonały
nie zmienia
temperatury
Q=0, W=0
czyli dU=0
dV
V
U
dT
T
U
dU
T
V
∂
∂
+
∂
∂
=
0
=
∂
∂
T
V
U
∫
∫
∫
−
=
−
=
−
=
−
=
2
1
2
1
2
1
1
2
kw
ln
V
V
V
V
w
V
V
V
V
nRT
dV
V
nRT
dV
p
pdV
W
V
p
pdV
W
V
V
∆
−
=
−
=
∫
2
1
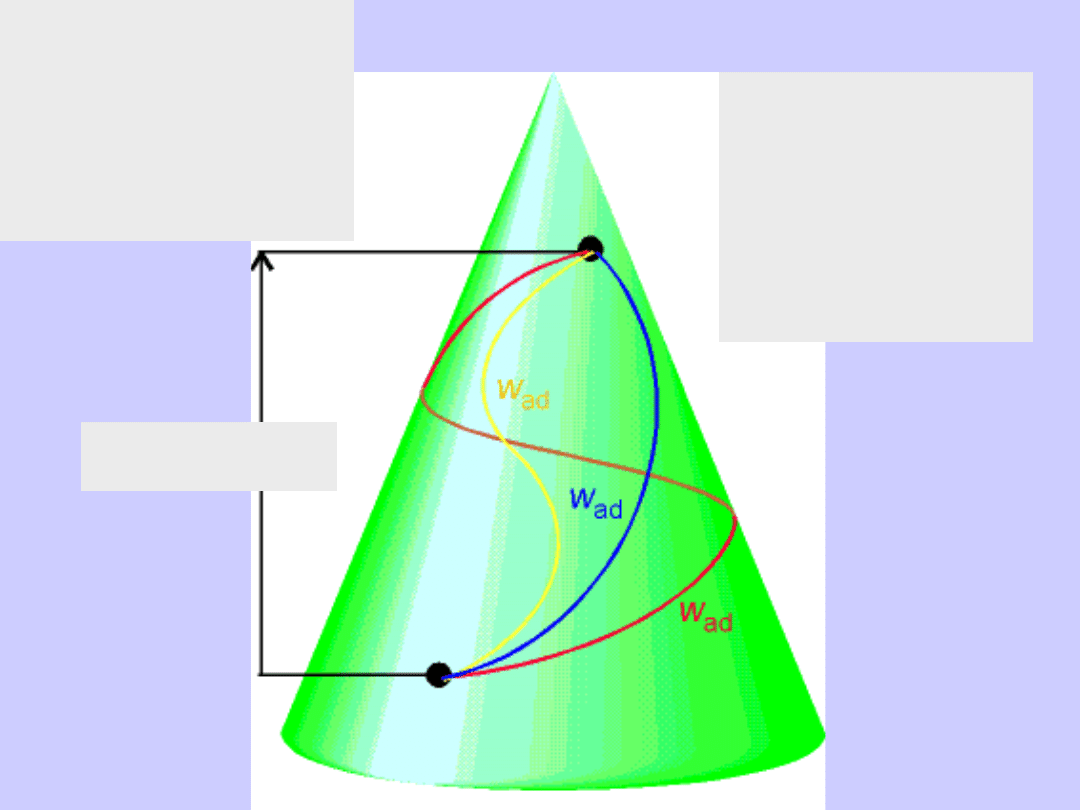
Izoterma T=const.

Adiabata odwracalna
czyli kwazystatyczna (Poissona)
gaz doskonały
Q = 0, dU = W
el
2
2
1
1
2
2
1
1
(
1)
(
1)
2
2
1 1
za
ł:
ln
ln
gdzie
1
V
el
T
V
V
V
T
V
V
V
nRT
dU
C dT
dV
W
V
nRT
C dT
dV
C
const
V
T
V
C
nR
T
V
nR
T V
TV
C
κ
κ
κ
−
−
=
= −
=
= −
=
= −
=
− =
∫
∫

Adiabata odwracalna
cd
2
1
1
2
2
1
1
1
2
1
1
Praca
(
)
1
V
V
V
W
C
T
C T
T
V
T
T
V
V
W
C T
V
κ
κ
−
−
=
∆ =
−
=
=
−
V
V
V
V
R
C
nR
C
κ
+
+
=
=
C
C
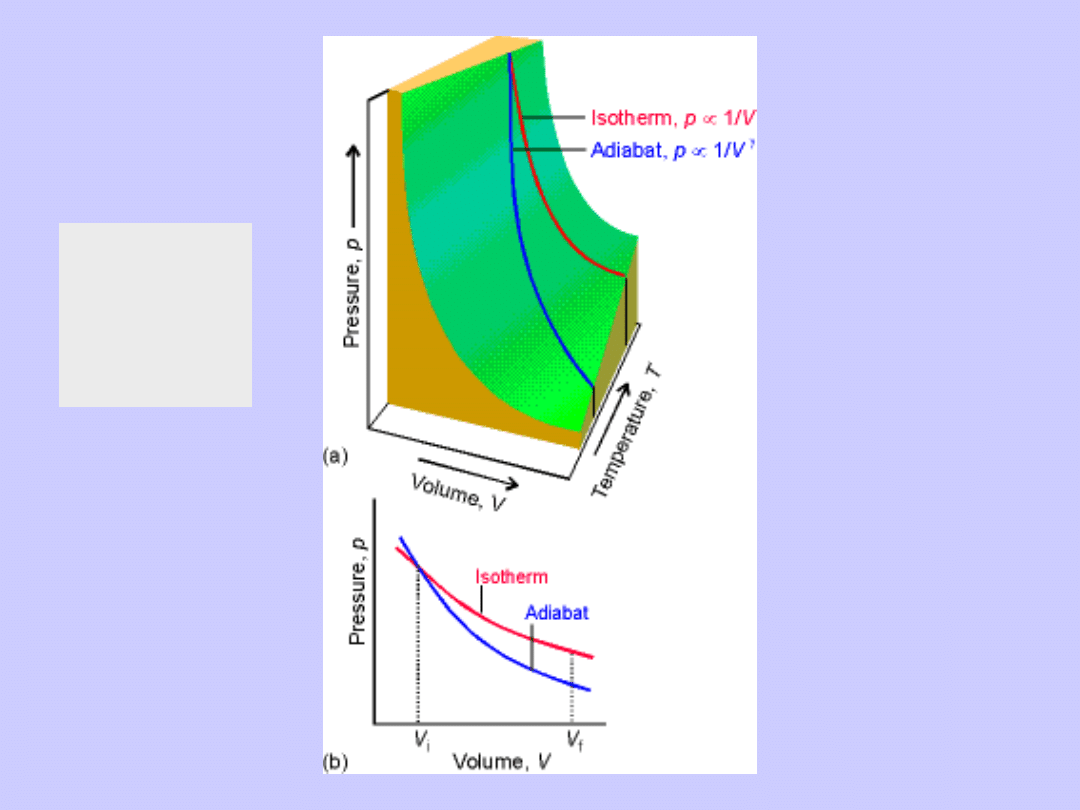
Izoterma
i
adiabata

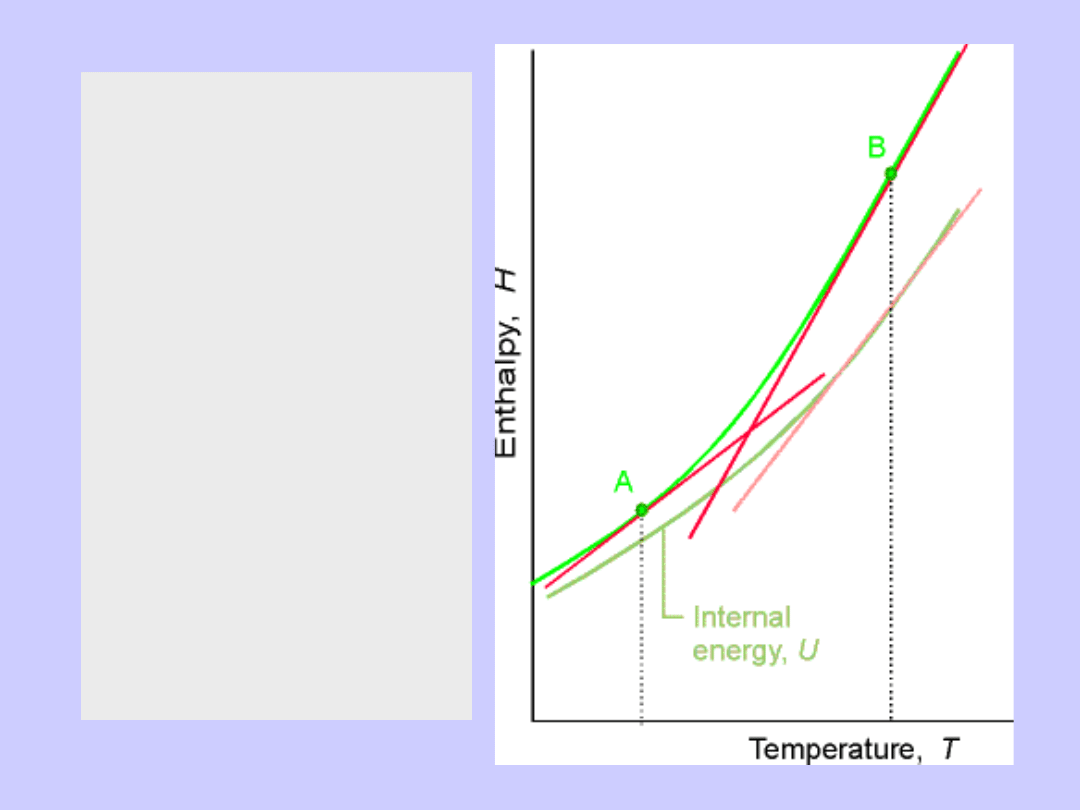
Entalpia H
∆U = Q + W = Q – p ∆V
Ponieważ
∆U=Q gdy V=const
Czy istnieje funkcja H, taka że
∆H=Q gdy p=const
???
∆H=Q= ∆U+p ∆V= ∆(U+pV)
Wniosek:
H=U+pV
Zatem:
dH=dU+pdV+Vdp=Q
el
+Vdp

Pojemność cieplna
w stałej objętości
V
V
C
=
∂
∂
=
∆
=
T
U
Q
U
const
V
G dy
V
Pojemność cieplna
pod stałym ciśnieniem
p
p
p
p
C
=
∂
∂
=
∂
∂
=
∆
=
T
Q
T
H
Q
H
const.
p
Gdy
pV=nRT
H-U=pV=nRT>0
Gdy T rośnie
H-
U także rośnie
Skąd wniosek
C
p
>C
V
>0
H(T)
U(T)

(
)
p
V
p
V
p
V
H
U
pV
dH
dU
d(pV)
C dT
C dT d nRT
C dT
C dT nRdT
C
C
nR
= +
=
+
=
+
=
+
=
+
Gaz doskonały
p
V
V
V
R
κ
+
=
=
C
C
C
C

Po podstawieniu
Poniewa
ż
0, zatem
0
p
T
V
T
T
T
dH
dU
d(pV)
dU
nRdT
H
dH
C dT dp
p
U
dU
C dT dV
V
U
H
V
p
=
+
=
+
∂
=
+
∂
∂
=
+
∂
∂
∂
=
=
∂
∂
Własności entalpii

Zasada ekwipartycji energii
3
2
RT
U =
Molowa średnia energia wewnętrzna (kinetyczna)
gazu doskonałego
3
2
V
V
R
T
∂
=
∂
U
C
=

Gaz doskonały ale realny
,
,
V
p
V
p
p
V
C C
R
=
+
C C
C
C
Pojemności cieplne
Molowe pojemności cieplne
Gaz atomowy
Gaz molekularny,
cząsteczki liniowe
Gaz molekularny,
cząsteczki dowolne
3
2
5
2
6
2
V
V
V
R
R
R
=
=
=
C
C
C
Ruchy
oscylacyjne
zaniedbujemy
w niskich
temperaturach

Empiryczna pojemność cieplna
jako funkcja temperatury
dla dowolnej substancji
,
2
2
( )
p i
o
i
i
i
i
T
a
b T
c T
d T
−
= +
+
+
C
a
i
, b
i
, c
i
, d
i
,
Współczynniki znajdowane
doświadczalnie
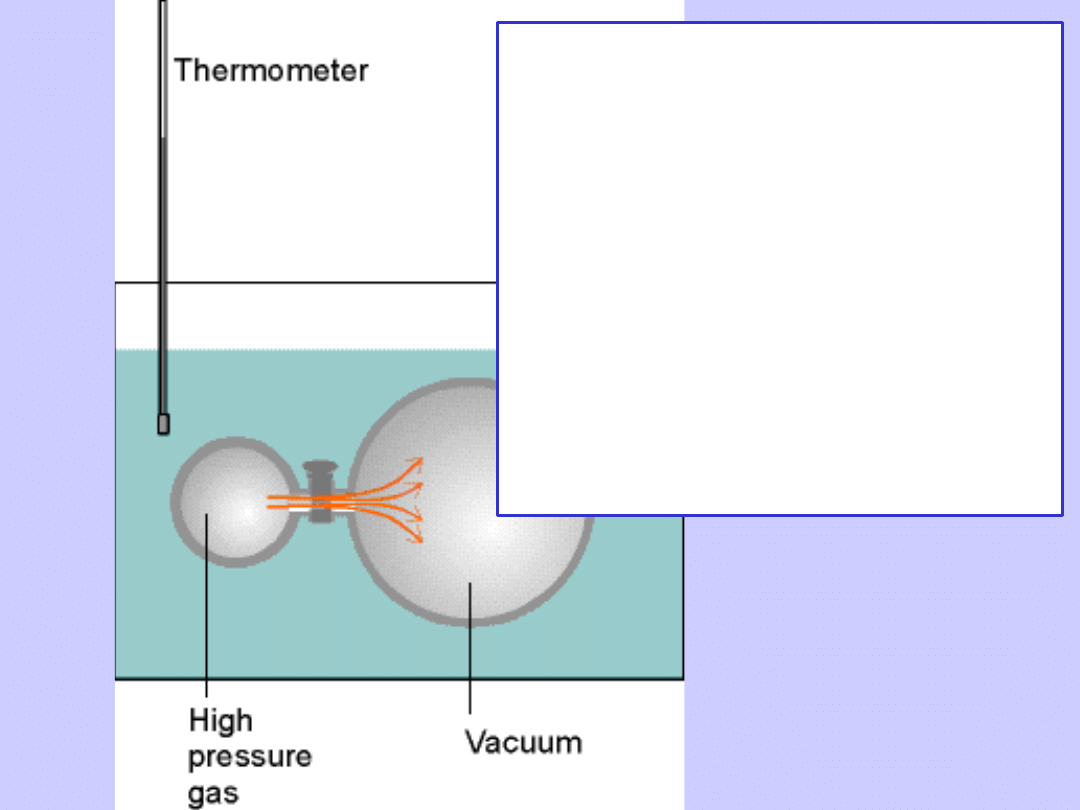
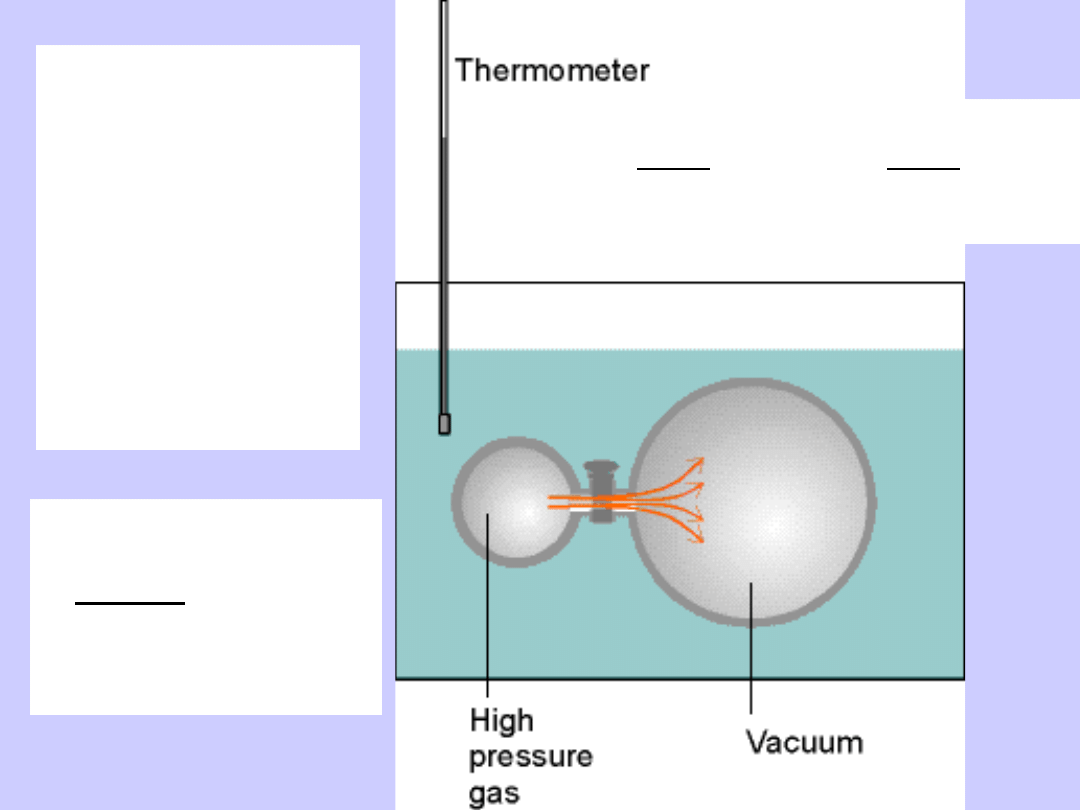
Doświadczenie Joule’a dla gazów
rzeczywistych
•
Rozprężanie do próżni (W=0)
•
Zmiana temperatury kąpieli ∆T<0
•
Ciepło pobrane z kąpieli
Q=C
V
∆T<0
•
Zmiana energii wewnętrznej gazu
∆U=-Q>0
• Wniosek:
∆U/∆V>0
•
Na co zużyta została energia ?
0
0
V
T
V
T
T
J
U
V
U
U
dU
dT
dV
T
V
U
dU
C dT
dV
V
U
T
V
V
C
µ
∂
∂
=
+
∂
∂
∂
=
+
=
∂
∂
∂
∂
=
= −
<
∂
0
V
J
T
U
C
V
µ
∂
=−
>
∂
Gaz rzeczywisty
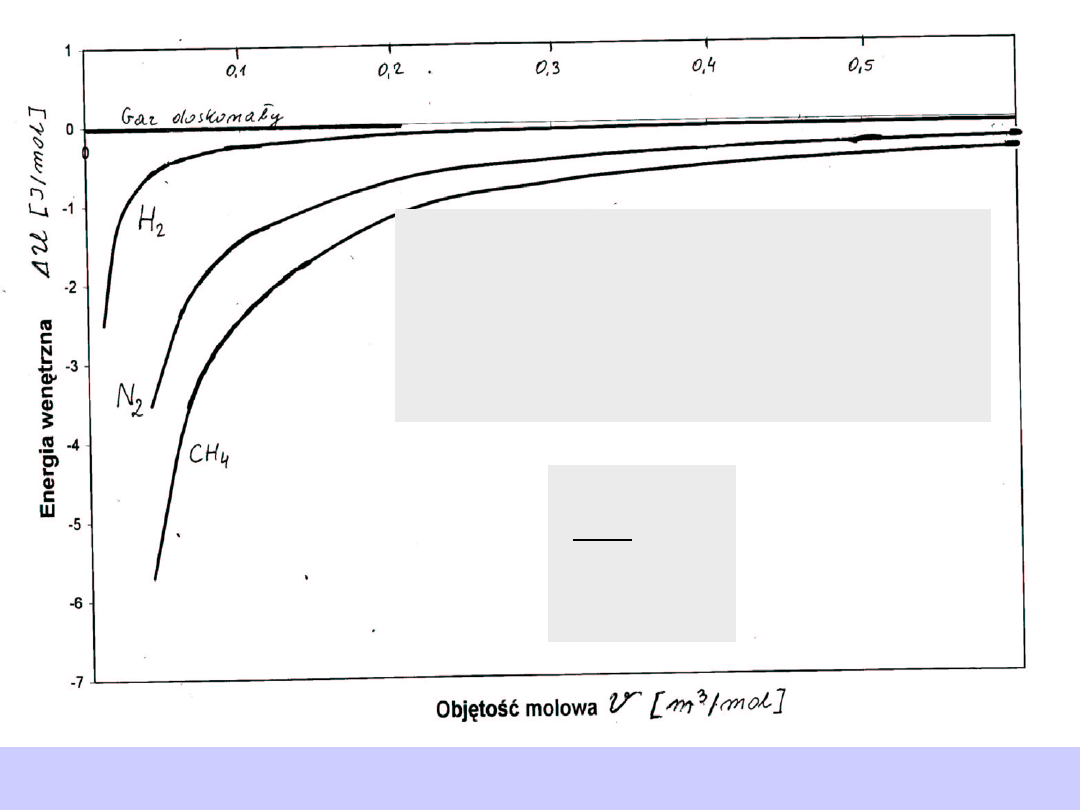
Doświadczenie Joule’a dla
gazów rzeczywistych
WNIOSKI
0
T
U
V
∂
>
∂
2
2
.
2
(
)
0
0
0
J
V
g dosk
T
B
a
p
b
RT
a
C
a
U
U
V
U
a
a
V
V
a
T
Rb
µ
+
− =
= −
<
=
−
∂
= + >
>
∂
=
V
V
V
Gaz van der
Waalsa
b
= objętość własna
a/V
= miara oddziaływań
przyciągających
Współczynnik Joule’a otrzymany
przez różniczkowanie
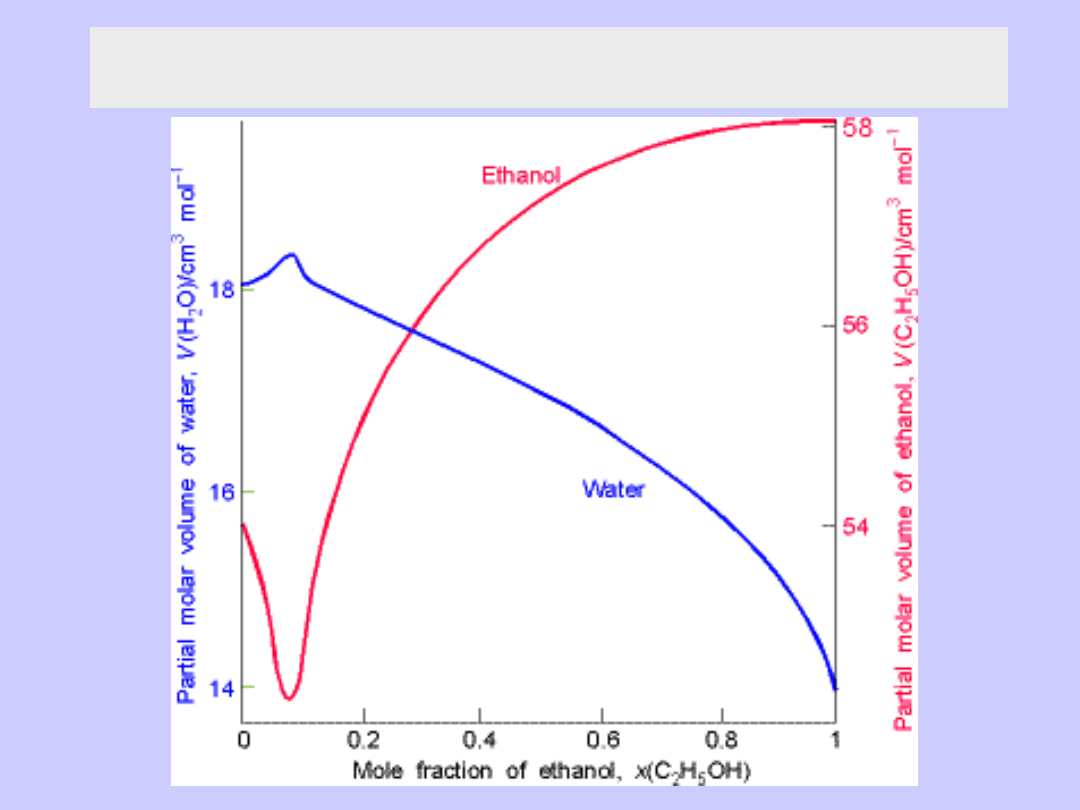
Wielkości cząstkowe molowe
czyli
„parcjalne”
w mieszaninach
Objętość mieszaniny (roztworu) V
V
≠ n
A
V
A
+ n
B
V
B
Załóżmy jednak że V = n
A
V
A
+n
B
V
B
Czyli w roztworze V
A
≠ V
A
oraz V
B
≠ V
B
V (
n
A
,n
B
) znane z doświadczenia !!!
V
A
≡ (∂V/∂n
A
)
T,p
Cząstkowa molowa objętość w roztworze
Cząstkowe objętości molowe
Cząstkowa, molowa
pojemność cieplna
w stałej objętości
,
,
,
,
T
T
j
j
j
V
V i
V
i
i
T n
T n
i
V
i
T n
V
C
U
n
n
U
T
n
∂
∂
∂
=
=
=
∂
∂
∂
∂
∂
∂
=
=
∂
∂
∂
U
C
i
i
T
U
n
∂
=
∂
U
Mieszanina gazów

Egzo- i endo-

Liczba postępu
reakcji „
ξ”
2 H
2
+O
2
→ 2 H
2
O
0
2
1
2
2
2
2
>
∆
≡
∆
=
−
∆
=
−
∆
ξ
O
H
O
H
n
n
n
i
i
v
dn
d
=
ξ
ξ
d
v
dn
i
i
=
Współczynniki
stechiometryczne
ν
i

Obliczanie pracy i ciepła w przemianach gazowych
Liczba moli substancji jest stała.
V
T
U
U
dU
dT
dV
T
V
∂
∂
=
+
∂
∂
( , )
U V T
el
U
Q W
dU
Q
pdV
∆ = +
=
−
0
V
T
V
U
U
C
V
T
∂
∂
=
=
∂
∂

Obliczanie pracy i ciepła w przemianach gazowych
Liczba moli substancji jest stała.
( , )
H p T
0
p
p
T
H
H
C
p
T
∂
∂
=
=
∂
∂
p
T
H
H
dH
dT
dp
T
p
∂
∂
=
+
∂
∂
(
)
el
H
Q W
pV
dH
Q
Vdp
∆ = +
− ∆
=
+

,
,
,
,
.;
.
p
p T
T
r
p T
H
H
H
dH
d
dT
dp
T
p
p
const
T
const
H
dH
d
H d
ξ
ξ
ξ
ξ
ξ
ξ
ξ
∂
∂
∂
=
+
+
∂
∂
∂
=
=
∂
=
= ∆
∂
Entalpia procesu
izotermiczno-izobarycznego
gdy zachodzi reakcja chemiczna

,
,
,
.
,
.
Gaz doskonaly
r
p T
r
V T
r
r
i
gaz
H
T p
const
H
U
T V
const
U
H
U
RT
ξ
ξ
ν
∂
=
∆
=
∂
∂
=
∆
=
∂
∆
= ∆
+
∑
Ciepło reakcji pod stałym ciśnieniem
oraz w stałej objętości
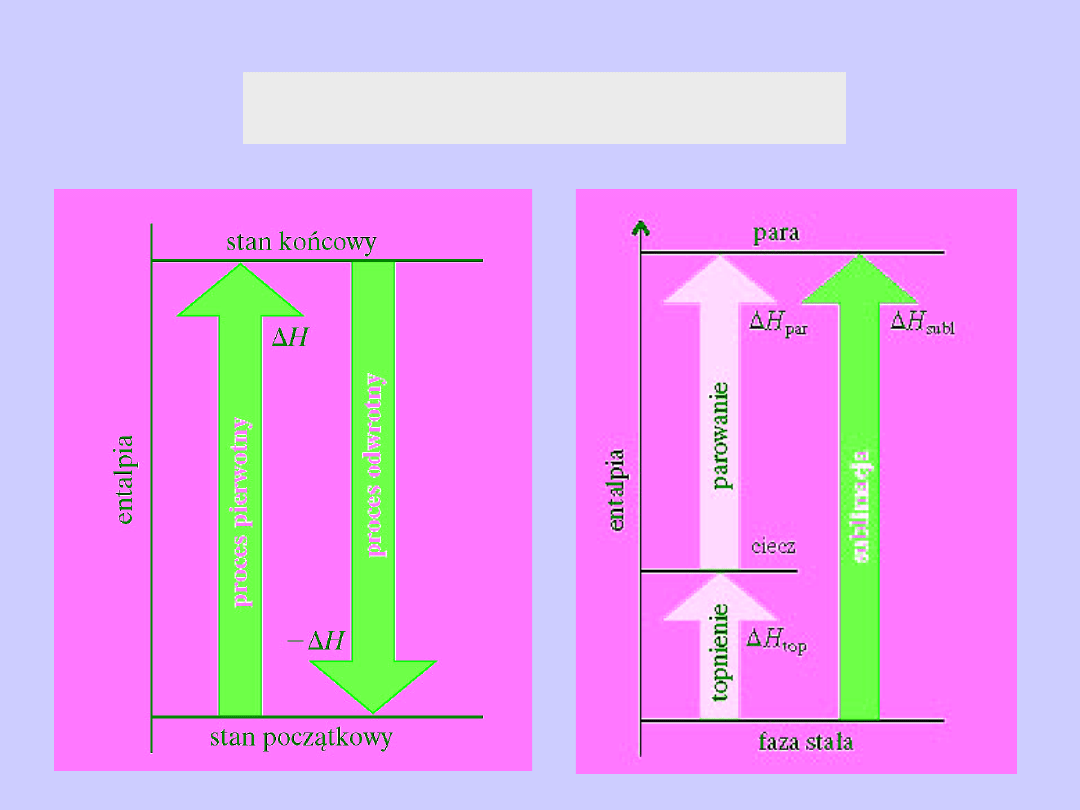
Ciepło procesu
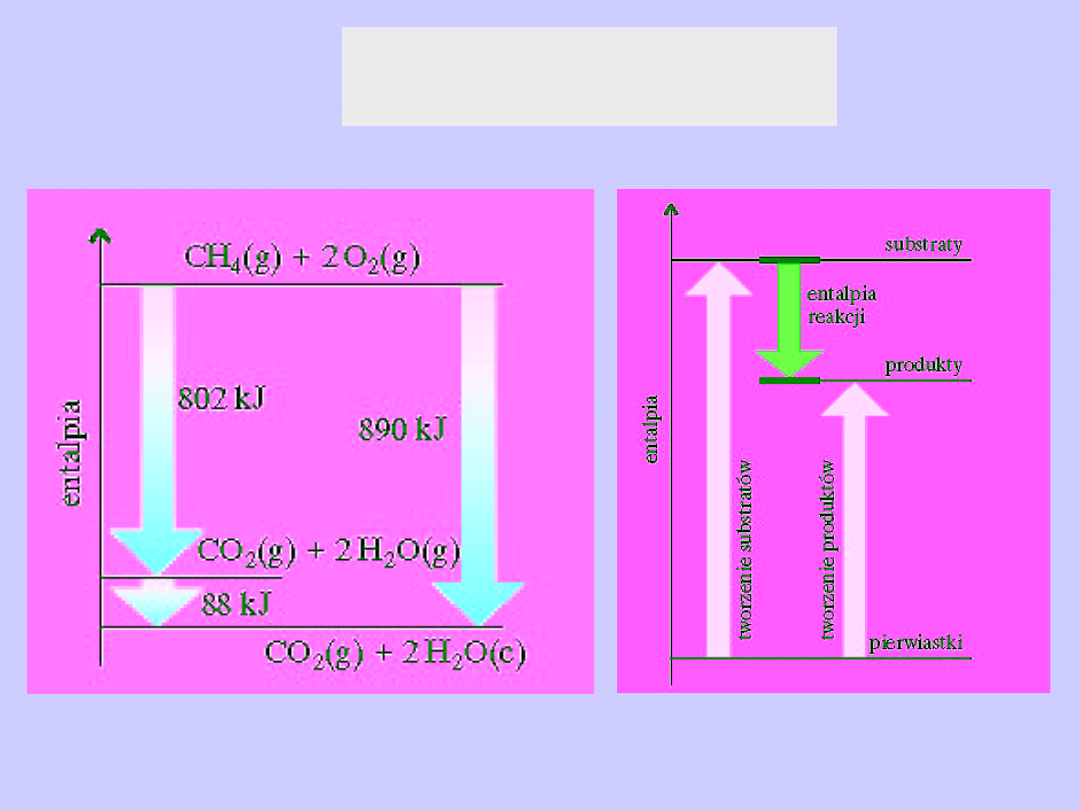
Prawo Hessa

Prawo Hessa -zastosowanie
∆H
tw
–
ciepło tworzenia
∆H
sp
–
ciepło spalania
0
doskonaly
Gaz
=
∂
∂
∂
∂
=
∂
∂
∂
∂
=
∂
∆
∂
T
T
T
r
p
H
H
p
p
H
ξ
ξ
,
,
,
,
p
r
p
p
p
p
p
i
p i
i
p
i
p i
o
o
i
r
p i
p i
i
i
i
i
p
p
p
p
C
H
H
H
T
T
T
C
n
C
n
n
H
T
ξ
ξ
ξ
ν
ξ
ξ
ξ
∂
∂∆
∂ ∂
∂ ∂
=
=
=
∂
∂ ∂
∂ ∂
∂
=
∂
∂
∂
∂∆
=
=
=
∂
∂
∂
∂
≅
∑
∑
∑
∑
C
C
C
C
Zależność od ciśnienia oraz temperatury
cząstkowe molowe (parcjalne)

Prawo Kirchhoffa
,
2
,
1
,
2
1
2
2
( )
( )
( )
( )
( )
p i
p i
p i
o
r
i
i
p
T
o
r
r
i
i
T
o
i
i
i
i
H
T
T
T
T
T
T
a
b T
c T
d T
ν
ν
−
∂∆
=
∂
∆
= ∆
+
= +
+
+
∑
∑ ∫
C
C
C
H
H
Standardowe ciepło reakcji
Czyste, rozdzielone substraty
→czyste, rozdzielone produkty
w warunkach standardowych
∆
H
o
,
∆
U
o
∆
∆
H
U
Document Outline
- Ogłoszenia: e-portal
- Energia wewnętrzna U(T,V) I Zasada termodynamiki
- Slajd numer 3
- Doświadczenie Joule’a Gaz doskonały nie zmienia temperatury Q=0, W=0 czyli dU=0
- Slajd numer 5
- Adiabata odwracalna czyli kwazystatyczna (Poissona) gaz doskonały
- Adiabata odwracalna cd
- Slajd numer 8
- Entalpia H
- Pojemność cieplna w stałej objętości
- Slajd numer 11
- Slajd numer 12
- Slajd numer 13
- Slajd numer 14
- Slajd numer 15
- Slajd numer 16
- Slajd numer 17
- Slajd numer 18
- Slajd numer 19
- Slajd numer 20
- Wielkości cząstkowe molowe czyli „parcjalne” w mieszaninach
- Cząstkowe objętości molowe
- Cząstkowa, molowa pojemność cieplna w stałej objętości
- Egzo- i endo-
- Slajd numer 25
- Obliczanie pracy i ciepła w przemianach gazowych Liczba moli substancji jest stała.
- Obliczanie pracy i ciepła w przemianach gazowych Liczba moli substancji jest stała.
- Slajd numer 28
- Slajd numer 29
- Ciepło procesu
- Prawo Hessa
- Slajd numer 32
- Slajd numer 33
- Slajd numer 34
Wyszukiwarka
Podobne podstrony:
Pchf W2 2
Pchf W2 7
Pchf W2 2
Psycholgia wychowawcza W2
SP dzienni w2
w2 klasy(1)
W2 Chemiczne skladniki komorki
OK W2 System informacyjny i informatyczny
W2 6
Algebra w2
W2 Uproszczone formy rachunkowości
W2 i W3
ulog w2
UC W2
więcej podobnych podstron