j a k t o o d k r y l i
eureka!
N
a prze³omie wieków funkcjonowa³ model niezbyt
wyrafinowany - atom by³ kul¹ ³adunku dodatniego,
w której, dla zachowania elektroobojêtnoœci, tkwi³y
elektrony jak rodzynki w cieœcie, a dok³adniej jak w
puddingu, no bo jesteœmy w Anglii, w Cavendish Labo-
ratory w Cambridge. Autorem tego modelu by³ odkryw-
ca elektronu, J.J. Thomson, od którego model wzi¹³
swoj¹ nazwê. Jego pozorna prostota (nazywano go tak-
¿e plum pudding model) kry³a w sobie wiele naprawdê
wyrafinowanych zagadnieñ, takich jak u³o¿enie w prze-
strzeni wzajemnie siê przyci¹gaj¹cych i odpychaj¹cych
³adunków elektrycznych. J.J. Thomson opublikowa³ w
„Philosophical Magazine” w marcu 1904 roku artyku³,
w którym na prawie trzydziestu stronicach przedstawi³
obliczenia mo¿liwych konfiguracji na³adowanych do-
datnio i ujemnie cz¹stek w objêtoœci zajmowanej przez
atom. Model Thomsona „funkcjonowa³” w œrodowisku
fizyków ok. dziesiêciu lat i zosta³ porzucony (zwyk³y los
modelu w fizyce), za spraw¹ innej wspó³czeœnie odkry-
tej cz¹stki, mianowicie cz¹stki α.
Aby o tym opowiedzieæ, musimy siê cofn¹æ do ro-
ku 1895, gdy do zespo³u J.J. Thomsona w Cavendish
Laboratory do³¹czy³ 24-letni Nowozelandczyk Ernest
Rutherford. Pocz¹tkowo kontynuowa³ swoje wczeœniej-
sze, prowadzone w Nowej Zelandii, badania nad falami
Hertza, ale w grudniu 1985 roku Konrad Roentgen od-
kry³ promienie nazwane jego imieniem i Thomson za-
proponowa³ Ernestowi udzia³ w badaniach nad oddzia-
³ywaniem tych promieni na rozrzedzony gaz. Badania
w³aœciwoœci zjonizowanego promieniami rentgenowski-
mi gazu, a tak¿e zjawiska
rekombinacji
jonów ca³kowi-
cie poch³onê³y m³odego badacza, ale nie na d³ugo.
F
Fiin
n
d
dee ssiiééccllee
dziewiêtnastego wieku by³ rzeczywiœcie nie-
zwyk³y, bo w rok póŸniej Henri Becquerel, we Francji,
odkry³, ¿e nie tylko promienie rentgenowskie zaczernia-
j¹ kliszê fotograficzn¹, ale robi¹ to tak¿e takie pierwiast-
ki jak uran. Rutherford natychmiast zaj¹³ siê tym proble-
mem i wykorzystuj¹c swoje doœwiadczenie wyniesione
z badañ nad jonizacj¹ gazów, wykaza³, ¿e zjawisko ob-
serwowane przez Becquerela wywo³ywane jest przez
dwa rodzaje nieznanego dotychczas promieniowania,
które nazwa³ promieniowaniem α i promieniowaniem β.
Jak siê wkrótce przekonano, promieniowanie α by³o
strumieniem ca³kowicie zjonizowanych atomów helu,
nios¹cych ³adunek dodatni +2e, a promieniowanie β
by³o po prostu strumieniem elektronów.
Trzy lata od przyjazdu do Wielkiej Brytanii Er-
nest Rutherford by³ postaci¹ znacz¹c¹ w œrodowisku
naukowym i otrzyma³ propozycje objêcia Katedry Fizyki
na Uniwersytecie McGill w Montrealu, gdzie podj¹³ wy-
k³ady w 1898 roku. Jego zainteresowania naukowe w
dalszym ci¹gu pozostawa³y w obszarze badañ w³aœci-
woœci nowo odkrytych cz¹stek α. Rutherford zaobser-
wowa³, ¿e po-
stawienie
p³ytki przezro-
czystej miki
na drodze
tych cz¹stek
powoduje roz-
mycie dotych-
czas ostrego
obrazu
koli-
matora
na kli-
szy fotogra-
ficznej, co
wskazywa³o
na fakt rozpra-
szania cz¹stek
na przeszko-
dzie. By³a to
obserwacja
zaskakuj¹ca
o tyle, ¿e dla
M
Ł
ODY
TECHNIK
2/2005
Odkrycie elektronu (1897) było ostatnim wiel-
kim odkryciem naukowym zamykającym wiek
dziewiętnasty. Konsekwencją tego odkrycia
była próba zbudowania modelu atomu
uwzględniającego właściwości tej nowej
cząstki. Trzeba było jeszcze odkryć jądro ato-
mowe. Dokonał tego Ernest Rutherford.
ERNEST RUTHERFORD –
ODKRYCIE JĄDRA ATOMOWEGO
Z d z i s ł a w L i b r a n t
4
49
9
1
„ J e ś l i w i d z i a ł e m d a l e j n i ż i n n i ,
t o d l a t e g o , ż e s t a ł e m n a r a m i o n a c h
g i g a n t ó w ”
I s a a c N e w t o n
TEKST TRUDNY
!!!
cz¹stek poruszaj¹cych siê z prêdkoœci¹ ok. 20000 km/s,
nawet dla niewielkiego odchylenia ich toru na obser-
wowanych d³ugoœciach, potrzebne by³oby pole elek-
tryczne o niewyobra¿alnym w ówczesnym laborato-
rium natê¿eniu 100 MV/cm.
Rutherford wróci³ do tego problemu po powrocie
z Kanady w roku 1907 i objêciu Katedry Fizyki na uni-
wersytecie w Manchesterze. W tym czasie, w kierowa-
nym przez niego laboratorium, dwóch m³odych ludzi:
œwie¿o przyby³y z Niemiec Hans Geiger (tak, tak, ten
od licznika Geigera-Müllera) i dwudziestoletni student
Ernest Marsden, zajmowa³o siê bombardowaniem
cz¹stkami α folii metalicznych. Ich doœwiadczenia wy-
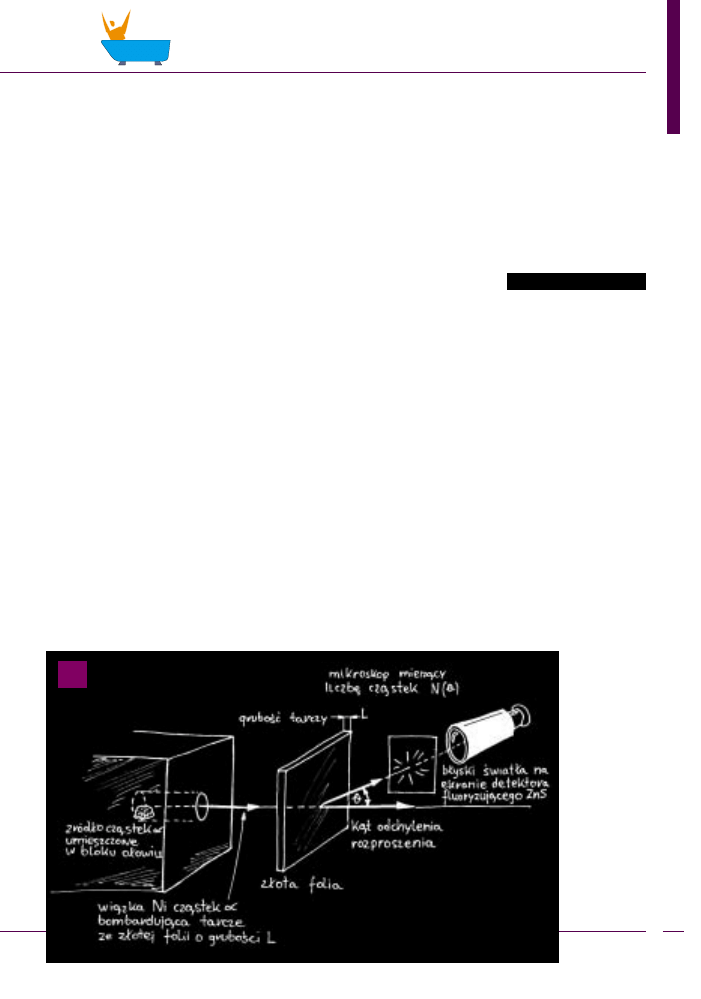
konane na niezwykle prostej aparaturze (
) polega³y
na pomiarach rozk³adu k¹towego cz¹stek α przecho-
dz¹cych przez bombardowan¹ cz¹stkami tarczê ze z³o-
tej folii. Rutherford zasugerowa³ Geigerowi i Marsdeno-
wi ustawienie detektora (ekran z siarczku cynku) pod
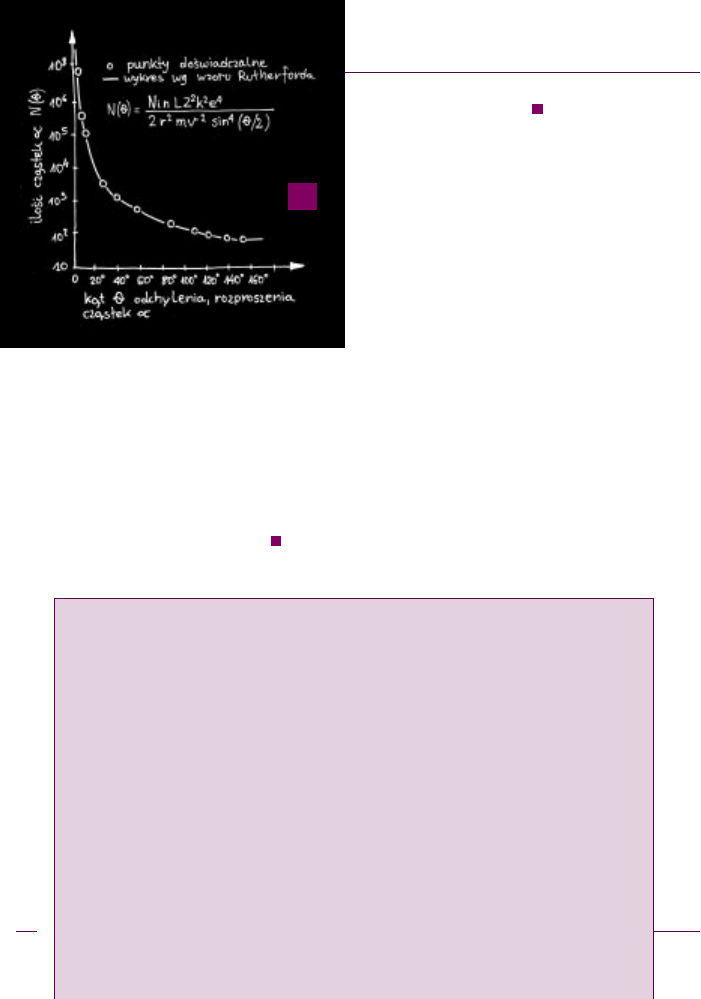
k¹tami powy¿ej 90°. Uzyskany w tych warunkach histo-
ryczny wykres przedstawia rys.
.
Pojawienie siê cz¹steczek rozproszonych pod k¹-
tami wiêkszymi od 90° by³o ca³kowitym zaskoczeniem.
W kategoriach modelu Thomsona, przy znajomoœci ma-
sy atomowej i liczby Avogadra, promieñ atomu w z³otej
folii wynosi³ 0,179 nm i dla tej odleg³oœci si³a Coulomba
F = 2kZe
2
/(1,79 ·10
–10
)
2
(znaczenia u¿ytych symboli w dalszym ci¹gu tekstu)
mia³a zbyt ma³¹ wartoœæ, aby odchyliæ cz¹stkê α pod
du¿ym k¹tem. Na cz¹stkê α, znajduj¹c¹ siê na ze-
wn¹trz atomu, oddzia³ywa³ si³¹ Coulomba ca³y atom.
W chwili kiedy cz¹stka wchodzi³a w obszar atomu,
a wiêc równomiernie roz³o¿onego w przestrzeni ³adun-
ku dodatniego, odpychaj¹ce dzia³anie na cz¹stkê jego
poszczególnych fragmentów znosi³o siê. Tak wiêc wyli-
czenia k¹ta odchylenia wg modelu Thomsona, dla
cz¹stki α, która przy energii 4,87 MeV (Ÿród³o
226
Ra)
mia³a prêdkoœæ 1,5 ·10
7
m/s dawa³y wartoœæ poni¿ej
0,02°, st¹d ca³kowite zaskoczenie eksperymentatorów.
Zapamiêtano s³owa Rutherforda, które nawet
w swobodnym przek³adzie brzmi¹ bardzo dramatycz-
nie „... to by³o najbardziej niewiarygodne zdarzenie
w moim ¿yciu. To by³o tak nieprawdopodobne, jakbyœ
wystrzeli³ 15-calowy pocisk do papierowej serwetki,
a on odbi³ siê od niej i waln¹³ w ciebie”. W tej sytuacji
model Thomsona mo¿na by³o spokojnie schowaæ do la-
musa. Pojawienie siê cz¹stek o k¹cie rozproszenia
wiêkszym od 90° œwiadczy³o o tym, ¿e cz¹stka α musi
zbli¿aæ siê do geometrycznego œrodka atomu na nies³y-
chanie ma³¹ odleg³oœæ, tak aby si³a oddzia³ywania elek-
trostatycznego (si³a Coulomba) by³a zdolna do odrzuce-
nia jej wstecz.
W szkolnym rozumowaniu za³ó¿my, ¿e wektor
prêdkoœci cz¹stki α i œrodek atomu le¿¹ na tej samej
osi. Przy dzia³aniu si³ odpychania, pêdz¹ca z prêdko-
œci¹ v cz¹stka zbli¿y siê do œrodka atomu, czyli œrodka
2
1
M
Ł
ODY
TECHNIK
2/2005
5
50
0
2
Ernest Rutherford urodził się 30 sierpnia 1871 roku
w Spring Grove w Nowej Zelandii jako czwarte z dwunastu
dzieci kołodzieja Jamesa i Marty Rutherfordów. Ojciec miał
swój warsztat w Brightwater koło Nelson. Rodzice, ubodzy
emigranci z Wielkiej Brytanii, odmawiali sobie wielu rzeczy,
aby dzieci mogły się uczyć w dobrych szkołach. Ernest był
bardzo dobrym uczniem i podobno świetnym piłkarzem.
Zdobywał wszystkie możliwe stypendia, które pozwoliły mu
ukończyć studia w zakresie matematyki i fizyki w Canterbu-
ry College w Christchurch. W roku 1893 uzyskał tam sto-
pień magistra M.A. z pierwszą lokatą i podjął pracę badaw-
czą nad właściwościami żelaza w zmiennym polu magne-
tycznym, a także nad odkrytymi właśnie falami Hertza.
Opublikowane prace pomogły mu uzyskać stypendium na
dalszą pracę badawczą w Wielkiej Brytanii, do której przy-
był w roku 1895. Podjął pracę w Laboratorium Cavendisha
na uniwersytecie w Cambridge pod kierunkiem J.J. Thom-
sona, który właśnie prowadził badania prowadzące do od-
krycia elektronu. Współpraca z J.J.Thomsonem nad joniza-
cją gazów za pomocą promieni rentgenowskich była bar-
dzo owocna i Rutherford po trzech latach pracy w Cam-
bridge dostał propozycję objęcia Katedry Fizyki na Uniwer-
sytecie McGill w Montrealu. W roku 1900 wrócił do swej oj-
czyzny, aby ożenić się z panną Mary Newton, z którą był
zaręczony jeszcze przed opuszczeniem Nowej Zelandii.
W ciągu siedmiu lat pobytu w Montrealu opublikował 80
prac (sic!), które dały mu taką pozycję w świecie nauko-
wym, że wiele uniwersytetów zaczęło się ubiegać o zatrud-
nienie go u siebie. Royal Society powołało go na swojego
członka w roku 1903. Do Wielkiej Brytanii wrócił w roku
1907 i objął Katedrę Fizyki na uniwersytecie w Mancheste-
rze. W roku następnym otrzymał Nagrodę Nobla z chemii
za prace nad rozpadem promieniotwórczym pierwiastków.
W roku 1911 badaniami nad rozpraszaniem cząstek α na
foliach metalicznych wykazał, że cała masa i ładunek do-
datni skoncentrowane są w jądrze ponad 10 tysięcy mniej-
szym od rozmiarów atomu. Badania te pozwoliły zbudować
nowy model atomu, który dwa lata później Niels Bohr do-
prowadził do postaci w zasadzie uznawanej do dnia dzi-
siejszego. Badania prowadzone przez Ernesta Rutherforda
odbijały się szerokim echem w świecie naukowym i były
wzorem do naśladowania i rozwoju przez wielu fizyków na
świecie. W roku 1914 otrzymał tytuł szlachecki, a pięć lat
później został następcą J.J.Thomsona w Cavendish Labo-
ratory. W latach 1925-1930 był prezydentem Royal Society.
Warto podkreślić, że w 1925 roku został wybrany człon-
kiem Polskiej Akademii Umiejętności.
Ernest Rutherford był pogodnym, przyjaznym człowiekiem,
cieszącym się dobrym zdrowiem i lubiącym życie domowe,
grę w golfa, ale i ciężką pracę. Był uwielbiany przez
uczniów i szanowany przez wszystkich. Pod koniec życia
został parem, członkiem Izby Lordów. Po krótkiej chorobie
zmarł 19 października 1937 roku w Cambridge i został po-
chowany w Opactwie Westminsterskim.
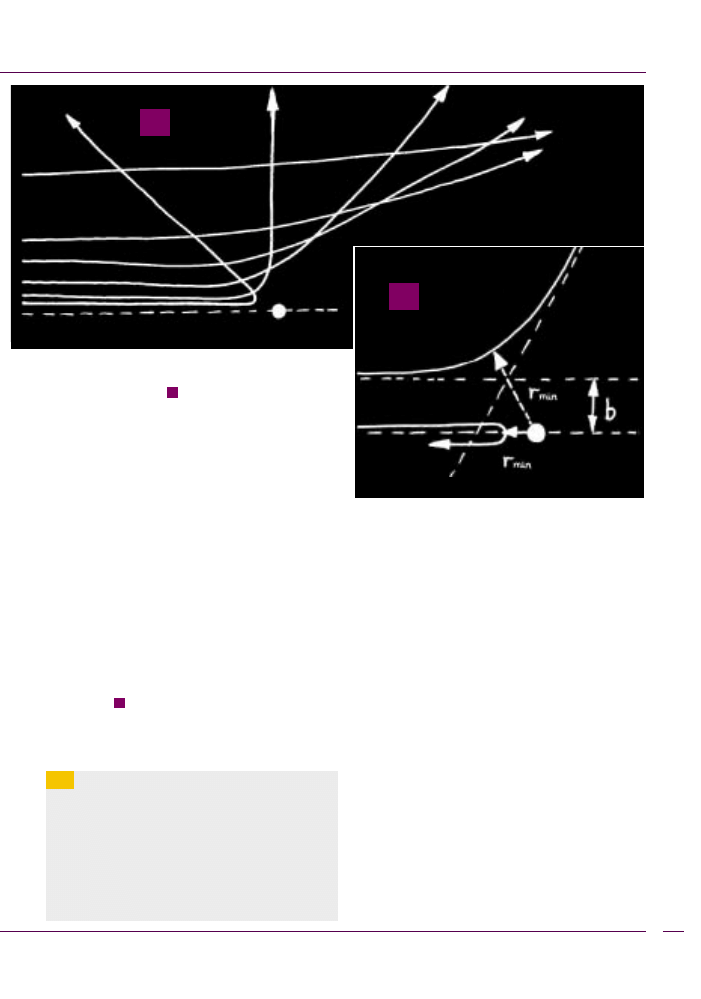
centralnej si³y odpychania, na odleg³oœæ r
min
, przy której
ca³a jej energia kinetyczna zamieni siê w energiê po-
tencjaln¹ odpychania (
). Innymi s³owy, musi byæ
spe³nione równanie:
m
mvv
2
/2 = 2k
kZ
Zee
2
/rr
m
miin
n
,
gdzie m
m jest mas¹ cz¹stki α,
k
k = 1/4πε
0
jest sta³¹ proporcjonalnoœci w prawie Cou-
lomba,
ε
0
jest przenikalnoœci¹ dielektryczn¹ pró¿ni,
Z
Z liczb¹ atomow¹ atomu rozpraszaj¹cego, czyli liczb¹
atomow¹ materia³u, z którego zrobiona jest folia,
ee jest ³adunkiem elementarnym.
WartoϾ r
min
z powy¿szego równania mo¿na by³o
wyznaczyæ, poniewa¿ wszystkie inne parametry by³y
znane. Wyliczona dla atomów z³ota, srebra i miedzi,
wartoϾ r
min
wynosi³a w przybli¿eniu 10 ·10
–15
m, czyli 10
femtometrów (wielkoœæ 1·10
–15
m zosta³a póŸniej nazwa-
na 1 fermi na czeœæ jednego z ojców fizyki j¹drowej En-
rico Fermiego). Ernest Rutherford przeprowadzi³ precy-
zyjn¹ analizê eksperymentu Geigera i Marsdena i wyli-
czy³ wzór na rozk³ad k¹towy cz¹stek α rozproszonych
na foliach metalicznych, tzn. wzór na liczbê cz¹stek
N(θ) padaj¹cych na jednostkê powierzchni detektora
ustawionego pod k¹tem θ. Wzór ten nale¿a³o tylko na-
nieœæ na wykres z danymi doœwiadczalnymi Geigera
i Marsdena (
) - zgodnoœæ by³a znakomita!
Nie ulega³o ju¿ w¹tpliwoœci, ¿e ca³a masa i ³adu-
nek dodatni atomu mieœci siê w obszarze od 10 do 100
tysiêcy mniejszym od rozmiarów atomu. Obszar ten
nazwano j¹drem i nazwa ta okreœli³a równie¿ nowy
rozdzia³ w fizyce wspó³czesnej - fizykê j¹drow¹ - która
od
6 sierpnia 1945 roku
zmieni³a znacz¹co oblicze
œwiata. Ernest Rutherford z pewnoœci¹ nale¿a³ do oj-
ców za³o¿ycieli tego rozdzia³u.
Wracaj¹c jeszcze do porównania wielkoœci j¹dra
i atomu, wyobraŸmy sobie j¹dro o wielkoœci pomarañczy
(ok. 10 cm). Przy tej wielkoœci j¹dra zewnêtrzna „pow³o-
ka” atomu znajduje siê w odleg³oœci kilku kilometrów.
Atom jest wiêc przeraŸliwie pusty. Jego wymiary pozo-
sta³y w zasadzie niezmienione, ale maleñkie w stosun-
ku do wymiarów ca³oœci i centralnie po³o¿one j¹dro, gro-
madz¹ce ca³¹ masê, jest otoczone „chmurami” ³adunku
ujemnego, którym kilkanaœcie lat póŸniej mechanika
kwantowa nada³a spektakularne kszta³ty. To by³o jed-
nak póŸniej, ale w roku 1911, roku odkrycia j¹dra atomo-
wego, Ernest Rutherford móg³ spokojnie pomyœleæ o no-
wym modelu atomu. Nauce by³ ju¿ od stuleci znany mo-
del ruchu cia³ w polu si³ centralnych, który mo¿emy
umownie nazwaæ modelem Kopernika-Keplera-Newto-
na. To nasz uk³ad planetarny. Byæ mo¿e Rutherford po-
myœla³ o spójnoœci wszechœwiata w mikro- i makroskali
i zaproponowa³ tzw. model planetarny, w którym ujem-
ne elektrony porusza³y siê po orbitach w polu si³ cen-
tralnego ³adunku dodatniego. Ten jak¿e przemawiaj¹cy
do wyobraŸni model atomu nie spe³nia³ jednak wyma-
gañ elektrodynamiki klasycznej, gdzie poruszaj¹cy siê
po orbicie ³adunek elektryczny musi traciæ energiê. De-
fekty tego modelu zosta³y radykalnie poprawione dwa
lata póŸniej, w roku 1913, przez Nielsa Bohra, ale to ju¿
jest przedmiotem innego opowiadania. !
2
3
M
Ł
ODY
TECHNIK
2/2005
5
51
1
C z y w y s t r z e l o n y 1 5 c a l o w y p o c i s k
m o ż e s i ę o d b i ć o d p a p i e r o w e j s e r w e t k i ?
3
LEKSYKON
Rekombinacja
– zanik pary jonów różnoimiennych (dodat-
niego i ujemnego) wskutek ich połączenia. Ten sam termin
używa się również dla określenia zaniku pary elektron –
dziura w półprzewodnikach.
Fin de siécle
(franc.) – koniec wieku.
Kolimator
– przyrząd optyczny do otrzymania równoległej
wiązki promieni.
6 sierpnia 1945 roku
– data zrzucenia bomby atomowej
na Hiroszimę.
4
Wyszukiwarka
Podobne podstrony:
C22 Fizyka jadra atomowego(01 12)
fizyka jadra atomowego
BUDOWA JĄDRA ATOMOWEGO, PROMIENIOTWÓRCZOŚĆ xp
Budowa jądra atomowego(1)
31 Jadra atomowe, skladniki jadra (2)
39 Budowa jądra atomowego Energia jądrowa Reakcje jądrowe Reaktory jądrowe 2
Budowa jadra atomowego, sily ja Nieznany (2)
fizyka atomy, jądra atomowe, promieniowania
39 Budowa jądra atomowego Energia jądrowa Reakcje jądrowe Reaktory jądrowe
podstawy fizyki jadra atomowego
Jądra atomowe, energia atomowa, broń atomowa
Fizyka jądra atomowego 9
W02 Jądra atomowe
SPRAWDZIAN BUDOWA JĄDRA ATOMOWEGO, Publikacje
BUDOWA JĄDRA ATOMOWEGO
Budowa jądra atomowego
więcej podobnych podstron