
Elwira Czerska, 2IM1 aC
POMIAR pH METODĄ POTENCJOMETRYCZNĄ
Cel ćwiczenia:
1. Teoretyczne i praktyczne zapoznanie się z metodą potencjometryczną pomiaru pH.
2. Sporządzenie krzywych miareczkowania mocnego kwasu mocną zasadą i słabego kwasu mocną zasadą.
3. Wyznaczenie punktu równoważnikowego metodą analityczną.
4. Obliczenie wartości pH roztworu w czasie miareczkowania mocnego kwasu mocną zasadą.
Opracowanie wyników:
Na niepewność pomiaru pH miała wpływ przede wszystkim niepewność pomiarowa pehametru, która wynosi:
Na niepewność pomiaru dodanej objętości roztworu NaOH miała wpływ niepewność kalibracji biurety i niepewność
odczytu położenia menisku, przyjmuję więc, że:
T
ABELA
1. W
YNIKI
MIARECZKOWANIA
KWASU
SOLNEGO
PRZY
POMOCY
0.1 M NaOH
V
NaOH
[cm
3
]
pH
0
1,54
5
1,61
10
1,72
15
1,84
20
1,97
25
2,11
30
2,31
35
2,65
36
2,75
37
2,92
37,2
2,96
37,4
3,00
37,6
3,04
37,8
3,09
38,0
3,15
38,2
3,21
38,4
3,29
38,6
3,38
38,8
3,50
39,0
3,75
39,2
4,14
39,4
5,75
39,6
6,98
39,7
7,71
40,0
8,96
40,5
10,93
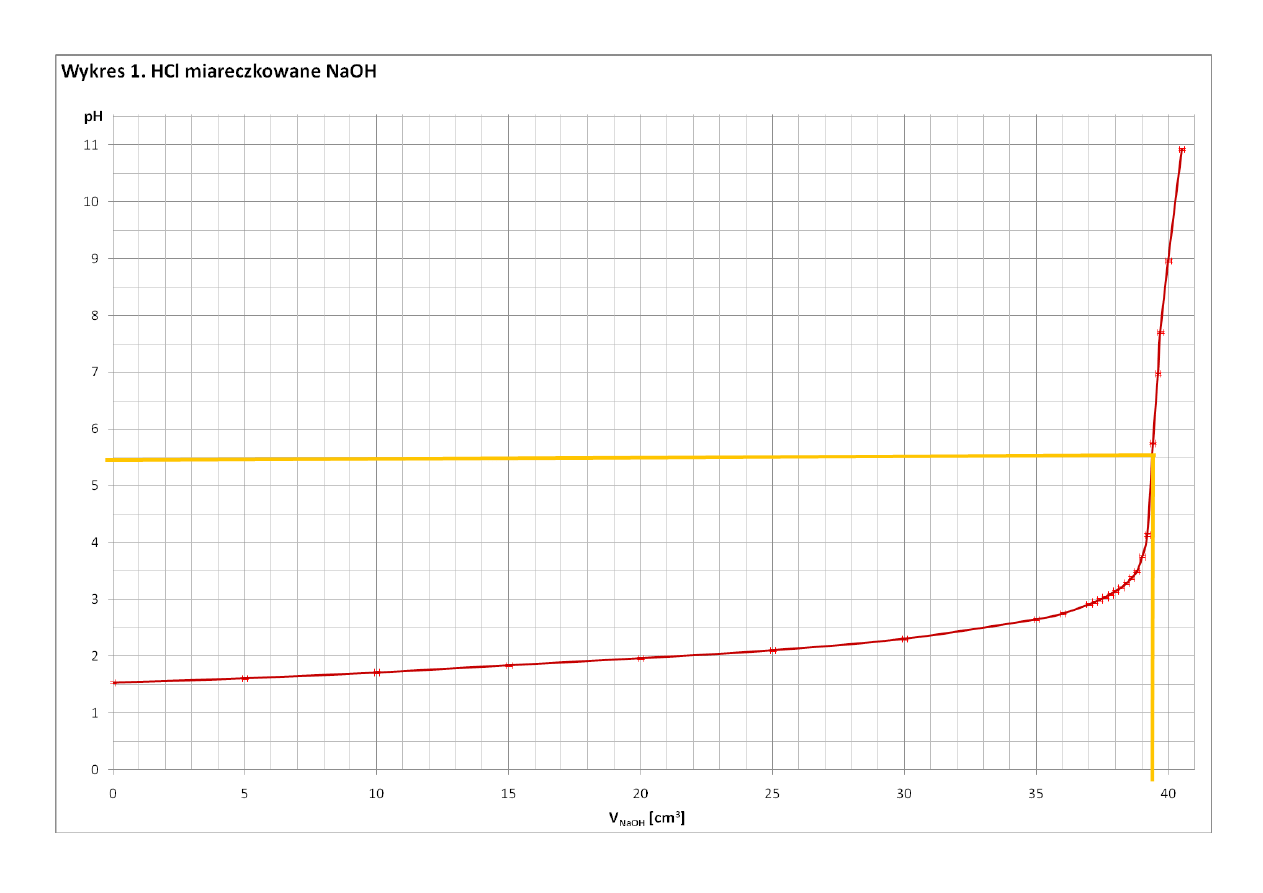
39,4
5,75
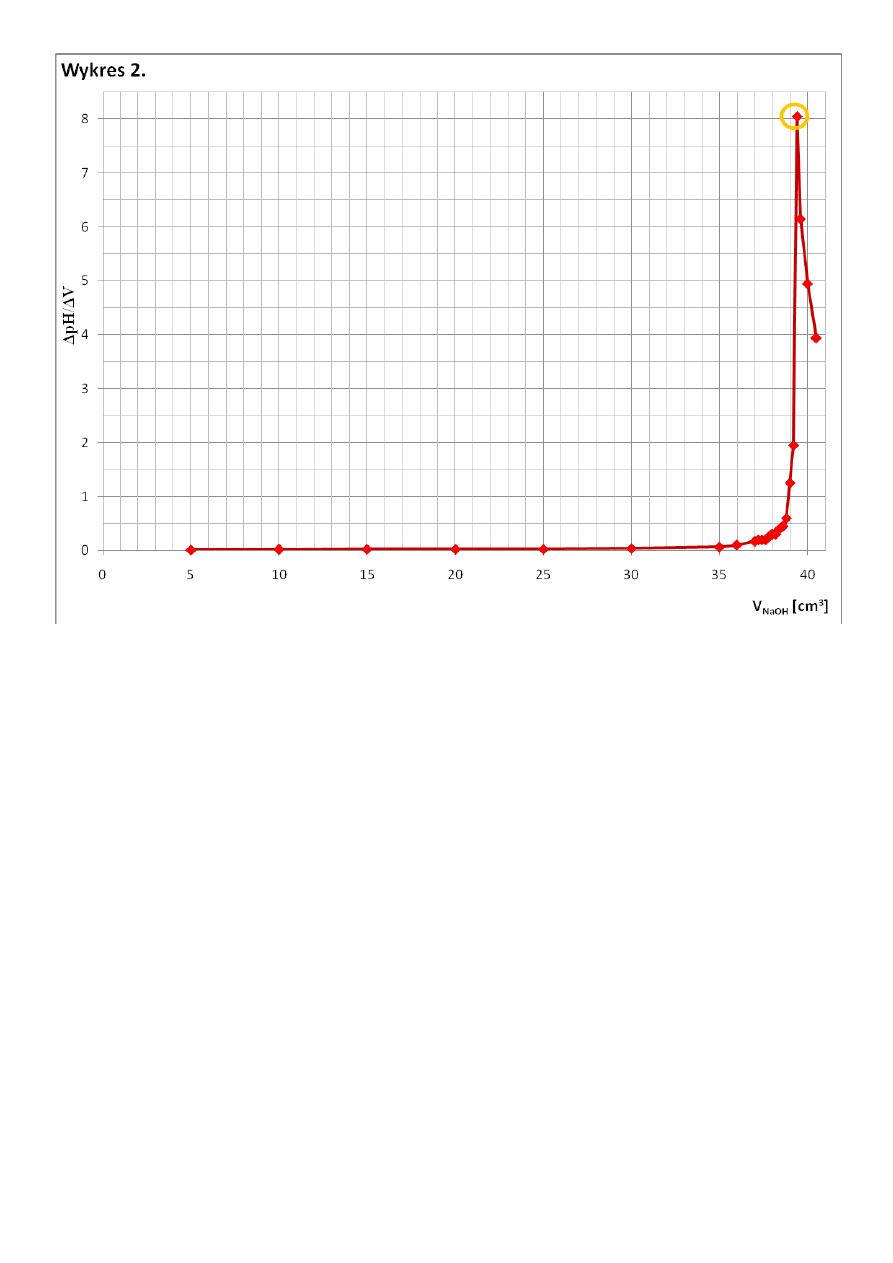
Z Wykresu 2 odczytałam, że punkt równoważnikowy miareczkowania HCl nastąpił po dodaniu 39,4 cm
3
roztworu
NaOH. Z Wykresu 1 odczytałam, że przy tej objętości dodanego NaOH pH roztworu wynosi 5,75.
Podczas miareczkowania kwasu solnego w roztworze zachodziły następujące reakcje:
HCl + NaOH NaCl + H
2
O
HCl H
+
+ Cl
-
NaOH Na
+
+ OH
-
H
2
O H
+
+ OH
-
Na ich podstawie można wyznaczyć teoretyczną krzywą miareczkowania 0,1 M roztworu HCl roztworem 0,1 M
NaOH.
Dane potrzebne do wyznaczenia teoretycznej krzywej miareczkowania zostały zamieszczone w Tabeli 2.
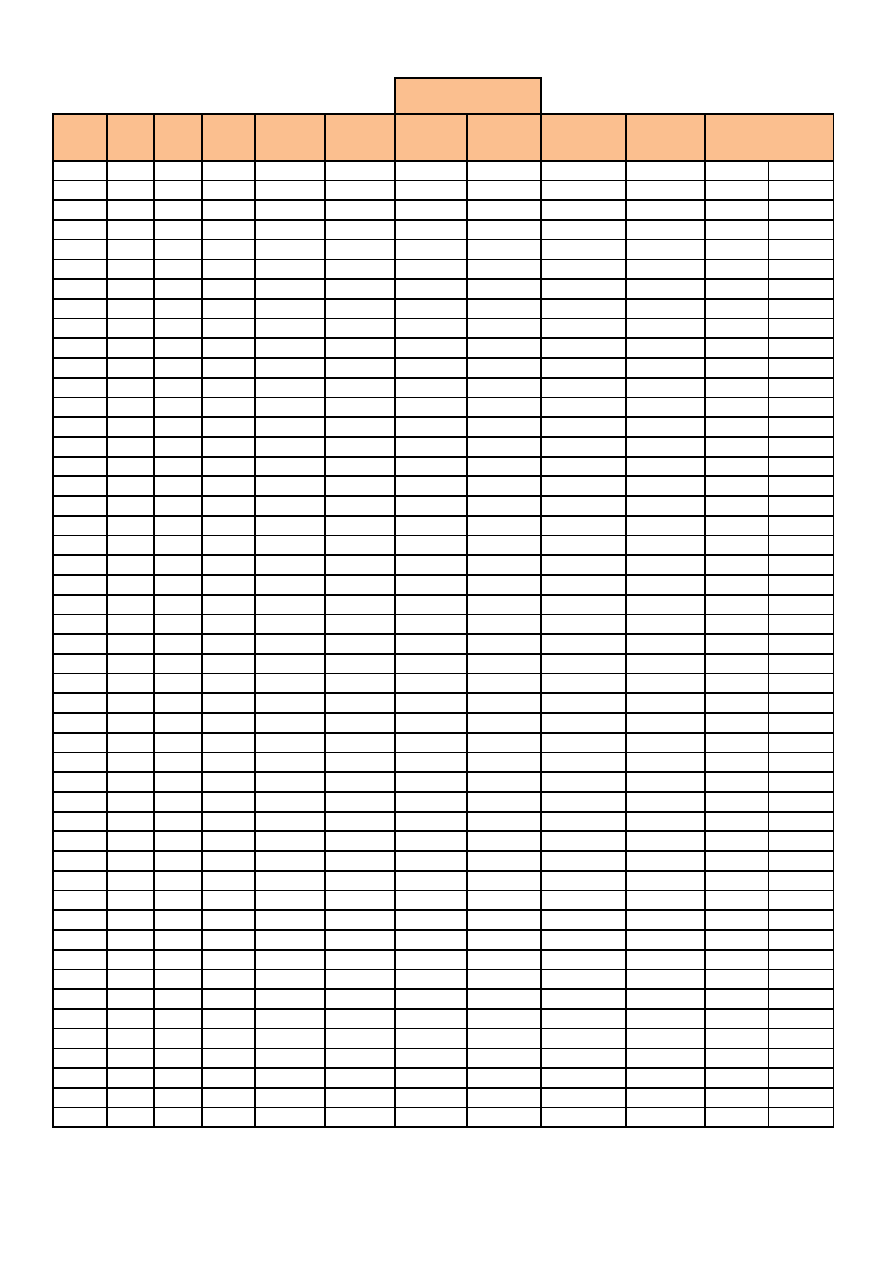
T
ABELA
2.
nadmiar
V
NaOH
[cm
3
]
V
HCl
[cm
3
]
V
r-ru
[cm
3
]
n
HCl
n
NaOH
n
NaCl
n’
HCl
n’
NaOH
[H
+
]
[OH
-
]
pH
0
40
40
0,004
0
0
0,004
-
0,1
0
1,00
-
5
40
45
0,004 0,0005
0,0005
0,0035
-
0,077778
0
1,11
-
10
40
50
0,004
0,001
0,001
0,003
-
0,06
0
1,22
-
15
40
55
0,004 0,0015
0,0015
0,0025
-
0,045455
0
1,34
-
20
40
60
0,004
0,002
0,002
0,002
-
0,033333
0
1,48
-
25
40
65
0,004 0,0025
0,0025
0,0015
-
0,023077
0
1,64
-
30
40
70
0,004
0,003
0,003
0,001
-
0,014286
0
1,85
-
35
40
75
0,004 0,0035
0,0035
0,0005
-
0,006667
0
2,18
-
36
40
76
0,004 0,0036
0,0036
0,0004
-
0,005263
0
2,28
-
37
40
77
0,004 0,0037
0,0037
0,0003
-
0,003896
0
2,41
-
37,2
40
77,2 0,004 0,00372 0,00372 0,00028
-
0,003627
0
2,44
-
37,4
40
77,4 0,004 0,00374 0,00374 0,00026
-
0,003359
0
2,47
-
37,6
40
77,6 0,004 0,00376 0,00376 0,00024
-
0,003093
0
2,51
-
37,8
40
77,8 0,004 0,00378 0,00378 0,00022
-
0,002828
0
2,55
-
38
40
78
0,004 0,0038
0,0038
0,0002
-
0,002564
0
2,59
-
38,2
40
78,2 0,004 0,00382 0,00382 0,00018
-
0,002302
0
2,64
-
38,4
40
78,4 0,004 0,00384 0,00384 0,00016
-
0,002041
0
2,69
-
38,6
40
78,6 0,004 0,00386 0,00386 0,00014
-
0,001781
0
2,75
-
38,8
40
78,8 0,004 0,00388 0,00388 0,00012
-
0,001523
0
2,82
-
39
40
79
0,004 0,0039
0,0039
1E-04
-
0,001266
0
2,90
-
39,2
40
79,2 0,004 0,00392 0,00392
8E-05
-
0,00101
0
3,00
-
39,4
40
79,4 0,004 0,00394 0,00394
6E-05
-
0,000756
0
3,12
-
39,6
40
79,6 0,004 0,00396 0,00396
4E-05
-
0,000503
0
3,30
-
39,7
40
79,7 0,004 0,00397 0,00397
3E-05
-
0,000376
0
3,42
-
40
40
80
0,004
0,004
0,004
0
0
7,00
7,00
40,5
40
80,5 0,004 0,00405
0,004
-
5E-05
-
0,000621
-
10,79
41
40
81
0,004 0,0041
0,004
-
0,0001
-
0,001235
-
11,09
41,5
40
81,5 0,004 0,00415
0,004
-
0,00015
-
0,00184
-
11,27
42
40
82
0,004 0,0042
0,004
-
0,0002
-
0,002439
-
11,39
42,5
40
82,5 0,004 0,00425
0,004
-
0,00025
-
0,00303
-
11,48
43
40
83
0,004 0,0043
0,004
-
0,0003
-
0,003614
-
11,56
43,5
40
83,5 0,004 0,00435
0,004
-
0,00035
-
0,004192
-
11,62
44
40
84
0,004 0,0044
0,004
-
0,0004
-
0,004762
-
11,68
44,5
40
84,5 0,004 0,00445
0,004
-
0,00045
-
0,005325
-
11,73
45
40
85
0,004 0,0045
0,004
-
0,0005
-
0,005882
-
11,77
45,5
40
85,5 0,004 0,00455
0,004
-
0,00055
-
0,006433
-
11,81
46
40
86
0,004 0,0046
0,004
-
0,0006
-
0,006977
-
11,84
46,5
40
86,5 0,004 0,00465
0,004
-
0,00065
-
0,007514
-
11,88
47
40
87
0,004 0,0047
0,004
-
0,0007
-
0,008046
-
11,91
47,5
40
87,5 0,004 0,00475
0,004
-
0,00075
-
0,008571
-
11,93
48
40
88
0,004 0,0048
0,004
-
0,0008
-
0,009091
-
11,96
48,5
40
88,5 0,004 0,00485
0,004
-
0,00085
-
0,009605
-
11,98
49
40
89
0,004 0,0049
0,004
-
0,0009
-
0,010112
-
12,01
49,5
40
89,5 0,004 0,00495
0,004
-
0,00095
-
0,010615
-
12,03
50
40
90
0,004
0,005
0,004
-
0,001
-
0,011111
-
12,05
55
40
95
0,004 0,0055
0,004
-
0,0015
-
0,015789
-
12,20
60
40
100 0,004
0,006
0,004
-
0,002
-
0,02
-
12,30
65
40
105 0,004 0,0065
0,004
-
0,0025
-
0,02381
-
12,38
70
40
110 0,004
0,007
0,004
-
0,003
-
0,027273
-
12,44
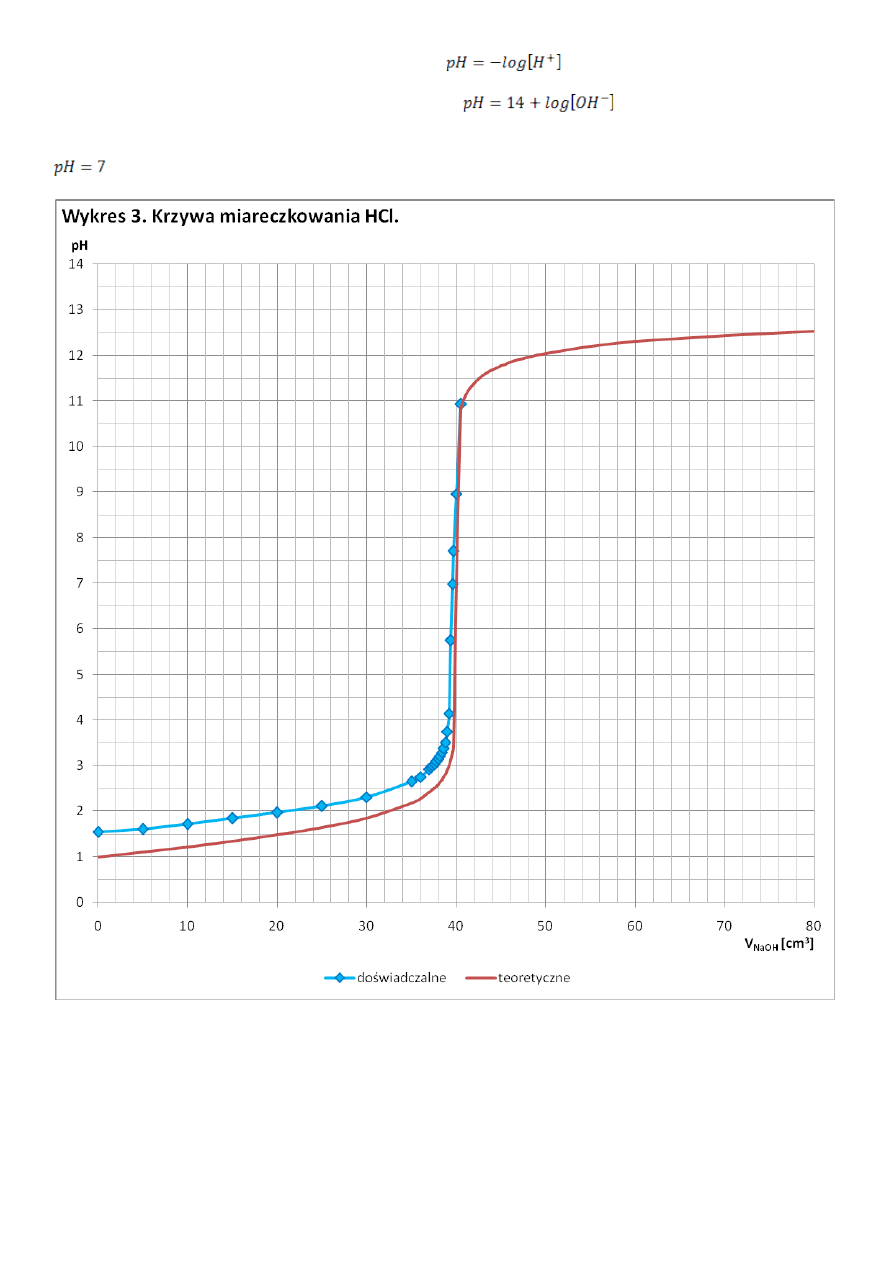
Gdy w roztworze był nadmiar HCl pH obliczyłam ze wzoru:
Gdy w roztworze był nadmiar NaOH pH obliczyłam ze wzoru:
Gdy w roztworze była równowaga kwasowo-zasadowa przyjęłam, że pH w przybliżeniu jest równe pH czystej wody:
Mimo że krzywa miareczkowania otrzymana w doświadczeniu ma podobny przebieg, a w niektórych punktach nawet
pokrywa się z teoretyczną krzywą miareczkowania, to wyznaczona na jej podstawie wartość pH znacząco odbiega od
wartości oczekiwanej. Punkt równoważnikowy powinien nastąpić po dodaniu 40cm
3
roztworu NaOH przy pH równym
7. Błąd może wynikać z niedokładnego odmierzenia roztworów i niedokładnego odczytania zużytej objętości
roztworu NaOH.
9,54
39,2
T
ABELA
3. W
YNIKI
MIARECZKOWANIA
KWASU
SOLNEGO
PRZY
POMOCY
0.1 M NaOH
V
NaOH
[cm
3
]
pH
0
3,19
5
4,08
10
4,42
15
4,64
20
4,84
25
5,05
30
5,30
35
5,72
36
5,85
37
6,01
37,2
6,07
37,4
6,11
37,6
6,18
37,8
6,22
38,0
6,33
38,2
6,37
38,4
6,53
38,6
6,67
38,8
7,02
39,0
7,66
39,2
9,54
40,0
10,93
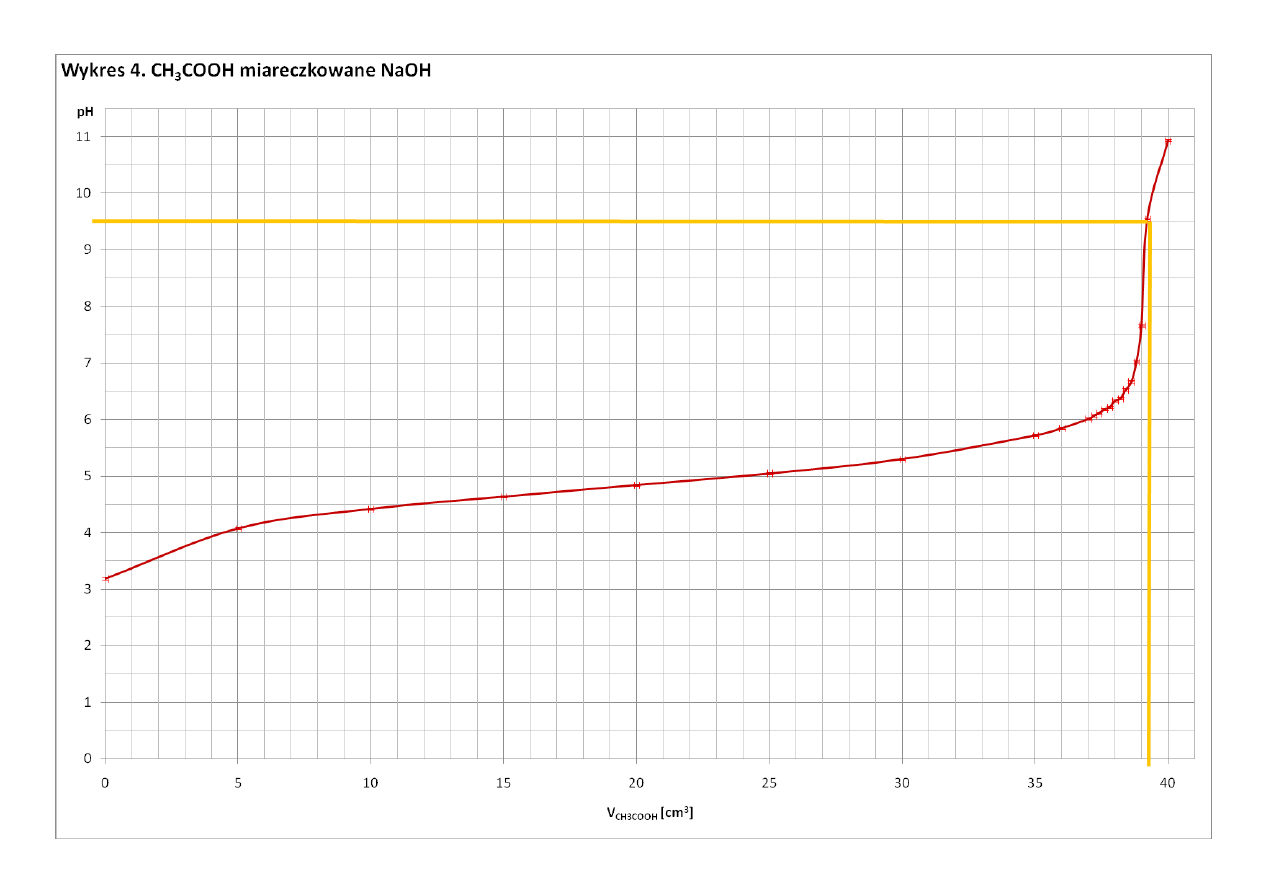
Z Wykresu 5 odczytałam, że punkt równoważnikowy miareczkowania CH
3
COOH nastąpił po dodaniu 39,2 cm
3
roztworu NaOH. Z Wykresu 4 odczytałam, że przy tej objętości dodanego NaOH pH roztworu wynosi 9,54.
Document Outline
Wyszukiwarka
Podobne podstrony:
07 Dysocjacja elektrolityczna, pH sprawozdanie
07 Dysocjacja elektrolityczna, pH sprawozdanie
ph sprawozdanie
ćw 1 - skala PH SPRAWOZDANIE, Chemia ogólna i nieorganiczna
POTENCJANOMETRYCZNY POMIAR pH sprawozdanie pH
Chemia pH Sprawozdanie 2
07 Dysocjacja elektrolityczna, pH sprawozdanie
Sprawozdanie 5 pH, Politechika Białostocka, budownictwo semestr I 2013-2014, Chemia budowlana, Spraw
SPRAWOZDANIE CHEMIA OGÓLNA skala pH
Chemia - sprawozdanie - pomiary ph i hydroliza soli, Mechanika i Budowa Maszyn, Chemia sprawozdania
sprawozdanie 8 potencjometryczny pomiar ph LQ3AVZQUURSLZWSMF5NI3VN42RUTV7PYD3HXMYY
wzor-sprawozdania-cw 1-pomiar-ph, Chemia
pH roztworów, Politechnika Poznańska ZiIP, II semestr, nom, Laboratoria-sprawozdania NOM, sprawozdan
Wartość pH roztworów wodnych sprawozdanie
5 - Miar. pH - metryczne, Sprawozdanie - 5 - xx, Celem ćwiczenia jest wyznaczenie zależności potencj
więcej podobnych podstron