ZAPOZNANIE SIĘ Z METODĄ OKREŚLANIA PRZYBLIŻONEJ, A NASTĘPNIE DOKŁADNEJ, WARTOŚCI pH ROZTWORU ZA POMOCĄ WSKAŹNIKÓW KWASOWO ZASADOWYCH I UNIWESALNYCH PAPIERKÓW WSKAŹNIKOWYCH.
Do 5 probówek wlewamy po około 5cm3 badanego roztworu, następnie
dodajemy po 2 krople roztworów wskaźnikowych i odczytujemy wartość pH badanego roztworu.
Próbkę z błękitem bromotymolowym porównujemy ze skalą wzorców i określamy dokładnie pH roztworu.
Wskaźnik |
pH |
Kolor roztworu |
Fenoloftaleina |
8,0 |
Bezbarwny |
Oranż metylowy |
4,4 |
Żółty |
Czerwień metylowa |
6,2 |
Żółty |
Błękit bromotymolowy |
7,6 |
niebieski |
W ostatniej próbówce pH roztworu wnosiło 8,0.
PORÓWNANIE pH MOCNEGO I SŁABEGO KWASU O TYM SAMYM STĘŻENIU.
Za pomocą pehametru zmierzyliśmy wartość pH kwasu octowego i solnego o takim samym stężeniu, równym 0,1mol/dm3.
pH HCl = 1
pH CH3COOH = 2,8
HCl jest mocnym elektrolitem, czyli jego cząsteczki są zdysocjowane całkowicie. Stężenie takiego kwasu jest prawie równe wartości pH. Natomiast kwas octowy jest słabym elektrolitem i dysocjuje tylko częściowo. Jego wartość pH przewyższa wartość stężenia. Dla słabych kwasów wartość pH zależy od stałej dysocjacji.
MIESZANINY WYSTĘPUJĄCE W PRZYRODZIE.
WŁAŚCIWOŚCI BUFOROWE WODY WODOCIĄGOWEJ W PORÓWNANIU Z WODĄ DESTYLOWANĄ.
Do dwóch par zlewek wlewamy:
wodę destylowaną
wodę wodociągową
Następnie mierzymy pH w zlewkach. Po dokonaniu pomiarów do zlewek dolewamy HCl i NaOH o stężeniu 0,01mol/dm3. Mieszamy roztwory w zlewkach za pomocą bagietki i dokonujemy pomiaru pH.
Woda |
pH wody |
pH wody z NaOH |
pH wody z HCl |
ΔpH |
Δβ |
Δn |
||
Woda destylowana |
5,6 |
8,0 |
3,4 |
2,4 |
-2,2 |
0,0002 |
0,0002 |
0,0005 |
Woda wodociągowa |
6,9 |
7,1 |
6,8 |
0,2 |
-0,1 |
0,0025 |
0,005 |
0,0005 |
Obliczam pojemność buforową.
β = Δn /ΔpH
β1 = 0,0005/2,4 = 0,00020
β2 = 0,0005/2,2 =0,00022
β3 = 0,0005/0,2 = 0,0025
β4 = 0,0005/0,1 = 0,005
Obliczam Δn.
1000cm3 0,1mol
5cm3 X
X = 0,0005
Zaobserwowaliśmy, że woda wodociągowa zachowuje się jak bufor po dodaniu NaOH lub HCl. Jej pH nieco się zmienia, świadczy to o istnieniu w wodzie soli które neutralizują działanie kwasów i zasad.
BADANIE WPŁYWU SKŁADU ROZTWORU BUFOROWEGO NA JEGO POJEMNOŚĆ BUFOROWĄ.
Do sporządzenia roztworów wykorzystujemy kwas octowy i octan sodowy o stężeniu 0,1mol/dm3.Po dokładnym wymieszaniu roztworów mierzymy pH, następnie dodajemy po 5cm3 kwasu solnego o stężeniu 0,1mol/dm3 i ponownie mierzymy pH.
Ck/Cs |
Objętość CH3COOH [CM3] |
Objętość CH3COONa [CM3] |
pH |
pH po dodaniu 5 cm3 HCl |
Δn HCl |
ΔpH |
β [mol/m3] |
0,25 0,5 1 2 3 4
|
8,0 13,3 20,0 26,7 30,0 32,0 |
32,0 26,7 20,0 13,3 10,0 8,0 |
4,92 4,63 4,37 4,07 3,86 3,76 |
4,64 4,42 4,14 3,78 3,48 3,23 |
0,0125 0,0125 0,0125 0,0125 0,0125 0,0125 |
0,28 0,21 0,23 0,29 0,38 0,53 |
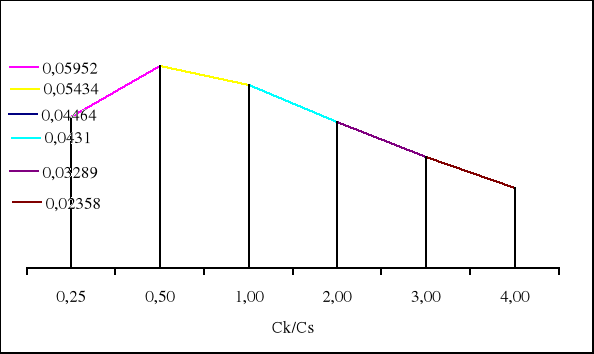
0,04464 0,05952 0,05434 0,04310 0,03289 0,02358 |
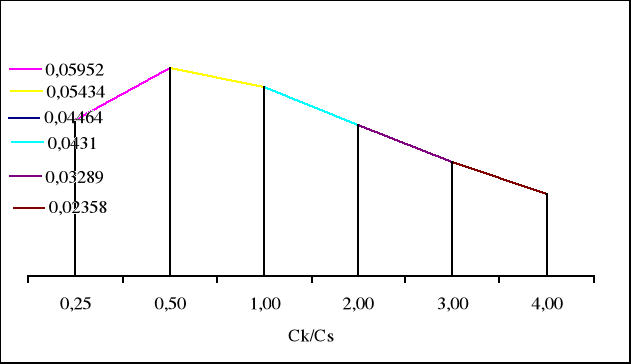
Maksymalna pojemność buforu jest wtedy gdy objętość CH3COOH wynosi 13,3cm3, a objętość CH3COONa wynosi 26,7cm3.
a) Obliczam Δn.
1000cm3 0,1mol
5cm3 X
X = 0,0005
Δn = 0,0005 * 25 = 0,0125
b) Obliczam pojemność buforową.
β = Δn /ΔpH
β1 = 0,0125/0,28 = 0,04464 mol/dm3
β2 = 0,0125/0,21 = 0,05952 mol/dm3
β3 = 0,0125/0,23 = 0,05434 mol/dm3
β4 = 0,0125/0,29 = 0,04310 mol/dm3
β5 = 0,0125/0,38 = 0,03289 mol/dm3
β6 = 0,0125/0,53 = 0,02358 mol/dm3
ΔpH obliczam ze wzoru
ΔpH = pH - pH HCl
BADANIE WPŁYWU SUMARYCZNEGO STĘŻENIA SKŁADNIKÓW BUFORU NA JEGO POJEMNOŚĆ BUFOROWĄ.
Roztwory buforowe o różnym sumarycznym stężeniu kwasu i soli sporządza się z roztworu kwasu octowego o stężeniu 0,1mol/dm3 i stężeniu soli 0,1mol/dm3.Uzyskuje się różne stężenia poprzez odpowiednie rozcieńczenie wodą destylowaną. Po przygotowaniu roztworów należy je dokładnie wymieszać i zmierzyć pH. Następnie należy dodać do każdego roztworu po 5cm3 roztworu kwasu solnego o stężeniu 0,1mol/dm3 i ponownie zmierzyć pH.
Ck + Cs [mol/dm3] |
Objętość CH3COOH [cm3] |
Objętość CH3COONa [cm3] |
Objętość H2O [cm3] |
pH |
pH po dodaniu 5 cm3 HCl |
Δn HCl |
ΔpH |
β [mol/m3] |
0,025 0,050 0,075 0,100 |
10 20 30 40 |
10 20 30 40 |
60 40 20 0 |
4,30 4,32 4,31 4,32 |
3,98 4,01 4,28 4,33 |
0,0125 0,0125 0,0125 0,0125 |
0,32 0,31 0,03 0,01 |
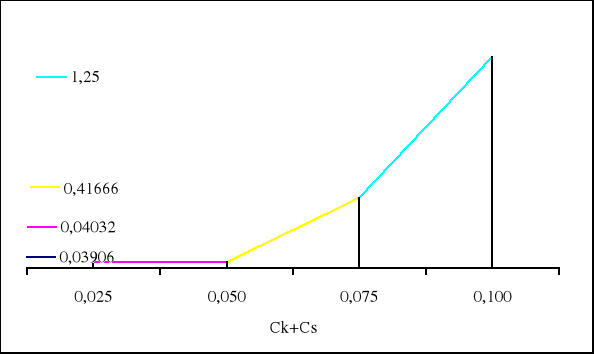
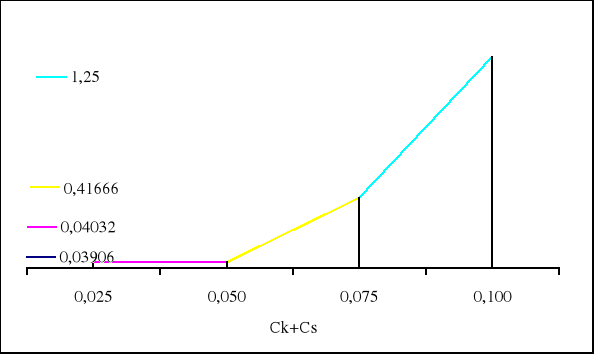
0,03906 0,04032 0,41666 1,25000 |
a) Obliczam Δn.
1000cm3 0,1mol
5cm3 X
X = 0,0005
Δn = 0,0005 * 25 = 0,0125 mola
b) Obliczam pojemność buforową.
β = Δn /ΔpH
β1 = 0,0125/0,32 = 0,03906
β2 = 0,0125/0,31 = 0,04032
β3 = 0,0125/0,03 = 0,41666
β4 = 0,0125/0,01 = 1,25000
ΔpH obliczam ze wzoru
ΔpH = pH - pH HCl
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 2 Badanie właściwości i analiza jakościowa anionów, Politechika Białostocka, budownictw
Sprawozdanie 3 Właściwości chemiczne metali, Politechika Białostocka, budownictwo semestr I 2013-201
Sprawozdanie 2 Badanie właściwości i analiza jakościowa kationów, Politechika Białostocka, budownict
Sprawozdanie 2 - analiza otrzymanej próbki soli, Politechika Białostocka, budownictwo semestr I 2013
sprawozdanie 9, NAUKA, Politechnika Bialostocka - budownictwo, Semestr III od Karola, Wytrzymałośc M
cw-9 p, NAUKA, Politechnika Bialostocka - budownictwo, Semestr III od Karola, Wytrzymałośc Materiałó
cw-2 p, NAUKA, Politechnika Bialostocka - budownictwo, Semestr III od Karola, Wytrzymałośc Materiałó
cw-1 p, NAUKA, Politechnika Bialostocka - budownictwo, Semestr III od Karola, Wytrzymałośc Materiałó
cw-7 p, NAUKA, Politechnika Bialostocka - budownictwo, Semestr III od Karola, Wytrzymałośc Materiałó
cw-9 p, NAUKA, Politechnika Bialostocka - budownictwo, Semestr III od Karola, Wytrzymałośc Materiałó
opracowane sprawozdania, NAUKA, Politechnika Bialostocka - budownictwo, Semestr III od Karola, Techn
Schody 1, NAUKA, Politechnika Bialostocka - budownictwo, Semestr III od Karola, Budownictwo Ogólne,
4a, NAUKA, Politechnika Bialostocka - budownictwo, Semestr III od Karola, Technologia Betonu, betony
POLITECHNIKA BIAŁOSTOCKA, NAUKA, Politechnika Bialostocka - budownictwo, Semestr III od Karola, Budo
cw7, NAUKA, Politechnika Bialostocka - budownictwo, Semestr III od Karola, Technologia Betonu, beton
Mur1, NAUKA, Politechnika Bialostocka - budownictwo, Semestr III od Karola, Budownictwo Ogólne, kolo
zbioróweczka zagadnienia na IV semestr z chemii, nauka, politechnika białostocka, budownictwo semest
laborki kolo 2, nauka, politechnika białostocka, budownictwo semestr 1, chemia politechnika białosto
więcej podobnych podstron