
Etery i epoksydy
Etery –
pochodne alkoholi, w których atom wodoru
przy grupie –OH jest zastąpiony resztą organiczną.
E T E R Y
tlenek etylenu
(oksiran)
acykliczne R(Ar)-O-R'(Ar')
- alifatyczne
symetryczne
(R-O-R),
np.
eter dietylowy
niesymetryczne
(R-O-R'),
np.
eter etylowo-propylowy
- arylowe
symetryczne
(Ar-O-Ar),
np
.
eter difenylowy
niesymetryczne
(Ar-O-Ar'),
np.
eter fenylowo-4-nitrofenylowy
- alifatyczno-arylowe
(R-O-Ar),
np.
eter fenylowo-metylowy
cykliczne
O
O
oksetan
(tlenek 1,3-propylenu)
O
O
O
tetrahydrofuran
1,3-dioksolan
O
O
O
O
O
1,4-dioksan
tetrahydropiran
1,3-dioksan
Nomenklatura
Nazwy eterów tworzy się przez dodanie słowa eter do połączonych myślnikiem
przymiotnikowych nazw obu reszt organicznych zgodnie z kolejnością alfabetyczną.
Resztę organiczną z atomem tlenu można również traktować
jako podstawnik alkoksylowy (
-OR
) lub aryloksylowy (
-OAr
) w związku.
CH
3
CH
2
-O-CH
2
CH
3
eter dietylowy
CH
3
-O-CH
2
CH
2
Br
1-bromo-2-metoksyetan
CH
3
CH
2
CHCH
2
-COOH
OCH
2
CH
3
kwas 3-etoksypentanowy
OCH(CH
3
)
2
2-izopropoksynaftalen

Nomenklatura
Nazewnictwo zamienne
- stosowane głównie do tworzenia nazw
polieterów
, czyli związków zawierających kilka eterowych atomów tlenu.
Eterowe atomy tlenu w łańcuchu są traktowane i liczone jak atomy węgla,
czyli uwzględnia się je w nazwie węglowodoru macierzystego,
a wyróżnia się je przedrostkiem
oksa
podając odpowiednie lokanty
i liczebnik zwielokratniający.
CH
3
-O-CH
2
CH
2
-O-CH
2
CH
2
-O-CH
2
CH
2
-O-CH
3
2,5,8,11-tetraoksadodekan
11
1
5
4
3
2
10
9
8
7
6
12

Otrzymywanie eterów
1. Dehydratacja (odwodnienie) alkoholi katalizowana kwasem, np. H
2
SO
4
– otrzymywanie eterów symetrycznych, głównie z alkoholi 1
o
- otrzymywanie eterów RCH
2
-O-
tert
-Bu w reakcji odpowiedniego
alkoholu z alkoholem
tert
-butylowym
2. Alkoholiza halogenków alkilowych (głównie 3
o
)
3. Synteza Williamsona
- daje dobre wyniki w przypadku halogenków 1
o
- 2
o
halogenki często ulegają reakcji eliminacji i wydajność eteru jest mała
- wykorzystywana do syntezy eterów alkilowo-fenylowych
4. Reakcja bromków i jodków arylowych z fenolami katalizowana
solami miedzi(I) – otrzymywanie eterów diarylowych
5. Alkoksyrtęciowanie/odrtęciowanie alkenów

Dehydratacja alkoholi katalizowana kwasem
2 CH
3
CH
2
OH
H
2
SO
4
140
o
C
CH
3
CH
2
-O-CH
2
CH
3
+ H
2
O
etanol
eter dietylowy
(przemys
łowa metoda otrzymywania)
Machanizm reakcji
CH
3
-CH
2
-OH
H
- H
2
O
O
H
H
CH
3
-CH
2
-
+
CH
3
-CH
2
-OH
CH
3
-CH
2
-O-CH
2
-CH
3
H
- H
CH
3
-CH
2
-O-CH
2
-CH
3
eter dietylowy
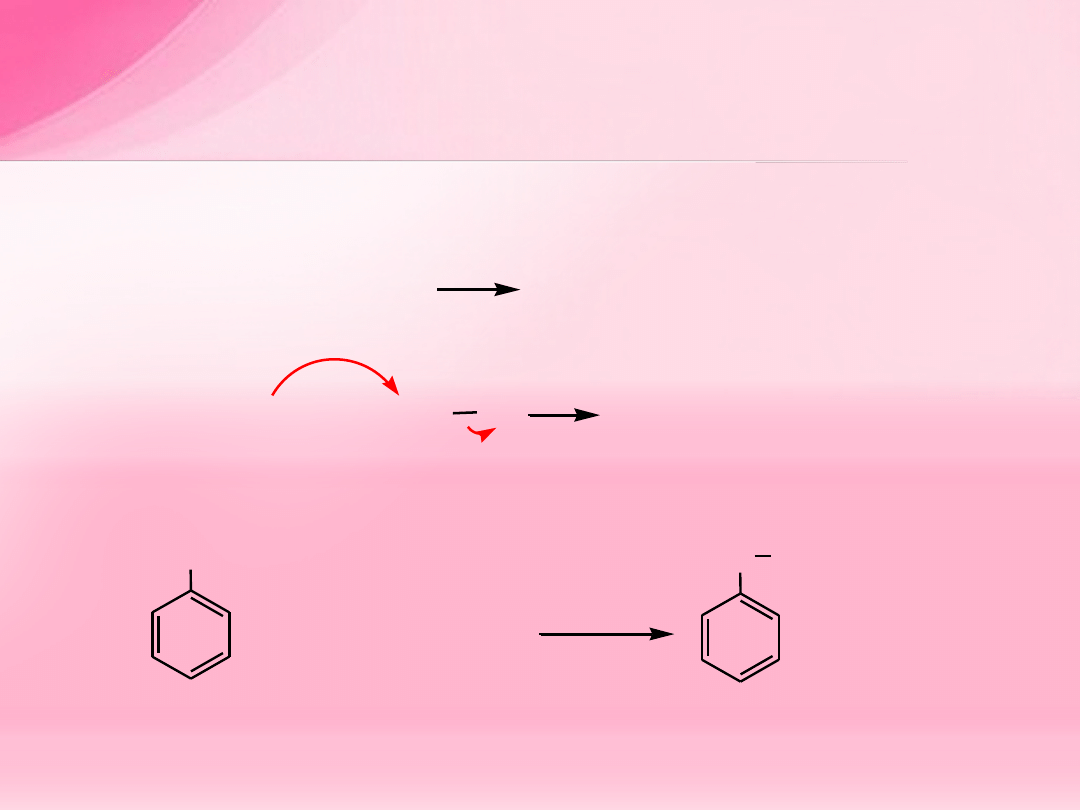
Synteza Williamsona
(odkryta w 1850 roku)
–
alkilowanie alkoholanów halogenkami, siarczanami lub
tosylanami alkilowymi:
Na
etanol
CH
3
CH
2
OH
etanolan sodu
CH
3
CH
2
O
-
Na
+
CH
3
Br
etanolan sodu
CH
3
CH
2
O
-
Na
+
+
S
N
2
CH
3
CH
2
-O-CH
3
+
NaBr
eter
etylowo-metylowy
OH
+
CH
2
=CHCH
2
-Br
K
2
CO
3
aceton, tw
O CH
2
CH=CH
2
fenol
bromek allilu
eter allilowo-fenylowy
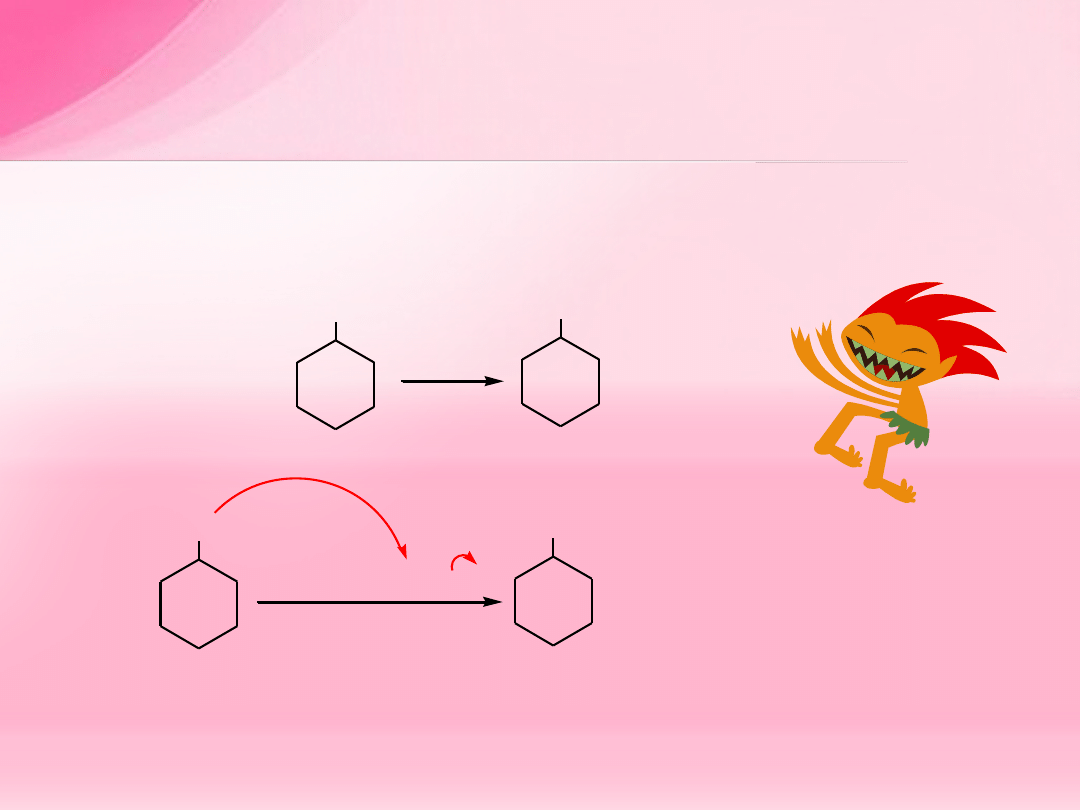
Pytanie
Przedstaw mechanizm reakcji otrzymywania eteru
n
-butylowo-cykloheksylowego.
+ H
2
eter
n-butylowo-cykloheksylowy
OH
NaH
O
-
Na
+
O
-
Na
+
CH
3
CH
2
CH
2
CH
2
-Br
S
N
2
+ NaBr
O-CH
2
CH
2
CH
2
CH
3
cykloheksanolan sodu
cykloheksanol
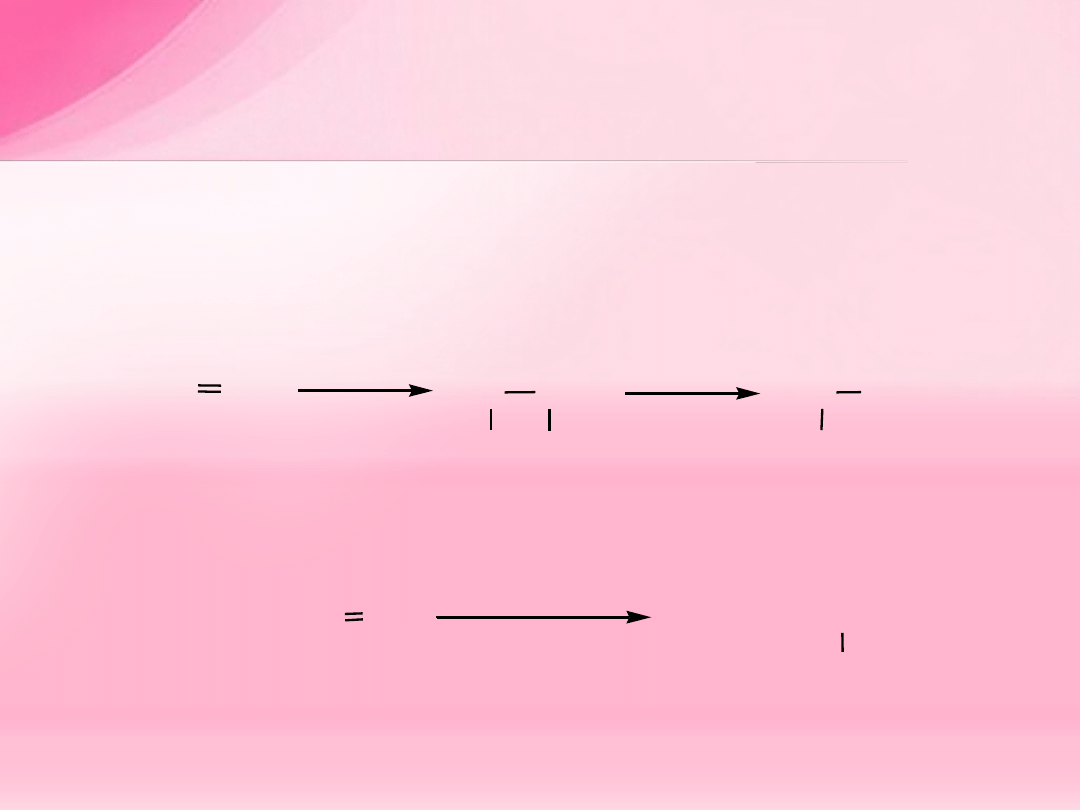
Alkoksyrtęciowanie/odrtęciowanie alkenów
Alkeny w reakcji z octanem rtęci (CH
3
COO)
2
Hg
lub trifluorooctanem rtęci (CF
3
COO)
2
Hg w obecności alkoholu
dają addukt, który pod wpływem NaBH
4
ulega odrtęciowaniu
(redukcji) do odpowiedniego eteru.
Hg(OAc)
2
alken
R
2
C
NaBH
4
CHR
R'OH
octan alkoksyalkilort
ęci(II)
R
2
C
CHR
OR' HgOOCCH
3
eter
R
2
C
CH
2
R
OR'
1. Hg(OAc)
2
,
CH
3
CH
2
OH
pent-1-en
CH
3
CH
2
CH
2
CH
2. NaBH
4
CH
2
2-etoksypentan
CH
3
CH
2
CH
2
CHCH
3
OCH
2
CH
3

Właściwości
fizyczne eterów
Eter dimetylowy (CH
3
-O-CH
3
) i etylowo-metylowy (CH
3
-O-CH
2
CH
3
) są gazami.
Od eteru dietylowego etery alkilowe są cieczami. Nerolina (2-metoksynaftalen) i
nerolina nowa (2-etoksynaftalen) są przykładem eterów stałych, stosowanych w
przemyśle perfumeryjno-kosmetycznym. Etery posiadają temperatury wrzenia
znacznie niższe od temp. wrzenia odpowiednich alkoholi ale zbliżone do temp. wrzenia
odpowiednich węglowodorów. Są dobrze rozpuszczalne w alkoholach ponieważ tworzą z
nimi wiązania wodorowe. Niższe etery, np. eter dimetylowy są całkowicie, a wyższe
częściowo rozpuszczalne w wodzie. Etery są powszechnie stosowane jako
rozpuszczalniki w syntezie organicznej: eter dietylowy (Et
2
O), tetrahydrofuran
(THF), 1,4-dioksan, dimetoksyetan (DME).
Etery są łatwo palne, praca z nimi wymaga szczególnej
ostrożności. Reagują one z tlenem z powietrza i tworzą się
groźne nadtlenki.

Właściwości chemiczne eterów
Etery pod wpływem silnych kwasów ulegają reakcji rozszczepienia na
halogenek i alkohol. Szereg reaktywności kwasów halogenowodorowych:
HI
>
HBr
>
HCl
>>
HF
Szereg eterów, wg podatności na rozszczepienie kwasowe:
R-O-
t
-Bu
>
Ar-O-Ar
>
R-O-Ar
>
R-O-R
CH
3
CH
2
-OH
etanol
CH
3
-O-CH
3
eter dimetylowy
CH
3
CH
2
CH
3
propan
M
cz
46 46 44
temp. wrzenia
+78,5
o
C -24
o
C -42
o
C
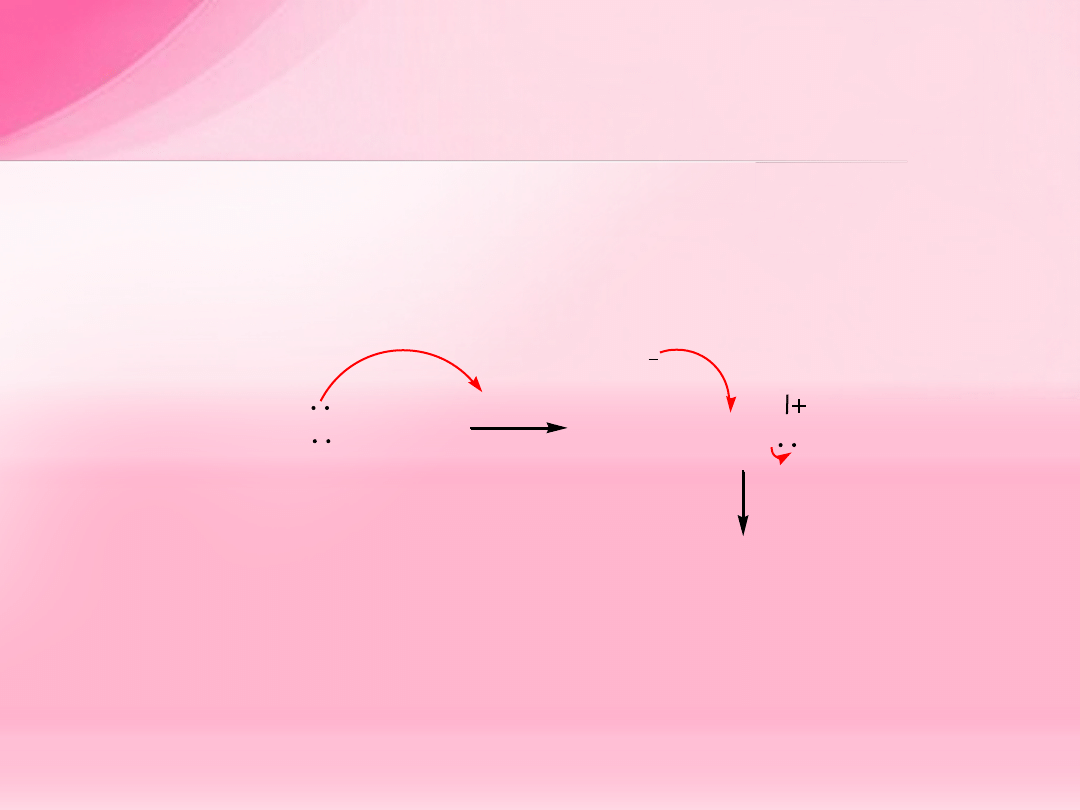
Mechanizm reakcji
Mechanizm
S
N
2
-
protonowanie atomu tlenu i utworzenie soli oksoniowej,
która pod wpływem anionu halogenkowego (I
-
, nukleofila) przekształca się
w halogenek alkilowy i alkohol.
CH
3
CH
2
CH
2
CH
2
-O-CH(CH
3
)
2
eter n-butylowo-izopropylowy
HI / H
2
O
CH
3
CH
2
CH
2
CH
2
-O-CH(CH
3
)
2
H
I
S
N
2
CH
3
CH
2
CH
2
CH
2
I + (CH
3
)
2
CHOH
jodek butylu
izopropanol
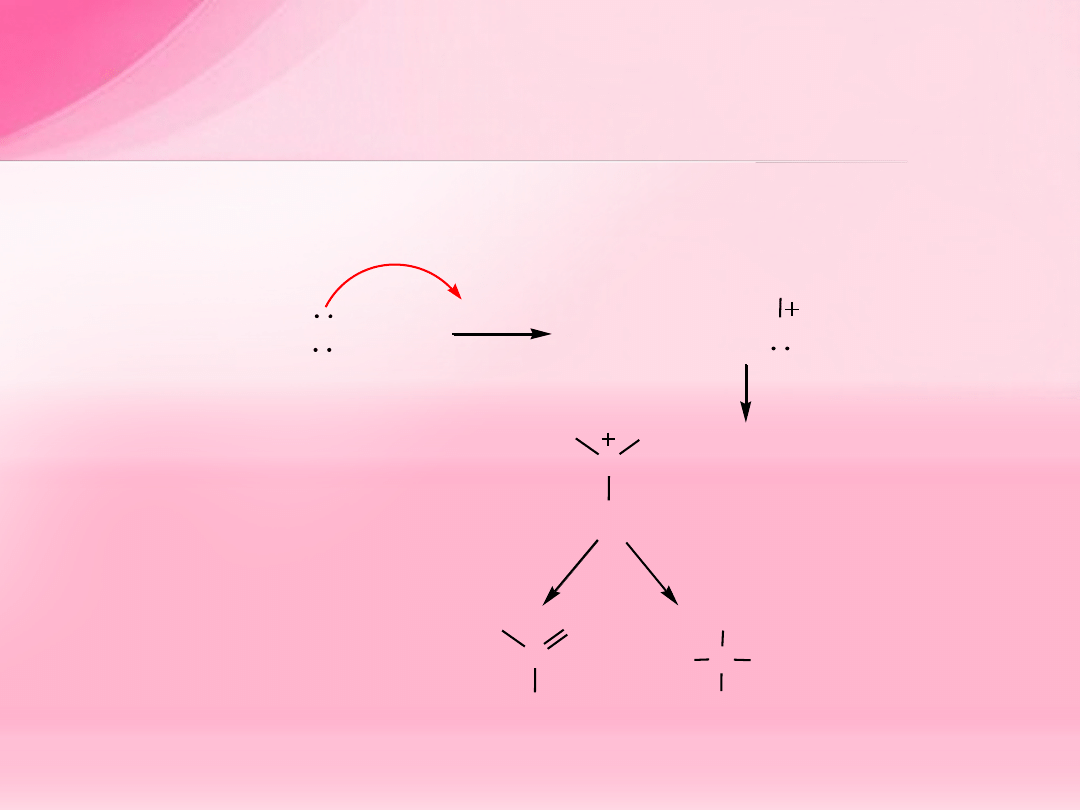
Mechanizm
S
N
1
– (dotyczy eterów zawierających 3
o
reszty
alkilowe, np.
t
-butylowe); sól oksoniowa rozpada się na alkohol i karbokation,
który stabilizuje się poprzez przyłączenie nukleofila i powstaje halogenek
alkilowy lub odszczepia się proton i tworzy się alken.
CH
3
CH
2
CH
2
CH
2
-O-C(CH
3
)
3
eter n-butylowo-t-butylowy
HBr / H
2
O
S
N
1
CH
3
CH
2
CH
2
CH
2
-O-C(CH
3
)
3
H
C
CH
3
H
3
C
CH
3
+ CH
3
CH
2
CH
2
CH
2
-OH
- H
+
Br
-
C
CH
2
H
3
C
CH
3
izobuten
C
CH
3
H
3
C
CH
3
Br
bromek t-butylu
butan-1-ol
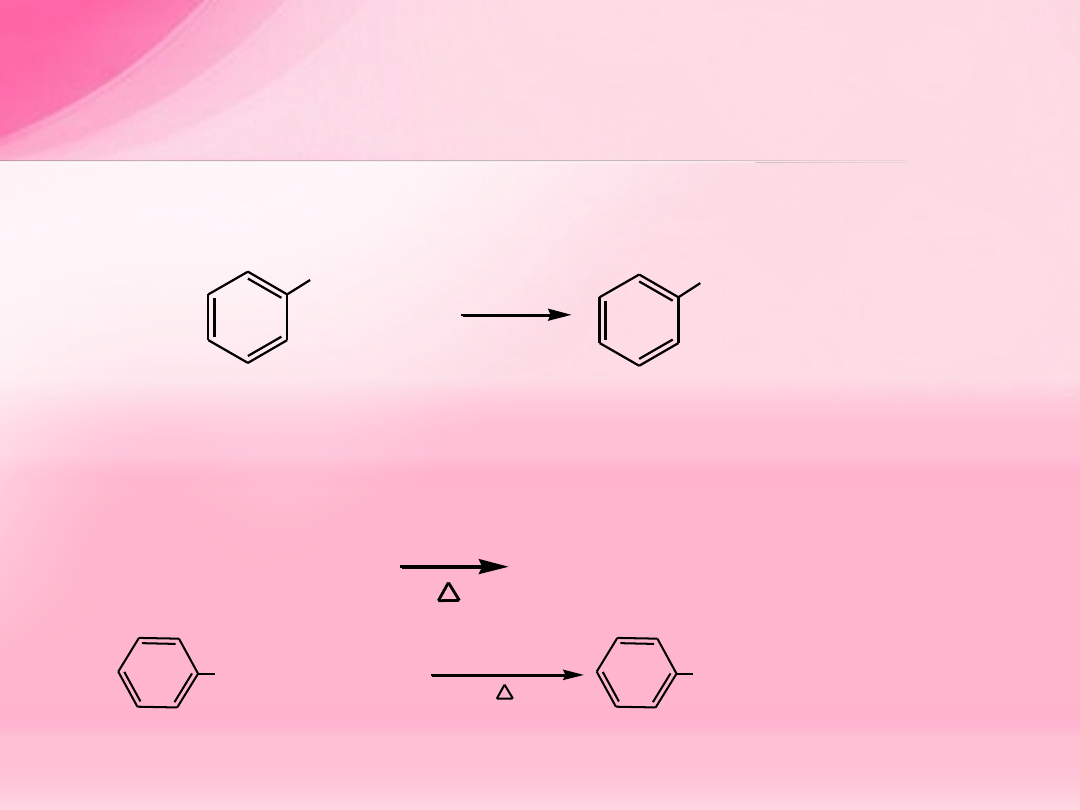
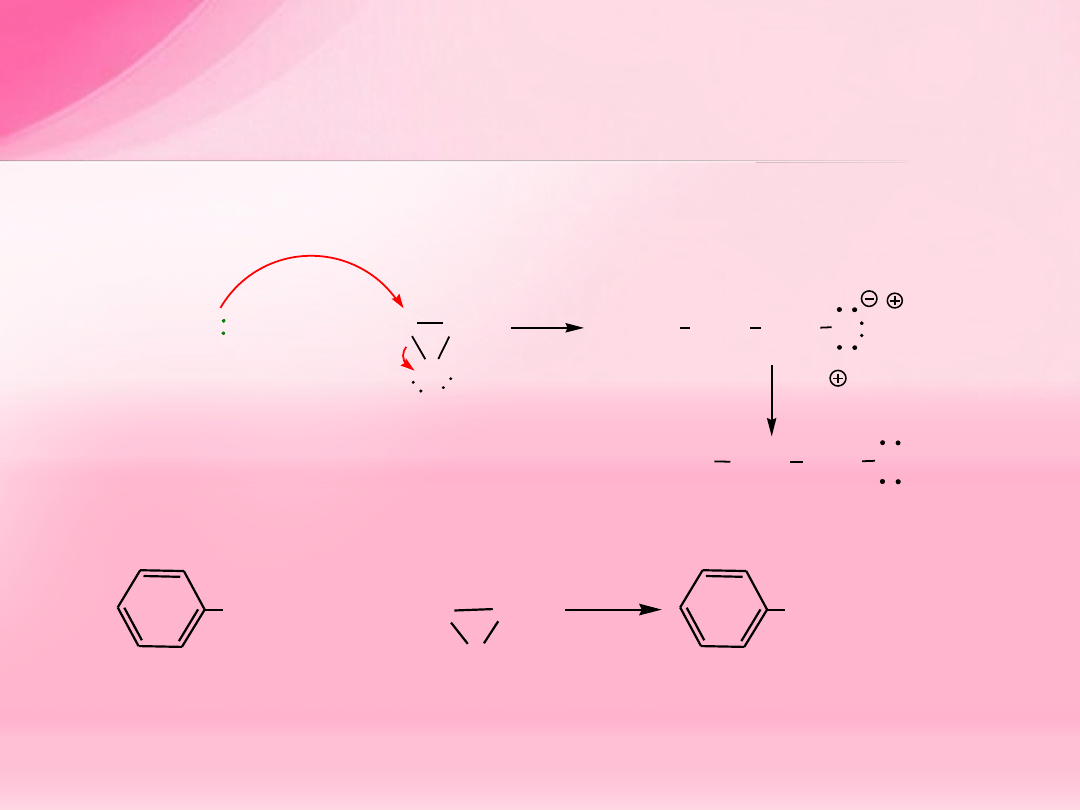
Rozszczepienie eterów alkilowo-arylowych
- powstaje fenol i jodek alkilu
bromek etylu
eter etylowo-fenylowy
(etoksybenzen)
HBr / H
2
O
+ CH
3
CH
2
-Br
fenol
O-CH
2
CH
3
tw
OH
Etery w reakcji z nadmiarem silnego kwasu dają halogenki:
bromek propylu
eter bezylowo-propylowy
+ CH
3
CH
2
CH
2
-Br
bromek benzylu
CH
2
OCH
2
CH
2
CH
3
CH
2
Br
2 HBr
2 H
X
R-O-R'
R-
X
+ R'-
X
+ H
2
O
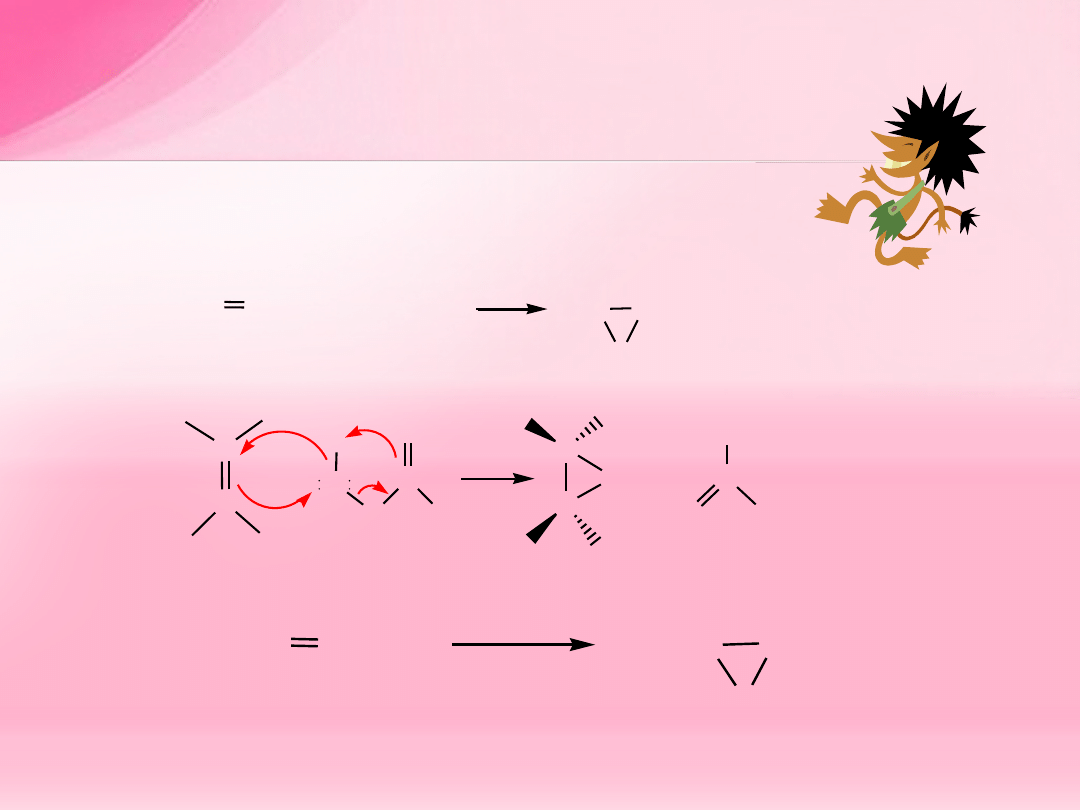
Epoksyzwiązki
Otrzymywanie epoksydów
1. Utlenianie alkenów nadkwasami (RCOOOH)
alken
R
2
C
CR
2
R'COOOH
epoksyd
R
2
C
CR
2
O
+
R'COOH
+
kwas karboksylowy
2,3-dimetylobut-2-en
(CH
3
)
2
C
CH
3
COOOH
C(CH
3
)
2
2,2,3,3-tetrametylooksiran
(CH
3
)
2
C
C(CH
3
)
2
O
addycja
C
C
+
epoksyd
C
O
O
R
O
H
C
C
O
C
OH
O
R
+
nadtlenokwas
alken
kwas karboksylowy
syn
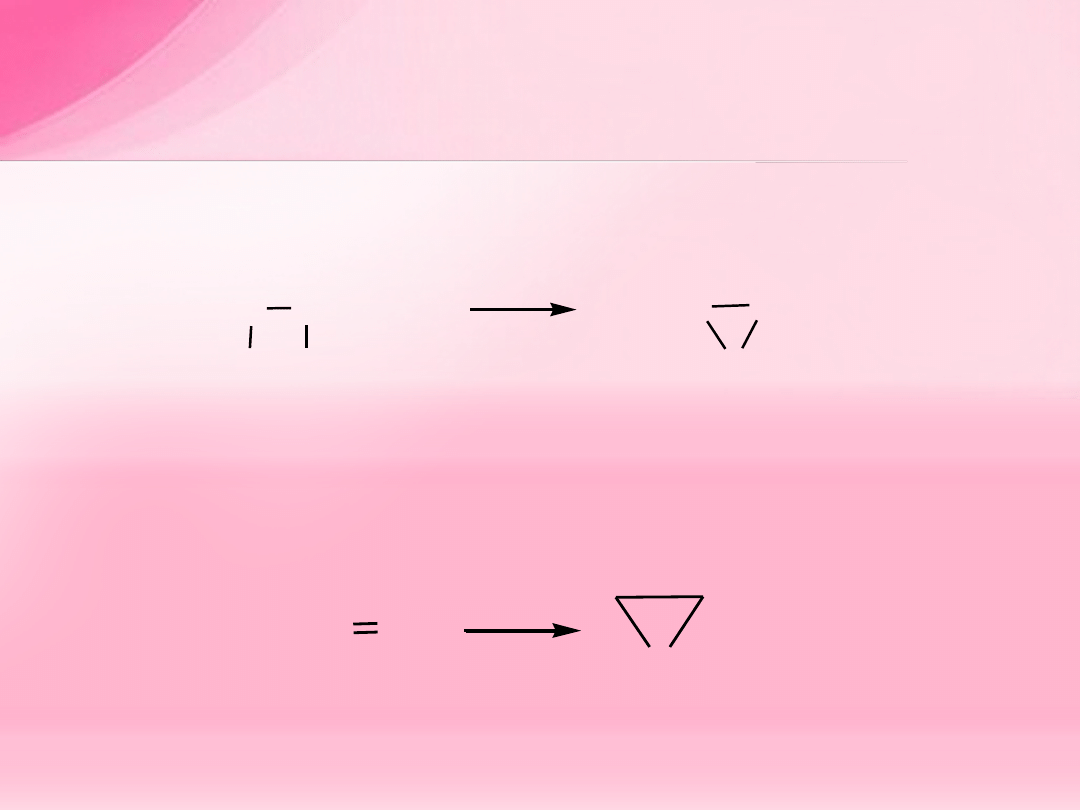
2. Eliminacja halogenowodoru z halohydryn (cyklizacja
vic
-halohydryn)
w środowisku zasadowym:
Utlenianie etenu do tlenku etylenu tlenem z powietrza
w obecności srebra jako katalizatora (metoda przemysłowa):
3-bromo-2-metylopentan-2-ol
(CH
3
)
2
C
NaOH
CHCH
2
CH
3
2,3-epoksy-2-metylopentan
(CH
3
)
2
C
CCH
2
CH
3
O
H
2
O
OH Br
CH
2
CH
2
O
2
/ Ag
250
o
C
eten
O
tlenek etylenu
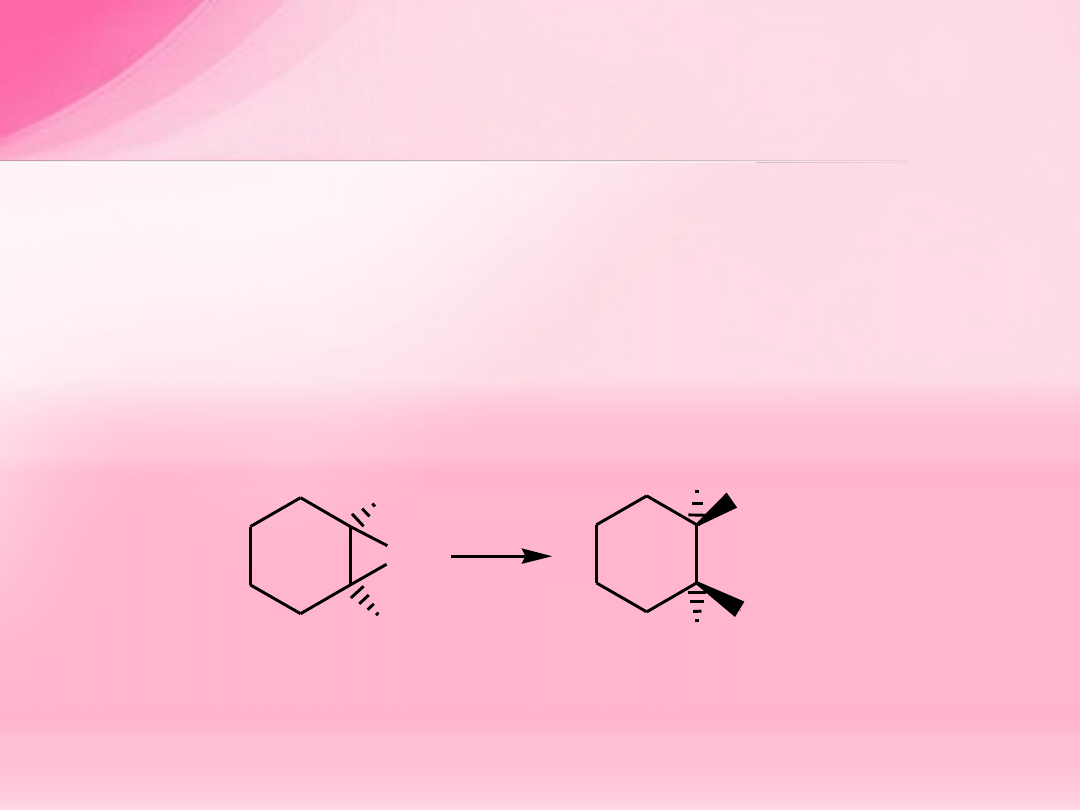
Właściwości chemiczne epoksydów
Epoksydy są bardzo reaktywne. W obecności odczynników
nukleofilowych ulegają rozszczepieniu prowadzącemu do
1,2-difunkcyjnych związków. Addycja nowego podstawnika
zachodzi w sposób
anti
czyli zajmuje on pozycję po przeciwnej
stronie cząsteczki niż grupa –OH wywodząca się z pierścienia
epoksydowego.
1,2-epoksycykloheksan
O
H
2
O
H
H
H
OH
O
H
H
trans-1,2-cykloheksanodiol
HClO
4
Reakcje tlenku etylenu ze związkami
magnezoorganicznymi – otrzymywanie alkoholi 1
o
o przedłużonym łańcuchu węglowym
CH
2
MgBr
1. Et
2
O
+
2. H
3
O
+
CH
2
H
2
C
O
tlenek etylenu
CH
2
CH
2
CH
2
OH
2-fenylopropan-1-ol
bromek benzylomagnezu
Et
2
O
R-CH
2
MgX
H
2
C
+
CH
2
MgX
H
3
O
A
N
O
CH
2
CH
2
O
alkohol 1
o
R-CH
2
CH
2
CH
2
OH
R-CH
2

Reakcje tlenku etylenu z alkoholami katalizowana
zarówno przez kwasy, jak i zasady
CH
3
CH
2
OCH
2
CH
2
OH
CH
3
CH
2
OH
+
H
+
CH
2
H
2
C
O
tlenek etylenu
lub NaOCH
2
CH
3
2-etoksyetanol
Reakcja tlenku etylenu z amoniakiem –
powstaje
etanoloamina, ważny składnik glicerofosfolipidów. Jako rozpuszczalnik
jest ona stosowana w przemyśle rafineryjnym do usuwania związków
siarki z produktów naftowych.
NH
2
CH
2
CH
2
OH
etanoloamina
NH
3
+
CH
2
H
2
C
O
tlenek etylenu
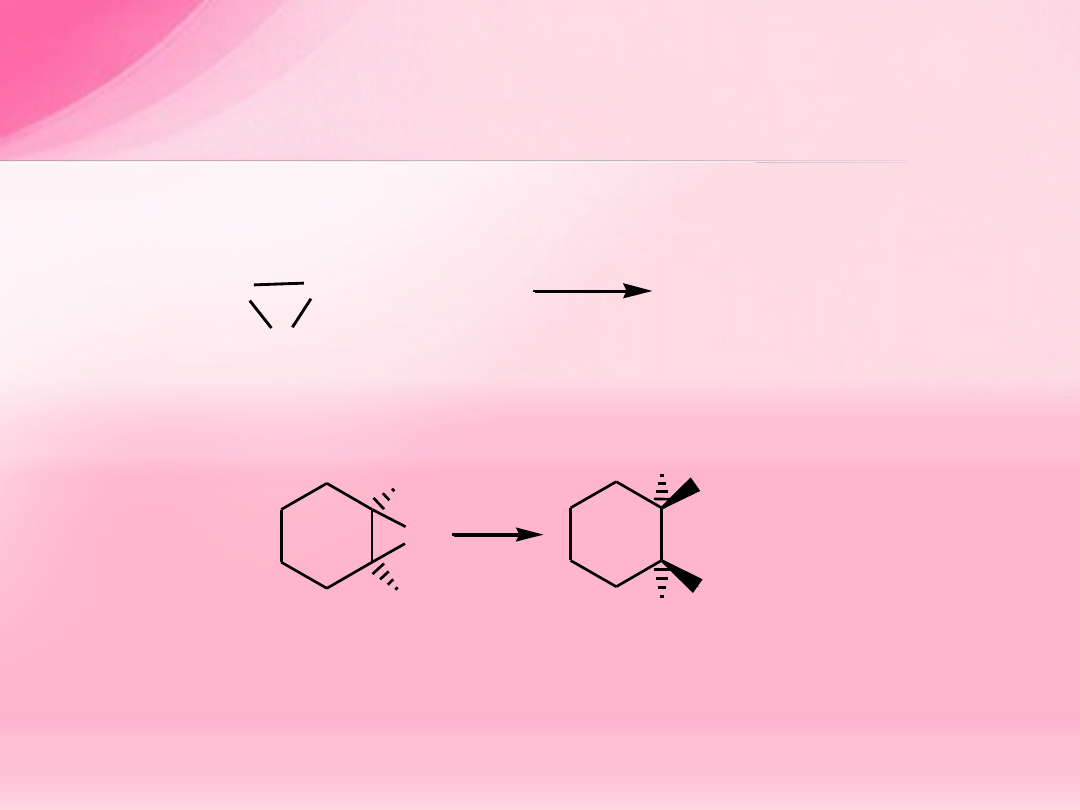
Reakcje tlenku etylenu z halogenowodorami
(HF, HCl, HBr, HI)
BrCH
2
CH
2
OH
2-bromoetanol
HBr
+
CH
2
H
2
C
O
tlenek etylenu
10
o
C
1,2-epoksycykloheksan
O
HBr
H
H
H
Br
OH
H
trans-2-bromocykloheksanol
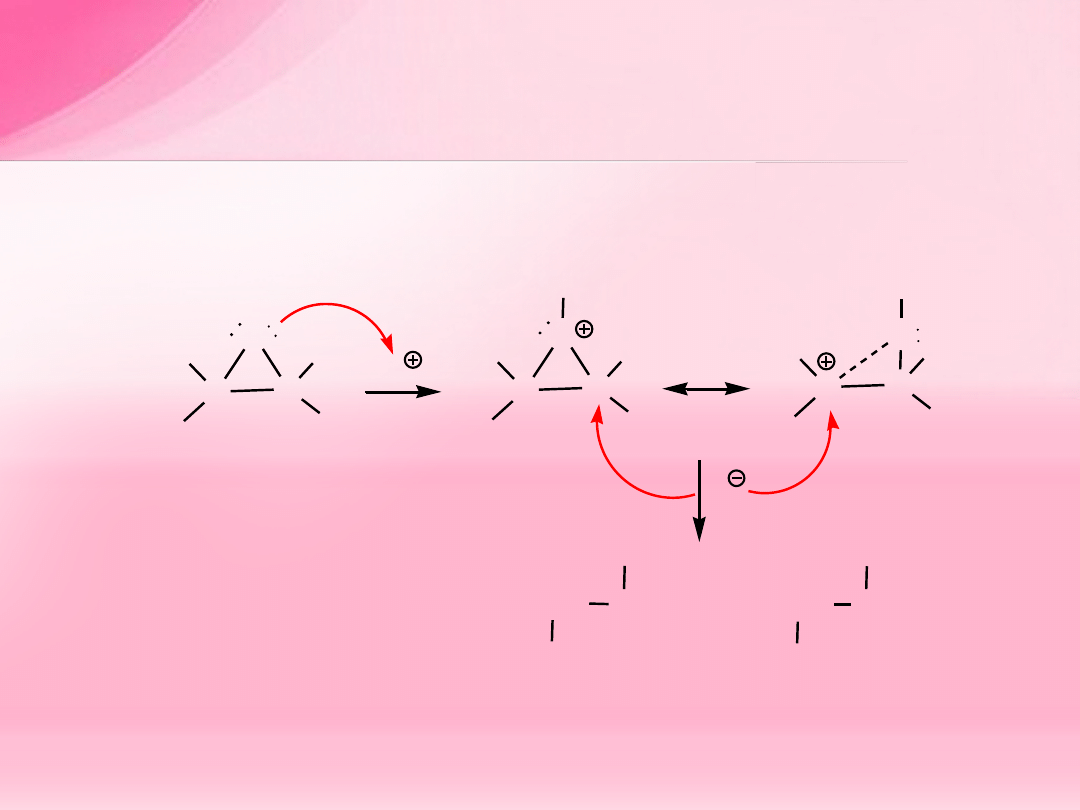
Reakcje epoksydów niesymetrycznych
z nukleofilami
W środowisku kwaśnym powstaje zwykle mieszanina produktów:
H
CH
3
CH CH
2
+
OH
C
C
O
H
H
H
3
C
H
Br
CH
3
CH CH
2
Br
OH
C
C
O
H
H
H
3
C
H
H
C
C
O H
H
H
3
C
H
H
Br
1-bromopropan-2-ol
1,2-epoksypropan
2-bromopropan-1-ol
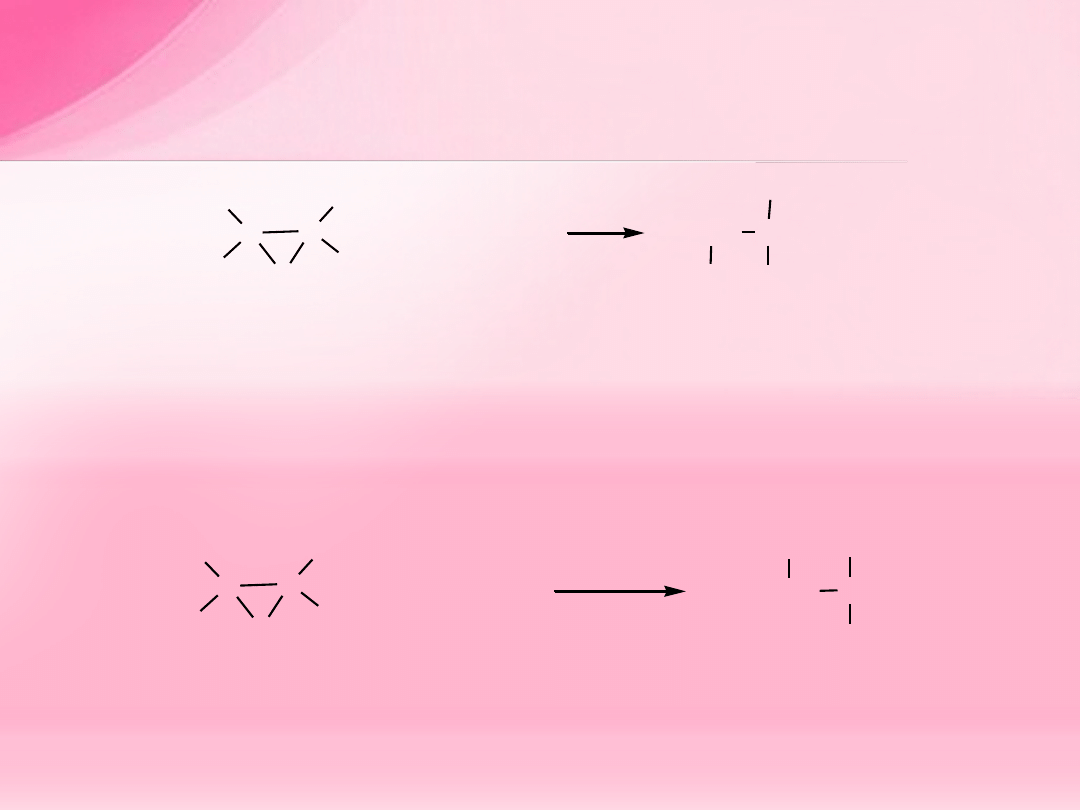
W środowisku zasadowym nukleofil przyłącza się do mniej
zatłoczonego atomu węgla:
CH
3
CH
CH
3
CH
2
OH
CCH
3
+
3-etoksy-2-metylobutan-2-ol
NaOCH
2
CH
3
CH
3
C
C
O
2,2,3-trimetylooksiran
(2,3-epoksy-3-metylobutan)
CH
3
CH
3
H
3
C
H
OH
CH
3
CH
2
O
CH
3
CH
CH
3
CH
2
OH
CCH
3
+
3-etoksy-3-metylobutan-2-ol
H
2
SO
4
OH
OCH
2
CH
3
C
C
O
2,2,3-trimetylooksiran
(2,3-epoksy-3-metylobutan)
CH
3
CH
3
H
3
C
H
CH
3
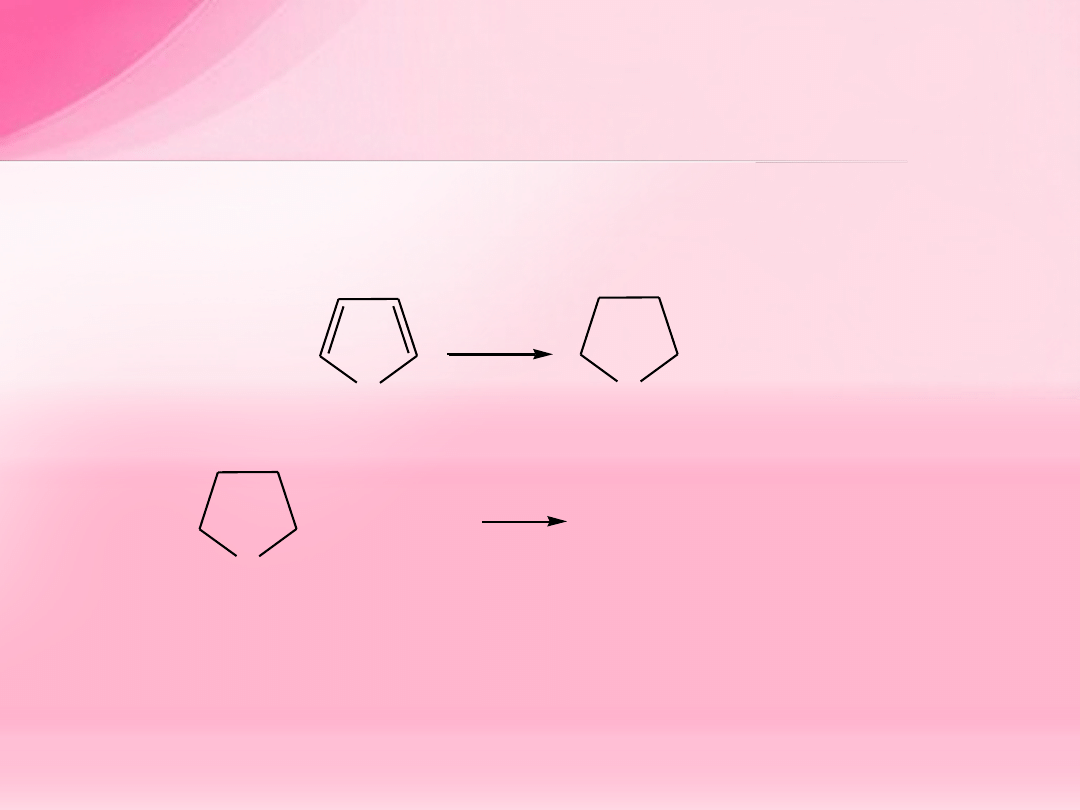
Etery cykliczne
o pierścieniach od pięcioczłonowego wzwyż,
właściwościami chemicznymi przypominają etery alifatyczne.
O
furan
H
2
/Ni
50
o
C
O
tetrahydrofuran
O
tetrahydrofuran
+ 2 HBr
BrCH
2
CH
2
CH
2
CH
2
Br
1,4-dibromobutan
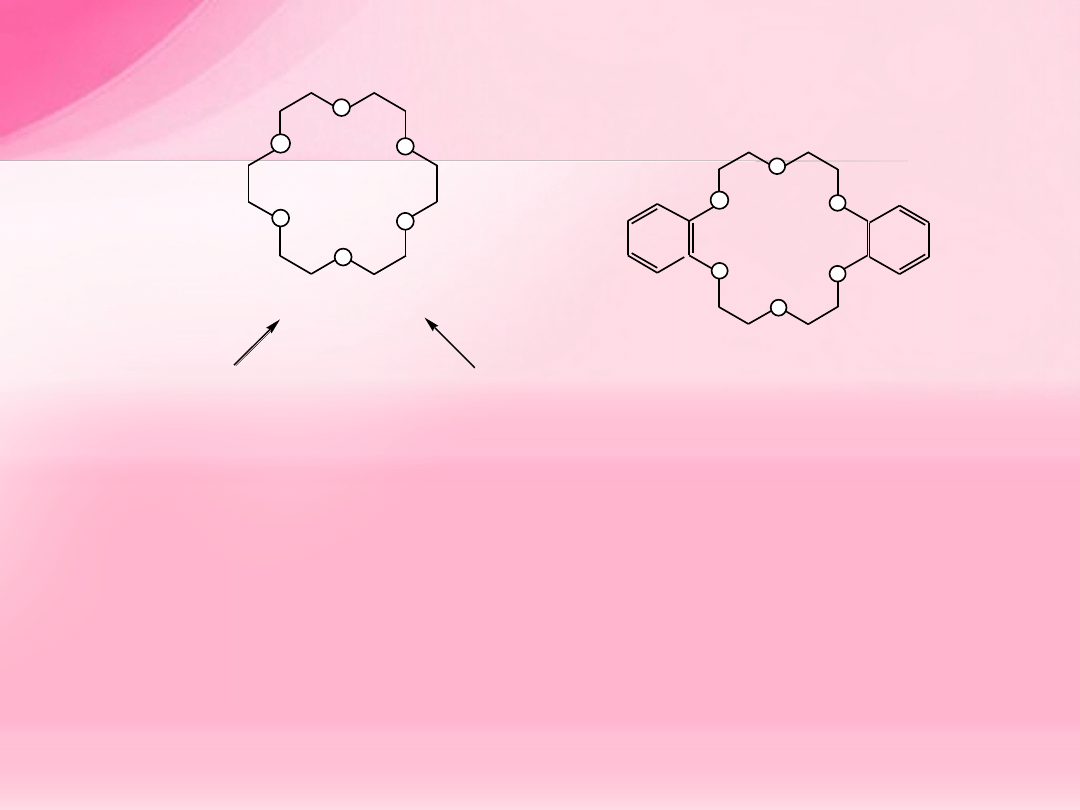
dibenzo-18-korona-6
Polietery, zwłaszcza makrocykliczne etery koronowe
[Nagroda Nobla w 1987
roku] znalazły zastosowanie jako katalizatory przeniesienia międzyfazowego. Kataliza
przeniesienia fazowego polega na wprowadzeniu do dwufazowego układu reakcyjnego
katalizatora, który transportuje odczynnik nieorganiczny z fazy wodnej do fazy
organicznej. Etery koronowe charakteryzują się zdolnością do solwatacji kationów,
dzięki zróżnicowanej wielkości pierścienia mogą wybiórczo solwatować określony
rodzaj kationu (np. sodu lub potasu). Dzięki lipofilowym właściwościom otoczki jonu
umożliwiają rozpuszczanie soli nieorganicznych w rozpuszczalnikach, takich jak
węglowodory czy fluorowcowęglowodory.
18-korona-6
liczba atomów
tworzących pierścień
liczba atomów
tlenu
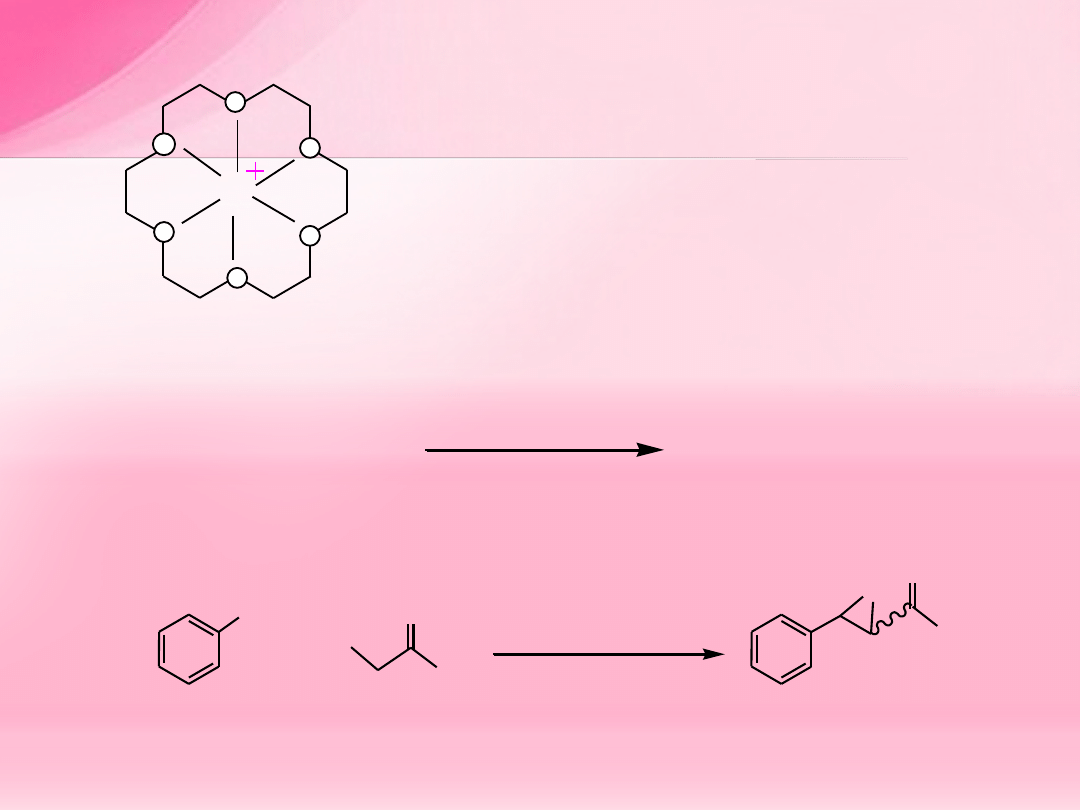
We wnętrzu każdej korony znajduje się wnęka
o określonych rozmiarach, otoczona przez atomy tlenu
zdolne do koordynowania kationów.
Kompleksowanie kationów przez eter koronowy ułatwia
rozpuszczanie soli nieorganicznych w rozpuszczalnikach
niepolarnych.
K
18-korona-6
1-bromooktan
18-korona-6
KF, benzen, 90
o
C
CH
3
(CH
2
)
6
CH
2
-Br
CH
3
(CH
2
)
6
CH
2
-F
1-fluorooktan
18-korona-6
(1% mol)
benzaldehyd
(aldehyd benzoesowy)
CHO
+
K
2
CO
3
, 15 min.
Cl
OEt
O
chlorooctan etylu
OEt
O
O
3-fenylo-2,3-epoksypropionian etylu
Pytanie
Podaj produkty następujących reakcji:
(Z)-pent-2-en
1. Na
HI
C
C
O
H
H
C
6
H
5
H
C
H
OH
Me
Et
2. CH
3
CH
2
I
?
a.
b.
1. AcOOH
2. H
3
O
+
?
c.
?
d.
CH
3
CH
3
O
CH
3
CH
2
SNa
?
CH
3
CH
2
SH
Odpowiedź
C
C
CH
3
OH
HO
H
C
H
OCH
2
CH
3
Me
Et
C
6
H
5
CHCH
2
OH
I
CH
3
CH
3
OH
SCH
2
CH
3
H
CH
3
CH
2

Dziękuję za uwagę
Wyszukiwarka
Podobne podstrony:
11 Etery epoksydy i sulfidy 6 13 06 2011 zadania
etery, epoksydy reakcje
1 Etery i epoksydy, BIOFIZYKA TOKSYKOLOGIA ANALITYCZNA POLIMEROW OLIMPIADY
Etery 2 id 164359 Nieznany
Alkohole, tiole, fenole i etery wiadomosci ogolne id 58092
zywice epoksydowe 1 id 107078 Nieznany
inne estry i etery winylowe
Etery analityka
ETERY
Etery chlorometylowoalkilowe
ETERY 3
S2 Etery, Kosmetologia - studia (Szczecin)
5 Alkohole fenole etery materiały
etery
Rozpuszczalniki organiczne pochodne chloroorganiczne, etery, ppt
Alkohole, fenole, etery
10. Etery, , chemi pwr, chemia organiczna
Żywice epoksydowe, II rok, żywice, prezentacje
więcej podobnych podstron