1
Wpływ środowiska na reakcje redoks –
wpływ pH na przebieg reakcji redoks
]
[
]
][
[
log
5
059
,
0
2
8
4
Mn
H
MnO
E
E
o
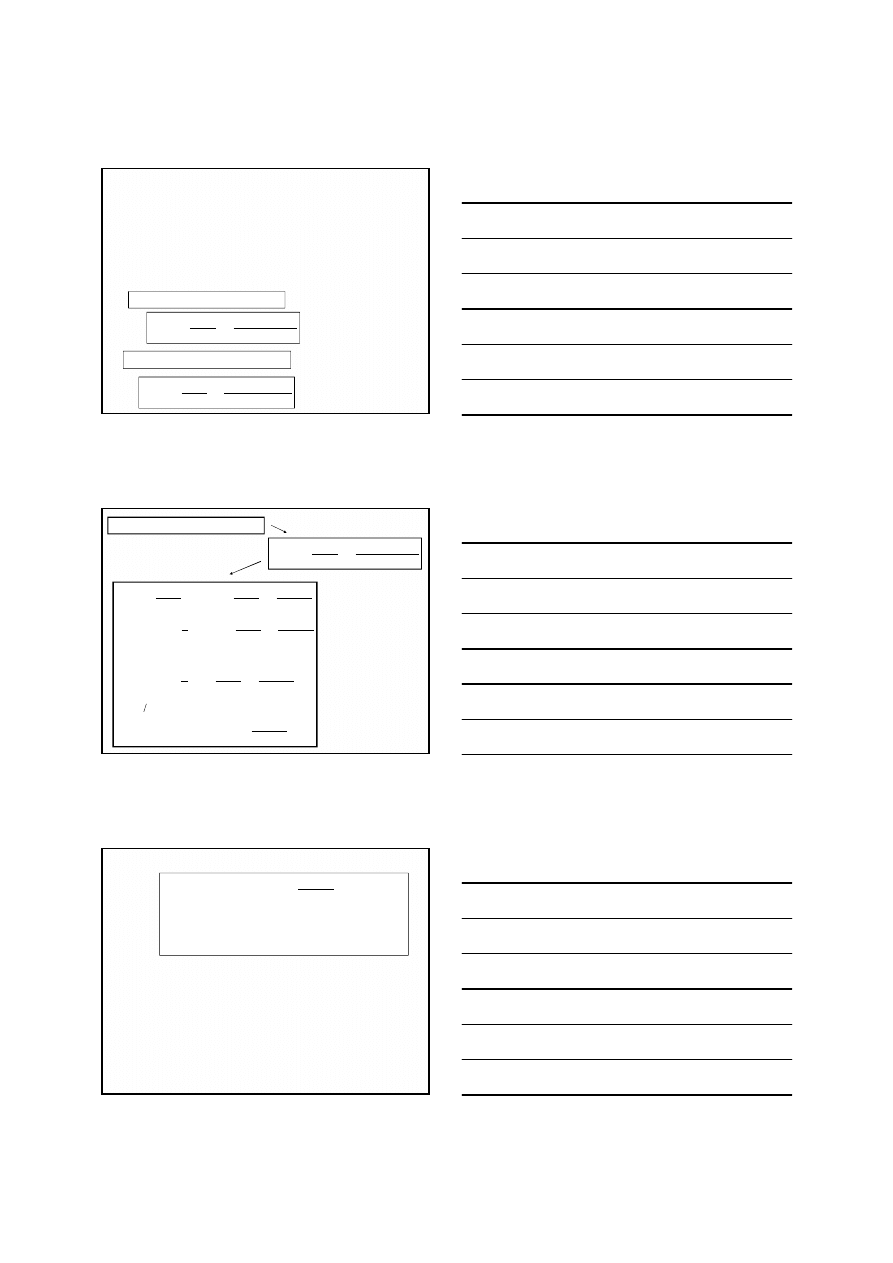
Wpływ stężenia jonów wodorowych na wartość
potencjału redoks uwidacznia się, gdy w reakcji biorą
udział jony H
+
lub OH
-
np.
O
H
Mn
e
H
MnO
2
2
4
4
5
8
O
H
Cr
e
H
O
Cr
2
3
2
7
2
7
2
6
14
2
3
14
2
7
2
]
[
]
][
[
log
6
059
,
0
Cr
H
O
Cr
E
E
o
W reakcjach tych
jony H
+
wiążą
atomy tlenu
i wzrost ich stężenia
bardzo zwiększa
potencjał redoks
układu
]
[
]
][
[
log
5
059
,
0
2
8
4
0
Mn
H
MnO
E
E
O
H
Mn
e
H
MnO
2
2
4
4
5
8
]
[
]
[
log
012
,
0
094
,
0
52
,
1
52
,
1
]
[
]
[
log
5
059
,
0
5
8
059
,
0
]
log[
]
[
]
[
log
5
059
,
0
]
log[
5
8
059
,
0
]
[
]
[
log
5
059
,
0
]
log[
5
059
,
0
2
4
2
4
2
4
2
4
8
2
4
Mn
MnO
pH
E
V
E
Mn
MnO
pH
E
E
H
pH
Mn
MnO
H
E
E
Mn
MnO
H
E
E
Mn
MnO
o
o
o
o
V
E
V
E
Mn
MnO
Mn
MnO
pH
E
95
,
0
0
57
,
0
52
,
1
1
log
012
,
0
6
094
,
0
52
,
1
24
,
1
0
28
,
0
52
,
1
1
log
012
,
0
3
094
,
0
52
,
1
]
[
]
[
]
[
]
[
log
012
,
0
094
,
0
52
,
1
2
4
2
4
pH = 3 →
pH = 6 →
Jak wynika z przedstawionych
obliczeń, gdy reakcja redoks
przebiega z udziałem jonów
wodorowych, zmniejszenie pH, czyli
zwiększenie kwasowości środowiska,
zwiększa potencjał utleniający układu
2
Wpływ pH na przebieg reakcji redoks
W przypadku układów redoks, których potencjał zależy
od stężenia w roztworze jonów H
3
O
+
(jon hydroniowy),
można wpływać na kierunek przebiegu reakcji poprzez
zmianę pH roztworu.
H
I
AsO
O
H
I
AsO
O
H
I
AsO
O
H
I
AsO
2
2
lub
2
2
3
3
4
2
2
3
3
3
3
4
2
2
3
3
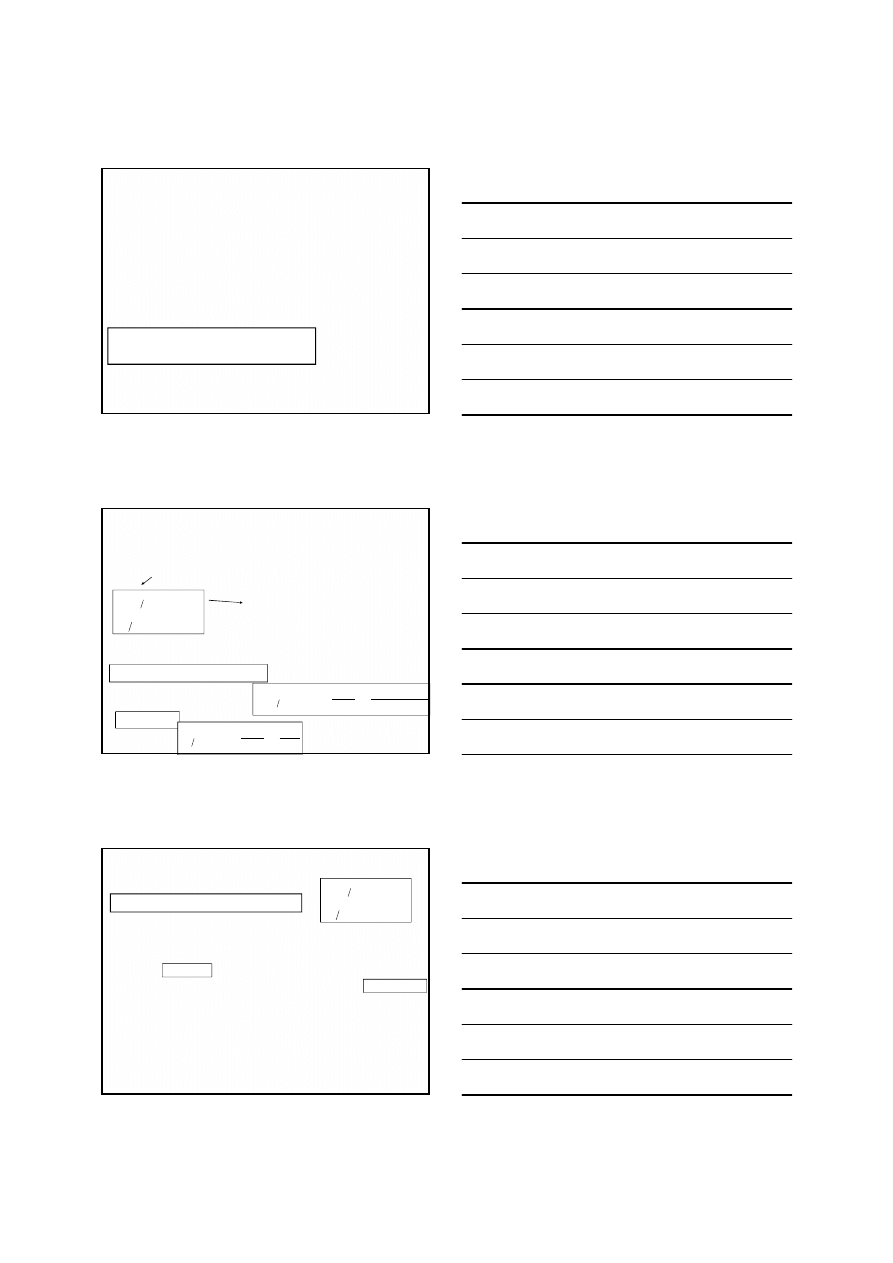
Typowym przykładem jest reakcja arsenianu(III) z jodem:
Wpływ pH na przebieg reakcji redoks
Potencjały normalne układów biorących udział w tej
reakcji są bardzo zbliżone i wynoszą
V
E
V
E
o
I
I
o
AsO
AsO
53
,
0
58
,
0
2
2
3
3
3
4
Gdy potencjały normalne
dwóch układów są zbliżone, to reakcje
redoks są odwracalne
O
H
AsO
e
H
AsO
2
3
3
3
4
2
2
]
[
]
][
[
log
2
059
,
0
58
,
0
3
3
2
3
4
3
3
3
4
AsO
H
AsO
E
AsO
AsO
I
e
I
2
2
2
Równania połówkowe układów redoks mają postać
2
2
2
]
[
]
[
log
2
059
,
0
53
,
0
2
I
I
E
I
I
Wpływ pH na przebieg reakcji redoks
H
I
AsO
O
H
I
AsO
2
2
3
4
2
2
3
3
V
E
V
E
o
I
I
o
AsO
AsO
53
,
0
58
,
0
2
2
3
3
3
4
Aby zachodziła reakcja utleniania arsenianu(III) jodem
(z lewej strony na prawą) należy zmniejszyć potencjał
układu przez zwiększenie pH do 7, wówczas
potencjał układu przy założeniu upraszczający
wynosi 0,17V.
]
[
]
[
3
3
3
4
AsO
AsO
3
3
3
4
/ AsO
AsO
Reakcję utleniania prowadzi się po dodaniu NaHCO
3
,
który ulega w środowisku kwaśnym częściowemu
rozkładowi. Otrzymuje się w ten sposób mieszaninę
buforową zawierającą NaHCO
3
i CO
2
, której pH
wynosi ok. 7.
3
Wpływ pH na przebieg reakcji redoks
H
I
AsO
O
H
I
AsO
2
2
3
4
2
2
3
3
V
E
V
E
o
I
I
o
AsO
AsO
53
,
0
58
,
0
2
2
3
3
3
4
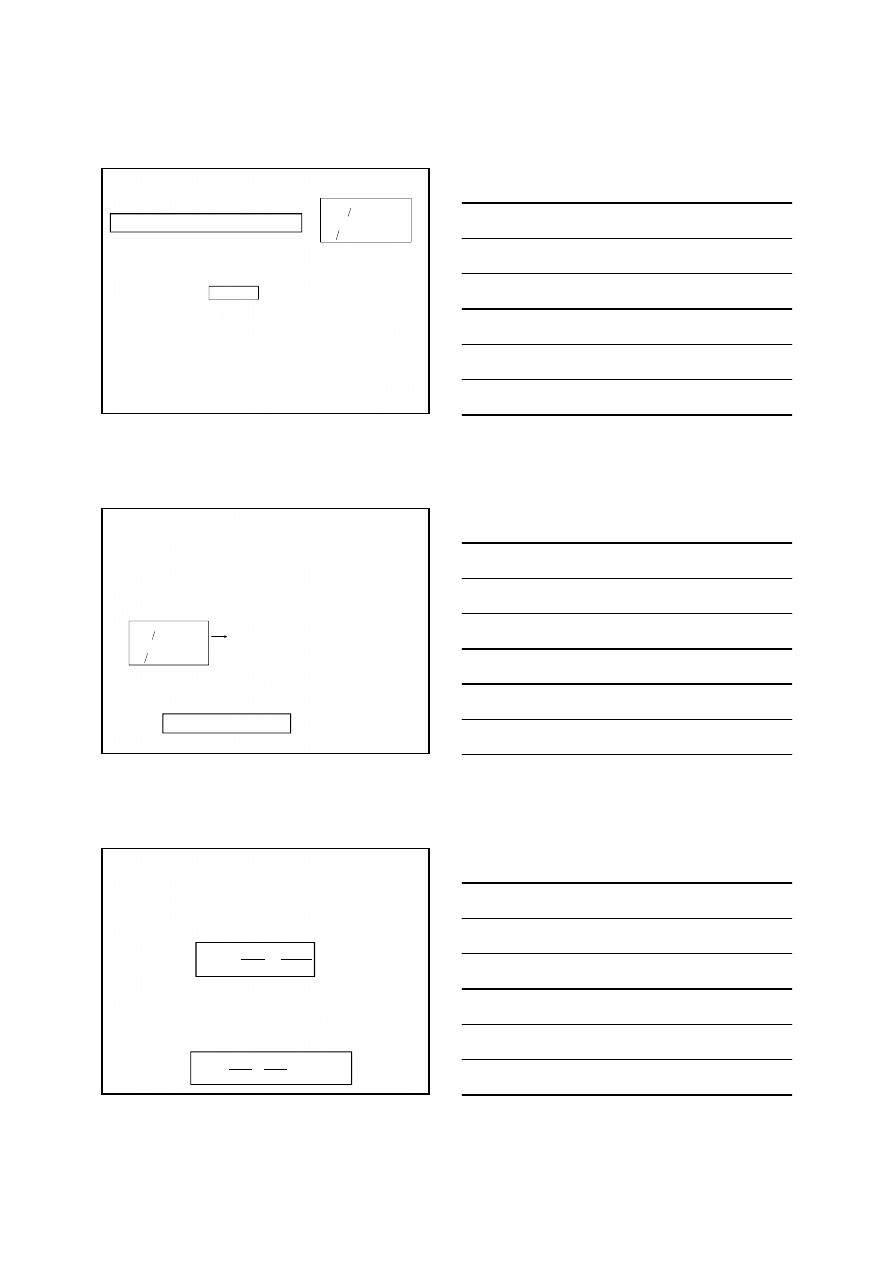
Aby zachodziła reakcja redukcji arsenianu(V) jonami
jodkowymi (z prawej strony na lewą) należy zwiększyć
potencjał układu przez zmniejszenie pH
(zwiększenie stężenia jonów wodorowych)
3
3
3
4
/ AsO
AsO
Reakcja, w której jony jodkowe redukują arsenian(V)
do arsenianu(III) wykorzystywana jest do
jodometrycznego oznaczania arsenianów(V)
Wpływ reakcji kompleksowania i wytrącania
osadów na potencjał redoks
Przykładem wpływu reakcji wytrącania osadów na
potencjał układu redoks może być jodometryczne
oznaczanie Cu
2+
2
2
2
4
2
I
CuI
I
Cu
V
E
V
E
o
I
I
o
Cu
Cu
53
,
0
17
,
0
2
2
2
Należy przywidywać, że jony Cu
+
powinny być utleniane przez jod do
Cu
2+
W rzeczywistości zachodzi reakcja w odwrotnym
kierunku
Wpływ reakcji kompleksowania i wytrącania
osadów na potencjał redoks
Wytłumaczenie tego przebiegu reakcji jest następujące:
potencjał redoks układu Cu
2+
/Cu
+
wynosi
]
[
]
[
log
1
059
,
0
17
,
0
2
Cu
Cu
E
Wskutek wytrącania trudno rozpuszczalnego osadu CuI, w
roztworze pozostaje bardzo małe stężenie jonów Cu
+
. Iloczyn
rozpuszczalności CuI wynosi ok. 10
-12
, a więc stężenie jonów
Cu
+
w roztworze 0,1 mol/L KI wyniesie
L
mol
I
Cu
/
10
10
10
]
[
10
]
[
11
1
12
12
4
Wpływ reakcji kompleksowania i wytrącania
osadów na potencjał redoks
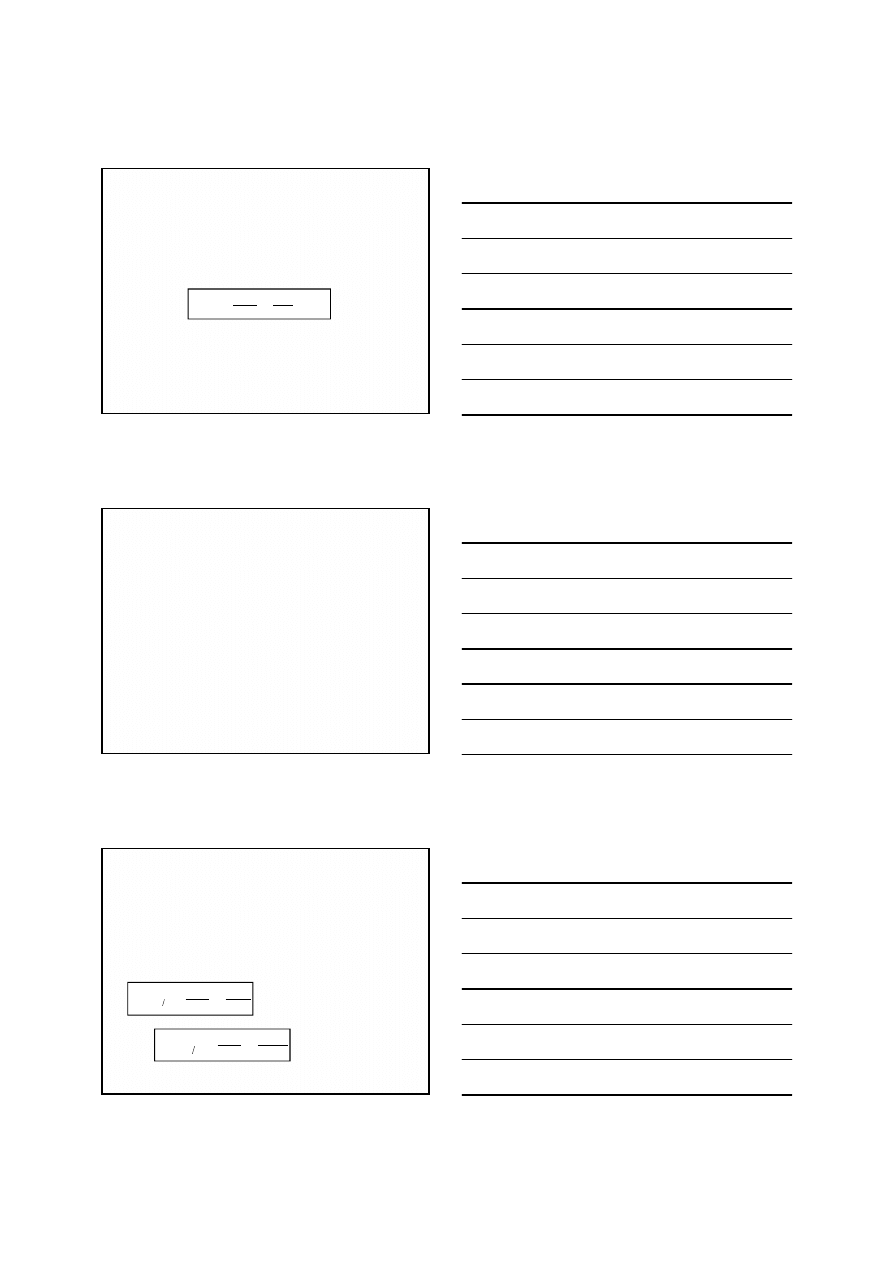
Wobec tak małego stężenia formy zredukowanej, potencjał
układu ulegnie znacznemu zwiększeniu, osiągają dla
roztworu soli miedzi(II) o stężeniu 0,1 mol/L wartość
V
E
76
,
0
10
10
log
1
059
,
0
17
,
0
11
1
Dzięki tak dużemu wzrostowi potencjału (z 0,17 V do
0,76 V) jony Cu
2+
utleniają jony I
-
i reakcja przebiega w
kierunku tworzenia CuI i I
2
.
Krzywa miareczkowania redoks
Rozpatrzymy przebieg miareczkowania jonów żelaza(II)
jonami ceru(IV) w środowisku 1 mol/L kwasu
solnego.
Do obliczeń przyjęto potencjały formalne odpowiednich
układów redoks: E
f
Fe(III)/Fe(II)
=0,67 V, E
f
Ce(IV)/Ce(III)
=1,28V
Reakcja utleniania Fe(II) za pomocą Ce(IV) przebiega
zgodnie z równaniem:
Fe(II) + Ce(IV) → Fe(III) + Ce(III)
Krzywa miareczkowania redoks
Przed punktem równoważnikowym miareczkowania
(przed osiągnięciem PR) potencjał redoks zależy od
stosunku stężeń układu miareczkowanego, np.
Fe(III)/Fe(II) w przypadku miareczkowania jonów
Fe(II) jonami Ce(IV).
]
[
]
[
log
059
,
0
1
1
1
1
1
1
red
utl
n
E
E
f
red
utl
]
[
]
[
log
1
059
,
0
2
3
1
2
3
Fe
Fe
E
E
f
Fe
Fe
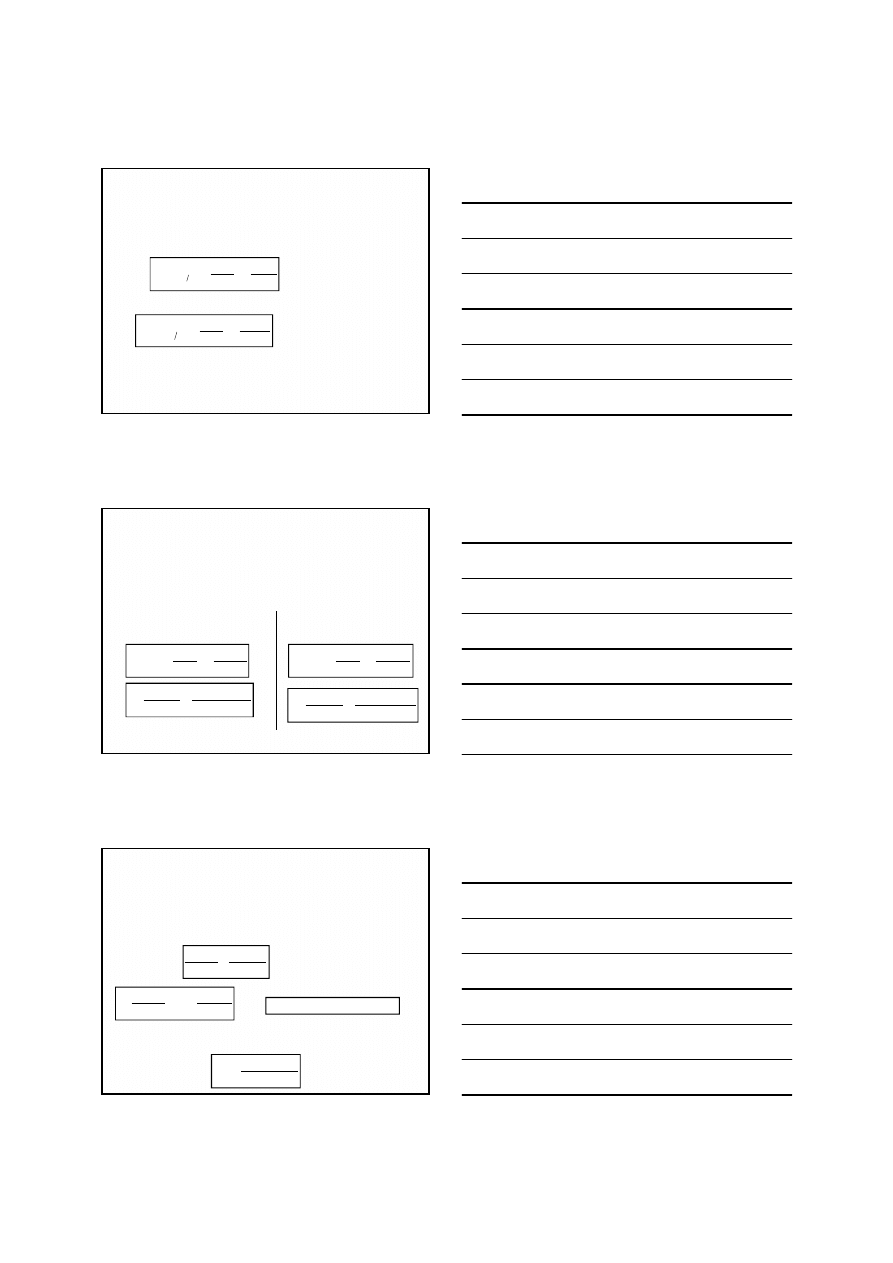
5
Krzywa miareczkowania redoks
Po przekroczeniu PR potencjał roztworu zależy od
układu titranta, np. Ce(IV)/Ce(III)
]
[
]
[
log
059
,
0
2
2
2
2
2
2
red
utl
n
E
E
f
red
utl
]
[
]
[
log
1
059
,
0
3
4
2
3
4
Ce
Ce
E
E
f
Ce
Ce
Krzywa miareczkowania redoks
W punkcie równoważnikowym – potencjały redoks
obu reagujących układów mają identyczne wartości:
E
1
= E
2
= E
PR
Ze wzoru dla pierwszego
układu:
PR
PR
f
PR
red
utl
n
E
E
]
[
]
[
log
059
,
0
1
1
1
1
059
,
0
)
(
]
[
]
[
log
1
1
1
1
n
E
E
red
utl
f
PR
PR
PR
Ze wzoru dla drugiego
układu:
PR
PR
f
PR
red
utl
n
E
E
]
[
]
[
log
059
,
0
2
2
2
2
059
,
0
)
(
]
[
]
[
log
2
2
2
2
n
E
E
red
utl
f
PR
PR
PR
Krzywa miareczkowania redoks
W punkcie równoważnikowym stosunek stężeń postaci
utlenionej do zredukowanej reduktora musi być równy
stosunkowi stężeń postaci zredukowanej do utlenionej
utleniacza
PR
PR
PR
PR
utl
red
red
utl
]
[
]
[
]
[
]
[
2
2
1
1
czyli
PR
PR
PR
PR
red
utl
red
utl
]
[
]
[
log
]
[
]
[
log
2
2
1
1
2
2
1
1
)
(
)
(
n
E
E
n
E
E
f
PR
f
PR
i
Po przekształceniu równania 3 otrzymuje się wzór na
potencjał redoks w punkcie równoważnikowym
2
1
2
2
1
1
n
n
n
E
n
E
E
f
f
PR
(3)
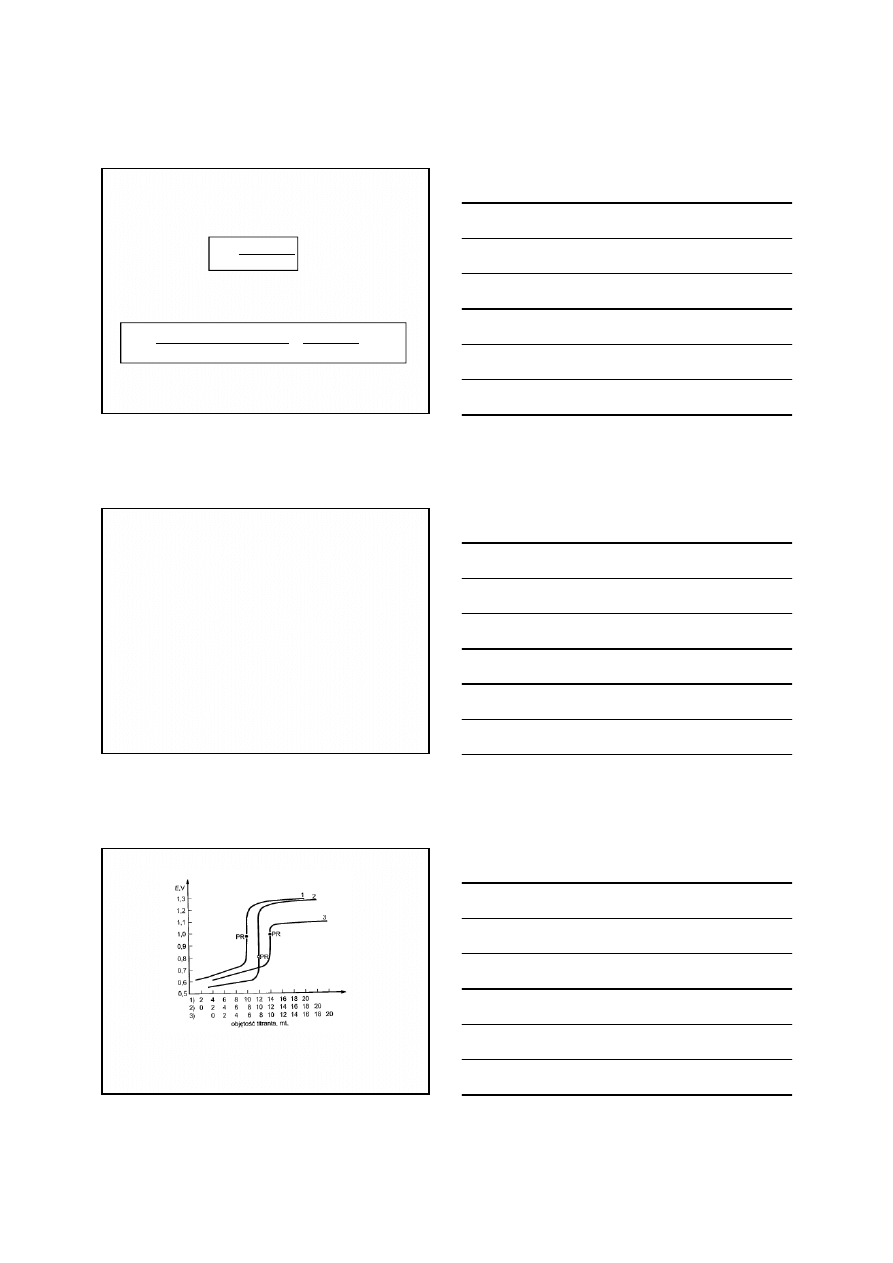
6
Krzywa miareczkowania redoks
Wzór na potencjał redoks w punkcie równoważnikowym
2
1
2
2
1
1
n
n
n
E
n
E
E
f
f
PR
W rozpatrywanym przypadku miareczkowania Fe(II) za
pomocą Ce(IV) potencjał w PR miareczkowania wynosi:
V
n
n
E
E
E
f
III
Ce
IV
Ce
f
II
Fe
III
Fe
PR
98
,
0
2
28
,
1
67
,
0
2
1
)
(
/
)
(
)
(
/
)
(
Krzywa miareczkowania redoks
Jeżeli reakcje połówkowe obu reagujących układów redoks
są równoelektronowe (n
1
= n
2
), krzywa miareczkowania jest
symetryczna względem PR (np. w przypadku układów
Fe(III)/Fe(II) i Ce(IV)/Ce(III), gdzie n = 1), jeżeli natomiast
n
1
nie równa się n
2
, krzywa miareczkowania jest
niesymetryczna w stosunku do PR.
Rozcieńczanie roztworu podczas miareczkowania ma tylko
niewielki wpływ na wartość potencjału redoks, a więc i na
kształt krzywej miareczkowania; może ono jedynie nieco
zmieniać wartość potencjału formalnego (ze względu na
zmiany mocy jonowej i stężenia kwasu), natomiast w
drugim członie wzoru Nernsta występuje stosunek stężeń, a
ten nie ulega zmianie przy rozcieńczaniu roztworu
Krzywe miareczkowania redoks
Krzywe miareczkowania redoks: 1) 10 mL roztworu Fe(II)
roztworem Ce(IV), 2) 10 mL roztworu As(III) roztworem
Ce(IV), 3) 10 mL roztworu Fe(II) roztworem Cr
2
O
7
2-
w
środowisku 1 mol/L kwasu solnego.
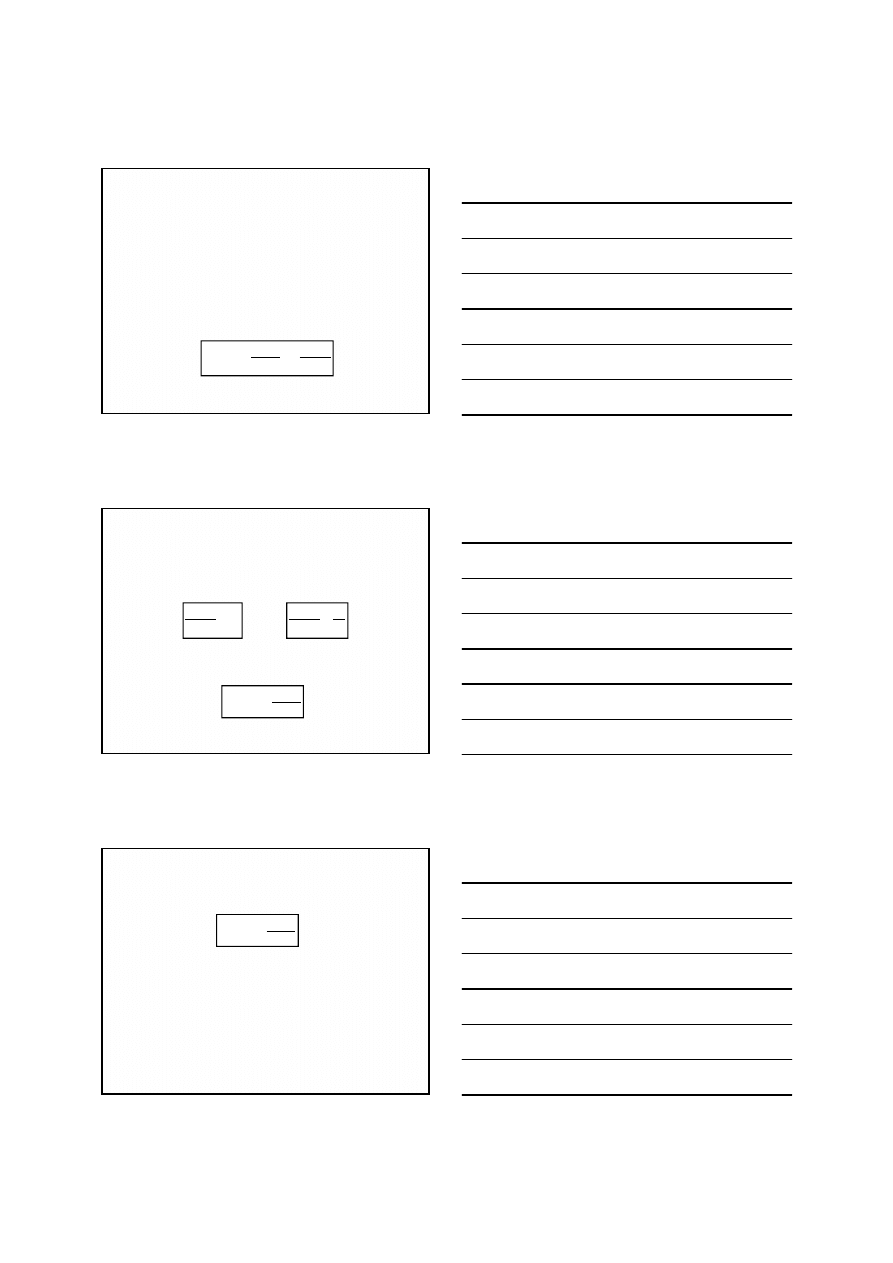
7
Niespecyficzne wskaźniki redoks
Reakcja „połówkowa” odpowiedzialna za zmianę barwy w
typowych niespecyficznych wskaźnikach redoks może być
zapisana:
In
ox
+ ne
-
↔ In
red
gdzie: In
ox
– postać utleniona wskaźnika
In
red
– postać zredukowana wskaźnika
Układ redoks utworzony przez wskaźnik ma potencjał
określany wzorem:
]
[
]
[
log
059
,
0
0
red
ox
In
In
In
n
E
E
gdzie: E
0
In
– normalny potencjał redoks wskaźnika, w którym
[In
ox
]=[In
red
]
Niespecyficzne wskaźniki redoks
Barwa wskaźnika zależy od stosunku stężeń postaci
utlenionej i zredukowanej. Zakładając, że podobnie jak w
przypadku wskaźników alkacymetrycznych obserwuje się
zabarwienie tylko jednej postaci przy stosunkach stężeń
10
1
]
[
]
[
red
ox
In
In
10
]
[
]
[
red
ox
In
In
otrzymuje się obszar zmiany barwy wskaźnika w granicach
wartości potencjału redoks
n
E
E
In
059
,
0
0
lub
Niespecyficzne wskaźniki redoks
Zmiana potencjału wymagana do pełnej zmiany barwy
wskaźnika
n
E
E
In
059
,
0
0
Z równania tego wynika, że typowy wskaźnik niespecyficzny
redoks wykazuje zauważalną zmianę barwy wtedy, gdy titrant
powoduję zmianę potencjału układu z E
0
In
+ 0,059/n do
E
0
In
– 0,059/n, czyli o około 0,118/n V.
Wyszukiwarka
Podobne podstrony:
P 10 id 343561 Nieznany
Materialy pomocnicze 4 id 28534 Nieznany
dodawanie do 10 4 id 138940 Nieznany
ldm rozmaite 10 id 264068 Nieznany
Dubiel LP01 MRS 10 id 144167 Nieznany
I CSK 305 10 1 id 208211 Nieznany
IMG 10 id 211085 Nieznany
na5 pieszak 03 02 10 1 id 43624 Nieznany
img 10 id 211004 Nieznany
cwicz 10 F id 124010 Nieznany
IMG 10 id 210949 Nieznany
Chemia 10 3 id 111757 Nieznany
IMG 10 id 210983 Nieznany
BiolMol 10 id 87436 Nieznany
egzamin09 10 id 153651 Nieznany
ETI Semestr 5 inz 10 10 id 1644 Nieznany
DrgAE Wym 10 id 141914 Nieznany
więcej podobnych podstron