
1
Wykorzystane materiały
– S. Thomas, M. Zalbowitz, Fuel Cells-Green Power, Los Alamos National
Laboratory, 1999
• www.education.lani.gov
• http://fuelcellworks.com
• www.h-tec.com
• www.hynet.info
• Vailant GmbH

2
Wodór
• Wodór jest najpowszechniej występującym
pierwiastkiem we Wszechświecie. Występuje
w gwiazdach i obłokach międzygwiazdowych.
• W stanie wolnym występuje w postaci
gazowych cząsteczek dwuatomowych H
2
,
tworząc wodór cząsteczkowy. Na Ziemi w
tej postaci występuje w górnej warstwie
atmosfery (0,9%).
• W postaci związanej wchodzi w skład wielu
związków nieorganicznych (np.: wody,
kwasów, zasad, wodorotlenków) oraz
związków organicznych (węglowodory i ich
pochodne)

3
Wodór - historia
• Prawdopodobnie pierwszą osobą, która opisała
otrzymywanie wodoru w stanie czystym był
alchemik
Paracelsus żyjący w latach 1493–1541. Paracelsus
wykonywał eksperymenty polegające na wrzucaniu metali do
kwasów i zbieraniu do naczyń gazowych produktów tych
reakcji, co do dzisiaj stanowi najprostszy sposób
otrzymywania tego pierwiastka w warunkach
laboratoryjnych.
• Eksperymenty te powtórzył w 1661 r. Robert Boyle.
• Pierwszą osobą, która uznała wodór za pierwiastek, a
właściwie flogiston, czyli "pierwiastek palności", będący
przedmiotem błędnej teorii flogistonowej i reliktem
wielowiekowej tradycji alchemii, był Henry Cavendish (1766).
• Pristley opisał wybuchową naturę mieszanki wodoru z
powietrzem, zwanej dziś mieszaniną piorunującą, a wówczas
aria tonante - z włoskiego - "powietrze grzmiące".
• Pierwotnie polska nazwa, przetłumaczona z łaciny przez
Jędrzeja Śniadeckiego brzmiała "wodoród". Nazwę tą przyjęli
także Chodkiewicz,
Fonberg
, Krzyżanowski i Radwański,
który używał także nazwy "lżeń". Z biegiem czasu została
skrócona do powszechnie dziś znanej którą Jako pierwszy
nazwę "wodór" zaproponował
Filip Walter
, co zatwierdziła
krakowska
Akademia Umiejętności
w roku
1900
.

4
Wodór - historia
• aria tonante - z włoskiego - "powietrze grzmiące„
(Volta, 1776)
• O słuszności nazwy przekonał się na własnej skórze
Pilatre Rozier. Na wieść o doświadczeniach
Cavendisha postanowił je powtórzyć. Łykał
„powietrze palne” i wydmuchiwał je przez otwarte
usta na płomień. Gdy powtórzył doświadczenie,
zastępując czyste „powietrze palne” przez jego
mieszaninę z powietrzem zwykłym nastąpił wybuch.
„Miałem wrażenie, że mi wszystkie zęby
wylecialy”
– żalił się później.

5
Położenie wodoru w układzie
okresowym i jego ogólne
właściwości
•
1.
Struktura elektronowa atomu wodoru: 1s
1
• Stopnie utlenienia wodoru: +1 i –1:
• *Podobieństwo do litowców
•
+ 1 stopień utlenienia (H
+
), np. H, H
2
O, H
2
SO
4
• *Podobieństwo do fluorowców
• - 1 stopień utlenienia (H
-
) wodorki metali (np.
LiH),
• - nietrwały w obecności wody:
• H
-
+ H
2
O = H
2
+ OH
-
•
•
- elektroujemność (wg. P):
• H
2,1
• Litowce
1 - 0,7
• Fluorowce
4 - 2,2

6
Kation wodorowy
• Kation wodorowy H
+
jest w istocie
równoważny protonowi. W stanie wolnym
występuje on w próżni, plazmie i górnych
warstwach atmosfery ziemskiej (promienie
UV jonizują atomy wodoru). W roztworach
wodnych kation ten jest natychmiast
solwatowany do jonu hydroniowego H
3
O
+
:
H
+
+ H
2
O → H
3
O
+
• Czasami, w równaniach dysocjacji
elektrolitycznej podaje się uproszczenie
H
3
O
+
i pisze się po prostu H
+
, co zupełnie
mija się z prawdą. Z tego względu należy
pamiętać, że skala pH jest miarą aktywności
jonów hydroniowych, a nie wodorowych.

7
Metody otrzymywania wodoru
•
Rozkład wody
•
Niektóre metale roztwarzają się w wodzie.
Przykład: sód
2Na + 2H
2
O = H
2
+ 2Na
+
+ 2OH
-
•
W wodzie roztwarzają się także: Li, K,
Rb, Cs, Ca, Sr, Ba
•
Elektroliza wody - wodnych roztworów
elektrolitów, np. NaCl
•
katoda : 2H
+
+ 2e = H
2

8
Metody otrzymywania wodoru
•
Z kwasów i zasad w reakcji z metalami
nieszlachetnymi
•
metal nieszlachetny + kwas wodór
•
Zn + 2H
+
= Zn
2+
+ H
2
•
Fe + 2H
+
= Fe
2+
+ H
2
• amfoteryczny metal nieszlachetny + zasada
wodór
•
Zn + 2OH
-
+ 2H
2
O = [Zn(OH)
4
]
2-
+ H
2
• 2Al + 2OH
-
+ 6H
2
O = 2[Al(OH)
4
]
-
+ 3H
2

9
Metody otrzymywania wodoru
• Reakcja Boscha (metoda Boscha) - reakcja chemiczna uzyskiwania
wodoru przez rozpad pary wodnej przy użyciu rozżarzonego koksu.
• Reakcja zachodzi w temperaturze ok. 1 200°C. W jej wyniku
otrzymuje się pierwotnie tzw. gaz wodny
(CO+H
2
).
C + H
2
O → CO + H
2
Gaz ten następnie mieszany jest z parą wodną. W dalszym
procesie w temperaturze 300-450°C gaz wodny poddaje się
konwersji na katalizatorze Fe
2
O
3
i Cr
2
O
3
. W wyniku tego
wydziela się dwutlenek węgla (CO
2
).
CO + H
2
+ H
2
O → CO
2
+ 2H
2
Mieszaninę gazów oczyszcza się z CO
2
. Przy ciśnieniu rzędu 10-30
MPa większa jego część jest pochłaniana w wodzie. Resztkowe ilości
dwutlenku węgla pochłaniane są następnie przez roztwór NaOH.

10
Metody otrzymywania wodoru
Z gazu ziemnego (katalizator: Ni, 700 K)
CH
4
+ 2H
2
O = CO + 3H
2
CO + H
2
O = CO
2
+ H
2
termiczny rozpad CH
4
2CH
4
→ C
2
H
2
+ 3H
2
(T=2000 °C)
reakcje metanu z tlenem
2CH
4
+ O
2
→ 2CO + 4 H
2

11
Elektroliza wody

12
Elektroliza wody
Proces
rozkładu
wody
prądem
elektrycznym
w
celu
otrzymania
wodoru
i
tlenu.
Ponieważ
czysta
woda
praktycznie
nie
przewodzi
prądu
elektrycznego
jako
elektrolit stosuje się rozcieńczony roztwór kwasu siarkowego
lub
wodorotlenku
sodowego.
Proces
prowadzi
się
w
elektrolizerach
wyposażonych
w
kilkadziesiąt
elektrod
stalowych i przepony azbestowe oddzielające część anodową
od katodowej. Wodór i tlen produkuje się metodą e.w. w
przypadku dysponowania tanią energią elektryczną. Rozwój
przemysłu petrochemicznego i przeróbka gazu ziemnego,
będących tańszym źródłem wodoru, spowodował, że e.w.
straciła znaczenie.
Proces
rozkładu
wody
prądem
elektrycznym
w
celu
otrzymania
wodoru
i
tlenu.
Ponieważ
czysta
woda
praktycznie
nie
przewodzi
prądu
elektrycznego
jako
elektrolit stosuje się rozcieńczony roztwór kwasu siarkowego
lub
wodorotlenku
sodowego.
Proces
prowadzi
się
w
elektrolizerach
wyposażonych
w
kilkadziesiąt
elektrod
stalowych i przepony azbestowe oddzielające część anodową
od katodowej. Wodór i tlen produkuje się metodą e.w. w
przypadku dysponowania tanią energią elektryczną. Rozwój
przemysłu petrochemicznego i przeróbka gazu ziemnego,
będących tańszym źródłem wodoru, spowodował, że e.w.
straciła znaczenie.

13
Elektroliza: rozważmy elektrolizę roztworu
NaCl, którego stężenie wynosi 1mol/dm
3
Możliwe reakcje utlenienia:
2Cl
–
(aq) = Cl
2
(g) + 2e
–
E° = 1.358 V
2H
2
O = 4H
+
(aq) + O
2
(g) + 4e
–
E° = 0.82 V
(zjawisko nadnapięcia powoduje,że E utleniania wody
wynosi 1.4 V)
Możliwe reakcje redukcji:
Na
+
(aq) + e
–
= Na(s)
E° = –2.713 V
2H
2
O + 2e
–
= H
2
(g) + 2OH
–
(aq)
E° = -0.42 V
(zjawisko nadnapięcia powoduje,że E redukcji wody
wynosi -0.8 do-1.0 V)
Możliwe reakcje utlenienia:
2Cl
–
(aq) = Cl
2
(g) + 2e
–
E° = 1.358 V
2H
2
O = 4H
+
(aq) + O
2
(g) + 4e
–
E° = 0.82 V
(zjawisko nadnapięcia powoduje,że E utleniania wody
wynosi 1.4 V)
Możliwe reakcje redukcji:
Na
+
(aq) + e
–
= Na(s)
E° = –2.713 V
2H
2
O + 2e
–
= H
2
(g) + 2OH
–
(aq)
E° = -0.42 V
(zjawisko nadnapięcia powoduje,że E redukcji wody
wynosi -0.8 do-1.0 V)

14
Elektroliza: rozważmy elektrolizę roztworu
NaCl, którego stężenie wynosi 1mol/dm
3
• Ze względu na nadnapięcie potencjał
otrzymywania O
2
(g) wynosi ok. 1.5 V
• W rezultacie będziemy otrzymywać Cl
2
(g) i
H
2
.
Anoda, utlenianie: 2Cl
–
(aq) = Cl
2
(g) + 2e
–
E
°
Cl2/Cl-
= 1.358 V
• katoda, redukcja: 2H
2
O + 2e– = H
2
(g) + 2OH
–
(aq)
E
° = -0.42 V (zjawisko nadnapięcia
powoduje, że
E
redukcji wody wynosi -0.8 do-
1.0 V)

15
Elektroliza wody
• Możliwe reakcje utlenienia:
• 2SO
4
2–
(aq) = S
2
O
8
2–
(aq) + 2e– E° = 2.01 V
• 2H
2
O = 4H
+
(aq) + O
2
(g) + 4e– E° = 0.82 V
(zjawisko nadnapięcia powoduje,że E utleniania
wody wynosi 1.4 V)
•
Możliwe reakcje redukcji:
• H
+
(aq) + e– = H
2
E° = 0 V
• 2H
2
O + 2e– = H
2
(g) + 2OH
–
(aq)E° = -0.42 V
• (zjawisko nadnapięcia powoduje,że E redukcji
wody wynosi -0.8 do-1.0 V)

16
Izotopy wodoru
•
Wodór
(H) (Masa atomowa: 1,00782504(7))
posiada trzy występujące naturalnie izotopy,
1
H,
2
H, i
3
H. Pozostałe, (
4
H -
7
H) zostały
wytworzone sztucznie i nie występują w
środowisku naturalnym.
•
Wodór
jest jedynym pierwiastkiem, który
posiada w powszechnym użyciu nazwy dla
swoich izotopów. Dla deuteru i trytu stosuje
się ponadto oznaczenia odp. D i T (zamiast
2
H
i
3
H).
H
prot
99,98%
D
deuter
0,016%
T
tryt
~10
-16
%
17
Izotopy wodoru
•The energy gained from a fusion reaction is enormous. To illustrate, 10
grams of Deuterium (which can be extracted from 500 litres of water)
and 15g of Tritium (produced from 30g of Lithium) reacting in a fusion
powerplant would produce enough energy for the lifetime electricity needs
of an average person in an industrialised country.
•The energy gained from a fusion reaction is enormous. To illustrate, 10
grams of Deuterium (which can be extracted from 500 litres of water)
and 15g of Tritium (produced from 30g of Lithium) reacting in a fusion
powerplant would produce enough energy for the lifetime electricity needs
of an average person in an industrialised country.
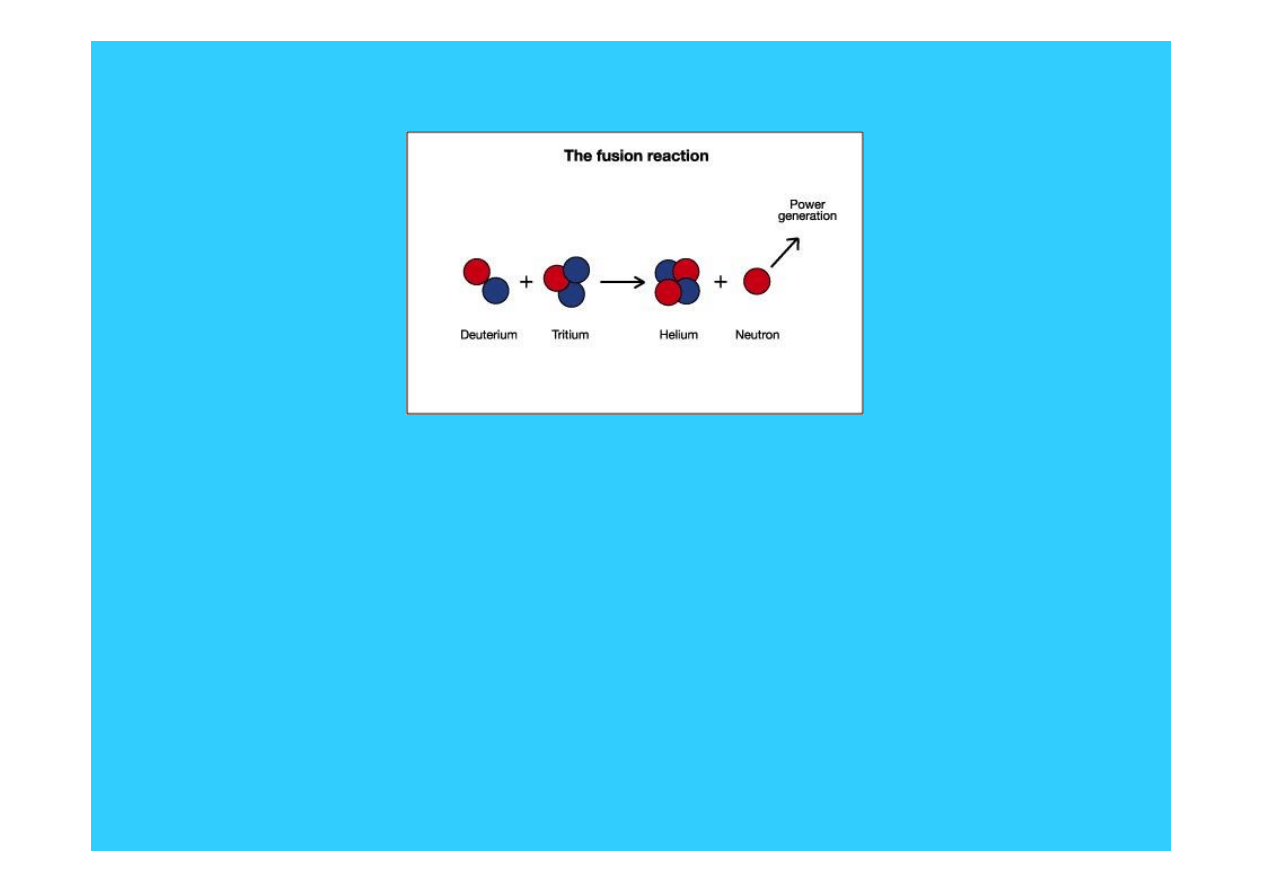
Otrzymywanie trytu
7
Li + n
4
He + T + n - 2.47 MeV
6
Li + n
4
He (2.05 MeV) + T (2.73 MeV)

18
Wodór atomowy i cząsteczkowy
• H2 - cząsteczka bardzo trwała (w normalnych
warunkach).
W wyższych temperaturach i przy zmianach ciśnienia:
H
2
2H
H
0
= +436 kJ/mol
•
•
reakcja endotermiczna reakcji rozkładu
sprzyjają wysokie temperatury:
•
1000 K
= 0,12 %
•
3000 K
= 9,0 %
•
4000 K
= 62 %
•
Wpływ ciśnienia - niskie ciśnienie sprzyja
rozkładowi wodoru cząsteczkowego.
•
Wodór aktywny = wodór in statu nascendi (tzn. w
chwili powstania) np. redukuje KMnO
4
.

19
Dwie odmiany wodoru cząsteczkowego
• ortowodór i parawodór
Jądra atomów wodoru zawierają protony, które mają
określone spinowe momenty magnetyczne
orto - zgodne para – przeciwne
•
W temperaturze 25
0
C wodór składa się z 75 % obj.
ortowodoru i w 25 % obj. parawodoru.
W miarę oziębiania, zawartość parawodoru (odmiany
uboższej w energię) rośnie i w 20 K dochodzi do
99,7%.
•
Odmiany te różnią się m.in. ciepłem właściwym.

20
Właściwości fizyczne wodoru
• Gaz bezbarwny, bez zapachu, bez smaku, słabo
rozpuszczalny w wodzie (0,021 obj. w 1 obj. wody).
• T
wrz
=20,38 K; T
topn
=13,95 K
Skraplanie wodoru – metoda ekspansyjna
(konieczne wstępne schłodzenie wodoru do ok. 200 K
ze względu na ujemny w wyższych temperaturach
efekt Joula-Thompsona),
Dodatkowy problem – egzotermiczna przemiana orto –
para (1,41 kJ/mol) powodująca odparowanie ok. 60%
skroplonego wodoru.
Rozwiązanie: ochłodzenie prawie do temp. skraplania,
zastosowanie katalizatora przyspieszającego
przemianę orto-para i dopiero po całkowitej
przemianie skraplanie wodoru.

21
Właściwości fizyczne wodoru
• Gęstość gazowego wodoru – 0,08988 g/dm
3
• Gęstość ciekłego wodoru w temp. wrzenia –
0.07 kg/dm
3
• Duża rozpuszczalność w niektórych metalach
(gąbka Pd może pochłonąć objętość wodoru
800 razy większą od swojej objętości).
• W wysokich temperaturach wodór rozpuszcza
się w platynie, niklu, żelazie, miedzi).

22
Właściwości chemiczne wodoru
•
W temperaturze pokojowej - niezbyt aktywny.
Łączy się z fluorem (HF) a podczas naświetlania też z chlorem (HCl).
W podwyższonych temperaturach reaguje :
- z niemetalami
- z metalami
tworząc wodorki
Reakcja z tlenem :
•
H
2
+ 1/2 O
2
= H
2
O
H
0
= -286 kJ/mol
- do 450 K brak reakcji
- 450 720 K reakcja przebiega z bardzo niską szybkością
-
> 720 K reakcja przebiega wybuchowo.
•
Mieszanina H
2
: O
2
w stosunku objętościowym 2 : 1 to
mieszanina piorunująca.
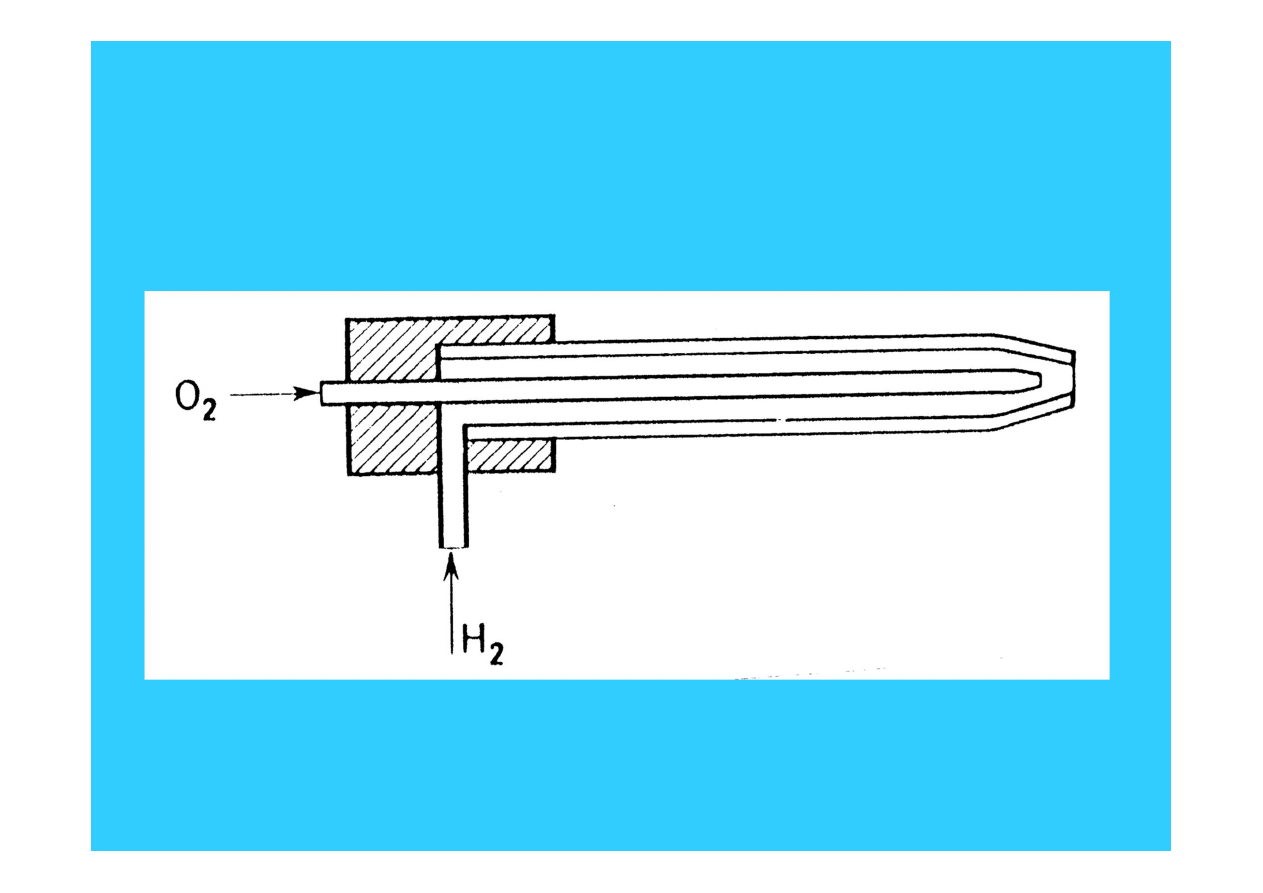
23
Palnik Daniella - temp. do 3000 K

24
Wodór jest silnym reduktorem w
podwyższonych temperaturach
CuO + H
2
Cu + H
2
O
3Fe
2
O
3
+ H
2
2Fe
3
O
4
+ H
2
O
Fe
2
O
3
+ H
2
2FeO + H
2
O
Fe
2
O
3
+ 3H
2
2Fe + 3H
2
O
530 K
800 K
900 K
420 K
420 K

25
Wodorki - X
m
H
n
Wg Paulinga
jednakowy udział
wiązania jonowego i
kowalencyjnego
pojawia się przy
różnicy
elektroujemności ok.
1.7
W miarę jak różnica
elektroujemności
maleje, wzrasta
tendencja do
tworzenia się wiązań
kowalencyjnych lub
wiązań metalicznych
Wiązania
kowalencyjne
powstają gdy
elektroujemności
pierwiastków
przekraczają wartość
1.8-1.9. Poniżej tej
wartości powstają
wiązania metaliczne
.
Wg Paulinga
jednakowy udział
wiązania jonowego i
kowalencyjnego
pojawia się przy
różnicy
elektroujemności ok.
1.7
W miarę jak różnica
elektroujemności
maleje, wzrasta
tendencja do
tworzenia się wiązań
kowalencyjnych lub
wiązań metalicznych
Wiązania
kowalencyjne
powstają gdy
elektroujemności
pierwiastków
przekraczają wartość
1.8-1.9. Poniżej tej
wartości powstają
wiązania metaliczne
.

26
Wodorki
W wodorkach stopień utlenienia wodoru wynosi +1 lub
-1. Stopień utlenienia w niektórych wodorkach metali
przejściowych nie jest dobrze zdefiniowany.
Trzy typy wodorków:
- wodorki jonowe (typu soli) - związki wodoru z
pierwiastkami elektrododatnimi (st. utlenienia wodoru
-1)
-wodorki kowalencyjne (związki wodoru z niemetalami)
- wodorki metaliczne (związki wodoru z metalami
przejściowymi)
W wodorkach stopień utlenienia wodoru wynosi +1 lub
-1. Stopień utlenienia w niektórych wodorkach metali
przejściowych nie jest dobrze zdefiniowany.
Trzy typy wodorków:
- wodorki jonowe (typu soli) - związki wodoru z
pierwiastkami elektrododatnimi (st. utlenienia wodoru
-1)
-wodorki kowalencyjne (związki wodoru z niemetalami)
- wodorki metaliczne (związki wodoru z metalami
przejściowymi)

27
Wodorki jonowe
Wodorki grupy 1A i 2A.
-stopione przewodzą prąd elektryczny
- w czasie elektrolizy litowiec (berylowiec)
wydziela się na katodzie a wodór na anodzie
- jon wodorowy H
-
ma własności zasadowe
H
-
+ H
2
O = H
2
+ OH
-
CaH
2
+ 2H
2
O = Ca
2+
+ 2OH
-
+ 2H
2
wodorki sodu, litu, wapnia są silnymi zasadami. LiH
i CaH
2
są przenośnymi źródłami wodoru. LiH
reaguje z AlCl
3
dając LiAlCl
4
będący użytecznym
reduktorem w chemii organicznej.
Wodorki grupy 1A i 2A.
-stopione przewodzą prąd elektryczny
- w czasie elektrolizy litowiec (berylowiec)
wydziela się na katodzie a wodór na anodzie
- jon wodorowy H
-
ma własności zasadowe
H
-
+ H
2
O = H
2
+ OH
-
CaH
2
+ 2H
2
O = Ca
2+
+ 2OH
-
+ 2H
2
wodorki sodu, litu, wapnia są silnymi zasadami. LiH
i CaH
2
są przenośnymi źródłami wodoru. LiH
reaguje z AlCl
3
dając LiAlCl
4
będący użytecznym
reduktorem w chemii organicznej.

28
Wodorki metaliczne
Wodorki metaliczne długo uważano za związki o strukturze
regularnej z atomami wodoru zajmującymi pozycje
międzywęzłowe.
Otrzymuje się je w reakcji pomiędzy metalami przejściowymi,
lantanowcami i aktynowcami i gazowym wodorem. W
podwyższonej temperaturze reakcja jest odwracalna -
prowadzi do otrzymania gazowego wodoru i sproszkowanego
metalu.
Wygląd metaliczny, dobre przewodnictwo elektryczne, zmienny
skład.
Często mają niestechiometryczny skład, np.: TiH
1.7
, TiH
2
,
PdH
0.65
, LaH
1.68
, UH
3
Jedno z ważniejszych zastosowań - magazynowanie wodoru
Wodorki metaliczne długo uważano za związki o strukturze
regularnej z atomami wodoru zajmującymi pozycje
międzywęzłowe.
Otrzymuje się je w reakcji pomiędzy metalami przejściowymi,
lantanowcami i aktynowcami i gazowym wodorem. W
podwyższonej temperaturze reakcja jest odwracalna -
prowadzi do otrzymania gazowego wodoru i sproszkowanego
metalu.
Wygląd metaliczny, dobre przewodnictwo elektryczne, zmienny
skład.
Często mają niestechiometryczny skład, np.: TiH
1.7
, TiH
2
,
PdH
0.65
, LaH
1.68
, UH
3
Jedno z ważniejszych zastosowań - magazynowanie wodoru

29
Odnawialne źródła energii
• energia słoneczna
• energia wiatru, wody
• energia geotermiczna
• biomasa
30
Wykorzystanie bezpośrednie
(energia elektryczna, ciepło)
Magazynowanie energii
(wodór)
Zbiorniki ciśnieniowe, ciekły wodór,
wodorotlenki metali, nanowłókna węglowe
Wykorzystanie bezpośrednie
(silniki spalinowe, cieplne)
Produkcja energii elektrycznej
(ogniwa paliwowe)
Energia ze źródeł odnawialnych

31
Wodór jako paliwo przyszłości
• Najbardziej perspektywicznym paliwem jest wodór, który
spala się wg reakcji:
2H
2
+ O
2
= 2H
2
O
H
0
= -142 MJ/kg
• Podczas spalania 1kg wodoru wydziela się 142 MJ energii,
a powstająca woda, jest w 100 % ekologiczna. Reakcja ta
może być realizowana w tzw. ogniwie paliwowym.
• Dla porównania ze spalenia 1 kg węgla i 1 kg metanu
otrzymuje się odpowiednio 33 i 50 MJ energii (przy 100 %
wydajności tych reakcji). Jednak nie rozwiązany jest, jak
dotychczas, problem magazynowania tego paliwa gazowego.
Można to realizować na następujące sposoby:
– Sprężanie wodoru ciśnienie 300 – 700 atm.,
– Skraplanie wodoru temperatura – 253 ºC,
– Zamiana w wodorki, np. NaAlH4 oraz wodorki Sm i Co,
– Absorbenty wodoru, np. nanorurki węglowe.

32
Magazynowanie wodoru

33
Sposoby magazynowania wodoru
zbiorniki
ciśnieniowe
ciekły
wodór
nanowłókna
węglowe
wodorki
metali

34
Magazynowanie wodoru w postaci
gazowej (pod ciśnieniem)

35
Magazynowanie wodoru w
postaci ciekłej (d=0,07kg/dm
3
)
36
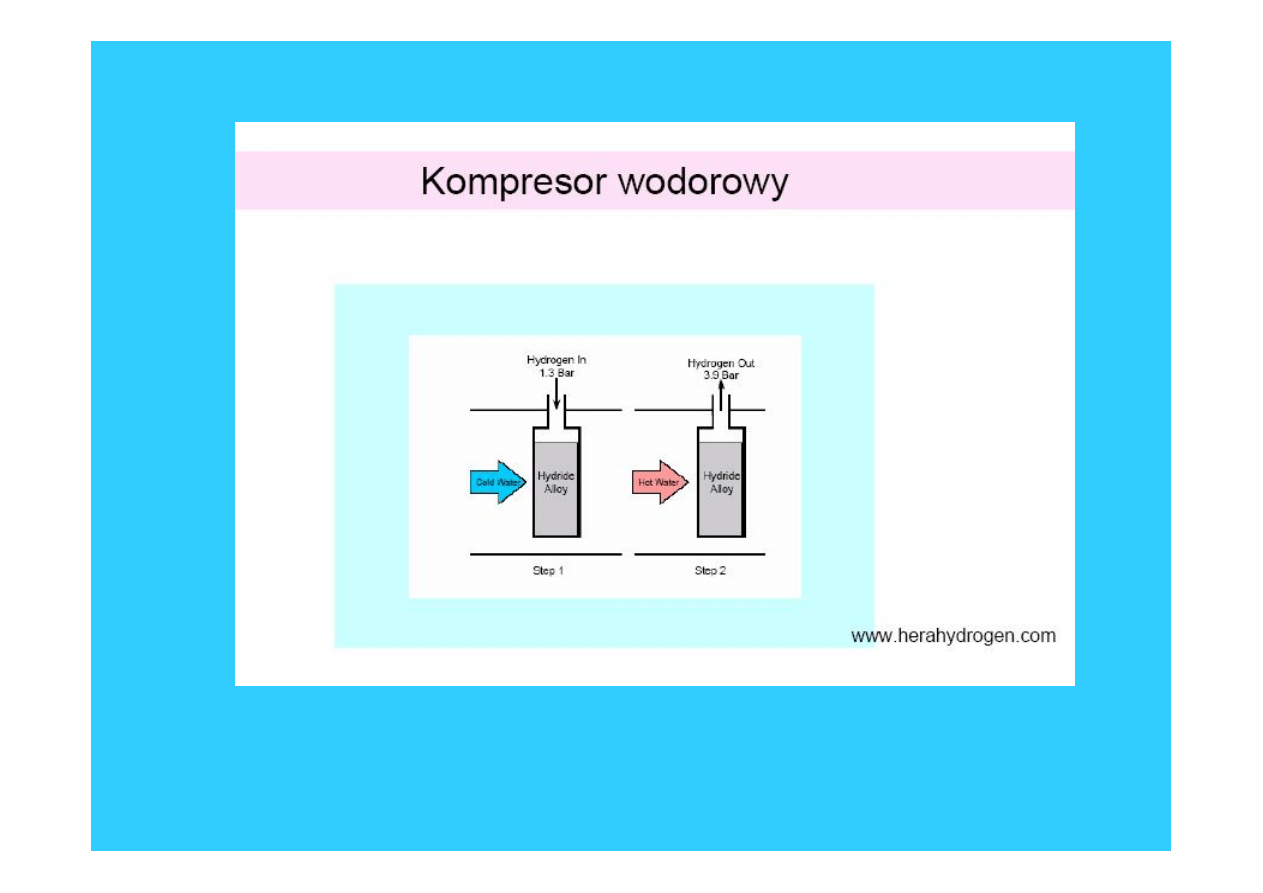
37
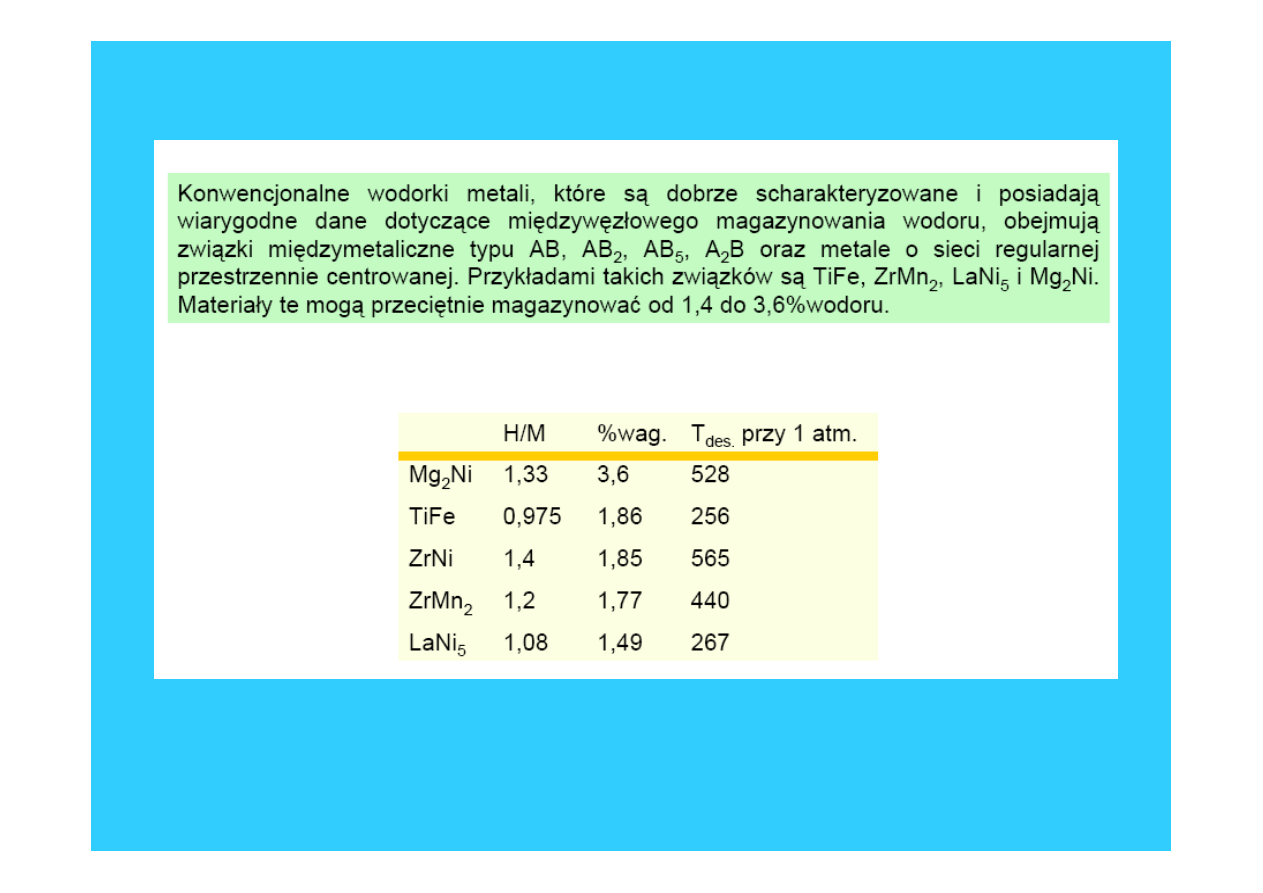
38
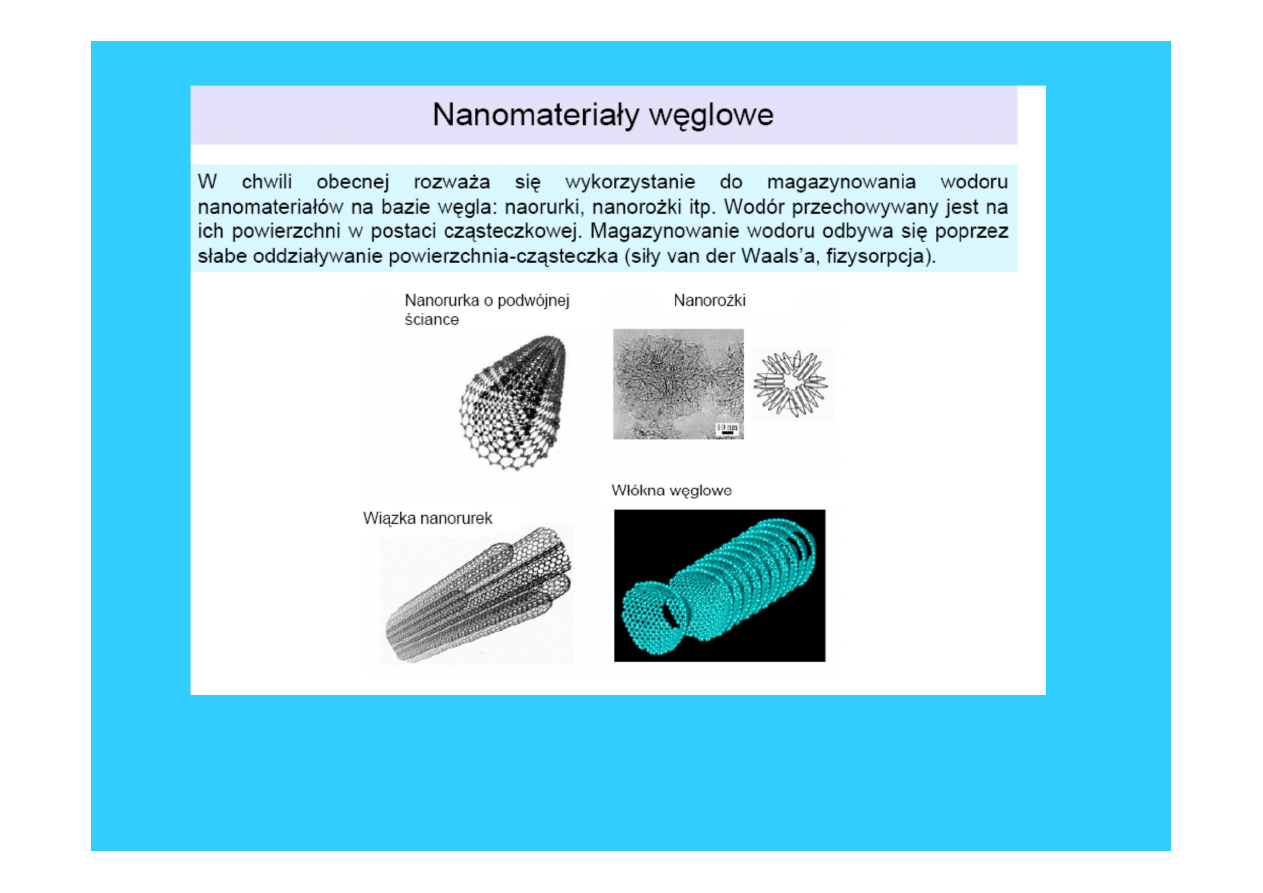
39
40
Zasada działania ogniwa
energia elektryczna
woda
CO
2
?
tlen z powietrza
paliwo
H
2
, CH
3
OH
OGNIWO
PALIWOWE

41
Ogniwo
Elektrolit
Temp. pracy (C)
PEM
Stały polimer organiczny
(kwas polinadfluorosulfonowy)
60-100
AFC
Wodny roztwór wodorotlenku
potasu
90-100
PAFC
Roztwór kwasu fosforowego
175-200
MCFC
Roztwór węglanów litu, sodu
i/lub potasu
600-1000
SOFC
Tlenek cyrkonu stabilizowany
itrem
600-1000
Rodzaje ogniw paliwowych
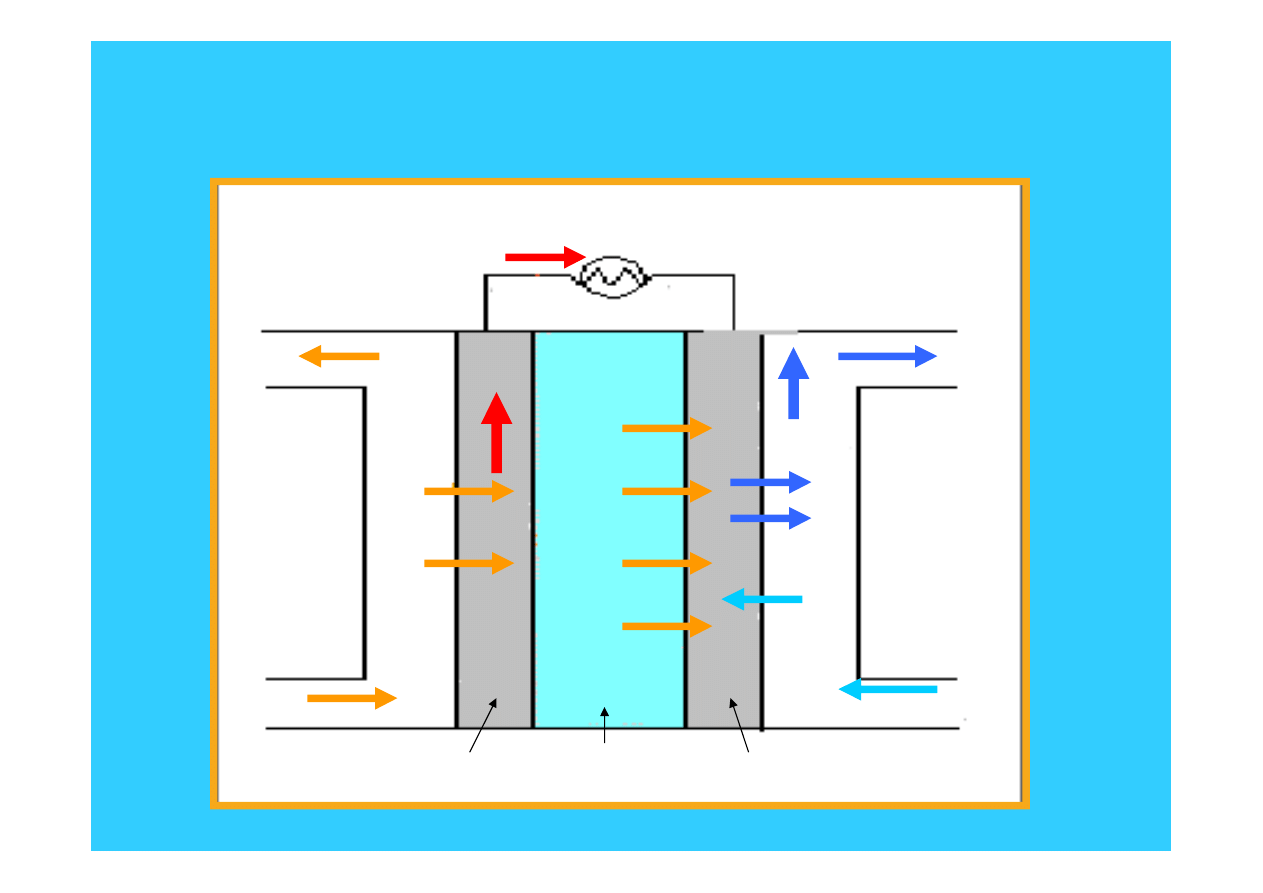
42
Ogniwo paliwowe PEM
nadmiarowe
paliwo
woda i ciepło
paliwo
powietrze
H
2
O
2
H
2
O
H
+
H
+
H
+
H
+
e
e
e
anoda elektrolit katoda
2H
2
= 4H
+
+ 4e
4H
+
+ O
2
+4e = 2H
2
O
43
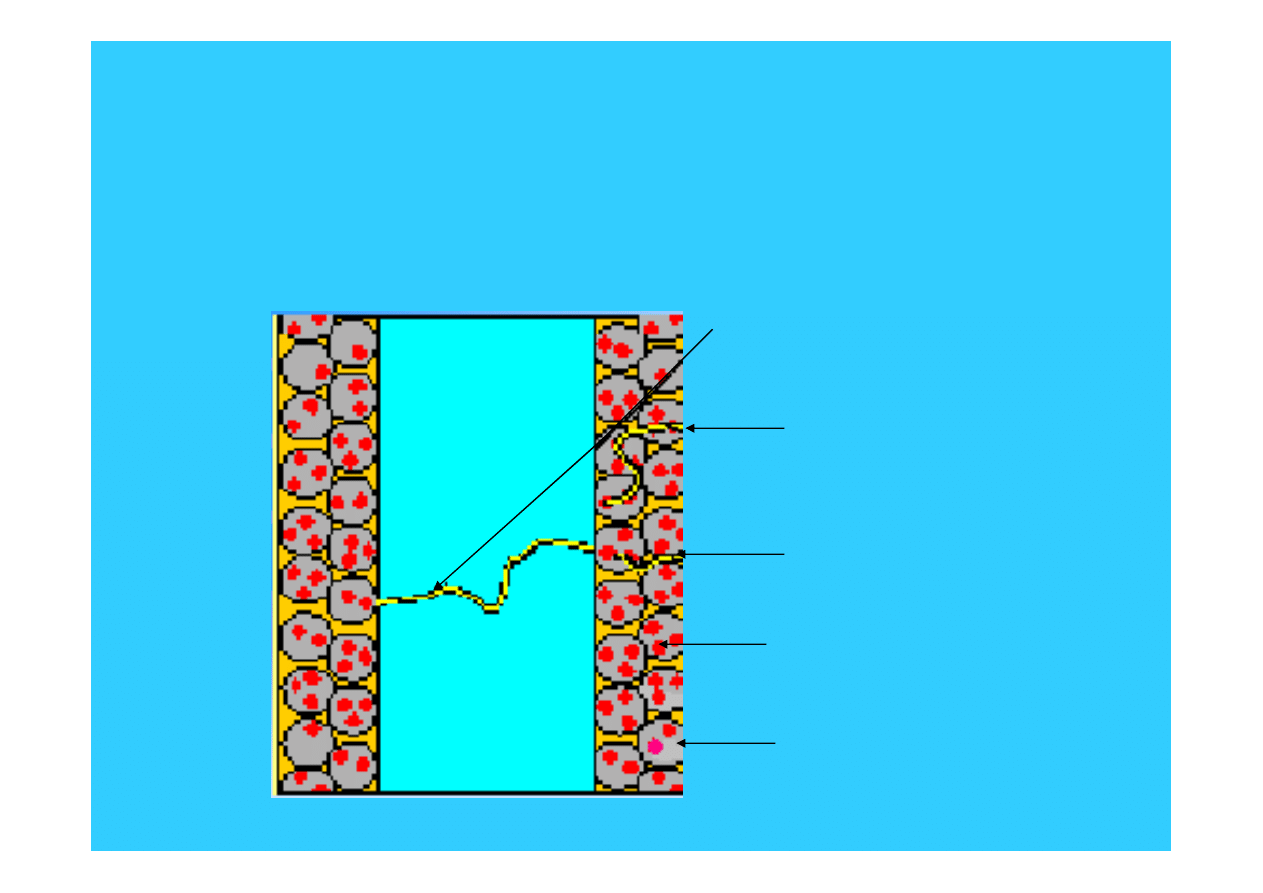
Membrana polimerowa
z porowatymi elektrodami
ścieżka przewodzenia
jonów wodorowych
ścieżka przewodzenia
elektronów
ścieżka dostępu gazu do
powierzchni katalizatora
platyna
węgiel
membrana
polimerowa
44
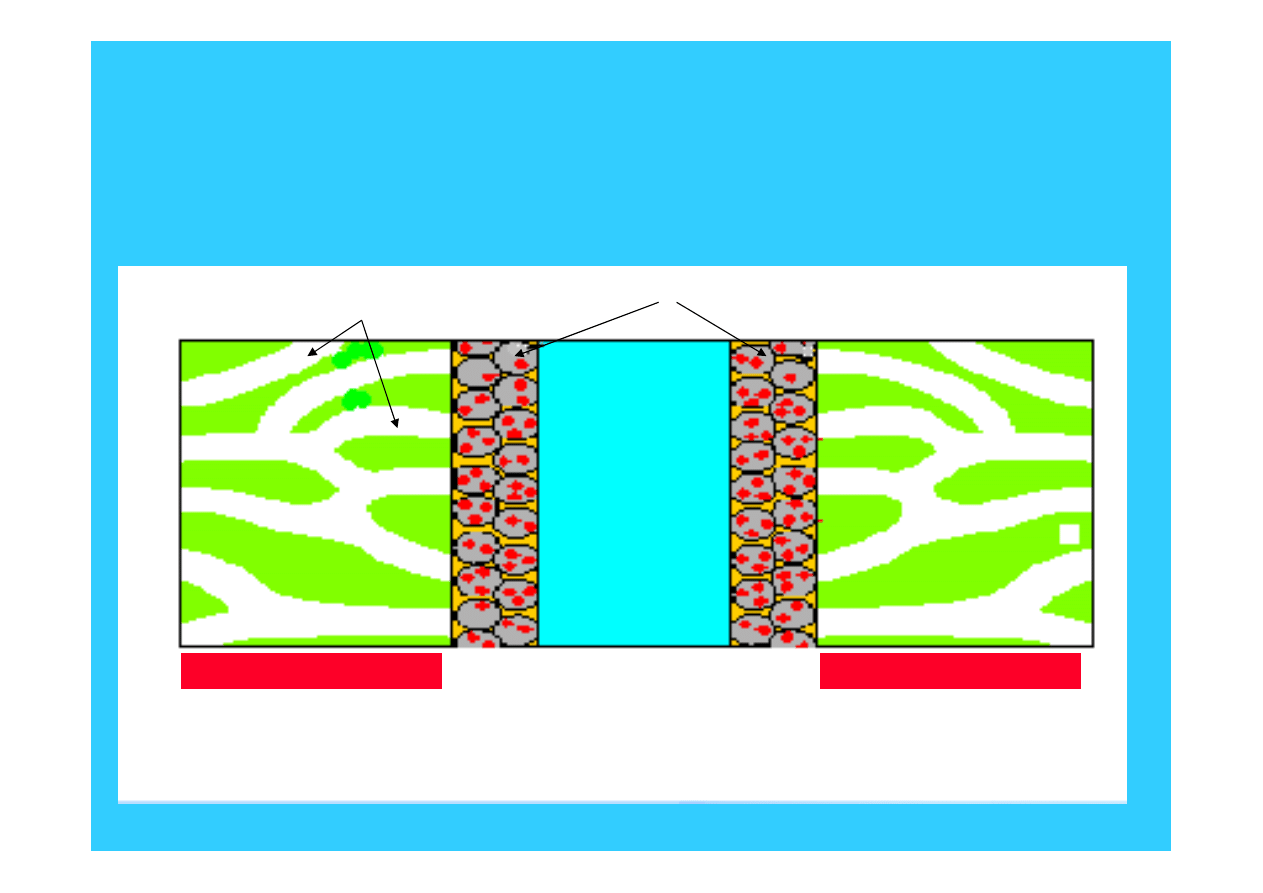
Przekrój zespołu
elektroda - membrana
warstwa zewnętrzna
warstwa zewnętrzna
zespół
membrana - elektrody
ścieżki dostępu gazu do elektrody
elektrody
membrana
polimerowa
45
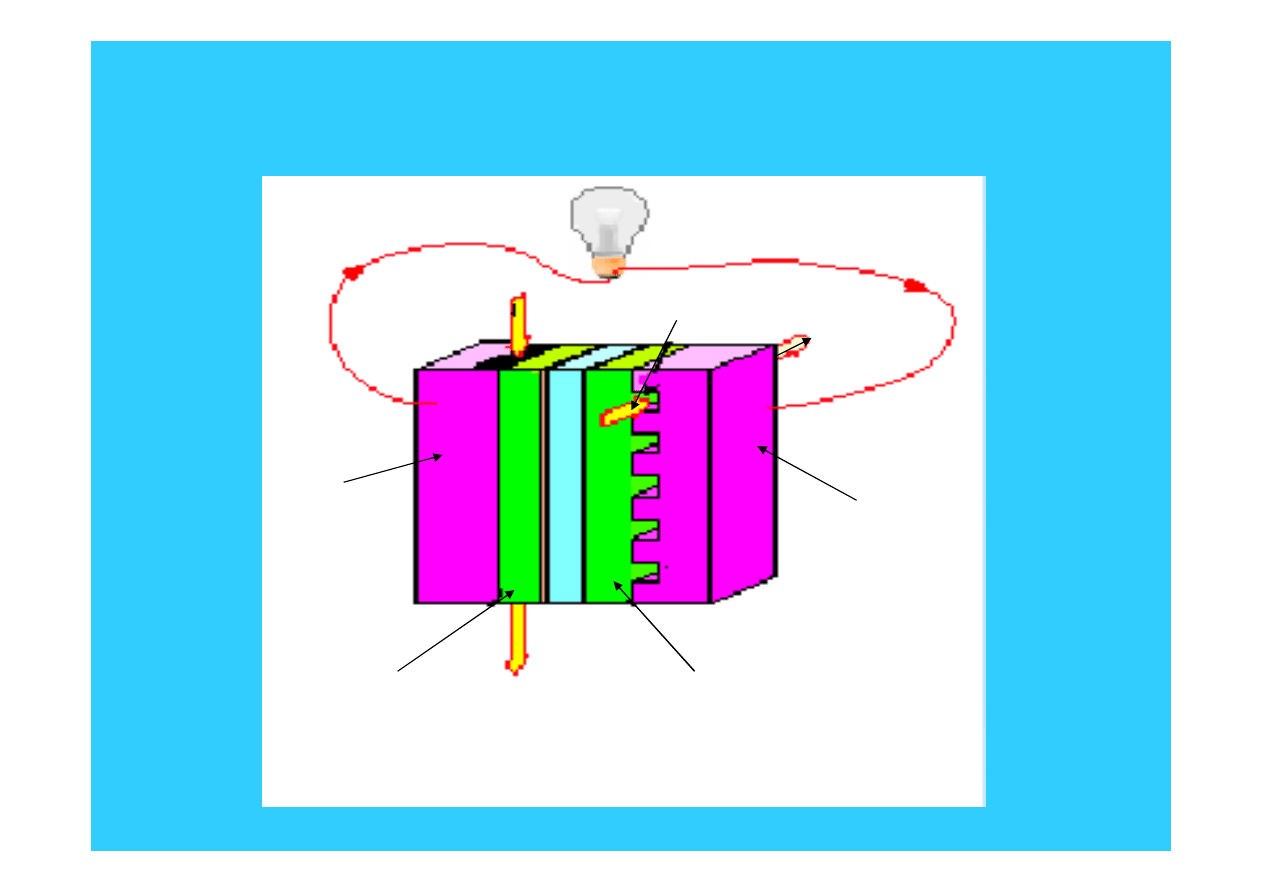
Pojedyncze ogniwo paliwowe PEM
kolektor prądu
anodowego
kolektor prądu
katodowego
wlot
wodoru
powietrze
i woda
wlot
powietrza
zewnętrzna warstwa
anodowa
zewnętrzna warstwa
katodowa
wylot
wodoru
ZEM
ZEM = zespół elektrody - membrana
e
e

46
Ogniwo paliwowe z polimerową
membraną protonowymienną
• silniki elektryczne
• w pojazdach
• badania kosmiczne
• mobilne generatory
elektryczności
• elektrociepłownie
• niska temperatura pracy (60-
100°C)
• wysoka sprawność (80%)
• brak emisji zanieczyszczeń
• łatwość łączenia w baterie o mocy
od kilku watów do kilkunastu
megawatów
• ZALETY
• ZASTOSOWANIA
WADY:
- wysoka cena
- wysoka czystość wodoru
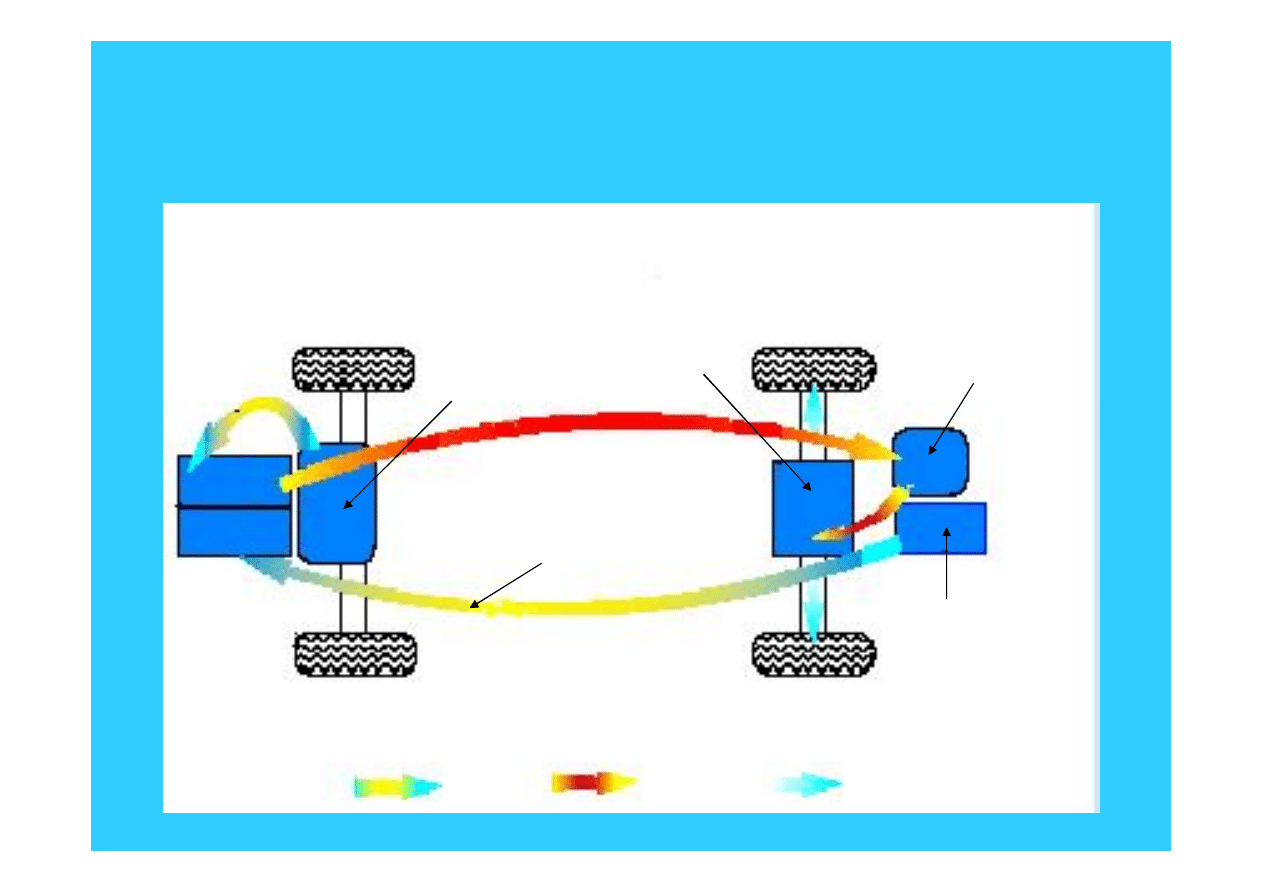
47
Schemat samochodu z wodorowym
ogniwem paliwowym
wodór
zbiornik
wodoru
energia
chemiczna
energia
mechaniczna
energia
elektryczna
powietrze
z turbokompresora
ogniwo
paliwowe
turbokompresor
konwerter
trakcyjny
silnik elektryczny
z przekładnią

48
Przykłady zastosowań
ogniw paliwowych
• P-2000 Ford (PEM FC) zerowa
emisja
• Opel Zafira (DM FC) zerowa
emisja SO
2
, N
x
O
y,
50% CO
2
• HydroGen3 (Opel) (PEM FC) -
zerowa emisja
• BMW 745h - silnik o mocy 135 kW
zasilany wodorem

49

50
System energetyczny przyszłości

51
Wodorki kowalencyjne
Węgiel jest pierwszym pierwiastkiem w okresie 3
wykazującym elektroujemność większa od wodoru. Różnica
elektroujemności jest mała i wiązanie ma charakter
kowalencyjny. Przesuwając się w prawo w okresie
następuje wzrost właściwości kwasowych wodorków
kowalencyjnych
Węgiel jest pierwszym pierwiastkiem w okresie 3
wykazującym elektroujemność większa od wodoru. Różnica
elektroujemności jest mała i wiązanie ma charakter
kowalencyjny. Przesuwając się w prawo w okresie
następuje wzrost właściwości kwasowych wodorków
kowalencyjnych
Wyszukiwarka
Podobne podstrony:
Wodór technologia2
SPRAWOZDANIE wodór
Geografia-super(PLIKI), geografia klimat, Atmosfera : azot (78%), tlen 21%, argon 0,9%, inne 0,1% (n
ZGAZOWAIE, WODÓR
Wodór i helowce
geografia klimat, Atmosfera : azot (78%), tlen 21%, argon 0,9%, inne 0,1% (neon, hel, krypton, wodór
Wodór
04-Wodór TECH, Materiały PG, Nieorgana
wodór, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
jak zmetalizowac wodor
Geografia-super(PLIKI), geografia atmosfera, Atmosfera : azot (78%), tlen 21%, argon 0,9%, inne 0,1%
Zasady żywienia, Zasady żywienia - Białka, Pierwiastki z których zbudowane są białka:azot,węgiel,wod
WODÓR
WODÓR
Wodor, WAT chemia zaocznie, chemia nieorganiczna wyklady
tlen, dziura ozonowa, wodor, woda
więcej podobnych podstron