Pierwszy egzaminacyjny stres zwiàzany z nowà maturà z chemii w skali ogólnopolskiej poza nami
– uczniami i nauczycielami. Czas wi´c na krótkie podsumowania i analizy na podstawie konkretnych
doÊwiadczeƒ i uzyskanych wyników. Dokonuj´ tego z punktu widzenia nauczyciela – praktyka z 34-
letnim sta˝em pracy, posiadajàcego III stopieƒ specjalizacji zawodowej i status nauczyciela dyplomo-
wanego, pracujàcego w czterdziestotysi´cznym mieÊcie, w szkole ogólnokszta∏càcej o du˝ym presti-
˝u Êrodowiskowym i bogatej 138-letniej tradycji.
■
W minionym roku szkolnym do egzaminu maturalnego w szkole, w której pracuj´, a wi´c w I Li-
ceum Ogólnokszta∏càcym im. Króla Stanis∏awa Leszczyƒskiego w JaÊle, przystàpi∏o 268 abiturientów,
z czego 35 abiturientów z klasy o profilu biologiczno-chemicznym (w tym 27 z chemii na poziomie
podstawowym i na poziomie rozszerzonym) oraz 233 abiturientów z pozosta∏ych profilów (w tym 20
z chemii) na obydwu poziomach. Wszyscy abiturienci naszej Szko∏y zdali egzamin maturalny ze
wszystkich przedmiotów. Uzyskane wyniki z chemii prezentuj´ w tabeli:
Nauk´ chemii prowadzi∏em w nast´pujàcym wymiarze tygodniowym:
■
Na uzyskane wyniki, oprócz cech osobowoÊciowych uczniów i nauczyciela, wp∏yn´∏o wiele czyn-
ników. Do najwa˝niejszych z nich zaliczam:
I. Wybór programu nauczania i podr´czników wspomagajàcych proces kszta∏cenia
■
Na zaj´ciach, zarówno z zakresu podstawowego, jak i rozszerzonego, realizowa∏em program na-
uczania opracowany przez Andrzeja Czerwiƒskiego, Ann´ Czerwiƒskà, Ma∏gorzat´ Jeliƒskà-Kazi-
mierczuk i Krzysztofa KuÊmierczyka nr DKOS-4015-75/02. Spiralny uk∏ad treÊci nauczania wynika-
jàcy z tego programu w praktyce warunkuje sprawdzonà jego uniwersalnoÊç. Niestety, liczne zespo∏y
klasowe (Êrednio 34–35 uczniów), ma∏a liczba godzin przeznaczonych na realizacj´ materia∏u, szcze-
gólnie w klasach innych ni˝ biologiczno-chemiczne, i brak podzia∏u na grupy çwiczeniowe eliminujà
w wi´kszoÊci przypadków mo˝liwoÊç samodzielnego wykonywania eksperymentów przez uczniów
oraz ograniczajà si´ w praktyce do pokazów nauczyciela przy wspó∏udziale wybranych uczniów. Po-
nadto realizacja napi´tego programu w tym wymiarze godzin (3 godz. w cyklu kszta∏cenia) wymaga
ogromnej dyscypliny nauczyciela w aspekcie maksymalizacji efektywnego wykorzystania czasu lekcyj-
nego i powoduje przecià˝anie uczniów pracami domowymi. Uniemo˝liwia równie˝ szeroko stosowane
Pomaturalne reminiscencje nauczyciela chemii
Pomaturalne reminiscencje nauczyciela chemii
Profile
Klasa I
Klasa II
Klasa III
Razem w cyklu
kszta∏cenia
biologiczno-chemiczny
3 godz.
3 godz.
3 godz.
9 godz.
inne ni˝ biologiczno-
-chemiczny
1 godz.
2 godz.
–
3 godz.
Profile klasy
Liczba uczniów
Zdajàcy chemi´ na poziomie:
podstawowym
rozszerzonym
biologiczno-chemiczny
35
uzyskana Êrednia punktów
(%)
porównanie ze Êrednià okre-
Êlonà przez OKE w Krakowie
233
27
84,8 %, w tym 3 uczniów
po 100 %
+13 %
20
27
66,9 %, w tym 1 uczeƒ 100 %,
2 uczniów po 90 %
+14,3 %
20
inne ni˝ biologiczno-
-chemiczny
uzyskana Êrednia
punktów (%)
porównanie ze Êrednià okre-
Êlonà przez OKE w Krakowie
76,8 %, w tym najwy˝szy wynik:
2 uczniów po 97 %
+6 %
51,3 %, w tym najwy˝szy
wynik: 1 uczeƒ 95 %
–1,3 %
Juliusz Jankisz
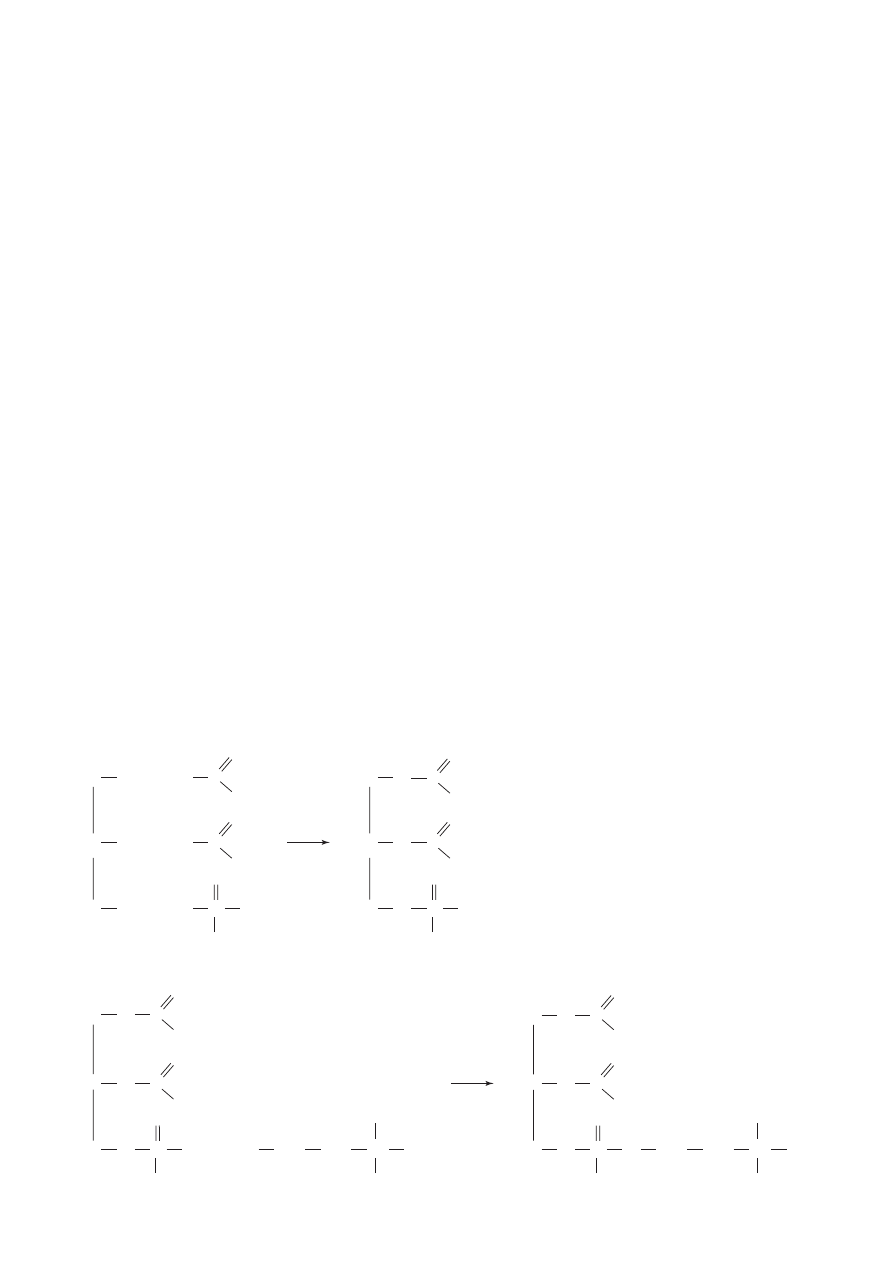
sprawdzanie wiadomoÊci na zasadzie odpowiedzi ustnych i eliminuje mo˝liwoÊç planowania dosta-
tecznej liczby lekcji powtórzeniowych, a ostatecznie gwarantuje przygotowanie m∏odzie˝y do matu-
ralnego egzaminu z chemii w zakresie podstawowym. A przecie˝, jak wykazuje praktyka (tabela z wy-
nikami) zapotrzebowanie spo∏eczne doÊç du˝ej grupy m∏odzie˝y jest wi´ksze. Stàd wzrós∏ udzia∏
m∏odzie˝y w zaj´ciach ko∏a chemicznego i to zarówno w aspekcie liczbowym, jak te˝ jakoÊciowym.
Szkoda, ˝e zaj´cia te ze wzgl´du na brak Êrodków bud˝etowych muszà byç prowadzone na zasadach
spo∏ecznych, gdy˝ szczególnie z chemii jest to czasoch∏onne i pracoch∏onne – poniewa˝ dodatkowo
wymaga przygotowania odczynników i sprz´tu dla uczniów.
Trudno jest zabezpieczyç wszechstronny rozwój ucznia i rozwijaç jego pasje poznawcze, co jest pod-
stawowym zadaniem wspó∏czesnej szko∏y, bez ponoszenia stosownych kosztów. Ale dziwnym trafem
kolejne ekipy decydentów nie chcà przyjàç tego do ÊwiadomoÊci, chocia˝ przez 34 lata mojej peda-
gogicznej pracy ∏udzony jestem coraz intratniejszymi obietnicami.
■
Do pe∏nej realizacji zadaƒ wynikajàcych z wybranego programu nauczania wzià∏em podr´cznik
autorstwa A. Czerwiƒskiego i innych wydany przez WSiP. Jest on skorelowany z programem naucza-
nia, co u∏atwia mi organizacj´ pracy. Zamieszczone na koƒcu ka˝dego rozdzia∏u podsumowania sà
wartoÊciowym kompendium wiedzy na lekcje powtórzeniowe. Zawarte równie˝ na koƒcu ka˝dego
dzia∏u zagadnienia „Sprawdê, czy potrafisz” – wykorzystuj´ na prace domowe uczniów, zaÊ problemy
„Sprawdê, czego si´ nauczy∏eÊ” – do samokszta∏cenia si´ uczniów. Problemy te, szczególnie oznaczo-
ne literà „M” (zadania z poziomu maturalnego), cz´sto omawiamy na zaj´ciach ko∏a chemicznego.
■
Aby u∏atwiç uczniom samokontrol´ i samoocen´ poprawnoÊci wykonania poleceƒ, z w∏asnej inwen-
cji, wspólnie z uczniami opracowaliÊmy modele odpowiedzi na te pytania. Odpowiedzi do wybranych py-
taƒ uczniowie opracowywali indywidualnie i oddawali mi do merytorycznej weryfikacji. Nast´pnie prze-
pisywali te opracowania w formacie elektronicznym i drukowali. Wydrukowane karty odpowiedzi
w foliowych koszulkach zosta∏y wpi´te w ogólnodost´pny dla uczniów skoroszyt. Do ka˝dego z nich jest
do∏àczona kopia na noÊniku elektronicznym. Przyk∏ady takich opracowaƒ zamieszczam poni˝ej:
■
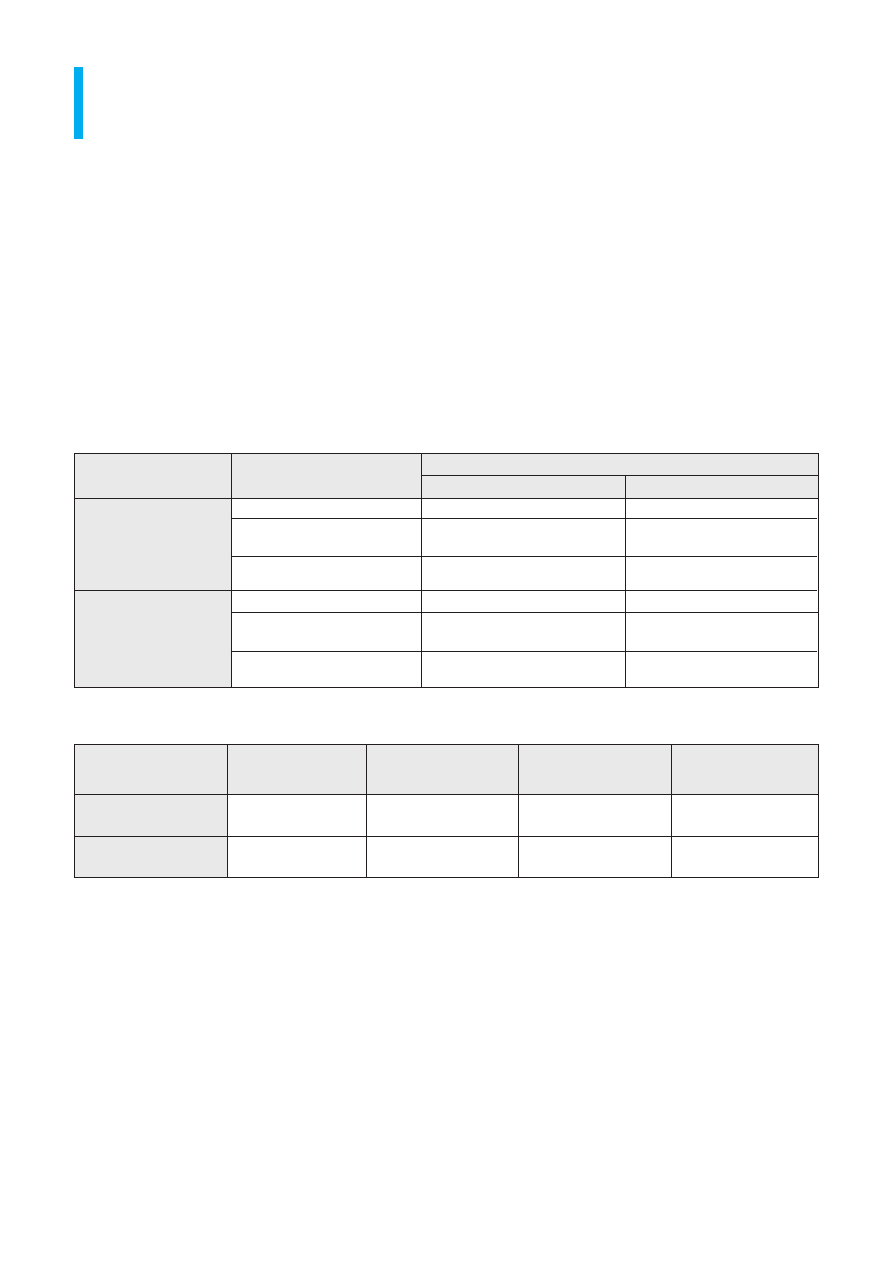
Opisz budow´ i funkcje biologiczne fosfolipidów
Fosfolipidy, zwane równie˝ fosfatydami, fosfot∏uszczowcami lub fosfoglicerydami, sà to zwiàzki za-
liczane do lipidów (z greckiego lipos – t∏uszcz), których wspólnà cechà jest rozpuszczalnoÊç w roz-
puszczalnikach niepolarnych. Pochodne glicerolu (gliceryny), w których jedna z pierwszorz´dowych
grup – OH jest zestryfikowana kwasem fosforowym(V), a pozosta∏e dwie tworzà wiàzania estrowe
z kwasami t∏uszczowymi, sà nazywane kwasami fosfatydowymi.
H
2
C
OH
HO
C
+
C
17
H
35
H
2
C
OH
HO
P
+
OH
HC
OH
HO
C
+
O
O
C
15
H
31
O
OH
H
2
C
O
H
2
O
C
+
C
17
H
35
H
2
C
O
H
2
O
P
+
OH
HC
O
H
2
O
C
+
O
O
C
15
H
31
O
OH
glicerol
kwas fosfatydowy
woda
H
2
C
O
C
C
17
H
35
H
2
C
O
P
OH
HC
O
C
O
O
C
15
H
31
O
OH
kwas fosfatydowy
cholina
lecytyna (fosfolipid)
HO
CH
2
+
CH
2
N
+
CH
3
CH
3
CH
3
CH
2
CH
2
N
+
CH
3
CH
3
CH
3
H
2
C
O
C
C
17
H
35
H
2
C
O
P
O
HC
O
C
O
O
C
15
H
31
O
OH
—
H
2
O
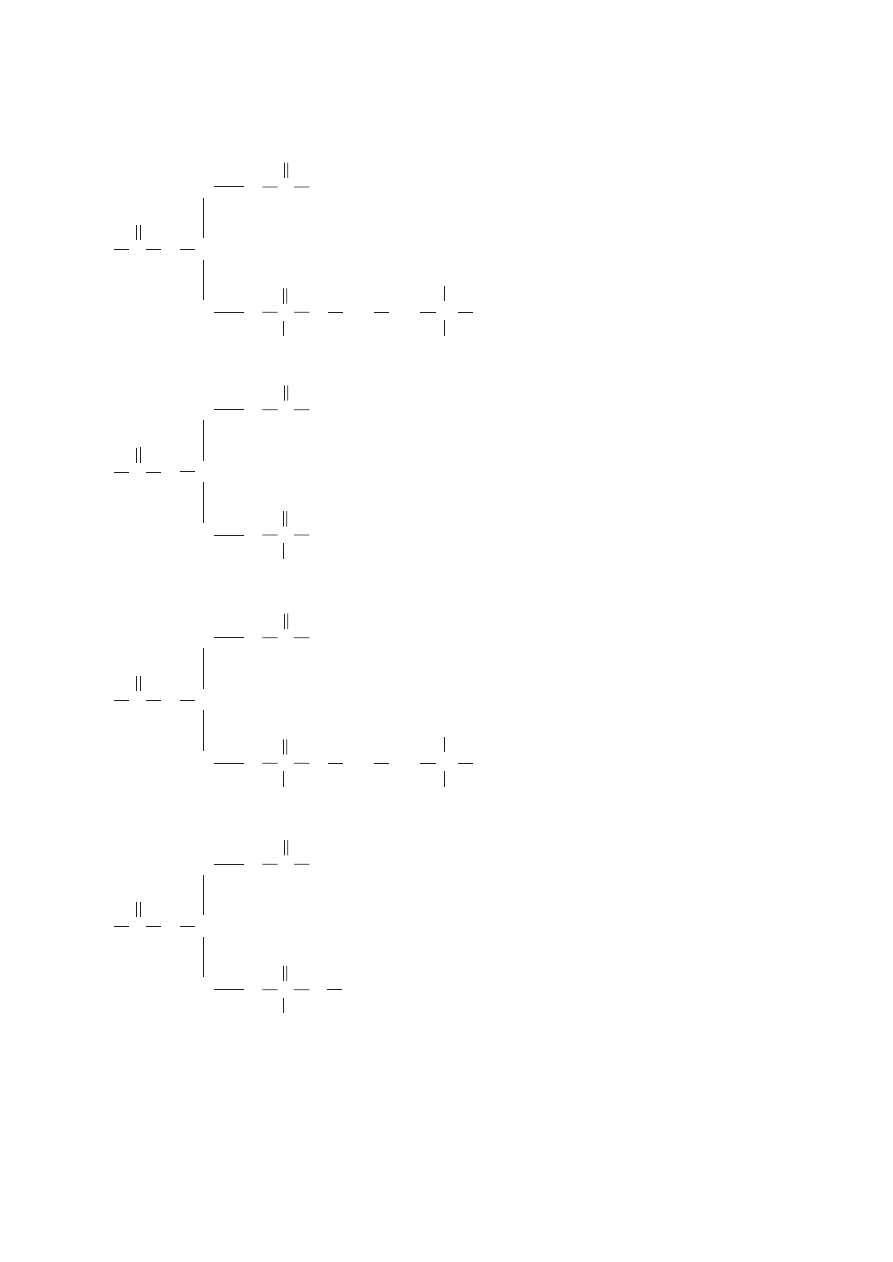
Wolne kwasy fosfatydowe rzadko wyst´pujà w przyrodzie, ale ka˝da ˝ywa komórka zawiera znacz-
ne iloÊci ich estrów z silnie hydrofilowymi, polarnymi alkoholami, takimi jak: etanoloamina, cholina,
seryna (aminokwas zawierajàcy grup´ – OH) lub inozyt. Estry te sà nazywane fosfoglicerydami.
Tak wi´c ich czàsteczki zawierajàce d∏ugie, niepolarne ∏aƒcuchy reszt kwasów t∏uszczowych i po-
larne fragmenty fosfoestrowe w roztworach wodnych mogà stabilizowaç emulsje. Ponadto czàstecz-
ki fosfolipidów majà zdolnoÊç samorealizacji, która warunkuje powstanie b∏on komórkowych. Te „in-
teligentne moleku∏y” porzàdkujà si´ tak, ˝e mo˝liwe jest oddzielenie wn´trza komórki od
Êrodowiska. ObecnoÊç dwóch niepolarnych „ogonów” i polarnej „g∏owy” pozwala im tworzyç po-
dwójnà warstw´ lipidowà. Reszty nienasyconych kwasów t∏uszczowych o konfiguracji cis, wp∏ywajà na
fosfatydyloetanoloamina
(kefalina)
CH
CH
2
CH
2
H
2
C
N
+
H
H
H
R
2
C
O
O
P
O
O
O
–
O
H
2
C
C
R
1
O
O
fosfatydylocholina
(lecytyna)
CH
CH
2
CH
2
H
2
C
N
+
CH
3
CH
3
CH
3
R
2
C
O
O
P
O
O
O
–
O
H
2
C
C
R
1
O
O
kwas fosfatydowy
CH
H
2
C
R
2
C
O
O
P
OH
O
O
–
O
H
2
C
C
R
1
O
O
fosfogliceryd
(R
3
= polarny alkohol)
CH
H
2
C
R
2
C
O
O
P
O
O
O
–
O
H
2
C
C
R
1
O
O
R
3
p∏ynnoÊç podwójnej warstwy lipidowej. Wygi´cie ∏aƒcucha lipidowego uniemo˝liwia ich Êcis∏e upako-
wanie i os∏abia si∏´ oddzia∏ywaƒ mi´dzyczàsteczkowych. Z ogólnego schematu budowy fosfoglicery-
dów wynika, ˝e zawierajà one du˝y, hydrofobowy fragment, zbudowany z dwóch reszt kwasu t∏usz-
czowego, po∏àczony z fragmentem hydrofilowym o du˝ej polarnoÊci.
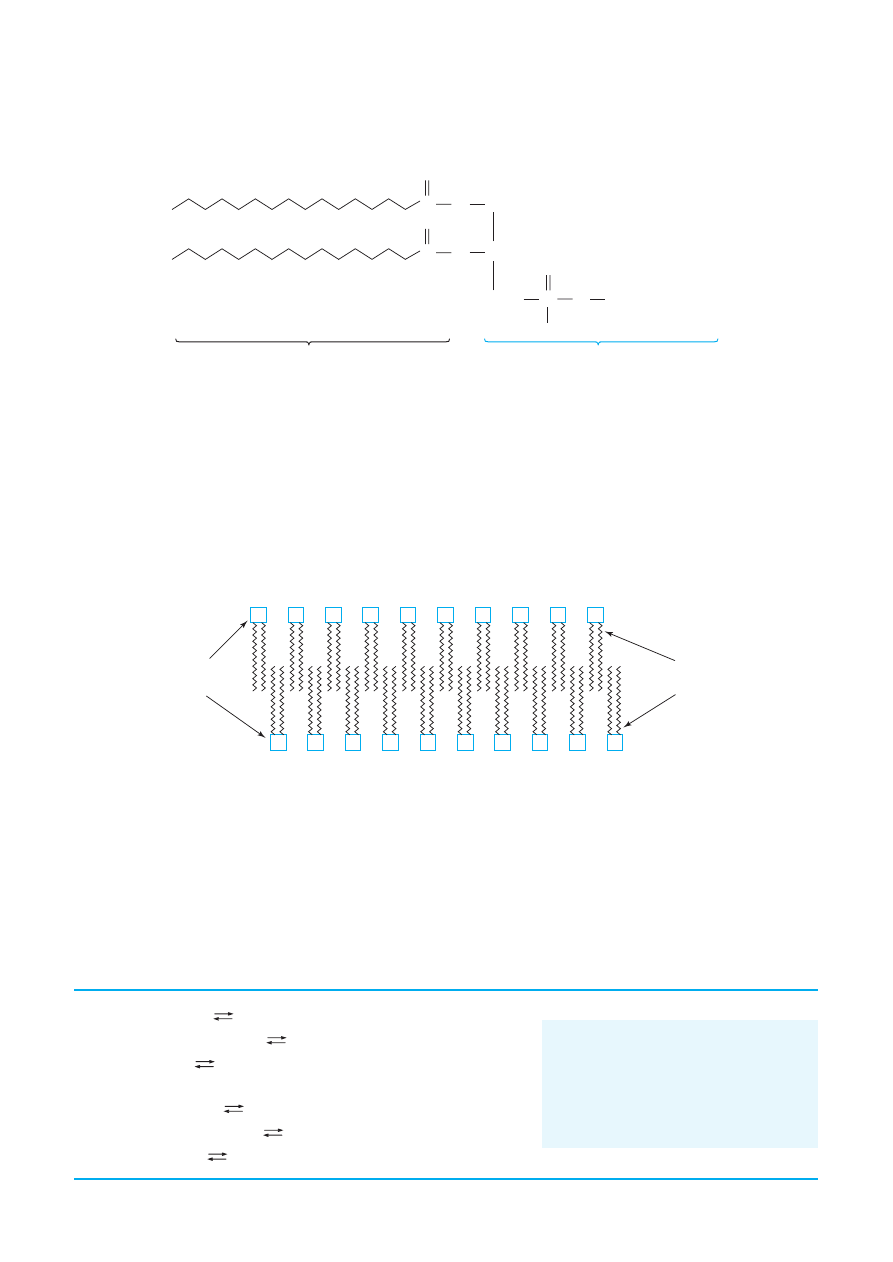
Dzi´ki takiej budowie, czàsteczki fosfoglicerydów w roztworach wodnych uk∏adajà si´ tak, by istnia-
∏o maksymalnie du˝e oddzia∏ywanie fragmentów hydrofobowych ze sobà i fragmentów hydrofilowych
z wodà. Jednym ze sposobów zrealizowania takiego stanu jest tworzenie miceli, a drugim, znacznie wa˝-
niejszym z punktu widzenia biologicznej roli fosfoglicerydów, jest powstawanie podwójnych warstw.
Fosfoglicerydy i inne fosfolipidy samorzutnie tworzà struktury warstwowe, w których hydrofobowe koƒ-
ce czàsteczek znajdujà si´ wewnàtrz warstwy, a fragmenty polarne kontaktujà si´ ze Êrodowiskiem wod-
nym. Podwójne warstwy lipidowe pe∏nià w przyrodzie rol´ niezb´dnych do ˝ycia komórki membran, od-
dzielajàcych od siebie poszczególne fragmenty komórek. Budowa i funkcja membran lipidowych jest
obecnie jednym z g∏ównych kierunków badaƒ biochemicznych i biofizycznych.
■
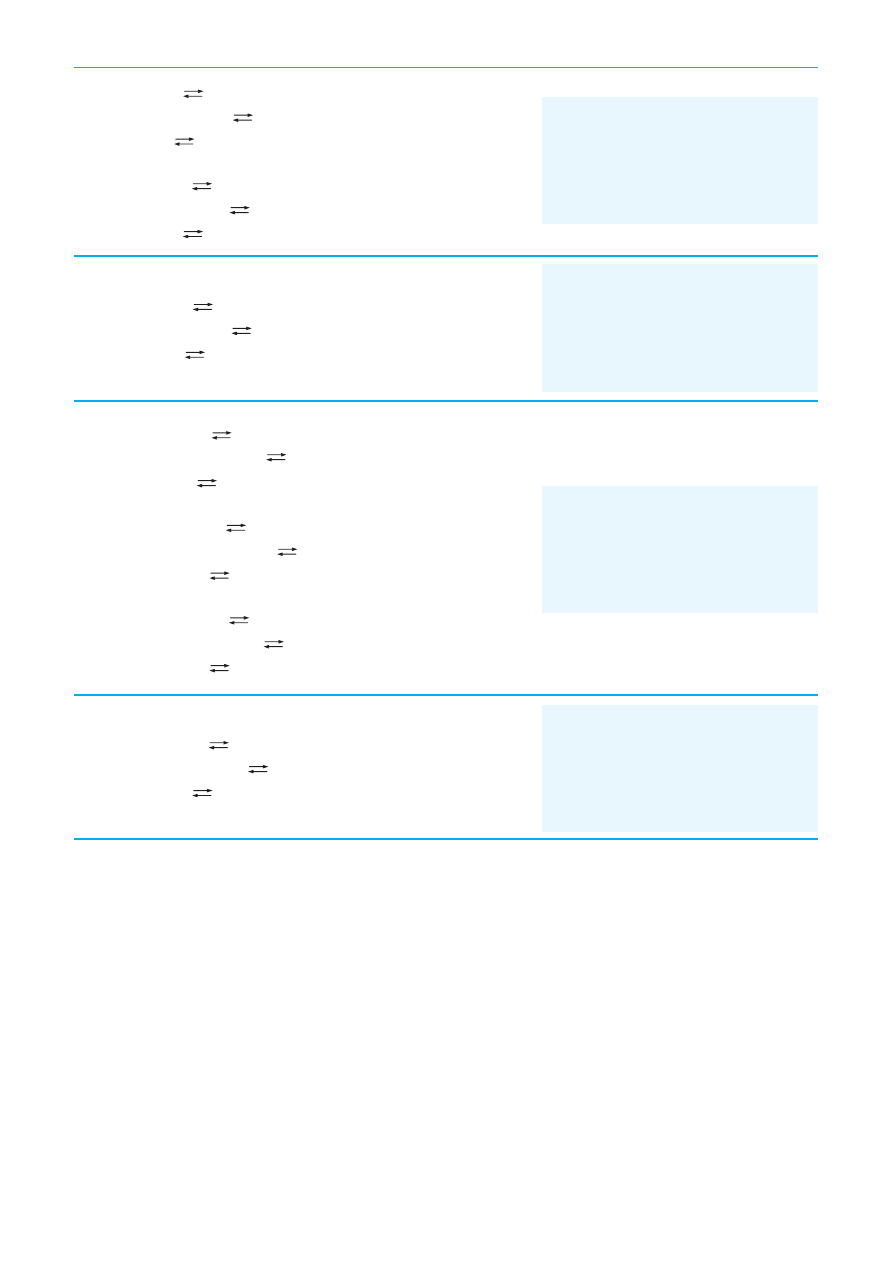
Dlaczego fenoloftaleina dodana do wodnych roztworów: Na
2
2
CO
3
3
, K
2
2
S, NaNO
2
2
, KCN, Na
3
3
PO
4
4
zmienia zabarwienie na kolor malinowy?
Zabarwienie fenoloftaleiny na kolor malinowy dowodzi obecnoÊci wi´kszej liczby jonów OH
–
ni˝
H
+
w roztworach. Wynika z tego, ˝e w roztworach wymienionych substancji spe∏niony jest powy˝szy
warunek, co spowodowane jest hydrolizà tych soli, jako zwiàzków pochodzàcych od s∏abego kwasu
i mocnej zasady.
Na
2
CO
3
+ H
2
O
NaOH + NaHCO
3
2 Na
+
+ CO
3
2–
+ H
2
O Na
+
+ OH
–
+ Na
+
+ HCO
3
–
CO
3
2–
+ H
2
O HCO
3
–
+
OH
–
–
NaHCO
3
+ H
2
O
NaOH + H
2
O + CO
2
Na
+
+ HCO
3
–
+ H
2
O Na
+
+ OH
–
+ H
2
O + CO
2
HCO
3
–
+ H
2
O
OH
–
–
+ H
2
O + CO
2
CH
CH
2
O
CH
2
CH
2
N
+
(CH
3
)
3
O
_
C
O
O
CH
2
C
O
O
P
O
O
fragment hydrofobowy
fragment hydrofilowy
fragmenty
polarne
fragmenty
hydrofobowe
Rys. Schematyczny przekrój podwójnej warstwy lipidowej
Na
2
CO
3
jako sól kwasu dwuzasadowego
hydrolizuje dwustopniowo.
Jest to hydroliza soli s∏abego kwasu
i mocnej zasady.
Jest to hydroliza anionowa, gdy˝ woda
oddzia∏uje z anionem z dysocjacji soli.
K
2
S + H
2
O
KOH + KHS
2 K
+
+ S
2–
+ H
2
O K
+
+ OH
–
+ K
+
+ HS
–
S
2–
+ H
2
O
OH
–
–
+ HS
–
KHS + H
2
O
KOH + H
2
S
K
+
+ HS
–
+ H
2
O K
+
+ OH
–
+ H
2
S
HS
–
+ H
2
O
OH
–
–
+ H
2
S
KCN + H
2
O
KOH + HCN
K
+
+ CN
–
+ H
2
O K
+
+ OH
–
+ HCN
CN
–
+ H
2
O
OH
–
–
+ HCN
Na
3
PO
4
+ H
2
O Na
2
HPO
4
+ NaOH
3 Na
+
+ PO
4
3–
+ H
2
O 2
Na
+
+ HPO
4
2–
+ Na
+
+ OH
–
PO
4
3–
+ H
2
O HPO
4
2–
+
OH
–
–
Na
2
HPO
4
+ H
2
O NaH
2
PO
4
+ NaOH
2 Na
+
+ HPO
4
2–
+ H
2
O Na
+
+ H
2
PO
4
–
+ Na
+
+ OH
–
HPO
4
2–
+ H
2
O H
2
PO
4
–
+
OH
–
–
NaH
2
PO
4
+ H
2
O
NaOH + H
3
PO
4
Na
+
+ H
2
PO
4
–
+ H
2
O Na
+
+ OH
–
+ 3 H
+
+ PO
4
3–
H
2
PO
4
–
+ H
2
O
OH
–
–
+ 3 H
+
+ PO
4
3–
NaNO
2
+ H
2
O
NaOH + HNO
2
Na
+
+ NO
2
–
+ H
2
O Na
+
+ OH
–
+ HNO
2
NO
2
–
+ H
2
O
OH
–
–
+ HNO
2
Opracowania te uczniowie albo kserujà, albo kopiujà na swoje noÊniki i wykorzystujà w procesie
samooceny poprawnoÊci rozwiàzywanych w drodze samokszta∏cenia problemów. Podstawowà zaÊ ro-
là nauczyciela jest stworzenie takiego systemu motywacji, „aby uczeƒ chcia∏ chcieç”.
Do osiàgni´cia za∏o˝onych celów wykorzystuj´ te˝ zbiór zadaƒ autorstwa M. Koszmider i J. Sygnie-
wicz: Chemia. Kszta∏cenie w zakresach: podstawowym i rozszerzonym oraz popularnà wÊród uczniów pu-
blikacj´ Maturalnie, ˝e zdasz. Chemia. Zakresy podstawowy i rozszerzony. Pytania, zadania, testy, arku-
sze egzaminacyjne autorstwa A.M. Persony i J.W. Dymary. Obydwie pozycje wydane przez WSiP sà
pomocne przy pog∏´bianiu wiedzy i umiej´tnoÊci uczniów.
II. Organizacja pracy
■
W celu maksymalnego efektywnego wykorzystania czasu lekcyjnego, ka˝dà jednostk´ lekcyjnà
nale˝y dok∏adnie przemyÊleç i przygotowaç. Pomocnym dla mnie jest Poradnik dla nauczyciela autor-
stwa Andrzeja Czerwiƒskiego i innych, wydany przez WSiP. Po zakoƒczeniu ka˝dego rozdzia∏u zawie-
ra on „Przewidywane osiàgni´cia uczniów”. Determinujà one dobór atrakcyjnych metod pracy i form
pobudzania aktywnoÊci uczniów. Zawarte w opracowaniu propozycje prostych do przeprowadzenia
K
2
S jako sól kwasu dwuzasadowego
hydrolizuje dwustopniowo.
Jest to hydroliza soli s∏abego kwasu
i mocnej zasady.
Jest to hydroliza anionowa, gdy˝ woda
oddzia∏uje z anionem z dysocjacji soli.
Na
3
PO
4
jako sól kwasu trójzasadowego
hydrolizuje trójstopniowo.
Jest to hydroliza soli s∏abego kwasu
i mocnej zasady.
Jest to hydroliza anionowa, gdy˝ woda
oddzia∏uje z anionem z dysocjacji soli.
NaNO
2
jako sól kwasu jednozasadowego
hydrolizuje jednostopniowo.
Jest to hydroliza soli s∏abego kwasu
i mocnej zasady.
Jest to hydroliza anionowa, gdy˝ woda
oddzia∏uje z anionem z dysocjacji soli.
KCN jako sól kwasu jednozasadowego
hydrolizuje jednostopniowo.
Jest to hydroliza soli s∏abego kwasu
i mocnej zasady.
Jest to hydroliza anionowa, gdy˝ woda
oddzia∏uje z anionem z dysocjacji soli.
eksperymentów chemicznych (np. odbarwianie wody bromowej przez sok z pomidorów) u∏atwiajà
uzyskanie zamierzonych celów. Efekt ten wzmo˝ony zostaje równie˝ przez wykorzystanie zdj´ç do-
Êwiadczeƒ w aspekcie wyników eksperymentów i p∏ynàcych z nich wniosków.
Oprócz tradycyjnych i powszechnie stosowanych aktywizujàcych metod, na czele z metodà proble-
mowà, warto stwarzaç sytuacje inspirujàce do twórczego dzia∏ania uczniów. Dobre efekty uzyskuj´,
stosujàc mi´dzy innymi:
■
„Rozsypanki” odczynników oraz sprz´tu laboratoryjnego, z których uczniowie wybierajà i zesta-
wiajà elementy niezb´dne do przeprowadzenia eksperymentu.
■
Form´ zamówieƒ sk∏adanych przez uczniów na odczynniki i sprz´t konieczny do przeprowadze-
nia okreÊlonego doÊwiadczenia. W tym wypadku dodatkowo istnieje mo˝liwoÊç praktycznej weryfi-
kacji w toku dzia∏ania i samooceny poprawnoÊci pomys∏u.
■
Tworzenie „banku” uczniowskich pytaƒ do okreÊlonych dzia∏ów programowych, które wykorzy-
stuj´ na lekcjach powtórzeniowych. Pytania te uk∏adajà uczniowie z ró˝nych zespo∏ów klasowych
i deponujà u nauczyciela. Ta forma pracy wyzwala inwencj´ twórczà uczniów uzdolnionych, prowa-
dzàc cz´sto do ciekawych i nowych sformu∏owaƒ, np. Oceƒ wartoÊç logicznà zdania (prawda/fa∏sz)
„Izotopy to atomy o tej samej liczbie atomowej i ró˝nej ró˝nicy liczby masowej i atomowej” oraz
wzbogaca obudow´ dydaktycznà przedmiotu.
■
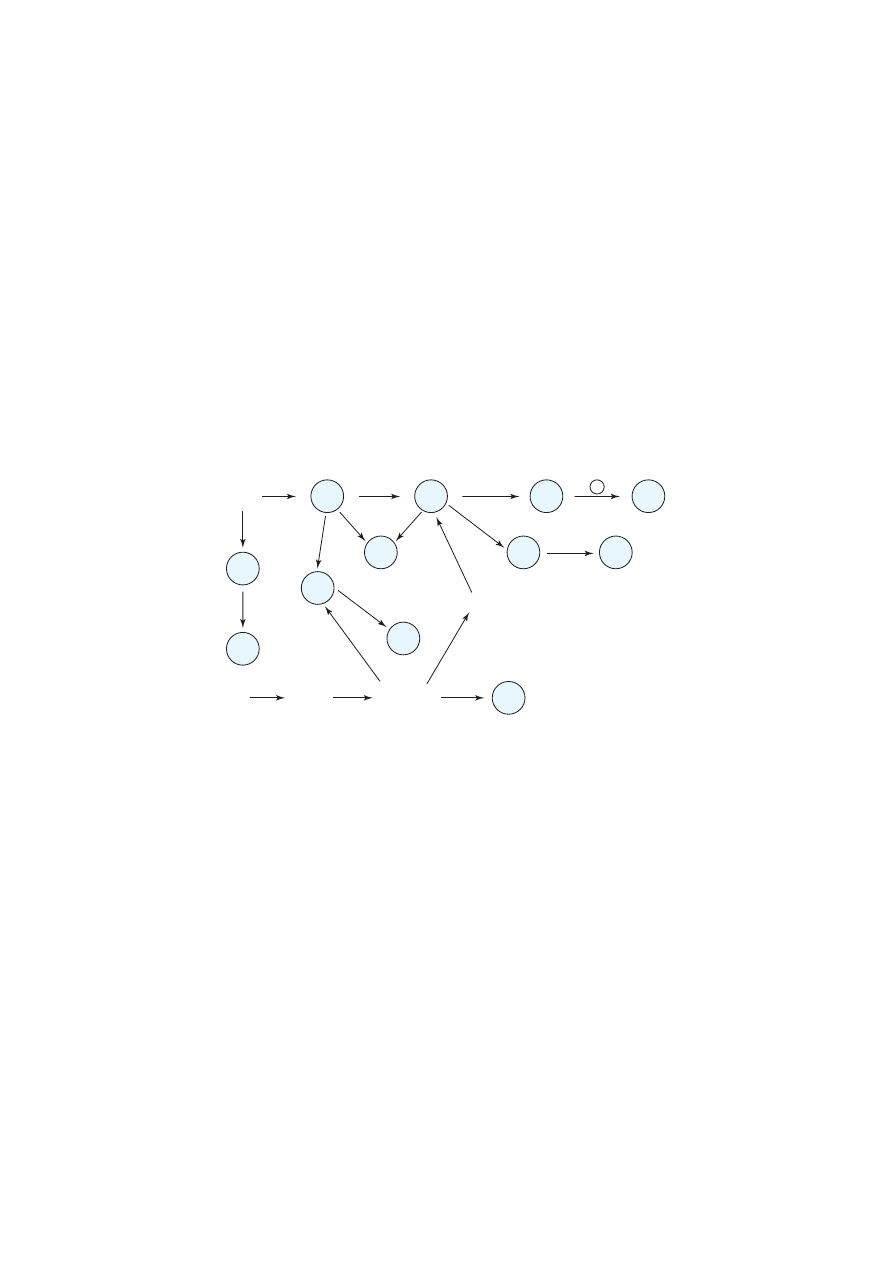
Wzmocnienie zasady trwa∏oÊci pozyskanej wiedzy – dzi´ki korzystaniu z chemografów, ∏àczàcych
wiadomoÊci z chemii organicznej i nieorganicznej, którego przyk∏ad podaj´ poni˝ej.
Ta forma permanentnego utrwalania wiadomoÊci cieszy si´ du˝ym zainteresowaniem uczniów i jest
êród∏em wiàzania wiadomoÊci w jednà ca∏oÊç.
■
Ciàg∏e zwracanie uwagi na poprawnoÊç j´zykowà i naukowà podczas formu∏owaniu wniosków
i sàdów oraz dok∏adne czytanie poleceƒ przez uczniów. Praktyka dowodzi, ˝e zdecydowana wi´k-
szoÊç b∏´dnych odpowiedzi nie wynika z braku stosownej wiedzy, lecz z ma∏ej precyzyjnoÊci, a cz´sto
wr´cz „niechlujnoÊci” j´zykowej w zapisywaniu odpowiedzi, ma∏ej koncentracji przy uzgadnianiu
wspó∏czynników w prostych równaniach reakcji, a tak˝e z braku odpowiedzi na wszystkie postawio-
ne pytania. Dlatego systematyczne zwracanie uwagi na te podstawowe problemy pot´guje czujnoÊç
uczniów i chroni ich przed niepotrzebnymi pora˝kami. Nale˝y to ka˝dorazowo czyniç w bie˝àcej pra-
cy lekcyjnej, ale mo˝na te˝ w fazie wprowadzajàcej do lekcji stosowaç polecenia typu: znajdê b∏´dy
w uczniowskim stwierdzeniu: „wodorotlenek miedzi jest nierozpuszczalny w wodzie”.
■
Prowadzenie próbnych egzaminów maturalnych. Ta forma dzia∏ania wprowadzona w praktyk´
szkolnà jest potwierdzeniem zasady, ˝e „trening czyni mistrza” i dlatego jest ona preferowanà przeze
mnie metodà podnoszenia kompetencji uczniów. Z tegorocznymi absolwentami w czasie ich nauki
szkolnej przeprowadzi∏em 12 takich prób. By∏y to 3 próby w ramach wspó∏dzia∏ania z OKE oraz 9 z w∏a-
snej inspiracji, do których wykorzysta∏em arkusze egzaminacyjne z matur próbnych przeprowadzonych
w innych regionach Polski. Egzaminy próbne by∏y prowadzone dla ch´tnych uczniów, gdy˝ odbywa∏y si´
w czasie pozalekcyjnym (w wolne soboty i w ferie szkolne) i pe∏ni∏y one funkcj´ szkoleniowo-diagno-
stycznà zarówno dla mnie, jak i dla moich podopiecznych.
Bardzo istotnym elementem tego dzia∏ania jest dok∏adna analiza wraz z uczniami b∏´dów, które
uczniowie automatycznie eliminowali w kolejnych pracach.
■
Inne formy wzmagania aktywnoÊci uczniów, jako wspó∏autor przedstawi∏em w czasopiÊmie
„Chemia w Szkole”, Nr 3/1995 i Nr 1/2001.
C
2
H
6
Cu
CuCl
2
Cu(OH)
2
– H
2
– H
2
O
A
+CuO(r)
B
+
C
I
H
+Cl
2
K
+NaOH
B
B
NH
3
G
CuO
+Cu(OH)
2
F
+KMn
O
4
(aq)
E
+HBr
+HBr
+Na
D
B
+H
2
O

III. Konstrukcja arkusza egzaminacyjnego
Problemy do rozwiàzania zawarte zarówno w arkuszu I, jak i II tegorocznej matury z chemii doty-
czy∏y podstawowych treÊci programowych nauczanego przedmiotu i by∏y spójne z Podstawà progra-
mowà… oraz ze standardami wymagaƒ egzaminacyjnych zawartymi w informatorze maturalnym.
Obejmowa∏y szeroki zakres istotnych i typowych treÊci programowych, z którymi uczeƒ zapoznaje si´
na lekcjach chemii i styka w ˝yciu codziennym. Formu∏a pytaƒ by∏a zgodna z podstawowymi zasada-
mi nowego egzaminu maturalnego, gdy˝ umo˝liwi∏a sprawdzenie wiadomoÊci i umiej´tnoÊci
uczniów. Wymaga∏a wiadomoÊci i ich rozumienia, korzystania i tworzenia informacji naukowych,
a wi´c priorytetowych walorów intelektualnych, jakimi powinien charakteryzowaç si´ absolwent
wspó∏czesnej polskiej szko∏y ponadgimnazjalnej.
■
Jedyne zastrze˝enie, jakie wnosz´ ze swojej strony, to brak zadaƒ z zakresu jak˝e wa˝nych st´-
˝eƒ molowych i przeliczania st´˝eƒ roztworów. Nie by∏o równie˝ ani jednego zadania obliczeniowe-
go z zakresu chemii organicznej. Sugeruj´, aby w przysz∏oÊci wprowadziç te wa˝kie problemy, kosz-
tem zmniejszenia nadmiaru, wed∏ug mojej oceny, liczby pytaƒ z zakresu eksperymentów
chemicznych. Ca∏y uk∏ad arkuszy oceniam mimo wszystko jako przyjazny dla uczniów, pozwalajàcy
na obiektywnà ocen´ ich realnych wiadomoÊci oraz umiej´tnoÊci z zakresu chemii i, jak wynika z opi-
nii wi´kszoÊci moich zdajàcych uczniów, nie by∏ dla nich zaskoczeniem, gdy˝ mia∏ podobnà struktu-
r´ i stopieƒ trudnoÊci, jak wczeÊniejsze arkusze rozwiàzywane w czasie matur próbnych.
■
Pozyskane kolejne doÊwiadczenia w pracy pedagogicznej b´dà szczególnie cennà wskazówkà do
jeszcze lepszej organizacji pracy w celu podnoszenia poziomu kszta∏cenia.
Wyszukiwarka
Podobne podstrony:
Reminiscencja
Brown Derren Reminiscence
Muzykoterapia i reminiscencja
Reminiscencje e 01dk
Federal Writers Project Wyoming Folklore Reminiscences, Folktales, Beliefs, Customs, and Folk Spee
Edward Winter Reminiscences by Capablanca
Capablanca 03 Reminiscencias de Capablanca Edward Winter
1918 Reminiscencias OBrasileiroquemaissabe
1943 15 de Novembro Reminiscencias
Reminiscencje wiedeńskie
Reminiscencje wspomnienia i refleksje
Reminiscences and Recollections
Derren Brown Reminiscence
Jan Strzelecki, reminiscencje sentymentalne
Samotna Włóczęga Na Planetę Reminiscencji
więcej podobnych podstron