
1
ĆWICZENIE 4
ELEMENTARNA ANALIZA JAKOŚCIOWA
ZWIĄZKÓW ORGANICZNYCH
Celem ćwiczenia jest identyfikacja związku organicznego – ustalenie nazwy i
wzoru (sumarycznego i strukturalnego).
1. Próby wstępne – demonstracja
- próba spalania,
- wykrywanie węgla i wodoru,
- próba Beilsteina,
- stapianie z metalicznym sodem – przesącz sodowy.
2. Obserwacja substancji pod mikroskopem.
3. Wykrywanie azotu, siarki, fluorowców w przesączu.
4. Obliczenie wzoru uproszczonego na podstawie składu procentowego pierwiastków.
5. Badanie rozpuszczalności związku – zakwalifikowanie związku do określonej grupy
rozpuszczalności.
6. Wyznaczenie temperatury topnienia związku – demonstracja.
7. Ustalenie wzoru rzeczywistego związku i jego nazwy na podstawie zebranych
informacji – „Poradnik fizykochemiczny”.

2
Analiza jakościowa związków organicznych
Analiza jakościowa związków organicznych sprowadza się do wykrycia rodzaju
atomów pierwiastków tworzących cząsteczkę. W związku z tym, że większość związków
organicznych zawiera oprócz atomów węgla i wodoru jedynie atomy kilku innych
pierwiastków, takich jak: azot, siarka, tlen, fluorowce (chlor, brom jod), fosfor, względnie -
znacznie rzadziej, selen, krzem i niektóre metale, analiza jakościowa nie przedstawia
większych trudności.
Przed przystąpieniem do analizy należy wykonać tzw. próby wstępne, do których
należy:
- określenie stanu skupienia substancji, ewentualnie obserwacja kryształów pod
mikroskopem,
- ustalenie, czy jest to związek organiczny, wykonując próbę spalania i wykrywanie węgla i
wodoru,
- stwierdzenie, czy substancja zawiera fluorowce, na podstawie próby Beilsteina,
- zakwalifikowanie związku w stanie stałym do określonej grupy rozpuszczalności,
wykonując próby rozpuszczalności,
- przygotowanie substancji do wykrywania pozostałych pierwiastków (azotu, siarki i
fluorowców) – stapianie z metalicznym sodem.
Próba spalania
Analizę jakościową związku organicznego rozpoczyna się zwykle od próby spalania.
Jeżeli badana substancja pali się płomieniem (często kopcącym), lub po odpowiednim
prażeniu daje czarną pozostałość, która stopniowo zanika, substancja ta zawiera węgiel.
Wykonanie: ok. 0,1g badanej substancji umieszcza się na łyżce porcelanowej lub w
porcelanowym tygielku i ogrzewa się początkowo bardzo ostrożnie w płomieniu palnika,
następnie silniej, wreszcie praży się. Należy obserwować zachodzące zjawisko.
Wykrywanie węgla i wodoru
Węgiel i wodór można łatwo wykryć przez ogrzewanie związku z tlenkiem
miedziowym, dzięki czemu utlenia się do dwutlenku węgla, a wodór do wody:
O
H
CO
Cu
CuO
H
C
2
2
,

3
Wykonanie: ok. 0,1g substancji uprzednio osuszonej miesza się z 1-2g wyprażonego tlenku
miedziowego. Probówkę zatyka się korkiem z rurką zgiętą pod takim kątem, aby
wywiązujące się gazy mogły być odprowadzane pod warstwę klarownego roztworu
wodorotlenku wapniowego (wody wapiennej) znajdującego się w drugiej probówce. Po
odpowiednim zestawieniu aparatury ogrzewa się zawartość probówki z substancją
początkowo bardzo ostrożnie, potem stopniowo, aż do ciemnej czerwieni. Powstający w tych
warunkach CO
2
powoduje zmętnienie wody wapiennej, względnie powstanie białego osadu:
O
H
CaCO
OH
Ca
CO
2
3
2
2
Jeżeli w chłodniejszej części tej probówki pojawią się na ścianach kropelki wody, świadczą
one o obecności wodoru w badanej substancji.
Wyniki doświadczenia nie są miarodajne jeśli badana substancja była wilgotna lub
zawierała wodę krystalizacyjną.
Wykrywanie fluorowców - próba Beilsteina
Wykonanie: na drucie lub siatce miedzianej, wyprażonej w płomieniu palnika aż do zaniku
zielonego zabarwienia i ochłodzonej, umieszcza się szczyptę badanej substancji lub jej kroplę
i wprowadza się do nieświecącego płomienia palnika. W tych warunkach następuje rozkład
związku organicznego z wytworzeniem lotnych połączeń halogenomiedziowych, barwiących
nieświecący płomień na kolor intensywnie zielony.
Stapianie z metalicznym sodem
Pozostałe pierwiastki znajdujące się w analizowanym związku organicznym (azot,
siarkę, fluorowce) wykrywa się dopiero po przekształceniu ich w połączenia jonowe, dobrze
rozpuszczalne w wodzie. W tym celu wykonuje się stapianie z metalicznym sodem, które
powoduje rozkład związku, a pierwiastki, z których jest zbudowany, przekształcają się w
aniony. Azot, siarka i fluorowce, znajdują się w roztworze w postaci anionów: cyjankowego
CN
-
, siarczkowego S
2-
, chlorkowego Cl
-
, bromkowego Br
-
, jodkowego J
-
:
N S Cl Br J
NaCN Na S NaCl NaBr NaJ
Na
, , ,
,
,
,
,
,
2
Poszczególne aniony wykrywa się, metodami, stosowanymi w analizie jakościowej
nieorganicznej.
Wykonanie: w małej, suchej fiolce np. o wymiarach ok. 60x5mm umieszcza się na przemian
drobne kawałeczki metalicznego sodu z rozdrobnioną substancją. Tak przygotowaną fiolkę,
umieszczoną pionowo w łapie metalowej, ogrzewa się słabym płomieniem aż sód stopi się.

4
Następnie fiolkę rozgrzewa się do temperatury tzw. czerwonego żaru i gorącą fiolkę wrzuca
się do parowniczki zawierającej około 10 cm
3
wody destylowanej. Jeżeli probówka nie pęknie
można rozbić ją za pomocą szklanej bagietki, probówkę rozdrabnia się i miesza zawartość
parownicy. Parowniczkę z roztworem ogrzewa się do wrzenia i sączy. Przesącz, który
powinien być bezbarwny względnie jasnożółty i alkaliczny, służy do wykrywania azotu,
siarki i fluorowców.
Wykrywanie azotu
Metoda Lassaigne
’
a: ok. 2 cm
3
przesączu po stopieniu ze sodem przenosi się do
probówki, dodaje około 0,1 - 0,2 g sproszkowanego FeSO
4
, mieszaninę ogrzewa się łagodnie
aż do zagotowania, wstrząsając probówką. Następnie dodaje się rozcieńczonego kwasu
siarkowego (VI) H
2
SO
4
aż do uzyskania odczynu kwaśnego.
4
2
6
4
4
6
SO
Na
CN
Fe
Na
FeSO
NaCN
Pod wpływem tlenu z powietrza część jonów żelaza (II) utlenia się do żelaza (III), które po
dodaniu kwasu siarkowego (VI) występują w postaci siarczanu (VI) żelaza (III) Fe
2
(SO
4
)
3
:
Fe
2+
2
O
Fe
3+
2Fe
3+
+ 3H
2
SO
4
Fe
2
(SO
4
)
3
+6H
+
Wytrącenie się niebieskiego osadu błękitu pruskiego Fe
4
[Fe(CN)
6
]
3
(lub pojawienie się
niebieskiego zabarwienia roztworu), świadczą o obecności azotu:
2Fe
2
(SO
4
)
3
+ 3Na
4
Fe(CN)
6
Fe
4
[Fe(CN)
6
]
3
↓+ 6Na
2
SO
4
.
Wykrywanie siarki
Jeżeli badana substancja zawiera siarkę, po dodaniu FeSO
4
, przy wykrywaniu azotu
metodą Lassaigne’a, wytrąca się czarny osad siarczku żelaza (II) FeS, który roztwarza się po
dodaniu rozcieńczonego H
2
SO
4
, z wydzieleniem siarkowodoru H
2
S:
Na
2
S + FeSO
4
FeS↓ + Na
2
SO
4
FeS↓ + H
2
SO
4
FeSO
4
+ H
2
S↑
Reakcja z nitroprusydkiem sodu: do 1cm
3
roztworu po stopieniu ze sodem (przesączu)
dodaje się kilka kropli świeżo przygotowanego, rozcieńczonego roztworu nitroprusydku
sodowego. Pojawienie się zabarwienia czerwonofioletowego, zanikającego po chwili,
świadczy o obecności siarki:
Na
2
S + Na
2
Fe(CN)
5
NO Na
4
Fe(CN)
5
NOS.
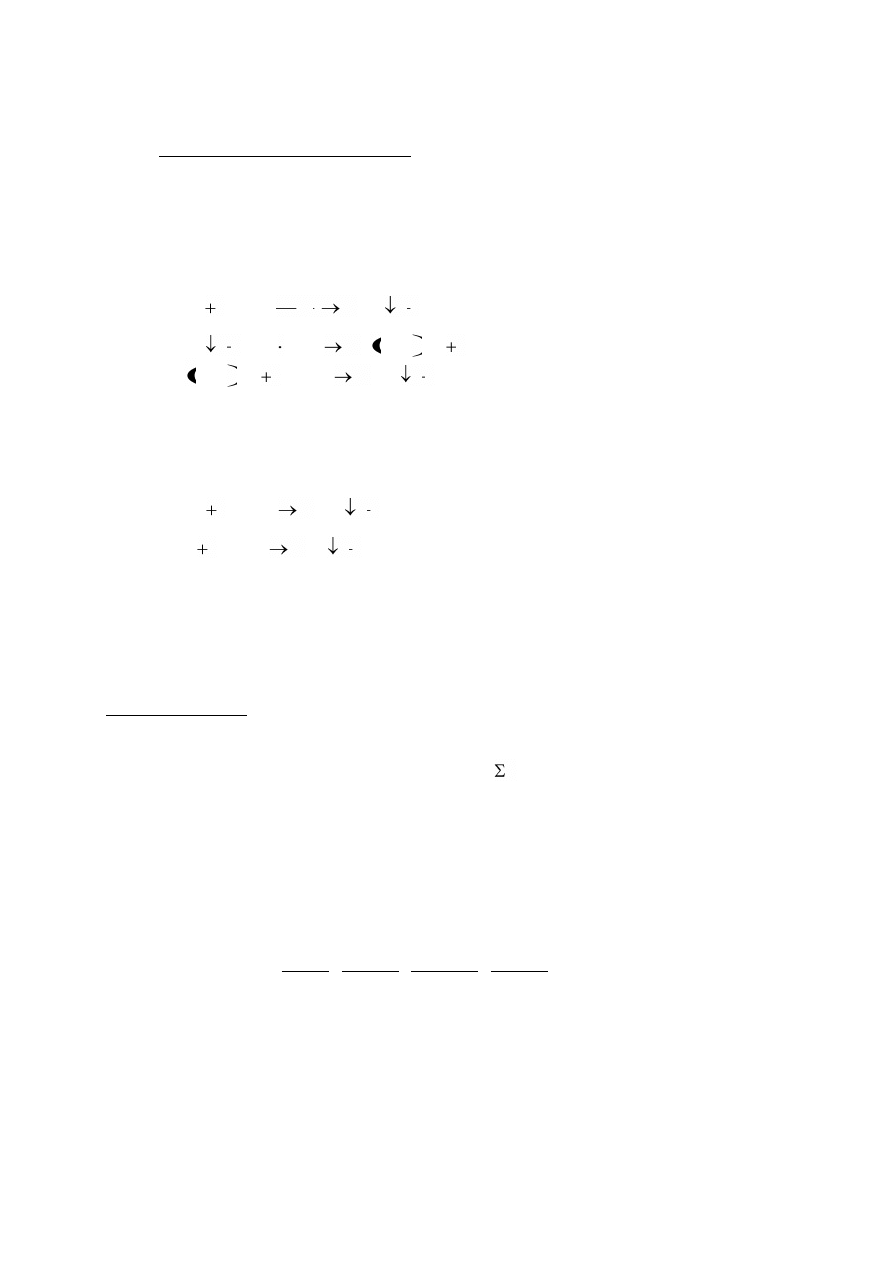
5
Wykrywanie fluorowców
Reakcja z azotanem (V) srebra: około 1cm
3
przesączu zakwasić w probówce
rozcieńczonym kwasem azotowym (V) HNO
3
i dodać kroplami roztwór azotanu (V) srebra
AgNO
3
. Strącanie się osadu świadczy o obecności fluorowca. Jeżeli substancja zawierała
chlor, tworzy się biały, serowaty osad AgCl, rozpuszczalny w amoniaku (można użyć stęż.) i
wytrącający się z powrotem po zakwaszeniu HNO
3
:
3
3
3
NaNO
AgCl
AgNO
NaCl
HNO
3
4
3
2
3
2
2
3
2
3
2
2
2
2
NO
NH
AgCl
HNO
Cl
NH
Ag
O
H
Cl
NH
Ag
O
H
NH
AgCl
W przypadku obecności bromu i jodu w analizowanej substancji, po dodaniu roztworu
AgNO
3
do przesączu zakwaszonego HNO
3
, powstają żółte osady bromku srebra AgBr i jodku
srebra:
3
3
NaNO
AgBr
AgNO
NaBr
3
3
NaNO
AgJ
AgNO
NaJ
Ustalenie wzoru uproszczonego związku.
Po określeniu składu jakościowego badanego związku, ustala się jego wzór
uproszczony , zwany również empirycznym, na podstawie wyników analizy ilościowej .
Przykład obliczeń: na podstawie analizy jakościowej i ilościowej ustalono, że badana
substancja zawiera ona węgiel, wodór, azot i tlen. Ich procentowa zawartość jest następująca:
C - 20,00%, H - 6,71%, N - 46,65%, O - 26,64% ( = 100,00%).
Na podstawie składu procentowego poszczególny pierwiastków należy obliczyć,
liczbę atomów węgla, wodoru, azotu i tlenu we wzorze empirycznym: C
x
H
y
N
z
O
f
Stosunek ilościowy poszczególnych pierwiastków jest wprost proporcjonalny do ich
mas atomowych pomnożony przez ich ilości:
20,00 : 6,71 : 46,65 : 26,64 = 12,011x : 1,00794y : 14,00674z : 15,9994f
x:y:z:f =
9994
,
15
64
,
26
:
00674
,
14
65
,
46
:
00794
,
1
71
,
6
:
011
,
12
00
,
20
x:y:z:f = 1,6651 : 6,6571 : 3,3305 : 1,6651
/
:1,6651
x:y:z:f = 1 : 4 : 2 : 1
Wzór C
1
H
4
N
2
O
1
jest wzórem empiryczny badanej substancji.

6
Rozpuszczalność połączeń organicznych
Celem ćwiczenia jest identyfikacja badanej substancji przez rozpuszczanie jej w
określonych rozpuszczalnikach. Rozpuszczalność substancji jest ściśle związana z budową
substancji. O rozpuszczalności substancji w pewnym stopniu decyduje podobieństwo budowy
substancji rozpuszczonej i rozpuszczalnika. Związki o charakterze polarnym rozpuszczają się
łatwiej w rozpuszczalnikach polarnych, natomiast związki o charakterze niepolarnym
trudniej.
Szkło i aparatura: probówki, zakraplacze.
Odczynniki: woda destylowana, 5% NaOH, 5% HCl, 5% NaHCO
3
,
stęż. H
2
SO
4
,
85% H
3
PO
4
, benzen.
Wykonanie: do probówki pobrać badaną substancję w ilości 0,1 g (lub 0,2 cm
3
) i rozpuścić
łącznie w 3 cm
3
danego rozpuszczalnika, dodając każdorazowo po 1 cm
3
rozpuszczalnika i
wytrząsając po każdej dodanej porcji.
Substancję uważa się za rozpuszczoną, jeżeli podane ilości rozpuszczą się w 3 cm
3
rozpuszczalnika. Jeżeli substancja nie rozpuszcza się natychmiast, należy wstrząsać probówkę
przez 1-2 minuty. Wszystkie próby wykonuje się w temperaturze pokojowej.
Przy oznaczaniu rozpuszczalności danej substancji postępować według załączonego schematu
i na tej podstawie zakwalifikować substancję do odpowiedniej grupy związków.
Poniżej przedstawiono schemat postępowania przy badaniu rozpuszczalności związku.
W schemacie znak „+” oznacza rozpuszczalność, a „-” nierozpuszczalność, E
1
- dobrze
rozpuszczalne, E
2
- związki polarne, kw
1
- mocne kwasy, kw
2
- słabe kwasy, Z - związki
zasadowe, R - związki obojętne, N - związki nie reagujące, O
1
- związki o słabszej
zasadowości i mniejszej apolarności, O
2
- związki apolarne (przewaga wpływów apolarnych).
Wyniki badań zestawia się w tabeli grup rozpuszczalności.
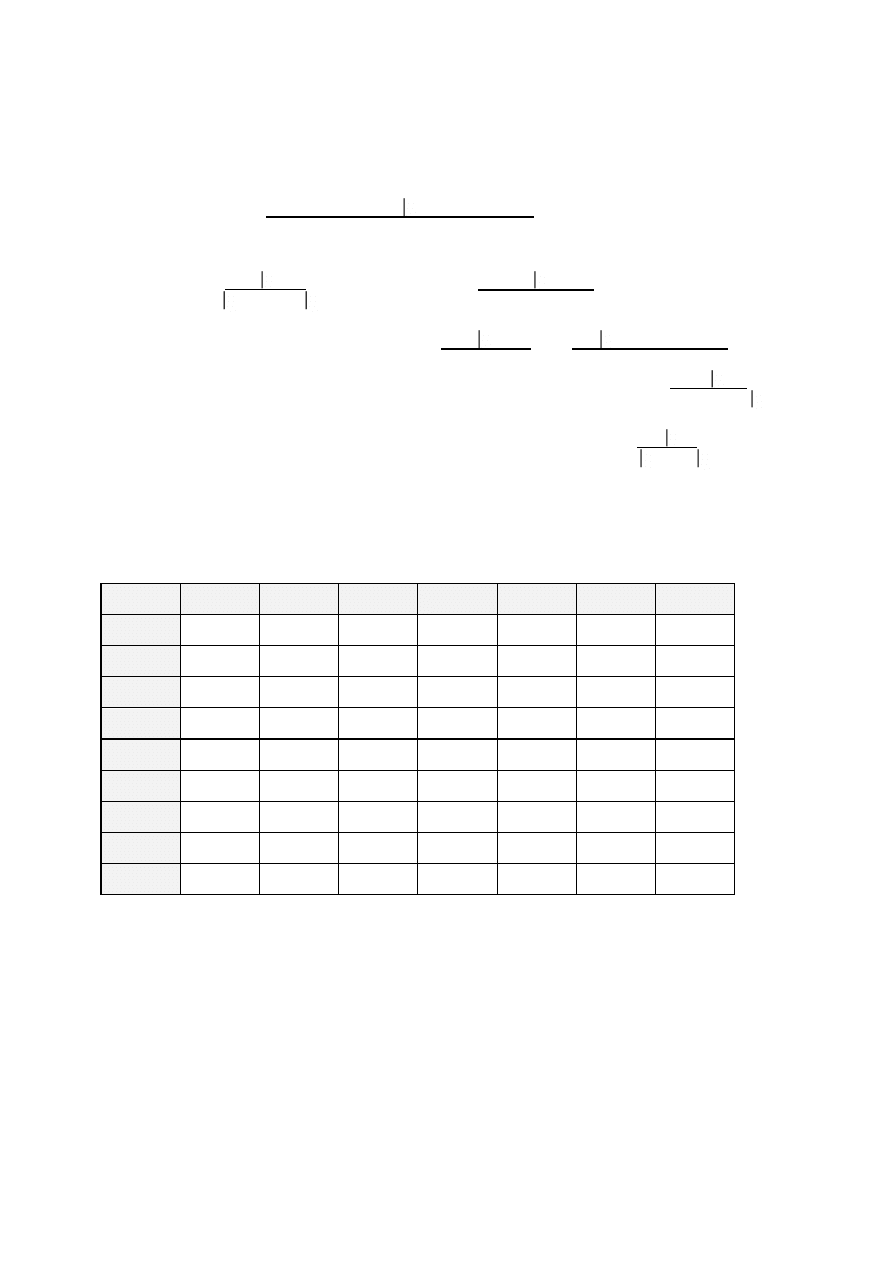
7
Schemat rozpuszczalności związków organicznych:
Woda
+__
_ _ -
↓
↓
Benzen (eter)
NaOH
+ -
+
-
↓
↓
E
1
E
2
NaHCO
3
HCl
+ - + - -
kw
1
kw
2
Z R
H
2
SO
4
+ -
↓
H
3
PO
4
N
+ -
O
1
O
2
Grupy rozpuszczalności związków organicznych
Grupy
Woda
Eter
NaOH
NaHCO
3
HCl
H
2
SO
4
H
3
PO
4
E
1
+
+
E
2
+
-
kw
1
-
+
+
kw
2
-
+
-
Z
-
-
+
R
-
-
-
O
1
-
-
-
+
+
O
2
-
-
-
+
-
N
-
-
-
-

8
Podział substancji organicznych należących do poszczególnych grupy rozpuszczalności:
E
1
- związki rozpuszczalne w benzenie (lub eterze) i wodzie: niższe homologi alkoholi, aldehydów,
ketonów, kwasów, estrów, fenoli, bezwodników, amin, nitryli, polifenoli;
E
2
- związki rozpuszczalne w wodzie i nierozpuszczalne w eterze : kwasy wielokarboksylowe i
hydroksykwasy, glikole, alkohole poliwodorotlenowe, określone amidy, aminokwasy, związki
poliaminowe,kwasy sulfonowe i sulfinowe, sole;
kw
1
i kw
2
- związki rozpuszczalne w 5% NaOH: kwasy, fenole, imidy, I i II rzędowe związki
nitrowe, merkaptany, tiofenole, kwasy sulfonowe, sulfinowe, alkilosiarkowe, sulfonamidy, niektóre
dwuketony;
Z - związki rozpuszczalne w 5% HCl: aminy I i II rzędowe, aminy alifatyczne, aryloalkiloaminy, III
rzędowe aminy alifatyczne i niektóre III rzędowe aryloalkiloaminy, hydrazyny;
O
1
, O
2
- związki nie zawierające azotu lub siarki, rozpuszczalne tylko w stężonym H
2
SO
4
:
węglowodory nienasycone, niektóre polialkilowe węglowodory aromatyczne, alkohole, aldehydy,
ketony, estry bezwodniki, etery, acetale, laktany, chlorki kwasowe;
N - związki nie zawierające azotu lub siarki, nie rozpuszczalne w stężonym H
2
SO
4
: węglowodory
nasycone alifatyczne, alicykliczne, aromatyczne, pochodne chlorowcowe węglowodorów 1, 2 i 3,
etery diarylowe;
R - związki zawierające azot lub siarkę, nie podane w grupach poprzednich: związki nitrowe III
rzędowe, amidy i pochodne aldehydów i ketonów, nitryle, aminy z podstawnikami ujemnymi,
związki nitrozowe, azo-, hydrazo-, sulfony, sulfonamidy, pochodne amin II rzędowych, siarczki,
siarczany.
Wyszukiwarka
Podobne podstrony:
Analiza jakościowa związków organicznych
Analiza jakościowa związków organicznych, STUDIA IŚ, semestr III, Chemia
analiza jakościowa związków organicznych(1)
analiza jakościowa związków organicznych(1)
Analiza jakościowa związków organicznych
Analiza klasyczna związku organicznego I 2012
Analiza klasyczna związku organicznego II 2012
cwiczenie 4 Analiza jakosciowa zwiazkow org
Elementy analizy jakosciowej kationy id 112043
Elementy analizy jakosciowej aniony id 112042
Analiza klasyczna związku organicznego II
cw 1 elementy analizy jakosciowej
Analiza jakościowa, Chemia organiczna
Analiza klasyczna związku organicznego
Analiza klasyczna związku organicznego I 2012
więcej podobnych podstron