
Analiza jakościowa
związków organicznych

Analiza jakościowa związków organicznych
sprowadza się do wykrycia rodzaju atomów
pierwiastków tworzących cząsteczkę. Ze
względu na to, że większość związków
organicznych zawiera oprócz atomów węgla i
wodoru jedynie atomy kilku innych
pierwiastków, takich jak: azot, siarka, tlen,
fluorowce (chlor, brom jod), fosfor, względnie
- znacznie rzadziej, selen, krzem i niektóre
metale, analiza jakościowa nie przedstawia
większych trudności.

Do zadań analizy elementarnej należy
stwierdzenie czy w badanym związku
występują takie pierwiastki jak azot, siarka,
chlorowce ewentualnie węgiel i wodór.
Analiza ta nie daje jednak żadnej informacji
o sposobie ich połączenia.
Elementarna analiza jakościowa

Przed przystąpieniem do analizy należy wykonać tzw. próby
wstępne, do których należy:
- określenie stanu skupienia substancji, ewentualnie
obserwacja kryształów pod mikroskopem,
- ustalenie, czy jest to związek organiczny, wykonując próbę
spalania i wykrywanie węgla i wodoru,
- stwierdzenie, czy substancja zawiera fluorowce, na
podstawie próby Beilsteina,
- zakwalifikowanie związku w stanie stałym do określonej
grupy rozpuszczalności, wykonując próby rozpuszczalności,
- przygotowanie substancji do wykrywania pozostałych
pierwiastków (azotu, siarki i fluorowców) – stapianie z
metalicznym sodem.

Analizę jakościową związku organicznego
rozpoczyna się zwykle od próby spalania. Jeżeli
badana substancja pali się płomieniem (często
kopcącym), lub po odpowiednim prażeniu daje
czarną pozostałość, która stopniowo zanika,
substancja ta zawiera węgiel. Wykonanie: ok.
0,1g badanej substancji umieszcza się na łyżce
porcelanowej lub w porcelanowym tygielku i
ogrzewa się początkowo bardzo ostrożnie w
płomieniu palnika, następnie silniej, wreszcie
praży się. Należy obserwować zachodzące
zjawisko.
Próba spalania

Węgiel i wodór można łatwo wykryć przez
ogrzewanie związku z tlenkiem
miedziowym, dzięki czemu utlenia się do
dwutlenku węgla, a wodór do wody:
C, H + CuO Cu+ CO2↑ -H20 ↑
Wykrywanie węgla i
wodoru

Fluorowce są pierwiastkami o wysokiej elektroujemności i dużej
aktywności chemicznej. W stanie pierwiastkowym występują w
formie dwuatomowych cząsteczek. W związkach chemicznych
występują na stopniach utlenienia od -1 do +7. Do pełnego
zapełnienia swojej powłoki walencyjnej potrzebują jednego
elektronu, dlatego najczęściej tworzą jednoujemny anion. Ze
związkami organicznymi wchodzą w reakcje addycji oraz
podstawienia.
Próba Beilsteina Obecność chloru, bromu i jodu w związkach
organicznych można wstępnie stwierdzić spalając badany
związek na szpatelce miedzianej i obserwując zabarwienie
płomienia. Próba ta jest bardzo czuła, ale ma jedynie
orientacyjny charakter, ponieważ dają ją również związki nie
zawierające fluorowców (np. cyjanki, mocznik, fenole i niektóre
kwasy organiczne).
Wykrywanie fluorowców

Pozostałe pierwiastki znajdujące się w
analizowanym związku organicznym (azot, siarkę,
fluorowce) wykrywa się dopiero po
przekształceniu ich w połączenia jonowe, dobrze
rozpuszczalne w wodzie. W tym celu wykonuje się
stapianie z metalicznym sodem, które powoduje
rozkład związku, a pierwiastki, z których jest
zbudowany, przekształcają się w aniony. Azot,
siarka i fluorowce, znajdują się w roztworze w
postaci anionów: cyjankowego CN-, siarczkowego
S2-, chlorkowego Cl-, bromkowego Br-, jodkowego
J.
Stapianie z metalicznym
sodem

Metoda Lassaigne’a służy nam do
wykrywania azotu, siarki i fluorowców.
jakościowa metoda oznaczania azotu,
fluorowców i siarki w związkach organicznych.
Badana próbka jest stapiana z sodem w celu
wytworzenia cyjanków, halogenków lub
siarczków, identyfikowanych następnie
klasycznymi metodami po rozpuszczeniu
stopu w wodzie.
Wykrywanie azotu, fluorowców i
siarki.

Analiza jakościowa związków organicznych
nie wymaga na ogół potwierdzenia
obecności w badanych próbkach atomów
węgla i wodoru. Jeżeli jednak zachodzi taka
konieczność, obecność tych pierwiastków
można stwierdzić na podstawie opisanych
poniżej prób. Orientacyjnie obecność węgla
stwierdza się, spalając substancję w
płomieniu palnika.
Próba na obecność węgla i
wodoru

Rozpuszczalność
Cechą silnie związaną z budową substancji jest jej
rozpuszczalność w określonych
rozpuszczalnikach. Podobieństwo budowy
chemicznej związku rozpuszczanego i
rozpuszczalnika w dużej mierze decyduje o
rozpuszczalności w myśl zasady „ similia similibus
solvuntur ” (podobne rozpuszcza podobne). Dla
potrzeb analizy organicznej przyjęto system
wprowadzony przez Shrinera, Fusona i Curtina
kwalifikacji związków do jednej z siedmiu grup
rozpuszczalności
Rozpuszczalność

Przeprowadzenie prób rozpuszczalności badanego
związku oraz znajomość (z analizy elementarnej)
rodzaju pierwiastków wchodzących w skład jego
cząsteczki pozwala na zakwalifikowanie analizowanej
substancji do określonej grupy rozpuszczalności
(zgodnie z tabelą 1). Należy jednak pamiętać, że
wykonane próby mają znaczenie orientacyjne i do
końca nie przesądzają o budowie badanej substancji.
Pojawiające się trudności dotyczą szczególnie
związków zawierających kilka grup funkcyjnych. Duże
problemy w interpretacji wyników stwarza zwłaszcza
obecność grup nitrowych w badanych związkach.
Grupy rozpuszczalności

Woda – należy do rozpuszczalników polarnych, rozpuszcza
związki organiczne silnie polarne należące najczęściej do
niższych członów homologicznych.
Eter dietylowy – jest związkiem o małej cząsteczce
posiadającej słabo zasadowe wolne pary elektronowe mogące
tylko w małym stopniu uczestniczyć w tworzeniu wiązań
wodorowych z kwasami. Eter rozpuszcza związki rozpuszczalne
w wodzie (grupa E1) zawierające pewne grupy niepolarne z
niewielkimi fragmentami polarnymi (np. alkohole
jednowodorotlenowe). Nie rozpuszcza związków z dominującymi
grupami polarnymi (grupa E2) (np. cukry).
5% roztwór NaOH – jest rozpuszczalnikiem związków, które z
zasadą sodową dają sole rozpuszczalne w wodzie. Reakcjom tym
ulegają kwasy które, ze względu na zbyt dużą cząsteczkę w
stosunku do ilości grup polarnych są nierozpuszczalne w wodzie
Rozpuszczalniki stosowane w
badaniach rozpuszczalności

5% roztwór NaHCO3 – różnicuje nierozpuszczalne w wodzie
kwasy na mocniejsze (grupa K1) lub słabsze (grupa K2) od
H2CO3.
5% roztwór HCl – pozwala na rozpuszczenie związków o
charakterze zasadowym tworzących w wodzie rozpuszczalne
chlorowodorki.
stężony H2SO4 – rozpuszcza wszystkie związki z wyjątkiem
związków typowo niepolarnych. Przy badaniu rozpuszczalności w
tym rozpuszczalniku często pojawia się nierozpuszczalny osad
produktu reakcji badanego związku z kwasem siarkowym.
85% H3PO4 – jest kwasem nieco mniej polarnym i
protonodonorowym niż stężony H2SO4, dlatego rozpuszcza
związki o niedużych różnicach w ilości grup niepolarnych w
stosunku do polarnych (grupa O1). Kwas ortofosforowy(V) nie
rozpuszcza związków z przewagą grup niepolarnych (grupa O2).
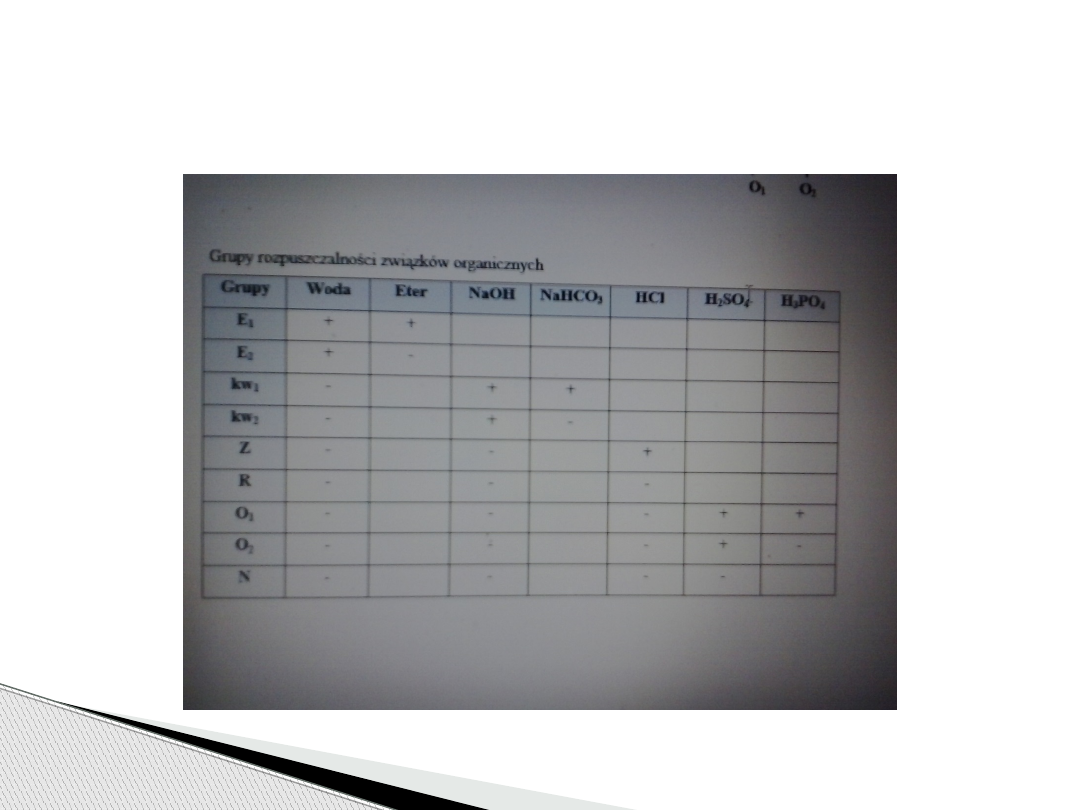
Grupy rozpuszczalności zw.
organicznych

E1 - związki rozpuszczalne w benzenie (lub eterze) i
wodzie: niższe homologi alkoholi, aldehydów,
ketonów, kwasów, estrów, fenoli, bezwodników, amin,
nitryli, polifenoli;
E2 - związki rozpuszczalne w wodzie i nierozpuszczalne w
eterze : kwasy wielokarboksylowe i hydroksykwasy,
glikole, alkohole poliwodorotlenowe, określone amidy,
aminokwasy, związki poliaminowe,kwasy sulfonowe i
sulfinowe, sole;
kw1 i kw2 - związki rozpuszczalne w 5% NaOH: kwasy,
fenole, imidy, I i II rzędowe związki nitrowe, merkaptany,
tiofenole, kwasy sulfonowe, sulfinowe, alkilosiarkowe,
sulfonamidy, niektóre dwuketony
Podział substancji organicznych należących
do poszczególnych grupy rozpuszczalności:

Z - związki rozpuszczalne w 5% HCl: aminy I i II rzędowe, aminy
alifatyczne, aryloalkiloaminy, III rzędowe aminy alifatyczne i
niektóre III rzędowe aryloalkiloaminy, hydrazyny;
O1, O2 - związki nie zawierające azotu lub siarki, rozpuszczalne tylko
w stężonym H2SO4: węglowodory nienasycone, niektóre
polialkilowe węglowodory aromatyczne, alkohole, aldehydy,
ketony, estry bezwodniki, etery, acetale, laktany, chlorki kwasowe;
N - związki nie zawierające azotu lub siarki, nie rozpuszczalne w
stężonym H2SO4: węglowodory nasycone alifatyczne,
alicykliczne, aromatyczne, pochodne chlorowcowe węglowodorów 1, 2
i 3, etery diarylowe;
R - związki zawierające azot lub siarkę, nie podane w grupach
poprzednich: związki nitrowe III rzędowe, amidy i pochodne
aldehydów i ketonów, nitryle, aminy z podstawnikami ujemnymi,
związki nitrozowe, azo-, hydrazo-, sulfony, sulfonamidy, pochodne
amin II rzędowych, siarczki, siarczany.

Schemat rozpuszczalności
związków organicznych

Reakcje węglowodorów aromatycznych
◦
Pierwszym sygnałem obecności układu
aromatycznego w badanym związku jest
charakterystyczny często bardzo kopcący płomień
pojawiający się podczas spalania związku w
płomieniu palnika. Temperatury wrzenia tych
związków wzrastają ze wzrostem masy
cząsteczkowej. Ciekłe węglowodory aromatyczne
są substancjami lżejszymi od wody i praktycznie
w niej nierozpuszczalnymi.
Reakcje charakterystyczne

Badanie rozpuszczalności prowadzi się w
temperaturze pokojowej. Substancje stałe należy
maksymalnie rozdrobnić, gdyż duże kryształy
rozpuszczają się powoli, co może być mylnie
ocenione jako brak ich rozpuszczalności. Po
zmieszaniu związku z rozpuszczalnikiem
probówkę dokładnie się wytrząsa. Należy przy
tym pamiętać, że przy tej czynności roztwór
miesza się z powietrzem, którego banieczki mogą
być mylnie uznane za powstającą emulsję (w
poznaniu tego zjawiska pomaga wykonanie ślepej
próby z czystym rozpuszczalnikiem).
Badanie rozpuszczalności

Grupa funkcyjna -atom lub układ atomów
(nie stanowiący reszty węglowodorowej) w
cząsteczce związku organicznego, który
determinuje specyficzne własności tej
cząsteczki i jest jednocześnie
charakterystyczny dla struktury określonej
klasy związków. Cząsteczka może zawierać
jedną lub więcej grup funkcyjnych, które
mogą być identyczne lub różne.
Grupy funkcyjne

Grupa fenolowa
Grupa hydroksylowa
Grupa aldehydowa
Grupa karboksylowa
Do ważniejszych grup
funkcyjnych należą :

Fenole to związki powstające przez podstawienie
w pierścieniu homoaromatycznym jednego lub
wielu atomów wodoru grupami hydroksylowymi.
W zależności od liczby tych grup fenole dzielimy
na jedno- i wielowodorotlenowe. Związki te
ulegają w niewielkim stopniu dysocjacji w
roztworach wodnych i mają charakter bardzo
słabych kwasów. Tworzą fenolany zarówno w
reakcji z metalicznym sodem jak
i wodorotlenkiem sodowym (odróżnienie od
alkoholi).
Wykrywanie grupy fenolowej:

Do około 1cm
3
roztworu badanego związku
dodać 2-3 krople roztworu FeCl
3
. Powstaje
związek kompleksowy o intensywnym
fioletowym (ew. zielonym) zabarwieniu.
reakcja z FeCl
3

Alkohole można uważać za pochodne wody, w cząsteczce której
jeden atom wodoru został zastąpiony rodnikiem alkilowym lub za
pochodne węglowodorów alifatycznych, w których atom wodoru
został zastąpiony grupą hydroksylową.
Ze względu na ilość grup hydroksylowych w cząsteczce alkohole
dzielimy na jedno- lub wielowodorotlenowe. W zależności od
tego, czy grupa hydroksylowa związana jest z atomem węgla I, II
lub III rzędowym, alkohole dzielimy odpowiednio na: I, II lub III
rzędowe.
Najłatwiej odróżnić rzędowość alkoholi poddając je próbie
Lucasa. Roztworem Lucasa jest bezwodny chlorek cynku
rozpuszczony w stężonym kwasie solnym. Alkohole III rzędowe z
odczynnikiem Lucasa reagują szybko dając chlorki alkilowe,
alkohole II rzędowe reagują wolniej, natomiast alkohole I
rzędowe nie reagują wcale.
Wykrywanie grupy hydroksylowej:

Do około 1cm
3
alkoholu dodać kilka kropli kwasu
organicznego (np. octowego)
i stężonego kwasu siarkowego oraz kamyczek
wrzenny. Ogrzać ostrożnie do wrzenia, zbadać
charakterystyczny dla estrów zapach. Z uwagi na
odwracalny charakter reakcji próba słabo wychodzi
w środowisku wodnym. Kwas siarkowy ma silne
właściwości higroskopijne, wiąże wytwarzającą się
w reakcji wodę, jak również dostarcza jonów
wodorowych, które katalizują reakcję.
H
+
CH
3
COOH + C
2
H
5
OH ⇆ CH
3
COOC
2
H
5
+ H
2
O
Reakcja estryfikacji

Reakcja ta zachodzi tylko dla alkoholi o
wzorze R-CH (OH)-CH
3
(np. etanolu):
Do 2cm
3
alkoholu dodać około 4cm
3
5%
NaOH, wymieszać, dodać 2-3cm
3
płynu
Lugola (roztwór jodu w wodnym roztworze
KI)- wydziela się żółtawy osad jodoformu.
C
2
H
5
OH + NaIO → CH
3
CHO + NaI + H
2
O
CH
3
CHO + 3 NaIO → CI
3
CHO + 3 NaOH
CI
3
CHO + NaOH → ↓CHI
3
+ HCOONa
Reakcja jodoformowa

Aldehydy zawierają jednowartościową,
aktywną chemicznie grupę aldehydową
W skład grupy aldehydowej wchodzi
grupa karbonylowa (ketonowa),
dlatego aldehydy i ketony dają wiele
wspólnych reakcji.
Aldehydy są związkami nietrwałymi. Łatwo
ulegają utlenieniu do odpowiednich kwasów,
redukcji do odpowiednich alkoholi oraz
polimeryzacji, kondensacji oraz reakcji
przyłączania.
Wykrywanie grupy aldehydowej

Do próbówki z roztworem badanej substancji dodać
równą objętość odczynnika Tollensa, po kilku minutach
lub lekkim ogrzaniu na ściankach osadza się tzw. lustro
srebrne, powstające wskutek redukcji jonów
diamosrebrowych do metalicznego srebra. W skład
odczynnika Tollensa wchodzą: 5% AgNO
3
, 15% NaOH,
25% wodnego NH
3
. W wyniku dwuetapowej reakcji
powstaje wodorotlenek diamosrebrowy:
I etap: 2AgNO
3
+ 2NaOH → ↓Ag
2
O
+ 2NaNO
3
+ H
2
O
II etap: Ag
2
O + 4NH
3
+ H
2
O → 2[Ag(NH
3
)
2
]OH
2[Ag(NH
3
)
2
]OH + HCOH → 2Ag ↓ + HCOO
-
+ 3NH
3
+
H
2
O + NH
4+
Próba Tollensa

Do próbówki z około 1cm
3
2% roztworu CuSO
4
dodajemy 2M NaOH, aż do całkowitego wytrącenia się
osadu Cu(OH)
2
. Następnie dodajemy 1-2 cm
3
badanego roztworu i ogrzewamy.
Aldehyd redukuje Cu(OH)
2
do ceglastego Cu
2
O (odcień
zależny od warunków reakcji).
Jeśli badana substancja nie jest aldehydem, bądź
występuje w znikomym stężeniu, wówczas zawartość
próbówki czernieje po dłuższym ogrzewaniu na skutek
termicznego rozkładu Cu(OH)
2
do CuO (czarny osad).
2 Cu(OH)
2
+ R-CHO → ↓Cu
2
O + R-COOH + 2
H
2
O
Próba Trommera

Do próbówki z badanym roztworem wkraplamy powoli,
mieszając, rozcieńczony roztwór KMnO
4.
Roztwór ulega
odbarwieniu i wytrąca się brunatny osad MnO
2
.
2 MnO
4-
+ 3 R-CHO + H
2
O → 3 R-COOH + ↓ 2 MnO
2
+
2OH
-
W powyższej reakcji na skutek kondensacji grupy
karbonylowej ze słabo zasadową hydroksyloaminą
powstaje oksym nie posiadający własności zasadowych.
R
2
C=O + (NH
3
OH)
+
Cl
-
⇆ R
2
C=NOH + H
2
O + H
+
+ Cl
-
1.Należy wystrzegać się nadmiaru wodorotlenku
2. Badany związek musi mieć odczyn obojętny
reakcja z KMnO
4

Zachodzi tylko dla metyloketonów.
Wykonanie opisane przy wykrywaniu
alkoholi.
CH
3
COCH
3
+ 3 NaIO → CI
3
COCH
3
+ 3
NaOH
CI
3
COCH
3
+ NaOH → ↓CHI
3
+
CH
3
COONa
Reakcja jodoformowa

Ketony są związkami zawierającymi grupę karbonylową
C=O. Powoduje ona,
że związki te są pod wieloma względami podobne do
aldehydów. Jednak reakcja utleniania ketonów zachodzi
tylko pod wpływem silnych środków utleniających.
Dlatego ketony nie dają reakcji lustra srebrnego, reakcji
Trommera ani reakcji Fehlinga. Metyloketony
(np.aceton) tworzą charakterystyczne zabarwienie
z nitroprusydkiem sodowym. Jest to reakcja Legala
odznaczająca się dużą czułością i znajdująca
zastosowanie do wykrywania związków ketonowych w
moczu,
w przypadku cukrzycy.
Wykrywanie grupy ketonowej

reakcja Legala
Do roztworu metyloketonu dodajemy kilka
kropli roztworu nitroprusydku sodowego,
następnie alkalizujemy 2M roztworem
NaOH. W obecności metyloketonów
występuje czerwone zabarwienie.
Zabarwienie po zakwaszeniu stężonym
kwasem octowym przechodzi w
fioletowoczerwone. Przebieg reakcji nie jest
dokładnie znany, ale odznacza się dużą
czułością.

Kwasy organiczne charakteryzują się obecnością
jednowartościowej grupy kwasowej zwaną karboksylową.
W roztworach wodnych związki te ulegają dysocjacji
elektrolitycznej. Są to słabsze kwasy od większości
kwasów nieorganicznych.
- reakcja z roztworem wodorowęglanu
Do próbówki z 1-2cm
3
wodorowęglanu (5% roztwór)
dodać około 0,5cm
3
roztworu badanego i uważnie
obserwować roztwór. W wyniku reakcji wydzielają się
pęcherzyki CO
2
.
R-COOH + NaHCO
3
→ R-COO
-
+ Na
+
+ ↑CO
2
+ H
2
O
- reakcja estryfikacji
Wykrywanie grupy karboksylowej
Document Outline
- Slide 1
- Slide 2
- Elementarna analiza jakościowa
- Slide 4
- Próba spalania
- Wykrywanie węgla i wodoru
- Wykrywanie fluorowców
- Stapianie z metalicznym sodem
- Wykrywanie azotu, fluorowców i siarki.
- Próba na obecność węgla i wodoru
- Rozpuszczalność
- Grupy rozpuszczalności
- Rozpuszczalniki stosowane w badaniach rozpuszczalności
- Slide 14
- Grupy rozpuszczalności zw. organicznych
- Slide 16
- Slide 17
- Schemat rozpuszczalności związków organicznych
- Reakcje charakterystyczne
- Badanie rozpuszczalności
- Grupy funkcyjne
- Do ważniejszych grup funkcyjnych należą :
- Wykrywanie grupy fenolowej:
- reakcja z FeCl3
- Wykrywanie grupy hydroksylowej:
- Reakcja estryfikacji
- Reakcja jodoformowa
- Wykrywanie grupy aldehydowej
- Próba Tollensa
- Próba Trommera
- reakcja z KMnO4
- Reakcja jodoformowa
- Wykrywanie grupy ketonowej
- Slide 34
- Wykrywanie grupy karboksylowej
Wyszukiwarka
Podobne podstrony:
Analiza jakościowa związków organicznych
Analiza jakościowa związków organicznych, STUDIA IŚ, semestr III, Chemia
analiza jakościowa związków organicznych(1)
Elementarna analiza jakościowa związków organicznych
analiza jakościowa związków organicznych(1)
Jakościowa analiza elementarna związków organicznych
Analiza klasyczna związku organicznego I 2012
Analiza klasyczna związku organicznego II 2012
cwiczenie 4 Analiza jakosciowa zwiazkow org
Analiza klasyczna związku organicznego II
Analiza jakościowa, Chemia organiczna
Analiza klasyczna związku organicznego
Analiza klasyczna związku organicznego I 2012
analiza zwiazkow organiczna id Nieznany (2)
więcej podobnych podstron