
Temat: Jądro atomowe.
Omawiając budowę atomu wspominaliśmy, że jądro atomowe zostało odkryte przez
nowozelandzkiego fizyka Rutherforda. Wprowadził on planetarny model budowy atomu.
Późniejsze badania doprowadziły do dokładnego zbadania struktury jądra, oraz
zachodzących w nich procesów, których efekty możemy zaobserwować w otaczającym nas
świecie.
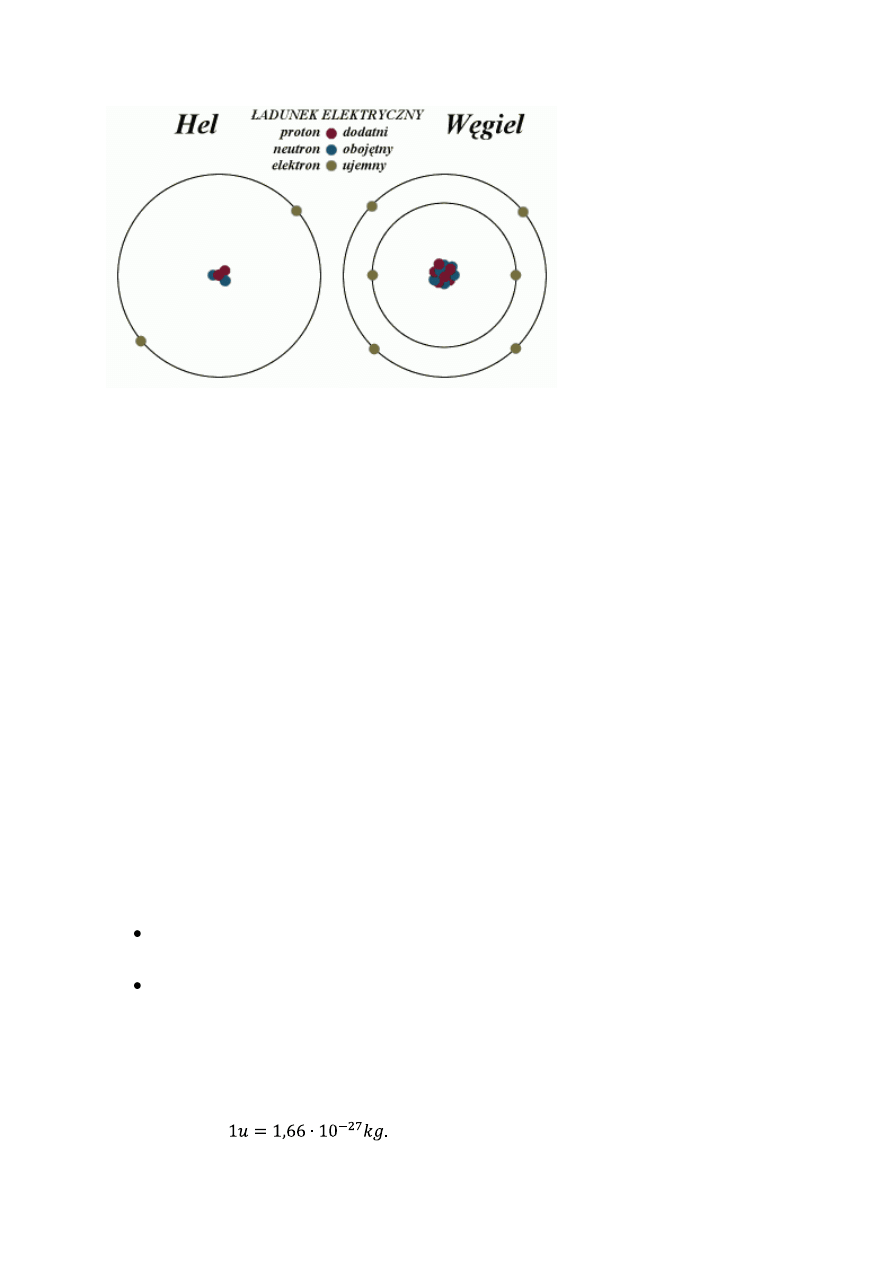
Najprostszy atom to wodór, którego jądro składa się z jednej cząstki naładowanej
dodatnio i masie niemal dwa tysiące razy większej od masy elektronu. Jest to proton.
Ładunek elektronu jest ujemny i ma taką samą wartość, co ładunek protonu. Suma ładunków
w atomie jest równa zero.
Atomy kolejnych pierwiastków mają więcej elektronów niż wodór, czyli muszą
posiadać więcej protonów w jądrze, aby sumaryczny ładunek atomu był równy zero. Na
podstawie badań stwierdzono, że masa atomu nie rośnie proporcjonalnie do ilości
elektronów. Na przykład masa berylu, który ma cztery elektrony, jest dziewięć razy większa
od masy atomu wodoru.. Stąd wniosek, że muszą w jądrze występować jeszcze inne cząstki o
masie zbliżonej do masy protonu, które nie posiadają ładunku. Są to neutrony.
Protony i neutrony mają wspólną nazwę – nukleony.
Omawiając budowę jądra atomowego oraz procesy w nim zachodzące, nie będziemy
zajmować się elektronami, gdyż w skali atomu są one bardzo oddalone od jądra i nie mają
wpływu na procesy w nim zachodzące. Dla przypomnienia – średnica atomu jest około
10 000 razy większa od średnicy jądra.
Nie licząc wodoru, każde jądro posiada kilka lub kilkadziesiąt protonów w jądrze.
Posiadają one ładunek ujemny, czyli zgodnie z prawem Coulomba odpychają się
(oddziaływania elektrostatyczne). Jednak mimo występowania tej siły protony nie oddalają
się od siebie. Wniosek – w jądrze występują siły, które mają za zadanie przezwyciężyć siły
elektrostatyczne i utrzymać protony (i neutrony) blisko siebie. Są to siły jądrowe. Są to siły o
bardzo małym zakresie, nie dużo większym od rozmiarów nukleonów. Każdy nukleon
„trzyma” tylko sąsiednie nukleony. Oderwanie pojedynczego nukleonu od jądra jest możliwe,
ale w przypadku większości pierwiastków bardzo trudne. Możemy powiedzieć, że jądra
atomów są strukturami trwałymi.
Występują jednak w przyrodzie takie pierwiastki, których jądra same z siebie
wyrzucają nukleony. Są to atomy pierwiastków promieniotwórczych, o których będziemy
mówili za kilka tematów.
Do opisu pierwiastków stosuje się podawanie liczb charakterystycznych dla pierwiastka.
Są to:
liczba atomowa (Z) – podaje ilość protonów w jądrze. Liczba elektronów na orbitach
jest taka sama,
liczba masowa (A) – podaje liczbę wszystkich nukleonów (protonów i neutronów).
Liczbę neutronów możemy określić za pomocą różnicy: N = A – Z.
W opisie pierwiastka znajdziemy także informację o masie atomu wyrażoną w
jednostkach masy atomowej, którą jest przybliżona masa jednego nukleonu.
Wynosi ona:

Zapis symboliczny dowolnego pierwiastka
gdzie:
A
Z
– liczba atomowa,
X
– symbol pierwiastka
Na przykład:
- hel, posiada 2 protony i elektrony, oraz 4
– 2 = 2 neutrony.
- tlen
, posiada 8 protonów i elektronów, oraz 16 – 8 = 8 neutronów.
złoto, posiada 79 protonów i elektronów, oraz 197 – 79 = 118 neutronów.
Atomy, które posiadają taką samą liczbę protonów, są z definicji atomami jednego pierwiastka. Nie
oznacza to
jednak, że wszystkie atomy jednego pierwiastka posiadają taką samą masę, gdyż mogą
one posiadać różną liczbę neutronów w jądrach. Atomy posiadające tę samą liczbę atomową, ale
różną liczbę neutronów nazywa się izotopami.
Izotopy wodoru p
osiadają własne symbole chemiczne, ale można łatwo rozpoznać, że jest to ten sam
pierwiastek, dzięki jednakowej liczbie atomowej:
- prot, posiada 1 proton i elektron, oraz 1
– 1= 0 neurtonów.
- deuter, posiada 1 proton i elektron, oraz 2
– 1= 1 neutron.
- tryt, posiada 1 proton i elektron, oraz 3
– 1= 2 neutrony.
Liczba atomowa jest podstawą uporządkowania pierwiastków w układzie okresowym i z tego powodu
nazywana jest także liczbą porządkową. Obecnie znane nauce są pierwiastki o liczbach atomowych z
zakresu 1
–118 (odkrycia pierwiastków o liczbach atomowych 115, 117 i 118 wymagają jeszcze
potwierdzenia), teoretycznie możliwe jest istnienie jąder o większym Z.
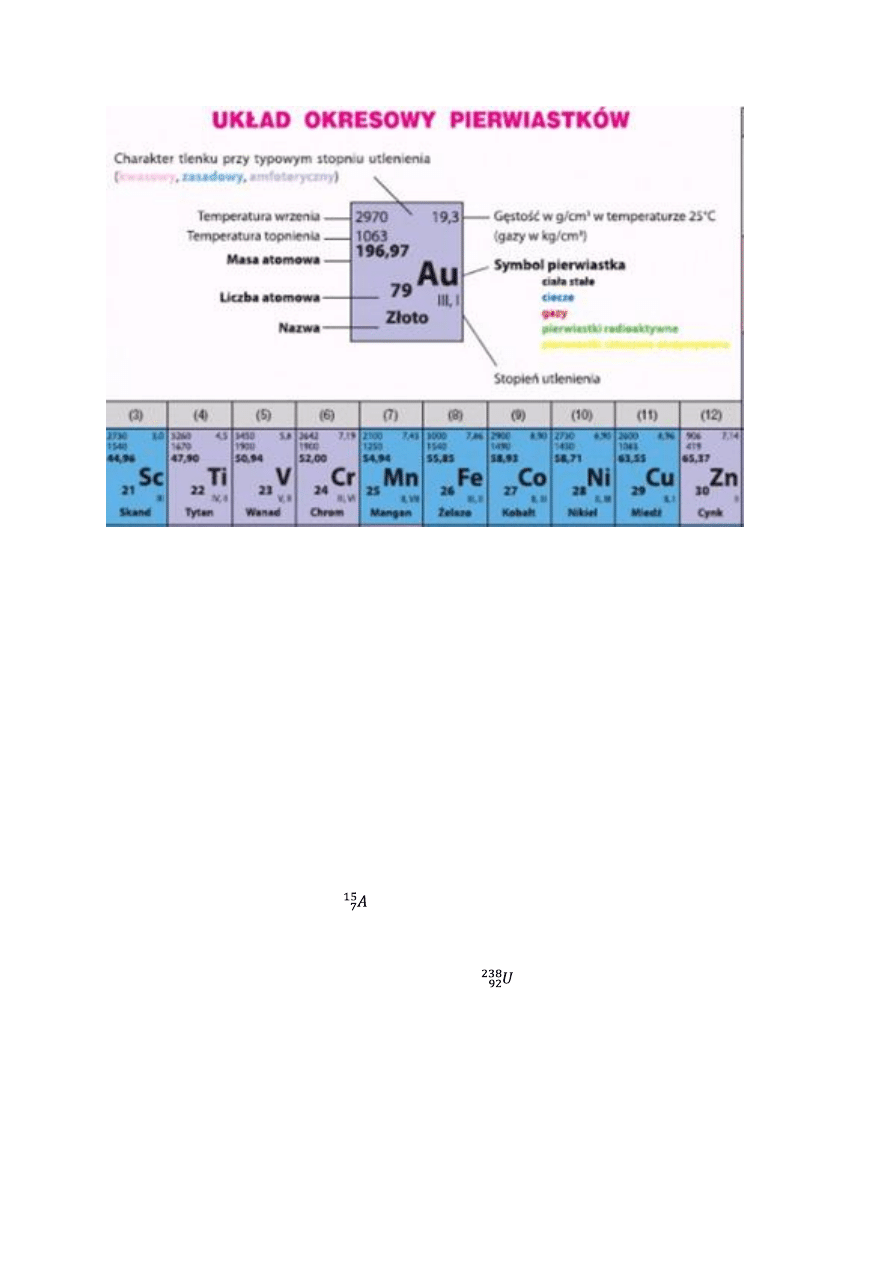
Na rysunku powyżej przedstawiony jest fragment układu okresowego pierwiastków. W
środkowej części podany jest opis jak odczytywać informacje opisu pierwiastków. Zauważamy, że
liczba atomowa jest liczbą naturalną (ilość protonów), natomiast liczba masowa jest zapisana w
postaci ułamka dziesiętnego. Ta nieścisłość wynika z występowania deficytu masy. Zjawisko to
polega na tym, że masa łączna elementów jest mniejsza niż sama mas pojedynczych elementów.
Możemy wyciągnąć wniosek, że liczba masowa dla złota wynosi 197.
Zadanie 1
W skład jądra izotopu azotu wchodzi 7 protonów i 8 neutronów. Zapisz jego symbol.
Rozwiązanie
Liczba atomowa Z = 7
Liczba masowa: A = 7 +8 = 15.
Zapis symboliczny pierwiastka:
.
Zadanie 2
Najczęściej spotykany izotop uranu opisuje symbol:
. Ile neutronów zawiera jego jądro?
Rozwiązanie
Liczba masowa tego izotopu uranu wynosi A = 238, liczba atomowa Z = 92. Ilość neutronów jest
równa różnicy liczby masowej i liczby atomowej. N = A – Z = 238 – 92 = 146.
Odpowiedź: W atomie tego izotopu uranu znajduje się 146 neutronów.

Zadanie 3
Ile protonów, elektronów i neutronów znajduje się w izotopie atomu żelaza
?
Rozwiązanie
Ilość protonów i elektronów jest równa liczbie atomowej: Z = 26.
Ilość neutronów jest równa liczby masowej i liczby atomowej: N = A – Z = 56 – 26 = 30.
Odpowiedź: W podanym atomie żelaza znajduje się 26 protonów i elektronów, oraz 30
neutronów.
Wyszukiwarka
Podobne podstrony:
lekcja 18 id 265103 Nieznany
IMG 15 id 211090 Nieznany
36 15 id 36115 Nieznany (2)
Lekcja Joanny id 265196 Nieznany
Zestaw 15 3 id 587996 Nieznany
Lekcja 5 Przypisy id 265168 Nieznany
IMG 15 id 211078 Nieznany
09 15 id 53452 Nieznany (2)
Cwiczenie nr 15 id 125710 Nieznany
47 3 1 15 id 39027 Nieznany (2)
cw1 15 id 122742 Nieznany
lekcja 19 id 265104 Nieznany
E 15 id 148852 Nieznany
lekcja 17 id 265102 Nieznany
41 15 id 38540 Nieznany
IMG 15 id 211140 Nieznany
IMG 15 id 211155 Nieznany
Hurra I Lekcja 2 str23 id 20726 Nieznany
IMG 15 id 211056 Nieznany
więcej podobnych podstron