
Ć W I C Z E N I E Nr 34
OZNACZANIE WSPÓŁCZYNNIKA PODZIAŁU KWASU BENZOESOWEGO
W UKŁADZIE WODA - TOLUEN
Cel ćwiczenia: wyznaczenie współczynnika podziału kwasu benzoesowego
pomiędzy dwie fazy, wodna i organiczną.
Rozpatrzmy ciekły układ trójskładnikowy, złożony z dwóch składników
ciekłych,
α i β, o ograniczonej rozpuszczalności wzajemnej oraz trzeciego składnika
A, którym może być ciało stałe, ciecz lub gaz, który dobrze rozpuszcza się w obu
cieczach. W stałej temperaturze i pod stałym ciśnieniem, ustala się równowaga
dwóch faz ciekłych, którymi są roztwory składnika A w ciekłej fazie
α i ciekłej fazie β.
Warunkiem równowagi jest równość potencjałów chemicznych każdego składnika w
obu fazach. Dla składnika A można napisać następującą równość:
β
α
μ
=
μ
)
(
)
(
A
A
w której (
μ
A
)
α
oraz (
μ
A
)
β
oznaczają potencjały chemiczne tego składnika w każdej z
faz. Uzależniając potencjał chemiczny składnika od jego aktywności
termodynamicznej można napisać równanie:
β
β
⊗
α
α
⊗
+
μ
=
+
μ
)
a
ln(
RT
)
(
)
a
ln(
RT
)
(
A
A
A
A
które można przekształcić do zależności:
RT
)
(
)
(
)
a
(
)
a
(
ln
A
A
A
A
α
⊗
β
⊗
β
α
μ
−
μ
=
w której (a
A
)
α
i (a
A
)
β
oznaczają aktywność termodynamiczną składnika A w fazach
α
oraz
β. (μ
A
⊗
)
α
oraz (
μ
A
⊗
)
β
oznaczają standardowe potencjały chemiczne składnika A
odpowiednio w fazach
α oraz β. W stałej temperaturze i pod stałym ciśnieniem
wyrażenie po prawej stronie równania (3) jest wielkością stałą, co pozwala
przekształcić to równanie do następującej postaci:
const
k
)
a
(
)
a
(
A
A
=
=
β
α
Zależność ta jest najogólniejszą postacią prawa podziału, które określa jak
składnik A rozdziela się pomiędzy dwie dowolne, współistniejące w równowadze,
fazy ciekłe.
Jeżeli stężenia składnika A w obu fazach są niewielkie, można przyjąć, iż
współczynniki aktywności termodynamicznej składnika A w tych fazach, (
γ
A
)
α
oraz
(
γ
A
)
β
są bliskie jedności, co pozwala zastąpić aktywności termodynamiczne składnika
(a
A
)
α
i (a
A
)
β
, ułamkami molowymi tego składnika, odpowiednio (x
A
)
α
i (x
A
)
β
:
β
α
β
α
β
α
≅
γ
γ
≡
=
)
x
(
)
x
(
)
x
(
)
x
(
)
a
(
)
a
(
k
A
A
A
A
A
A
A
W roztworze rozcieńczonym liczba moli składnika A jest znacznie mniejsza od
liczby moli rozpuszczalnika:
rozp
A
rozp
A
A
A
n
n
n
n
n
x
≅
+
=
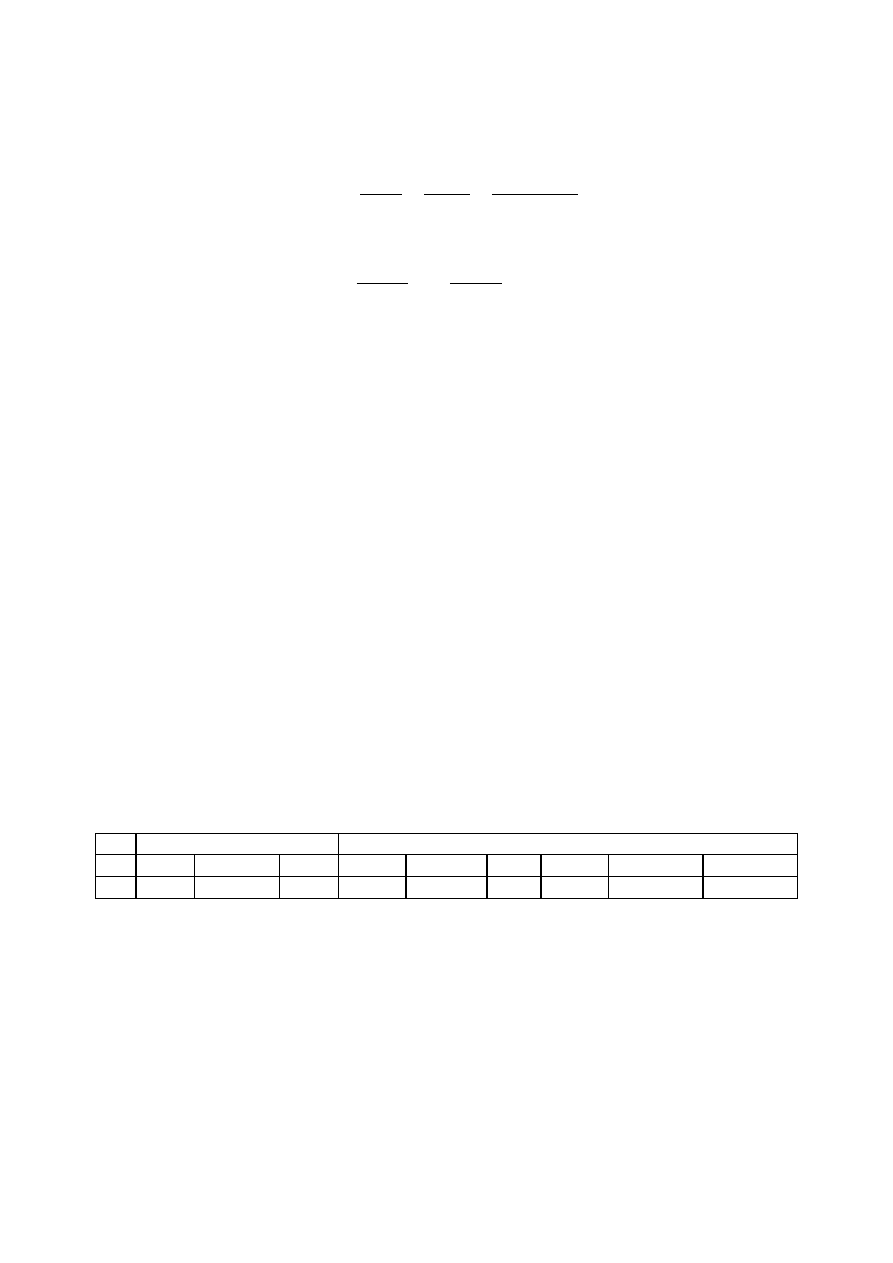
Ponieważ objętość roztworu jest praktycznie równa objętości rozpuszczalnika
można napisać następującą zależność określającą stężenie molowe składnika w
roztworze:
0
rozp
rozp
A
rozp
A
rozt
A
A
V
n
n
V
n
V
n
c
≡
≅
=
Uwzględniając powyższe zależności otrzymujemy równanie:
K
)
V
(
)
V
(
k
)
c
(
)
c
(
0
0
A
A
≡
⋅
=
α
β
β
α
z którego wynika, że w dostatecznie rozcieńczonych roztworach stosunek stężeń
składnika w dwóch współistniejących fazach ciekłych, zwany współczynnikiem
podziału, jest stały i niezależny od stężenia.
Wykonanie ćwiczenia
1. Sporządzić wodne roztwory kwasu benzoesowego, po 50 ml, o stężeniach
podanych przez asystenta.
2. Do suchych kolbek ze szlifem odpipetować po 25 ml z przygotowanych
roztworów kwasu benzoesowego.
3. Do każdego odpipetowanego roztworu dodać po 25 ml toluenu.
4. Po zakorkowaniu kolbki otrzymane układy dwufazowe energicznie wytrząsać
przez 3-5 min i pozostawić na kilkanaście minut aż do dokładnego
rozdzielenia faz.
5. Wyznaczyć miano roztworu NaOH, miareczkując 10 ml próbki tego roztworu
kwasem solnym o znanym mianie.
6. Oznaczyć stężenie początkowe kwasu benzoesowego w przygotowanych
roztworach, C
o
W
, przez zmiareczkowanie próbek, (V
pr
)
0
= 10 ml, wodnego
roztworu kwasu benzoesowego roztworem NaOH wobec fenoloftaleiny jako
wskaźnika.
7. Po rozdzieleniu się warstw pobrać próbki, (V
pr
)
1
= 10 ml, roztworu z dolnej
warstwy wodnej i oznaczyć w niej równowagowe stężenie kwasu
benzoesowego w fazie wodnej, C
W
, przez zmiareczkowanie próbki roztworem
NaOH wobec fenoloftaleiny.
8. Wyniki pomiarów zestawić w tabelce:
Roztwory
wyjściowe
Roztwory w stanie równowagi
Lp (V
pr
)
0
(V
NaOH
)
0
C
o
w
(V
pr
)
1
(V
NaOH
)
1
C
w
C
org.
logC
w
logC
org
9. Ponieważ objętości obu faz, wodnej i organicznej, są jednakowe, stężenie
równowagowe w fazie organicznej C
org
, można obliczyć jako różnicę stężeń
kwasu benzoesowego w fazie wodnej, początkowego C
o
w
i w stanie
równowagi C
w
:
w
0
w
org
C
C
C
−
=

Opracowanie wyników.
1. Współczynnik podziału może przyjąć bardziej złożoną postać, jeżeli w jednej z
faz składnika asocjuje lub dysocjuje. Dysocjacja kwasu benzoesowego w
wodzie jest pomijalna, natomiast w roztworze toluenowym kwas benzoesowy
asocjuje współczynnik podziału wyraża zależność:
K
C
C
n
/
1
org
W
=
w której n jest liczbą wskazującą ile razy masa cząsteczkowa substancji
rozpuszczonej w fazie organicznej jest większa od masy cząsteczkowej w
roztworze wodnym.
2. Po zlogarytmowaniu tej zależności otrzymujemy równanie prostej:
org
W
C
log
n
1
K
log
C
log
+
=
3. Zależność log(C
W
) od log(C
org
) należy przedstawić na wykresie.
4. Parametry prostej logK i 1/n obliczyć albo za pomocą arkusza kalkulacyjnego,
albo metodą najmniejszych kwadratów z podanych równań:
∑
⎥
⎦
⎤
⎢
⎣
⎡
∑
−
∑
∑
∑
−
=
=
=
=
=
=
m
1
i
2
m
1
i
i
org
2
i
org
m
1
i
m
1
i
m
1
i
i
org
i
W
i
org
i
W
)
C
(log
)
C
(log
m
)
C
(log
)
C
(log
)
C
log(
)
C
[(log
m
n
1
m
)
C
(log
)
n
1
(
m
)
C
(log
K
log
m
1
i
i
org
m
1
i
i
W
∑
⋅
−
∑
=
=
=
w których m jest liczbą punktów, wyznaczonych w doświadczeniu.
Document Outline
Wyszukiwarka
Podobne podstrony:
45 Arkuszy ćwiczeniowych Matura angielski rozmowy sterowane, Arkusz ćwiczeniowy 34, Arkusz ćwiczenio
Toto-lotek, Ćwiczenie 34
Ćwiczenie1 34, TiR UAM II ROK, Informatyka
cwiczenie 34, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, chemia fizyczna
Spraw34 niezg z raportem ale dobre, Sprawozdanie z Ćwiczenia 34
34, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA FIZYCZNA laboratorium, Ćwiczenie 34
Sprawozdanie z 34, Sprawozdanie z Ćwiczenia 34
ćwiczenie 34,1
Wyniki ćwiczenia 34
ćwiczenie 34
pascal cwiczenia fragment id 34 Nieznany
Mechanika - Dynamika, cwiczeniadynamika10, Ćwiczenia 10
ĆWICZENIA PORANNE MAC (34), ZESTAWY ĆWICZEŃ PORANNYCH MAC
Ćwiczenia proj. 34, 1
Pytanie 31 i 34, st. Pedagogika ćwiczenia, pedagogika U P tematy do egzaminów 46 tematów
Ćwiczenie nr 34
Ćwiczenie nr 34
więcej podobnych podstron