
™
Badania
Hydrologiczne
GLOBE
™
Publikacjê dofinansowano ze œrodków
Narodowego Funduszu Ochrony Œrodowiska i Gospodarki Wodnej
Przegl¹d
Badania hydrologiczne
Protoko³y
Proponowana kolejnoœæ dzia³añ
GLOBE™
Powitanie-2
Hydrologia
Pomiary cotygodniowe:
prze Ÿroczystoœæ
temperatura wody
tlen rozpuszczony
odczyn (pH)
przewodnictwo elektryczne
zasolenie
zasadowo Ͼ
azotany
Przeczytaj list od uczonych przed wyjœciem w teren w celu przeprowadzenia badañ.
Rozdzia³ Spacer nad wodê powinien rozbudziæ zainteresowania uczniów jakoœci¹ wody
i jej sk³adem chemicznym.
Rozdzia³ Modeluj twoje dorzecze ukazuje uczniom w makroskali dorzecze, w którym
mieszkaj¹ i miejsce, w którym bêd¹ prowadziæ badania.
Rozdzia³ Zastosowania protoko³u powinien zaznajomiæ uczniów
z procedur¹ takiego postêpowania, które pozwoli uzyskaæ
rzetelne wyniki, a tak¿e z procedur¹ korzystania z
instrumentów badawczych.
Rozpoczynamy zbieranie danych w terenie: klasa idzie w
miejsce prowadzenia badañ i rozpoczyna cotygodniowe pomiary wody.
Nastêpuj¹ce rozdzia³y dzia³u pt. Dzia³ania poznawcze uczniów pozwol¹ uczniom
zapoznaæ siê z kluczowymi ideami nauki:
Detektywi Wodni oraz Gra w pH wprowadz¹ uczniów w podstawowe parametry
chemii wód oraz uzmys³owi¹ im potrzebê stosowania odpowiedniego
instrumentarium w celu uzyskania poprawnych wyników.
Woda, wszêdzie woda. Jak to porównaæ? Ten rozdzia³ pozwoli uczniom dokonywaæ
analiz zebranych danych, poszukiwaæ trendów i porównywaæ ich dane z danymi
uzyskanymi z innych szkó³. Te dzia³ania nale¿y prowadziæ ca³y czas i powtarzaæ w
miarê gromadzenia siê nowych danych.
Modelowanie twojego bilansu wodnego pozwoli uczniom zrozumieæ, w jaki sposób
mog¹ wykorzystaæ zebrane dane w procesie modelowania.
Odkrywanie wielkich bezkrêgowców pozwala na wychwytywanie zwi¹zków miêdzy
pomiarami parametrów wody a ¿yciem w wodzie. Te dzia³ania nale¿y prowadziæ ca³y
czas i powtarzaæ przy ka¿dej zmianie warunków.
Zaczynamy ³¹czyæ dane o wodzie z innymi danymi uzyskiwanymi w programie
GLOBE.

GLOBE™
Powitanie-3
Hydrologia
Powitanie – Zapraszamy do badañ hydrologicznych
List uczonych do uczniów.........................................................................Powitanie-4
Spotkanie z dr Bales i dr Conklin...............................................................Powitanie-5
Wprowadzenie
Zarys problematyki ..........................................................................Wprowadzenie-1
Badanie hydrologiczne w terenie ......................................................Wprowadzenie-2
Przegl¹d dzia³añ edukacyjnych .........................................................Wprowadzenie-3
Cele nauczania ...................................................................................Wprowadzenie-3
Protoko³y
Jak prowadziæ badania hydrologiczne..................................................... Protoko³y-2
Pobieranie próbek wody........................................................................... Protoko³y-4
Protokó³: przeŸroczystoœæ wody ............................................................. Protoko³y-5
Protokó³: temperatura wody .................................................................... Protoko³y-6
Protokó³: rozpuszczony tlen...................................................................... Protoko³y-8
Protokó³: odczyn pH ................................................................................ Protoko³y-11
Protokó³: przewodnictwo elektryczne .................................................... Protoko³y-11
Protokó³: zasolenie .................................................................................. Protoko³y-11
Protokó³: zasadowoœæ ............................................................................. Protoko³y-11
Protokó³: azotany .................................................................................... Protoko³y-11
Dzia³ania poznawcze uczniów
Spacer nad wod¹ ............... Dzia³ania poznawcze-2
Modeluj twoje dorzecze ....................... Dzia³ania poznawcze-3
Wodni detektywi ....................................... Dzia³ania poznawcze-9
Gra w pH ....................................................... Dzia³ania poznawcze-13
Zastosowania protoko³u ...................................................... Dzia³ania poznawcze-22
Woda, wszêdzie woda. Jak to porównaæ? ........................... Dzia³ania poznawcze-24
Odkrywanie wielkich bezkregowców ................................... Dzia³ania poznawcze-22
Modelowanie twojego bilansu wodnego ............................. Dzia³ania poznawcze-22
Za³¹czniki
Arkusz obserwacji ................................................................................. Za³¹czniki-2
Arkusz kalibracji .................................................................. Za³¹czniki-4
S³owniczek .............................................................................................. Za³¹czniki-8
Arkusz przekazywania danych ................................................................. Za³¹czniki-9
SPIS TREŒCI

List uczonych do uczniów
Powieliæ i rozdaæ
uczniom
Jesteœmy uczonymi odpowiedzialnymi za badania z
zakresu hydrologii i chemii w ód w Programie
GLOBE, do kt órych Was serdecznie zapraszamy.
Bêdziecie uczestniczy æ w programie naukowym,
który pozwoli nam wype ³niæ wiele bia ³ych plam w
naszej wiedzy o planecie Ziemi.
Hydrologia jako dyscyplina naukowa zajmuje si ê
badaniami wody, jednego z najwa¿niejszych zasobów
na Ziemi. Woda ma fundamentalne znaczenie dla
¿ycia. Wy, a tak¿e Wasi koledzy – uczniowie ze szkó³
na ca ³ym œwiecie, b êdziecie dokonywa æ wielu
pomiarów i gromadzi æ dane o wodzie i jej jako œci.
Dziêki Programowi GLOBE mamy mo¿liwoœæ dotarcia do tak wielu zbiorników wody w tym
samym czasie, co wczeœniej nigdy nie by³o mo¿liwe. Mamy nadziejê, ¿e te wspólne dzia³ania
w skali ca ³ej planety b êd¹ ekscytuj ¹ce i wa ¿ne, a tak ¿e wyzwol ¹ w œród Was ducha
wspó³zawodnictwa.
Dokonuj¹c pomiarów jakoœci wody w wybranym do tego celu miejscu bada ñ, dowiecie siê
bardzo wiele o jej znaczeniu jako komponentu lokalnego œrodowiska, oraz o tym, jak ona
siê zmienia w ci¹gu roku.
Dr Roger C. Bales i Martha H. Concklin
Tuscon, Arizona, USA
GLOBE™
Powitanie-5
Hydrologia
Drodzy uczniowie
Profesorowie Uniwersytetu w Arizonie
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Wywiad z naukowcem

Powieliæ i rozdaæ
uczniom
GLOBE™
Powitanie -6
Hydrologia
Spotkanie z dr Rogerem C. Balesem
i dr Marth¹ H. Conklin
Oboje jesteœcie odpowiedzialni za
badania hydrologiczne w ramach
Programu GLOBE, poza tym
jesteœcie równie¿ ma³¿eñstwem?
Tak. Mamy dwuletni¹ córeczkê, a
w styczniu urodzi³ nam siê syn.
Jesteœcie ma³¿eñstwem nau-
kowców. Jak siê spotkaliœcie?
W czasie studiów. Oboje intere-
sowaliœmy siê chemi¹ wody.
Woda to po prostu H2O. Co mo¿e
w niej byæ interesuj¹ce pod wzgl-
êdem chemicznym?
Przedmiotem naszych zaintereso-
wañ s¹ wszelkie domieszki i
zanieczyszczenia w wodzie.
Naprawdê czystej chemicznie
wody nie znajdziemy w przyrod-
zie z tego wzglêdu, ¿e jest ona
uniwersalnym rozpuszczalnikiem.
Ka¿dy rodzaj materia³u albo zos-
tanie w niej rozpuszczony, albo
znajdzie siê tam jako osad. Celem
Programu GLOBE jest próba
poznania tego, co siê w wodzie
pojawia i zrozumienia tego co siê
dzieje po dodaniu do niej sub-
stancji chemicznych.
Wed³ug danych, którymi dyspo-
nuje Zarz¹d Agencji Ochrony
Œrodowiska USA, oko³o 40 %
wód powierzchniowych w Sta-
nach Zjednoczonych nie nadaje
siê do p³ywania oraz do uprawia-
nia wêdkarstwa. Bardzo czêsto
standardom nie odpowiadaj¹ nie-
wielkie akweny, szczególnie na
obszarach rolniczych. Mo¿na by
s¹dziæ, ¿e jest ktoœ kto bada i nad-
zoruje ich jakoϾ, niestety, w
wiêkszoœci wypadków nic takiego
siê nie dzieje. Dziêki Programowi
GLOBE uzyskamy informacje z
wielu nie zbadanych dot¹d stru-
mieni, rzek i jezior.
Na ca³ym œwiecie znajduje siê
bardzo wiele ró¿nych zbiorników
wodnych, przy czym ka¿dy z nich
jest unikatowy. Robione przez
uczniów pomiary to wspania³y
sposób gromadzenia informacji.
Dlaczego maj¹ to robiæ uczniowie?
Czy nie mo¿na w tym celu wykor-
zystaæ uczonych lub studentów?
Nas jest bardzo ma³o. Nawet gdy-
byœmy dwukrotnie zwiêkszyli lic-
zebnoϾ badanych przez nas
miejsc, to i tak nie uda³oby siê
nam wszêdzie dotrzeæ.
Czy przedmiotem waszych zainter-
esowañ jest to wszystko co dostaje
siê do wody ze Ÿróde³ naturalnych?
Czy te¿ to co wi¹¿e siê z dzia³al-
noœci¹ cz³owieka? Czy te¿ jedno i
drugie?
Jedno i drugie. Zanieczyszczenia
– pod tym pojêciem niekoniecz-
nie nale¿y rozumieæ coœ z³ego.
Jest to po prostu coœ innego ni¿
H
2
O, co dostaje siê do wody w
wyniku rozpuszczania ska³, py³ów
i gazów. Niektóre zanieczyszcze-
nia docieraj¹ do wód powierzch-
niowych z atmosfery razem z
padaj¹cym deszczem lub œnie-
giem. Inne zaœ dostaj¹ siê tam,
gdy ludzie zrzucaj¹ nie oczyszc-
zone œcieki do rzek i jezior.
Wspomnia³ Pan o wp³ywie ska³ na
stan jakoœci wód. Czy¿by ska³y roz-
puszcza³y siê w wodzie?
GLOBE:
Dr Conklin:
GLOBE:
Roger C.Bales oraz Martha H. Conklin nauczaj¹ i
prowadz¹ badania z zakresu hydrologii i zasobów
wodnych na Uniwersytecie Arizona w Tucson, USA.
GLOBE:
Dr Conklin:
GLOBE:
Dr Bales:
Dr Conklin:
Dr Bales:
GLOBE:
Dr Conklin:
Dr Bales:
GLOBE:
Dr Bales:

Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Wywiad z naukowcem
Dr Conklin:
GLOBE:
GLOBE:
Dr Conklin:
GLOBE:
Dr Bales:
Dr Conklin:
Dr Bales:
Dr Conklin:
GLOBE:
Dr Bales:
Tak, ale w bardzo wolnym tem-
pie. D³ugookresowe oddzia³ywa-
nie wody na ska³y widoczne jest w
starych górach, takich jak np.
Appalachy. Procesy wietrzenia i
erozji sprawi³y, ¿e nie s¹ one, tak
bardzo wysokie.
Dlaczego zbiorniki wodne
po³o¿one na terenach rolniczych s¹
zanieczyszczone?
Uprawa roœlin wymaga stosowa-
nia nawozów i pestycydów. S¹
one potrzebne do lepszego plo-
nowania roœlin i do walki ze
szkodnikami. Niestety, czêsto
dzieje siê tak, ¿e s¹ one wyp³uki-
wane i przenoszone wraz z wod¹
deszczow¹ lub s³u¿¹c¹ do nawod-
nieñ do strumieni i jezior, albo do
wód gruntowych.
Czy zdarza³o siê wczeœniej, ¿e ucz-
niowie zbierali dane dla hydro-
logów?
Tak, uczniowie gromadzili dane o
rzekach i jeziorach, ale nigdy nie
odbywa³o siê to w skali takiej jak
w Programie GLOBE.
Proszê nam opowiedzieæ coœ o
sobie. Gdzie siê urodziliœcie. Gdzie
dorastaliœcie?
Urodzi³em siê w mieœcie Lafay-
ette w stanie Indiana, w tym te¿
stanie, w miejscowoœci Blooming-
ton koñczy³em szko³ê œredni¹.
Dyplom studiów wy¿szych uzy-
ska³em w Uniwersytecie Purdue,
ze specjalizacj¹ z in¿ynierii cywil-
nej i œrodowiskowej. Dyplom
magistra z tej samej specjalnoœci
uzyska³em na Uniwersytecie Kali-
fornia w Berkeley.
Ja urodzi³am siê w New Jersey,
lecz wkrótce po tym moja rodzina
przenios³a siê do stanu Illinois.
Nied³ugo po tym wyemigrowa-
liœmy do Europy, która jest kon-
tynentem zupe³nie odmiennym.
Przez piêæ lat mieszkaliœmy w
Holandii, tam te¿ zaczê³am inter-
esowaæ siê naukami przyrodnic-
zymi. Kolejnym etapem w moim
¿yciu by³ dwuletni pobyt w
szkole z internatem w Anglii,
sk¹d wróci³am do Ameryki i
ukoñczy³am szko³ê œredni¹ pod
Bostonem.
Czy zdarza³y siê przypadki, ¿e ktoœ
próbowa³ Pani¹ zniechêciæ do zaj-
mowania siê naukami przyrodnic-
zymi tylko z tego wzglêdu ¿e jest
Pani kobiet¹?
Nie. Uczêszcza³am do szkó³
przeznaczonych g³ównie dla
dziewcz¹t, st¹d te¿ nie
wywo³ywa³ zdziwienia fakt, ¿e
kobieta zainteresowana jest
przyrod¹ lub matematyk¹.
Kiedy pojawi³o siê zainteresowanie
hydrologi¹?
W czasie studiów. Interesowa³o
mnie, jakie reakcje zachodz¹ w
kropelkach wody w atmosferze.
Zaczê³am wiêc studiowaæ chemiê
wód.
GLOBE:
Dr Conklin:
GLOBE™
Powitanie -7
Hydrologia
Dr Conklin:
Dr Bales:
GLOBE: I co Pani odkry³a?
Moje badania wykaza³y, ¿e wyst-
êpowanie kwaœnej mg³y jest
gorsze od kwaœnych deszczy. Kro-
ple deszczu spadaj¹ w atmosferze
raczej doœæ szybko, wy³apuj¹c
przy okazji zanieczyszczenia
atmosferyczne. Natomiast kro-
pelki mg³y unosz¹ siê w powietr-
zu godzinami. Absorbuj¹ one
znacznie wiêcej zanieczyszczeñ,
którymi póŸniej oddychaj¹
zwierzêta i ludzie.
Co Was bawi, jak wypoczywacie?
Zabawa z dzieæmi. Mamy
równie¿ dwa psy rasy labrador
oraz domek letniskowy w okoli-
cach Tucson. Jestem zapalonym
wêdrowcem, alpinist¹ i narciar-
zem. Je¿eli tylko mamy okazjê,
bardzo chêtnie jeŸdzimy na row-
erach.
Czy mieliœcie podobne odczucia do
tych, które mia³ Archimedes wykr-
zykuj¹c swoje s³ynne „Eureka"?
Czy zdarzaj¹ siê Wam podobne
odkrycia?
Nie jestem teoretykiem, zajmuje
siê badaniami eksperymentalny-
mi. W moim laboratorium prze-
prowadzam eksperymenty u³at-
wiaj¹ce zrozumienie
zachodz¹cych procesów. Jestem
bardzo podekscytowana kiedy
okazuje siê, ¿e dane eksperymen-
talne uzyskane przeze mnie nie
pasuj¹ do moich wczeœniejszych
przewidywañ. Zabawn¹ rzecz¹ s¹
próby okreœlenia, co siê w rzeczy-
wistoœci dzieje.
Czy jako naukowiec uwa¿a Pani,
¿e nawet tzw. nietrafione ekspery-
menty maj¹ wartoœæ naukow¹?
Oczywiœcie. Ich wartoœæ jest
wiêksza ani¿eli tych, których
wynik mogliœmy w pewnym stop-
niu przewidzieæ. Je¿eli okazuje
siê ¿e wyniki s¹ inne od oczekiwa-
nych, oznacza to, ¿e postawiona
hipoteza by³a niepoprawna i
nale¿y sformu³owaæ now¹. Takie
rzeczy w nauce s¹ zawsze ekscy-
tuj¹ce.
Czy oznacza to, ¿e nauka by³aby
szalenie nudna, gdyby ka¿da hipo-
teza by³a prawdziwa?
Tak, strasznie nudna.
Jeœli ju¿ rozumie siê mechanizm
funkcjonowania pewnego zjawis-
ka, czy to oznacza, ¿e mo¿na je
przewidywaæ?
Dok³adnie tak. Je¿eli wiemy
dok³adnie, dlaczego pewne rzeczy
siê zdarzaj¹, mo¿emy powiedzieæ
„No tak, je¿eli w przysz³oœci
nast¹pi¹ zmiany, mo¿emy prze-
widzieæ jak na nie zareaguj¹ stru-
mienie." Moim g³ównym zada-
niem jest prognozowanie zmian w
rzekach i jeziorach wywo³anych
zmiennoœci¹ klimatu, globalnymi
zmianami klimatu i postêpuj¹cym
zakwaszeniem wód.
Co to jest zakwaszenie?
Jest to stan, w którym deszcz lub
œnieg maj¹ bardzo niski odczyn
pH spowodowany zawartymi w
atmosferze kwasami, z których
wiele jest ubocznym wytworem
ludzkiej dzia³alnoœci. Kwaœne
deszcze siej¹ spustoszenie w wie-
lu niszach ekologicznych.
Kwas na ogó³ kojarzy siê z czymœ,
co parzy skórê. W ogólnym odczu-
ciu kwaœny deszcz niczym nie ró¿ni
siê od normalnego deszczu. Co
sprawia, ¿e normalny deszcz staje
siê kwaœnym deszczem?
Jest to mieszanina mocnego kwa-
su z wod¹. Jego odczyn jest ni¿szy
ani¿eli odczyn deszczu naturalne-
go. Nie jest tak kwaœny jak na
przyk³ad sok z cytryny lub p³yn w
akumulatorze. Mo¿e byæ jednak
tak kwaœny jak ocet. W sytuacjach
ekstremalnych cz¹steczki mg³y
staja siê tak kwaœne jak sok z
cytryny. G³ównym Ÿród³em pow-
stawania zakwaszenia jest spala-
nie paliw kopalnych, takich jak
ropa i jej pochodne, wegiel i gaz
ziemny.
GLOBE:
GLOBE:
GLOBE:
Dr Conklin:
Dr Bales:
Dr Conklin:
GLOBE:
Dr Conklin:
Dr Bales:
GLOBE:
Dr Bales:
GLOBE:
GLOBE:
GLOBE™
Powitanie -8
Hydrologia

Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Wywiad z naukowcem
GLOBE:
Dr Conklin:
Dr Bales:
GLOBE:
Dr Bales:
GLOBE:
GLOBE:
Emitowane w trakcie spalania pal-
iw kopalnych substancje dostaj¹
siê do atmosfery i wchodz¹ w
reakcjê z wod¹?
Padaj¹cy œnieg lub deszcz
wy³apuj¹ kwaœne cz¹steczki z
atmosfery i spadaj¹ wraz z nimi
na powierzchniê. To co wêdruje
w górê, wraca z powrotem na dó³.
Jaka jest rola nauki. Co Wy, jako
uczeni, macie z tych badañ?
Mamy poczucie, ¿e wnosimy
okreœlony wk³ad w zrozumienie
potencjalnych problemów
spo³ecznych i jednoczeœnie mamy
nadziejê, ¿e uda nam siê je roz-
wi¹zaæ. Badamy równie¿
przesz³oœæ, tak jak na przyk³ad w
Grenlandii, aby przewidzieæ, co
nam mo¿e przynieœæ przysz³oœæ.
W którym kierunku pójd¹ zmiany
w œrodowisku wywo³ane spala-
niem coraz wiêkszej masy paliw
kopalnych oraz zmianami klima-
tycznymi i hydrologicznymi.
Jedn¹ z najbardziej fascynuj¹cych
rzeczy w nauce jest to ¿e ci¹gle
zdobywamy now¹ wiedzê, oraz ¿e
przy tej okazji, poznajemy now-
ych ludzi. Je¿eli nie wiem czegoœ
w danej dziedzinie, zawsze mogê
znaleŸæ kogoœ takiego, kto siê na
tym zna. W ten sposób zdobywam
nowych przyjació³.
Ludzie musz¹ siê nauczyæ podej-
mowania inteligentnych decyzji
dotycz¹cych Ziemi, nawet wtedy,
kiedy id¹ g³osowaæ. Tak wiêc kie-
dy wyk³adam moim studentom
problemy zwi¹zane z ociepleniem
klimatu, zanieczyszczeniem
powietrza i wód, mam nadziejê,
¿e lepiej bêd¹ oni rozumieæ Zie-
miê, gdy¿ wszystkim nam to siê
na pewno op³aci.
Czy wiemy ju¿ wystarczaj¹co du¿o?
Co sk³ania nas do zdobywania
nowej wiedzy?
Œrodowisko jest szalenie
z³o¿onym systemem sk³adaj¹cym
siê z wielu komponentów, tote¿
niemo¿liwe jest, aby jedna osoba
posiada³a odpowiedni¹ wiedzê
umo¿liwiaj¹c¹ jego ca³kowite zro-
zumienie. Je¿eli jednak wiemy
wiêcej, lepiej mo¿emy przewidy-
waæ przysz³e wydarzenia.
Czy w okresie dorastania mieliœcie
swoich bohaterów?
Jedynym powodem mojego zain-
teresowania naukami o œrodowis-
ku jest chêæ uczynienia œwiata
lepszym. Je¿eli wiêc mam wska-
zaæ moich bohaterów, to byli nimi
ludzie, którzy mieli podobne cele.
S¹ nimi Linus Pauling, laureat
Nagrody Nobla z chemii oraz
nagrody pokojowej oraz Albert
Einstein.
Czy macie kolegów za granic¹?
Oczywiœcie. Zarówno my, jak i
oni nie mog¹ wszystkiego robiæ
samodzielnie, st¹d te¿ musimy
kooperowaæ i dzieliæ siê posiada-
nymi informacjami i danymi.
Jak wygl¹da dzieñ pracy naukow-
ca. Czy prowadzicie badania labo-
ratoryjne?
Na mój przeciêtny dzieñ pracy
sk³adaj¹ siê takie zajêcia jak
nauczanie, kontakty ze studenta-
mi, przygotowywanie wyk³adów,
pisanie publikacji, analizowanie
danych zebranych przez stu-
dentów, du¿o pracy z komputer-
em. Do laboratorium idê zobac-
zyæ jak pracuj¹ inni.
Czy to prawda, ¿e obecnie coraz
wiêcej pracy naukowej wykonuje
siê przy u¿yciu komputera?
Tak, gdy¿ samo gromadzenie
danych nie wystarcza. Nale¿y je
rozumieæ, st¹d te¿ komputery
s³u¿¹ do prowadzenia analiz.
Niemal ka¿dego dnia poœwiêcam
kilka godzin na przygotowanie i
przeprowadzenie wyk³adów.
Jedn¹ lub dwie godziny spêdzam
przy komputerze, prowadz¹c
Dr Bales:
Dr Bales:
GLOBE:
GLOBE:
Dr Conklin:
Dr Bales:
Dr Conklin:
GLOBE:
Dr Conklin:
Dr Bales:
GLOBE™
Powitanie -9
Hydrologia

Dr Bales:
GLOBE:
GLOBE:
Dr Conklin:
GLOBE:
Dr Bales:
GLOBE:
GLOBE:
Dr Bales:
Dr Bales:
Dr Conklin:
korespondencjê z innymi uczony-
mi, czytaj¹c i komentuj¹c prace
studentów. Kolejn¹ jedn¹ lub
dwie godziny zajmuj¹ mi spotka-
nia z moimi studentami. Pozos-
ta³y czas to inne obowi¹zki uni-
wersyteckie.
Czy w zwi¹zku z wykonywan¹
prac¹ powsta³y jakieœ anegdoty?
Prowadzi³em wiele badañ w
wysokich partiach gór pokrytych
œniegiem, gdy¿ wiêkszoœæ opadów
w zachodniej czêœci USA przy-
biera postaæ œniegu. Kiedy w uni-
wersytecie przygotowywa³em
moj¹ pracê doktorsk¹, musia³em
wielokrotnie wychodziæ w góry i
przy pomocy ³opaty kopaæ dziury
w œniegu. Nie s¹dzê, ¿eby moja
Matka, wysy³aj¹c mnie na studia
myœla³a o kopaniu przeze mnie
³opat¹ otworów w œniegu.
Tak wiêc uczeni mog¹ badaæ
emisjê zanieczyszczeñ do atmosfery
wykorzystuj¹c rdzenie lodowe,
maj¹ce 100, 10 000 lub nawet 100
000 lat?
Tak robimy. Ostatnio spêdzi³em
cztery letnie tygodnie na Gren-
landii, gdzie z pokrywy lodowej
przy pomocy œwidra pobiera³em
próbki lodu z ró¿nych g³êbokoœci.
Spa³em w rozcitym na lodzie
namiocie przez dwanaœcie dni.
By³ Pan ca³kowicie otoczony loda-
mi. Czy by³o tam coœ jeszcze?
Wszystko dooko³a by³o bia³e i
niebieskie. Oczywiœcie S³oñce
nigdy nie zachodzi³o, jak to zwy-
kle dzieje siê latem na terenach
po³o¿onych daleko na pó³nocy.
Wierciliœmy otwory w pokrywie
lodowej i bardzo siê œpieszyliœmy,
aby wykorzystaæ czas przed
nadejœciem burzy. ZnaleŸliœmy
tam w lodach œlady zwiastuj¹ce
nadejœcie rewolucji przemys³owej,
a tak¿e substancje pochodz¹ce z
po¿arów lasów.
Jakie korzyœci, Pani zdaniem,
odnios¹ uczniowie realizuj¹cy Pro-
gram GLOBE?
Mam nadziejê, ¿e uczniowie
naucz¹ siê okreœlaæ stan zdrowot-
noœci systemów œrodowiska.
Spo³eczeñstwu siê wydaje, ¿e
mo¿e w nieskoñczonoœæ zrzucaæ
do œrodowiska zanieczyszczenia, a
ono samo siê z tym problemem
upora. Mam nadziejê, ¿e ucznio-
wie badaj¹c otaczaj¹cy ich system
wodny, bêd¹ mogli stwierdziæ, czy
jest on zdrowy, czy zanieczyszczo-
ny. Jestem równie¿ przekonany o
tym, ¿e naucz¹ siê dokonywaæ
rzetelnych pomiarów.
Dlaczego uczniowie powinni poz-
nawaæ problematykê, któr¹
Pañstwo siê zajmujecie?
Woda nale¿y do najwa¿niejszych
zasobów. Hydrologia jest t¹
dziedzin¹ wiedzy, której znacze-
nie bêdzie wzrastaæ w miarê kurc-
zenia siê zasobów czystej wody.
Uczniowie chc¹ robiæ coœ, co nie
tylko jest interesuj¹ce i pozwala
im przebywaæ w terenie, ale chc¹
oni równie¿ mieæ swój udzia³ w
procesie polepszania stanu œrodo-
wiska i w budowaniu lepszego
spo³eczeñstwa. Jako ludzie zaj-
muj¹cy siê t¹ dziedzin¹ ju¿ to
robimy, gdy¿ mamy œwiadomoœæ
tego, ¿e woda jest fundamentem
¿ycia na Ziemi.
GLOBE™
Powitanie -10
Hydrologia
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Wywiad z naukowcem
GLOBE:
GLOBE™
Powitanie -11
Hydrologia
Dr Conklin:
Dr Bales:
GLOBE:
Dr Conklin:
Jakich rad mog¹ Pañstwo udzieliæ
uczniom, którzy chcieliby zaj¹æ siê
naukami przyrodniczymi, w tym
hydrologi¹?
Nie jest ³atwo o tym mówiæ, ale
trzeba nauczyæ siê podstaw –
matematyki, fizyki, chemii, biolo-
gii. Uczyæ siê stawiaæ pytania,
gdy¿ ten kto potrafi formu³owaæ
dobre pytania, dokonuje bardzo
wa¿nych odkryæ. Nale¿y równie¿
uczyæ siê pisaæ.
Dlaczego musimy uczyæ siê pisaæ?
Mo¿na byæ bardzo b³yskotliwym i
inteligentnym, je¿eli jednak nie
potrafimy swoich osi¹gniêæ zako-
munikowaæ innym, nikt o nich nie
bêdzie wiedzia³.
Uczyæ siê jak najwiêcej w przyr-
odzie, w bezpoœrednim z ni¹ kon-
takcie.
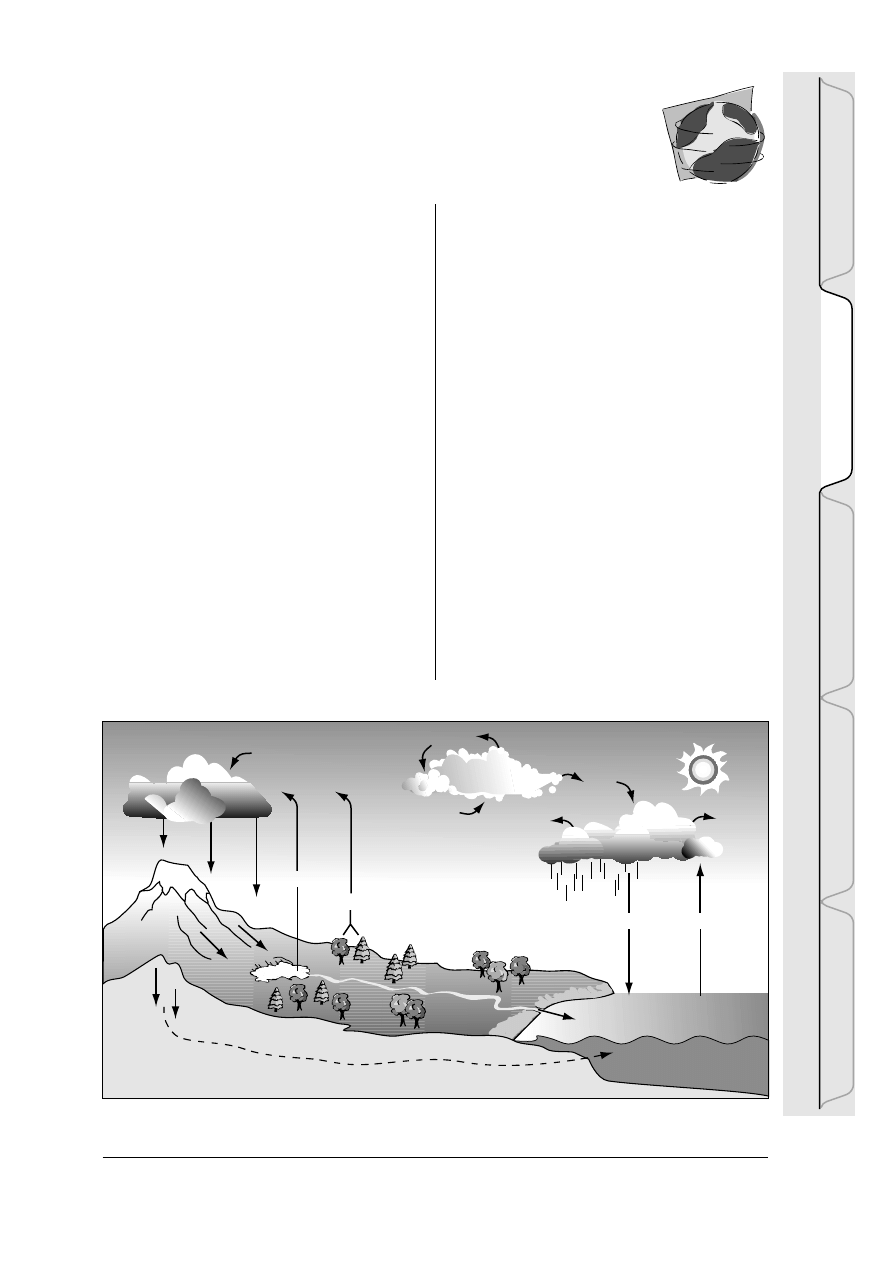
Rysunek HYD-I-1: Obieg wody w przyrodzie
3
Km
3
.
Lodowiec
ziemia
Wsiakanie
Wody podziemne
(9.5)
Œnieg i lód
(29)
Deszcz
Sp³yw powierzchniowy
Opady
Parowanie
Parowanie
Transpiracja
Rzeka
Gleby
Ocean
(1370)
Wody powierzchniowe
(0.13)
Sun
Chmury
Wody atmosferyczne
(0.013)
Opady
Jezioro
Hydrologia
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Zarys problematyki
Wprowadzenie
Zarys problematyki
GLOBE™
Wprowadzenie-1
Hydrologia
My po prostu nie tylko pijemy wod ê, my
jesteœmy wod ¹. Woda stanowi od 50 do 90
procent wagi wszystkich ¿ywych organizmów.
Jest to jedna z najbardziej powszechnie wy-
stêpuj¹cych i najwa ¿niejszych substancji na
Ziemi. Woda podtrzymuje ¿ycie ro œlin i
zwierz¹t i odgrywa kluczow¹ rolê w kszta³tow-
aniu pogody, modeluje powierzchniê globu w
wyniku erozji i innych proces ów. Pokrywa
oko³o 70 procent powierzchni naszej planety.
W o d a n i e p r z e r w a n i e k r ¹ ¿ y m i ê d z y
powierzchni¹ Ziemi a jej atmosfer¹ – nazywa-
my to cyklem hydrologicznym. Ten cykl
hydrologiczny, nazywany r ównie¿ obiegiem
wody, jest jednym z najwa¿niejszych procesów
w przyrodzie. Na skutek oddzia³ywania ciep³a
s³onecznego i innych czynnik ów, woda z
oceanów, rzek, jezior, gleby i pokrywy roœlin-
nej paruje i w atmosferze wyst êpuje pod po-
staci¹ pary wodnej. Para wodna wraz z masa-
mi powietrza w êdruje w g órne partie atmo-
sfery, sch³adza siê i przyjmuje posta æ wody
lub lodu, tworz ¹c chmury. Kiedy cz ¹steczki
wody lub kryszta ³ki lodu osi ¹gn¹ okreœlon¹
wielkoœæ, spadaj¹ na powierzchni ê ziemi w
postaci deszczu lub œniegu. Po osi ¹gniêciu
powierzchni cz êœæ wody opadowej paruje,
wsi¹ka w gleb ê, zu¿ywana jest przez ro œlin-
noœæ lub te¿ zasila zbiorniki w ód podziem-
n y c h . P o z o s t a ³ a c z ê œ æ w o d y o p a d o w e j
odp³ywa do mórz i oceanów.
Woda w jeziorze, le ¿¹cy w g órach œnieg,
zawarta w powietrzu wilgo æ oraz poranna
rosa s¹ czêœciami jednego systemu. Ca³kowita
i l o œ æ w o d y w c y k l u r o c z n y m , p a r u j ¹ c a
i odp³ywaj¹ca z powierzchni l¹dowych odpo-
wiada ilo œci wody dostarczanej w czasie
opadów. Jakakolwiek zmiana dokonana w
jednej czêœci systemu, taka jak na przyk ³ad
zmiana u¿ytkowania ziemi lub zmiana szaty
roœlinnej w regionie, wp ³ywa na stosunki
hydrologiczne w ca³ym systemie.
Chocia¿ woda jest dobrem wyst êpuj¹cym
powszechnie, nie mo¿emy u¿ytkowaæ wszyst-
kich jej zasobów. Je¿eli przyjmiemy, ¿e ca³ko-
GLOBE™
Wprowadzenie-2
Hydrologia
wite zasoby wodne Ziemi wynosz¹ 100 litrów,
to a ¿ 97 litr ów przypada na s ³on¹ wod ê
morsk¹. Wiêkszoœæ z pozosta³ych 3 litrów to
lód. Tylko oko³o 3 ml ze wspomnianych 100
litrów stanowi woda s ³odka, któr¹ mo¿emy
konsumowaæ; pochodzi ona z podziemnych
ujêæ w ód gruntowych lub ze zbiornik ów
powierzchniowych – jezior i rzek.
W o d a w c h o d z i w w i e l e b a r d z o w a ¿ n y c h
reakcji chemicznych i jest bardzo dobrym roz-
puszczalnikiem. Dziêki tym walorom znako-
mitego rozpuszczalnika, w rzeczywisto œci
prawdziwie czysta woda w przyrodzie nie
wystêpuje. Woda zawiera w sobie wiele natu-
ralnych i wprowadzanych przez cz ³owieka
zanieczyszczeñ, dostaj¹cych siê do niej w cza-
sie jej wêdrówki w cyklu hydrologicznym. Te
zanieczyszczenia sprawiaj¹, ¿e ka¿da woda
charakteryzuje si ê pewnym specyficznym
sk³adem chemicznym, decyduj ¹cym o jej
jakoœci. Deszcz lub œnieg przechwytuje z
atmosfery pewn¹ iloœæ niewielkich cz¹steczek
py³u lub aerozoli, œwiat³o s³oneczne sprawia,
¿e emitowane w czasie spalania benzyny lub
innych paliw kopalnych cz¹steczki wchodz¹ w
reakcjê z wod¹ i tworz¹ kwasy siarkowe i azo-
towe. Te zanieczyszczenia wracaj¹ na Ziemiê
pod postaci¹ kwaœnych opadów – deszczu lub
œniegu. Zawarte w wodzie kwasy powoli roz-
puszczaj¹ ska³y, natomiast ich rozpuszczone
czêœci sta³e osadzane s¹ w wodzie. Ma ³e ale
widoczne fragmenty ska ³ lub gleby r ównie¿
dostaj¹ si ê do wody, tworz ¹c zawiesinê i
wp³ywaj¹c na jej przezroczysto œæ. W czasie
wêdrówek wód podziemnych, w bliskim kon-
takcie ze ska ³ami wiele buduj ¹cych je min-
era³ów ulega rozpuszczeniu. Te wszystkie
zanieczyszczenia, w postaci roztworu lub
zawiesiny decyduj¹ o jakoœci wody.
W czasie swoich bada ñ uczniowie podejm ¹
b a d a n i a k l u c z o w y c h p a r a m e t r ó w d e c y -
duj¹cych o jakoœci wody.
PrzeŸroczystoœæ
Œwiat³o, podstawowy czynnik wp ³ywaj¹cy na
wzrost ro œlin zielonych, dociera g ³êbiej w
wodzie czystej, w porównaniu z wod¹ mêtn¹,
zawieraj¹c¹ zawiesinê lub substancje zabar-
wiaj¹ce wodê. Powszechnie s¹ u¿ywane dwie
metody. W pomiarach przeŸroczystoœci wody,
to jest stopnia przenikania przez ni¹ œwiat³a –
jest to kr¹¿ek Secchiego oraz tuba (cylinder)
do pomiarów zmêtnienia. Kr¹¿ek Secchiego
po raz pierwszy zastosowa³ w 1865 roku nauk-
owy doradca papie ¿a, Ojciec Pietro Angelo
Secchi.Ten prosty i powszechnie u ¿ywany
pomiar polega na tym, ¿e kr¹¿ek o œrednicy
20 cm, pomalowany na bia³o i czarno, zanurz-
amy w wodzie do momentu kiedy zniknie
nam z oczu, a nast êpnie podnosimy go do
chwili, kiedy go ponownie ujrzymy. Inna,
alternatywn¹ metod¹ pomiaru prze Ÿroczys-
toœci jest nalanie wody do szklanej tuby, na
dnie której znajduje siê wzór analogiczny do
kr¹¿ka Secchiego. Odnotujemy wysoko œæ
s³upa wody w momencie kiedy umieszczony
na dnie wzór znika nam z oczu. Kr ¹¿ka Sec-
chiego u ¿ywamy na wodach spokojnych,
stoj¹cych, w miar ê g ³êbokich. Cylindra do
pomiarów zmêtnienia u¿ywamy w przypadku
wód p³ytkich, p³yn¹cych, lub w celu zbadania
przeŸroczystoœci powierzchniowych warstw
wód g³êbokich zbiorników.
Œwiat³o s³oneczne dostarcza energii niezbêd-
nej w fotosyntezie, czyli w procesie warun-
kuj¹cym wzrost roœlin pobieraj¹cych wêgiel,
azot, fosfor i inne sk ³adniki pokarmowe i
oddaj¹cych tlen. Wspomniana penetracja
œwiat³a s³onecznego w zbiornikach wodnych
wyznacza g³êbokoœæ, na kt órej jeszcze algi i
inne roœliny mog¹ jeszcze wzrasta æ, a tak ¿e
determinuje wzglêdne tempo ich przyrostu.
PrzeŸroczystoœæ zmniejsza siê, je¿eli w wodzie
wzrasta zawartoœæ substancji zabarwiaj¹cych,
zawiesiny lub szcz ¹tków alg. Kolor wody
mo¿e siê zmieniaæ ze wzglêdu na obecnoœæ w
niej niekt órych bakterii, fitoplanktonu i
innych organizmów, a tak¿e substancji chem-
icznych wymywanych z gleby i rozk ³adaj¹cej
siê materii organicznej. Tak wiêc iloœæ sk³ad-
ników od¿ywczych dla roœlin, dostaj¹cych siê
do zbiorników wodnych z takich Ÿróde³ jak
oczyszczalnie œcieków, nawozy wymywane z
gleby, drobne cz¹stki mineralne i organiczne,
wp³ywa na prze Ÿroczystoœæ wody. • ród³em
wite zasoby wodne Ziemi wynosz¹ 100 litrów,
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Zarys problematyki
GLOBE™
Wprowadzenie-3
Hydrologia
zawiesiny najcz êœciej bywa rolnictwo,
budownictwo, sp³yw powierzchniowy wody i
erozja z dna osadzonego tam materia³u.
Wiêkszoœæ naturalnych zbiornik ów wody
p³yn¹cej i stoj¹cej jest przejrzysta do g ³êbo-
koœci od jednego do kilku metr ów. Wartoœci
mniejsze, poni¿ej jednego metra, wyst êpuj¹
na ogó³ w zbiornikach o podwy ¿szonej pro-
duktywnoœci. Mog ¹ si ê r ównie¿ pojawi æ w
wodzie zawieraj¹cej bardzo du¿o zawiesiny.
Nadzwyczajnie przeŸroczyste wody (30 – 40
metrów), charakterystyczne dla obszarów nis-
kiej produktywnoœci, wystêpuj¹ w niektórych
jeziorach i w s¹siedztwie raf koralowych.
Temperatura wody
Temperatura wody zale¿y przede wszystkim
od iloœci energii s³onecznej zaabsorbowanej
przez wodê, otaczaj¹cy j¹ l¹d i powietrze. Im
wiêksze jest promieniowanie cieplne S³oñca,
tym temperatura wody jest wy ¿sza. Pod-
wy¿szon¹ temperatur ê mo ¿e mie æ r ównie¿
woda wykorzystywana w procesach prze-
mys³owych i zrzucana do zbiornik ów wod-
nych. Parowanie z powierzchni wody mo ¿e z
kolei obni¿yæ jej temperaturê, ale zjawisko to
dotyczy tylko bardzo cienkiej jej warstewki
przy powierzchni. Pomiary temperatury wody
s ¹ p o t r z e b n e w c e l u z r o z u m i e n i a p r a -
wid³owoœci zmian dokonuj¹cych siê w ci¹gu
roku, z tego wzglêdu, ¿e temperatura wody w
zbiornikach wywiera bardzo silny wp ³yw na
iloœæ i ró¿norodnoœæ ¿ycia wodnego. Jeziora,
które s¹ wzglêdnie ch³odne w zimie, maj ¹ w
tym okresie ¿ycie ro œlinne bardzo ubogie.
Zakwitaj¹ zaœ latem i wiosn¹, kiedy tempera-
tura wody siê podnosi i dochodzi do miesza-
nia siê bogatych w sk ³adniki od¿ywcze wód
przydennych z wodami powierzchniowymi.
Podobne zjawisko mieszania si ê w ód ma
równie¿ miejsce w jesieni. Z powodu miesza-
nia siê wody i jej nagrzewania, po prze ³omie
wiosennym nast êpuje okres gwa ³townego
wzrostu mikroskopijnych ro œlin i zwierz ¹t.
Wiele gatunków ryb i innych organizm ów w
tym okresie sk³ada ikrê, gdy¿ woda jest ciep³a
i wystêpuje obfitoœæ po¿ywienia. Wyj¹tek sta-
nowi¹ jeziora p³ytkie, w których proces mies-
zania przebiega przez ca³y rok. Nale¿y jednak
pamiêtaæ, ¿e ciep³a woda mo ¿e byæ zgubna
dla niekt órych bardzo wra ¿liwych organ-
izmów, takich jak ³osoœ lub pstr ¹g, wyma-
gaj¹cych wody zimnej i bogatej w tlen.
Rozpuszczony tlen
Cz¹steczk¹ wody sk³ada siê z dwóch atomów
wodoru i jednego atomu tlenu, st¹d jej wzor-
em chemicznym jest H
2
O. Poza tym jednak,
w ka¿dym zbiorniku wodnym obok cz¹steczek
wody znajduje siê zmieszany z nimi tlen gaz-
owy (O
2
). Ten rozpuszczony tlen jest natural-
nym zanieczyszczeniem wody. Organizmy
¿yj¹ce w wodzie, takie jak ryby lub zooplank-
ton, nie oddychaj ¹ tlenem wchodz ¹cym w
sk³ad moleku³ wody, lecz w³aœnie tym tlenem
rozpuszczonym w wodzie. Bez odpowiedniej
iloœci tlenu w wodzie, ¿ycie zamiera. Iloœæ roz-
puszczonego tlenu nie przekraczaj¹ca 3 mg/l
jest niebezpieczna dla wiêkszoœci organizmów
wodnych.
W atmosferze prawie co pi ¹ta moleku³a to
t l e n , w w o d z i e n a t o m i a s t n a m i l i o n j e j
cz¹steczek przypada zaledwie jedna do dziesi-
êciu moleku³ tlenu. Intensywne mieszanie siê
w o d y , j a k i e n a p r z y k ³ a d m a m i e j s c e w
rw¹cych strumieniach górskich, wzbogaca j¹
w rozpuszczony tlen. T ê sam¹ funkcjê pe³ni
proces fotosyntezy organizm ów wodnych.
Tlen jest zu¿ywany przez ryby, zooplankton i
bakterie rozk³adaj¹ce materia³ organiczny.
Takim materia³em organicznym s ¹ martwe
cz¹stki ro œlin i zwierz ¹t dostaj ¹ce si ê do
cieków wodnych wraz z wpadaj ¹c¹ do nich
wod¹ deszczow ¹ przep ³ywaj¹c¹ przez lasy,
p a s t w i s k a , ³ ¹ k i i p o l a u p r a w n e . I n n y m
Ÿród³em materii organicznej s¹ zrzuty wody z
zak³adów pracy i oczyszczalni œcieków. Bez
wzglêdu na Ÿród³a, najmniej rozpuszczonego
w wodzie tlenu znajdujemy w wodach wolno
p³yn¹cych, w s¹siedztwie miejsc powstawania
materii organicznej. Poza tym, woda ciep ³a
zawiera mniej tlenu ani¿eli woda zimna, st¹d
te¿ niebezpiecznym dla ¿ycia ryb i zooplank-
tonu jest okres lata. Przyk³adowo, w wodzie o
temperaturze 25oC zawartoϾ rozpuszczone-
go tlenu wynosi 8,3 mg/l, natomiast w wodzie
o temperaturze 4oC mo¿e siê rozpuœciæ 13,1
mg/l.
GLOBE™
Wprowadzenie-4
Hydrologia
Odczyn (pH)
Miar¹ zawartoœci kwasów w wodzie jest pH.
O d c z y n w o d y w y w i e r a w p ³ y w n a w i e l e
zachodz¹cych w niej procesów chemicznych.
Czysta woda, bez zanieczyszcze ñ (i bez kon-
taktu z powietrzem) ma pH równe 7.0.
Skala pH jest zupe ³nie niepodobn¹ do skal
okreœlaj¹cych inne zanieczyszczenia. Jest to
skala logarytmiczna, co oznacza, ¿e zmiana
pH o jedn¹ jednostkê oznacza dziesiêciokrot-
ny przyrost lub spadek zawarto œci kwasu w
wodzie. Woda maj ¹ca pH r ówne 3 zawiera
dziesiêciokrotnie wiêcej kwasu ani¿eli woda z
pH równym 4, kt óra z kolei ma dziesi êciok-
rotnie wiêcej kwasu ani¿eli woda maj¹ca pH
wynosz¹ce 5.
Naturalny, nie zanieczyszczony deszcz ma pH
w przedziale miêdzy 5 a 6, gdy ¿ woda deszc-
zowa, nawet pochodz ¹ca z najmniej zaniec-
zyszczonych miejsc na Ziemi, ma pewn¹ natu-
raln¹ kwasowoœæ. Wi¹¿e siê ona z obecnoœci¹
w atmosferze dwutlenku w êgla, rozpuszcza-
nego przez krople deszczu. Woda destylowa-
na, maj ¹ca kontakt z powietrzem, b êdzie
mieæ taki sam odczyn. Wi êkszoœæ kwaœnych
deszczów ma odczyn oko³o 4, chocia¿ stwierd-
zano ju¿ przypadki mg³y w obszarach zurbani-
zowanych maj ¹cej pH r ówne 2. Wi êkszoœæ
cieków oraz jezior ma odczyn zawarty w
przedziale miêdzy 6.5 a 8.5.
M o ¿ n a z n a l e Ÿ æ w o d y p o s i a d a j ¹ c e p o d -
wy¿szon¹ kwasowoœæ uwarunkowan¹ natural-
nie, co nale¿y wi¹zaæ z okreœlonymi rodzajami
ska³ lub gleb (np. siarczany). Górnicze odpa-
dy zawieraj ¹ce substancje kwasotw órcze,
zrzucane do cieków wodnych, mog¹ obni¿yæ
wartoœæ pH. Wody o pH zbli ¿onym do neu-
tralnego spotkaæ mo¿na na obszarach wystêp-
owania gleb wapiennych bogatych w takie
minera³y jak kalcyt.
Odczyn wody wywiera wp ³yw na ¿ycie w
zbiorniku. salamandry, ¿aby i inne organizmy
ziemno-wodne s¹ bardzo wra¿liwe na niskie
pH. Wi êkszoœci gatunk ów owad ów, ryb i
p ³ a z ó w n i e z n a j d z i e m y w w o d a c h o p H
mniejszym od 4.
Przewodnictwo elektryc
zne
Czysta woda jest s³abym przewodnikiem elek-
trycznoœci. Je¿eli zostanie zanieczyszczona,
np. rozpuszczonymi w niej solami, jej zdol-
noœæ przewodzenia pr ¹du roœnie. W sytuac-
jach takich, w kt órych nie mamy wystarc-
zaj¹co du¿o czasu lub œrodków finansowych
aby analizowaæ jakoœæ wody i okreœlaæ ró¿ne
wystêpuj¹ce w niej substancje, mo ¿emy
pos³u¿yæ siê tym dobrym wska Ÿnikiem. Poz-
wala on oceni æ jako œæ wody pod wzgl êdem
zawartoœci w niej wszystkich obcych substanc-
ji na podstawie jej zdolnoœci do przewodzenia
pr¹du. Im wi êcej zanieczyszczeñ w wodzie,
tym jej lepsze przewodnictwo.
Woda przeznaczona do wykorzystania w rol-
nictwie lub gospodarce komunalnej powinna
mieæ mniej ni ¿ 1000 – 1200 cz êœci zaniec-
zyszczeñ na milion czêœci wody – okreœlanych
wagowo (ppm). Odpowiada to zdolno œci do
przewodzenia wynosz¹cej oko³o 1500–1800
mikroSiemensów/cm. Je ¿eli te warto œci s ¹
wy¿sze, nale ¿y si ê spodziewa æ uszkodze ñ
roœlin szczególnie wra¿liwych. Woda u¿ywana
w gospodarstwach domowych powinna
zawieraæ mniej ni¿ 500 ppm rozpuszczonych
substancji, lub tez charakteryzowaæ siê prze-
wodnictwem elektrycznym oko³o 750 micro-
Siemensów/cm. Czysta woda jest ze wzglêdów
technologicznych bardzo wa¿na w niektórych
ga³êziach przemys³u, np. w przemyœle elektro-
nicznym. Czysta woda pochodz¹ca z roztopio-
nego œniegu z g ór oddalonych od centr ów
cywilizacyjnych ma przewodnictwo w grani-
cach 5 – 30 microSiemensów/cm.
Zasolenie
Morze jest s³one; ma ono wiêcej, w porówna-
niu z wodami s³odkimi, rozpuszczonych sub-
stancji. Zasolenie jest miar¹ obecnoœci owych
substancji, wyra¿an¹ ich stosunkiem liczbo-
wym do tysi¹ca czêœci wody. Przeciêtne zaso-
lenie oceanu œwiatowego wynosi 35 ppt (35
czêœci na tysi¹c – lub w promilach ( ‰). Sód i
chlor, sk ³adniki soli kuchennej (NaCl) s ¹
podstawowymi elementami determinuj¹cymi
zasolenie. W zatokach i estuariach mo ¿emy
spotkaæ siê z ró¿nym stopniem zasolenia,
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Zarys problematyki
GLOBE™
Wprowadzenie-5
Hydrologia
gdy¿ s¹ to obszary, na kt órych dochodzi do
mieszania siê wód s³odkich z wodami morski-
mi. Zasolenie owych w ód s³onawych (ang.
brackish – brak polskiego odpowiednika),
waha si ê w przedziale od warto œci 0,5 ppt,
typowej dla w ód s³odkich, do warto œci pow-
szechnie wystêpuj¹cych we wszechoceanie.
Na ka¿dym kontynencie s¹ s³one jeziora. Naj-
bardziej znanymi przyk ³adami mog ¹ by æ
Morze Kaspijskie w Azji Œrodkowej, Wielkie
Jezioro S ³one w Ameryce P ó³nocnej oraz
wiele jezior znajduj ¹cych siê w rowie tekto-
nicznym Afryki Wschodniej. W niekt órych z
nich stopieñ zasolenia jest wiêkszy jak w mo-
rzach – np. Morze Martwe.
Wody staj¹ siê zasolone, gdy¿ rzeki nios¹ sole
pochodz¹ce z produkt ów wietrzenia i roz-
puszczania ska³ na kontynentach. Woda par-
uje, natomiast sól pozostaje. O ile zasolenie
oceanów zmienia siê bardzo powoli, w ci ¹gu
tysiêcy lat, o tyle zasolenie wód wewnêtrznych
zmienia siê znacznie szybciej, w zale¿noœci od
sk³adu chemicznego opad ów deszczu lub
œniegu .
ZawartoϾ soli w wodzie jest podstawowym
czynnikiem determinuj¹cym rozmieszczenie
gatunków roœlin i zwierz¹t. Wody s³odkie, w
przeciwieñstwie do w ód s³onych, s¹ siedlis-
kiem ¿ycia zupe³nie innych gatunków. Roœliny
i zwierz êta ¿yj¹ lub korzystaj ¹ z zasob ów
wody s³odkiej (poni¿ej 1 ppt).
ZasadowoϾ
Zasadowoœæ jest miar ¹ odpornoœci wody na
obni¿anie siê pH wywo³anego dostaj¹cymi siê
do niej kwasami. Najcz êœciej s ¹ to kwasy
zawarte w padaj¹cym deszczu lub œniegu, cho-
cia¿ na niekt órych obszarach ich Ÿród³em
mo¿e byæ gleba. Przyczyn¹ odczynu zasado-
wego wód jest rozpuszczanie przez nie ska ³
zawieraj¹cych wêglan wapnia, takich jak np.
wapienie. Je¿eli zasadowoœæ strumienia lub
jeziora jest niska, tzn. poni¿ej 100 mg/l, du¿y
dop³yw wody pochodz¹cej z obfitego deszczu
lub topniej ¹cego gwa ³townie œniegu mo ¿e
doprowadziæ do dalszego jej spadku i takiego
pH wody, które bêdzie niebezpieczne dla ryb,
g a d ó w i z o o p l a n k t o n u . N a o b s z a r a c h
górskich, gdzie pokrywa glebowa jest s ³abo
rozwiniêta, rzeki i jeziora cechuj ¹ siê niska
z a s a d o w o œ c i ¹ . T e o b s z a r y w o d n e s ¹
szczególnie wra¿liwe w okresie gwa³townych
roztopów œniegu. Zanieczyszczenia w czasie
topnienia wymywane s¹ ze œniegu w pierwszej
kolejnoœci, tote¿ dop³yw kwasów do wody w
okresie wiosennym jest szczeg ólnie niebez-
pieczny dla budz¹cego siê w niej ¿ycia.
Azotany
Roœliny zar ówno w wodach s ³odkich jak i
zasolonych potrzebuj¹ trzech g³ównych sk³ad-
ników niezbêdnych dla ich wzrostu – wêgla,
azotu i fosforu. Wi êkszoœæ roœlin pobiera te
trzy sk³adniki pokarmowe w sta³ych proporc-
jach, ich wzrost jest zagro¿ony, gdy pojawi siê
niedostatek jednego z nich. Wêgiel jest pier-
wiastkiem powszechnie dost êpnym, gdy ¿
wystêpuje w atmosferze jako dwutlenek
wêgla, rozpuszczalny w wodzie. Tak wi êc
jedynie dostêpnoœæ dwóch pozosta³ych sk³ad-
ników, azotu i fosforu, mo ¿e ogranicza æ
wegetacjê ro œlin wodnych. W niekt órych
sytuacjach, dostêpnoœæ innych pierwiastków,
jak np. ¿elaza, mo¿e byæ ograniczona. Azot w
wodzie wystêpuje pod wieloma postaciami:
rozpuszczone cz¹steczki azotu (N
2
), sk³adnik
organiczny – amoniak (NH
4
), azotyny (NO
2
)
oraz azotany (NO
3
). Najwa¿niejsze z nich s¹
azotany. Azotyny s ¹ charakterystyczna dla
wód zawieraj¹cych ma³o rozpuszczonego tle-
nu. Azot wystêpuj¹cy w wodzie w postaci azo-
tanów pochodzi z atmosfery, dostaje siê tam z
opadami deszczu, œniegu, mg³y lub z depozyc-
ji sta ³ej, a tak ¿e z rozk ³adu obumieraj ¹cej
materii organicznej zawartej w glebach i osa-
dach. Jego Ÿród³em jest r ównie¿ proces
wymywania i przenoszenia do zbiornik ów
nawozów u¿ywanych w rolnictwie.
Je¿eli do jeziora lub rzeki dostaj ¹ siê wielkie
iloœci sk ³adników pokarmowych takich jak
azot, ich wody zostaj ¹ wzbogacone, co pro-
wadzi do wzmo ¿onego wzrostu alg i innych
roœlin. Proces ten nosi nazw ê eutrofizacji.
Doprowadza on do zmian koloru i zapachu
wody, co stwarza problemy z jej wykorzysta-
niem dla celów konsumpcyjnych i mo¿e odbiæ
siê na warunkach egzystencji ryb i innych

GLOBE™
Wprowadzenie-6
Hydrologia
organizmów wodnych. Problemy z nadmiar-
em azotu lub fosforu w wodach powierzch-
niowych i przybrze¿nych s¹ czêsto zwi¹zane
ze zrzutami œcieków. Koncentracjê azotanów
wykazujemy zawsze pos ³uguj¹c si ê zawar-
toœci¹ azotu. Tak wi êc zawartoœæ azotanów
opisujemy jako iloϾ azotu w azotanach (NO3
– N) w miligramach na litr (np. 14 gram ów
azotu na cz ¹steczkê NO 3 ), nigdy za œ jako
NO3 (tzn. 62 gramy na cz¹steczkê NO3). W
wiêkszoœci zbiornik ów w ód naturalnych
stê¿enie azotanów wynosi poni¿ej 1 mg/l azo-
tu, lecz zdarza siê, ¿e przekracza na pewnych
obszarach nawet 10 mg/l.
Znaczenie pomiarów
Jaka jest kondycja wiêkszoœci wód powierzch-
niowych na Ziemi – w strumieniach, rzekach,
jeziorach? W jakim stopniu ich kondycja
zmienia siê w ci ¹gu roku? Czy takie zmiany
nastêpuj¹ z roku na rok? Dzi êki badaniom
hydrologicznym w ramach Programu GLOBE
wasi uczniowie, wraz z uczniami szk ó³ na
ca³ym œwiecie uczestnicz¹cych w tym progra-
mie, poszukiwaæ bêd¹ odpowiedzi na te pyta-
nia. Nasza wiedza o istniej ¹cych trendach
odnosz¹cych siê do jakoœci wody, zarówno w
skali globalnej jak i lokalnej jest ograniczona
niewielk¹ liczb¹ reprezentatywnych stanowisk
pomiarowych. Takie i inne podobne badania
wykonuje si ê sporadycznie. Na przyk ³ad,
nasze informacje o jeziorach pochodz ¹ z
badañ prowadzonych tylko kilkakrotnie w
ci¹gu dziesiêciu lat. W celu dokonania oceny
zmian, potrzebujemy rzetelnych informacji
odnosz¹cych si ê do stanu aktualnego. W
momencie pojawiania si ê zmian, bardzo
pomocne w ich zrozumieniu mo¿e okazaæ siê
porównanie warunków zmienionych i natural-
nych.
Pomiary rozpuszczonego tlenu i odczynu
wskazuj¹ bezpoœrednio na jakoœæ warunków
¿yciowych w danym zbiorniku wodnym. Bard-
zo interesuj¹ce jest œledzenie rocznego cyklu
rozpuszczonego tlenu, pH i zasadowo œci i
porównywanie w tym zakresie ró¿nych zbior-
ników. Mo ¿emy stawia æ takie pytania: czy
iloϾ rozpuszczonego w wodzie tlenu jest
zawsze maksymalna w stosunku do mo ¿li-
woœci wyznaczanych przez temperatur ê, lub
czy jest ni ¿sza w poszczeg ólnych porach
roku? Je¿eli jest ni¿sza, chcemy poznaæ przyc-
zynê. Chcemy siê równie¿ dowiedzieæ, czy pH
spada bezpoœrednio po opadach deszczu, czy
te¿ wtedy gdy do jeziora lub rzeki sp ³ywa
woda z roztopionego œniegu. Je¿eli stwierdzi-
my spadek pH, mo ¿emy siê spodziewaæ, ¿e
woda ma niski poziom zasadowoœci. I tak jest
w rzeczywistoœci – w wodzie o niskiej zasado-
woœci, po deszczu lub dop³ywie wody roztopo-
wej, pH siê obni¿y. Pomiary wykonujemy po
to, aby nasze przypuszczenia potwierdziæ.
Wykonywanie przez uczni ów pomiar ów
powinno mieæ na celu r ównie¿ pewien kon-
t e k s t s p o ³ e c z n y . P o p i e r w s z e , c h c e m y
kszta³towaæ lepsze zrozumienie spraw lokal-
nych, w tym problematyki zasobów wodnych.
Ta wiedza pomo ¿e nam w podejmowaniu
bardziej przemyœlanych decyzji odnosz¹cych
siê do zasob ów –sposobu ich u ¿ytkowania,
zarz¹dzania nimi i cieszenia si ê z nich. Po
drugie, chcemy mieæ mo¿liwoœæ oceny stopnia
wp³ywu dzia³alnoœci cz³owieka na jakoœæ wody
w chwili obecnej, a tak ¿e w przysz ³oœci. W
w i ê k s z o œ c i k r a j ó w p r o g r a m y p o m i a r ó w
dotycz¹ tylko niewielkiej cz êœci obszar ów
wodnych, dokonywanych kilka razy w roku.
Mamy nadziejê, ¿e pomiary w ramach Pro-
gramu GLOBE pozwol¹ wype³niæ tê lukê i i
lepiej rozumie æ problematyk ê jako œci w ód
naturalnych na Ziemi.
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Badanai hydrologiczne w terenie
GLOBE™
Wprowadzenie-7
Hydrologia
Badania hydrologiczne w
terenie
Wprowadzenie
Uczniowie b êd¹ pobiera æ pr óbki wody z
ró¿nych zbiorników, badaæ je w celu okreœle-
nia sk³adu wody i innych parametr ów, anali-
zowaæ wyniki. Dzia³ania te maj¹ siê przyczy-
niæ do lepszego zrozumienia problematyki
jakoœci wody i jej wp³ywu na stan œrodowiska.
Tabela HYD-I-1 zawiera zestawienie zaleca-
nych protoko³ów, z uwzgl êdnieniem wieku
uczniów. Nauczyciele sami podejmuj¹ decyzjê
o wybraniu protoko ³ów, bior ¹c pod uwag ê
zdolnoœci i stopie ñ przygotowania uczni ów.
Nale¿y pamiêtaæ równie¿ o tym, ¿e bardziej
zaawansowane protoko³y wymagaj¹ stosowa-
nia specjalnych œrodków bezpieczeñstwa.
Tabela HYD-I-1: Poziomy badañ hydrologicznych
Terminarz pomiarów
Pomiary musz¹ byæ wykonywane raz w tygod-
niu, w tym samym wybranym dniu, o tej samej
g o d z i n i e . P o m i a r y t y g o d n i o w e m a j ¹
szczególne znaczenie w tych porach roku, w
których zachodz¹ gwa³towne zmiany w œrodo-
wisku wodnym.
Wybór miejsca pobierania
próbek i pomiarów
(uporz¹dkowane od najbardziej do najmniej
po¿¹danych)
1. Strumieñ lub rzeka,
2. Jezioro, sztuczny zalew, zatoka morska,
3. Staw,
4. Rów melioracyjny lub inny zbiornik (je¿eli
nie mo ¿na wykorzystywa æ ¿adnego z wy ¿ej
podanych).
Zespo³y uczniowskie
Zespo³y powinny sk³adaæ siê z 2 – 3 uczniów.
Zadania w zespole polegaæ bêd¹ na pobiera-
n i u p r ó b e k , i c h b a d a n i u i n o t o w a n i u
wyników. Dobrze jest, je ¿eli kilka zespo ³ów
dokonuje pomiaru tego samego parametru
(np. rozpuszczonego tlenu). Po pierwsze,
pozwala to zaanga¿owaæ wiêcej uczniów, po
drugie za œ, powstanie wewn êtrzny system
kontroli jako œci wynik ów. Uczniowie pro-
wadz¹cy badania jednego parametru powinni
porównaæ swoje wyniki z rezultatami innych
grup oraz ustaliæ, czy s¹ one podobne. Je¿eli
wyniki siê ró¿ni¹, powinni powtórzyæ proce-
durê i próbowaæ odnaleŸæ przyczyny ró¿nic.
Kontrola jakoœci pomiarów powinna staæ siê
istotnym elementem ka¿dej pracy badawczej,
nawet tej wykonywanej w szko³ach w ramach
programów edukacyjnych.
Przegl¹d dzia³añ edukacyjnych
Je¿eli protoko ³y opisuj ¹ce prowadzenie
pomiarów po³¹czymy z zadaniami opisanymi
w rozdziale Dzia³ania poznawcze uczniów, otr-
zymamy spójny program edukacyjny poma-
gaj¹cy zrozumieæ problematykê chemizmu
otaczaj¹cych wód. Mo¿e siê pojawiæ tenden-
cja, ¿e uczniowie ogranicz ¹ si ê jedynie do
wykonywania pomiarów i przesy³ania ich do
bazy danych GLOBE. Pami êtajmy jednak o
tym, ¿e celem dzia ³añ edukacyjnych jest
przede wszystkim dostarczenie uczniom wied-
zy o przedmiocie nauki i jej metodach oraz
wyposa¿enie ich w umiej êtnoœæ krytycznego
myœlenia. Rozdzia³ Dzia³ania poznawcze ucz-
niów przybli ¿y Wam sens wszystkich czyn-
noœci opisanych w Protoko³ach.
Poziom nauczania Pomiar
pocz¹tkowy przeŸroczystoœæ
temperatura
odczyn pH (papier)
przewodnictwo lub zasolenie
œredni/ transparency
zaawansowany temperatura
tlen rozpuszczony
odczyn pH (phpen lub phmetr)
przewodnictwo lub zasolenie
zasadowoϾ
azotany

GLOBE™
Wprowadzenie-8
Hydrologia
Cele kszta³cenia
Pomiary i obserwacje prowadzone przez ucz-
niów pozwol¹ im lepiej zrozumieæ znaczenie
unikalnego zasobu naszej planety, jakim jest
woda. Dziêki wykorzystaniu wyników analiz,
uczniowie zrozumiej¹ problematykê chemiz-
mu wód i jej znaczenie w utrzymywaniu odpo-
wiedniej jakoœci œrodowiska wodnego.
Przed rozpoczêciem opisanych dzia³añ, ucz-
niowie powinni zapozna æ si ê i zrozumie æ
nastêpuj¹ce pojêcia oraz nabyæ umiejêtnoœci.
Treœci kszta³cenia
– Chemizm w ód jest istotnym elementem
determinuj¹cym ¿ycie w siedliskach
– Temperatura mo¿e wp³ywaæ na inne wskaŸ-
niki zwi¹zane z chemi¹ wód
– Chemizm w ód wp ³ywa na r ó¿norodnoœæ
gatunkow¹
– Instrumenty s ¹ przed ³u¿eniem naszych
zmys³ów i pozwalaj¹ nam na lepsze pozna-
nie sk³adu wody
– Zebrane dane s ³u¿¹ do stawiania pyta ñ i
poszukiwania odpowiedzi
– W y k r e s y i m a p y s ¹ d o b r y m i œ r o d k a m i
s³u¿¹cymi do prezentacji danych
– Wa ¿nym sk ³adnikiem pomiar ów jest ich
rzetelnoϾ i precyzja
– Gleba zawiera wod ê, od jej ilo œci zale ¿y
wzrost roœlin
– To co dzieje si ê z wod¹ opadow¹ zale¿y od
cech lokalnego œrodowiska
– Wysokie temperatury oraz d ³ugi okres
nas³onecznienia zwiêkszaj¹ transpiracjê
– Przep³yw wody jej zmienny w czasie
– Bilans wodny mo¿na zbudowaæ dysponuj¹c
danymi o temperaturze, opadach i szerokoœci
geograficznej obszaru
Umiejêtnoœci
· Prowadzenie obserwacji
· Pos³ugiwanie si ê technikami zbierania
danych w terenie
· Skalowanie instrumentów naukowych
· Postêpowanie zgodnie z instrukcj¹
· Zapisywanie i przekazywanie dok³adnych
danych
· Czytanie skali
· Komunikowanie siê ustne
· Komunikowanie siê pisemne
· Zadawanie pytañ
· Formu³owanie i sprawdzanie hipotez
· Przygotowywanie doœwiadczeñ narzêdzi
i modeli
· Stosowanie wyposa¿enia s³u¿¹cego badaniu
jakoœci wody
· Tworzenie i czytanie wykresów
· Obliczanie wartoœci œrednich
· Porównywanie w wymiarze czasowym
i przestrzennym
· Analizowanie danych, odnajdywanie trendów
i zró¿nicowañ
· Wykorzystywanie danych GLOBE

Protoko³y
Jak prowadziæ badania hydrologiczne
Pobieranie próbek wody
Protokó³: przeŸroczystoœæ wody
Na pocz¹tku uczniowie mierz¹ przezroczystoœæ wody w swoim niezaburzonym punkcie
pomiarowym
Protokó³: temperatura wody
Bezpoœrednio po pobraniu próbek wody, uczniowie dokonuj¹ pomiaru jej temperatury (w
próbce lub in situ)
Protokó³: rozpuszczony tlen
Uczniowie dokonuj¹ pomiaru rozpuszczonego w wodzie tlenu (w próbce lub in situ)
Protokó³: odczyn pH
Uczniowie mierz¹ odczyn (pH) próbki wody. Mog¹ w tym celu u¿yæ papierka lakmusowego
lub phehametru
Protokó³: przewodnictwo elektryczne
Uczniowie mierz¹ przewodnictwo elektryczne w œwie¿o pobranej próbce wody
Protokó³: zasolenie
Uczniowie przy pomocy hydrometru mierz¹ zasolenie wody (wody s³onej lub s³onawej)
Protokó³: zasadowoœæˇ
Uczniowie mierz¹ zasadowoœæ próbki wody
Protokó³: azotany
Uczniowie mierz¹ zawartoœæ azotu wystêpuj¹cego w azotanach w pobranej próbce wody
GLOBE™
Protoko³y-1
Hydrologia

Wybór miejsca badañ
Idealne miejsce pobierania próbek i prowad-
zenia badañ powinno znajdowaæ siê w dorzec-
zu, w obrêbie kwadratu 15 x 15 kilometr ów,
wyodrêbnionego dla innych badañ Programu
GLOBE. W tym jednym wybranym miejscu
odbywaæ siê bêd¹ pomiary temperatury wody,
jej przezroczystoœci, odczynu, rozpuszczonego
tlenu, zasadowoœci, przewodnictwa elektrycz-
nego, zasolenia i zawartoœci azotanów. Je¿eli
w obrêbie dorzecza znajduje si ê jakieœ spec-
jalne miejsce, nale¿y je wybraæ. Oto kolejnoœæ
najbardziej preferowanych miejsc poboru
wody:
1. Strumyk lub rzeka
2. Jezioro, sztuczny zbiornik, zatoka morska
lub oceaniczna
3. Staw
W ostatecznoœci mo¿e to byæ rów melioracyj-
ny, w sytuacji gdy w obrêbie obszaru badawc-
zego Programu GLOBE nie ma ¿adnego z
wy¿ej wymienionych obiektów.
Próbki za ka ¿dym razem nale ¿y pobieraæ z
tego samego miejsca.
W przypadku lokalizacji miejsca pomiarowe-
go nad wod ¹ p³yn¹c¹ (strumieñ lub rzeka),
nale¿y wybraæ taki odcinek, w kt órym woda
nie p³ynie zbyt szybko (nale¿y unikaæ bystrzy
i miejsc zastoiskowych). Je ¿eli wybierzemy
wodê stoj¹c¹ (jezioro lub zbiornik retencyj-
n y ) , m i e j s c e p o m i a r ó w l o k a l i z u j e m y w
pobli¿u jego œrodka, na obszarze odp ³ywu
wody (nigdy przy dop³ywie wód do zbiornika
lub jeziora). Dobrym miejscem jest most lub
molo.
Opis miejsca pomiarowego
Je¿eli dokonaliœmy ju¿ wyboru miejsca badañ
hydrologicznych, okreœlamy dok³adnie jego
po³o¿enie wykorzystuj¹c urz ¹dzenie GPS.
Po³o¿enie miejsca oraz jego opis wprowadza-
my do arkusza obserwacji hydrologicznych
Czêstotliwoœæ
Próbki do pomiar ów parametrów chemicz-
nych wody pobieramy raz w tygodniu, w tym
samym dniu i o tej samej godzinie. Je ¿eli
woda w miejscu pomiarowym zamarznie lub
wyschnie, fakt ten odnotowujemy ka ¿dego
tygodnia i przekazujemy informacjê o tym do
chwili zmiany warunków.
Uwaga: W niekt órych porach roku nasze
obserwacje i pomiary mog¹ byæ bardzo inter-
esuj¹ce. Je¿eli wyst¹pi silny sp³yw powierzch-
niowy wywo³any gwa³townymi opadami, zwi-
êkszony przep³yw rzeki i obecno œæ osadów
zdecydowanie wp ³ynie na nasze pomiary
chemiczne. Równie¿ po roztopieniu siê pok-
rywy lodowej na jeziorze pojawi ¹ siê intere-
suj¹ce zjawiska wywo ³ane mieszaniem si ê
ró¿nych warstw wody – przypowierzchnio-
wych i przydennych. Niejednokrotnie woda ze
s t r e f y p r z y d e n n e j w ê d r u j e w g ó r ê , n a
powierzchniê, co sprawia, ¿e uzyskujemy zad-
ziwiaj¹ce wyniki naszych pomiarów.
Jakoœæ pomiarów i jej kontrola
Plan sprawdzania jako œci pomiar ów jest
niezbêdnym warunkiem uzyskania pewnoœci,
¿e otrzymane wyniki bêd¹ dok³adne, tzn. opi-
sywaæ bêd¹ rzeczywistoœæ zgodnie ze stanem
faktycznym. Dok ³adnoœæ i wiarygodno œæ
pomiarów sk ³adaj¹ si ê na ich rzetelno œæ,
któr¹ mo¿emy osi¹gn¹æ dziêki temu ¿e:
· P r ó b k i w o d y p o b i e r a m y z g o d n i e z
instrukcj¹;
· Badania wykonujemy bezpo œrednio po
pobraniu próbek;
· U ¿ywamy odpowiednio wyskalowanych
(skalibrowanych) instrumentów;
· Postêpujemy zgodnie z instrukcj ¹ i zalece-
niami opisanymi w protoko³ach;
· Powtarzamy pomiary w celu sprawdzenia
GLOBE™
Protokó³y-3
Hydrologia
Jak prowadziæ
badania hydrologiczne
Przygotowanie pomiarów
GLOBE™
Protokó³y-3
Hydrologia
Jak prowadziæ badania hydrologiczne
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Rodzaj pomiaru Max. ró¿nica
przeŸroczystoœc 1,0 cm
temperatura wody 0,5
o
C
rozpuszczony tlenn
0,4 mg/l
1,0 mg/l (zestawHach)
pH (papier) 1,0 jednostki pH
pH (pehapen lub
pehameter 0,2 jednostki pH
przewodnictwo 2% pe³nej skali
zasolenie (hydrometr) 0,4 czêœci na 1000
zasadowoœæ 4 mg/l wyra¿one w CaCO3
(zestaw La Motte)
1 kropla (zestaw Hach):
17 mg/l as CaCO3
(granica górna)
6,8 mg/l as CaCO3
(granica dolna)
azotany 1,0 mg/l
(40 mS/cm)
dok³adnoœci i znalezienia przyczyn b³êdów;
· Staramy siê w minimalnym stopniu zaniec-
zyszczaæ sprz êt i odczynniki u ¿ywane do
badañ;
· Sprawdzamy zgodnoœæ danych przesy³anych
do Uczniowskiego Serwera Danych z zapisa-
mi na Arkuszu obserwacji hydrologicznych.
Kalibrowanie (skalowanie
instrumentów)
Kalibrowanie jest procedur¹ zmierzaj¹c¹ do
sprawdzenia prawid³owoœci dzia³ania instru-
mentów. Je¿eli na przyk³ad chcemy sprawdziæ
prawid³owoœæ dzia³ania pH-metru, mierzymy
nim roztwory o znanym nam odczynie. Proce-
dury kalibrowania ró¿ni¹ siê miêdzy sob¹ i s¹
opisane w poszczeg ólnych protoko ³ach.
Niektóre z nich musz¹ byæ wykonane w dniu
pomiaru i w miejscu pomiaru, inne w klasie
lub pracowni bezpoœrednio przed wyjœciem w
teren. W niektórych przypadkach konieczne
bêdzie powtórzenie kalibracji w terenie, przy
wykorzystaniu roztworów o znanych nam par-
ametrach (Zobacz protoko ³y pH oraz prze-
wodnictwa elektrycznego)
Czas i kolejnoϾ wykonywania
pomiarów
Badanie przezroczysto œci, temperatury i
zawartoœci rozpuszczonego tlenu w wodzie
n a l e ¿ y w y k o n y w a æ n a m i e j s c u p o b r a n i a
próbki wody, bezpoœrednio po jej pobraniu.
Nie nale¿y dopuszczaæ do sytuacji, w kt órej
pobrana woda bêdzie znajdowaæ siê w kuble
d³u¿ej ni¿ pó³ godziny. Je¿eli tak siê zdarzy,
pobieramy now¹ próbkê. Je¿eli nie mo¿emy
dokonaæ pomiarów na miejscu, wod ê prze-
lewamy do butelki (zobacz rozdzia³ Technika
butelkowania), i badania przeprowadzamy w
klasie. Nale ¿y jednak do ³o¿yæ wszelkich
starañ, aby pomiary wykona æ na miejscu (in
situ). Nie zalecamy dokonywania pomiar ów
rozpuszczonego tlenu w klasie z tego wzgl-
êdu, ¿e musz ¹ one by æ przeprowadzone w
c z a s i e 3 0 m i n u t o d m o m e n t u p o b r a n i a
próbki. Pomiarów pH i azotan ów dokonuje-
my w czasie nie przekraczaj ¹cym 2 godzin;
zasadowoœci, zasolenia i przewodnictwa elek-
trycznego w czasie 24 godzin.
Uwaga: Bardzo wa¿na jest kolejnoœæ prowad-
zenia badañ i pomiar ów. Najpierw badamy
przezroczystoœæ, nastêpnie temperaturê wody
i zawartoϾ rozpuszczonego tlenu, dalej kolej-
no pH, przewodnictwo elektryczne i zasole-
nie, zasadowoϾ i azotany.
Uwaga: WartoϾ pomiaru rozpuszczonego w
wodzie tlenu jest niewielka, je ¿eli nie znamy
temperatury wody. Pomiaru zawartoœci tlenu
w wodzie dokonujemy tylko wtedy, kiedy
zmierzymy jej temperatur ê. Je ¿eli miejsce
pomiaru znajduje si ê u brzegu w ód s ³ona-
wych, musimy zmierzyæ zasolenie, gdy¿ jedy-
nie wtedy mo ¿emy w³aœciwie interpretowaæ
zawartoϾ rozpuszczonego tlenu.
Powtarzanie pomiarów
W celu przeprowadzenia pomiar ów klas ê
dzielimy na co najmniej dwie grupy. Je ¿eli
jedna grupa sko ñczy pomiar, przyrz ¹dy
pomiarowe przekazujemy drugiej grupie.
Obie grupy wykorzystuj¹ wodê z tego samego
pojemnika.
Je¿eli wyniki uzyskane przez obie grupy
ró¿ni¹ siê w spos ób istotny, pomiary nale ¿y
powtórzyæ wykorzystuj¹c w tym celu grup ê
trzeci¹, lub te ¿ obie grupy kt óre wcze œniej
d o k o n y w a ³ y p o m i a r u . O t o n a j w i ê k s z e
dopuszczalne ró¿nice w pomiarach.
GLOBE™
Protokó³y-4
Hydrologia
Ka¿da grupa powinna u ¿ywaæ w ³asnego
Arkusza obserwacji hydrologicznych. War-
toœci przekazywane do Serwera Danych Ucz-
niowskiech Programu GLOBE powinny sta-
n o w i æ w a r t o œ æ œ r e d n i a z e w s z y s t k i c h
pomiarów spe ³niaj¹cych opisane kryteria.
Proszê zauwa ¿yæ, ¿e w przypadku badania
przezroczystoœci wody, do Serwera Danych
Uczniowskich przekazujemy wszystkie wyniki
poszczególnych pomiarów.
Postêpowanie z cieczami
wykorzystanymi w
doœwiadczeniach
Po przeprowadzeniu badañ, wszystkie otrzy-
mane p³yny (z wyj¹tkiem u¿ytych do badania
zawartoœci azotanów) gromadzimy w pojem-
niku z zakrêcanym wlewem, a nastêpnie prze-
kazujemy je do utylizacji zgodnie z instrukcja
obowi¹zuj¹c¹ w danej szkole. P ³yny odpa-
dowe powsta³e w trakcie badania zawarto œci
azotanów, ze wzgl êdu na obecno œæ kadmu,
powinny zostaæ zdeponowane na sk ³adowis-
kach substancji niebezpiecznych.

Opró¿nianie wiadra z wod¹
Je¿eli uczniowie maj¹ bezpieczny dostêp do
wody (w zasiêgu rêki), pomiary nastêpuj¹cych
parametrów mo¿na wykonaæ na miejscu (in
situ): temperatura, pH, rozpuszczony tlen i
przewodnictwo elektryczne. Do pomiar ów
zasadowoœci, zasolenia i azotan ów musimy
zaczerpn¹æ wodê kub³em. Próbki nale¿y prze-
badaæ natychmiast po ich uzyskaniu. Je¿eli to
nie jest mo ¿liwe, wodê wlewamy do butelki
i w klasie badamy pH, zasadowoϾ oraz prze-
wodnictwo elektryczne. Rozpuszczony w
wodzie tlen musi zostaæ ustabilizowany, zgod-
nie z procedur¹ opisan¹ w protokole, przed
przyniesieniem pr óbki do klasy. W celu
pobrania próbek wody oraz umieszczenia ich
w butelkach stosujemy okre œlone techniki,
pozwalaj¹ce na badanie wody w klasie.
Wody powierzchniowe badamy przy u ¿yciu
tuby do badania zmêtnienia. Kr¹¿ka Secchie-
go u¿ywamy w przypadku du¿ych, g³êbokich,
zbiorników wodnych, wykorzystuj ¹c w tym
celu most lub molo.
Techniki pobierania próbek
1.Umocowany na linie kube³ opuszczamy do
wody i stopniowo go nape³niamy. Je¿eli woda
jest zbyt p³ytka, tak ¿e kube³ osiada na dnie,
o d p o w i e d n i o m a n e w r u j e m y l i n ¹ a ¿ d o
momentu nape ³nienia go wod ¹. Kiedy jest
nape³niony, manewruj¹c odpowiednio lin ¹
w y l e w a m y w o d ê i n a p e ³ n i a m y k u b e ³
powtórnie – w ten spos ób p³uczemy kube³.
Nie nale ¿y u ¿ywaæ destylowanej wody do
mycia kub³a, gdy¿ to mo¿e wp³yn¹æ na jakoœæ
wyników badañ. Nie nale ¿y równie¿ u¿ywaæ
kub³a do innych celów, np. mycia lub zmywa-
nia, gdy¿ mo¿e to wp³yn¹æ na jakoœæ wyników.
Je¿eli pobieramy próbkê ze strumienia, kube³
wrzucamy w miejsce gdzie woda jest dobrze
wymieszana, w pewnej odleg³oœci od brzegu.
Idealne miejsce to takie w kt órym woda
p³ynie w miar ê powoli. Je ¿eli natomiast
pobieramy wodê z szybko p³yn¹cego strumie-
nia, nale¿y linê dobrze do czegoœ przywi¹zaæ ,
gdy¿ si³a p³yn¹cej wody mo¿e porwaæ kube³.
Je¿eli próbkê pobieramy z jeziora, zatoki lub
morza, rzucamy kube³ jak najdalej od brzegu
i wyci¹gamy nim wod ê. Zawsze staramy si ê
pobieraæ wodê z warstwy powierzchniowej
lustra wody. Nie pozwalamy mu si ê zanurzaæ
oraz nie powinniœmy zabieraæ z wod¹ osadów
z dna.
Pobieranie próbek wody
Materia³y i narzêdzia
Czterolitrowy kube³ dobrze umocowany na mocnej linie
Papierowe rêczniki
Plastikowa butelka do próbek o pojemnoœci 500 ml
Notatnik Naukowy GLOBE, o³ówki,
Arkusz obserwacji
Gumowe rêkawice (zalecane)
GLOBE™
Protokó³y-5
Hydrologia
Pobieranie próbek wody
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
GLOBE™
Protokó³y-6
Hydrologia
2. Aby otrzymaæ w³aœciw¹ próbkê, nape³nia-
my kube³ wodê do 2/3 lub 3/4 jego objêtoœci.
Technika butelkowania
Co prawda zaleca siê, aby wszystkie badania
prowadziæ na miejscu poboru próbki wody, to
jednak dopuszczalne jest przeprowadzenie
niektórych z nich w klasie – dotyczy to bada-
nia pH, zasadowo œci, azotan ów, zasolenia
i przewodnictwa elektrycznego. Badanie
zawartoœci rozpuszczonego w wodzie tlenu
mo¿emy równie¿ przeprowadziæ w klasie, jed-
nak¿e pod warunkiem utrwalenia jego zawar-
toœci na miejscu i w czasie poboru próbki.
W celu zabezpieczenia pr óbki w butelce
i wykorzystania jej w badaniach w klasie (z
wyj¹tkiem temperatury, przezroczysto œci
i rozpuszczonego tlenu) stosujemy nast ê-
puj¹c¹ procedurê:
1. Na plastikow ¹ butelkê o pojemno œci 500
ml naklejamy karteczk ê zawieraj¹c¹ infor-
macjê o nazwie szko³y, nazwisku nauczyciela,
nazwie miejsca poboru wody, dacie i godzinie
pobrania próbki.
2 . B u t e l k ê d o b r z e p ³ u c z e m y w o d ¹
pochodz¹c¹ z miejsca poboru próbki.
3. Nape ³niamy butelkê pod korek, tak ¿eby
po jej zamkniêciu w butelce nie by ³o powie-
trza.
4. Korek (nakr êtkê) owijamy dodatkowo
taœm¹ izolacyjn¹.
Uwaga: taœma izolacyjna jest wska Ÿnikiem
tego, czy butelka by ³a otwierana. Taœma nie
mo¿e mieæ kontaktu z próbk¹ wody zawartej
w butelce.
5. Butelki z pr óbkami wody przechowujemy
w lodówce w temperaturze oko³o 4oC, a¿ do
momentu rozpoczêcia badañ (do dwóch god-
zin dla pH i azotan ów oraz do 24 godzin dla
zasadowoœci, zasolenia i przewodnictwa elek-
trycznego).
6. Po odklejeniu ta œmy i odkorkowaniu
butelki, w pierwszej kolejno œci badamy pH,
nastêpnie zaœ zasolenie, przewodnictwo elek-
tryczne, zasadowoœæ i azotany. Najlepiej, jeœli
wszystkie te badania przeprowadzamy w cza-
sie jednej sesji, bezpo œrednio po otwarciu
butelki.
Bezpieczeñstwo!
– Nale ¿y przestrzega æ instrukcji
z a m i e s z c z o n y c h w z e s t a w a c h d o
badañ, a tak¿e regulaminu szkolnego
odnosz¹cego siê do zajêæ terenowych.
– W ka ¿dym przypadku u ¿ywania
chemikaliów z zestawów badawczych,
nale¿y nak ³adaæ gumowe r êkawice
i okulary ochronne.

Protokó³:
przezroczystoϾ wody
Zadanie
Okreœlenie przezroczystoœci wody przy u¿yciu
kr¹¿ka Secchiego (wody g³êbokie, spokojne)
lub tuby do pomiarów zmêtnienia (w
przypadku wód p³ytkich, szybko p³yn¹cych)
Znaczenie
Kr¹¿ek Secchiego jest instrumentem
powszechnie stosowanym do pomiaru
przezroczystoœci wody. Zale¿y ona od iloœci
zawieszonej w wodzie substancji
i rozpuszczonego materia³u wp³ywaj¹cego na
jej kolor. Wp³yw na przepuszczanie przez
wodê œwiat³a maj¹ dostaj¹ce siê do niej
sedymenty oraz rozwijaj¹ce siê w niej ¿ycie
biologiczna. Tuby do pomiaru zmêtnienia
u¿ywamy w przypadku wód p³yn¹cych, tam
gdzie zastosowanie kr¹¿ka Secchiego by³oby
utrudnione
Czas
10–15 minut
Poziom nauczania
Wszystkie
Czêstotliwoœæ
Raz w tygodniu
G³ówne pojêcia
Okreœlanie przezroczystoœci wody przy u¿yciu
kr¹¿ka Secchiego lub tuby
Rozproszenie œwiat³a
Zawiesiny
Poch³anianie œwiat³a
Kolor wody
ProduktywnoϾ
Umiejêtnoœci
Pos³ugiwanie siê kr¹¿kiem Secchi’ego lub tub¹
Planowanie strategii pomiarów
Zapisywanie danych
Interpretowanie danych
Œrodki dydaktyczne
Kr¹¿ek Secchiego
Lina o d³ugoœci 5 metrów (krótsza lub
d³u¿sza, w zale¿noœci od warunków
lokalnych)
Farba (emalia) w kolorze bia³ym i czarnym
Stalowy prêt o œrednicy 2,5 – 3 cm, d³ugoœci
ok. 15 cm
Œwider (wiertarka)
Okr¹g³a drewniana p³yta o œrednicy 20 cm i
gruboœci 2,5 cm
2 haki z gwintem
Sznurek d³ugoœci 15 cm
Klej
Wodoodporne pisaki (czerwony, niebieski
i czarny)
Miarka metrowa
Tuba do pomiaru zmêtnienia
Plastikowy przezroczysty cylinder (rura)
d³ugoœci ok. 1 metra (w zale¿noœci od
klarownoœci wody w danej okolicy),
o œrednicy 4,5 cm
Bia³y kr¹¿ek plastikowy stanowi¹cy dno rury
Czarny wodoodporny pisak
Miarka metrowa
Przygotowanie
Je¿eli nie dysponujemy gotowym kr¹¿kiem
Secchiego, musimy go sami wykonaæ.
Instrukcja podana jest w dalszej czêœci
rozdzia³u
Uwarunkowania
Przed rozpoczêciem przez uczniów
pierwszych pomiarów przeprowadzamy
z nimi krótk¹ dyskusjê na temat
funkcjonowania obydwu opisanych
poprzednio przyrz¹dów
GLOBE™
Protokó³y-7
Hydrologia
PrzexroczystoϾ wody
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
GLOBE™
Protokó³y-8
Hydrologia
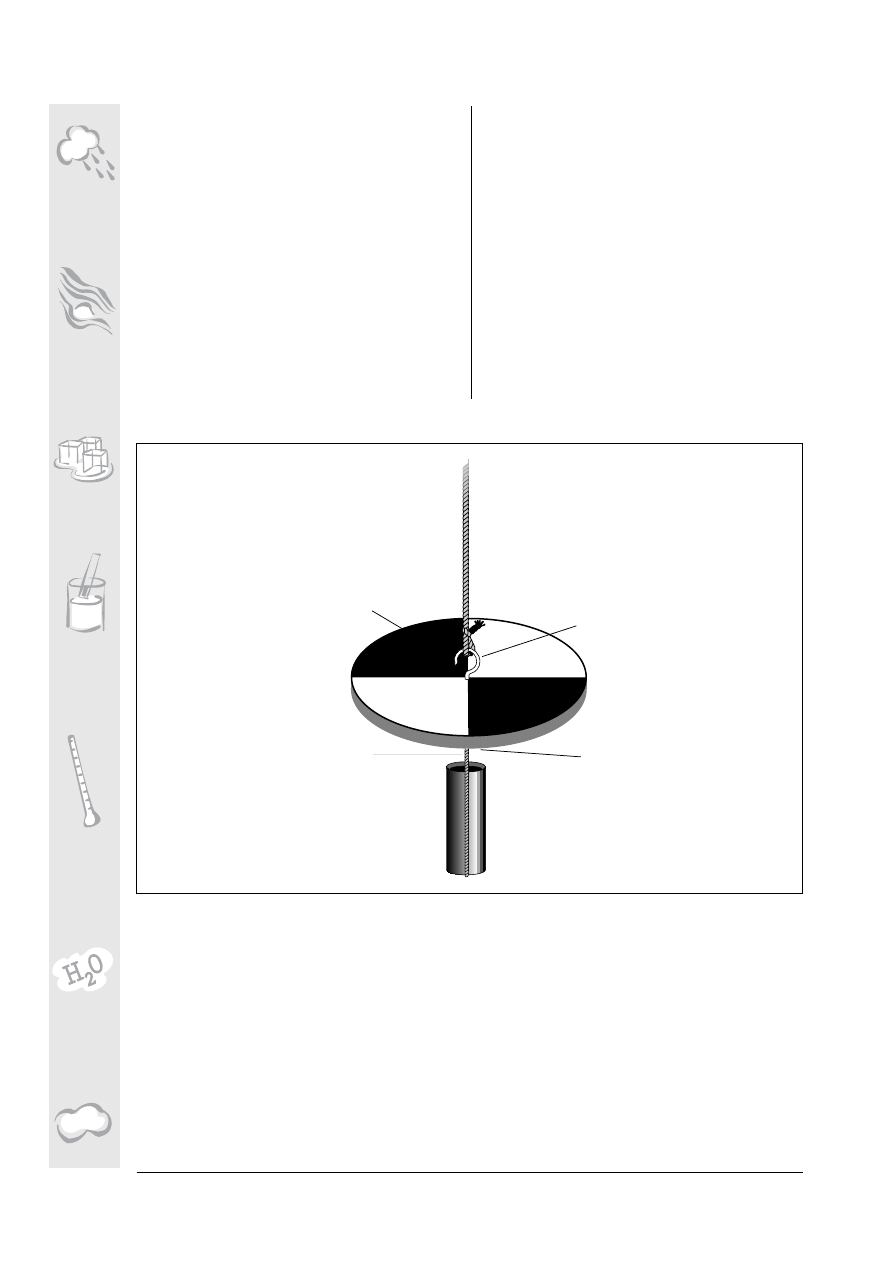
Jak zbudowaæ kr¹¿ek Secchiego
1. Na drewnianym kr ¹¿ku rysujemy dwie
linie przechodz¹ce przez jego œrodek, przeci-
naj¹ce siê pod k¹tem prostym
2. Dwie le ¿¹ce naprzeciw siebie æwiartki
malujemy na kolor bia ³y, dwie pozosta ³e na
kolor czarny
3. Z obu stron kr¹¿ka, dok³adnie w jego œrod-
ku, wkrêcamy haki. Do haka znajduj¹cego siê
na górze mocujemy 5-metrowy odcinek liny.
4. Na haku wkr êconym w dno kr ¹¿ka przy
u¿yciu sznurka zawieszamy stalowy pr êt,
s³u¿¹cy jako balast
5. Na 5-metrowej linie, zaczynaj¹c od kr¹¿ka,
co 10 cm zaznaczamy odleg ³oœæ czarnym
w o d o o d p o r n y m p i s a k i e m ( m a r k e r e m ) .
Odcinki 0,5 metrowe zaznaczamy markerem
niebieskim, natomiast odcinki 1 metrowe
markerem czerwonym. Przyrz¹d jest gotowy
do pomiarów.
lina do opuszczania kr¹¿ka
du¿y hak z gwintem
krótki sznurek
drugi (niewidoczny) hak
do umocowania stalowego prêta
stalowy prêt (balast)
drewniany kr¹¿ek
o œrednicy 20 cm
Rysunek HYD-P-1. Budujemy kr¹¿ek Secchiego
GLOBE™
Protokó³y-9
Hydrologia
PrzeŸroczystoœæ wody
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
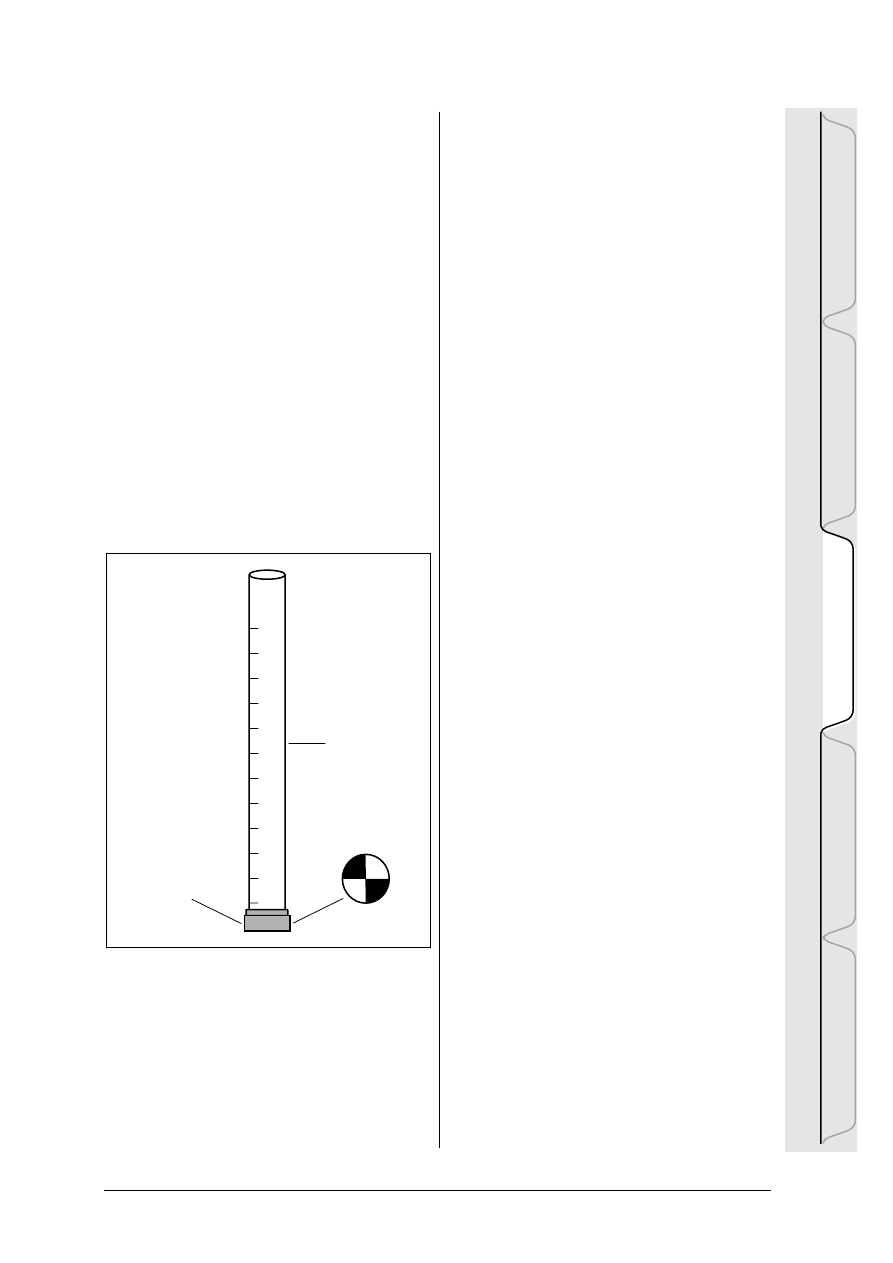
Jak skonstruowaæ tubê do
pomiaru zmêtnienia:
1. Na ko ñcu przezroczystej plastikowej rury
montujemy dno w ten sposób, ¿eby woda nie
wycieka³a
2. Z drewnianej sklejki lub plastiku wycina-
my kr¹¿ek o takiej samej œrednicy jak rura w
œrodku
3. Na kr ¹¿ku rysujemy dwie prostopad³e linie
przechodz¹ce przez jego œrodek. Le ¿¹ce
naprzeciw siebie æwiartki malujemy na czar-
no, dwie pozosta ³e na bia ³o. Pokrywamy je
wodoodpornym lakierem.
4. Tak przygotowany kr ¹¿ek przyklejamy do
dna rury, pomalowan¹ powierzchni¹ do góry
5. Przy pomocy miarki metrowej i markera
na tubê nanosimy skalê. Powierzchnia kr¹¿ka
to 0 cm.
Jak mierzymy przezroczystoϾ
(zmêtnienie)
W czasie pomiarów z wykorzystaniem kr¹¿ka
Secchiego oraz tuby, przyrz ¹dy te powinny
znajdowaæ si ê w cieniu, natomiast S ³oñce
powinni znajdowa æ si ê za plecami wyko-
nuj¹cego pomiar. Je¿eli w chwili pomiaru nie
ma cienia, mo¿emy skorzystaæ z parasola lub
arkusza kartonu w celu os³oniêcia przyrz¹du.
W przypadku stosowania tuby cie ñ rzucany
przez obserwatora powinien wystarczyæ.
Ro ¿ne osoby w ró¿ny sposób oceniaj¹ g³êbo-
koœæ po³o¿enia kr¹¿ka Secchiego lub te¿ gru-
boϾ warstwy wody w tubie. Z tego powodu, o
ile jest to mo ¿liwe, pomiary powinny by æ
wykonane niezale ¿nie przez co najmniej 3
uczniów, a wszystkie uzyskane przez nich
wyniki nale¿y przekazaæ do Serwera Danych
Uczniowskich GLOBE.
Kr¹¿ek Secchiego
1. Kr ¹¿ek zanurzamy powoli w wodzie, a¿ do
momentu kiedy zniknie nam z oczu. Je ¿eli
jest to mo ¿liwe, chwytamy lin ê przy samej
powierzchni wody i zaznaczamy na niej to
miejsce (np. wbijaj ¹c szpilk ê krawieck ¹).
Je¿eli to nie jest mo¿liwe, g³êbokoœæ zanurze-
nia okreœlamy na podstawie podzia³ki nanie-
sionej na linê.
2. Kr ¹¿ek powoli wynurzamy, a¿ do momen-
tu kiedy pojawi si ê powtórnie. Powtarzamy
procedurê opisan¹ w p.1. Odleg³oœæ pomiêdzy
zaznaczonymi miejscami na linie nie powinna
przekraczaæ kilku centymetrów
3. Uzyskane wyniki zapisujemy w Arkuszu
obserwacji, z dok³adnoœci¹ do 1 cm
4. Je ¿eli wyniki pomiarów ró¿ni¹ siê o wiêcej
ni¿ 10 cm, pomiary powtarzamy i nowe wyni-
ki zapisujemy w Arkuszu obserwacji
5. Pos ³uguj¹c siê protokó³em stopnia zach-
murzenia, okreœlamy stopieñ zachmurzenia
nieba (w skali 4-stopniowej)
6. Do Serwera Danych Uczniowskich prze-
kazujemy wyniki: g ³êbokoœæ zanurzenia
kr¹¿ka oraz stopie ñ zachmurzenia. Uwaga:
Nie podajemy warto œci œredniej, ale wynik
ka¿dego obserwatora.
Uwaga: Je ¿eli kr¹¿ek dotknie dna, a my go
wci¹¿ widzimy, to po prostu zapisujemy t ê
g³êbokoœæ. W chwili przekazywania danych
do Serwera Danych Uczniowskich przed war-
toœci¹ wyra ¿on¹ w centymetrach stawiamy
matematyczny znak wiêkszoœci (>).
skala w cm
przezroczysta rura
4.5 x 120 cm
PVC dno
pomalowany
kr¹¿ek na
dnie rury
10
20
30
40
50
60
70
80
90
100
110
120
Rysunek HYD-P-2. Konstruowanie tuby

GLOBE™
Protokó³y-10
Hydrologia
Tuba do badania zmêtnienia
1. Próbkê wody wlewamy do tuby a ¿ do tego
momentu w którym bia³o-czarny wzór na jej
dnie przestanie byæ widoczny, kiedy patrzymy
pionowo w d ó³. Wskazane jest nie dotyka æ
tuby w momencie pomiaru, gdy¿ pojawiaj¹ce
s i ê n a p o w i e r z c h n i w o d y z m a r s z c z k i
wywo³ane dotykiem utrudniaj¹ obserwacjê.
2. Uzyskany wynik zapisujemy w Arkuszu
obserwacji z dok³adnoœci¹ do 1 cm
3. Zmierzon ¹ g ³êbokoœæ przekazujemy do
Uczniowskiego Serwera Danych, pamiêtaj¹c
o tym, ¿e podajemy wyniki ka¿dego obserwa-
tora, a nie wartoœæ œredni¹.
Uwaga: Je ¿eli po ca ³kowitym nape ³nieniu
tuby bia³o-czarny wzór na jej dnie jest ci ¹gle
widoczny, przed podan ¹ w centymetrach
g³êbokoœci¹ (d³ugoœci¹ tuby) stawiamy mate-
matyczny znak wiêkszoœci (> ).

Protokó³:
temperatura wody
Zadanie
Pomiar temperatury
Znaczenie
ZnajomoϾ temperatury wody
wykorzystywana jest w badaniach jej pH oraz
rozpuszczonego tlenu, a tak¿e w studiach
nad globalnymi problemami hydrologii
Czas
5 min. po skalibrowaniu termometru
Poziom nauczania
Wszystkie
Czêstotliwoœæ
Raz w tygodniu. Kalibracja instrumentów co
3 miesi¹ce.
G³ówne pojêcia
Temperatura, pomiar temperatury
Ciep³o, przemieszczanie siê ciep³a,
Przewodzenie ciep³a
Precyzja
RzetelnoϾ
Umiejêtnoœci
U¿ytkowanie termometru w sposób w³aœciwy
Czytanie skali
Zapisywanie danych
Œrodki dydaktyczne
Termometr alkoholowy
Zegarek
Sznurek odpowiedniej d³ugoœci, pozwalaj¹cy
zanurzyæ termometr w wodzie
Gumowa taœma
Arkusze danych
Przygotowanie
Wszystkie instrumenty i materia³y
przynosimy na miejsce badañ
GLOBE™
Protokó³y-11
Hydrologia
Temperatura wody
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Kalibrowanie i kontrola jakoœci
Ten pomiar zajmuje jedynie kilka minut.
Nale¿y zadbaæ o to, aby termometr przebywa³
w wodzie dostatecznie d ³ugo i temperatura
uleg³a wyrównaniu – trwa to na og ó³ od 3 do
5 minut.
U¿ywany w badaniach termometr wype³niony
alkoholem powinien byæ kalibrowany co trzy
miesi¹ce, i oczywi œcie przed rozpocz êciem
badañ. Procedura kalibrowania termometrów
opisana jest w rozdziale Badania atmosfery –
Protokó³: temperatura bie ¿¹ca, maksymalna
i minimalna.
Jak mierzymy temperaturê wody
1. Na jednym ko ñcu sznurka przywi¹zujemy
termometr, na drugim mocujemy gumow ¹
taœmê. Taœmê okrêcamy wokó³ d³oni, zapo-
biegaj¹c w ten sposób przypadkowemu upad-
kowi termometru do wody.
2. Trzymaj¹c termometr za koniec przeciw-
leg³y do zbiorniczka cieczy potrz ¹samy nim
kilkakrotnie w celu usuni êcia pêcherzyków
powietrza. Odnotowujemy aktualn¹ tempera-
turê.
3. Termometr zanurzamy w wodzie na g³êbo-
koœæ oko³o 10 cm i trzymamy go tam od 3 do
5 minut
4. Po up³ywie tego czasu termometr wyjmuje-
my i szybko odczytujemy temperatur ê. W
sytuacjach gdy temperatura powietrza r ó¿ni
siê zdecydowanie od temperatury wody, lub
w czasie silnego wiatru, w czasie wyci ¹gania
temperatura na termometrze zmieni siê bar-
dzo szybko. Nale¿y wtedy próbowaæ dokonaæ
odczytu na termometrze, kt órego zbiornik z
c i e c z ¹ j e s t c i ¹ g l e z a n u r z o n y w w o d z i e .

GLOBE™
Protokó³y-12
Hydrologia
Zanurzamy termometr na jedn ¹ minut ê w
celu ustabilizowania go. Odczytujemy tem-
peraturê ponownie, je ¿eli si ê nie zmienia,
przechodzimy do punktu 5.
5. Zapisujemy temperatur ê Arkuszu obser-
wacji, odnotowuj¹c jednoczeœnie datê i go-
dzinê pomiaru.
6. Obliczamy œredni¹ z pomiarów kilku grup
uczniowskich. Je¿eli ró¿nica miêdzy wszystki-
mi pomiarami zawiera siê w przedziale 1oC w
stosunku do œredniej, wynik ten przekazujemy
do Serwera Danych Uczniowskich. Je¿eli nie,
powtarzamy pomiary.
GLOBE™
Protokó³y-13
Hydrologia
Temperatura wody
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Source: Jan Smolík, 1996, TEREZA, Association for Environmental Education, Czech Republic

GLOBE™
Protokó³y-14
Hydrologia
Kalibrowanie i kontrola jakoœci
Kalibrowanie nale¿y przeprowadzaæ co szeœæ
miesiêcy w celu sprawdzenia jakoœci stosowa-
nych chemikaliów
1. Butelkê o pojemnoœci 250 ml dwukrotnie
przemywamy destylowan¹ wod¹. Przy pomocy
menzurki odmierzamy 100 ml destylowanej
wody.
2. Odmierzon ¹ wod ê wlewamy do 250 ml
butelki. Zamykamy j¹ szczelnie i przez 5 min.
intensywnie ni¹ potrz¹samy.
3. Zdejmujemy nakrêtkê z butelki i mierzymy
temperaturê wody. Zwracamy uwag ê na to,
aby zbiorniczek z p³ynem w termometrze nie
dotyka³ dna ani œcianek butelki. Termometr
trzymamy 1 minut ê i odczytujemy tempera-
turê.
4. Wynik odczytu zapisujemy w Arkuszu
obserwacji.
5. Postêpujemy zgodnie z instrukcj¹ opisuj¹c¹
pomiar rozpuszczonego w wodzie tlenu.
W arkuszu danych nale ¿y zapisaæ zawartoœæ
rozpuszczonego tlenu, w mg/l, dla wzorcowej
w o d y d e s t y l o w a n e j . U s t a l o n a m e t o d ¹
potrz¹sania iloœæ rozpuszczonego w destylo-
wanej wodzie tlenu nie mo ¿e r ó¿niæ si ê o
wiêcej jak o 0,4 mg/l od wartoœci oczekiwanej.
Tê warto œæ oczekiwan ¹ zawarto œci rozpu-
szczonego tlenu w wodzie destylowanej ustalamy
Protokó³:
rozpuszczony tlen
Zadanie
Zmierzenie iloœci tlenu rozpuszczonego w
próbce wody
Znaczenie
Od iloœci rozpuszczonego w wodzie tlenu
zale¿y przetrwanie wszystkich roœlin i
zwierz¹t wystêpuj¹cych w danym zbiorniku
wodnym. Iloœæ tlenu zale¿y od czynników
naturalnych i od ró¿nych form oddzia³ywania
cz³owieka na przyrodê
Czas
15 minut na kalibracjê instrumentów
15 minut pracy terenowej
Poziom nauczania
Œredni i zaawansowany
Czêstotliwoœæ
Raz w tygodniu
G³ówne pojêcia
Rozpuszczony tlen
Porównywanie ze standardami
Dok³adnoœæ, rzetelnoœæ
Umiejêtnoœci
Korzystanie poprawne z zestawu badawczego
do oznaczania rozpuszczonego tlenu
Zapisywanie danych
Œrodki dydaktyczne
Zestaw badawczy do pomiaru
rozpuszczonego tlenu (zobacz
Instrumentarium)
Uwaga: w zestawie znajduj¹ siê
niebezpieczne chemikalia
Woda destylowana
Butelka plastikowa o pojemnoœci 250 ml
z zamkniêciem
Termometr
Arkusz obserwacji
Rêkawice gumowe,
Okulary ochronne
Przygotowanie
Nale¿y przeæwiczyæ procedurê przygotowania
i zabezpieczenia próbki opisan¹ w tym
protokole

GLOBE™
Protokó³y-15
Hydrologia
Rozpuszczony tlen
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
0
6
.
4
1
6
1
9
.
9
2
3
3
.
7
1
2
.
4
1
7
1
7
.
9
3
3
2
.
7
2
8
.
3
1
8
1
5
.
9
4
3
1
.
7
3
5
.
3
1
9
1
3
.
9
5
3
0
.
7
4
1
.
3
1
0
2
1
.
9
6
3
8
.
6
5
8
.
2
1
1
2
9
.
8
7
3
7
.
6
6
5
.
2
1
2
2
7
.
8
8
3
6
.
6
7
1
.
2
1
3
2
6
.
8
9
3
5
.
6
8
9
.
1
1
4
2
4
.
8
0
4
4
.
6
9
6
.
1
1
5
2
3
.
8
1
4
3
.
6
0
1
3
.
1
1
6
2
1
.
8
2
4
2
.
6
1
1
0
.
1
1
7
2
0
.
8
3
4
1
.
6
2
1
8
.
0
1
8
2
8
.
7
4
4
0
.
6
3
1
5
.
0
1
9
2
7
.
7
5
4
9
.
5
4
1
3
.
0
1
0
3
6
.
7
6
4
8
.
5
5
1
1
.
0
1
1
3
4
.
7
7
4
7
.
5
Temp. rozpuszcz. Temp.
rozpuszcz. Temp. rozpuszcz.
°
C
mg/l
°
C
mg/l
°
C
mg/l
Tabela HYD-P-1: Rozpuszczalnoœæ tlenu w wodzie maj¹cej kontakt z powietrzem
przy ciœnieniu atmosferycznym 750 mm Hg

GLOBE™
Protokó³y-16
Hydrologia
w nastepuj¹cy sposób:
1. W tabeli HYD-P-1 odnajdujemy tempera-
turê naszej próbki wody.
2. Dla tej temperatury przyporz ¹dkujemy
odpowiadaj¹c¹ jej rozpuszczalnoœæ tlenu (w
mg/l) i zapisujemy t ê warto œæ w Arkuszu
Danych Roboczych Kalibracji. Przyk³ad: przy
temperaturze 22 oC rozpuszczalno Ͼ tlenu
wynosi 8,7 mg/l
3. W tabeli HYD-P-2 odnajdujemy warto Ͼ
wspó³czynnika rozpuszczalnoœci w zale¿noœci
od wzniesienia naszego miejsca pomiar ów
nad poziomem morza. Przyk³ad: Wzniesienie
1544 m n.p.m. – wartoœæ wspó³czynnika wyno-
si 0,83.
4. Obie uzyskane na etapie drugim i trzecim
wartoœci mno¿ymy. Przyk³ad: Dla wysokoœci
1544 m oraz temperatury 22 oC (mno ¿ymy
8,74 mg/l x 0,83). Otrzymany wynik to 7,25.
5. Ta warto œæ (7,25 w naszym przyk ³adzie)
jest oczekiwan¹ zawartoœci¹ rozpuszczonego
tlenu we wzorcowej wodzie destylowanej.
6. T ê oczekiwan ¹ warto œæ por ównujemy z
wynikiem przeprowadzanego przez nas kali-
browania wzorcowej wody destylowanej.
Je¿eli wynik ró¿ni siê o wiêcej ni¿ 0,4 mg/l (w
zestawie La Motte) lub 1 mg/l (w zestawie
Hacha), próbê ponawiamy. Je¿eli w kolejnej
próbie wynik nie odpowiada oczekiwanej
wartoœci wyliczonej, ale ró¿nica nie przekra-
cza 1 mg/l, wynik zapisujemy w Arkuszu
Danych Roboczych Kalibracji.
7. Je¿eli ró¿nica jest wiêksza ni¿ 1 mg/l, war-
toœæ tê zapisujemy, ale wymieniamy chemika-
lia z zestawu u ¿ywane w kalibracji. Nowej
kalibracji dokonujemy z zastosowaniem no-
wego zestawu chemikaliów.
Jak mierzyæ rozpuszczony tlen
Pobieranie próbki
1. Butelkê do pobierania pr óbki wody oraz
rêce p³uczemy trzy razy wod ¹ przeznaczon¹
do badañ. Zlewki przemywamy wod¹ destylo-
wan¹.
2. Butelkê zamykamy korkiem.
3. Butelkê zanurzamy w badanej wodzie, wyj-
mujemy korek. Butelka nape³nia siê wod¹.
4. Poruszamy butelk ¹ w celu pozbycia si ê
pêcherzyków powietrza.
5. W czasie zanurzenia butelki w wodzie,
zamykamy j¹ korkiem. Zakorkowan¹ butelkê
wyjmujemy z wody.
6. Jeszcze raz sprawdzamy, czy w wodzie nie
znajduj¹ siê pêcherzyki powietrza. Je¿eli tam
s¹, procedurê nape³niania powtarzamy.
Procedura utrwalania próbki wody i badania.
1. W celu wyznaczenia zawartoœci rozpuszczo-
nego w wodzie tlenu, pos ³ugujemy siê zesta-
wami spe³niaj¹cymi kryteria obowi¹zuj¹ce w
Programie GLOBE. Nale ¿y post êpowaæ
zgodnie z instrukcj¹ producenta zestawu.
2. Otrzymane przez uczniów wyniki zapisuje-
my w arkuszu obserwacji bada ñ hydrologicz-
nych.
3. Z wyników otrzymanych przez ró¿ne grupy
uczniów obliczmy warto œæ œredni¹. Je ¿eli
ró¿nice miêdzy poszczególnymi wynikami nie
przekraczaj¹ wielkoœci 1 mg/l, ten uœredniony
wynik przekazujemy do Serwera Danych Ucz-
niowskich Programu GLOBE. Je¿eli ró¿nice
s¹ wiêksze, powtarzamy badania.
4. Wszystkie p³yny u¿ywane w badaniach, po
ich zakoñczeniu umieszczmy w specjalnym
pojemniku na odpady.
W zestawach do badañ rozpuszczonego tlenu
opisane s ¹ dwie procedury – utrwalania
próbki wody oraz badañ w³aœciwych. Utrwala-
nie próbki polega na dodaniu do wody odpo-
wiedniej substancji chemicznej (np. siarczanu
manganawego). W badaniach w ³aœciwych
pos³ugujemy siê procedur¹ miareczkowania
r o z t w o r u , c z y l i d o d a w a n i a d o n i e g o
okreœlonej substancji chemicznej, a ¿ do
momentu kiedy zabarwienie roztworu zni-
knie. IloϾ rozpuszczonego w wodzie tlenu
okreœlana jest na podstawie obj êtoœci sub-
stancji (liczba kropli) dodawanej do badanej
wody.
GLOBE™
Protokó³y-17
Hydrologia
Tabela HYD-P-2 Wspó³czynnik rozpuszczalnoœci tlenu w wodzie w zale¿noœci
od ciœnienia atmosferycznego i wysokoœci n.p.m.
Rozpuszczony tlen
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
g
H
m
m
a
P
k
m
n
o
i
t
a
r
b
i
l
a
C
%
e
u
l
a
v
8
6
7
3
.
2
0
1
4
8
-
1
0
.
1
0
6
7
3
.
1
0
1
0
0
0
.
1
2
5
7
3
.
0
0
1
5
8
9
9
.
0
5
4
7
3
.
9
9
0
7
1
8
9
.
0
7
8
7
8
.
8
9
6
5
2
7
9
.
0
0
3
7
3
.
7
9
3
4
3
6
9
.
0
2
2
7
3
.
6
9
1
3
4
5
9
.
0
4
1
7
2
.
5
9
9
1
5
4
9
.
0
7
0
7
2
.
4
9
8
0
6
3
9
.
0
9
9
6
2
.
3
9
8
9
6
2
9
.
0
2
9
6
2
.
2
9
9
8
7
1
9
.
0
4
8
6
2
.
1
9
0
8
8
0
9
.
0
6
7
6
2
.
0
9
2
7
9
9
8
.
0
9
6
6
2
.
9
8
6
6
0
1
8
8
.
0
1
6
6
2
.
8
8
0
6
1
1
7
8
.
0
4
5
6
1
.
7
8
4
5
2
1
6
8
.
0
6
4
6
1
.
6
8
0
5
3
1
5
8
.
0
8
3
6
1
.
5
8
7
4
4
1
4
8
.
0
ciœnienie
mm Hg
cisnienie
kPa
wzniesien
m
wspó³.
%
g
H
m
m
a
P
k
m
n
o
i
t
a
r
b
i
l
a
C
%
e
u
l
a
v
1
3
6
1
.
4
8
4
4
5
1
3
8
.
0
3
2
6
1
.
3
8
3
4
6
1
2
8
.
0
6
1
6
1
.
2
8
3
4
7
1
1
8
.
0
8
0
6
1
.
1
8
3
4
8
1
0
8
.
0
0
0
6
0
.
0
8
5
4
9
1
9
7
.
0
3
9
5
0
.
9
7
7
4
0
2
8
7
.
0
5
8
5
0
.
8
7
1
5
1
2
7
7
.
0
8
7
5
0
.
7
7
6
5
2
2
6
7
.
0
0
7
5
0
.
6
7
2
6
3
2
5
7
.
0
2
6
5
0
.
5
7
9
6
4
2
4
7
.
0
5
5
5
0
.
4
7
7
7
5
2
3
7
.
0
7
4
5
0
.
3
7
7
8
6
2
2
7
.
0
0
4
5
9
.
1
7
7
9
7
2
1
7
.
0
2
3
5
9
.
0
7
9
0
9
2
0
7
.
0
4
2
5
9
.
9
6
3
0
2
3
9
6
.
0
7
1
5
9
.
8
6
7
3
1
3
8
6
.
0
9
0
5
9
.
7
6
3
5
2
3
7
6
.
0
2
0
5
9
.
6
6
1
7
3
3
6
6
.
0
ciœnienie
mm Hg
ciœnienie
kPa
wzniesien
m
wspó³.
%

Protokó³:
odczyn pH
Zadanie
Dokonanie pomiaru pH
Znaczenie
Odczyn pH, czyli kwasowoϾ wody jest
podstawowym czynnikiem warunkuj¹cym
¿ycie w zbiorniku wodnym
Czas
5 minut to rzeczywisty czas pomiaru
10 do 15 minut w klasie oraz 5 minut w
terenie na skalibrowanie przyrz¹dów
Czêstotliwoœæ
Raz w tygodniu
G³ówne pojêcia
Pomiar pH
Wp³yw temperatury na pH
Kalibrowanie
Umiejêtnoœci
Pos³ugiwanie siê przyrz¹dami do pomiaru pH
Zapisywanie danych
Œrodki dydaktyczne
Dla metody nr 1
Papier lakmusowy
Zlewka 50 lub 100 ml
Dla metody nr 2
Dla uczniów œrednich i zaawansowanych –
wskaŸnik pH (pehapen)
Œrubokrêt jubilerski do kalibracji
Trzy zlewki 50 lub 100 ml
Trzy zamykane butelki plastikowe o
pojemnoœci 50 ml
Roztwór buforowy dla pH równego 7
lub
pehametr (dla zaawansowanych)
Piêæ zlewek o pojemnoœci 50 lub 100 ml
Trzy zamykane butelki plastikowe o
pojemnoœci 50 ml
Trzy roztwory buforowe dla pH równego 4, 7
oraz 10
Oraz dla obydwu rodzajów pomiarów:
Menzurka z podzia³k¹ o pojemnoœci 100 ml
Papierowe rêczniki, chusteczki
Woda destylowana
Mieszade³ko
Taœma izolacyjna
Wodoodporny pisak
Gumowe rêkawice, okulary ochronne
Przygotowanie
Nale¿y przeprowadziæ próbê dzia³ania
instrumentów zgodnie z zaleceniami
producenta. Czas próby powinien
przekraczaæ 1 godzinê
Uwarunkowania
Nie ma
GLOBE™
Protokó³y-18
Hydrologia

GLOBE™
Protokó³y-19
Hydrologia
Odczyn pH
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Wprowadzenie
W tym protokole opisana jest procedura
pomiaru pH próbki wody ze sta ³ego miejsca
badañ. Wskazane jest, by uczniowie klas
m³odszych pos³ugiwali siê w tym celu papie-
rem lakmusowym (wskaŸnikowym). Ucznio-
wie klas starszych powinni pos ³ugiwaæ si ê
wskaŸnikiem pH (pehapenem) lub pehame-
trem.
Jak mierzyæ pH
Metoda 1: papier lakmusowy
Ni¿sze poziomy nauczania
1. Zlewkê o pojemnoœci 50 ml lub 100 ml co
najmniej dwukrotnie p³uczemy wod¹ z bada-
nego zbiornika.
2. Zlewkê nape³niamy wod¹ przeznaczon¹ do
badania mniej wi êcej do po ³owy jej wyso-
koœci.
3. Zanurzamy w wodzie pasek papieru lakmu-
sowego i trzymamy go tam oko ³o 1 minuty.
Upewniamy siê, czy wszystkie cztery sektory
paska s¹ zanurzone.
4. Wyjmujemy pasek z wody i por ównujemy
go ze skal¹ pH umieszczon¹ na opakowaniu.
Staramy si ê odnale Ÿæ tak ¹ sekwencj ê, w
której wszystkie cztery kolory sektor ów s ¹
identyczne z kolorami na skali.
5. Je ¿eli kolory nie s ¹ wyra Ÿne, mo ¿e to
œwiadczyæ o zbyt kr ótkim przetrzymywaniu
paska w wodzie. Papier lakmusowy reaguje
po d³u¿szym czasie w wodzie w kt órej prze-
wodnictwo elektryczne jest ni¿sze ani¿eli 400
mikroSiemensów/cm. (wiêcej informacji w
protokole przewodnictwa elektrycznego).
Je¿eli to jest przyczyn¹ s³abej reakcji papieru,
nale¿y go ponownie umie œciæ w wodzie na
czas 1 minuty. Czynnoœæ tê nale¿y powtarzaæ
a¿ do chwili osi¹gniêcia zadowalaj¹cych rezul-
tatów. Je¿eli jednak nawet po dziesiêciu min-
utach odczyt jest niemo ¿liwy, zaczynowy
pomiar z wykorzystaniem nowego paska
papieru. W przypadku powt órnego niepo-
wodzenia, fakt ten odnotowujemy w Arkuszu
obserwacji.
6. Po zapisaniu odczytu w Arkuszu obserwacji,
uzyskane wyniki przekazujemy do Serwera
Danych Uczniowskiech.
Uwaga: pomiar pH z u¿yciem papieru lakmu-
sowego mo¿e byæ ma³o dok³adny je¿eli woda
ma przewodnictwo elektryczne mniejsze ni ¿
300 mikroSiemensów/cm
Metoda 2: pehametr
Wy¿sze poziomy nauczania
W celu dokonania pomiaru pH przy u ¿yciu
pehametru nale¿y: (1) przygotowaæ roztwory
buforowe, (2) wykalibrowaæ instrumenty, (3)
powtórnie sprawdziæ instrumenty przy u¿yciu
roztworów buforowych w terenie, oraz (4)
dokonaæ pomiaru pH w terenie.
Kalibrowanie
Kalibrowania instrumentów nale¿y dokony-
waæ przd ka¿d¹ seri¹ pomiarow¹. Mo¿na tego
dokonaæ w klasie przed wyj œciem w teren
badañ.
Etap 1. Przygotowanie wzorcowych
roztworów buforowych
Gotowe roztwory buforowe maj ¹ trwa ³oœæ
oko³o 1 roku i mog ¹ by æ stosowane a ¿ do
momentu ich nadmiernego zanieczyszczenia.
Je¿eli u ¿ywamy sproszkowanej substancji
buforowej, rozpuszczamy j¹ w destylowanej
wodzie zgodnie z instrukcj ¹ zamieszczon ¹
poni¿ej. Je¿eli u¿ywamy roztworów gotowych,
do menzurki wlewamy 50 ml roztworu i prze-
chodzimy do punktu 4.
Instrukcja dla ka¿dego z roztworów
buforowych (ph 4, 7 i 10)
1. Na dw óch kawa ³kach ta œmy zapisujemy
wartoœæ roztworu buforowego oraz dat ê.
Jeden kawa³ek taœmy naklejamy na czystej,
suchej zlewce o pojemnoœci 100 ml, drugi na
czystej plastikowej butelce o pojemno œci 50
ml.
2. Przy pomocy menzurki odmierzamy 50 ml
destylowanej wody i wlewamy j¹ do zlewki.
3. Nad zlewk¹ rozcinamy torebkê z proszkiem
buforowym i wsypujemy go do wody. Nale ¿y
siê upewni æ, czy ca ³y proszek dosta ³ si ê do
zlewki. Mieszamy wodê do momentu ca³kowi-
tego rozpuszczenia siê proszku.
4. Roztwór buforowy wlewamy do oznaczonej
butelki, któr¹ szczelnie zamykamy. Po mie-
si¹cu roztwór wylewamy.

GLOBE™
Protokó³y-20
Hydrologia
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14

GLOBE™
Protokó³y-21
Hydrologia
Odczyn pH
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
5. Inne roztwory buforowe tworzymy zgodnie
z procedur¹ opisan¹ w punktach 1– 4
Etap 2. Kalibrowanie wskaŸników pH oraz
pehametrów
Uwaga t³umacza: w literaturze angielsko-j êzycznej
rozró¿nia siê dwa instrumenty s ³u¿¹ce do badania
odczynu – tzw. pH pen oraz pehametr. Dla potrzeb
Programu GLOBE podtrzymamy to rozr ó¿nienie, i
pierwszy z nich nazwiemy wska Ÿnikiem pH lub
pehapenem, drugi, bardziej skomplikowany, zgodnie
z polsk¹ tradycj¹ nazywaæ bêdziemy pehametrem
A. Kalibrowanie wskaŸnika pH(pehapenu)
Uwaga: Je ¿eli wska Ÿnik pH nie posiada
urz¹dzenia automatycznie uwzglêdniaj¹cego
temperaturê, roztwory buforowe powinny
mieæ temperaturê 25oC.
1. Z elektrod¹ nale¿y postêpowaæ zgodnie z
instrukcjami producenta instrumentu.
2. Elektrodê (szklan¹ koñcówkê) oraz miejsca
do niej bezpo œrednio przyleg³e dwukrotnie
p³uczemy destylowan ¹ wod ¹ i delikatnie
wycieramy miêkkim materia³em (papierow¹
chusteczk¹) po ka¿dym p³ukaniu. Nie dotyka-
my elektrody palcami.
3. Trzymaj¹c wskaŸnik za jego g órn¹ czêœæ,
elektrodê zanurzamy ca³kowicie w roztworze
o wartoœci pH równym 7. Postêpujemy tak jak
na ilustracji HYD-P-3.
4. Delikatnie mieszamy roztwór elektrod¹, do
chwili ustabilizowania siê wyniku.
5. Przy pomocy œrubokrêta jubilerskiego
odpowiednio podkrêcamy ma³¹ œrubkê w tyl-
nej czêœci wskaŸnika, tak aby w okienku poja-
wi³a siê wartoœæ 7 pH.
6. Wyjmujemy wskaŸnik pH z roztworu, p ³u-
czemy elektrod ê w destylowanej wodzie.
Roztwór buforowy przelewamy do butelki,
któr¹ szczelnie zamykamy.
B. Kalibrowanie pehametru
1. Z elektrod¹ nale¿y postêpowaæ zgodnie z
instrukcj¹ producenta instrumentu.
2. Elektrodê (szklan¹ koñcówkê) oraz miejsca
bezpoœrednio do niej przylegaj¹ce dwukrotnie
przemywamy destylowan¹ wod¹ i delikatnie
wycieramy miêkkim materia³em (papierow¹
chusteczk¹) po ka¿dym p³ukaniu. Nie dotyka-
my palcami elektrody.
3. W ³¹czamy urz ¹dzenie (naciskaj ¹c guzik
ON/OFF). Nast êpnie wciskamy przycisk
CAL, aby wskazaæ ¿e przystêpujemy do kali-
browania instrumentu.
4. Elektrod ê zanurzamy ca ³kowicie w roz-
tworze buforowym o warto œci 7 pH. Nie
nale¿y instrumentu zanurzaæ wiêcej ni¿ to jest
konieczne. Postêpujemy tak jak na ilustracji
HYD-P-3.
5. Delikatnie mieszamy elektrod ¹ w roz-
tworze, czekaj¹c na ustabilizowanie siê wyni-
ku. Je¿eli wynik si ê ustabilizuje, naciskamy
przycisk HOLD/CON w celu potwierdzenia
tej warto œci i zako ñczeniu kalibrowania.
Zanurzona w roztworze elektroda powinna
wskazywaæ w okienku wartoœæ równ¹ pH roz-
tworu buforowego, tzn. 4, 7 lub 10.
6. Wyci¹gamy instrument z roztworu, elek-
t r o d ê p r z e m y w a m y w o d ¹ d e s t y l o w a n ¹ i
wycieramy miêkk¹ œciereczk¹.
7. Czynnoœci opisane w punktach od 3 do 6
powtarzamy dla ka¿dego roztworu buforowe-
go, tzn. dla wartoœci 4, 7 oraz 10.
Source: Jan Smolík, 1996, TEREZA, Association for Environmental Education, Czech Republic

GLOBE™
Protokó³y-22
Hydrologia
Ilustracja HYD-P-3:
8. Po zako ñczeniu sprawdzania instrument
wyci¹gamy i k³adziemy na miêkkim papiero-
wym rêczniku. Urz¹dzenie wy³¹czamy nacis-
kaj¹c przycisk ON/OFF.
9. Roztwór buforowy przelewamy do opisanej
butelki, któr¹ szczelnie zamykamy.
Etap 3: Powtórne sprawdzanie wskaŸnika pH
lub pehametru w terenie
1. Na miejsce bada ñ zabieramy butelk ê z
roztworami buforowymi. Traktujemy je jako
próbki badanej wody. Sprawdzamy odczyn
poszczególnych roztworów buforowych, po
czym wyniki zapisujemy. Je ¿eli wyniki od-
czytów r ó¿ni¹ si ê o wi êcej ni ¿ + albo – 0,2
jednostki pH, od warto œci poszczeg ólnych
roztworów buforowych, procedurê kalibrowa-
nia przeprowadzamy jeszcze raz.
2. Po sprawdzeniu instrumentów, tzn. wskaŸ-
nika pH i pehametru, przyst êpujemy do
w³aœciwych badañ próbki wody.
Procedura pomiaru odczynu
1. Przemywamy elektrodê i s¹siaduj¹ce z ni¹
m i e j s c a w o d ¹ d e s t y l o w a n ¹ . W t y m c e l u
pos³ugujemy siê plastikow¹ butelk¹ zawie-
raj¹c¹ koñcówkê umo¿liwiaj¹c¹ spryskiwanie
elektrody. Op³ukane miejsca wycieramy do
sucha miêkk¹ œciereczk¹ lub ligninow¹ chus-
teczk¹.
2. Czyst¹, such¹ zlewkê o pojemnoœci 100 ml
nape³niamy próbk¹ wody przeznaczonej do
badañ w iloœci 50 ml.
3. Elektrodê zanurzamy w wodzie. Nale¿y siê
upewniæ, czy ca ³a elektroda jest zanurzona.
N i e z a n u r z a m y j e j g ³ ê b i e j n i ¿ t o j e s t
konieczne.
4. Delikatnie mieszamy wod ê do momentu
ustabilizowania siê wyniku.
5. Je¿eli wyœwietlana w okienku wartoœæ stabi-
lizuje siê, dokonujemy odczytu i wynik zapisu-
jemy w Arkuszu obserwacji.
6. Czynnoœci opisane w punktach od 1 do 5
powtarzamy w celu kontroli wynik ów z na-
stêpn¹ pr óbk¹ wody. Uzyskane wyniki nie
powinny siê ró¿niæ od siebie o wi êcej ni¿ 0,2
jednostki.
7. Ponownie przemywamy elektrodê destylo-
wan¹ wod¹, wycieramy do sucha, zak ³adamy
nakrêtkê i wy³¹czamy instrument.
8. Z wyników uzyskanych przez poszczególne
grupy uczni ów wyliczamy warto œæ œredni¹.
Je¿eli wszystkie wyniki poszczeg ólnych grup
nie ró¿ni¹ siê od wyliczonej wartoœci œredniej
o wiêcej ni¿ 0.2 jednostki, t ê wyliczon¹ war-
t o œ æ œ r e d n i ¹ p r z e k a z u j e m y d o S e r w e r a
Danych Uczniowskich. Je ¿eli tylko jeden
wynik zdecydowanie r ó¿ni si ê od œredniej,
odrzucamy go i wyliczamy kolejn ¹ warto œæ
œredni¹ z pozosta ³ych wyników. Je¿eli teraz
wszystkie wyniki nie r ó¿ni¹ siê o wi êcej ni¿
0,2 jednostki od nowej warto œci œredniej, tê
wartoœæ œredniej przekazujemy do Serwera
Danych Uczniowskich. W sytuacji, gdy wyniki
s¹ bardzo rozproszone, staramy si ê z ucznia-
mi przedyskutowaæ ten problem i odnale Ÿæ
przyczyny b³êdów – uzyskanych wyników nie
przekazujemy do serwera. Mo¿emy ca³a pro-
cedurê opisan¹ w protokole powt órzyæ raz
j e s z c z e w c e l u o t r z y m a n i a w y n i k ó w
spe³niaj¹cych kryteria wymagane przy ich
przekazywaniu do serwera.
Uwaga: Wyniki uzyskane w wyniku bada ñ
prowadzonych z wykorzystaniem wska Ÿnika
pH lub pehametru mog¹ byæ ma³o rzetelne w
sytuacji gdy badana woda charakteryzuje si ê
przewodnictwem elektrycznym mniejszym ni¿
100 mikroSiemensów/cm (wskaŸniki pH oraz
pehametry nie funkcjonuj¹ w³aœciwie przy tak
niskim przewodnictwie elektrycznym). Proszê
zapoznaæ si ê z protoko ³em przewodnictwo
elektryczne.
Protokó³:
przewodnictwo elektryczne
Zadanie
Pomiar przewodnictwa elektrycznego wody
w miejscu badañ hydrologicznych
Znaczenie
Przewodnictwo elektryczne jest miar¹ iloœci
rozpuszczonych w wodzie substancji sta³ych
Czas
5 minut
Poziom nauczania
Wszystkie
Czêstotliwoœæ
Raz w tygodniu, z uwzglêdnieniem kalibracji
G³ówne pojêcia
Przewodnictwo elektryczne i czynniki
wp³ywaj¹ce na jego wielkoœæ
Standaryzacja, kalibrowanie
Dok³adnoœæ, rzetelnoœæ
Umiejêtnoœci
Pos³ugiwanie siê konduktometrem
Zapisywanie danych
Œrodki dydaktyczne
Przyrz¹d do pomiaru zawartoœci substancji
sta³ych rozpuszczonych w wodzie lub
konduktometr
Roztwór wzorcowy
Woda destylowana
Plastikowa butelka ze spryskiwaczem
Miêkkie œciereczki
Trzy zlewki o pojemnoœci 50 lub 100 ml
Œrubokrêt jubilerski (do kalibracji)
Przygotowanie
Postêpujemy zgodnie z procedur¹ opisan¹
poni¿ej. Materia³y i narzêdzia zabieramy na
miejsce badañ
Uwarunkowania
¯adne
Uwaga: Ten pomiar dotyczy wy³¹cznie
s³odkich wód œródl¹dowych. W przypadku
wód s³onych i s³onawych, zamiast tego
pomiaru badamy zasolenie
GLOBE™
Protokó³y-23
Hydrologia
Przewodnictwo elektryczne
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Wprowadzenie
Jednostk¹ okreœlaj¹c¹ wielkoœæ przewodni-
ctwa elektrycznego w wodzie jest mikroSie-
mens/cm.
Przewodnictwo elektryczne próbki wody jest
miar¹ jej zdolnoœci do przewodzenia pr ¹du.
Im wiêcej zanieczyszczeñ w wodzie (rozpu-
szczonych substancji sta ³ych) tym wi êksze
przewodnictwo elektryczne. Mierz¹ przewod-
nictwo elektryczne pr óbki wody mo ¿emy
okreœliæ ca³kowit¹ iloœæ rozpuszczonych sub-
stancji. Aby przekszta ³ciæ wyniki pomiaru
przewodnictwa okreœlone w mikroSiemen-
sach/cm w miarê koncentracji rozpuszczonych
substancji sta³ych (wyra¿anych w ppm), wynik
pomiaru przewodnictwa nale ¿y pomno ¿yæ
przez wspó³czynnik o warto œci zawieraj¹cej
siê w przedziale mi êdzy 0,54 a 0,96, dla w ód
naturalnych. Wielkoœæ tego wsp ó³czynnika
zale¿y od rodzaju rozpuszczonych w wodzie
substancji sta ³ych. Powszechnie u ¿ywa si ê
wspó³czynnika o warto œci 0,67, w sytuacji
je¿eli nie okreœlamy rodzaju rozpuszczonych
substancji. TDS (ppm) = przewodnictwo
(mikroSiemensy/cm) x 0,67
Kalibrowanie
Kalibrowania konduktometru nale¿y dokony-
waæ przed ka ¿d¹ sesj ¹ pomiarow ¹. Bez-
poœrednio przed u¿yciem oraz co ka¿de szeœæ
miesiêcy nale¿y sprawdziæ dzia³anie funkcji
okreœlaj¹cej wp³yw temperatury na warto œæ
pomiaru. Kalibrowanie z zastosowaniem
wzorca nale¿y przeprowadzaæ raz w roku.

GLOBE™
Protokó³y-24
Hydrologia
Ilustracja HYD-P-4:
Kalibrowanie
1. Wzorcowy roztwór do kalibrowania powi-
nien byæ szczelnie zamkniêty i przechowywa-
ny w lod ówce. Na etykiecie butelki zawie-
raj¹cej roztwór powinna znajdowaæ siê infor-
macja o dacie produkcji i sprzeda¿y roztworu.
2. Z konduktometru zdejmujemy nakrêtkê.
3. Obok siebie ustawiamy dwie suche, czyste
zlewki o pojemno œci 100 ml. Nape ³niamy je
roztworem wzorcowym do wysokoœci umo¿li-
wiaj¹cej zanurzenie elektrody konduktome-
tru. Uwaga: w handlu dostêpne s¹ mo¿liwe do
zaakceptowania inne roztwory wzorcowe.
N a l e ¿ y z n i m i p o s t ê p o w a æ z g o d n i e z
instrukcj¹ producenta.
4 . W c i s k a j ¹ c g u z i k z n a p i s e m O N / O F F
w³¹czamy konduktometr.
5. Elektrodê sp³ukujemy wod¹ destylowan¹ z
butelki ze spryskiwaczem. Nie nale¿y spryski-
waæ konduktometru powy¿ej br¹zowej linii.
Elektrodê suszymy delikatnym, mi êkkim
materia³em.
6. Zanurzamy elektrod ê na jedn ¹ – dwie
sekundy w pierwszej zlewce zawieraj ¹cej
roztwór wzorcowy. Wyjmujemy przyrz¹d i bez
sp³ukiwania zanurzamy go w drugiej zlewce z
roztworem wzorcowym – tak jak na rycinie
HYD-P-4.
7. Delikatnie mieszamy roztwór konduktome-
trem do momentu ustabilizowania siê zapisu
w okienku.
8. Je ¿eli warto œæ odczytana w okienku nie
zgadza siê parametrami roztworu wzorcowe-
go, nale¿y instrument dostosowaæ do wartoœci
tych parametrów. Przy pomocy ma ³ego œru-
bokrêta przekrêcamy œrubkê na tylnej œciance
konduktometra w celu dopasowania poja-
wiaj¹cego siê tam zapisu do wartoœci standar-
d o w e j r o z t w o r u w z o r c o w e g o . U w a g a :
niektóre konduktometry maj ¹ inne systemy
kalibrowania.
9. U ¿yty w procesie kalibrowania roztw ór
wzorcowy wylewamy. Nie wolno przelewaæ go
z powrotem do butelki.
10. Elektrodê sp³ukujemy wod¹ destylowan¹ i
suszymy. Przemywamy równie¿ zlewki.
11. Naciskamy na guzik ON/OFF w celu
wy³¹czenia urz¹dzenia.
Sprawdzanie wp³ywu temperatury
Temperatura próbki wody wywiera wp³yw na
p o m i a r p r z e w o d n i c t w a e l e k t r y c z n e g o .
Przyrz¹d powinien byæ odpowiednio dostoso-
wany do tego aby pokazywa æ przewodnictwo
w³aœciwe dla temperatury 25oC.
Pomiaru przewodnictwa w roztworze wzorco-
wym dokonujemy w temperaturze 5,15, 25
i 35oC. Je¿eli wielkoœæ odczytu ró¿ni siê dla
tych temperatur o wi êcej ni ¿ 40 mikroSie-
mensów/cm od warto œci charakterystycznej
dla 25oC, kontaktujemy si ê z producentem
instrumentu.
Kontrola jakoœci w terenie
Bez wzglêdu na to, czy instrument kalibruje-
my w klasie czy te ¿ w terenie, po zbadaniu
próbki wody sprawdzamy funkcjonowanie
instrumentu za pomoc¹ roztworu wzorcowe-
go. Je¿eli wynik badania roztworu wzorcowe-
go jest zgodny z jego parametrami, akceptuje-
my wyniki pomiaru pr óbki wody. Je ¿eli nie,
powtórnie kalibrujemy konduktometr i bada-
nie wody przeprowadzamy powtórnie.

GLOBE™
Protokó³y-25
Hydrologia
Przewodnictwo elektryczne
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Jak mierzyæ przewodnictwo
1. Zdj¹æ nakrêtkê z instrumentu i nacisn ¹æ
guzik ON/OFF w celu jego w³¹czenia.
2. Przemy æ elektrod ê wod ¹ destylowan ¹
i wysuszyæ miêkim materia³em.
3. Nape ³niæ czyst ¹, such ¹ 100 ml zlewk ê
badan¹ wod¹.
4. Zanurzyæ elektrodê w wodzie, tak jak na
rycinie HYD-P-4.
5. Delikatnie mieszaæ woe w celu ustabilizo-
wania siê wyniku.
6. Odczytaæ w okienku wartoœæ odczytu i zapi-
saæ w Arkuszu obserwacji
7. Obliczyæ wartoœæ œredni¹ wyników uzyska-
nych przez ró¿ne grupy uczniów.
8 . J e ¿ e l i r ó ¿ n i c e m i ê d z y w y n i k a m i p o -
szczególnych grup a wartoœci¹ œredni¹ nie s¹
wiêksze ni¿ 40 mikroSiemens ów/cm, wynik
ten przekazujemy do Serwera Danych Ucz-
niowskich. Je¿eli w badaniach bierze udzia ³
wiêcej ni¿ trzy grupy uczniów, a wyniki jednej
z nich r ó¿ni¹ siê zdecydowanie od œredniej,
odrzucamy je i warto œæ œredni¹ obliczamy z
pozosta³ych. Je¿eli w tej sytuacji wszystkie
wyniki nie r ó¿ni¹ siê wiêcej ni¿ o 40 mikro-
Siemensów/cm od wartoœci œredniej, przeka-
zujemy j¹ do Serwera Danych Uczniowskich.
W przypadku pojawienia siê wyników bardzo
zró¿nicowanych, inicjujemy dyskusjê z ucznia-
mi maj¹c¹ na celu zidentyfikowanie b ³êdów,
przy czym wyników nie przekazujemy do Ser-
wera Danych Uczniowskich. Powtarzamy
czynnoœci opisane w protokole w celu uzyska-
nia danych spe³niaj¹cych kryteria.

Protokó³: zasolenie
Zadanie
Zmierzyæ zasolenie próbki wody metod¹
areometryczn¹
Znaczenie
Zasolenie wody w danym zbiorniku wodnym
jest jednym z podstawowych czynników
okreœlaj¹cych wp³ywaj¹cych na sk³ad
gatunkowy organizmów które mo¿na tam
¿yj¹. Gêstoœæ wody jest œciœle zwi¹zana z
iloœci¹ soli w niej rozpuszczonej. Przyrz¹dem
do pomiaru gêstoœci jest areometr. Zasolenie
wody zale¿y od jej gêstoœci i temperatury
Czas
Nie przekracza 10 minut
Poziom nauczania
Wszystkie
Czêstotliwoœæ
Raz w tygodniu
G³ówne pojêcia
Przyp³ywy i odp³ywy morza
Metody pomiaru zasolenia z wykorzystaniem
gêstoœci wody
Gêstoœæ
Zasolenie wód
Standaryzacja
RzetelnoϾ pomiaru
Dok³adnoœæ
Umiejêtnoœci
Pos³ugiwanie siê areometrem i termometrem
Odczytywanie danych z tabeli modyfikuj¹cej
wyniki
Wyznaczanie strategii pomiaru
Zapisywanie danych
Interpretowanie wyników
Œrodki dydaktyczne
Aerometr
Tabela z modyfikacj¹ wyników
Plastikowy, przezroczysty, wyskalowany
cylinder o pojemnoœci 500 ml
Termometr alkoholowy
Sól kuchenna (NaCl)
Woda destylowana
Waga
2 jednolitrowe butelki plastikowe
Taœma samoprzylepna
Przygotowanie
Nale¿y postêpowaæ zgodnie z procedur¹
kalibracji opisan¹ po¿ej. Wszystkie materia³y
i narzêdzia nalezy przynieœæ na miejsce
prowadzenia badañ hydrologicznych.
Uwarunkowania
Przeprowadzenie krótkiej dyskusji na temat
zasolenia i jego zwi¹zku z gêstoœci¹ cieczy.
nabywanie praktycznych umiejêtnoœci w
trakcie kalibrowania instrumentów.
Uwaga: te pomiary s¹ przeznaczone wy³¹cznie
dla wód s³onych i s³onawych. Dla wód
s³odkich ich odpowiednikiem jest badanie
przewodnictwa elektrycznego.
GLOBE™
Protokó³y-26
Hydrologia
Kalibrowanie i kontrola jakoœci
Standaryzacjê przyrz¹dów nale¿y przeprowa-
dzaæ co najmniej dwa razy do roku. Roztw ór
do standaryzacji zachowuje trwa ³oœæ przez
jeden rok.
Standard zasolenia
Standardowy roztw ór zasolenie nie jest
do³¹czny do areometru i nale ¿y go wykonaæ
zgodnie z poni¿sz¹ instrukcj¹:
1. Do wody dodajemy soli kuchennej w celu
otrzymania roztworu o zasoleniu 35 ppt
(promile). W celu sprawdzenia rzetelno œci
areometru u¿ywamy równie¿ roztworu kon-
trolnego.
Standard 35 ppt
1.1.Na wadze analitycznej odmierzamy 17,5 g
NaCl (soli kuchennej) i wsypujemy j ¹ do
menzurki o pojemnoœci 500 ml.

GLOBE™
Protokó³y-27
Hydrologia
Zasolenie
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
1.2. Menzurkê nape³niamy wod¹ destylowan¹
do linii oznaczaj¹cej 500 ml.
1.3. Ostro¿nie mieszamy do momentu roz-
puszczenia siê soli.
1.4. Roztw ór przelewamy do plastikowej
butelki o pojemno œci 1 litra, naklejamy na
niej taœmê z informacj¹ o dacie jego wykona-
nia.
Roztwór kontrolny
1. Odmierzamy 500 ml wody destylowanej
i przelewamy j ¹ do 1 litrowej plastikowej
butelki, na której naklejamy taœmê.
2. Zgodnie z zaleceniami protoko ³u, mierzy-
my zasolenie roztworu standardowego i kon-
trolnego.
3. Wyniki pomiar ów zapisujemy w Arkuszu
Danych Roboczych Kalibracji.
4. Je¿eli roztwór kontrolny nie wyka ¿e war-
toœci zero, przemywamy naczynia co najmniej
trzykrotnie i powtarzamy procedur ê. Je¿eli
równie¿ teraz nie otrzymamy wyniku zero,
korzystamy z innego Ÿród³a wody destylowa-
nej.
5. Je ¿eli roztw ór standardowy r ó¿ni si ê o
wiêcej ni¿ 2 ppt, przygotowujemy inny, nowy
roztwór i powtarzamy pomiar.
Jak mierzyæ zasolenie
Uwaga: Przed u ¿yciem termometru, nale ¿y
sprawdziæ jego rzetelno œæ zgodnie z proce-
dur¹ opisan¹ w Protokole temperatury maksy-
malnej, minimalnej i bie ¿¹cej w Badaniach
Atmosfery.
1. Plastikow¹ menzurkê o pojemnoœci 500 ml
co najmniej dwukrotnie przemywamy wod ¹
przeznaczon¹ do badañ.
2. Menzurkê nape³niamy próbk¹ wody przez-
naczonej do badañ do wysokoœci 2 – 3 cm od
szczytu naczynia.
3. Mierzymy temperaturê postêpuj¹c zgodnie
z zaleceniami Protoko³u Temperatury Wody
i uzyskany wynik zapisujemy w Arkuszu obser-
wacji.
4. Postêpuj¹c zgodnie z instrukcj¹ producenta
instrumentu, do wody w menzurce wk³adamy
areometr. Nie mo ¿e on dotyka æ œcian men-
zurki. Odczutu dokonujemy bior¹c pod uwa-
gê dno menisku.Gêstoœæ odczytujemy na skali
areometru, z dok³adnoœci¹ trzech miejsc po
przecinku. Uczniowie starsi mog¹ dokonywaæ
odczytu z dok ³adnoœci¹ czterech miejsc po
przecinku, co umo ¿liwi im interpolacj ê
danych na podstawie tabeli HYD-P-3. Wyni-
ki zapisujemy w Arkuszu obserwacji bada ñ
hydrologicznych. Zobacz rycinê HYD-P-5.
5. Na podstawie tabeli HYD-P-3 zawieraj¹cej
temperaturê oraz gêstoœæ wody, odczytujemy
zasolenie próbki wody. Uzyskany wynik zapi-
sujemy w Arkuszu Danych Roboczych Badañ
Hydrologicznych. Na przyk³ad, woda o tem-
peratyrze 22 oC oraz o g êstoœci 1,0070 ma
zasolenie 10,6 ppt.
6. Czynnoœci opisane w punktach 2 – 6 pow-
tarzamy co najmniej dwukrotnie wykorzys-
tuj¹c nastêpne próbki wody. Mog ¹ to robi æ
inne grupy uczniów.
7. Obliczamy œredni¹ wartoœæ z wykonanych
pomiarów. Je¿eli ró¿nice miêdzy wartoœciami
poszczególnych badañ a wartoœci¹ œredni¹ nie
przekraczaj¹ 2 ppt, przyst êpujemy do etapu
opisanego w punkcie 8. Je ¿eli tak nie jest,
uczniowie wykonuj ¹ nast êpne pomiary z
wykorzystaniem nowych próbek wody, zapi-
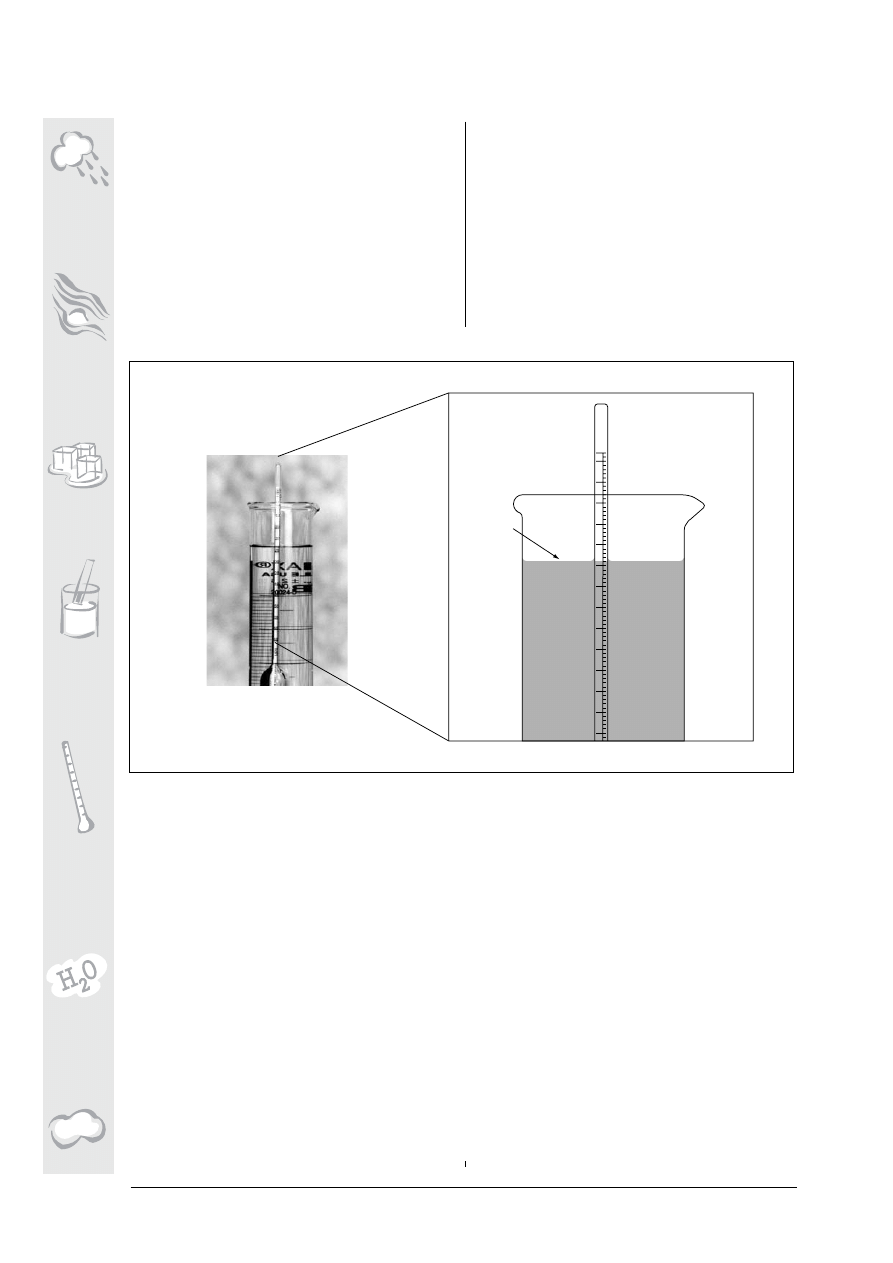
GLOBE™
Protokó³y-28
Hydrologia
suj¹ wyniki i obliczaj¹ wartoœæ œredni¹. Je¿eli
jeden z wynik ów ró¿ni siê zdecydowanie od
innych, odrzucamy go i wyliczamy warto Ͼ
œredni¹ z pozosta³ych. Je¿eli wyniki nie ró¿ni¹
siê o wi êcej ni ¿ o 2 ppt, przyst êpujemy do
punktu 8. Je¿eli jednak wyniki ró¿ni¹ siê zde-
cydowanie, omawiamy ten problem z ucznia-
mi i w miarê mo¿liwoœci powtarzamy badania.
8. Do Serwera Danych Uczniowskich przeka-
zujemy informacjê o temperaturze, g êstoœci
i zasoleniu wody, korzystaj¹c z danych tej gru-
py uczniów, których wynik by³ najbli¿szy war-
toœci œredniej. Je ¿eli by ³y tylko dwie grupy
badawcze, przekazujemy oba wyniki.
Rysunek HYD-P-5: Odczytywanie gestoœci wody
Odczyt na areometrze
wynosi 1.024
Dno menisku
Uwaga: Odzczytu dokonujemy na wysokoœci dna menisku.
00
10
05
10
15
20
25
30
35
40
45
50
55
60
65

Wart. odczytu -2.0
-1.0
0.0
1.0
2.0
3.0
4.0
5.0
6.0
7.0
8.0
9.0 10.0 11.0 12.0 13.0 14.0
0.9980
0.9990
1.0000
1.0010
0.7
0.6
0.6
0.5
0.5
0.2
0.2
0.2
0.2
0.2
0.2
0.5
0.5
0.6
0.6
0.7
0.8
1.0020
2.0
1.9
1.9
1.8
1.6
1.6
1.6
1.5
1.5
1.6
1.6
1.6
1.8
1.9
2.0
2.1
2.3
1.0030
3.3
3.2
3.1
2.9
2.9
2.8
2.8
2.8
2.8
2.8
2.9
2.9
3.1
3.2
3.3
3.4
3.6
1.0040
4.5
4.4
4.2
4.2
4.1
4.1
4.1
4.1
4.1
4.1
4.2
4.2
4.4
4.5
4.6
4.8
4.9
1.0050
5.8
5.7
5.5
5.4
5.4
5.4
5.3
5.3
5.4
5.4
5.4
5.5
5.5
5.7
5.8
5.9
6.2
1.0060
7.0
6.8
6.8
6.7
6.6
6.6
6.6
6.6
6.6
6.7
6.7
6.8
6.8
7.0
7.1
7.2
7.5
1.0070
8.1
8.1
8.0
7.9
7.9
7.9
7.9
7.9
7.9
7.9
8.0
8.1
8.1
8.3
8.4
8.5
8.8
1.0080
9.4
9.3
9.2
9.2
9.2
9.2
9.2
9.2
9.2
9.2
9.3
9.3
9.4
9.6
9.7
9.8 10.0
1.0090
10.6 10.5 10.5 10.4 10.4 10.4 10.4 10.4 10.5 10.5 10.6 10.6 10.7 10.9 11.0 11.1 11.3
1.0100
11.9 11.8 11.7 11.7 11.7 11.7 11.7 11.7 11.7 11.8 11.8 11.9 12.0 12.2 12.3 12.4 12.6
1.0110
13.1 13.0 13.0 12.8 12.8 12.8 12.8 13.0 13.0 13.1 13.1 13.2 13.4 13.5 13.6 13.7 13.9
1.0120
14.3 14.3 14.1 14.1 14.1 14.1 14.1 14.1 14.3 14.3 14.4 14.5 14.7 14.8 14.9 15.0 15.2
1.0130
15.6 15.4 15.4 15.4 15.4 15.4 15.4 15.4 15.4 15.6 15.7 15.8 15.8 16.0 16.2 16.3 16.5
1.0140
16.7 16.7 16.6 16.6 16.6 16.6 16.6 16.7 16.7 16.9 17.0 17.0 17.1 17.3 17.5 17.7 17.8
1.0150
18.0 17.9 17.9 17.9 17.9 17.9 17.9 17.9 18.0 18.0 18.2 18.3 18.4 18.6 18.8 19.0 19.1
1.0160
19.2 19.2 19.1 19.1 19.1 19.1 19.2 19.2 19.3 19.3 19.5 19.6 19.7 19.9 20.1 20.3 20.4
1.0170
20.4 20.4 20.4 20.4 20.4 20.4 20.4 20.5 20.5 20.6 20.8 20.9 21.0 21.2 21.3 21.6 21.7
1.0180
21.7 21.7 21.7 21.6 21.6 21.7 21.7 21.7 21.8 22.0 22.1 22.2 22.3 22.5 22.6 22.9 23.0
1.0190
22.9 22.9 22.9 22.9 22.9 22.9 23.0 23.0 23.1 23.3 23.4 23.5 23.6 23.8 23.9 24.2 24.3
1.0200
24.2 24.2 24.2 24.0 24.2 24.2 24.2 24.3 24.3 24.4 24.6 24.7 24.8 25.1 25.2 25.5 25.6
1.0210
25.3 25.3 25.3 25.3 25.3 25.5 25.5 25.6 25.6 25.7 25.9 26.0 26.1 26.4 26.5 26.8 26.9
1.0220
26.6 26.6 26.6 26.6 26.6 26.6 26.8 26.8 26.9 27.0 27.2 27.3 27.4 27.7 27.8 28.1 28.2
1.0230
27.8 27.8 27.8 27.8 27.8 27.9 27.9 28.1 28.2 28.3 28.5 28.6 28.7 28.9 29.1 29.4 29.5
1.0240
29.1 29.1 29.1 29.1 29.1 29.1 29.2 29.4 29.5 29.5 29.8 29.9 30.0 30.2 30.4 30.6 30.8
1.0250
30.3 30.3 30.3 30.3 30.4 30.4 30.6 30.6 30.7 30.8 30.9 31.1 31.3 31.5 31.7 31.9 32.1
1.0260
31.6 31.6 31.6 31.6 31.6 31.7 31.7 31.9 32.0 32.1 32.2 32.4 32.6 32.8 33.0 33.2 33.4
1.0270
32.8 32.8 32.8 32.9 32.9 32.9 33.0 33.2 33.3 33.4 33.5 33.7 33.9 34.1 34.3 34.5 34.7
1.0280
33.9 34.1 34.1 34.1 34.1 34.2 34.3 34.5 34.5 34.7 34.8 35.0 35.1 35.4 35.6 35.8 36.0
1.0290
35.2 35.2 35.2 35.4 35.4 35.5 35.5 35.6 35.8 35.9 36.2 36.3 36.4 36.7 36.8 37.1 37.3
1.0300
36.4 36.5 36.5 36.5 36.7 36.7 36.8 36.9 37.1 37.2 37.3 37.6 37.7 38.0 38.1 38.4 38.6
1.0310
37.7 37.7 37.7 37.8 37.8 38.0 38.1 38.2 38.4 38.5 38.6 38.9 39.0 39.3 39.4 39.7 39.9
Tabela HYD-P-3: Zasolenie (w promilach – ppt) jako funkcja gêstoœci i temperatury
Temperatura wody w menzurce (oC)
GLOBE™
Protoko³y-29
Hydrologia
GLOBE™
Protokó³y-30
Hydrologia
Tabela HYD-P-3: Zasolenie (w promilach – ppt) jako funkcja gêstoœci i temperatury cd
Wart. odczytu
15.0 16.0 17.0 18.0 18.5 19.0 19.5 20.0 20.5 21.0 21.5 22.0 22.5 23.0 23.5 24.0 24.5
0.9980
0.9990
0.0
0.1
0.2
0.3
0.5
0.6
0.7
1.0000
0.0
0.2
0.3
0.5
0.6
0.7
0.8
1.0
1.1
1.2
1.4
1.5
1.6
1.8
1.9
2.0
1.0010
1.0
1.2
1.5
1.6
1.8
1.9
2.0
2.1
2.3
2.4
2.5
2.5
2.7
2.8
2.9
3.1
3.2
1.0020
2.4
2.5
2.8
2.9
3.1
3.2
3.3
3.4
3.6
3.7
3.8
4.0
4.1
4.2
4.4
4.6
4.8
1.0030
3.7
3.8
4.1
4.2
4.4
4.5
4.6
4.8
4.9
5.0
5.1
5.3
5.4
5.5
5.8
5.9
6.1
1.0040
5.0
5.1
5.4
5.5
5.7
5.8
5.9
6.1
6.2
6.3
6.4
6.6
6.7
7.0
7.1
7.2
7.4
1.0050
6.3
6.6
6.7
7.0
7.1
7.1
7.2
7.4
7.5
7.6
7.7
7.9
8.1
8.3
8.4
8.5
8.7
1.0060
7.6
7.9
8.0
8.3
8.4
8.5
8.7
8.8
8.9
9.1
9.2
9.3
9.4
9.6
9.7
9.8 10.1
1.0070
8.9
9.2
9.3
9.6
9.7
9.8 10.0 10.1 10.2 10.4 10.5 10.6 10.7 10.9 11.0 11.3 11.4
1.0080
10.2 10.5 10.6 10.9 11.0 11.1 11.3 11.4 11.5 11.7 11.8 11.9 12.0 12.2 12.4 12.6 12.7
1.0090
11.5 11.8 11.9 12.2 12.3 12.4 12.6 12.7 12.8 13.0 13.1 13.2 13.4 13.6 13.7 13.9 14.0
1.0100
12.8 13.1 13.2 13.5 13.6 13.7 13.9 14.0 14.1 14.3 14.4 14.5 14.8 14.9 15.0 15.2 15.3
1.0110
14.1 14.4 14.5 14.8 14.9 15.0 15.2 15.3 15.4 15.6 15.7 16.0 16.1 16.2 16.3 16.5 16.7
1.0120
15.4 15.7 15.8 16.1 16.2 16.3 16.5 16.6 16.7 17.0 17.1 17.3 17.4 17.5 17.7 17.9 18.0
1.0130
16.7 17.0 17.1 17.4 17.5 17.7 17.8 17.9 18.0 18.3 18.4 18.6 18.7 18.8 19.1 19.2 19.3
1.0140
18.0 18.3 18.6 18.7 18.8 19.0 19.1 19.3 19.5 19.6 19.7 19.9 20.0 20.1 20.4 20.5 20.6
1.0150
19.3 19.6 19.9 20.0 20.1 20.4 20.5 20.6 20.8 20.9 21.0 21.2 21.3 21.6 21.7 21.8 22.0
1.0160
20.6 20.9 21.2 21.3 21.4 21.7 21.8 22.0 22.1 22.2 22.3 22.5 22.7 22.9 23.0 23.3 23.4
1.0170
22.0 22.2 22.5 22.7 22.9 23.0 23.1 23.3 23.4 23.5 23.6 23.8 24.0 24.2 24.3 24.6 24.7
1.0180
23.3 23.5 23.8 24.0 24.2 24.3 24.4 24.6 24.7 24.8 24.9 25.2 25.3 25.5 25.6 25.9 26.0
1.0190
24.6 24.8 25.1 25.3 25.5 25.6 25.7 25.9 26.0 26.1 26.4 26.5 26.6 26.8 27.0 27.2 27.3
1.0200
25.9 26.1 26.4 26.6 26.8 26.9 27.0 27.2 27.3 27.4 27.7 27.8 27.9 28.2 28.3 28.5 28.6
1.0210
27.2 27.4 27.7 27.9 28.1 28.2 28.3 28.5 28.6 28.9 29.0 29.1 29.2 29.5 29.6 29.8 30.0
1.0220
28.5 28.7 29.0 29.2 29.4 29.5 29.6 29.8 30.0 30.2 30.3 30.4 30.7 30.8 30.9 31.2 31.3
1.0230
29.8 30.0 30.3 30.6 30.7 30.8 30.9 31.2 31.3 31.5 31.6 31.7 32.0 32.1 32.2 32.5 32.6
1.0240
31.1 31.3 31.6 31.9 32.0 32.1 32.2 32.5 32.6 32.8 32.9 33.2 33.3 33.4 33.7 33.8 33.9
1.0250
32.4 32.6 32.9 33.2 33.3 33.4 33.7 33.8 33.9 34.1 34.2 34.5 34.6 34.7 35.0 35.1 35.2
1.0260
33.7 33.9 34.2 34.5 34.6 34.7 35.0 35.1 35.2 35.4 35.6 35.8 35.9 36.0 36.3 36.4 36.7
1.0270
35.0 35.2 35.5 35.8 35.9 36.2 36.3 36.4 36.5 36.7 36.9 37.1 37.2 37.5 37.6 37.8 38.0
1.0280
36.3 36.5 36.8 37.1 37.2 37.5 37.6 37.7 37.8 38.1 38.2 38.4 38.5 38.8 38.9 39.1 39.3
1.0290
37.6 37.8 38.1 38.4 38.6 38.8 38.9 39.0 39.1 39.4 39.5 39.7 39.9 40.1 40.2 40.5 40.6
1.0300
38.9 39.1 39.4 39.7 39.9 40.1 40.2 40.3 40.6 40.7 40.8 41.0 41.2 41.4 41.6 41.8 41.9
1.0310
40.2 40.5 40.7 41.0 41.2 41.4 41.5 41.8 41.9 42.0 42.1 42.3 42.5
Temperatura wody w menzurce (oC)
Tabela HYD-P-3: Zasolenie (w promilach – ppt) jako funkcja gêstoœci i temperatury cd
Temperatura wody w menzurce (oC)
Wart. odczytu
25.0 25.5 26.0 26.5 27.0 27.5 28.0 28.5 29.0 29.5 30.0 30.5 31.0 31.5 32.0 32.5 33.0
0.9980
0.1
0.2
0.3
0.6
0.7
0.8
1.1
1.2
1.5
1.6
1.9
2.0
2.3
2.4
0.9990
0.8
1.0
1.2
1.4
1.5
1.8
1.9
2.0
2.3
2.4
2.5
2.8
2.9
3.2
3.4
3.6
3.8
1.0000
2.1
2.4
2.5
2.7
2.9
3.1
3.2
3.4
3.6
3.7
4.0
4.1
4.4
4.5
4.8
4.9
5.1
1.0010
3.4
3.6
3.8
4.0
4.2
4.4
4.5
4.8
4.9
5.1
5.1
5.4
5.5
5.8
5.9
6.2
6.4
1.0020
4.9
5.0
5.1
5.4
5.5
5.7
5.9
6.1
6.3
6.4
6.6
6.8
7.0
7.2
7.5
7.6
7.9
1.0030
6.2
6.3
6.6
6.7
6.8
7.1
7.2
7.4
7.6
7.7
8.0
8.1
8.4
8.5
8.8
9.1
9.2
1.0040
7.5
7.7
7.9
8.0
8.3
8.4
8.5
8.8
8.9
9.2
9.3
9.6
9.7 10.0 10.1 10.4 10.5
1.0050
8.9
9.1
9.2
9.3
9.6
9.7 10.0 10.1 10.2 10.5 10.6 10.9 11.0 11.3 11.5 11.7 11.9
1.0060
10.2 10.4 10.5 10.7 10.9 11.0 11.3 11.4 11.7 11.8 12.0 12.2 12.4 12.6 12.8 13.1 13.2
1.0070
11.5 11.7 11.9 12.0 12.2 12.4 12.6 12.8 13.0 13.1 13.4 13.6 13.7 14.0 14.1 14.4 14.7
1.0080
12.8 13.0 13.2 13.4 13.6 13.7 13.9 14.1 14.3 14.5 14.7 14.9 15.2 15.3 15.6 15.7 16.0
1.0090
14.1 14.4 14.5 14.7 14.9 15.0 15.3 15.4 15.7 15.8 16.1 16.2 16.5 16.6 16.9 17.1 17.3
1.0100
15.6 15.7 15.8 16.1 16.2 16.5 16.6 16.7 17.0 17.1 17.4 17.5 17.8 18.0 18.2 18.4 18.7
1.0110
16.9 17.0 17.3 17.4 17.5 17.8 17.9 18.2 18.3 18.6 18.7 19.0 19.1 19.3 19.6 19.7 20.0
1.0120
18.2 18.3 18.6 18.7 19.0 19.1 19.3 19.5 19.6 19.9 20.1 20.3 20.5 20.6 20.9 21.2 21.3
1.0130
19.5 19.7 19.9 20.0 20.3 20.4 20.6 20.8 21.0 21.2 21.4 21.6 21.8 22.1 22.2 22.5 22.7
1.0140
20.9 21.0 21.2 21.4 21.6 21.8 22.0 22.2 22.3 22.6 22.7 23.0 23.1 23.4 23.6 23.8 24.0
1.0150
22.2 22.3 22.5 22.7 22.9 23.1 23.3 23.5 23.6 23.9 24.0 24.3 24.6 24.7 24.9 25.2 25.3
1.0160
23.5 23.6 23.9 24.0 24.3 24.4 24.7 24.8 25.1 25.2 25.5 25.6 25.9 26.1 26.3 26.5 26.8
1.0170
24.8 25.1 25.2 25.3 25.6 25.7 26.0 26.1 26.4 26.5 26.8 27.0 27.2 27.4 27.7 27.8 28.1
1.0180
26.1 26.4 26.5 26.8 26.9 27.2 27.3 27.6 27.7 27.9 28.1 28.3 28.5 28.7 29.0 29.2 29.4
1.0190
27.6 27.7 27.8 28.1 28.2 28.5 28.6 28.9 29.0 29.2 29.5 29.6 29.9 30.0 30.3 30.6 30.8
1.0200
28.9 29.0 29.2 29.4 29.6 29.8 30.0 30.2 30.4 30.6 30.8 30.9 31.2 31.5 31.6 31.9 32.1
1.0210
30.2 30.3 30.6 30.7 30.9 31.1 31.3 31.5 31.7 32.0 32.1 32.4 32.5 32.8 33.0 33.3 33.4
1.0220
31.5 31.7 31.9 32.0 32.2 32.5 32.6 32.9 33.0 33.3 33.4 33.7 33.9 34.1 34.3 34.6 34.8
1.0230
32.8 33.0 33.2 33.4 33.5 33.8 33.9 34.2 34.5 34.6 34.8 35.0 35.2 35.5 35.6 35.9 36.2
1.0240
34.2 34.3 34.5 34.7 35.0 35.1 35.4 35.5 35.8 35.9 36.2 36.4 36.5 36.8 37.1 37.2 37.5
1.0250
35.5 35.6 35.9 36.0 36.3 36.4 36.7 36.8 37.1 37.2 37.5 37.7 37.8 38.1 38.4 38.6 38.8
1.0260
36.8 36.9 37.2 37.3 37.6 37.7 38.0 38.2 38.4 38.6 38.8 39.0 39.3 39.4 39.7 39.9 40.2
1.0270
38.1 38.4 38.5 38.8 38.9 39.1 39.3 39.5 39.8 39.9 40.2 40.3 40.6 40.8 41.0 41.2 41.5
1.0280
39.4 39.7 39.8 40.1 40.2 40.5 40.7 40.8 41.1 41.2 41.5
1.0290
40.8 41.0 41.2 41.4 41.6 41.8
GLOBE™
Protoko³y-31
Hydrologia
Protokó³: zasadowoœæ
Zadanie
Zmierzyæ zasadowoœæ próbki wody
Znaczenie
Od zasadowoœci wody zale¿¹ w du¿ym
stopniu warunki ¿ycia biologicznego w wodzie
Czas
15 minut
Poziom nauczania
Œredni i zaawansowany
Czêstotliwoœæ
Raz w tygodniu
Kalibracja raz na pó³ roku
G³ówne pojêcia
Zasadowoœæ i czynniki naturalne na ni¹
wp³ywaj¹ce
Metody pomiaru zasadowoœci
Standaryzacja
RzetelnoϾ pomiaru, precyzja
Umiejêtnoœci
Przestrzeganie procedury badania
zasadowoœci
Zapisywanie danych
Œrodki dydaktyczne
Zestaw do badañ zasadowoœci
Soda spo¿ywcza (wêglan sodu)
Butelka wody destylowanej
Zlewka o pojemnoœci 500 ml
Menzurka o pojemnoœci 100 ml
Menzurka o pojemnoœci 500 ml
Mieszade³ko
Arkusze danych
Butelka na próbkê wody
Rêkawice gumowe i okulary ochronne
Waga
Przygotowanie
Nale¿y postêpowaæ zgodnie z opisan¹
poni¿ej instrukcj¹ kalibrowania i kontroli
jakoœci. Instrumenty i materia³y zanosimy na
miejsce badañ wody.
Uwarunkowania
Nie ma
GLOBE™
Protokó³y-32
Hydrologia
Kalibrowanie i kontrola jakoœci
Przygotowanie roztworu standardowego
z u¿yciem sody
1. Nale¿y odwa¿yæ 1.9 g sody i wsypa æ j¹ do
menzurki o pojemno œci 500 ml. Nale ¿y si ê
upewniæ czy ca³oœæ substancji znalaz³a siê w
menzurce.
2. Menzurkê nape³niamy wod¹ destylowan¹
do objêtoœci 500 ml.
3 . R o z t w ó r t e n p r z e l e w a m y d o z l e w k i o
pojemnoœci 500 ml., mieszamy do momentu
ca³kowitego rozpuszczenia siê sody.
4. Przelewamy ze zlewki 15 ml roztworu do
menzurki 100 ml.
5. Dok³adnie myjemy destylowan¹ wod¹ men-
zurkê 500 ml. Wlewamy do niej 15 ml roz-
tworu sody.
6. Do menzurki 500 ml wlewamy destylowan¹
wodê do kreski oznaczajacej 500 ml.
7. Ten roztw ór w menzurce 500 ml jest roz-
tworem standardowym.
Rzeczywista zasadowoϾ tego standardowego
roztworu sodowego wynosi 68 mg/l wyra¿ona
jako CaCO3 . Rzeczywista zasadowoϾ wody
destylowanej na og ó³ nie jest wy ¿sza ni¿ 14
mg/l.

GLOBE™
Protokó³y-33
Hydrologia
ZasadowoϾ
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Procedura kontroli jakoœci
1. Protokó³ zasadowoœci wype³niamy korzys-
t a j ¹ c z e s t a n d a r d o w e g o r o z t w o r u s o d y
zamiast z próbki wody.
2. Zasadowo œæ wyra ¿on¹ w postaci mg/l
C a C O 3 zapisujemy w Arkuszu Danych
Roboczych Kalibracji.
Je¿eli roztwór standardowy sody b êdzie siê
ró¿niæ o wi êcej ni ¿ o jednostk ê mg/l lub o
jedn¹ kropl ê w metodzie miareczkowania,
nale¿y przygotowaæ nowy roztwór z zachowa-
niem dok³adnych proporcji. Je ¿eli ta pr óba
siê nie powiedzie, nale¿y zmieniæ odczynniki
w zestawie.
Jak mierzyæ zasadowoœæ
Je¿eli dysponujemy zestawem do badañ zasa-
dowoœci przeznaczonego zarówno do badañ
jej niskich i wysokich wartoœci, rozpoczynamy
badania od wartoœci niskich w celu uzyskania
wiêkszej dok³adnoœci, chyba ¿e próbka wody
wyka¿e zasadowo œæ wi êksz¹ ni ¿ 125 mg/l
CaCO3.
1. Nale¿y u¿ywaæ zestawów do badania zasa-
dowoœci spe ³niaj¹cych warunki Programu
GLOBE. Nale¿y przestrzegaæ instrukcji pro-
ducenta zestawu. Zestawy do bada ñ bazuj¹
na technice dodawania substancji barwi ¹cej
do próbki oraz na póŸniejszym miareczkowa-
niu a¿ do momentu zmiany barwy.
2. Zasadowoœæ wyra¿on¹ w postaci CaCO 3
zapisujemy w Arkuszu obserwacji bada ñ
hydrologicznych.
3. Obliczamy warto œæ œredni¹ pomiar ów
wykonanych przez ró¿ne grupy uczniowskie.
Je¿eli wszystkie wyniki nie ró¿ni¹ siê o wiêcej
ni¿ o jedn¹ jednostkê mg/l lub o jeden stopieñ
w przypadku miareczkowania, têwartoœæ œred-
ni¹ przekazujemy do Serwera Danych Ucz-
niowskich. Je¿eli mamy wiêcej ni¿ trzy grupy
pomiarowe i wyniki jednej z nich r ó¿ni¹ siê
zdecydowanie od innych, odrzucamy je i
obliczamy œredni¹ z pozosta³ych. Je¿eli wyniki
wszystkich uczniowskich grup nie r ó¿ni¹ siê
wiêcej ni¿ o jednostkê od wartoœci œredniej, tê
wartoœæ œredni¹ przekazujemy do Serwera
Danych Uczniowskich. Je ¿eli wyniki po-
szczególnych grup s ¹ bardzo zr ó¿nicowane,
wspólnie z uczniami poszukujemy potencjal-
nych b³êdów w procedurze badawczej, przy
czym wyników nie przekazujemy do serwera.
Badania powtarzamy tak d³ugo, a¿ osi¹gnie-
my wyniki odpowiadaj ¹ce standardom Pro-
gramu GLOBE.
Kalibrowanie i kontrola jakoœci
Standaryzacja powinna byæ przeprowadzana
co szeœæ miesiêcy w celu sprawdzenia techniki
badañ oraz jakoœci u¿ywanych chemikaliów.
Za ka¿dym razem nale¿y przygotowaæ nowy
roztwór standardowy. Ta czynno œæ pomaga
lepiej zapoznaæ siê z zestawem badawczym, w
którym czêsto instrukcje s ³owne nie s ¹ wys-
tarczaj¹co jasne.
Standardowy roztwór azotanowy
Standardowe roztwory azotanowe nie s ¹
sk³adnikiem zestawów badawczych, st¹d te¿
mo¿na je dodatkowo zakupi æ lub wykona æ
zgodnie z poni¿sz¹ instrukcj¹:
· Podstawowy roztwór azotanowy: W piecu, w
temperaturze 105oC przez 24 godziny suszy-
my KNO3 (azotan potasu). Nast êpnie roz-
puszczamy 3,6 g KNO 3 w destylowanej wo-
d z i e , w m e n z u r c e o p o j e m n o œ c i 5 0 0 m l ,
Protokó³: azotany
Zadanie
Zmierzyæ zawartoœæ azotanów w wodzie na
miejscu badañ hydrologicznych
Znaczenie
Pomiar zawartoœci azotanów w wodzie
pozwala oceniæ jej jakoœæ. Azot w wodzie
wystêpuje pod ró¿nymi postaciami –
azotanów i azotynów. Wa¿niejsza jest
obecnoœæ azotanów, gdy¿ stanowi¹ one Ÿród³o
pokarmu dla alg i innych roœlin wodnych.
W wodzie mo¿e pojawiæ siê ich nadmiar,
wywo³any ró¿nymi czynnikami. Bezpoœredni
pomiar azotanów jest bardzo trudny, st¹d te¿
redukujemy je do postaci azotynów i na tej
podstawie obliczamy ich koncentracjê.
W wyniku pomiaru otrzymujemy ³¹czn¹
konncentracjê azotynów (je¿eli s¹ obecne)
oraz azotanów. Wynik podajemy w postaci
azotu azotanowego w mg/l, lub w postaci
azotu azotynowego, równie¿ w mg/l.
Czas
15 minut
Poziom nauczania
Œredni i zaawansowany
Czêstotliwoœæ
Raz w tygodniu
Kalibracja dwa razy w roku
G³ówne pojêcia
Kolorymetryczne metody analizy wody
Azotany w wodzie
Umiejêtnoœci
Wykonywanie analiz kolorymetrycznych
Planowanie strategii badawczych
Zapisywanie danych
Œrodki dydaktyczne
Zlewka o pojemnoœci 50 ml
Zestaw do badañ azotanów
Menzurka o pojemnoœci 100 ml
Menzurka o pojemnoœci 500 ml
Butelka lub pojemnik o pojemnoœci 3,5 l
Woda destylowana
Przygotowanie
Przed rozpoczêciem badañ nale¿y
przeczytaæ dok³adnie instrukcjê producenta
zestawu do badañ. Nale¿y siê upewniæ czy
w zestawie s¹ wszystkie wymienione tam
materia³y. Okreœlamy odpowiedni¹
zawartoœæ azotanów w wodzie (10 mg/l
w wodzie pitnej)
Uwarunkowania
Przeprowadzenie krótkiej dyskusji nad
znaczeniem azotanów w wodzie
Dyskusja na temat ró¿nicy miêdzy azotem
azotanowym a azotanami
Dyskusja na temat ró¿nicy miêdzy
azotanami a azotynami
GLOBE™
Protokó³y-34
Hydrologia

GLOBE™
Protokó³y-35
Hydrologia
Azotany
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
na której naklejamy taœmê z zapisan¹ infor-
macj¹ o dacie jego powstania. Jest to roztwór
7200 mg/l KNO3 ( albo 1000 mg/l azotu azo-
tanowego).
Uwaga: W celu obliczenia azotu azotanowego
(NO3-N) nale ¿y wzi ¹æ pod uwag ê sk ³ad
cz¹steczkowy KNO3 ( stosunek masy jedne-
go mola azotu N do jednego mola KNO 3
wynosi 0,138): 7200 mg/l KNO3 x 0,1382~
1000 mg/l azotu azotanowego.
· Standardowy roztwór azotanowy: Odmierza-
my 50 ml podstawowego roztworu azotano-
wego za pomoc ¹ menzurki o pojemno œci
100ml. Wlewamy go do menzurki 500 ml
i rozpuszczamy wod¹ destylowan¹, do pojem-
noœci 500 ml. Powoli mieszamy. W rezultacie
otrzymujemy roztwór standardowy 100 mg/l
a z o t u a z o t a n o w e g o . P r z e l e w a m y g o d o
pojemnika, naklejamy taœmê z informacj¹ o
dacie jego powstania.
· N o w y p o d s t a w o w y r o z t w ó r a z o t a n o w y
nale¿y przyrz¹dzaæ za ka¿dym razem w trak-
cie kalibrowania (chyba ¿e by³ ustabilizowa-
n y ) . N a t o m i a s t r o z t w ó r s t a n d a r d o w y w
ka¿dym przypadku kalibracji musi byæ zrobio-
ny na nowo. Roztw ór podstawowy mo ¿emy
ustabilizowaæ na okres 6 miesiêcy przy u¿yciu
chloroformu (CHCl 3 ), pod warunkiem ¿e
mamy do niego bezpieczny dost êp. W celu
ustabilizowania roztworu dodajemy 1 ml chlo-
roformu na 500 ml roztworu podstawowego.
Kontrola jakoœci
1. Nasz standardowy roztwór azotu azotano-
wego 100 mg/l rozcieñczamy w celu otrzyma-
nia standardu 2 mg/l. Tego standardu u¿ywa-
my w celu sprawdzenia rzetelnoœci zestawu do
pomiarów. W tym celu nale ¿y odmierzyæ 10
ml standardu 100 mg/l i przelaæ do pojemnika
o objêtoœci 500 ml. W menzurce odmierzamy
490 ml wody destylowanej i dodajemy j ¹ do
pojemnika, na kt órym naklejamy ta œmê z
dat¹. Delikatnie mieszamy.
2 . P o s t ê p u j e m y z g o d n i e z i n s t r u k c j ¹
dotycz¹c¹ pomiaru standardu zawart ¹ w
odpowiednim fragmencie Protoko³u. Je¿eli
jest tam mowa o „próbce wody”, wtedy stosu-
jemy przygotowany przez nas standard.
3. WartoϾ standardu zapisujemy po bada-
niach w Arkuszu obserwacji bada ñ hydrolo-
gicznych.
4. Je¿eli ró¿nica w standardzie jest wi êksza
ni¿ 1 mg/l, przygotowujemy nowy roztw ór i
powtarzamy procedurê. Je¿eli nie uzyskamy
odpowiednich wyników, musimy przygotowaæ
nowy podstawowy roztwór azotanowy.
Jak mierzyæ azot azotanowy
1. Pos³ugujemy siê zestawem do bada ñ azo-
t a n ó w s p e ³ n i a j ¹ c y m k r y t e r i a P r o g r a m u
GLOBE. Pojemniki na pr óbki wody prze-
mywamy co najmniej trzykrotnie wod¹ przez-
naczon¹ do badañ.
2. Azot azotanowy plus azot azotynowy:
Nale¿y postêpowaæ zgodnie z instrukcj¹ pro-
ducenta zestawu. Zestawy wykorzystuj¹ tech-
nikê dodawania substancji chemicznej kt óra
wchodzi w reakcjê z azotanami aby wytworzyæ
azotyny. Z kolei azotyny, poddane dzia ³aniu
innego œrodka zabarwiaj¹ siê. Intensywnoœæ
koloru jest wprost proporcjonalna do zawar-
toœci azotanów w próbce wody. Koncentracjê
okreœla siê na podstawie porównania koloru
wody po dodaniu chemikaliów z wzorcowymi
kolorami bêd¹cymi na wyposa¿eniu zestawu.
Je¿eli instrukcja producenta wymaga aby
próbk¹ wody wstrz ¹sn¹æ, nale¿y to robi æ w
przeci¹gu czasu tam okreslonego. Je¿eli tego
nie uczynimy, otrzymane wyniki b êd¹ obar-
czone b³êdem.
3. Porównywania kolorów dokonuj¹ co najm-
niej trzy grupy uczniowskie. Ka¿da grupa ucz-
niów zapisuje w Arkuszu obserwacji bada ñ
hydrologicznych uzyskany wynik. ( Uwaga:
kolory wzorcowe powinny byæ ogl¹dane w jas-
nym œwietle, przy oknie lub lampie, nie nale¿y
ich jednak wystawiaæ na bezpoœrednie prom-
ieniowanie s³oneczne).
4. Obliczamy wartoœæ œredni¹ trzech wyników.
Je¿eli wszystkie wyniki nie ró¿ni¹ siê o wiêcej
ni¿ o 1 mg/l od warto œci œredniej, zapisujemy
ja w Arkuszu obserwacji bada ñ hydrologicz-
nych. Je¿eli tak nie jest, uczniowie ponownie
porównuj¹ kolory, odczytuj¹ wynik i wyliczaj¹
now¹ œredni¹ (Uwaga: powtórnego odczyta-
nia kolor ów nie mo ¿emy dokonywa æ je ¿eli
=
GLOBE™
Protokó³y-36
Hydrologia
up³ynê³o 5 minut.). Je¿eli w tej nowej sytuacji
wszystkie wyniki nie r ó¿ni¹ siê od œredniej o
wiêcej ni¿ 1 mg/l, tê now¹ œredni¹ zapisujemy
w Arkuszu obserwacji badañ hydrologicznych.
Je¿eli jednak jeden z wynik ów ró¿ni siê zde-
cydowanie od pozosta ³ych, odrzucamy go i
œredni¹ obliczamy z pozosta ³ych. W sytuacji
gdy wyniki s ¹ bardzo rozproszone (r ó¿nice
wiêksze ni¿ 1 mg/l), wspólnie z uczniami szu-
kamy przyczyn potencjalnych b ³êdów, przy
czym wyników nie przekazujemy do serwera.
Czynnoœci przewidziane protoko³em powta-
r z a m y t a k d ³ u g o , a ¿ o s i ¹ g n i e m y w y n i k i
zgodne ze standardami Programu GLOBE.
5. Azot azotynowy: Post êpujemy zgodnie z
instrukcj¹ producenta zestawu do okreœlania
a z o t y n ó w . P r o c e d u r a j e s t t a k a s a m a z
wyj¹tkiem dodawania substancji redukuj¹cej
azotany do azotynów.
6. Powtarzamy czynno œci opisane w punktach
3 i 4 w celu uzyskania wyniku azotynów.
Uwaga: Wyniki podajemy w postaci mg/l
azotu azotanowego (NO 3-N, czyli w takich
samych jednostkach jak nasz standard). Nie
podajemy w postaci mg/l azotanów (NO3
-).
Informacja og ólna: Aby przekszta ³ciæ mg/l
azotanów na mg/l azotu azotanowego, dzieli-
my przez 4,4 . Na przyk³ad: 44 mg/l azotanów
odpowiada 10 mg/l azotu azotanowego. Aby
przekszta³ciæ azotany w mg/l na azot azota-
nowy w mg/l, dzielimy przez 3,3, stosunek ich
masy.
Wprowadzenie
Obiekt wodny bêd¹cy przedmiotem Waszych
badañ jest czêœci¹ jakiegoœ dorzecza (zlewni).
Wyznaczone jest ono przez dzia³ wodny, czyli
liniê na powierzchni terenu rozgraniczaj ¹c¹
s¹siednie dorzecze lub poszczególne zlewnie.
Kszta³t dorzecza uwarunkowany jest topogra-
fi¹ terenu. Teren w obrêbie dorzecza, a tak¿e
sposób u¿ytkowania ziemi – miasta, autostra-
dy, hodowla zwierz¹t, pozyskiwanie drzewa w
lasach, naturalna wegetacja i inne podobne
c z y n n i k i m a j ¹ w p ³ y w n a c h e m i z m w o d y
ka¿dego obiektu wodnego w granicach do-
rzecza.
Wiele czynnik ów mo ¿e wp ³ywaæ na cechy
wody w jeziorach, stawach czy systemach
rzecznych. Do tych cech nale¿¹: temperatura,
kolor, kszta³t zbiornika itp. W protoko ³ach
bêdziemy gromadziæ dane odnosz¹ce siê do
jakoœci wody, korzystaj¹c z pomiarów takich
parametrów jak rozpuszczony tlen, pH, zasa-
dowoϾ i przewodnictwo elektryczne. Doko-
nywane obserwacje w terenie pomog ¹ ucz-
n i o m f o r m u ³ o w a æ w n i o s k i n a t e m a t
Zadanie
Zapoznanie siê z hydrologi¹ najbli¿szej
okolicy
Znaczenie
Uczniowie udadz¹ siê na miejsce sta³ych
badañ hydrologicznych, przeprowadz¹
powierzchown¹ obserwacjê sposobu
u¿ytkowania ziemi w okolicy i oceni¹ jakoœæ
wód. Na tej podstawie wykonaj¹ mapê oraz
szkic terenu zawieraj¹ce zebrane informacje.
To wstêpne badanie s³u¿yæ bêdzie stawianiu
pytañ dotycz¹cych sposobów u¿ytkowania
ziemi w okolicy oraz zagadnieñ chemizmu
wód, których zbadanie bêdzie konieczne w
przysz³oœci.
Czas
Czas dojœcia na miejsce plus jedna jednostka
lekcyjna
Poziom nauczania
Wszystkie
G³ówne pojêcia
Wody powierzchniowe wystêpuj¹ w postaci
jezior, stawów, rzek i pokrywy œnie¿nej.
Cechy wód zale¿¹ w du¿ym stopniu od cech
otaczaj¹cego ich l¹du.
Woda wêdruje z jednego miejsca w inne.
Wody powierzchniowe charakteryzuj¹ siê
pewnymi ³atwo obserwowalnymi cechami,
takimi jak kolor, zapach, przep³yw, kszta³t.
Umiejêtnoœci
Obserwowanie wody w miejscu sta³ych badañ
Opisywanie wody w miejscu sta³ych badañ
Organizowanie obserwacji
Formu³owanie pytañ bazuj¹cych na
obserwacjach
Identyfikowanie wspó³zale¿noœci miêdzy
cechami wody a cechami przyleg³ego terenu
Komunikowanie wyników wstêpnych
obserwacji w postaci werbalnej, pisemnej i
graficznej
Rysowanie mapy obszaru miejsca sta³ych
badañ
Œrodki dydaktyczne
Materia³y piœmienne do sporz¹dzania map i
rysunków
Aparat fotograficzny lub kamera video
Kompas oraz przyrz¹d do mierzenia
odleg³oœci
Przezroczyste kubki lub butelki do
obserwacji zmêtnienia i koloru wody
Przygotowanie
Pozyskanie map topograficznych lub zdjêæ
lotniczych miejsca sta³ych badañ
Uwarunkowania
Nie ma
GLOBE™
Dzia³ania poznawcze uczniów-2
Hydrologia
Spacer nad wod¹
!
?

zale¿noœci cech wody z cechami otaczaj¹cego
j¹ l¹du. Ta dzia³alnoœæ jest wstêpem do poz-
nania miejsca sta³ych obserwacji hydrologicz-
nych, planowanym tam dzia ³aniom poznaw-
czym oraz przygotowaniem do wype ³niania
protoko³ów.
Co robiæ i jak to robiæ
1. SprawdŸ wiedzê swoich uczniów na temat
obiektów wodnych w najbli ¿szej okolicy.
Zacznij od takich pytañ jak np.:
Czy widzia³eœ jezioro, staw, rzek ê lub stru-
myk?
Czy ten obiekt wodny ma jakie œ znaczenie
dla ciebie? Dlaczego?
2. Zabierz uczniów do miejsca sta³ych badañ
hydrologicznych. Pamiêtaj o bezpieczeñstwie.
Na ni¿szych etapach kszta³cenia:
3. Celem jest zorganizowanie uczniom space-
ru po okolicy miejsca badañ, w trakcie które-
go bêd¹ mieli mo¿liwoœæ prowadzenia obser-
w a c j i i s t a w i a n i a p y t a ñ n a t e m a t w ó d
powierzchniowych najbli¿szej okolicy, takich
jak p ³yn¹cych rzek i strumieni, obecno œci
stawów i jezior, Ÿróde³, wilgoci glebowej
i miejsc nape ³nionych wod ¹ po opadach
deszczu. Zachêcamy uczniów do zwracania
uwagi na wszystkie formy wystêpowania wód
powierzchniowych. Nale ¿y zabra æ ze sob ¹
pojemniki, w kt órych uczniowie b êd¹ gro-
madziæ pr óbki wody. Obserwacje powinny
koncentrowaæ siê na takich cechach jak kolor
wody, obiektach znajduj¹cych siê w niej, ruch
wody i jego prêdkoœæ, czy s³ychaæ szum powo-
li p³yn¹cej wody, zapach, przezroczysto œæ i
mêtnoœæ i in.
4. Uczniowie wykonuj ¹ szkic miejsca oraz
notatki opisuj ¹ce wygl ¹d miejsca sta ³ych
badañ hydrologicznych, z uwzgl êdnieniem
t a k i c h c e c h j a k w y s t ê p o w a n i e d r z e w ,
pagórków itp. Pytamy równie¿ uczniów o to,
sk¹d pochodzi woda w tym zbiorniku.
Na wy ¿szych etapach kszta³cenia
3.Wyznaczone zespo ³y uczni ów prowadz ¹
rozpoznanie wyodrêbnionych sektorów przy-
legaj¹cych do miejsca sta³ych badañ. W sk³ad
zespo³u wchodzi dziennikarz, kartograf,
rysownik i fotograf. Celem ich dzia ³añ jest
sporz¹dzenie dokumentacji przydzielonego
im sektora, obejmuj ¹cej wygl ¹d, zapach i
pochodzenie wody. Nale¿y scharakteryzowaæ
przylegaj¹cy teren – czy jest to zabudowa
miejska lub przemys ³owa, pola uprawne,
osiedla, las lub mokrad ³a itp. Uczniowie
powinni sporz¹dziæ kartograficzny szkic tere-
nu w swoim sektorze, z zaznaczeniem miejsc
o roœlinnoœci naturalnej. Nale¿y tak¿e opisaæ
ukszta³towanie powierzchni, z uwzgl êdnie-
niem nachylenia zboczy przylegaj ¹cych do
zbiornika wody.
4. Po powrocie do klasy, uczniowie powinni
sporz¹dziæ ogóln¹ mapê terenu, korzystaj¹c z
wycinkowych map sektorowych. Staraj ¹ siê
doszukaæ podobie ñstw i r ó¿nic oraz pra-
wid³owoœci. Korzystaj¹c z wyników obserwa-
cji, szukamy odpowiedzi na takie pytania jak
np. w jaki spos ób woda dosta ³a siê do tego
miejsca, dok¹d wyp³ywa, w jaki spos ób ota-
c z a j ¹ c y t e r e n w p ³ y w a n a j a k o œ æ w o d y ,
szczególnie w czasie opad ów deszczu, roz-
topów, powodzi itp. Wyniki zapisujemy na
posterze zawieszonym na œcianie klasy.
5. Na zakoñczenie prosimy uczniów o przedy-
skutowanie nastêpuj¹cych kwestii:
Jak¹ dzia³alnoœæ zwi¹zan¹ z u ¿ytkowaniem
ziemi zaobserwowali i odnotowali? W jaki
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
GLOBE™
Dzia³ania poznawcze uczniów-3
Hydrologia
Spacer nad wod¹
sposób ta dzia³alnoœæ mo¿e wp³yn¹æ na cechy
wody w zbiorniku?
Czy ta dzia³alnoœæ ma wp³yw na jakoœæ wody?
Czy napotkano przypadki korzystania przez
ludzi z wody?
Dalsze badania
1. W czasie odwiedzin miejsca sta³ych badañ,
raz w miesi¹cu uczniowie w swoim notatniku
opisuj¹ dostrze¿one tam zmiany.
2. Jakoœæ wody i jej ilo œæ jest wa ¿nym zaga-
d n i e n i e m o z a s i ê g u g l o b a l n y m . N a l e ¿ y
sporz¹dziæ pisemn¹ ogóln¹ charakterystykê
miejsca sta ³ych bada ñ, zawieraj ¹c¹ m.in.
wykresy ilustruj¹ce wyniki badañ. Nawi¹zuje-
my kontakt z inn ¹ szko³¹ przekazuj¹c¹ dane
i prosimy o przekazywanie naszej szkole
wykresów graficznych odnosz ¹cych si ê do
c e c h w o d y w i c h m i e j s c u s t a ³ y c h b a d a ñ .
Porównujemy je z naszymi wynikami. Na
nastêpnym etapie, ka ¿da ze szk ó³ przygoto-
wuje pisemny raport o miejscu sta³ych badañ
szko³y partnerskiej, opieraj¹c siê jedynie na
otrzymanych wynikach badañ. Te raporty s ¹
wymieniane miêdzy szko³ami i staj¹ siê pod-
stawa do dyskusji, maj¹cej na celu ustaliæ, w
jakim stopniu uda³o siê odtworzyæ charakte-
rystykê miejsca sta³ych badañ szko³y partner-
skiej na podstawie wynik ów bada ñ. Jakie
cechy mo¿emy, a jakich nie mo ¿emy opisaæ
pos³uguj¹c siê wy³¹cznie zbiorem danych.
Ocena pracy uczniów
Uczniowie przygotowuj¹ wystawê ukazuj¹c¹
to, co poznali badaj ¹c obiekt wodny i jego
najbli¿sze otoczenie, wraz z wp ³ywem ota-
czaj¹cego terenu (pozytywnym i negatyw-
nym) na jakoœæ wody, a tak¿e z zale¿noœciami
œwiata roœlinnego, zwierzêcego i cz³owieka od
jakoœci wody. Wystawa ta powinna by æ udo-
stêpniona wszystkim uczniom w szkole, a
tak¿e mieszkañcom spo³ecznoœci lokalnej.
GLOBE™
Dzia³ania poznawcze uczniów-4
Hydrologia
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
GLOBE™
Dzia³ania poznawcze uczniów-5
Hydrologia
Budujemy model naszego dorzecza
Wprowadzenie
W o d a o p a d o w a o r a z w r a z z e s p ³ y w e m
powierzchniowym (woda, osady i rozpuszczo-
ny materia³) z obszaru ca ³ego dorzecza do-
staj¹ si ê do innego wi êkszego odbiornika,
którym mo¿e byæ rzeka lub morze. Dzia³ wod-
ny jest lini¹ na powierzchni terenu rozgrani-
czaj¹c¹ s¹siednie dorzecze lub poszczególne
zlewnie. Byæ mo¿e s³yszeliœcie o kontynental-
nym dziale wodnym, oddzielaj¹cym np. rzeki
w Ameryce Pó³nocnej p³yn¹ce do Atlantyku
i P a c y f i k u . P o d o b n y m k o n t y n e n t a l n y m
dzia³em wodnym w Europie s¹ nasze Karpaty,
oddzielaj¹ce rzeki p³yn¹ce do Morza Ba³tyc-
kiego od tych które wpadaj¹ do Morza Czar-
nego. Wielkie dorzecza sk³adaj¹ siê z ma³ych
zlewni. W czasie tych zajêæ uczniowie zlokali-
zuj¹ ich w ³asne dorzecze oraz zbuduj ¹ jego
model, który pomo¿e im lepiej poznaæ system
wodny obszaru na którym mieszkaj¹.
Dzia³alnoœæ cz³owieka, taka jak np. budowa-
nie zapór w celu gromadzenia wody, przerzu-
canie wody z jednej zlewni do drugiej, zmie-
nianie topografii terenu przez budowanie
Zadanie
Zapoznanie uczniów z dorzeczem i jego
funkcjami
Znaczenie
M³odsi uczniowie buduj¹ trójwymiarowy
model dorzecza oraz prowadz¹
doœwiadczenia z przep³ywem wody.
Uczniowie bardziej zaawansowani, na
podstawie map topograficznych i zdjêæ
satelitarnych (Landsat) buduj¹
trójwymiarowy model dorzecza na którym
sprawdzaj¹ hipotezy dotycz¹ce przep³ywu
wody
Czas
W klasach m³odszych: 1 godzina lekcyjna
W klasach starszych: 2 do 3 godzin lekcyjnych
Poziom nauczania
Wszystkie
G³ówne pojêcia
Dorzecze jako obszar na którym wszystkie
opady oraz sp³yw powierzchniowy kierowane
s¹ do systemu rzecznego lub innego zbiornika
wodnego.
Miejsce prowadzenia sta³ych badañ
hydrologicznych w programie GLOBE jest
czêœci¹ dorzecza.
Cechy dorzecza zale¿¹ od warunków fizyczno-
geograficznych terenu
Umiejêtnoœci
Modelowanie dorzecza
Przewidywanie sp³ywu wody
Interpretowanie map i innych materia³ów
wizualnych w celu tworzenia modelu
dorzecza
Œrodki dydaktyczne
Dla uczniów m³odszych:
P³yta drewniana o wymiarach 1 x 1 m.
Od³amki ska³ o ró¿nych rozmiarach
Folia plastikowa
Rozpylacz
Dla uczniów zaawansowanych
Mapa topograficzna obszaru przylegaj¹cego
do miejsca badañ hydrologicznych
Zdjêcia satelitarne Landsat tego obszaru
(dostarczane przez GLOBE)
P³yta drewniana o wymiarach 1 x 1 m
Gips modelarski, glina lub inny podobny
materia³
Materia³ do izolacji wodoodpornej
Przygotowanie
Gromadzimy materia³y
Nabywamy mapy topograficzne lub zdjêcia
satelitarne najbli¿szej okolicy
Uwarunkowania
Dla uczniów œrednio i wysoko zaawansowanych:
umiejêtnoœæ czytania mapy topograficznej oraz
interpretacji zdjêæ satelitarnych
Budujemy model
naszego dorzecza
!
?
dróg i innych struktur powierzchniowych,
prowadzi do zmian w obr êbie dorzecza.
Uczenie si ê z wykorzystaniem modelu do-
rzecza pozwoli uczniom lepiej zrozumie æ sy-
stem wodny od kt órego w du ¿ym stopniu
zale¿¹ i dowiedzie æ si ê o tym sk ¹d woda
p³ynie i dok¹d, a tak¿e o tym, co ludzie mog¹
zrobiæ aby w³aœciwie korzystaæ z wody i chro-
niæ jej zasoby.
Co robiæ i jak to robiæ
Na ni¿szych etapach kszta³cenia:
1. Na drewnianej p ³ycie uk³adamy od³amki
ska³ o ró¿nej wielkoœci i kszta³cie. Przykrywa-
my je plastikow ¹ foli¹ i tak j ¹ modelujemy,
aby pojawi³y siê miejsca ni¿sze i wy¿sze, wklê-
s³e i wypuk³e.
2. Prosimy uczniów o wypowiedzi odnosz¹ce
siê do zachowania wody wylanej w r ó¿nych
miejscach na folii.
3. Uczniowie przy pomocy spryskiwacza pole-
waj¹ wod ¹ foli ê. Obserwujemy jak woda
sp³ywa i gdzie siê gromadzi.
4. Inicjujemy dyskusj ê z uczniami na temat
przeprowadzonej obserwacji, zwracaj ¹c
szczególn¹ uwagê na wp ³yw ukszta³towania
powierzchni na sp³yw wody.
5. Pytamy uczniów o to, co by si ê sta³o je¿eli
przemieœcimy kawa³ki ska³ w inne miejsca. Co
nale¿y zrobiæ, aby woda p ³ynê³a szybciej lub
wolniej, lub te ¿ aby w niekt órych miejscach
zbiera³o siê wiêcej wody, w innych zaœ mniej
6. Prosimy uczniów o to, aby uk³adaj¹c odpo-
w i e d n i o k a w a ³ k i s k a ³ s p r a w d z i l i s w o j e
pomys³y. Æwiczenie to w r ó¿nych kombina-
cjach mo¿emy powtarzaæ wiele razy.
Na wy¿szych etapach kszta³cenia:
1. Zadajemy uczniom pytanie:
Co to jest dorzecze (zlewnia)?
Jakie jest jego znaczenie?
2.Uczniom wr êczamy mapy topograficzne
okolicy oraz zdj êcia lotnicze (satelitarne
Landsat). Pomagamy im zorientowa æ siê w
tym co jest zawarte na mapach i zdj êciach
oraz jakie s ¹ relacje mi êdzy tymi dwoma
Ÿród³ami informacji geograficznej. Celem
dzia³añ uczniów powinno by æ odnalezienie
dorzecza w którym mieszkaj¹, nazwanie rzeki
oraz wyznaczenie dzia ³u wodnego. Temu
celowi mo¿e s³u¿yæ mapa poziomicowa z za-
znaczonymi miejscami o ró¿nej wysokoœci.
Na pocz¹tku swojej pracy uczniowie powinni
zidentyfikowaæ na mapie charakterystyczny i
³atwy do odnalezienia punkt, na przyk ³ad
ujœcie rzeki lub strumienia. Dalsze czynno œci
t o z i d e n t y f i k o w a n i e w z n i e s i e ñ i p a s m
górskich oddzielaj ¹cych ich dorzecze od
innych. W celu sprawdzenia poprawno œci
wykonanych dzia³añ mo¿emy postawiæ pyta-
nie: Któr¹ drog¹ pop³ynie woda z tego punk-
t u ? U c z n i o w i e m o g ¹ n a m a p i e r y s o w a æ
strza³ki wskazuj¹ce g³ówne kierunki sp³ywu
wód. Obraz dorzecza dla uczniów bêdzie tym
bardziej klarowny, im wiêcej punktów uda im
siê zidentyfikowaæ i zlokalizowaæ.
3. Dostarczamy uczniom materia ³ z którego
mog¹ wykonaæ model dorzecza – mo¿e to byæ
gips modelarski, glina lub inny podobny
materia³. Uczniowie powinni pracowaæ w nie-
wielkich grupach. Po zako ñczeniu pracy,
model mo¿na pokryæ np. lakierem wodood-
pornym.
4. Po zakoñczeniu budowy modelu, uczniowie
spryskuj¹ go wod¹, jednoczesnie œledz¹c ruch
poszczególnych kropel zmierzaj¹cych do rzeki.
5.Inicjujemy dyskusj ê na temat zale ¿noœci
miêdzy przyrodniczymi, fizyczno-geograficz-
nymi cechami dorzecza a lokalizacj¹ ró¿nych
przejawów ludzkiej dzia³alnoœci.
Dalsze badania
1. Czêœci¹ jakiego wi êkszego dorzecza jest
zlewnia rzeki na terenie kt órej mieszkacie?
Która z tych zlewni jest najwiêksza? Jakie jest
najwiêksze dorzecze?
2. Porównajcie zdjêcia satelitarne z ostatnie-
go czasu ze zdjêciami wczeœniejszymi. Czy w
obrêbie dorzecza zasz³y jakieœ zmiany?
GLOBE™
Dzia³ania poznawcze uczniów-6
Hydrologia
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
GLOBE™
Dzia³ania poznawcze uczniów-7
Hydrologia
Budujemy model naszego dorzecza
Ocena pracy uczniów
1. Uczniowie pisz ¹ wypracowanie na temat
roli i znaczenia dorzeczy.
2. Zadaniem uczni ów jest dokonanie oceny
ka¿dego z protoko³ów badawczych hydrologii
z punktu widzenia mo ¿liwoœci zrozumienia
dorzecza i jego znaczenia.
3. Na mapach topograficznych i zdjêciach sa-
telitarnych uczniowie nanosz¹ wiele obiektów
fizycznogeograficznych oraz stworzonych
przez cz³owieka. W drugim etapie pracy te
obiekty zaznaczj¹ na modelu dorzecza.
4. Zadaniem uczni ów jest pr óba udzielenia
odpowiedzi na pytanie o wp ³yw elementów
œrodowiska naturalnego dorzecza na chara-
kter dzia³alnoœci cz³owieka w tym regionie.
M o g ¹ r ó w n i e ¿ p r o g n o z o w a æ z m i a n y w
przysz³oœci.
5. Uczniowie opisuj¹ zmiany w kszta ³cie do-
rzecza wywo ³ane dzia ³alnoœci¹ cz ³owieka,
oraz, co siê z tym wi¹¿e, drogi którymi woda
bêdzie p³yn¹æ.

GLOBE™
Dzia³ania poznawcze uczniów-8
Hydrologia
Wprowadzenie
Je¿eli za ³o¿ymy, ¿e œredni odp ³yw roczny
wynosi 30 cm, to musimy przyzna æ, ¿e obieg
w o d y w p r z y r o d z i e j e s t c z y n n i k i e m
wywo³uj¹cym erozjê kontynentów. Powsta³y w
wyniku erozji materia³ ( pod postaci¹ zawiesi-
ny, czyli piasku, gliny lub i³u, lub te¿ w postaci
roztworu, np. soli) transportowany jest przez
rzeki i przenoszony do m órz i oceanów. Ten
materia³, który mo¿na potraktowaæ jako natu-
ralne zanieczyszczenie, jest ró¿nego pochod-
zenia – mo ¿e to by æ rozpuszczony wapie ñ
(wêglan wapnia) lub te ¿ mog ¹ to by æ roz-
puszczone minera ³y zawieraj ¹ce metale
ciê¿kie, takie jak o³ów, kadm lub cynk. Jeszcze
inne substancje dostaj¹ siê do wody w wyniku
r ó ¿ n o r o d n e j d z i a ³ a l n o œ c i c z ³ o w i e k a –
przyk³adem mog¹ byæ œcieki, oleje, nawozy
sztuczne lub œrodki ochrony roœlin. Staje siê
wiêc jasne, ¿e je ¿eli w wodzie znajduj ¹ si ê
ró¿ne substancje, to z pewno œci¹ oddzia³uj¹
one na wszystkie formy zwi¹zanego z ni¹ ¿ycia
biologicznego.
Uczeni dysponuj ¹ r ó¿nymi mo ¿liwoœciami
sprawdzenia obecnoœci w wodzie ró¿nych sub-
stancji – zarówno szkodliwych jak i po ¿ytecz-
Zadanie
Pomóc uczniom zrozumieæ, ¿e w wodzie
znajduje siê wiele rozpuszczonych substancji,
obecnoœæ których mo¿emy odkryæ pos³uguj¹c
siê zmys³ami, oraz to, ¿e obecnoœæ innych
mo¿emy stwierdziæ tylko wtedy, gdy
pos³u¿ymy siê odpowiednimi narzêdziami
Znaczenie
Uczniowie bêd¹ identyfikowaæ rozpuszczone
w wodzie substancje pos³uguj¹c siê piêcioma
zmys³ami, po czym zrobi¹ to samo korzystaj¹c
z przyrz¹dów u¿ywanych w Programie
GLOBE
Czas
Jedna lekcja
Poziom nauczania
Uczniowie m³odszych klas
G³ówne pojêcia
Piêæ twoich zmys³ów pozwoli ci poznaæ œwiat
Twoje zmys³y mog¹ odkrywaæ ró¿ne rzeczy
Przyrz¹dy s³u¿¹ wzmocnieniu naszych
zmys³ów
Umiejêtnoœci
Szukanie odpowiedzi na pytania
Przewidywanie odpowiedzi na pytania
(stawianie hipotez)
Prowadzenie eksperymentu
Prowadzenie obserwacji
Zapisywanie danych
Liczenie (dodawanie)
Œrodki dydaktyczne
Zestaw dla zespo³u 4–5 uczniów
5 przezroczystych plastikowych pojemników
5 plastikowych ³y¿eczek
Flamaster do znakowania pojemników
Substancje, które dodane do wody pozwol¹
wykorzystaæ w jej badaniu wszystkie piêæ
zmys³ów, takie jak:
Wzrok – ¿ó³ty barwnik spo¿ywczy, sok z
cytryny, woda gazowana
Dotyk – soda spo¿ywcza
Zapach – sok z cytryny, ocet
Smak – sól, cukier, woda destylowana, woda
z kranu
S³uch – woda gazowana
Przygotowanie
Przygotowujemy próbki wody do
eksperymentu oraz robimy kopie Roboczego
Arkusza Wodnego Detektywa
Uwarunkowania
¯adne
Wodni detektywi
!
?

Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
GLOBE™
Dzia³ania poznawcze uczniów-9
Hydrologia
Wodni detektywi
nych, naturalnych i sztucznie do niej wpro-
wadzonych. Nasze zadanie polegaæ bêdzie za
poznaniu sposobów i narzêdzi badania w³aœci-
woœci wody niedostêpnych naszym zmys³om.
Przygotowanie
· N a l e ¿ y p r z y g o t o w a æ d l a k a ¿ d e j g r u p y
miejsce do zajêæ, w którym znajd¹ siê pojem-
niki z wod¹ zawieraj¹c¹ ró¿ne „ tajemnicze"
domieszki (s³ona woda, gazowana woda min-
eralna itp.). Powinna tam siê równie¿ znaleŸæ
normalna woda z kranu.
· Do dyspozycji s ¹ ³y¿eczki do mieszania i
próbowania smaku wody.
· Pojemniki oznaczamy kolejnymi numerami
przy pomocy flamastra.
· Ka¿demu uczniowi wr êczamy skopiowany
egzemplarz Roboczego Arkusza Wodnego
Detektywa.
Co robiæ i jak to robiæ
Na pocz¹tku zajêæ inicjujemy dyskusj ê ucz-
niów na temat sposobów odkrywania ró¿nych
r z e c z y w n a s z y m o t o c z e n i u p r z y u ¿ y c i u
zmys³ów. Szczególn¹ uwagê zwracamy na za-
lety i wady ka ¿dego zmys³u. Uczniom mo ¿y
postawiæ nastepuj¹ce pytania:
1 . W j a k i s p o s ó b p r z y p o m o c y w z r o k u
mo¿emy odkryæ niebezpieczeñstwo? W jakich
warunkach zmys³ naszego wzroku nie mo ¿e
dobrze funkcjonowaæ? (je¿eli coœ jest poza
zasiêgiem wzroku, w ciemnoœciach, je¿eli coœ
jest niewidzialne...).
2. W jaki sposób przy pomocy s³uchu mo¿emy
odkryæ niebezpieczeñstwo? W jakich warun-
kach zmys³ naszego s³uchu nie mo¿e dobrze
funkcjonowaæ? (coœ co nie wytwarza ¿adnego
dŸwiêku, je¿eli nie s³uchamy lub nie zwraca-
my na coœ uwagi).
3 . W j a k i s p o s ó b p r z y p o m o c y z a p a c h u
mo¿emy odkryæ niebezpieczeñstwo? W jakich
warunkach zmys ³ naszego powonienia nie
mo¿e dobrze funkcjonowaæ? (niektóre rzeczy
s¹ pobawione zapachu, je ¿eli jesteœmy prze-
ziêbieni...).
4 . W j a k i s p o s ó b p r z y p o m o c y d o t y k u
mo¿emy odkryæ niebezpieczeñstwo? W jakich
warunkach zmys³ naszego dotyku nie mo ¿e
dobrze funkcjonowaæ? (je¿eli obiekt jest zbyt
daleko, je¿eli dotykanie czegoœ mo¿e byæ nie-
bezpieczne...).
5. W jaki sposób przy pomocy smaku mo¿emy
odkryæ niebezpieczeñstwo? W jakich warun-
kach zmys³ naszego smaku nie mo ¿e dobrze
funkcjonowaæ? ( je¿eli coœ mo¿e byæ zatrute,
je¿eli jest brudne...).
6. Do r êki bierzemy kubek z wod ¹. Pytamy
uczniów o to, który z naszych zmys³ów bêdzie
najbardziej u¿yteczny przy próbie okreœlenia
przydatnoœci tej wody do picia. Rozwa ¿amy
zalety i wady ka ¿dego ze zmys ³ów w takiej
próbie.
7. Czy myœlicie, ¿e przy próbie odnajdywania
kubka z wod ¹ do picia zawsze b êdziecie siê
pos³ugiwaæ tylko jednym zmys³em? Spróbuj-
cie przewidzieæ i odgadn¹æ, który ze zmys³ów
bêdzie najczêœciej u¿ywany w próbie okreœle-
nia „tajemniczej" substancji znajduj¹cej siê w
wodzie. Otaczamy k ó³kiem rysunek z ilus-
tracj¹ tego zmys ³u w g órnej cz êœci tabeli
zamieszczonej w Roboczym Arkuszu Wodnego
Detektywa.
Przebieg doœwiadczenia
1. Uczniom pokazujemy opakowania z „ta-
jemniczym" œrodkiem spo ¿ywczym kt óry
dodaliœmy do wody (s ól, soda spo ¿ywcza i
inne). Nastêpnie mówimy uczniom: „To s¹
œrodki spo¿ywcze które wymieszam z wod¹ na
waszych oczach. Naszym zadaniem b êdzie
wykorzystanie zmys ³ów w celu okre œlenia
które z nich znajduja si ê w poszczeg ólnych
kubkach".
T
D
S
pH
Fe. Myœlê ¿e tê wodê
trzeba koniecznie
przebadaæ!
!
TEST
FOR
ALKALINITY
Dissolved
Oxygen
Test Kit
2. Uczniowie przygl¹daj¹ siê poszczególnym
kubkom z wod ¹ zawieraj ¹c¹ rozpuszczony
œrodek spo¿ywczy. W Roboczym Arkuszu, w
kolumnie oznaczonej okiem (wzrok), stawiaj¹
literê X przy numerze tego kubka, kt óry ich
zdaniem nie zawiera wody z kranu. Liter ê W
stawiaj¹ natomiast przy tych numerach, który-
mi, ich zdaniem, oznaczono wodê z kranu.
3. Uczniowie „s³uchaj” kubków z wod¹ (mog¹
nimi np. potrz¹saæ). W kolumnie oznaczonej
u c h e m ( s ³ u c h ) , s t a w i a j ¹ l i t e r ê X p r z y
numerze tego kubka, kt óry ich zdaniem nie
wydaje d Ÿwieków charakterystycznych dla
wody z kranu. Liter ê W stawiaj¹ natomiast
przy tym numerze kubka, w kt órym woda
wydaje dŸwiêki jak woda z kranu.
4. Uczniowie w¹chaj¹ wodê w poszczególnych
kubkach. W odpowiedniej kolumnie wstawiaj¹
literê X przy numerze tego kubka, w kt órym
woda nie ma zapachu charakterystycznego dla
wody z kranu. Liter ê W stawiaj¹ natomiast
przy numerze kubka z wod ¹ o zapachu char-
akterystycznym dla wody z kranu.
5. Uczniowie, przy pomocy ³y¿eczki upuszc-
zaj¹ kilka kropli z ka¿dego kubka na d³oñ. W
odpowiedniej kolumnie stawiaj¹ literê X przy
numerze tego kubka, z kt órego woda swoim
„dotykiem” nie przypomina wody z kranu.
Literê W stawiaj¹ natomiast przy numerze
kubka, w kt órym ich zdaniem znajduje si ê
woda z kranu.
6. Uczniowie pos³uguj¹c siê ³y¿eczk¹ sprawd-
zaj¹ smak wody w poszczeg ólnych kubkach.
Za ka ¿dym razem nale ¿y u ¿ywaæ czystej
³y¿eczki. W odpowiedniej kolumnie stawiaj ¹
literê X przy numerze tego kubka, z kt órego
woda swoim smakiem nie przypomina wody z
kranu. Liter ê W stawiaja natomiast przy
numerze kubka, w którym woda swoim sma-
kiem przypomina wodê z kranu.
7. Uczniowie sumuj ¹ liczby X-s ów w ka ¿dej
k o l u m n i e , o d p o w i a d a j ¹ c e j j e d n e m u z e
zmys³ów. Kt óry ze zmys ³ów ma najwi êcej
oznaczeñ X? W ³aœnie ten zmys ³ okaza ³ si ê
najlepszy w pr óbach okre œlenia substancji
zawartej w wodzie.
8. Pytamy uczniów o ich wczesniejsze przewi-
dywania, który ze zmys³ów by³by najlepszy do
badania wody. Smak? Œwietnie, mogliœmy tak
postêpowaæ dzisiaj. „Ale czy zechcecie podj¹æ
próbê okreœlania smaku wody, nie wiedz ¹c
wczeœniej co siê w niej znajduje?"
9. Stawiamy uczniom pytanie, w jaki inny
sposób mog¹ zbadaæ substancje rozpuszczone
w w o d z i e . Z a p o z n a j e m y i c h z r ó ¿ n y m i
przyrz¹dami i prosimy o podanie przyk³adów
ró¿nych narz êdzi wzmacniaj ¹cych nasze
zmys³y. Mog¹ to np. by æ wykrywacze dymu,
mikroskop, aparaty s³uchowe i in.
10. Zapoznajemy uczniów z papierem lakmu-
sowym (wska Ÿnikowym) jako narz êdziem
badania wody. Przy jego pomocy mierz ¹ oni
odczyn (pH) wody w poszczeg ólnych kub-
k a c h . J a k ¹ c e c h ê w o d y m o ¿ e m y z b a d a æ
pos³uguj¹c siê tym narzêdziem?
Uwaga: Kolejnym æwiczeniem powinna by æ
Gra w pH . Uczniowie b êd¹ mieæ mo¿liwoœæ
zbadania odczynów ró¿nych substancji wyst-
êpuj¹cych w ich otoczeniu.
Dostosowanie zajêæ
dla uczniów starszych:
1. Uczniowie mog¹ pos³u¿yæ siê innymi meto-
dami w celu okre œlenia takich w ³aœciwoœci
wody jak zasadowo Ͼ, przewodnictwo elek-
tryczne, zasolenie lub gêstoœæ.
2. Zachêcamy uczniów do wymyœlania przez
nich metod i sposob ów okreœlania ró¿nic w
próbkach wody (np. potrz ¹sanie naczyniem,
d o d a w a n i e i n n y c h c h e m i k a l i ó w w c e l u
wywo³ania reakcji).
Ocenianie uczniów
Prosimy uczniów o:
· Sporz¹dzenie listy substancji znajdywanych
w wodzie
· W y j a œ n i e n i e k o n i e c z n o œ c i u ¿ y w a n i a
p r z y r z ¹ d ó w d o w y k r y w a n i a o b e c n o œ c i
niektórych substancji
· Odgadywanie (stawianie hipotez) w jaki
sposób ró¿ne substancje zawarte w wodzie
mog¹ wp³ywaæ na istniej¹ce w niej ¿ycie bio-
logiczne
· W y j a œ n i e n i e r o l i k a ¿ d e g o z e z m y s ³ ó w
GLOBE™
Dzia³ania poznawcze uczniów-10
Hydrologia
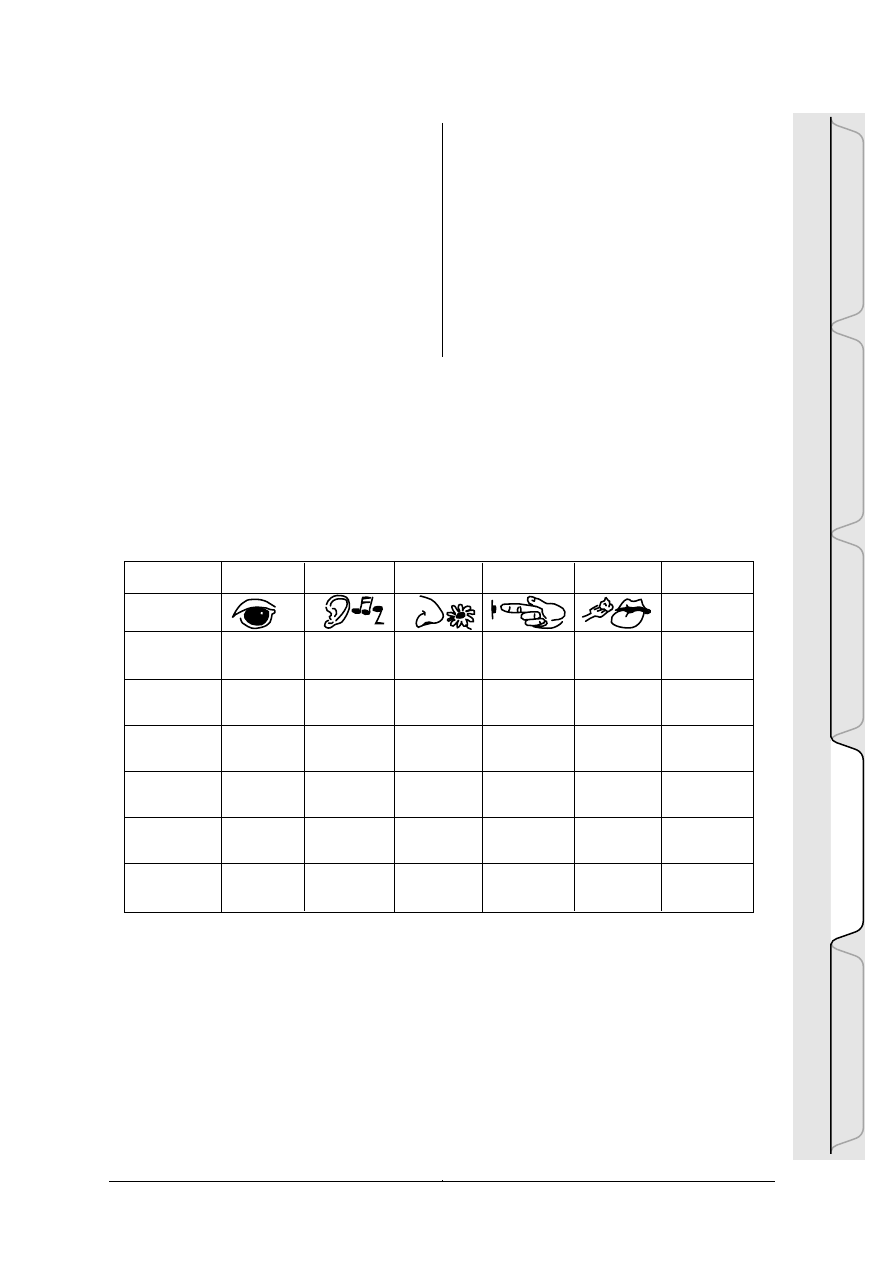
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
GLOBE™
Dzia³ania poznawcze uczniów-11
Hydrologia
Wodni detektywi
· Wyjaœnienie roli ka ¿dego ze zmys ³ów w
identyfikowaniu ró¿nych substancji zawartych
w wodzie
· Pos ³ugiwanie si ê si ê Arkuszem Danych
Roboczych w celu odpowiedniego zapisania
danych, w sposób umo¿liwiaj¹cy ich interpre-
tacjê.
Dalsze badania
Uczniowie staraj¹ siê ustaliæ, czy ró¿ne gatun-
ki roœlin i zwierz¹t lubi¹ ró¿ne typy wody.
Jak wype³niaæ tabelê
Na skrzy¿owaniu kolumny oznaczaj¹cej poszczególne zmys³y oraz wiersza oznaczaj¹cego kolejny
numerowany kubek, w odpowiedniej kratce wpisz liter ê X je¿eli uwa¿asz, ¿e p³yn w kubku nie
jest wod¹ z kranu. Literê W wpisz w odpowiedni¹ kratkê, je¿eli twoim zdaniem p³yn w kubku jest
normaln¹ wod¹ z kranu.
Upewnij siê, czy zawsze okre œlaj¹c wodê u¿ywa³eœ tylko tego zmys ³u który oznaczony jest w
odpowiedniej kolumnie. Je¿eli ju¿ za pomoc¹ ka¿dego ze zmys³ów przebada³eœ ka¿dy kubek i
wyniki odpowiednio zapisa³eœ, policz, w którym wierszu jest najwiêcej oznaczeñ W. Tam powin-
na znajdowaæ siê woda z kranu.
Name:_____________________________________
Kubek Widzieæ
S³yszeæ
W¹chaæ Czuæ
Smakowaæ
pH
1 pierwszy
2 drugi
3 trzeci
4 czwarty
5 pi¹ty
Razem
Roboczy Arkusz Wodnego Detektywa

GLOBE™
Dzia³ania poznawcze uczniów-12
Hydrologia
Wprowadzenie
Stopieñ zakwaszenia (pH) w decyduj ¹cy
sposób wp ³ywa na wegetacj ê i inne formy
¿ycia biologicznego w œrodowisku. Wp³yw na
wartoœæ pH ma wiele czynnik ów. Nale¿y do
nich oddzia³ywanie zasadowych substancji
pochodz¹cych z gleb i ska ³, ilo œci wody na
d a n y m t e r e n i e , a t a k ¿ e o d d z i a ³ a l n o œ c i
cz³owieka (ruch samochod ów, zabudowa,
miejsca pokryte asfaltem lub betonem). Na
odczyn lokalnych w ód mog ¹ mie æ r ównie¿
wp³yw kwa œne opady. Zrozumienie tych
wszystkich wspó³zale¿noœci jest bardzo wa¿ne.
Zadanie
Przybli¿yæ uczniom zagadnienie kwasowoœci
cieczy oraz innych substancji wystepuj¹cych w
otoczeniu szko³y oraz umozliwiæ im
zrozumienie roli stopnia zakwaszenia jako
wskaŸnika jakoœci œrodowiska
Znaczenie
Gra w pH powinna stanowiæ zachêtê dla
uczniów podejmuj¹cych pomiary odczynu
wody, gleby i roœlin oraz innych naturalnych
materia³ów z ró¿nych miejsc. Uczniowie
mog¹ mieszaæ ró¿ne substancje w celu
uzyskania zró¿nicowanych wyników wartoœci
pH
Czas
Jedna godzina lekcyjna na
przygotowanieJedna godzina lekcyjna na
przeprowadzenie gry
Poziom nauczania
Wszystkie
G³ówne pojêcia
Pomiar pH
Umiejêtnoœci
Dokonywanie pomiarów
Przeprowadzanie analiz
Interpretacja wyników
Rozumienie wspó³zale¿noœci w przyrodzie
Œrodki dydaktyczne
Dla ka¿dego zespo³u uczniowskiego (3–4
uczniów):
20 listków papieru lakmusowego
3 do 5 ma³ych kubeczków
Papier i o³ówek
Naklejki na których zapisujemy wyniki i
naklejamy na tabelê zbiorcz¹
Dla ca³ej klasy:
Tabela zbiorcza z rubryk¹ dla ka¿dego
zespo³u oraz z rubryk¹ do zaznaczania
wartoœci pH w granicach od 2 do 9
Arkusze papieru
Dodatkowe listki papieru lakmusowego
Przygotowanie
Zadaniem nauczyciela jest przygotowanie
mieszanin ró¿nych substancji o
zró¿nicowanej kwasowoœci i zasadowoœci,
zarówno naturalnych jak i sztucznych.
Roztwory te powinny byæ opisane, z
podaniem dodanych substancji, ale bez
charakterystki, czy jest to roztwór kawœny,
czy zasadowy. Przyk³ady roztworów
kwaœnych to: sfermentowana trawa, stê¿ony i
rozcieñczony sok z cytryny, czarna kawa,
ocet, sok pomarañczowy, coca cola oraz
napoje owocowe. Przyk³ady roztworów
zasadowych to: zasolona woda, szampon,
soda spo¿ywcza, bielinka, amoniak
spo¿ywczy i in. Mo¿na równie¿ przygotowaæ
mieszankê miejscowej gleby z wod¹, jak
równie¿ zbadaæ wodê z lokalnych
zbiorników. Nauczyciel mo¿e znaleŸæ w³asne
przyk³ady z s¹siedztwa szko³y, jak np. wodê
zanieczyszczon¹ olejem samochodowym,
p³yn zawarty w porzuconej butelce.
Uwarunkowania
¯adne
Gra w pH
!
?
GLOBE™
Dzia³ania poznawcze uczniów-13
Hydrologia
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Gra w pH
Te proste zaj êcia edukacyjne pozwol ¹ ucz-
niom zrozumieæ z³o¿ony system wzajemnych
relacji mi êdzy przyrod ¹ a dzia ³alnoœci¹
cz³owieka.
Uwaga: Przypominamy uczniom r ó¿nicê
miêdzy hipotez ¹ a otrzymanymi wynikami
badañ. Zachêcamy ich do formu³owania w³as-
nych hipotez i poszukiwania sposob ów ich
weryfikacji na podstawie wynik ów konkret-
nych badañ ( dostarczamy im odpowiedniej
literatury, zapraszamy do szko³y ekspertów z
okreœlonej dziedziny, wykorzystujemy wyniki
wczeœniejszych badañ i in.).
Regu³y gry
1. Wyjaœniamy uczniom cel prowadzonej gry,
którym jest zbadanie przez ka¿dy zespó³ roz-
tworów, których wartoœæ pH zawarta jest w
przedziale od 2 do 9.
Uczniowie powinni narysowaæ poziom¹ skalê
pH, z liniami oznaczaj¹cymi wartoœci pH od 0
do 14, o oznaczeniem punktu pH r ównego 7,
jako wartoœci neutralnej. Odleg³oœci pomiêd-
zy poszczeg ólnymi jednostkami powinny
wynosiæ co najmniej 1 cm. Dla ka ¿dej war-
toœci pH w przedziale od 2 do 9 na skali rysu-
jemy pod ni¹ prostok¹ty.
Ka¿dy z zespo³ów wyszukuje substancji posia-
daj¹cych pH odpowiadaj¹ce odczynowi odpo-
wiedniego prostok¹ta na skali.
2. Nauczyciel na tablicy szkolnej rysuje tabelê
na wzór zamieszczonej poni¿ej (HYD-L-1).
3. Zespó³ zdobywa jeden punkt za wype ³nie-
nie prostok¹ta, nawet wtedy gdy odnajdzie
dwie substancje o tej samej wartoœci pH.
4. Uczniowie powinni notowaæ wszelkie infor-
macje o roztworze, uzyskanych z napis ów na
etykiecie i na podstawie wynik ów pomiarów
pH.
5. Je¿eli uczniowie s¹ gotowi do przekazania
próbki i odnotowania jej na tablicy wynik ów,
pokazuj¹ nauczycielowi pr óbkê i notatki.
Wspólnie dokonuj¹ pomiaru pH przy u¿yciu
nowego paska papieru lakmusowego. Je ¿eli
wynik jest zgodny z wynikiem poprzedniego
pomiaru, zesp ó³ zdobywa punkt. Przyk ³ad
wype³nionej tabeli podany jest na rysunku
HYD-L-2.
6. Za ka ¿dy wynik zapisany w tabeli zesp ó³
otrzymuje dodatkowy pasek papieru lakmu-
sowego.
WartoϾ pH
Zespo³y
2
3
4
5
6 7
8
9
Ogó³em
Zespó³ 1
Zespó³ 2
Zespó³ 3
TabelaHYD-L-1
WartoϾ pH
Zespo³y
Ogó³em
Zespó³ 1
Zespó³ 2
Zespo³ 3
Tabela HYD-L-2
2
3
4
5
6 7
8
9
1
1
1
1
4
1
1
1
3
1
1
1
3
Modyfikacje gry i dostosowanie
jej do ró¿nego wieku uczniów
Poziom pocz¹tkowy
Na pierwszych etapach nauczania, dla lepsze-
go zrozumienia problematyki, u¿ywamy cukru
i soli. Pozwoli to uczniom wyjaœniæ, ¿e sól nie-
koniecznie oznacza odczyn kwa œny, a cukier
odczyn zasadowy. Dobrym przyk ³adem roz-
t w o r u s ³ o d k i e g o i j e d n o c z e œ n i e m o c n o
kwaœnego mo¿e byæ coca cola.
Poziom œredniozaawansowany
Grê mo ¿na uczyni æ bardziej pasjonuj ¹c¹ i
p ob ud z aj ¹ c¹ do w sp ó³ zawo dnic tw a. N a
przyk³ad, zespó³ który pierwszy wykona lub
odnajdzie próbkê roztworu o okreœlonej war-
toœci pH otrzymuje 5 punkt ów. Inni otrzy-
maj¹ za to zadanie po 1 punkcie.
W celu uczynienia gry bardziej skomplikowa-
nej, mo ¿emy ograniczy æ pr óbki p ³ynów do
takich które maj¹ pochodzenie naturalne.
Ograniczamy liczbê pasków papieru lakmuso-
wego przydzielanego ka ¿demu zespo ³owi.
Dodatkowe paski mog ¹ otrzymaæ w zamian
za uzyskane punkty.
Poziom zaawansowany
Zadaniem uczniom jest ustalenie takich roz-
t w o r ó w , k t ó r e p o w y m i e s z a n i u s t w o r z ¹
roztwór obojêtny. Hipotezy mog¹ sprawdzaæ
przez dodawanie roztwor ów o oznaczonym
pH i dokonywanie pomiar ów. Mog ¹ oni
równie¿ obliczaæ zdolnoœæ dzia³ania neutrali-
zuj¹cego ró¿nych roztworów i odnosiæ to do
mo¿liwoœci buforowych miejsca badañ hydro-
logicznych.
Mo¿emy uczniom dostarczy æ roztwor ów
pochodz¹cych z r ó¿nych cz êœci kraju (lub
œwiata) z proœb¹ o scharakteryzowanie ich.
Takie oraz inne analizy mo ¿emy prowadziæ
badaj¹c próbki pochodz¹ce z ró¿nych warstw
geologicznych, z ró¿nych miejsc w okolicy lub
z otoczenia s¹siaduj¹cego z miejscem badañ
hydrologicznych.
Uwaga: Zaleca siê zapraszanie ekspertów do
u c z n i ó w s t a r s z y c h , w c e l u w y j a œ n i e n i a
niektórych zagadnieñ.
Kontynuacja badañ
Badamy otoczenie (gleby, ska ³y, roœlinnoœæ)
miejsca bada ñ hydrologicznych oraz jego
potencjalny wp³yw na pH wody w zbiorniku.
Próbujemy okre œliæ oraz oszacowa æ wp ³yw
wystêpuj¹cych sporadycznie czynnik ów,
takich jak opad deszczu lub inne wydarzenia
w górnym biegu rzeki.
Ocenianie uczniów
Po zako ñczeniu gry zasiadamy wsp ólnie z
uczniami przed tablic¹ z wynikami, identyfi-
kujemy próbki które zosta³y odnalezione oraz
ich pH. Zachêcamy uczniów do podejmowa-
nia prób wyjaœnienia zró¿nicowanego pH u
ró¿nych substancji. Szczególn¹ uwagê zwraca-
my na zró¿nicowanie próbek pochodz¹cych z
ró¿nych œrodowisk, ska³, gleb, powierzchni
sztucznych, jezior i rzek. Wspominamy o
mo¿liwoœciach neutralizuj¹cego oddzia³ywa-
nia niektórych ska³ oraz o zakwaszeniu powo-
dowanym przez r ó¿ne materia ³y. Pytamy
równie¿ o to, dlaczego ³atwo by ³o znale Ÿæ
próbki o danym odczynie, trudno zaœ próbki o
innych pH.
Podziêkowania
Gra w pH zosta³a wymyœlona i wypróbowana
przez liderów Stowarzyszenia Edukacji Eko-
logicznej TEREZA z Republiki Czeskiej.
GLOBE™
Dzia³ania poznawcze uczniów-14
Hydrologia
GLOBE™
Dzia³ania poznawcze uczniów-15
Hydrologia
Zadanie
Uczniowie powinni:
1. Opanowaæ umiejêtnoœæ poprawnego
pos³ugiwania siê przyrz¹dami
2. Uœwiadomiæ sobie zakres mo¿liwoœci
pomiaru przy wykorzystaniu danego
instrumentu
3. Pos³ugiwaæ siê instrumentami zgodnie z
instrukcj¹ oraz wymaganiami opisanymi w
protokole
4. Zrozumieæ znaczenie kontrolowania
jakoœci pomiarów
Znaczenie
Grupy uczniów bêd¹ siê przemieszczaæ
pomiêdzy stanowiskami przygotowanymi dla
ka¿dego z protoko³ów zaplanowanych do
realizacji przez klasê. Uczniowie bêd¹ æwiczyæ
pos³ugiwanie siê instrumentami oraz
zestawami badawczymi zgodnie z
wymaganiami protoko³u, staraj¹c siê
jednoczeœnie odkryæ przyczyny i Ÿród³a
b³êdów pomiaru i jego niedok³adnoœci. W
trakcie tych zajêæ uczniowie powinni
korzystaæ z ró¿norodnych próbek wody,
przyniesionych przez nich z domu, podwórka
lub p³yn¹cego w s¹siedztwie strumyka. Je¿eli
dysponujemy wystarczaj¹c¹ liczb¹
instrumentów i zestawów badawczych,
mo¿emy skoncentrowaæ siê w danym
momencie tylko nad niektórymi fazami
pomiaru, w celu unikniêcia straty czasu na
dyskusjê.
Czas
Trzy lub cztery jednostki lekcyjne
Poziom nauczania
W zale¿noœci od wybranego protoko³u
G³ówne pojêcia
Zabezpieczenie jakoœci
Kontrola jakoœci
RzetelnoϾ pomiaru
Dok³adnoœæ
Protokó³
Kalibrowanie
Umiejêtnoœci
Pos³ugiwanie siê instrukcj¹
Prowadzenie pomiarów
Œrodki dydaktyczne
Wszystkie instrumenty i zestawy badawcze
przewidziane dla danego protoko³u
Kube³ wody z kranu
Kopie Arkuszy Uczniowskich Badañ
Hydrologicznych
Poza tym, dla poszczególnych protoko³ów
potrzebujemy nastêpuj¹cych dodatkowych
materia³ów:
Przezroczystoœæ: zielony barwnik spo¿ywczy,
³y¿eczka gliny
pH: próbki wody z octem, woda destylowana,
mleko, sok, woda sodowa itp.
Temperatura: lód
Przewodnictwo elektryczne: woda
destylowana, sól
Zasolenie: woda destylowana, sól, lód
Azotany: sztuczny nawóz do trawników
Przygotowanie
Prosimy uczniów o przyniesienie próbek
wody z domu lub podwórka
Dla ka¿dego protoko³u organizujemy
æwiczeniow¹ stacjê pomiarow¹. Ka¿da z nich
powinna byæ wyposa¿ona w:
Instrumenty pomiarowe
Jedn¹ kopiê odpowiedniego protoko³u
zawieszon¹ na stanowisku
Kopie Arkuszy Uczniowskich Badañ
Hydrologicznych
Na pocz¹tku dnia nape³niamy kube³ wod¹ z
kranu i pozostawiamy go na widoku w
klasie. Na przyczepionej do kub³a karteczce
notujemy czas nape³nienia.
Butelkê przeznaczon¹ do badania
rozpuszczonego tlenu nape³niamy w tym
samym czasie oraz zabezpieczamy próbkê
zgodnie z instrukcj¹ w protokole. Na
naklejce notujemy czas nape³nienia.
Wype³nianie protoko³ów
!
?
Wprowadzenie
Protoko³y
Dzia³ania poznawcze
Za³¹czniki
Powitanie
Wype³nianie protokó³ów
Wprowadzenie
Konieczne jest przygotowanie planu zapew-
niaj¹cego zabezpieczenie i kontrolê jakoœci w
celu uzyskania jak najlepszych wynik ów.
D o k ³ a d n o œ æ , p r e c y z j a o r a z r z e t e l n o œ æ
pomiarów zale¿¹ od:
– dok³adnego skalibrowania instrument ów
oraz pos ³ugiwania si ê odpowiednim mate-
ria³em testowym,
– postêpowania zgodnie z zaleceniami opisa-
nymi w protoko³ów,
– powtarzania pomiar ów do momentu uzy-
skania wyników znajduj¹cych siê w okre œlo-
nym przedziale wartoœci
– stopnia zanieczyszczenia pr óbek, u¿ywa-
nych chemikaliów oraz instrumentów.
Uwzglêdnianie powy¿szych zaleceñ sprawi, ¿e
otrzymane wyniki bêd¹ wartoœciowe, rzetelne
i znacz¹ce.
Kalibrowanie
Kalibrowanie jest procedur ¹ zapewniaj¹c¹
s p r a w d z e n i e r z e t e l n o œ c i i n s t r u m e n t ó w
badawczych. W celu upewnienia siê czy dany
instrument funkcjonuje prawid³owo, pos³ugu-
jemy siê roztworami kontrolnymi o znanych
wartoœciach. Procedury kalibrowania s¹ ró¿ne
i opisane zosta ³y w poszczeg ólnych proto-
ko³ach.
Bezpieczeñstwo
Nale¿y bezwzglêdnie przestrzegaæ instrukcji
postêpowania z zestawami badawczymi oraz
roztworami kontrolnymi.
Co robiæ i jak to robiæ
1. Uczniów dzielimy na ma ³e zespo³y, najle-
piej trzyosobowe. Sprawdzaj¹c siê wzajemnie,
uczniowie powinni kolejno zapozna æ si ê z
instrukcj¹, dokonaæ pomiaru i zapisaæ wyniki.
2. Uczniowie przechodz¹ do kolejnych stano-
wisk, zapoznaj¹c siê z instrumentami i proto-
ko³ami.
3. Likwidujemy grupy i przed frontem ca ³ej
klasy, dla ka¿dego pomiaru:
3.1. nanosimy wyniki w postaci punkt ów w
celu uzmys³owienia uczniom pojêcia dok³ad-
noœci pomiaru. Je ¿eli uzyskane wyniki by ³y
bliskie rzeczywistoœci, punkty grupuj¹ siê blis-
ko siebie. Dyskutujemy rozrzut wyników.
3.2. inicjujemy burzê mózgów w celu ustale-
nia przyczyn zró¿nicowania wyników. W tym
czasie rozwa¿amy znaczenie kalibrowania i
jego zwi¹zków z roztworami standardowymi,
dok³adnoœci¹ odczytu i zgodno œci¹ z proto-
ko³em. Wyjaœniane zró¿nicowanie wyników
przyporz¹dkujemy okreœlonym przyczynom,
zgodnie z poszczególnymi etapami protoko³u.
Eksponujemy znaczenie precyzji pomiaru,
gdy¿ to umo¿liwi nam porównywanie ró¿nych
próbek wody.
4. Por ównujemy otrzymane wyniki bada ñ
ró¿nych próbek wody. W celu lepszego zro-
zumienia problematyki, mo ¿emy te wyniki
nanieœæ na map ê z zaznaczonymi miejscami
pochodzenia badanej wody, z opisem, czy jest
to woda ze studni, z basenu, z e stawu lub
strumyka. Równie¿ tutaj eksponujemy znac-
zenie precyzji pomiarów w celu dokonywania
porównañ. Czy ró¿nica w wynikach jest odbi-
ciem rzeczywistoœci, czy te¿ po prostu wynika
z b³êdu pomiarowego? Jest to r ównie¿ czas i
miejsce do ukazania przyczyn zaniechania
pomiarów temperatury i rozpuszczonego tle-
nu w tym momencie oraz wyjaœnienia okolicz-
noœci poprawnego przeprowadzenia tych
pomiarów.
Dostosowania
Uczniowie pocz¹tkuj¹cy
Postêpuj¹c zgodnie z opisanymi wy¿ej zalece-
niami, nale¿y koncentrowaæ siê na wykonaniu
jednego pomiaru w jednostce czasu.
Uczniowie zaawansowani
Nale¿y uczniom umo¿liwiæ wykonywanie ich
w³asnych zestawów wyników interpretowanie
ich.
Dalsze badania
Mo¿emy powtórzyæ poszczególne æwiczenia
zmieniaj¹c jeden z parametrów, np. tempera-
turê pr óbki wody – jedn ¹ trzeci ¹ pr óbki
mo¿emy sch³odziæ, drug¹ jedn¹ trzeci¹ podgr-
zaæ, pozosta³¹ badaæ w temperaturze pokojo-
wej. W nast êpnej kolejno œci por ównujemy
wp³yw temperatury wody na uzyskane wyniki.
GLOBE™
Dzia³ania poznawcze uczniów-16
Hydrologia

GLOBE™
Dzia³ania poznawcze uczniów-17
Hydrologia
Stanowisko Badania
Przezroczystoœci
Wprowadzenie
Przezroczystoœæ jest miar¹ zmêtnienia wody.
O przezroczystoœci wody w miejscu prowa-
dzenia badañ decyduje iloœæ zawieszonych w
wodzie cz¹steczek oraz obecnoœci alg i innych
form ¿ycia roœlinnego. Przezroczystoœæ mo¿e
siê zmieniaæ w poszczególnych porach roku,
w zale¿noœci od intensywnoœci ¿ycia biologi-
cznego, iloœci wody opadowej sp³ywaj¹cej do
zbiornika oraz innych czynnik ów. Przezro-
czystoœæ wody limituje zasiêg promieniowania
s³onecznego w zbiorniku. Rozwój roœlinnoœci
zale¿y od œwiat³a s³onecznego, tote¿ przezro-
czystoœæ jest czynnikiem wp ³ywaj¹cym na
¿ycie roœlin.
W t e r e n i e , n a m i e j s c u b a d a ñ m o ¿ e m y
pos³u¿yæ si ê dwiema metodami pomiaru
przezroczystoœci: w przypadku wód g³êbokich
i spokojnych korzystamy z kr¹¿ka Secchiego,
natomiast tam gdzie woda jest p³ytka i p³ynie
szybko stosujemy tubê (cylinder) do badania
zmêtnienia. W praktyce laboratoryjnej, na
szkolnym stanowisku badañ pomiaru dokonu-
jemy przy u¿yciu tuby.
Co robiæ i jak to robiæ
1. Ka ¿dy ucze ñ indywidualnie nalewa do
cylindra wodê z kranu a¿ do momentu zaniku
wzoru na jego dnie, nastêpnie zapisuje wynik
w centymetrach.
2 . P o r ó w n u j e m y w y n i k i u z y s k a n e p r z e z
ró¿nych uczniów. Prosimy ich równie¿ o sfor-
mu³owanie hipotez wyjaœniaj¹cych zró¿nico-
wanie wyników.
3. Dokonujemy nastêpnych pomiarów ró¿ni-
cuj¹c warunki ich prowadzenia, np. ilo œæ
œwiat³a w pomieszczeniu, pomiar w cieniu i w
pe³nym œwietle, w okularach s ³onecznych i
bez nich, w wodzie poruszaj ¹cej siê oraz po
jej ustabilizowaniu si ê po ok. 15 –20 sekun-
dach.
4. Po przeæwiczeniu dokonywania odczytu z
u¿yciem wody z kranu, do kub ³a z wod¹ wsy-
pujemy kilka gram ów materia³u gliniastego
i mieszamy.
5. Uczniowie dokonuj¹ nastêpnego pomiaru,
wlewaj¹c do cylindra wod ê zanieczyszczon¹
glin¹, a¿ do momentu zaniku wzoru na dnie,
nastêpnie zapisuj ¹ wynik w centymetrach.
Porównujemy wyniki otrzymane przez kilku
uczniów.
6. Do wody z kranu wlewamy kilka kropel zie-
lonego barwnika spo¿ywczego i powtarzamy
procedurê.
Badania hydrologiczne
Arkusz Ucznia
Uczeñ
Rodzaj próbki wody
w cm

GLOBE™
Dzia³ania poznawcze uczniów-18
Hydrologia
Stanowisko Badania
Temperatury
Wprowadzenie
Temperatura wody to temperatura tej cieczy
znajduj¹cej siê w okreœlonym zbiorniku, np. w
stawie, jeziorze, strumieniu lub studni, w wa
runkach naturalnych. Temperatura w ró¿nych
zbiornikach mo¿e siê zmieniaæ w du ¿ym za
kresie w zale¿noœci od takich czynnik ów jak
szerokoϾ geograficzna, wzniesienie nad
poziom morza, pora dnia i roku lub g ³êbo-
koϾ. Temperatura wody odgrywa bardzo
wa¿n¹ rolê we wszystkich procesach chemicz-
nych, fizycznych i biologicznych zachodz¹cych
w danym zbiorniku. Na przyk³ad wysoka tem-
peratura mo¿e œwiadczyæ o intensywnej pro-
dukcji roœlinnej. Temperatura determinuje
równie¿ ró¿norodnoœæ biologiczn¹ w zbiorni-
ku, gdy¿ ka¿dy gatunek ma okreœlone wyma-
gania i nie mo¿e ¿yæ w temperaturze wy¿szej
b¹dŸ ni¿szej od optymalnej dla danego gatun-
ku. Na podstawie temperatury mo ¿emy wiêc
wnioskowaæ o ¿yciu biologicznym w zbiorni-
ku, bez konieczno œci wykonywania wielu
innych skomplikowanych pomiarów.
Co robiæ i jak to robiæ
1. Postêpujemy zgodnie z procedur¹ opisan¹
w Protokóle Temperatury Wody, umo¿liwiaj¹c
ka¿demu uczniowi dokonanie pomiaru przy
u¿yciu tego samego termometru. Wcze œniej
upewniamy siê, czy ka ¿dy z uczni ów opano-
wa³ umiejêtnoœæ odczytywania termometru.
Porównujemy wyniki odczytów. Czy wszystkie
z nich nie r ó¿ni¹ si ê o wi êcej ni ¿ o 0,5 oC?
Dlaczego? Dlaczego nie? Je ¿eli ró¿nica jest
wiêksza, powtarzamy æwiczenie z nast êpn¹
próbk¹ wody a ¿ do otrzymania wszystkich
wyników pozostaj¹cych w przedziale 0,5oC.
2. Ka¿dy z cz³onków zespo³u uczniowskiego
dokonuje pomiaru temperatury próbki wody
korzystaj¹c z innego termometru. Porównuj¹
uzyskane wyniki. Czy r ó¿nica mi êdzy nimi
przekracza 0,5oC? Dlaczego? Dlaczego nie?
Je¿eli r ó¿nica jest wi êksza, termometry
wymagaj¹ skalibrowania.
3. Postêpuj¹c zgodnie z etapami pomiaru opi-
sanymi w protokole, mierzymy temperatur ê
w o d y z z i m n e g o i c i e p ³ e g o k r a n u , w o d y
zmieszanej z lodem oraz wody w stoj ¹cym
jakiœ czas kuble. Robimy wykaz tych r ó¿nor-
odnych pomiarów i wyniki zapisujemy.
4. Podejmujemy dyskusj ê o zakresie mo ¿li-
woœci pomiarowych ka¿dego z termometrów.
Czy mo¿na przy ich u¿yciu zmierzyæ tempera-
turê marzn¹cej wody? Dlaczego? Dlaczego
nie? Czy termometrem, kt óry trzymasz w
rêku mo¿esz zmierzyæ temperaturê wrz¹cej
wody? Dlaczego? Dlaczego nie?
Badania hydrologiczne
Arkusz Ucznia
Uczeñ
Rodzaj próbki wody
Temperatura

GLOBE™
Dzia³ania poznawcze uczniów-19
Hydrologia
Stanowisko Badania
Rozpuszczonego Tlenu
Wprowadzenie
Wszystkie ¿yj¹ce istoty potrzebuj ¹ tlenu do
przetrwania. W œrodowisku wodnym tlen
wystêpuje pod postaci ¹ rozpuszczonych w
wodzie cz¹steczek. W powietrzu, na ka ¿de
jego 100 cz ¹steczek przypada 20 cz ¹steczek
tlenu. W wodzie natomiast 1 do 5 cz ¹steczek
tlenu przypada na ka¿dy milion jej cz¹steczek
Z tego miêdzy innymi wzglêdu stê¿enie roz-
puszczonego w wodzie tlenu podajemy w ppm
(czêœci na milion). Zapotrzebowanie po-
szczególnych gatunków na tlen rozpuszczony
w wodzie jest zró¿nicowane, ale na ogó³ przyj-
muje siê, ¿e woda umo¿liwiaj¹ca egzystencjê
musi zawieraæ co najmniej 6 ppm.
IloϾ rozpuszczonego w wodzie tlenu (wartoϾ
„równowagi”) zale¿y od jej temperatury oraz
po³o¿enia wzglêdem poziomu morza. Na ogó³
w o d a c i e p l e j s z a z a w i e r a m n i e j t l e n u w
porównaniu z wod ¹ ch ³odn¹. Podobnie,
zbiorniki wodne le ¿¹ce w wysokich g órach
zawieraj¹ znacznie mniej rozpuszczonego tle-
nu w porównaniu z wod¹ znajduj¹c¹ siê bli¿ej
poziomu morza. Zale ¿noœci te s ¹ zawarte w
tabeli w protokole Rozpuszczonego Tlenu.
To w³aœnie jest przyczyn¹, ¿e w prot
okole u¿ywamy standardu wody destylowanej,
korygowanego przez temperaturê i wysokoœæ
nad poziom morza.Rzeczywista ilo Ͼ roz-
puszczonego w wodzie tlenu mo¿e byæ wiêk-
sza lub mniejsza od warto œci „równowagi”.
Bakterie ¿yj¹ce w wodzie zu ¿ywaj¹ tlen w
trakcie rozk³adu materii organicznej, co pro-
wadzi do obni¿enia jego stê¿enia w zbiorniku.
Natomiast ¿yj¹ce w wodach algi wytwarzaj ¹
tlen w procesie fotosyntezy, co z kolei pro-
wadzi do wiêkszego jego stê¿enia w zbiorni-
ku, szczególnie w lecie.
Co robiæ i jak to robiæ
1 . P o s t ê p u j ¹ c z g o d n i e z o p i s e m e t a p ó w
zawartych w Protokóle Rozpuszczonego Tlenu,
ka¿dy z cz³onków zespo³u wykonuje pomiar
rozpuszczonego tlenu tej samej próbki wody.
Uczniowie porównuj¹ uzyskane wyniki. Czy
wszystkie nie r ó¿ni¹ si ê o wi êcej ni ¿ o 0,2
mg/l? Dlaczego? Dlaczego nie? Je¿eli ró¿nica
jest wiêksza, powtarzamy æwiczenie z now ¹
próbk¹ wody tyle razy, a ¿ otrzymane wyniki
nie bêd¹ siê ró¿niæ o wiêcej ni¿ o 0,2 mg/l.
2. Je¿eli w kranie zamontowane jest urz¹dze-
nie napowietrzaj¹ce wodê, badanie wykonu-
jemy po nalaniu wody z tego kranu. Jedn ¹ z
próbek jest woda któr¹ nalano rano i pozosta-
wiona w kuble przez d ³u¿szy czas, drug¹ zaœ
woda któr¹ poddano zabiegowi utrwalenia
próbki. Zapisujemy czas pomiaru wody z
kub³a. Ile czasu up ³ynê³o od nape ³nienia
k u b ³ a w o d ¹ ? P o r ó w n u j e m y w y n i k i . C z y
ró¿ni¹ siê one miêdzy sob¹? Dlaczego? Dla-
czego nie? Co mog ³o byæ przyczyn¹ powsta-
nia ró¿nicy?
Badania hydrologiczne
Arkusz Ucznia
Uczeñ Rodzaj próbki wody Czas Rozpuszczony tlen
GLOBE™
Dzia³ania poznawcze uczniów-20
Hydrologia
Stanowisko Badania pH
Wprowadzenie
pH jest wska Ÿnikiem zawarto œci kwas ów w
wodzie. Skala pH obejmuje stopnie od 1
(kwas) do 14 (zasada), przy czym roztw ór o
pH 7 jest roztworem neutralnym. Ta skala
jest skal¹ logarytmiczn¹, st¹d te¿ zmiana o
jedn¹ jednostkê pH w rzeczywistoœci oznacza
dziesiêciokrotne zwiêkszenie lub zmniejsze-
nie koncentracji kwasów w roztworze. Zmia-
na odczynu z pH 7 do pH 6 oznacza dzie-
siêciokrotne zwiêkszenie zakwaszenia roz-
tworu, zmiana z pH 7 do pH 5 oznacza z kolei
a¿ stukrotne zwiêkszenie tego¿ zakwaszenia.
Im mniejsze pH, tym woda jest bardziej za-
kwaszona. Zakwaszenie zbiornika wodnego
wywiera du¿y wp³yw na ¿yj¹ce w nim organi-
zmy, przy czym bardzo wra¿liwe na niskie pH
s¹ w szczególnoœci osobniki niedojrza³e.
Co robiæ i jak to robiæ
1. Post êpuj¹c zgodnie z opisem etap ów w
Protokole pH, ka¿dy z uczniów przy pomocy
papierka lakmusowego bada odczyn tej samej
próbki wody. Uczniowie porównuj¹ uzyskane
wyniki. Czy r ó¿ni¹ si ê one mi êdzy sob ¹ o
wiêcej ni ¿ o 1,0 pH? Dlaczego? Dlaczego
nie? Je¿eli ró¿nica jest wi êksza, nale¿y æwi-
czenie powtarzaæ korzystaj¹c z innej pr óbki
w o d y , a ¿ d o u z y s k a n i a w y n i k ó w n i e
ró¿ni¹cych siê o wiêcej ni¿ o 1,0 pH.
2. Nie kalibruj ¹c uprzednio wska Ÿnika pH,
lecz zgodnie z zaleceniami zamieszczonymi w
Protokóle, uczniowie mierz¹ odczyn ró¿nych
próbek wody, a nastêpnie zapisuj¹ wyniki.
3. Po skalibrowaniu wskaŸnika pH powtarza-
my seri ê pomiar ów, zgodnie z procedur ¹
zawart¹ w protokole, staraj ¹c siê nie zanie-
czyœciæ próbki wody. Mo¿na równie¿ jednego
pomiaru dokonaæ instrumentem skalibrowa-
nym, drugiego za œ wskaŸnikiem przed kali-
bracj¹. Zapisujemy wyniki.
4. Por ównujemy wyniki uzyskane r ó¿nymi
metodami oraz dyskutujemy przyczyny pow-
stania ró¿nic.
5. Dokonujemy pomiaru pH takich pow-
szechnie spotykanych p³ynów jak destylowana
woda, rozpuszczony w wodzie ocet, woda z
kranu, mleko, sok owocowy, woda sodowa i
in. Ka ¿dego z tych pomiar ów dokonujemy
przy u¿yciu trzech metod: papierka lakmuso-
wego, wska Ÿnika pH skalibrowanego oraz
wskaŸnika pH bez kalibracji. Sporz ¹dzamy
wykaz przebadanych próbek, zapisujemy uzy-
skane r ó¿nymi metodami wyniki. Kt óra z
metod daje najdok³adniejsze wyniki? Która z
nich jest najbardziej wiarygodna?
6. Na utworzonej przez nas skali pH nanosi-
my œrednie wyniki ka¿dej z próbek.
Badania hydrologiczne
Arkusz Ucznia
Badana próbka Papierek lakmusowy WskaŸnik pH WskaŸnik pH
niekalibrowany skalibrowany
GLOBE™
Dzia³ania poznawcze uczniów-21
Hydrologia
Stanowisko Badania
Przewodnictwa Elektrycznego
Wprowadzenie
Przewodnictwo elektryczne jest miar ¹ zdol-
noœci wody do przewodzenia pr¹du elektrycz-
nego. Czysta woda jest s ³abym przewodni-
kiem elektrycznoœci. Wystêpuj¹ce w wodzie
zanieczyszczenia, takie jak np. rozpuszczona
sól, zwiêkszaj¹ jej mo ¿liwoœæ przewodzenia
pr¹du. Dziêki tym w³asnoœciom pomiary prze-
wodnictwa elektrycznego s¹ wykorzystywane
w celu oszacowania ilo œci rozpuszczonych w
wodzie substancji, gdy ¿ ta metoda jest ³at-
wiejsza w porównaniu z koniecznoœci¹ odpa-
rowania ca³ej wody i zwa ¿enia sta³ych pozo-
sta³oœci.
Jednostk¹ pomiarow¹ przewodnictwa elek-
trycznego jest mikroSiemens/cm. Niekt óre
wra¿liwe roœliny ulegaj¹ uszkodzeniu je ¿eli
pobieraj¹ wod ê charakteryzuj ¹c¹ si ê prze-
wodnictwem w granicach 2200 – 2600 mikro-
Siemensów/cm. W gospodarstwach domo-
wych zaleca si ê korzystanie z wody o prze-
wodnictwie mniejszym ni ¿ 1100 mikroSie-
mensów. W niektórych ga³êziach przemys³u,
np. w produkcji elektronicznej, wymagana
jest bardzo czysta woda.
Co robiæ i jak to robiæ
1. Post êpuj¹c zgodnie z opisem etap ów w
Protokóle Przewodnictwa Elektrycznego, ka¿dy
cz³onek zespo³u kolejno dokonuje pomiaru
tej samej próbki wody. Uczniowie porównuj¹
otrzymane wyniki. Czy r ó¿nica miêdzy nimi
jest wi êksza ni ¿ 40 mikroSiemens ów/cm?
Dlaczego? Dlaczego nie? Je¿eli jest wiêksza,
powtarzamy æwiczenie z inn ¹ próbk¹ wody
tak d³ugo, a¿ otrzymamy wyniki nie r ó¿ni¹ce
siê od siebie o wi êcej ni ¿ o 40 mikroSie-
mensów.
2. Bez uprzedniego skalibrowania kondukto-
metru, ale zgodnie z zaleceniami protok ó³u,
wykonujemy seriê pomiarów takich p ³ynów
jak woda destylowana, woda z kranu oraz
woda destylowana z dodatkiem szczypty soli.
Zapisujemy uzyskane wyniki.
3. Po przeprowadzeniu kalibracji kondukto-
metru powtarzamy pomiary zgodnie z proce-
dur¹ opisan ¹ w protokole, staraj ¹c si ê nie
dopuœciæ do zanieczyszczenia pr óbki wody.
Wyniki zapisujemy.
4. Porównujemy wyniki uzyskane przy u¿yciu
wskaŸnika przed kalibracj¹ oraz po jego skali-
browaniu. Czy wyst¹pi³y jakieœ ró¿nice? Dys-
kutujemy nad przyczynami zr ó¿nicowania
wyników. Czy kt óryœ z konduktometr ów
zawsze pokazuje wynik wy ¿szy od pozos-
ta³ych? Czy wielkoœæ ró¿nicy jest sta³a?
5. Mierzymy przewodnictwo powszechnie
spotykanych p ³ynów, takich jak np. ocet,
woda z kranu, woda sto ³owa, mleko, sok,
woda sodowa. Sporz ¹dzamy wykaz tych
p³ynów i zapisujemy odpowiadaj¹ce im wyniki
pomiarów.
6. Jaka jest skala zr ó¿nicowania wyników?
Na sporz ¹dzonym wykresie prezentujemy
wyniki charakterystyczne dla ka¿dej badanej
cieczy.
Badania hydrologiczne
Arkusz Ucznia
Rodzaj próbki wody
Konduktometr przed kalibracj¹
Konduktometr po kalibracji
Woda destylowana
Woda z kranu
Woda z sol¹

GLOBE™
Dzia³ania poznawcze uczniów-24
Hydrologia
Stanowisko Badania Azotanów
Wprowadzenie
Azot jest jednym z trzech g ³ównych sk ³ad-
ników pokarmowych roœlin. Wiêkszoœæ z nich
nie mo ¿e korzysta æ z azotu w jego formie
molekularnej (N2).W wodnych ekosystemach
niebiesko-zielone algi przekszta ³caj¹ N2 w
amoniak (NH3)lub azotany (NO 3), czyli w
formy przyswajalne dla ro œlin. Zwierz êta
¿ywi¹ce siê roœlinami otrzymuj¹ w ten sposób
azot niezbêdny do budowy bia³ek. Po œmierci
roœliny lub zwierzêcia, cz¹steczki bia³ka pod
wp³ywem bakterii przekszta³caj¹ siê w amo-
niak. Inne bakterie przekszta ³caj¹ z kolei
amoniak w azotany lub azotyny.
W normalnych warunkach na og ó³ poziom
azotu w wodzie nie przekracza 1 ppm azotu
azotanowego. Azot uwolniony z rozk³adaj¹cej
siê materii organicznej jest natychmiast
pobierany przez ro œliny. W wodach zawie-
raj¹cych du¿o azotu mo¿e rozwijaæ siê proces
eutrofizacji. Poziom azotu mo¿e wzrastaæ na
skutek przyczyn naturalnych jak i wywo³anych
dzia³alnoœci¹ cz³owieka.
• ród³em azotu mo¿e byæ hodowla kaczek lub
gêsi w s¹siedztwie zbiornika, œcieki dostaj¹ce
siê do rzek i jezior, nawozy sztuczne wymy-
wane z p ól oraz gnojowica wyp ³ywaj¹ca z
obór. Poziom azotu mierzymy w miligramach
na litr azotu azotanowego.
Co robiæ i jak to robiæ
1. Post êpuj¹c zgodnie z opisem etap ów w
Protokole Azotan ów, mierzymy ilo œæ azo-
tanów w próbce wody. Porównujemy wyniki
otrzymane przez kilku uczni ów. Czy ró¿nica
miêdzy nimi przekracza 0,2 mg/l? Je ¿eli tak,
dyskutujemy nad przyczynami b ³êdu. Czyn-
noœci powtarzamy a¿ do uzyskania wynik ów
nie ró¿ni¹cych siê o wiêcej ni¿ o 0,2 mg/l.
2. Czynnoœci pomiarowe powtarzamy, z tym
¿e t ¹ sam ¹ wod ¹ potrz ¹samy przez okres
po³owy czasu przewidzianego w protokole.
3. Czynno œci pomiarowe powtarzamy raz
jeszcze, z tym ¿e wod ê badamy po up ³ywie
piêciu minut ponad czas przewidziany proto-
ko³em.
4 . M i e r z y m y i l o œ æ a z o t a n ó w w r ó ¿ n y c h
próbkach wody, np. pobranej na polu golfo-
w y m , w s t a w i e , r z e c e , z b i o r n i k u i t p .
Sporz¹dzamy wykaz Ÿróde³ pochodzenia
wody i zapisujemy ka¿dy z wyników.
5. Do próbki wody dodajemy kilka ziarenek
nawozu sztucznego. Powtarzamy pomiar. Czy
pojawi³a siê ró¿nica w wynikach?
6. Inicjujemy dyskusj ê nad mo ¿liwymi przy-
czynami obecnoœci azotu w wodzie.
Badania hydrologiczne
Arkusz Ucznia
Pobrana próbka
Wynik
Uczeñ

GLOBE™
Dzia³ania poznawcze uczniów-23
Hydrologia
Stanowisko Badania
Zasadowoœci
Wprowadzenie
Zasadowoœæ jest miar ¹ oporu wody przed
skutkami wprowadzenia do niej substancji
zawieraj¹cych kwasy. Kwasy do wody dostaj¹
siê wraz z opadami, lub te ¿, na pewnych
obszarach, ich Ÿród³em mo ¿e by æ gleba.
• ród³em zasadowo œci jest rozpuszczanie
przez wod ê ska ³ zawieraj ¹cych kalcyt, np.
wapieni. Zasadowo œæ jest form ¹ ochrony
¿ywych organizmów wodnych przed nag³ymi
zmianami pH.
Co robiæ i jak to robiæ
1. Postêpuj¹c zgodnie z etapami opisanymi w
Protokole Zasadowoœci, ka¿dy z cz³onków gru-
py kolejno dokonuje pomiaru zasadowo œci
próbki wody pobranej z kranu. Czy wyniki
pomiaru ró¿ni¹ siê o wiêcej ni¿ o jedn¹ kro-
plê lub jedn ¹ jednostkê przy miareczkowa-
niu? Dlaczego? Dlaczego nie? Je¿eli ró¿nica
jest wi êksza, powtarzamy pomiary z wyko-
rzystaniem nastêpnej próbki wody z kranu.
2. Sprawdzamy zasadowo œæ innych pr óbek
wody przyniesionych do klasy. Sporz ¹dzamy
w y k a z p r ó b e k w o d y o r a z o t r z y m a n y c h
wyników.
Porównujemy zasadowo œæ r ó¿nych pr óbek
wody. Czy wyniki s¹ zró¿nicowane? Co mo¿e
byæ przyczyn¹ tego zró¿nicowania?
Badania hydrologiczne
Arkusz Ucznia
Uczeñ
Próbka wody
Wynik
Za³¹czniki
Arkusz obserwacji
Arkusz Danych Roboczych Kalibracji
S³owniczek
Arkusze przekazywania danych do
Internetu
GLOBE™
Za³¹czniki-1
Hydrologia

Badania hydrologiczne
Nazwa szko³y: _________________________________________________________________________
Grupa uczniów: ________________________________________________________________________
Nazwa miejsca badañ: ___________________________________________________________________
Pobrana próbka – data : _______ czas: _______ (godz i min.) wybierz jeden: UT___ czas lokalny ___
PrzezroczystoϾ
Stopieñ zachmurzenia (wybierz jeden): ____ bezchmurne ____ rozproszone ____ du¿e ____ pe³ne
Kr¹¿ek Secchiego:
Obserwator 1: d³. liny: kiedy kr¹¿ek znika: ______ m kiedy kr¹¿ek siê pojawia: ______ m
Odleg³oœæ od miejsca oznaczonego przez obserwatora na linie do powierzchni wody: ___________ m
Obserwator 2: d³. liny: kiedy kr¹¿ek znika: ______ m kiedy kr¹¿ek siê pojawia: ______ m
Odleg³oœæ od miejsca oznaczonego przez obserwatora na linie do powierzchni wody ___________ m
Obserwator 3: d³. liny: kiedy kr¹¿ek znika: ______ m kiedy kr¹¿ek siê pojawia: ______ m
Odleg³oœæ od miejsca oznaczonego przez obserwatora na linie do powierzchni wody ___________ m
Cylinder do pomiaru zmêtnienia:
Wysokoœæ s³upa wody w cylindrze kiedy obraz znika:
Obserwator 1: ______ cm Obserwator 2: ______ cm Obserwator 3: ______ cm
Temperatura wody
Obserwator 1: ______
oC Obserwator 2: ______ oC Obserwator 3: ______ oC Œrednia: _______
oC
Rozpuszczony tlen
Obserwator 1: ______ mg/l Obserwator 2: ______ mg/l Obserwator 3: ______ mg/l Œrednia: _______mg/l
Rodzaj zestawu badawczego i nazwa producenta:__________________________________________
pH
Metoda pomiaru: _____papier _____pehapen (wskaŸnik pH) _____ pehametr
WartoϾ roztworu buforowego pH 4: ______ pH 7: _______ pH 10: ______
Obserwator 1: ______ Obserwator 2: ______ Obserwator 3: ______
Œrednia: _______
Przewodnictwo elektryczne
Przewodnictwo roztworu standardowego: _________ microSiemensów/cm (mS/cm)
Obserwator 1:_____ mS/cm Obserwator 2:_____ mS/cm Obserwator 3: _____ mS/cm Œrednia:______mS/cm
Arkusz obserwacji
GLOBE™
Za³¹czniki-2
Hydrologia

arkusz obserwacji (strona 2)
Zasolenie
Zasolenie(metoda areometryczna)
Obserwator 1 Obserwator 2 Obserwator 3
Temperatura wody w menzurce: ________ oC ________ oC ________
oC
Gêstoœæ:
________ ________
________
Zasolenie wody:
________ ppt ________ ppt ________ ppt
Zasolenie – wart. œrednia: ________ ppt
ZasadowoϾ
Zestawy mierz¹ce zasadowoœæ bezpoœrednio
Obserwator 1: ____ mg/l CaCO
3
Obserwator 2: ____ mg/l CaCO
3
Obserwator 3: ____ mg/l as CaCO
3
Œrednia: ______ mg/l as CaCO
3
Zestaw badawczy Hach lub inny w którym liczymy krople:
Obserwator 1
Obserwator 2
Obserwator 3
Œrednia
Liczba kropli _______kropli _______ kropli _______kropli _______ kropli
Wspó³czynnik: x______
x______ x______
x______
ZasadowoϾ (mg/l CaCO
3
) =______mg/l =_____ mg/l
=______mg/l =______ mg/l
Rodzaj zestawu badawczego i nazwa producenta:__________________________________________
Azotany
Obserwator 1: ______ mg/l NO
3
-
- N + NO
2
-
- N ______ mg/l NO
2
-
- N
Obserwator 2: ______ mg/l NO
3
-
- N + NO
2
-
- N ______ mg/l NO
2
-
- N
Obserwator 3: ______ mg/l NO
3
-
- N + NO
2
-
- N ______ mg/l NO
2
-
- N
Œrednia: ______ mg/l NO
3
-
- N + NO
2
-
- N ______ mg/l NO
2
-
- N
Rodzaj zestawu badawczego i nazwa producenta:______________________________
GLOBE™
Za³¹czniki-3
Hydrologia

Nazwa szko³y: _____________________________________________________________________
Grupa uczniów: _____________________________________________________________________
Data: _______
Rozpuszczony tlen:
Temperatura wody destylowanej: ______oC; WysokoϾ n.p.m.: _____metry
Rozpuszczony tlen we wstrzaœniêtej wodzie destylowanej:
Obserwator 1: _____ mg/l Obserwator 2: _____ mg/l Obserwator 3: _____ mg/l Œrednia: ______mg/l
dla danej temp. na poziomie morza dla danej wysokoœci dla wzorcowej wody
z Tabeli 1.
z Tabeli 2. destylowanej:
______________mg/l x _____________ = _________mg/l
Rodzaj zestawu badawczego i nazwa producenta:_________________________________________________
Zasolnie
Standard zasolenia: Obserwator 1: ______ ppt Obserwator 2: ______ ppt Obserwator 3: ______ ppt
Zasolenie – wart. œrednia: ______ ppt
Rodzaj zestawu badawczego i nazwa producenta:__________________________________________
ZasadowoϾ
Dla standardowego roztworu sodowego
Dla zestawu odczytuj¹cego zasadowoœæ bezpoœrednio
Obserwator 1: ____ mg/l CaCO3 Obserwator 2: ____ mg/l CaCO3 Observer 3: ____ mg/l CaCO3
Œrednia: ______ mg/l CaCO 3
Zestaw badawczy Hach lub inny w którym liczymy krople:
Obserwator 1 Obserwator 2 Obserwator 3 Œrednia
Liczba kropli _______kropli _______ kropli _______kropli _______ kropli
Wspó³czynnik: x______ x______ x______ x______
ZasadowoϾ (mg/l CaCO 3 )=______mg/l =_____ mg/l =______mg/l =______ mg/l
Rodzaj zestawu badawczego i nazwa producenta:_____________________________________________
Azotany
Obserwator 1: ____ mg/l NO 3
-
- N Obserwator 2: ____ mg/l NO3
-
- N Obserwator 3: ____ mg/l NO3
-
- N
Œrednia: ____ mg/l NO 3
-
- N
Rodzaj zestawu badawczego i nazwa producenta:______________________________________________
Badania hydrologiczne
Arkusz Danych Roboczych Kalibracji
GLOBE™
Za³¹czniki-4
Hydrologia
Rozpuszczalnoœæ tlenu w wodzie Wspó³czynnik kalibracji Spodziewana wartoœæ
Badania hydrologiczne
Arkusz przekazywania danych
Nazwa szko³y
Czas pomiaru:
Rok:
Miesi¹c:
Dzieñ:
Godzina:
UT
Czas bie¿¹cy:
1997 June 18, 20 UT
Nazwa miejsca badañ:
Nale¿y utworzyæ unikaln¹ nazwê miejsca badañ.
Proszê przekazaæ wszystkie dostêpne aktualnie informacje. W przypadku dodatkowych informacji
nale¿y "kikn¹æ" Entry buton
i przejϾ do "Edit a Study Site".
• ród³o danych:
GPS
inne
Szer. geogr. :
st.
min pó³nocna
po³udniowa
(dane nale¿y wprowadzaæ w formacie: 56 deg 12.84 min oraz zaznaczyæ czy jest to na pó³nocna czy
na po³udniowa od równika)
D³. geogr.:
st.
min
wschodnia
zachodnia
Wzniesienie n.p.m.:
w metrach
Klasyfikacja wody z której zosta³a pobrana próbka
Rodzaj wody:
s³ona
s³odka
Wody p³yn¹ce:
strumieñ rzeka inne
Przybli¿ona szerokoœæ dla wód p³yn¹cych:
w metrach
Wody stoj¹ce:
staw jezioro
zbiornik
inne
Wielkoœæ wody stoj¹cej:
mniejsza ni¿ 50m x 100m (boisko) w przybli¿eniu 50m x 100m (wielkoœæ boiska)
wiêksza ni¿ 50m x 100m (boisko)
Je¿eli wiadomo: przybli¿ona powierzchnia wody stoj¹cej
km2, œrednia g³êbokoœæ wody stoj¹cej
m
Lokalizacja:
ujœcie
brzeg
most
³ódka
dop³yw
PrzezroczystoϾ:
czysta mêtna
nie wiem
Czy dno jest widoczne?
tak nie
Brzeg:
gleba
ska³a
beton pokryty roœlinnoœci¹
Koryto zbudowane z:
granitu ska³ wapiennych
ska³ wulkanicznych
osadowych nie wiem
Zestaw do badania rozopuszczonego tlenu
Producent:
LaMotte
Hach
inne
do wyboru
GLOBE™
Za³¹czniki-5
Hydrologia
(dane nale¿y wprowadzaæ w formacie: 21 deg 15.50 min oraz zaznaczyæ czy jest to na wschód czy
zachód od po³udniaka zerowego)
Nazwa modelu:

Zestaw do badania zasadowoœci
Producent:
LaMotte
Hach
Inny
Nazwa modelu:
Wspó³czynnik:
Zestaw do badania azotu
Producent:
LaMotte
Hach
Inny
Nazwa modelu:
Zestaw do badania zasolenia
Producent:
LaMotte
Hach
Inny
Nazwa modelu:
NOAA/Forecast Systems Laboratory, Boulder,Colorado
GLOBE™
Za³¹czniki-6
Hydrologia

Czas pomiaru:
Rok:
Miesi¹c:
Dzieñ:
Godzina:
UT
Czas bie¿¹cy
: July 13, 1997, 16 UT
Lokalizacja miejsca obserwacji:
• ród³o wody:
PRZEZROCZYSTOή
Stopieñ zachmurzenia:
bezchmurne
rozproszone
du¿e pe³ne
Wype³nij dane poni¿ej, w zale¿noœci od tego czy u¿ywasz kr¹¿ka Secchiego czy cylindra
do pomiaru zmêtnienia.
Pierwszy test:
D³ugoœæ liny kiedy kr¹¿ek znika (m):
D³ugoœæ kiedy kr¹¿ek siê pojawia (m):
Odleg³oœæ od miejsca oznaczonego przez obserwatora na linie do pow. wody:
metry
Drugi test:
D³ugoœæ liny kiedy kr¹¿ek znika (m):
D³ugoœæ kiedy kr¹¿ek siê pojawia (m):
Odleg³oœæ od miejsca oznaczonego przez obserwatora na linie do pow. wody:
metry
Trzeci test:
D³ugoœæ liny kiedy kr¹¿ek znika (m):
D³ugoœæ kiedy kr¹¿ek siê pojawia (m):
Odleg³oœæ od miejsca oznaczonego przez obserwatora na linie do pow. wody:
metry
Cylinder do pomiaru zmêtnienia:
Uwaga: Je¿eli wzór na dnie cylindra znika przed jego ca³kowitym wype³nieniem wod¹ wprowadŸ wyskoœæ s³upa wody
Je¿eli nie, podaj ca³kowit¹ wusokoœæ cylindra.
Test 1 (cm):
Wiêksza ni¿ wysokoœæ cylindra?
Test 2 (cm):
Wiêksza ni¿ wysokoœæ cylindra?
Test 3 (cm):
Wiêksza ni¿ wysokoœæ cylindra?
TEMPERATURA WODY
Temperatura wody:
o
C
ROZPUSZCZONY TLEN
Œrednia zawartoœæ rozpuszczonego tlenu w próbce wody:
mg/l (ekwiwalent ppm)
ODCZYN pH
Odczyn pH:
mierzony przy pomocy
PRZEWODNICTWO
Œrednia wartoœæ przewodnictwa elektrycznego:
mikroSiemensy/cm
do wyboru
w³asna nazwa
do wyboru
do wyboru
GLOBE™
Za³¹czniki-7
Hydrologia

WprowadŸ dane poni¿ej, w zale¿noœci od tego czy u¿ywasz areometru czy metody miareczkowania.
Metoda areometryczna:
Temperatura próbki wody w 500 ml cylindrze (
o
C):
Gêstoœæ próbki wody:
Zasolenie próbki wody:
ppt
Œrednie wartoœæ zasolenia próbki wody:
ppt
Zasolenie badane metod¹ miareczkowania:
Zasolenie próbki wody:
ppt
ZASADOWOή
Œrednia zasadowoœæ próbki wody:
mg/l jako CaCO3
AZOT
Œrednia zawartoœæ azotanów i azotynów w próbce wody:
mg/l azot azotynowy + azot azotanowy
e
Œrednia zawartoœæ azotynów w próbce wody:
mg/l azot azotynowy
Uwagi:
NOAA/Forecast Systems Laboratory, Boulder,Colorado
GLOBE™
Za³¹czniki-8
Hydrologia
ZASOLENIE
S³owniczek
aerozole
Sta³e lub p³ynne cz¹steczki rozpuszczone lub
zawieszone w powietrzu
azotany
Sole kwasu azotowego HNO3, rozpuszczalne
w wodzie, mog¹ byæ zredukowane do azotynów
lub amoniaku
azot azotanowy
Jest to ogólna zawartoœæ azotu wchodzacego w
sk³ad zwi¹zków azotanowych obecnych w wo-
dzie
azot azotynowy
Jest to ogólna zawartoœæ azotu wchodz¹cego w
sk³ad zwi¹zków azotynowych w wodzie
buforowy roztwór
Roztwór o sta³ym stê¿eniu jonów wodorowych
(sta³ym pH), s³u¿¹cy do kalibrowania instru-
mentów s³u¿¹cych do pomiaru odczynu
dok³adnoœæ
Miara bliskoœci wartoœci pomierzonej do war-
toœci rzeczywistej
eutrofizacja
gromadzenie siê w œrodowisku wodnym sub-
stancji pokarmowych w iloœciach przekrac-
zaj¹cych mo¿liwoœci ich zu¿ycia lub rozk³adu
przez organizmy
ewaporacja (parowanie)
Parowanie z gleby lub wody przeliczone na jed-
nostkê powierzchni i jednostkê czasu
fotosynteza
Proces syntezy zwi¹zków organicznych z CO2 i
H2O kosztem energii œwietlnej poch³anianej
przez barwniki asymilacyjne i przeksztalconej
w energiê chemiczn¹
gêstoœæ
Stosunek masy substancji do jej objetoœci
hipoteza
przypuszczenie naukowe wysuniête dla obja-
œnienia jakiegoœ zjawiska lub szeregu zjawisk,
wymagaj¹ca sprawdzenia i potwierdzenia, aby
mog³a stac siê wiarygodnym prawem nauki
in situ
W pierwotnym po³o¿eniu, miejscu (³ac.)
kwas
Ka¿da substancja która mo¿e przekazaæ atom
wodoru lub proton (H
+
) ka¿dej innej sub-
stancji
kwaœny deszcz
Opad charakteryzuj¹cy siê odczynem ni¿szym
ni¿ pH 6
kwaœny
Charakteryzuje siê odczynem ni¿szym ni¿ pH 7
koncentracja bazowa (t³o)
Poziom stê¿enia zwi¹zków chemicznych obec-
nych w wodzie z powodu przyczyn naturalnych,
bez wzglêdu na dzia³alnoœæ cz³owieka
kalibrowanie
Ustawianie lub sprawdzanie instrumentów
pomiarowych przy pomocy znanych, sta³ych
wskaŸników standardowych
kolometryczna metoda
Oznaczenie kolorymetryczne polega na doda-
niu do badanej próby odpowiedniego indyka-
tora i porównaniu otrzymanego zabarwienia ze
skal¹ wzorców, np. w kompaktorze
mol
Jednostka podstawowa licznoœci (iloœci) sub-
stancji w uk³adzie SI
moleku³a (cz¹steczka)
Najmniejsza iloœæ pierwiastka lub zwi¹zku
chemicznego zachowuj¹ca wszelkie jego
fizyczne i chemiczne w³asnoœci
neutralny
o odczynie = pH 7
pH
Symbol ten oznacza logarytm st ê¿enia jonów
wodorowych (H
+
) ze znakiem ujemnym
ppm
Miara stê¿enia (jedna czêœæ na milion); w Pro-
gramie GLOBE odpowiednik miligrama na litr
ppt
Miara stê¿enia (jedna czêœæ na tysi¹c – promil)
przewodnictwo elektryczne
Wielkoœæ fizyczna charakteryzuj¹ca zdolnoœæ
cia³ do przewodzenia pr¹du elektrycznego. W
przypadku wody zale¿y ono od koncentracji
rozpuszczonych soli (jonów), rodzajów jonów
oraz temperatury roztworu
tlen rozpuszczony
Tlen znajduj¹cy siê w wodzie naturalnej w
postaci rozpuszczonych cz¹steczek. Jego
zawartoœæ w wodzie zale¿y od wielu para-
metrów np. od temperatury – w wodzie zimnej
rozpuszcza siê wiêcej tlenu w porównaniu z
wod¹ ciep³¹. Rozpuszczalnoœæ tlenu w wodzie
zale¿y rónie¿ od ciœnienia i zasolenia; zasolenie
zmniejsza zdolnoϾ wody do rozpuszczania tlenu
zasadowy
Charakteryzuje siê odczynem wiêkszym ni¿
pH7
GLOBE™
Za³¹czniki-9
Atmosfera
Wyszukiwarka
Podobne podstrony:
Course hydro pl 1
Course hydro pl 1
Hydro boost device Pl
download Zarządzanie Produkcja Archiwum w 09 pomiar pracy [ www potrzebujegotowki pl ]
Wyklad 6 Testy zgodnosci dopasowania PL
WYKŁAD PL wersja ostateczna
PERFORMANCE LEVEL, PL
struktura organizacyjna BTS [ www potrzebujegotowki pl ]
wyklad 2 Prezentacja danych PL
2a esperienza haccp PL
Sesja 58 pl 1
3a prerequisiti PL
animeo solo PL ext
wyklad 6 Testy zgodnosci dopasowania PL
Sesja 34 pl 1
więcej podobnych podstron