
Konkursy w województwie podkarpackim w roku szkolnym 2005/2006
Strona 1 z 10
....................................
kod pracy ucznia
.............................................
pieczątka nagłówkowa szkoły
PRZEDMIOTOWY KONKURS CHEMICZNY
DLA UCZNIÓW GIMNAZJÓW
ETAP SZKOLNY
Drogi Uczniu,
witaj na I etapie konkursu chemicznego. Przeczytaj uważnie instrukcję i postaraj się
prawidłowo odpowiedzieć na wszystkie pytania.
•
Arkusz liczy 10 stron i zawiera 25 zadań.
•
Przed rozpoczęciem pracy sprawdź, czy Twój test jest
kompletny. Jeżeli zauważysz usterki, zgłoś komisji
konkursowej.
•
Zadania czytaj uważnie i ze zrozumieniem.
•
Pisz tylko czarnym lub niebieskim długopisem lub piórem.
•
W każdym zadaniu podane są cztery odpowiedzi: A, B, C, D.
Tylko jedna jest poprawna.
•
Wybierz ją i wpisz znak X zaznaczając odpowiednią literę
w teście.
•
Staraj się nie popełnić błędów przy zaznaczaniu odpowiedzi,
ale jeżeli się pomylisz, otocz błędną odpowiedź kółkiem
i zaznacz inną.
•
Nie używaj korektora i kalkulatora.
•
Możesz korzystać z tablic dołączonych do zestawu zadań.
•
Brudnopis nie podlega ocenie.
Pracuj samodzielnie
.
Powodzenia!
Czas pracy:
60 minut
Liczba punktów
możliwych
do uzyskania:
25

Konkursy w województwie podkarpackim w roku szkolnym 2005/2006
Strona 2 z 10
Zadanie 1. (0-1 pkt)
Atomowa jednostka masy jest równa 0,166 x
10
-23
g. Masa cząsteczki azotu wynosi:
A. 14 u
B. 2,324
.
10
-23
g
C. 4,648
.
10
-23
u
D. 4,648
.
10
-23
g
Zadanie 2. (0-1 pkt)
O tym, jaki to pierwiastek decyduje:
A. liczba elektronów walencyjnych
B. liczba masowa
C. liczba protonów w jądrze atomu
D. liczba neutronów w jądrze atomu
Zadanie 3. (0-1 pkt)
Izotopy to atomy tego samego pierwiastka różniące się :
A. liczbą protonów
B. liczbą neutronów
C. liczbą elektronów
D. odpowiedzi A i B są poprawne
Zadanie 4. (0-1 pkt)
Jądra najcięższych izotopów są:
A. zazwyczaj nietrwałe
B. zazwyczaj trwałe
C. ulegają rozpadowi promieniotwórczemu
D. odpowiedzi A i C są poprawne
Zadanie 5. (0-1 pkt)
Do klasyfikacji metali nie można zastosować jednego z wymienionych kryteriów :
A. przewodnictwo cieplne
B. przewodnictwo elektryczne
C. twardość
D. rozpuszczalność w wodzie

Konkursy w województwie podkarpackim w roku szkolnym 2005/2006
Strona 3 z 10
Zadanie 6. (0-1 pkt)
Amalgamat to stop:
A. srebra z rtęcią
B. sodu z rtęcią
C. żelaza z rtęcią
D. odpowiedzi A i B są prawidłowe
Zadanie 7. (0-1 pkt)
Którą z wymienionych substancji należy podziałać na blaszkę żelaza, aby
otrzymać jony żelaza:
A. zasadą sodową
B. gorącym powietrzem
C. tlenkiem żelaza
D. rozcieńczonym kwasem solnym
Zadanie 8. (0-1 pkt)
Odważono po 1g czterech gazów: wodoru, tlenu, azotu, tlenku węgla(IV).
Najmniejszą objętość zajął :
A. azot
B. tlenek węgla (IV)
C. tlen
D. wodór
Zadanie 9. (0-1 pkt)
Z 22,4dm
3
tlenu (mierzonego w warunkach normalnych) całkowicie
przereaguje:
A. 2g wodoru
B. 4g wodoru
C. 44,8 dm
3
wodoru
D. odpowiedzi B i C są prawidłowe

Konkursy w województwie podkarpackim w roku szkolnym 2005/2006
Strona 4 z 10
Zadanie 10. (0-1 pkt)
Do całkowitego spalenia 3g węgla wystarczy 5,6dm
3
tlenu. 3g węgla ulegną
całkowitemu spaleniu w zamkniętym naczyniu wypełnionym powietrzem
o objętości :
A. 5,6 dm
3
B. 16,8dm
3
C. 20dm
3
D. 30dm
3
Zadanie 11. (0-1 pkt)
Zawartość procentowa tlenu w lapisie wynosi:
A. 28,2%
B. 63,5%
C. 8,2%
D. 60%
Zadanie 12. (0-1 pkt)
Rozpuszczalność cukru w temperaturze 70 o C wynosi 310g/100g H
2
O. W 82g
nasyconego roztworu w tej temperaturze znajduje się :
A. 22g cukru
B. 60g cukru
C. 20g wody
D. 60g wody
Zadanie 13. (0-1 pkt)
Oranż metylowy barwi się na kolor czerwony w :
A. czystej wodzie
B. roztworze wodorotlenku sodu
C. roztworze soli kamiennej
D. kwasie solnym

Konkursy w województwie podkarpackim w roku szkolnym 2005/2006
Strona 5 z 10
Zadanie 14. (0-1 pkt)
Podczas reakcji tlenku miedzi (II) z węglem otrzymano gaz, który wprowadzono
do wody wapiennej. Strącił się biały osad. Osad wysuszono i podziałano na
niego kwasem solnym. Zaczął gwałtownie wydzielać się gaz. Gazem tym jest:
A. chlorowodór
B. para wodna
C. tlenek węgla (II)
D. tlenek węgla (IV)
Zadanie 15. (0-1 pkt)
Na drewno padła kropla kwasu. Po chwili pojawiło się w tym miejscu brunatne
zabarwienie. Kwasem tym był:
A. stężony kwas solny
B. stężony kwas siarkowy (VI)
C. rozcieńczony kwas solny
D. rozcieńczony kwas siarkowy(VI)
Zadanie 16. (0-1 pkt)
Do probówki z tlenkiem miedzi (II) dodano kwasu siarkowego (VI) i mieszaninę
ogrzano. Które zdanie poprawnie opisuje obserwacje:
A. czarny osad zniknął, a roztwór przyjął barwę niebieską
B. tlenek miedzi (II) rozpuścił się w kwasie, wydzielał się bezbarwny gaz
C. czarny osad zmienił barwę na niebieską
D. nie zaszły widoczne zmiany
Zadanie 17. (0-1 pkt)
Podczas dysocjacji elektrolitycznej azotanu (V) potasu rozerwaniu ulega wiązanie
A. potas-azot
B. potas-tlen
C. azot-tlen
D. tlen-tlen

Konkursy w województwie podkarpackim w roku szkolnym 2005/2006
Strona 6 z 10
Zadanie 18. (0-1 pkt)
Z ilu jonów zbudowana jest cząsteczka fosforanu (V) magnezu:
A. 10
B. 2
C. 3
D. 5
Zadanie 19. (0-1 pkt)
Jakie jony pozostaną w roztworze po zmieszaniu roztworu azotanu(V) srebra
z roztworem kwasu solnego, gdy oba roztwory zawierają taką samą liczbę
cząsteczek:
A. kationy srebra i aniony azotanowe (V)
B. kationy wodoru i aniony chlorkowe
C. kationy srebra i aniony chlorkowe
D. kationy wodoru i aniony azotanowe (V)
Zadanie 20. (0-1 pkt)
Jeżeli do 2 moli H
2
SO
4
wprowadzi się 2 mole NaOH to odczyn powstałego
roztworu będzie:
A. zasadowy
B. obojętny
C. kwaśny
D. kwaśny, ale po ogrzaniu zmienia się na obojętny
Zadanie 21. (0-1 pkt)
Aby otrzymać 48% roztwór kwasu siarkowego (VI) z roztworu tego kwasu
o stężeniu 96% i o gęstości d=1,836g
.
cm
-3
, nie należy:
A. do 100g wody dodać 100 g kwasu
B. do 200g wody dodać 200g kwasu
C. do 50g kwasu dodać 50g wody
D. do 300 cm
3
wody dodać 300g kwasu

Konkursy w województwie podkarpackim w roku szkolnym 2005/2006
Strona 7 z 10
Zadanie 22. (0-1 pkt)
Roztwór kwasu rozcieńczono niewielką ilością wody. Jakie jest pH roztworu
rozcieńczonego:
A. 7
B. mniejsze niż 7
C. większe niż 7
D. 6
Zadanie 23. (0-1 pkt)
Podczas wykonywania doświadczeń zawsze należy zachować ostrożność.
W którym zestawie znajdują się substancje szczególnie niebezpieczne
w bezpośrednim kontakcie:
A. brom, azot, fosfor biały
B. fosfor biały, brom, chlor
C. chlor, brom, siarka
D. wodór, chlor, azot
Zadanie 24. (0-1 pkt)
Uzdatnianie wody to szereg etapów i metod. Metodami chemicznymi są:
A. filtracja
B. adsorpcja na węglu aktywnym
C. chlorowanie i ozonowanie
D. gotowanie
Zadanie 25. (0-1 pkt)
Ochrona powietrza to obowiązek każdego z nas. Emisji zanieczyszczeń
powietrza nie można ograniczyć przez:
A. montaż filtrów na kominach
B. odsiarczanie węgla
C. stosowanie benzyny bezołowiowej
D. stosowanie benzyny ołowiowej

Konkursy w województwie podkarpackim w roku szkolnym 2005/2006
Strona 8 z 10
BRUDNOPIS
(nie podlega ocenie)
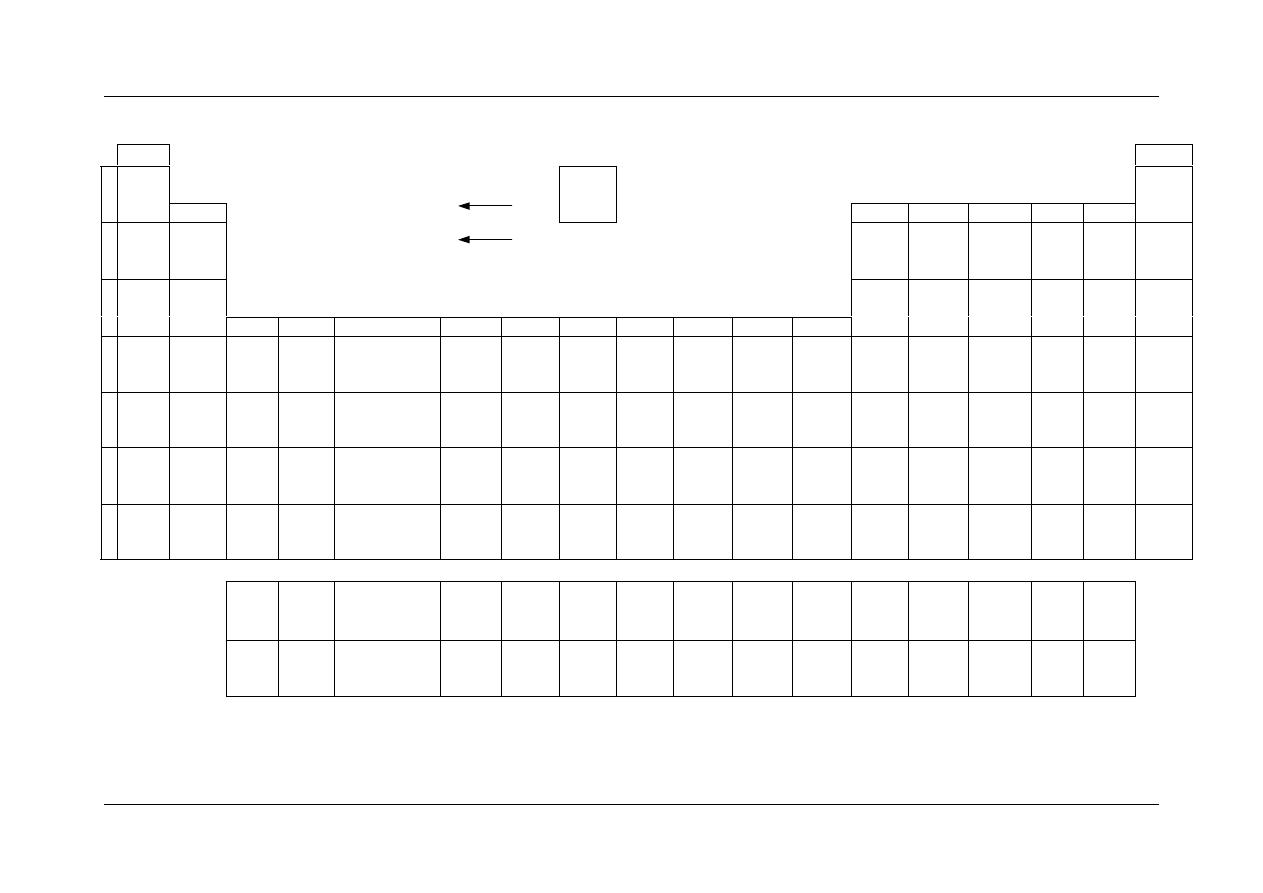
Konkursy w województwie podkarpackim w roku szkolnym 2005/2006
U
K Ł A D O K R E S O W Y P I E R W I A S T K Ó W C H E M I C Z N Y C H
1
18
1
1
H
wodór
1,01
2
12
Mg
magnez
24,31
13
14
15
16
17
2
He
hel
4,0
2
3
Li
lit
6,94
4
Be
beryl
9,01
5
B
bor
10,81
6
C
węgiel
12,01
7
N
azot
14,01
8
O
tlen
16,0
9
F
fluor
19,0
10
Ne
neon
20,18
3
11
Na
sód
22,99
12
Mg
magnez
24,31
3
4
5
6
7
8
9
10
11
12
13
Al
glin
26,98
14
Si
krzem
28,09
15
P
fosfor
30,97
16
S
siarka
32,06
17
Cl
chlor
35,45
18
Ar
argon
39,95
4
19
K
potas
39,10
20
Ca
wapń
40,08
21
Sc
skand
44,96
22
Ti
tytan
47,88
23
V
wanad
50,94
24
Cr
chrom
51,99
25
Mn
mangan
54,94
26
Fe
ż
elazo
55,85
27
Co
kobalt
58,93
28
Ni
nikiel
58,69
29
Cu
miedź
63,55
30
Zn
cynk
65,38
31
Ga
gal
69,72
32
Ge
german
72,59
33
As
arsen
74,92
34
Se
selen
78,96
35
Br
brom
79,9
36
Kr
krypton
83,8
5
37
Rb
rubid
85,47
38
Sr
stront
87,62
39
Y
itr
88,91
40
Zr
cyrkon
91,22
41
Nb
niob
92,91
42
Mo
molibden
95,94
43
Tc
technet
96,90
44
Ru
ruten
101,07
45
Rh
rod
102,91
46
Pd
pallad
106,42
47
Ag
srebro
107,87
48
Cd
kadm
112,41
49
In
ind
114,82
50
Sn
cyna
118,69
51
Sb
antymon
121,75
52
Te
tellur
127,60
53
I
jod
126,91
54
Xe
ksenon
131,29
6
55
Cs
cez
132,91
56
Ba
bar
137,33
La-Lu
57-71
72
Hf
hafn
178,49
73
Ta
tantal
180,95
74
W
wolfram
183,85
75
Re
ren
186,21
76
Os
osm
190,2
77
Ir
iryd
192,2
78
Pt
platyna
195,08
79
Au
złoto
196,97
80
Hg
rtęć
200,59
81
Tl
tal
204,38
82
Pb
ołów
207,2
83
Bi
bizmut
208,98
84
Po
polon
208,98
85
At
astat
209,99
86
Rn
radon
222,02
7
87
Fr
frans
223,02
88
Ra
rad
226,03
Ac-Lr
89-103
104
Rf
rutherford
261,1
105
Db
dubn
262,11
106
Sg
seaborg
263,12
107
Bh
bohr
262,12
108
Hs
has
265,1
109
Mt
meitner
266,1
110
Uun
111
Uuu
112
Uub
114
Uuq
57
La
lantan
138,91
58
Ce
cer
140,12
59
Pr
prazeodym
140,91
60
Nd
neodym
144,24
61
Pm
promet
144,91
62
Sm
samar
150,36
63
Eu
europ
151,96
64
Gd
gadolin
157,25
65
Tb
terb
158,93
66
Dy
dysproz
162,5
67
Ho
holm
164,93
68
Er
erb
167,26
69
Tm
tul
168,93
70
Yb
iterb
173,04
71
Lu
lutet
174,97
89
Ac
aktyn
227,03
90
Th
tor
232,04
91
Pa
protaktyn
231,04
92
U
uran
238,03
93
Np
neptun
237,05
94
Pu
pluton
244,06
95
Am
ameryk
243,06
96
Cm
kiur
247,07
97
Bk
berkel
247,07
98
Cf
kaliforn
251,08
99
Es
einstein
252,08
100
Fm
ferm
257,09
101
Md
mendelew
258,1
102
No
nobel
259,1
103
Lr
lorens
260,1
liczba atomowa
masa atomowa [u]
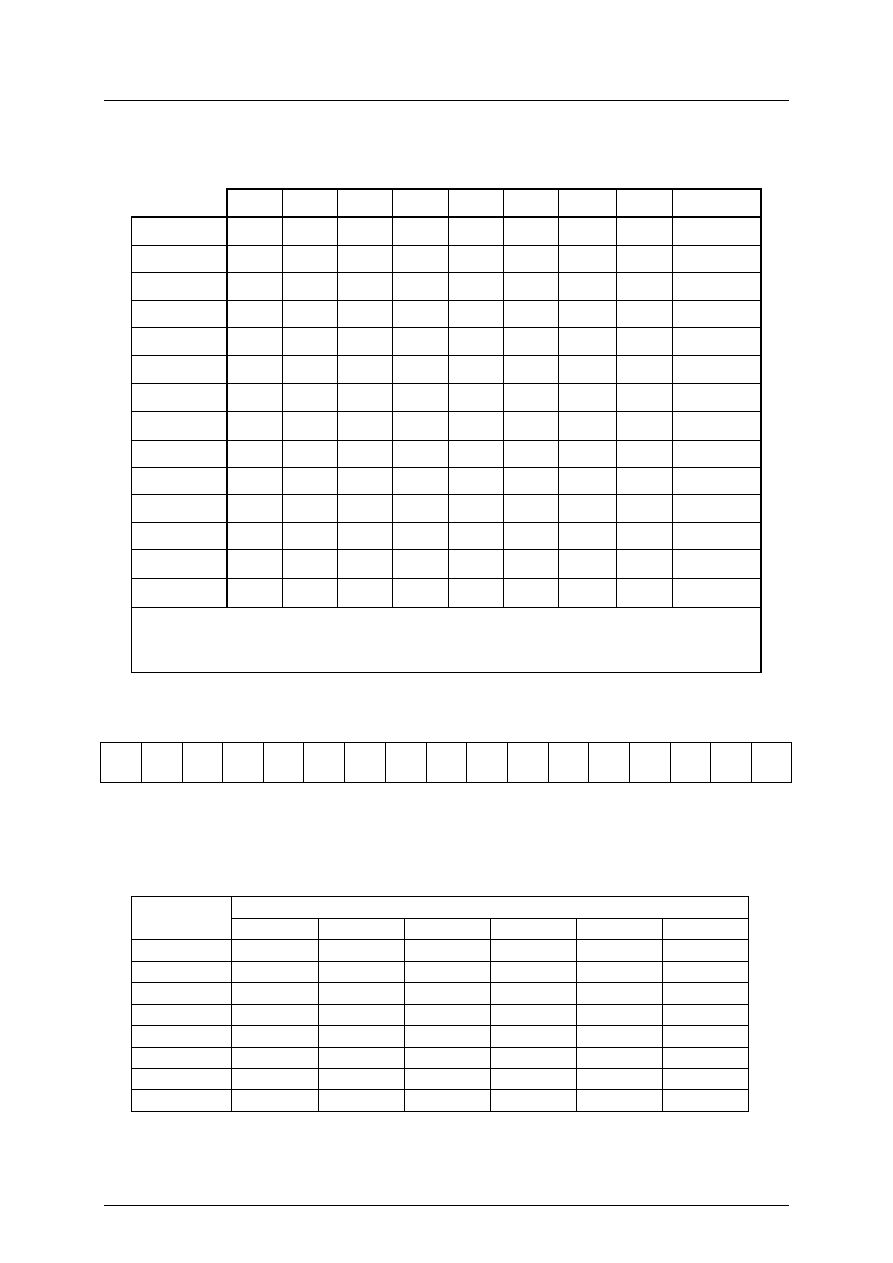
Konkursy w województwie podkarpackim w roku szkolnym 2005/2006
T
A B E L A R O Z P U S Z C Z A L N O Ś C I N I E K T Ó R Y C H S O L I
I W O D O R O T L E N K Ó W W W O D Z I E
I.
Szereg aktywności metali
K
Na
Li
Ca Mg Al Mn Zn
Fe
Sn
Pb
H
2
Cu Hg Ag Au Pt
R
O Z P U S Z C Z A L N O Ś Ć N I E K T Ó R Y C H S U B S T A N C J I
W Z A L E Ż N O Ś C I O D T E M P E R A T U R Y
Rozpuszczalność [ g / 100 g H
2
O ]
Substancja
0
o
C
20
o
C
40
o
C
60
o
C
80
o
C
100
o
C
KNO
3
13,6
31,9
62,9
109,0
170,9
242,4
K
2
CO
3
158,5
167,3
181,4
202,7
230,9
268,6
K
2
SO
4
8,53
11,0
14,8
18,4
21,5
24,0
CuSO
4
24,0
35,5
53,2
81,8
131,2
139,5
NaCl
35,6
35,9
36,4
37,1
38,0
39,0
NH
4
Cl
29,4
37,1
45,8
55,3
65,7
77,0
CH
3
COONa
79
111
192
139
153
170
C
12
H
22
O
11
179
204
238
288
363
488
OH
-
Cl
-
NO
3
-
S
2-
SO
3
2-
SO
4
2-
CO
3
2-
PO
4
3-
CH
3
COO
-
Li
+
R
R
R
R
R
R
R
N
R
Na
+
R
R
R
R
R
R
R
R
R
K
+
R
R
R
R
R
R
R
R
R
NH
4
+
R
R
R
R
R
R
R
R
R
Ag
+
N
N
R
N
N
T
N
N
R
Mg
2+
N
R
R
−
N
R
N
N
R
Ca
2+
T
R
R
R
N
T
N
N
R
Cu
2+
N
R
R
N
−
R
N
N
R
Ba
2+
R
R
R
R
N
N
N
N
R
Zn
2+
N
R
R
N
N
R
N
N
R
Pb
2+
N
T
R
N
N
N
N
N
R
Fe
2+
N
R
R
N
N
R
N
N
R
Fe
3+
N
R
R
N
−
R
−
N
−
Al
3+
N
R
R
−
−
R
−
N
R
R – substancja rozpuszczalna; T – substancja trudno rozpuszczalna; N – substancja
praktycznie nierozpuszczalna; − oznacza, że substancja nie została otrzymana lub
rozkłada się w wodzie
Wyszukiwarka
Podobne podstrony:
chemia zadania 2 id 113035 Nieznany
gim chemia klucze, chemia
gim chemia klucze
Chemia zadania D
Chemia zadania 1
Chemia zadania, doświadczenia
alkohole - zadania, Matura, Chemia, zadania z organicznej
powtórka 2 zadania, Chemia zadania
Chemia w zyciu codziennym IIIgim gr2, GIM CHEMIA
zbior zadan z chemmiii, chemia, zadania
mol stechiometria, AdrianM, LO, CHEMIA, ZADANIA
gim chemia tablice, chemia
Chemia pomoce naukowe, Chemia zadania sciaga, Chemia zadania
Chemia pomoce naukowe, Chemia zadania sciaga, Chemia zadania
che 3 etap gim 2012 zadania
Chemia Zadania pH
więcej podobnych podstron