
1
Jednofunkcyjne związki organiczne
– poziom podstawowy
Zadanie 1. (2 pkt)
Źródło: CKE 2010 (PP), zad. 25.
Egzamin maturalny z chemii
Poziom podstawowy
10
Informacja do zadania 23 i 24
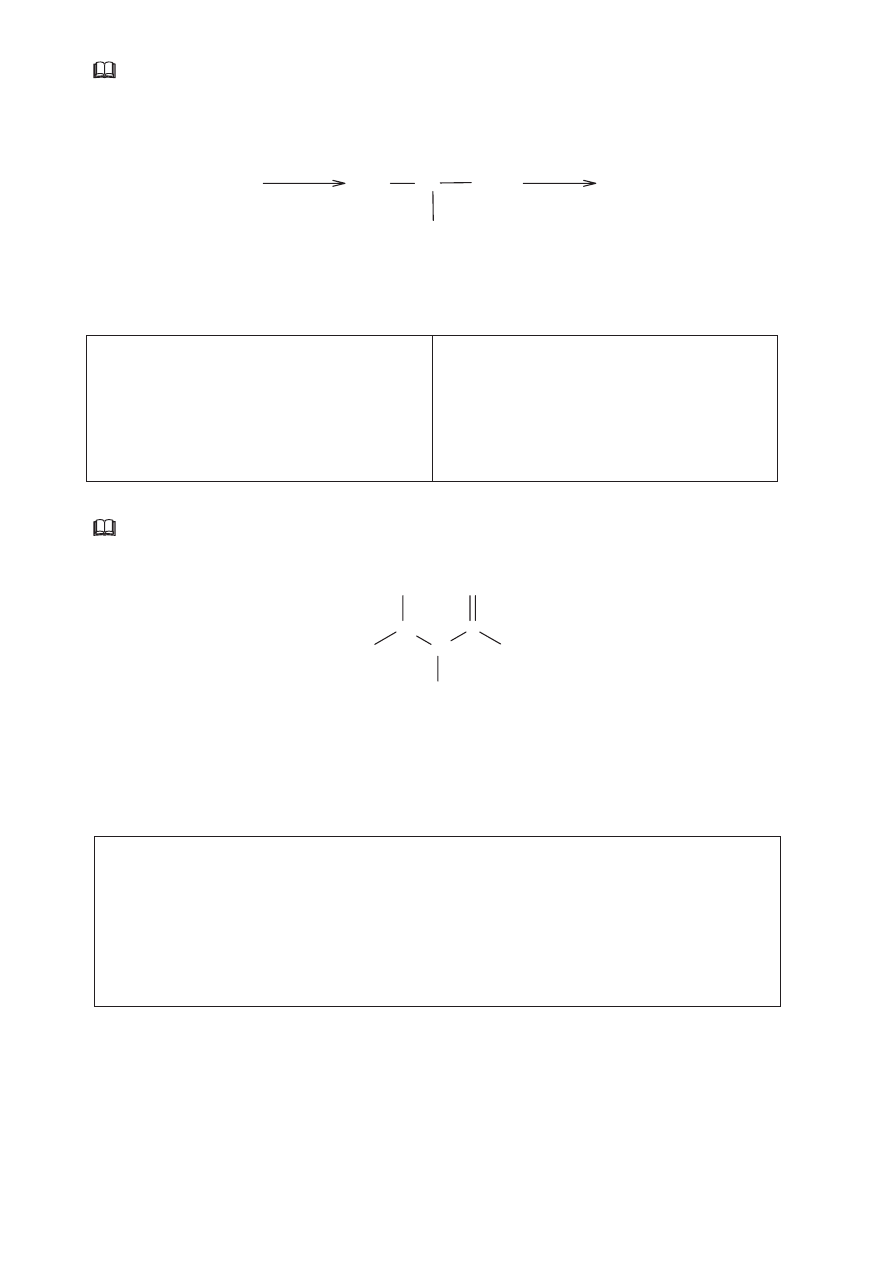
Poniższy schemat ilustruje ciąg przemian, których początkowym substratem jest etyn
(acetylen):
etyn (acetylen) ⎯→
⎯
1
eten ⎯→
⎯
2
polimer
Zadanie 23. (1 pkt)
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie
reakcji oznaczonej na schemacie numerem 1.
.......................................................................................................................................................
Zadanie 24. (1 pkt)
Spośród przedstawionych poniżej wzorów podkreśl ten, który przedstawia budowę
fragmentu łańcucha polimeru stanowiącego produkt reakcji oznaczonej na schemacie
numerem 2.
A.
C
C
C
C
H
H
Cl
H
H
H
Cl
H
B.
C
C
C
C
H
H
H
H
H
H
H
H
C.
C
H
H
C C C
H
H
H
H
D.
C
C
C
C
H
H
H
H
Zadanie 25. (2 pkt)
W wysokiej temperaturze w obecności Al
2
O
3
alkohole ulegają reakcji dehydratacji
(odwodnienia). Podczas dehydratacji nasyconych alkoholi (alkanoli) o wzorze ogólnym
R
1
–CH(OH)–R
2
(gdzie R
1
≠ R
2
) oprócz wody powstaje mieszanina nierozgałęzionych
alkenów, które są względem siebie izomerami konstytucyjnymi.
Narysuj wzory półstrukturalne (grupowe) dwóch alkenów będących izomerami
konstytucyjnymi, które mogą powstać w wyniku dehydratacji butan-2-olu.
Wzór I:
Wzór II:
Egzamin maturalny z chemii
Poziom podstawowy
11
Informacja do zadania 26 i 27
Właściwości substancji są uwarunkowane budową ich cząsteczek i charakterem
występujących wiązań. W cząsteczkach kwasów karboksylowych można wyróżnić dwa
fragmenty o przeciwstawnych właściwościach: polarną grupę karboksylową –COOH
i niepolarny fragment węglowodorowy –R. W kwasach o krótkich łańcuchach węglowych
dominuje grupa polarna. W miarę wzrostu długości łańcucha węglowego maleje wpływ grupy
karboksylowej na właściwości związków.
W poniższej tabeli zestawiono temperatury wrzenia wybranych kwasów karboksylowych
(pod ciśnieniem 1013 hPa).
Wzór półstrukturalny (grupowy) kwasu
Temperatura wrzenia, °C
CH
3
COOH 118
CH
3
CH
2
CH
2
COOH 163
CH
3
CH
2
CH
2
CH
2
CH
2
COOH 206
Na podstawie:
W. Mizerski, Tablice chemiczne, Warszawa 2003
Zadanie 26. (1 pkt)
Na podstawie analizy danych zawartych w informacji wprowadzającej sformułuj
wniosek, który określa związek pomiędzy długością łańcucha węglowego a lotnością
kwasów karboksylowych.
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 27. (1 pkt)
Ustal, który z kwasów karboksylowych wymienionych w informacji wprowadzającej jest
najlepiej rozpuszczalny w wodzie, i napisz jego wzór półstrukturalny (grupowy).
.......................................................................................................................................................
Nr
zadania
23. 24. 25. 26. 27.
Maks.
liczba
pkt 1 1 2 1 1
Wypełnia
egzaminator! Uzyskana liczba pkt
Egzamin maturalny z chemii
Poziom podstawowy
10
Informacja do zadania 23 i 24
Poniższy schemat ilustruje ciąg przemian, których początkowym substratem jest etyn
(acetylen):
etyn (acetylen) ⎯→
⎯
1
eten ⎯→
⎯
2
polimer
Zadanie 23. (1 pkt)
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie
reakcji oznaczonej na schemacie numerem 1.
.......................................................................................................................................................
Zadanie 24. (1 pkt)
Spośród przedstawionych poniżej wzorów podkreśl ten, który przedstawia budowę
fragmentu łańcucha polimeru stanowiącego produkt reakcji oznaczonej na schemacie
numerem 2.
A.
C
C
C
C
H
H
Cl
H
H
H
Cl
H
B.
C
C
C
C
H
H
H
H
H
H
H
H
C.
C
H
H
C C C
H
H
H
H
D.
C
C
C
C
H
H
H
H
Zadanie 25. (2 pkt)
W wysokiej temperaturze w obecności Al
2
O
3
alkohole ulegają reakcji dehydratacji
(odwodnienia). Podczas dehydratacji nasyconych alkoholi (alkanoli) o wzorze ogólnym
R
1
–CH(OH)–R
2
(gdzie R
1
≠ R
2
) oprócz wody powstaje mieszanina nierozgałęzionych
alkenów, które są względem siebie izomerami konstytucyjnymi.
Narysuj wzory półstrukturalne (grupowe) dwóch alkenów będących izomerami
konstytucyjnymi, które mogą powstać w wyniku dehydratacji butan-2-olu.
Wzór I:
Wzór II:
Informacja do zadania 2 i 3

2
Zadanie 3. (1 pkt)
Źródło: CKE 2010 (PP), zad. 27.
Egzamin maturalny z chemii
Poziom podstawowy
11
Informacja do zadania 26 i 27
Właściwości substancji są uwarunkowane budową ich cząsteczek i charakterem
występujących wiązań. W cząsteczkach kwasów karboksylowych można wyróżnić dwa
fragmenty o przeciwstawnych właściwościach: polarną grupę karboksylową –COOH
i niepolarny fragment węglowodorowy –R. W kwasach o krótkich łańcuchach węglowych
dominuje grupa polarna. W miarę wzrostu długości łańcucha węglowego maleje wpływ grupy
karboksylowej na właściwości związków.
W poniższej tabeli zestawiono temperatury wrzenia wybranych kwasów karboksylowych
(pod ciśnieniem 1013 hPa).
Wzór półstrukturalny (grupowy) kwasu
Temperatura wrzenia, °C
CH
3
COOH 118
CH
3
CH
2
CH
2
COOH 163
CH
3
CH
2
CH
2
CH
2
CH
2
COOH 206
Na podstawie:
W. Mizerski, Tablice chemiczne, Warszawa 2003
Zadanie 26. (1 pkt)
Na podstawie analizy danych zawartych w informacji wprowadzającej sformułuj
wniosek, który określa związek pomiędzy długością łańcucha węglowego a lotnością
kwasów karboksylowych.
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 27. (1 pkt)
Ustal, który z kwasów karboksylowych wymienionych w informacji wprowadzającej jest
najlepiej rozpuszczalny w wodzie, i napisz jego wzór półstrukturalny (grupowy).
.......................................................................................................................................................
Nr
zadania
23. 24. 25. 26. 27.
Maks.
liczba
pkt 1 1 2 1 1
Wypełnia
egzaminator! Uzyskana liczba pkt
Zadanie 4 (1 pkt)
Źródło: CKE 2010 (PP), zad. 28.
Egzamin maturalny z chemii
Poziom podstawowy
12
Informacja do zadania 28 i 29
Kwasy tłuszczowe o wzorach C
17
H
35
COOH (kwas stearynowy) i C
17
H
33
COOH (kwas
oleinowy) należą do różnych szeregów homologicznych.
Zadanie 28. (1 pkt)
Określ różnicę w budowie cząsteczek tych związków. W tym celu w każdym nawiasie
wybierz i podkreśl właściwe określenie.
Kwas oleinowy, w przeciwieństwie do kwasu stearynowego, jest kwasem
( nasyconym / nienasyconym ).
W cząsteczce kwasu stearynowego pomiędzy atomami węgla ( występuje jedno wiązanie
podwójne / występują tylko wiązania pojedyncze ).
Zadanie 29. (2 pkt)
Zaprojektuj doświadczenie, którego przebieg pozwoli potwierdzić nienasycony
charakter kwasu tłuszczowego.
a) Uzupełnij schemat doświadczenia, wpisując wzory odczynników wybranych
z poniższej listy:
•
C
17
H
33
COOH
•
C
17
H
35
COOH
•
Br
2 (aq)
•
NaOH
(aq)
•
FeCl
3 (aq)
Schemat doświadczenia:
Kwas tłuszczowy o wzorze ...............................................
..............................................................................
b) Napisz, co zaobserwowano podczas tego doświadczenia.
.......................................................................................................................................................
.......................................................................................................................................................
Egzamin maturalny z chemii
Poziom podstawowy
12
Informacja do zadania 28 i 29
Kwasy tłuszczowe o wzorach C
17
H
35
COOH (kwas stearynowy) i C
17
H
33
COOH (kwas
oleinowy) należą do różnych szeregów homologicznych.
Zadanie 28. (1 pkt)
Określ różnicę w budowie cząsteczek tych związków. W tym celu w każdym nawiasie
wybierz i podkreśl właściwe określenie.
Kwas oleinowy, w przeciwieństwie do kwasu stearynowego, jest kwasem
( nasyconym / nienasyconym ).
W cząsteczce kwasu stearynowego pomiędzy atomami węgla ( występuje jedno wiązanie
podwójne / występują tylko wiązania pojedyncze ).
Zadanie 29. (2 pkt)
Zaprojektuj doświadczenie, którego przebieg pozwoli potwierdzić nienasycony
charakter kwasu tłuszczowego.
a) Uzupełnij schemat doświadczenia, wpisując wzory odczynników wybranych
z poniższej listy:
•
C
17
H
33
COOH
•
C
17
H
35
COOH
•
Br
2 (aq)
•
NaOH
(aq)
•
FeCl
3 (aq)
Schemat doświadczenia:
Kwas tłuszczowy o wzorze ...............................................
..............................................................................
b) Napisz, co zaobserwowano podczas tego doświadczenia.
.......................................................................................................................................................
.......................................................................................................................................................
Egzamin maturalny z chemii
Poziom podstawowy
10
Informacja do zadania 23 i 24
Poniższy schemat ilustruje ciąg przemian, których początkowym substratem jest etyn
(acetylen):
etyn (acetylen) ⎯→
⎯
1
eten ⎯→
⎯
2
polimer
Zadanie 23. (1 pkt)
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie
reakcji oznaczonej na schemacie numerem 1.
.......................................................................................................................................................
Zadanie 24. (1 pkt)
Spośród przedstawionych poniżej wzorów podkreśl ten, który przedstawia budowę
fragmentu łańcucha polimeru stanowiącego produkt reakcji oznaczonej na schemacie
numerem 2.
A.
C
C
C
C
H
H
Cl
H
H
H
Cl
H
B.
C
C
C
C
H
H
H
H
H
H
H
H
C.
C
H
H
C C C
H
H
H
H
D.
C
C
C
C
H
H
H
H
Zadanie 25. (2 pkt)
W wysokiej temperaturze w obecności Al
2
O
3
alkohole ulegają reakcji dehydratacji
(odwodnienia). Podczas dehydratacji nasyconych alkoholi (alkanoli) o wzorze ogólnym
R
1
–CH(OH)–R
2
(gdzie R
1
≠ R
2
) oprócz wody powstaje mieszanina nierozgałęzionych
alkenów, które są względem siebie izomerami konstytucyjnymi.
Narysuj wzory półstrukturalne (grupowe) dwóch alkenów będących izomerami
konstytucyjnymi, które mogą powstać w wyniku dehydratacji butan-2-olu.
Wzór I:
Wzór II:
Informacja do zadania 4 i 5
Zadanie 2. (1 pkt)
Źródło: CKE 2010 (PP), zad. 26.
Egzamin maturalny z chemii
Poziom podstawowy
11
Informacja do zadania 26 i 27
Właściwości substancji są uwarunkowane budową ich cząsteczek i charakterem
występujących wiązań. W cząsteczkach kwasów karboksylowych można wyróżnić dwa
fragmenty o przeciwstawnych właściwościach: polarną grupę karboksylową –COOH
i niepolarny fragment węglowodorowy –R. W kwasach o krótkich łańcuchach węglowych
dominuje grupa polarna. W miarę wzrostu długości łańcucha węglowego maleje wpływ grupy
karboksylowej na właściwości związków.
W poniższej tabeli zestawiono temperatury wrzenia wybranych kwasów karboksylowych
(pod ciśnieniem 1013 hPa).
Wzór półstrukturalny (grupowy) kwasu
Temperatura wrzenia, °C
CH
3
COOH 118
CH
3
CH
2
CH
2
COOH 163
CH
3
CH
2
CH
2
CH
2
CH
2
COOH 206
Na podstawie:
W. Mizerski, Tablice chemiczne, Warszawa 2003
Zadanie 26. (1 pkt)
Na podstawie analizy danych zawartych w informacji wprowadzającej sformułuj
wniosek, który określa związek pomiędzy długością łańcucha węglowego a lotnością
kwasów karboksylowych.
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 27. (1 pkt)
Ustal, który z kwasów karboksylowych wymienionych w informacji wprowadzającej jest
najlepiej rozpuszczalny w wodzie, i napisz jego wzór półstrukturalny (grupowy).
.......................................................................................................................................................
Nr
zadania
23. 24. 25. 26. 27.
Maks.
liczba
pkt 1 1 2 1 1
Wypełnia
egzaminator! Uzyskana liczba pkt
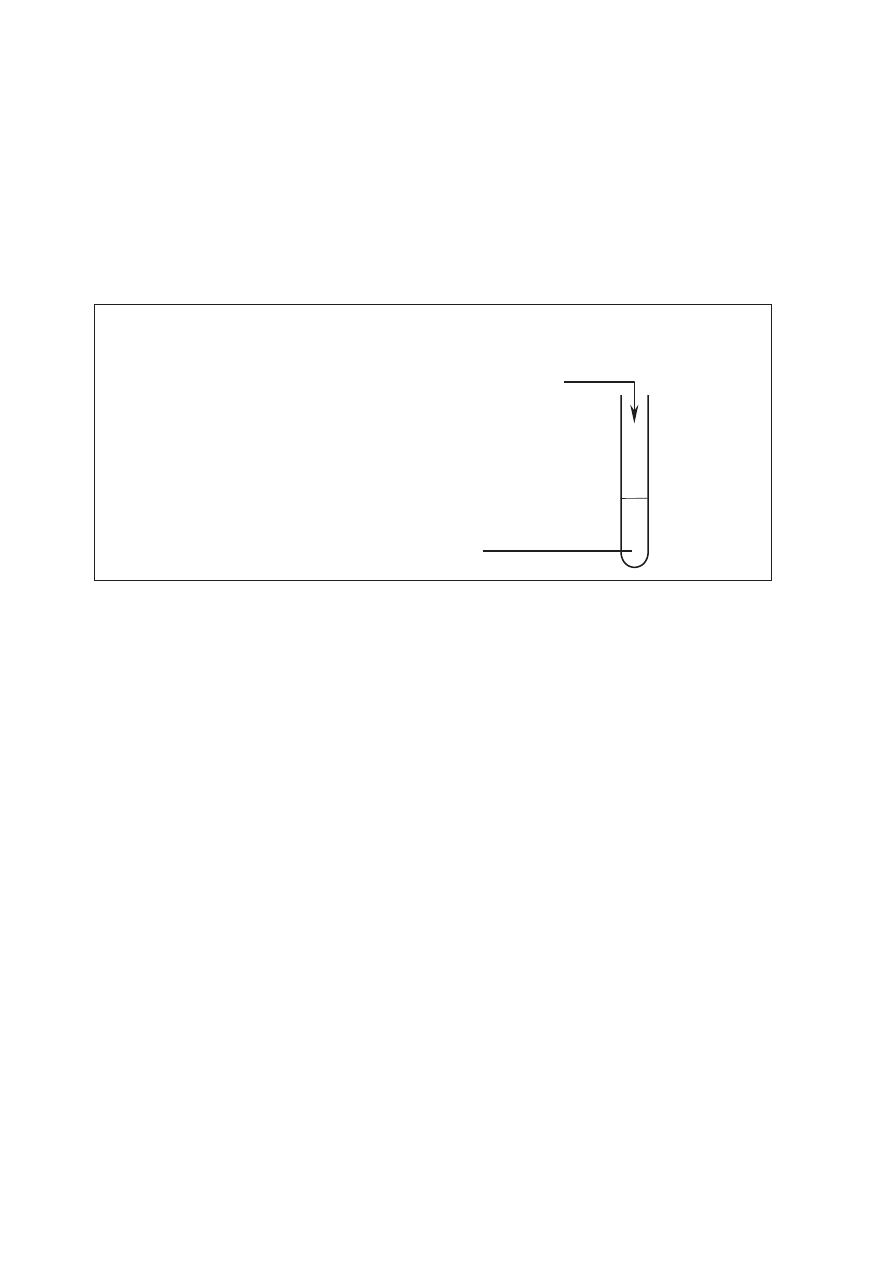
3
Egzamin maturalny z chemii
Poziom podstawowy
12
Informacja do zadania 28 i 29
Kwasy tłuszczowe o wzorach C
17
H
35
COOH (kwas stearynowy) i C
17
H
33
COOH (kwas
oleinowy) należą do różnych szeregów homologicznych.
Zadanie 28. (1 pkt)
Określ różnicę w budowie cząsteczek tych związków. W tym celu w każdym nawiasie
wybierz i podkreśl właściwe określenie.
Kwas oleinowy, w przeciwieństwie do kwasu stearynowego, jest kwasem
( nasyconym / nienasyconym ).
W cząsteczce kwasu stearynowego pomiędzy atomami węgla ( występuje jedno wiązanie
podwójne / występują tylko wiązania pojedyncze ).
Zadanie 29. (2 pkt)
Zaprojektuj doświadczenie, którego przebieg pozwoli potwierdzić nienasycony
charakter kwasu tłuszczowego.
a) Uzupełnij schemat doświadczenia, wpisując wzory odczynników wybranych
z poniższej listy:
•
C
17
H
33
COOH
•
C
17
H
35
COOH
•
Br
2 (aq)
•
NaOH
(aq)
•
FeCl
3 (aq)
Schemat doświadczenia:
Kwas tłuszczowy o wzorze ...............................................
..............................................................................
b) Napisz, co zaobserwowano podczas tego doświadczenia.
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 5 (2 pkt)
Źródło: CKE 2010 (PP), zad. 29.
Egzamin maturalny z chemii
Poziom podstawowy
12
Informacja do zadania 28 i 29
Kwasy tłuszczowe o wzorach C
17
H
35
COOH (kwas stearynowy) i C
17
H
33
COOH (kwas
oleinowy) należą do różnych szeregów homologicznych.
Zadanie 28. (1 pkt)
Określ różnicę w budowie cząsteczek tych związków. W tym celu w każdym nawiasie
wybierz i podkreśl właściwe określenie.
Kwas oleinowy, w przeciwieństwie do kwasu stearynowego, jest kwasem
( nasyconym / nienasyconym ).
W cząsteczce kwasu stearynowego pomiędzy atomami węgla ( występuje jedno wiązanie
podwójne / występują tylko wiązania pojedyncze ).
Zadanie 29. (2 pkt)
Zaprojektuj doświadczenie, którego przebieg pozwoli potwierdzić nienasycony
charakter kwasu tłuszczowego.
a) Uzupełnij schemat doświadczenia, wpisując wzory odczynników wybranych
z poniższej listy:
•
C
17
H
33
COOH
•
C
17
H
35
COOH
•
Br
2 (aq)
•
NaOH
(aq)
•
FeCl
3 (aq)
Schemat doświadczenia:
Kwas tłuszczowy o wzorze ...............................................
..............................................................................
b) Napisz, co zaobserwowano podczas tego doświadczenia.
.......................................................................................................................................................
.......................................................................................................................................................

4
Zadanie 6. (3 pkt)
Źródło: CKE 2010 (PP), zad. 30.
Egzamin maturalny z chemii
Poziom podstawowy
13
Zadanie 30. (3 pkt)
Przeanalizuj poniższe schematy przedstawiające trzy reakcje chemiczne i wpisz wzory
brakujących substratów lub produktów. Związki organiczne przedstaw za pomocą
wzorów półstrukturalnych (grupowych).
CH
3
C CH
3
O
+
H
2
......................................................
...............................
+
CH
3
CH
2
OH
CH
3
CH
CH
3
C
O
O CH
2
CH
3
+
..........
CH
2
CH
CH
2
O
O
O
C
C
C
O
O
C
17
H
33
C
17
H
33
C
17
H
33
O
+
2H
2
...............................................................................
(podaj wzór jednego z możliwych produktów)
Zadanie 31. (2 pkt)
Aminy alifatyczne otrzymuje się w reakcji chlorowcopochodnych węglowodorów
z amoniakiem. Przemianę tę przeprowadza się dwuetapowo. W pierwszym etapie powstaje
sól amoniowa RNH
+
3
Cl
−
. W drugim etapie powstałą sól poddaje się działaniu NaOH.
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równania
reakcji przedstawiające dwuetapowy proces otrzymywania metyloaminy.
Etap I:
...........................................................................................................................................
Etap II: ..........................................................................................................................................
Zadanie 32. (1 pkt)
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeżeli uznasz
zdanie za prawdziwe, lub literę F, jeżeli uznasz je za fałszywe.
1. Glukoza i fruktoza dobrze rozpuszczają się w wodzie, a ich wodne roztwory
mają odczyn obojętny.
2. Glukoza jest przedstawicielem cukrów prostych, a fruktoza dwucukrów.
3. Glukoza i fruktoza mają takie same masy molowe.
Nr zadania
28. 29a) 29b) 30. 31. 32.
Maks.
liczba
pkt 1 1 1 3 2 1
Wypełnia
egzaminator! Uzyskana liczba pkt
kat.
H
2
SO
4
kat.
5
Zadanie 8. (2 pkt)
Źródło: CKE 2009 (PP), zad. 26.
Egzamin maturalny z chemii
Poziom podstawowy
11
Zadanie 25. (2 pkt)
Polichlorek winylu (PVC) otrzymuje się z etenu i chloru w procesie, który można przedstawić
za pomocą poniższych schematów reakcji I i II oraz równania reakcji III.
I CH
2
= CH
2
+ Cl
2
⎯⎯
→
A
II
A ⎯⎯⎯⎯⎯⎯⎯→
katalizator / temperatura
CH
2
= CHCl + B
III
n CH
2
= CHCl
katalizator / temperatura / ciśnienie
⎯⎯⎯⎯⎯⎯⎯⎯⎯→
[
CH
2
– CHCl
]
n
a) Dokonaj analizy schematów i podaj wzór półstrukturalny (grupowy) substancji A
oraz wzór substancji B.
Wzór półstrukturalny (grupowy) substancji A: ...........................................................................
Wzór substancji B: ...........................
b) Określ typy reakcji I i II, posługując się podziałem charakterystycznym dla chemii
organicznej.
Typ reakcji I: .................................................................................
Typ reakcji II: ................................................................................
Zadanie 26. (2 pkt)
Etyloaminę (etanoaminę) można otrzymać w wyniku katalitycznej redukcji etanalu
w obecności amoniaku (aminowanie redukcyjne), zgodnie z poniższym równaniem reakcji.
CH
3
– CHO + NH
3
+ H
2
Ni
⎯⎯→
CH
3
– CH
2
– NH
2
+ H
2
O
Na podstawie: R.T. Morrison i R.N. Boyd: Chemia organiczna, PWN, Warszawa 1998
Oblicz, ile dm
3
amoniaku (w przeliczeniu na warunki normalne) przereaguje z 77,0 g
etanalu podczas otrzymywania etyloaminy metodą aminowania redukcyjnego. Wynik
podaj z dokładnością do jednego miejsca po przecinku.
Obliczenia:
Odpowiedź:
Nr zadania
23. 24a 24b 25a 25b 26.
Maks.
liczba
pkt 1 1 2 1 1 2
Wypełnia
egzaminator! Uzyskana liczba pkt
Zadanie 7. (2 pkt)
Źródło: CKE 2010 (PP), zad. 31.
Egzamin maturalny z chemii
Poziom podstawowy
13
Zadanie 30. (3 pkt)
Przeanalizuj poniższe schematy przedstawiające trzy reakcje chemiczne i wpisz wzory
brakujących substratów lub produktów. Związki organiczne przedstaw za pomocą
wzorów półstrukturalnych (grupowych).
CH
3
C CH
3
O
+
H
2
......................................................
...............................
+
CH
3
CH
2
OH
CH
3
CH
CH
3
C
O
O CH
2
CH
3
+
..........
CH
2
CH
CH
2
O
O
O
C
C
C
O
O
C
17
H
33
C
17
H
33
C
17
H
33
O
+
2H
2
...............................................................................
(podaj wzór jednego z możliwych produktów)
Zadanie 31. (2 pkt)
Aminy alifatyczne otrzymuje się w reakcji chlorowcopochodnych węglowodorów
z amoniakiem. Przemianę tę przeprowadza się dwuetapowo. W pierwszym etapie powstaje
sól amoniowa RNH
+
3
Cl
−
. W drugim etapie powstałą sól poddaje się działaniu NaOH.
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równania
reakcji przedstawiające dwuetapowy proces otrzymywania metyloaminy.
Etap I:
...........................................................................................................................................
Etap II: ..........................................................................................................................................
Zadanie 32. (1 pkt)
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeżeli uznasz
zdanie za prawdziwe, lub literę F, jeżeli uznasz je za fałszywe.
1. Glukoza i fruktoza dobrze rozpuszczają się w wodzie, a ich wodne roztwory
mają odczyn obojętny.
2. Glukoza jest przedstawicielem cukrów prostych, a fruktoza dwucukrów.
3. Glukoza i fruktoza mają takie same masy molowe.
Nr zadania
28. 29a) 29b) 30. 31. 32.
Maks.
liczba
pkt 1 1 1 3 2 1
Wypełnia
egzaminator! Uzyskana liczba pkt
kat.
H
2
SO
4
kat.
6
Zadanie 9. (3 pkt)
Źródło: CKE 2009 (PP), zad. 27.
Egzamin maturalny z chemii
Poziom podstawowy
12
Zadanie 27. (2 pkt)
W poniższej tabeli opisano właściwości dwóch związków organicznych zawierających taką
samą liczbę atomów węgla w cząsteczce, ale należących do różnych grup jednofunkcyjnych
pochodnych węglowodorów.
Związek A
Związek B
- Reaguje z metalami, tlenkami metali
i wodorotlenkami, tworząc sole.
- Jest reduktorem; daje pozytywny
wynik prób Tollensa i Trommera.
- Pod wpływem stężonego kwasu
siarkowego(VI) ulega odwodnieniu;
drugim produktem tej reakcji jest
tlenek węgla(II).
- W temperaturze około 160°C
rozkłada się, tworząc tlenek
węgla(IV) i wodór.
- Jest reduktorem; daje pozytywny
wynik prób Tollensa i Trommera.
- W wyniku redukcji tego związku
powstaje silnie toksyczny alkohol.
- W temperaturze pokojowej i pod
ciśnieniem atmosferycznym jest
gazem, który bardzo dobrze
rozpuszcza się w wodzie, a powstały
roztwór powoduje denaturację
białka.
Podaj wzory strukturalne związków A i B.
Związek A
Związek B
Zadanie 28. (2 pkt)
Węgliku wapnia użyto jako surowca w procesie, którego schemat przedstawiono poniżej.
CaC
2
⎯⎯⎯
→
2
H O
A
2
H / katalizator
⎯⎯⎯⎯⎯→
B
2
H O / katalizator
⎯⎯⎯⎯⎯→
C
Uwaga: związek B powstaje w reakcji związku A z wodorem w stosunku molowym 1:1.
Podaj wzory półstrukturalne (grupowe) związków organicznych A, B i C.
A
B C
Zadanie 10. (2 pkt)
Źródło: CKE 2009 (PP), zad. 29.
Egzamin maturalny z chemii
Poziom podstawowy
13
Zadanie 29. (2 pkt)
Oblicz, ile gramów kwasu aminooctowego (glicyny) H
2
N – CH
2
– COOH znajduje się
w 0,10 dm
3
roztworu tego związku o stężeniu 0,50 mol · dm
–3
. Wynik podaj
z dokładnością do dwóch miejsc po przecinku.
Obliczenia:
Odpowiedź:
Zadanie 30. (3 pkt)
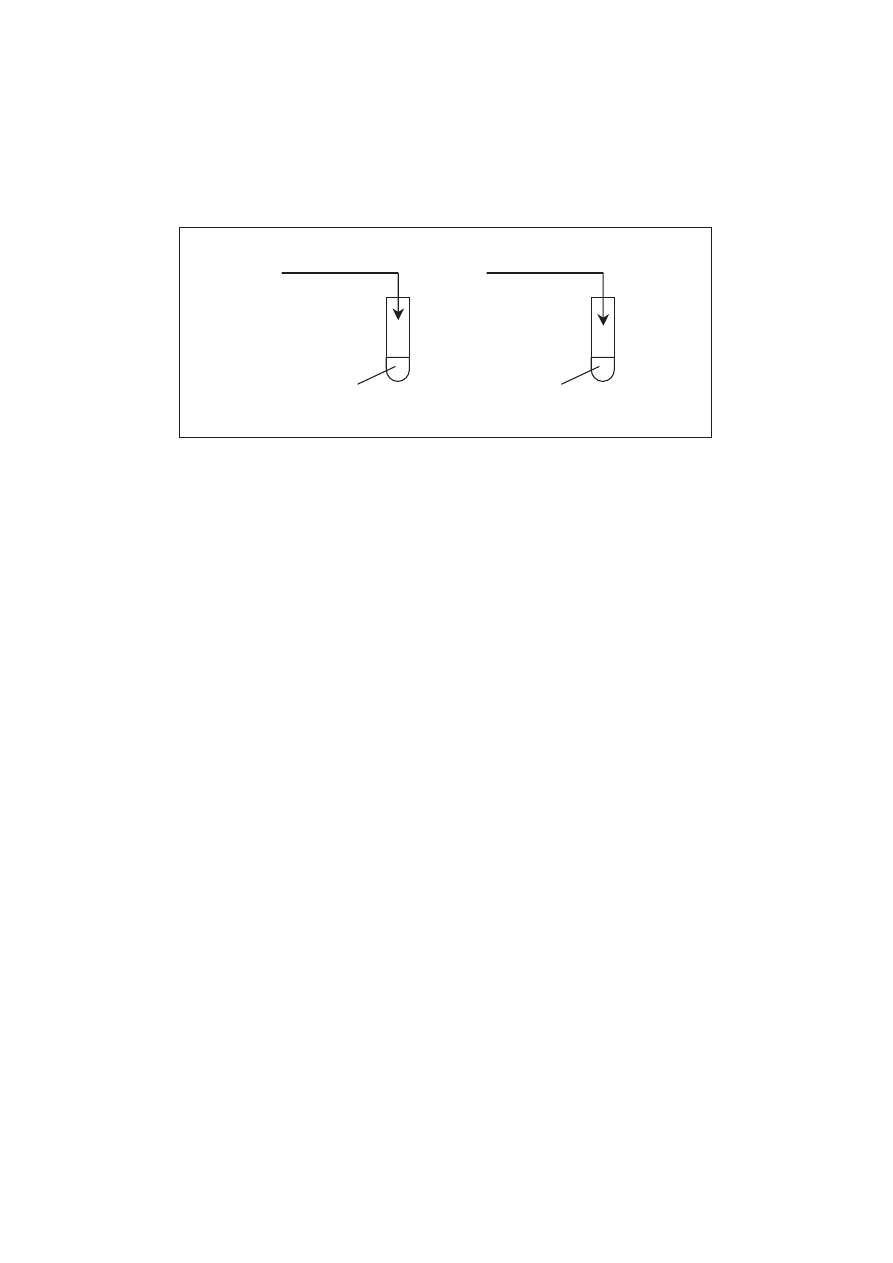
Przedstaw projekt doświadczenia, które wykaże, że kwas aminooctowy (glicyna) zawiera
w cząsteczce grupę funkcyjną o charakterze kwasowym (karboksylową) oraz grupę
funkcyjną o charakterze zasadowym (aminową). W tym celu:
a) uzupełnij poniższy opis doświadczenia, wpisując wzory potrzebnych odczynników
wybranych spośród:
HCl
(aq)
CuSO
4(aq)
I
2
w KI
(aq)
NaOH
(aq)
Cu(OH)
2(zawiesina)
b) wymień obserwacje, które umożliwią określenie charakteru chemicznego grup
funkcyjnych w cząsteczce glicyny (uwzględnij zmianę barwy roztworów)
Probówka I: ...............................................................................................................................
.......................................................................................................................................................
Probówka II: ..............................................................................................................................
.......................................................................................................................................................
c) określ charakter chemiczny grup funkcyjnych, których obecność potwierdzono,
wykonując doświadczenie.
W probówce I potwierdzono obecność grupy o charakterze ......................................................
W probówce II potwierdzono obecność grupy o charakterze ......................................................
Nr zadania
27. 28. 29. 30a 30b 30c
Maks.
liczba
pkt 2 2 2 1 1 1
Wypełnia
egzaminator! Uzyskana liczba pkt
.................. +
fenoloftaleina
I
glicyna
II
glicyna
.................. +
oranż metylowy
7
Zadanie 11. (3 pkt)
Źródło: CKE 2009 (PP), zad. 30.
Egzamin maturalny z chemii
Poziom podstawowy
13
Zadanie 29. (2 pkt)
Oblicz, ile gramów kwasu aminooctowego (glicyny) H
2
N – CH
2
– COOH znajduje się
w 0,10 dm
3
roztworu tego związku o stężeniu 0,50 mol · dm
–3
. Wynik podaj
z dokładnością do dwóch miejsc po przecinku.
Obliczenia:
Odpowiedź:
Zadanie 30. (3 pkt)
Przedstaw projekt doświadczenia, które wykaże, że kwas aminooctowy (glicyna) zawiera
w cząsteczce grupę funkcyjną o charakterze kwasowym (karboksylową) oraz grupę
funkcyjną o charakterze zasadowym (aminową). W tym celu:
a) uzupełnij poniższy opis doświadczenia, wpisując wzory potrzebnych odczynników
wybranych spośród:
HCl
(aq)
CuSO
4(aq)
I
2
w KI
(aq)
NaOH
(aq)
Cu(OH)
2(zawiesina)
b) wymień obserwacje, które umożliwią określenie charakteru chemicznego grup
funkcyjnych w cząsteczce glicyny (uwzględnij zmianę barwy roztworów)
Probówka I: ...............................................................................................................................
.......................................................................................................................................................
Probówka II: ..............................................................................................................................
.......................................................................................................................................................
c) określ charakter chemiczny grup funkcyjnych, których obecność potwierdzono,
wykonując doświadczenie.
W probówce I potwierdzono obecność grupy o charakterze ......................................................
W probówce II potwierdzono obecność grupy o charakterze ......................................................
Nr zadania
27. 28. 29. 30a 30b 30c
Maks.
liczba
pkt 2 2 2 1 1 1
Wypełnia
egzaminator! Uzyskana liczba pkt
.................. +
fenoloftaleina
I
glicyna
II
glicyna
.................. +
oranż metylowy

8
Zadanie 12. (2 pkt)
Źródło: CKE 2008 (PP), zad. 22.
Egzamin maturalny z chemii
Poziom podstawowy
10
Zadanie 22. (2 pkt)
Scharakteryzuj etan i etanol (w temperaturze pokojowej i pod ciśnieniem
atmosferycznym), wybierając ich właściwości spośród podanych poniżej i wpisując je
w odpowiednie kolumny tabeli.
1. gaz, ciecz, ciało stałe
2. bezbarwny, barwny
3. dobrze rozpuszczalny w wodzie, praktycznie nierozpuszczalny w wodzie
4. palny, niepalny
Etan Etanol
1.
1.
2.
2.
3.
3.
4.
4.
Informacja do zadania 23. i 24.
W wyniku reakcji addycji chlorowodoru do węglowodoru X powstaje chloroeten (chlorek
winylu) o wzorze
Cl
CH
C
H
2
−
=
.
Zadanie 23. (2 pkt)
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych,
a) równanie reakcji węglowodoru X z chlorowodorem.
.......................................................................................................................................................
b) równanie reakcji chloroetenu z wodorem wobec katalizatora.
.......................................................................................................................................................
Zadanie 24. (1 pkt)
Chloroeten ma zdolność ulegania reakcji polimeryzacji.
Spośród poniżej przedstawionych wzorów wybierz ten, który ilustruje budowę
fragmentu łańcucha produktu polimeryzacji chloroetenu (chlorku winylu). Zaznacz
odpowiedź A, B, C lub D.
A. B. C. D.
C
C
C
C
H
H
H
H
H
H
H
H
C C
C
C
H
H
Cl
H
H
H
Cl
H
C
C
C
C
H
H
H
H
C
C
C
C
H
Cl
H
Cl
Zadanie 13. (1 pkt)
Źródło: CKE 2008 (PP), zad. 26.
Egzamin maturalny z chemii
Poziom podstawowy
12
Zadanie 26. (1 pkt)
Jednym z jednowodorotlenowych alkoholi zawierających 4 atomy węgla w cząsteczce jest
2-metylopropan-1-ol o wzorze
C
H
3
CH CH
2
CH
3
OH
Spośród poniższych wzorów wybierz te, które przedstawiają izomery tego alkoholu,
i podaj ich numery.
C
H
3
CH CH
3
C
H
2
OH
C
H
3
C CH
3
CH
3
OH
C
H
3
CH
2
CH
2
OH
C
H
3
CH
2
CH
2
CH
2
OH
I
II
III
IV
Numery wzorów izomerów: .........................................................................................................
Informacja do zadania 27. i 28.
Poniżej przedstawiono wzór półstrukturalny butanonu.
C
H
3
C CH
2
CH
3
O
1
2
Zadanie 27. (1 pkt)
Napisz nazwy systematyczne grup oznaczonych we wzorze numerami 1 i 2.
Nazwa grupy numer 1: .................................................................................................................
Nazwa grupy numer 2: .................................................................................................................
Zadanie 28. (1 pkt)
Napisz wzór półstrukturalny (grupowy) alkoholu powstałego w wyniku redukcji
butanonu wodorem w obecności katalizatora.

9
Zadanie 14. (1 pkt)
Zadanie 15. (1 pkt)
Źródło: CKE 2008 (PP), zad. 27.
Źródło: CKE 2008 (PP), zad. 28.
Egzamin maturalny z chemii
Poziom podstawowy
12
Zadanie 26. (1 pkt)
Jednym z jednowodorotlenowych alkoholi zawierających 4 atomy węgla w cząsteczce jest
2-metylopropan-1-ol o wzorze
C
H
3
CH CH
2
CH
3
OH
Spośród poniższych wzorów wybierz te, które przedstawiają izomery tego alkoholu,
i podaj ich numery.
C
H
3
CH CH
3
C
H
2
OH
C
H
3
C CH
3
CH
3
OH
C
H
3
CH
2
CH
2
OH
C
H
3
CH
2
CH
2
CH
2
OH
I
II
III
IV
Numery wzorów izomerów: .........................................................................................................
Informacja do zadania 27. i 28.
Poniżej przedstawiono wzór półstrukturalny butanonu.
C
H
3
C CH
2
CH
3
O
1
2
Zadanie 27. (1 pkt)
Napisz nazwy systematyczne grup oznaczonych we wzorze numerami 1 i 2.
Nazwa grupy numer 1: .................................................................................................................
Nazwa grupy numer 2: .................................................................................................................
Zadanie 28. (1 pkt)
Napisz wzór półstrukturalny (grupowy) alkoholu powstałego w wyniku redukcji
butanonu wodorem w obecności katalizatora.
Egzamin maturalny z chemii
Poziom podstawowy
12
Zadanie 26. (1 pkt)
Jednym z jednowodorotlenowych alkoholi zawierających 4 atomy węgla w cząsteczce jest
2-metylopropan-1-ol o wzorze
C
H
3
CH CH
2
CH
3
OH
Spośród poniższych wzorów wybierz te, które przedstawiają izomery tego alkoholu,
i podaj ich numery.
C
H
3
CH CH
3
C
H
2
OH
C
H
3
C CH
3
CH
3
OH
C
H
3
CH
2
CH
2
OH
C
H
3
CH
2
CH
2
CH
2
OH
I
II
III
IV
Numery wzorów izomerów: .........................................................................................................
Informacja do zadania 27. i 28.
Poniżej przedstawiono wzór półstrukturalny butanonu.
C
H
3
C CH
2
CH
3
O
1
2
Zadanie 27. (1 pkt)
Napisz nazwy systematyczne grup oznaczonych we wzorze numerami 1 i 2.
Nazwa grupy numer 1: .................................................................................................................
Nazwa grupy numer 2: .................................................................................................................
Zadanie 28. (1 pkt)
Napisz wzór półstrukturalny (grupowy) alkoholu powstałego w wyniku redukcji
butanonu wodorem w obecności katalizatora.
Zadanie 16. (3 pkt)
Źródło: CKE 2008 (PP), zad. 29.
Egzamin maturalny z chemii
Poziom podstawowy
13
Zadanie 29. (3 pkt)
Przeprowadzono reakcje chemiczne według następującego schematu:
etanal
kwas octowy
octan etylu
octan sodu
+ O
2
+ NaOH
(aq)
I
III
II
+ C
2
H
5
OH/H
2
SO
4(stęż.)
Stosując wzory półstrukturalne (grupowe) związków organicznych, napisz równania
reakcji oznaczonych numerami I, II i III.
Równanie reakcji I:
.......................................................................................................................................................
Równanie reakcji II:
.......................................................................................................................................................
Równanie reakcji III:
.......................................................................................................................................................
Zadanie 30. (1 pkt)
Poniżej przedstawiono wzór pewnego dwucukru.
C
O
C
C
C
C
O
H
H
H
O
H
OH
H
OH
H
CH
2
OH
C
O
C
C
C
C
OH
H
H
H
OH
H
OH
H
CH
2
OH
I
II
Określ, od jakich cukrów prostych pochodzą fragmenty I i II, z których zbudowana jest
cząsteczka tego dwucukru. Zaznacz odpowiedź A, B, C lub D.
Fragment I
Fragment II
A.
od fruktozy
od fruktozy
B.
od fruktozy
od glukozy
C.
od glukozy
od fruktozy
D.
od glukozy
od glukozy
Nr
zadania
26. 27. 28. 29. 30.
Maks.
liczba
pkt 1 1 1 3 1
Wypełnia
egzaminator! Uzyskana liczba pkt
Egzamin maturalny z chemii
Poziom podstawowy
12
Zadanie 26. (1 pkt)
Jednym z jednowodorotlenowych alkoholi zawierających 4 atomy węgla w cząsteczce jest
2-metylopropan-1-ol o wzorze
C
H
3
CH CH
2
CH
3
OH
Spośród poniższych wzorów wybierz te, które przedstawiają izomery tego alkoholu,
i podaj ich numery.
C
H
3
CH CH
3
C
H
2
OH
C
H
3
C CH
3
CH
3
OH
C
H
3
CH
2
CH
2
OH
C
H
3
CH
2
CH
2
CH
2
OH
I
II
III
IV
Numery wzorów izomerów: .........................................................................................................
Informacja do zadania 27. i 28.
Poniżej przedstawiono wzór półstrukturalny butanonu.
C
H
3
C CH
2
CH
3
O
1
2
Zadanie 27. (1 pkt)
Napisz nazwy systematyczne grup oznaczonych we wzorze numerami 1 i 2.
Nazwa grupy numer 1: .................................................................................................................
Nazwa grupy numer 2: .................................................................................................................
Zadanie 28. (1 pkt)
Napisz wzór półstrukturalny (grupowy) alkoholu powstałego w wyniku redukcji
butanonu wodorem w obecności katalizatora.
Egzamin maturalny z chemii
Poziom podstawowy
10
Informacja do zadania 23 i 24
Poniższy schemat ilustruje ciąg przemian, których początkowym substratem jest etyn
(acetylen):
etyn (acetylen) ⎯→
⎯
1
eten ⎯→
⎯
2
polimer
Zadanie 23. (1 pkt)
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie
reakcji oznaczonej na schemacie numerem 1.
.......................................................................................................................................................
Zadanie 24. (1 pkt)
Spośród przedstawionych poniżej wzorów podkreśl ten, który przedstawia budowę
fragmentu łańcucha polimeru stanowiącego produkt reakcji oznaczonej na schemacie
numerem 2.
A.
C
C
C
C
H
H
Cl
H
H
H
Cl
H
B.
C
C
C
C
H
H
H
H
H
H
H
H
C.
C
H
H
C C C
H
H
H
H
D.
C
C
C
C
H
H
H
H
Zadanie 25. (2 pkt)
W wysokiej temperaturze w obecności Al
2
O
3
alkohole ulegają reakcji dehydratacji
(odwodnienia). Podczas dehydratacji nasyconych alkoholi (alkanoli) o wzorze ogólnym
R
1
–CH(OH)–R
2
(gdzie R
1
≠ R
2
) oprócz wody powstaje mieszanina nierozgałęzionych
alkenów, które są względem siebie izomerami konstytucyjnymi.
Narysuj wzory półstrukturalne (grupowe) dwóch alkenów będących izomerami
konstytucyjnymi, które mogą powstać w wyniku dehydratacji butan-2-olu.
Wzór I:
Wzór II:
Informacja do zadania 14 i 15

10
Zadanie 17. (3 pkt)
Źródło: CKE 2007 (PP), zad. 21.
Egzamin maturalny z chemii
Poziom podstawowy
9
Zadanie 20. (2 pkt)
Oblicz, jaką objętość wodoru, w przeliczeniu na warunki normalne, należy użyć
do całkowitego uwodornienia 6,5 g etynu, jeśli reakcja przebiega według równania:
CH ≡ CH + 2H
2
⎯
⎯ →
⎯
T
kat.,
CH
3
– CH
3
Obliczenia:
Odpowiedź:
Zadanie 21. (3 pkt)
Stosując wzory półstrukturalne (grupowe) związków organicznych, napisz równania
kolejnych reakcji zachodzących zgodnie z poniższym schematem.
CH
3
CH
2
OH
CH
3
CHO
CH
3
COOH
CH
3
COOCH
2
CH
3
CuO
1
Ag
2
O/NH
3
2
CH
3
CH
2
OH/H
2
SO
4
3
1. .......................................................................................................................................................
2. ......................................................................................................................................................
3. .......................................................................................................................................................
Zadanie 22. (2 pkt)
Do probówek oznaczonych numerami I – IV, zawierających substancje organiczne, dodano
zasadę sodową. Zawartość każdej z probówek ogrzano.
I II III IV
tłuszcz
tłuszcz
roślinny x
zwierzęcy x
parafina x
stearyna x
Podaj numery wszystkich probówek, w których otrzymano mydło.
..........................................................................................................................................................
Nr
zadania
18 19.1 19.2 19.3 20 21 22 suma
Maks.
liczba
pkt 2 1 1 1 2 3 2 12
Wypełnia
egzaminator! Uzyskana liczba pkt
Zadanie 18. (2 pkt)
Źródło: CKE 2007 (PP), zad. 22.
Egzamin maturalny z chemii
Poziom podstawowy
9
Zadanie 20. (2 pkt)
Oblicz, jaką objętość wodoru, w przeliczeniu na warunki normalne, należy użyć
do całkowitego uwodornienia 6,5 g etynu, jeśli reakcja przebiega według równania:
CH ≡ CH + 2H
2
⎯
⎯ →
⎯
T
kat.,
CH
3
– CH
3
Obliczenia:
Odpowiedź:
Zadanie 21. (3 pkt)
Stosując wzory półstrukturalne (grupowe) związków organicznych, napisz równania
kolejnych reakcji zachodzących zgodnie z poniższym schematem.
CH
3
CH
2
OH
CH
3
CHO
CH
3
COOH
CH
3
COOCH
2
CH
3
CuO
1
Ag
2
O/NH
3
2
CH
3
CH
2
OH/H
2
SO
4
3
1. .......................................................................................................................................................
2. ......................................................................................................................................................
3. .......................................................................................................................................................
Zadanie 22. (2 pkt)
Do probówek oznaczonych numerami I – IV, zawierających substancje organiczne, dodano
zasadę sodową. Zawartość każdej z probówek ogrzano.
I II III IV
tłuszcz
tłuszcz
roślinny x
zwierzęcy x
parafina x
stearyna x
Podaj numery wszystkich probówek, w których otrzymano mydło.
..........................................................................................................................................................
Nr
zadania
18 19.1 19.2 19.3 20 21 22 suma
Maks.
liczba
pkt 2 1 1 1 2 3 2 12
Wypełnia
egzaminator! Uzyskana liczba pkt
Zadanie 19. (1 pkt)
Źródło: CKE 2007 (PP), zad. 23.
Egzamin maturalny z chemii
Poziom podstawowy
10
Zadanie 23. (1 pkt)
Do naczynia zawierającego tłuszcz dodano wodę bromową. Zawartość naczynia wstrząśnięto
i zaobserwowano, że woda bromowa odbarwiła się.
Wskaż wzór tłuszczu, który znajdował się w naczyniu.
CH
2
OCOC
17
H
35
CHOCOC
17
H
35
CH
2
OCOC
17
H
35
CH
2
OCOC
15
H
31
CHOCOC
15
H
31
CH
2
OCOC
15
H
31
CH
2
OCOC
17
H
35
CHOCOC
15
H
31
CH
2
OCOC
17
H
35
CH
2
OCOC
17
H
35
CHOCOC
17
H
33
CH
2
OCOC
17
H
33
A.
B.
C.
D.
Informacja do zadania 24. i 25.
Mocznik podczas ogrzewania ulega reakcji przedstawionej równaniem:
O
C
H
2
N
NH
2
O
C
H
2
N
NH
2
+
ogrzewanie
O
C
H
2
N
N
H
O
C
NH
2
+
NH
3
Zadanie 24. (2 pkt)
Fragment cząsteczki organicznego produktu powyższej reakcji stanowi wiązanie
występujące między innymi w białkach. Narysuj ten fragment wzoru cząsteczki i podaj
nazwę tego wiązania.
Fragment wzoru: ...............................................................................................................................
Nazwa wiązania: ...............................................................................................................................
Zadanie 25. (1 pkt)
Określ, czy przedstawiona w informacji reakcja jest reakcją typu substytucji, kondensacji
czy polimeryzacji.
...........................................................................................................................................................
Nr zadania
23
24
25 suma
Maks. liczba pkt
1
2
1
4
Wypełnia
egzaminator! Uzyskana liczba pkt
11
Zadanie 20. (2 pkt)
Źródło: CKE 2006 (PP), zad. 20.
Egzamin maturalny z chemii
Arkusz I
9
Zadanie 19. (3 pkt)
W jednej probówce znajduje się wodny roztwór chlorku potasu, a w drugiej – wodny roztwór
bromku potasu.
Którego odczynnika – Br
2(aq)
czy Cl
2(aq)
– należy użyć, aby rozróżnić te roztwory? Podaj
wzór chemiczny wybranego odczynnika oraz przewidywane obserwacje. Napisz
w formie cząsteczkowej równanie reakcji, będącej podstawą rozróżnienia tych
roztworów.
Wzór odczynnika: ........................................................................................................................
Obserwacje: ..................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Równanie reakcji: ........................................................................................................................
Informacja do zadania 20. i 21.
Poniżej przedstawiono schemat ciągu reakcji, w wyniku których związek X można
przekształcić w związek Y.
CH
3
C
H
H
3
C
OH
X
Y
H
2
O
+
temp.
kat. (H
2
SO
4
)
+ [O]
Zadanie 20. (2 pkt)
Napisz wzory półstrukturalne (grupowe) związków X i Y.
Wzór związku X:
Wzór związku Y:
Zadanie 21. (1 pkt)
Posługując się podziałem charakterystycznym dla chemii organicznej, nazwij typ
reakcji, w której związek X jest substratem.
.......................................................................................................................................................
Nr
zadania
16 17.1 17.2
18 19.1 19.2 19.3 20 21
Maks.
liczba
pkt 1 1 2 1 1 1 1 2 1
Wypełnia
egzaminator! Uzyskana liczba pkt
Zadanie 21. (1 pkt)
Źródło: CKE 2006 (PP), zad. 25.
Egzamin maturalny z chemii
Arkusz I
11
Informacja do zadania 24. i 25.
Jednym z aminokwasów białkowych jest walina o następującym wzorze:
CH
C
O
CH
NH
2
C
H
3
CH
3
OH
Zadanie 24. (2 pkt)
Napisz w formie cząsteczkowej równania reakcji waliny z wodnym roztworem
wodorotlenku potasu i kwasem solnym (chlorowodorowym). Zastosuj wzory
półstrukturalne (grupowe) związków organicznych.
Równanie reakcji z wodnym roztworem wodorotlenku potasu:
Równanie reakcji z kwasem solnym (chlorowodorowym):
Zadanie 25. (1 pkt)
Podaj wzór półstrukturalny (grupowy) jednego z kwasów karboksylowych (z szeregu
homologicznego o wzorze ogólnym C
n
H
2n+1
COOH), zawierających tyle samo atomów
węgla co walina.
Wzór półstrukturalny (grupowy):
Nr zadania
22 23.1 23.2
24
25
Maks.
liczba
pkt 1 1 2 2 1
Wypełnia
egzaminator! Uzyskana liczba pkt
Egzamin maturalny z chemii
Arkusz I
11
Informacja do zadania 24. i 25.
Jednym z aminokwasów białkowych jest walina o następującym wzorze:
CH
C
O
CH
NH
2
C
H
3
CH
3
OH
Zadanie 24. (2 pkt)
Napisz w formie cząsteczkowej równania reakcji waliny z wodnym roztworem
wodorotlenku potasu i kwasem solnym (chlorowodorowym). Zastosuj wzory
półstrukturalne (grupowe) związków organicznych.
Równanie reakcji z wodnym roztworem wodorotlenku potasu:
Równanie reakcji z kwasem solnym (chlorowodorowym):
Zadanie 25. (1 pkt)
Podaj wzór półstrukturalny (grupowy) jednego z kwasów karboksylowych (z szeregu
homologicznego o wzorze ogólnym C
n
H
2n+1
COOH), zawierających tyle samo atomów
węgla co walina.
Wzór półstrukturalny (grupowy):
Nr zadania
22 23.1 23.2
24
25
Maks.
liczba
pkt 1 1 2 2 1
Wypełnia
egzaminator! Uzyskana liczba pkt
Egzamin maturalny z chemii
Poziom podstawowy
10
Informacja do zadania 23 i 24
Poniższy schemat ilustruje ciąg przemian, których początkowym substratem jest etyn
(acetylen):
etyn (acetylen) ⎯→
⎯
1
eten ⎯→
⎯
2
polimer
Zadanie 23. (1 pkt)
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie
reakcji oznaczonej na schemacie numerem 1.
.......................................................................................................................................................
Zadanie 24. (1 pkt)
Spośród przedstawionych poniżej wzorów podkreśl ten, który przedstawia budowę
fragmentu łańcucha polimeru stanowiącego produkt reakcji oznaczonej na schemacie
numerem 2.
A.
C
C
C
C
H
H
Cl
H
H
H
Cl
H
B.
C
C
C
C
H
H
H
H
H
H
H
H
C.
C
H
H
C C C
H
H
H
H
D.
C
C
C
C
H
H
H
H
Zadanie 25. (2 pkt)
W wysokiej temperaturze w obecności Al
2
O
3
alkohole ulegają reakcji dehydratacji
(odwodnienia). Podczas dehydratacji nasyconych alkoholi (alkanoli) o wzorze ogólnym
R
1
–CH(OH)–R
2
(gdzie R
1
≠ R
2
) oprócz wody powstaje mieszanina nierozgałęzionych
alkenów, które są względem siebie izomerami konstytucyjnymi.
Narysuj wzory półstrukturalne (grupowe) dwóch alkenów będących izomerami
konstytucyjnymi, które mogą powstać w wyniku dehydratacji butan-2-olu.
Wzór I:
Wzór II:
Informacja do zadania 21
Egzamin maturalny z chemii
Arkusz I
9
Zadanie 19. (3 pkt)
W jednej probówce znajduje się wodny roztwór chlorku potasu, a w drugiej – wodny roztwór
bromku potasu.
Którego odczynnika – Br
2(aq)
czy Cl
2(aq)
– należy użyć, aby rozróżnić te roztwory? Podaj
wzór chemiczny wybranego odczynnika oraz przewidywane obserwacje. Napisz
w formie cząsteczkowej równanie reakcji, będącej podstawą rozróżnienia tych
roztworów.
Wzór odczynnika: ........................................................................................................................
Obserwacje: ..................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Równanie reakcji: ........................................................................................................................
Informacja do zadania 20. i 21.
Poniżej przedstawiono schemat ciągu reakcji, w wyniku których związek X można
przekształcić w związek Y.
CH
3
C
H
H
3
C
OH
X
Y
H
2
O
+
temp.
kat. (H
2
SO
4
)
+ [O]
Zadanie 20. (2 pkt)
Napisz wzory półstrukturalne (grupowe) związków X i Y.
Wzór związku X:
Wzór związku Y:
Zadanie 21. (1 pkt)
Posługując się podziałem charakterystycznym dla chemii organicznej, nazwij typ
reakcji, w której związek X jest substratem.
.......................................................................................................................................................
Nr
zadania
16 17.1 17.2
18 19.1 19.2 19.3 20 21
Maks.
liczba
pkt 1 1 2 1 1 1 1 2 1
Wypełnia
egzaminator! Uzyskana liczba pkt
Egzamin maturalny z chemii
Poziom podstawowy
10
Informacja do zadania 23 i 24
Poniższy schemat ilustruje ciąg przemian, których początkowym substratem jest etyn
(acetylen):
etyn (acetylen) ⎯→
⎯
1
eten ⎯→
⎯
2
polimer
Zadanie 23. (1 pkt)
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie
reakcji oznaczonej na schemacie numerem 1.
.......................................................................................................................................................
Zadanie 24. (1 pkt)
Spośród przedstawionych poniżej wzorów podkreśl ten, który przedstawia budowę
fragmentu łańcucha polimeru stanowiącego produkt reakcji oznaczonej na schemacie
numerem 2.
A.
C
C
C
C
H
H
Cl
H
H
H
Cl
H
B.
C
C
C
C
H
H
H
H
H
H
H
H
C.
C
H
H
C C C
H
H
H
H
D.
C
C
C
C
H
H
H
H
Zadanie 25. (2 pkt)
W wysokiej temperaturze w obecności Al
2
O
3
alkohole ulegają reakcji dehydratacji
(odwodnienia). Podczas dehydratacji nasyconych alkoholi (alkanoli) o wzorze ogólnym
R
1
–CH(OH)–R
2
(gdzie R
1
≠ R
2
) oprócz wody powstaje mieszanina nierozgałęzionych
alkenów, które są względem siebie izomerami konstytucyjnymi.
Narysuj wzory półstrukturalne (grupowe) dwóch alkenów będących izomerami
konstytucyjnymi, które mogą powstać w wyniku dehydratacji butan-2-olu.
Wzór I:
Wzór II:
Informacja do zadania 20

12
Zadanie 23. (2 pkt)
Źródło: CKE 2005 (PP), zad. 28.
łśś
ś ż
ą ł ą
ź łą ą
ą
ą ł
ą
ż ż ć ł ż ł
łń ż
ę żą ść ę ńą żść
ł łń ę ż
ł ę ę ł
ł ń ż ś ęą
źł ł ł
Ś
•
ń ż ęą źł ł
ż ęą źł ł
•
ę ł ł
ż ę ś ę ńą
ż ęą źł ł
ż ęą źł ł
ł
Zadanie 22. (2 pkt)
Źródło: CKE 2005 (PP), zad. 26.
ż ą ę ż ą
► ń
ż ł
ę
ą
ś
ą
ł
ą ć ń ą
ę
ą
ł
ą
ż ą ę ż ą
► ń
ż ł
ę
ą
ś
ą
ł
ą ć ń ą
ę
ą
ł
ą
ż ą ę ż ą
► ń
ż ł
ę
ą
ś
ą
ł
ą ć ń ą
ę
ą
ł
ą
Egzamin maturalny z chemii
Poziom podstawowy
10
Informacja do zadania 23 i 24
Poniższy schemat ilustruje ciąg przemian, których początkowym substratem jest etyn
(acetylen):
etyn (acetylen) ⎯→
⎯
1
eten ⎯→
⎯
2
polimer
Zadanie 23. (1 pkt)
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie
reakcji oznaczonej na schemacie numerem 1.
.......................................................................................................................................................
Zadanie 24. (1 pkt)
Spośród przedstawionych poniżej wzorów podkreśl ten, który przedstawia budowę
fragmentu łańcucha polimeru stanowiącego produkt reakcji oznaczonej na schemacie
numerem 2.
A.
C
C
C
C
H
H
Cl
H
H
H
Cl
H
B.
C
C
C
C
H
H
H
H
H
H
H
H
C.
C
H
H
C C C
H
H
H
H
D.
C
C
C
C
H
H
H
H
Zadanie 25. (2 pkt)
W wysokiej temperaturze w obecności Al
2
O
3
alkohole ulegają reakcji dehydratacji
(odwodnienia). Podczas dehydratacji nasyconych alkoholi (alkanoli) o wzorze ogólnym
R
1
–CH(OH)–R
2
(gdzie R
1
≠ R
2
) oprócz wody powstaje mieszanina nierozgałęzionych
alkenów, które są względem siebie izomerami konstytucyjnymi.
Narysuj wzory półstrukturalne (grupowe) dwóch alkenów będących izomerami
konstytucyjnymi, które mogą powstać w wyniku dehydratacji butan-2-olu.
Wzór I:
Wzór II:
Informacja do zadania 22

13
Zadanie 24. (3 pkt)
Źródło: CKE 2005 (PP), zad. 30.
ż ć ą żś ż
ą ż ś
ż
ż
ęż
ś ą ć
ś
ą
ś
→
CH
3
→
CH
2
Br
CH
3
Wyszukiwarka
Podobne podstrony:
popr Chemia PP Weglowodory
PROBNA MATURA GRU2007 Chemia PP odp
2010 klucz chemia pp
2008 chemia pp (2)
zw org 2 kw kar id 593471 Nieznany
chemia1 pp o2012
popr Chemia PR weglowodory
2007 operon klucz chemia pp
2009 operon klucz chemia pp
chemia pp 2011
2010 operon chemia pp
chemia1 pp p2012
chemia pp pr odp klucz(1) id 11 Nieznany
2007 operon chemia pp
zw org 4 zw wiefun id 593472 Nieznany
7 Chem2 Zbiór zadań Załączniki Właściwości zw org Układ
typy reakcji zw org i ich miechanizmy rząd reakcji M Ziętara
więcej podobnych podstron