TYPY REAKCJI
TYPY REAKCJI
ZWIĄZKÓW
ZWIĄZKÓW
OGRANICZNYCH I
OGRANICZNYCH I
ICH
ICH
MECHANIZMY.
MECHANIZMY.
RZĄD REAKCJI.
RZĄD REAKCJI.
Autor
prezentacji:
Magdalena
Ziętara

POJĘCIE „MECHANIZMU
POJĘCIE „MECHANIZMU
REAKCJI”
REAKCJI”
MECHANIZM REAKCJI TO SPOSÓB
W JAKI PRZEBIEGA DANY PROCES
CHEMICZNY, TZN. JAKA JEST
DROGA OD SUBSTRATÓW DO
PRODUKTÓW.

RZĄD REAKCJI
RZĄD REAKCJI
Rząd reakcji jest równy sumie wykładników
potęgowych stężeń substratu w równaniu
kinetycznym.
Typowym przykładem
reakcji pierwszego rzędu
jest hydroliza
bromku t-butylu o szybkości zależnej tylko od stężenia
substratu organicznego.
(CH3)
3
C-Br + H
2
O (CH
3
)
3
C-OH + HBr
v= k[
(CH
3
)
3
CBr]
Jako
reakcja drugiego rzędu
przebiega np. hydroliza bromku
metylu w środowisku zasadowym. Szybkość tej
reakcji zależy nie tylko od stężenia substratu organicznego, lecz
także od stężenia drugiego partnera reakcji- jonu
hydroksylowego
CH
3
Br + OH
-
CH
3
OH +Br
-
v= k[CH
3
Br][OH
-
]
REAKCJE PIERWSZEGO RZĘDU SĄ ZWYKLE
REAKCJE PIERWSZEGO RZĘDU SĄ ZWYKLE
JEDNOCZĄSTECZKOWE
JEDNOCZĄSTECZKOWE
(W STADIUM
(W STADIUM
DECYDUJĄCYM O SZYBKOŚCI CAŁEGO
DECYDUJĄCYM O SZYBKOŚCI CAŁEGO
PROCESU BIORĄ UDZIAŁ CZĄSTECZKI
PROCESU BIORĄ UDZIAŁ CZĄSTECZKI
TYLKO JEDNEGO Z SUBSTRATÓW), A
TYLKO JEDNEGO Z SUBSTRATÓW), A
REAKCJE DRUGIEGO RZĘDU
REAKCJE DRUGIEGO RZĘDU
DWUCZĄSTECZKOWE
DWUCZĄSTECZKOWE
. W REAKCJACH
. W REAKCJACH
DWUCZĄSTECZKOWYCH
DWUCZĄSTECZKOWYCH
NAJWOLNIEJSZY
NAJWOLNIEJSZY
ETAP
ETAP
WYMAGA UDZIAŁU CZĄSTECZEK
WYMAGA UDZIAŁU CZĄSTECZEK
OBU PARTNERÓW REAKCJI.
OBU PARTNERÓW REAKCJI.
TYPY REAKCJI CHEMICZNYCH
TYPY REAKCJI CHEMICZNYCH
ZWIĄZKÓW ORGANICZNYCH.
ZWIĄZKÓW ORGANICZNYCH.
W chemii organicznej wyróżnia się
W chemii organicznej wyróżnia się
cztery
cztery
podstawowe typy przemian:
podstawowe typy przemian:
1.
1.
REAKCJA PODSTAWIENIA (
REAKCJA PODSTAWIENIA (
SUBSTYTUCJI
SUBSTYTUCJI
)
)
2. REAKCJA ADDYCJI (
2. REAKCJA ADDYCJI (
PRZYŁĄCZENIA
PRZYŁĄCZENIA
)
)
!!!TYLKO ZWIĄZKI NIENASYCONE!!!
!!!TYLKO ZWIĄZKI NIENASYCONE!!!
3. REAKCJA ELIMINACJI
3. REAKCJA ELIMINACJI
4. REAKCJA IZOMERYZACJI
4. REAKCJA IZOMERYZACJI

Kilka słów na temat sposobu
Kilka słów na temat sposobu
rozrywania wiązań
rozrywania wiązań
• Wszystkie zachodzące reakcje chemiczne polegają na
tym, że w cząsteczkach substratu rozrywają się
wiązania, następnie tworzą się inne, co skutkuje
powstaniem produktu. Sposób w jaki nastąpi rozerwanie
wiązań ma olbrzymi wpływ na przebieg prowadzonej
reakcji chemicznej i jej wynik.
• Należy wspomnieć, że w cząsteczkach związków
organicznych atomy połączone są WIĄZANIAMI
WIĄZANIAMI
KOWALENCYJNYMI
KOWALENCYJNYMI
, tworzonymi przez WIĄŻĄCE PARY
WIĄŻĄCE PARY
ELEKTRONOWE.
ELEKTRONOWE.
Podczas reakcji wspólna para elektronowa zostaje
Podczas reakcji wspólna para elektronowa zostaje
rozerwana homolitycznie
rozerwana homolitycznie
lub
lub
heterolitycznie
heterolitycznie
.
.
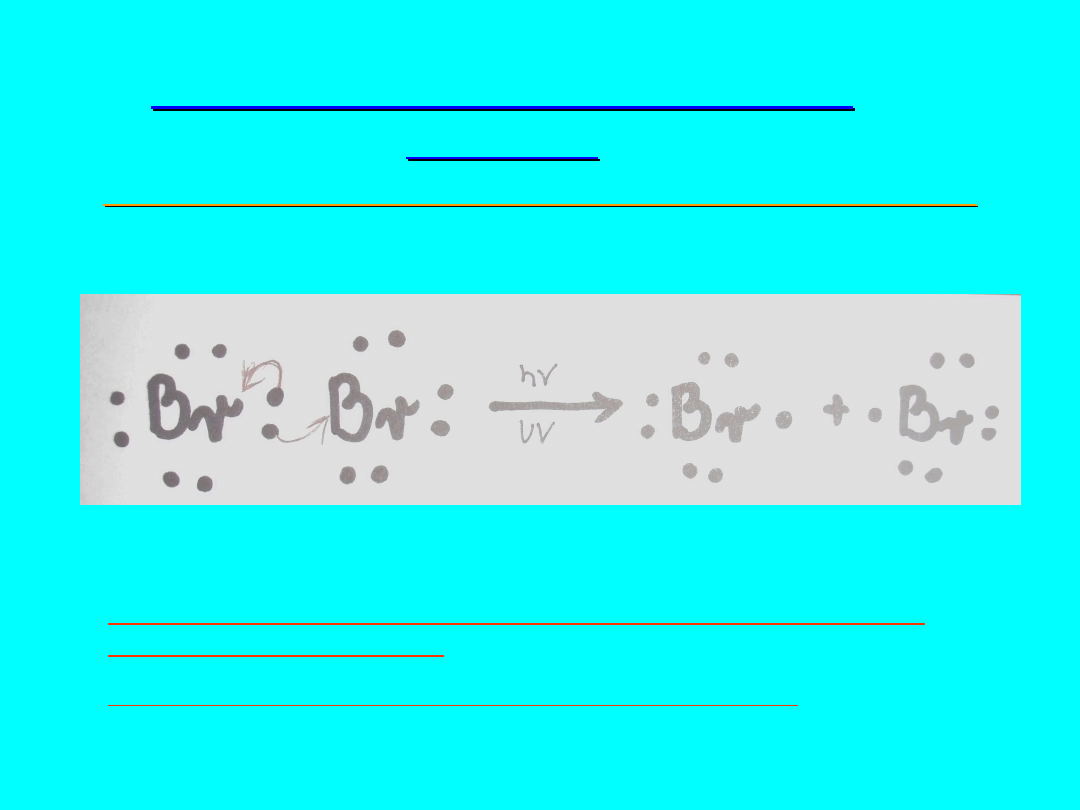
HOMOLITYCZNE ROZRYWANIE
HOMOLITYCZNE ROZRYWANIE
WIĄZAŃ
WIĄZAŃ
HOMOLIZA [z gr. homoios(jednakowy)+lysis(rozwiązanie)]
HOMOLIZA [z gr. homoios(jednakowy)+lysis(rozwiązanie)]
Przykładem jest reakcja rodnikowa (przykład tej reakcji na cząsteczce
bromu)
W cząsteczce bromu wiązanie ulega homolitycznemu
zerwaniu, przy każdym atomie bromu pozostaje jeden
niesparowany elektron, zwany RODNIKIEM,znajdujący się na
powłokach walencyjnych.
Powstające atomy bromu są elektrycznie obojętne.
!!!REAKCJE TE NAZYWAMI
!!!REAKCJE TE NAZYWAMI
RODNIKOWYMI!!!
RODNIKOWYMI!!!

HETEROLITYCZNE ROZRYWANIE WIĄZAŃ
HETEROLITYCZNE ROZRYWANIE WIĄZAŃ
Polega ono na tym, że wiążąca para elektronowa pozostaje przy
jednym z atomów
(TYM O WYŻSZEJ ELEKTROUJEMNOŚCI).
Atom
ten (lub grupa atomów) staje się
ANIONEM
, drugi atom(lub
grupa atomów)
KATIONEM
.
HETEROLIZA [gr. Heteros(inny)+lysis(rozwiązanie)]
HETEROLIZA [gr. Heteros(inny)+lysis(rozwiązanie)]
!!!REAKCJE TE NAZYWAMY
!!!REAKCJE TE NAZYWAMY
JONOWYMI!!!
JONOWYMI!!!
Przykładem jest dysocjacja chlorowcowodoru:
ENERGIA DYSOCJACJI TO MINIMALNA ENERGIA POTRZEBNA DO ROZERWANIA
ENERGIA DYSOCJACJI TO MINIMALNA ENERGIA POTRZEBNA DO ROZERWANIA
WIĄZANIA
WIĄZANIA
Może ona być dostarczona w postaci ciepła (odpowiednio wysokiej temperatury
Może ona być dostarczona w postaci ciepła (odpowiednio wysokiej temperatury
reakcji), promieniowania (np.
reakcji), promieniowania (np.
UV) lub w inny sposób.
UV) lub w inny sposób.
ENERGIA
DYSOCJACJI

Fragmenty heterolizy,
Fragmenty heterolizy,
w których ładunki
w których ładunki
znajdują się przy
znajdują się przy
atomach węgla
atomach węgla
nazywane są
nazywane są
odpowiednio
odpowiednio
karboanionem
karboanionem
i
i
karbokationem
karbokationem
.
.
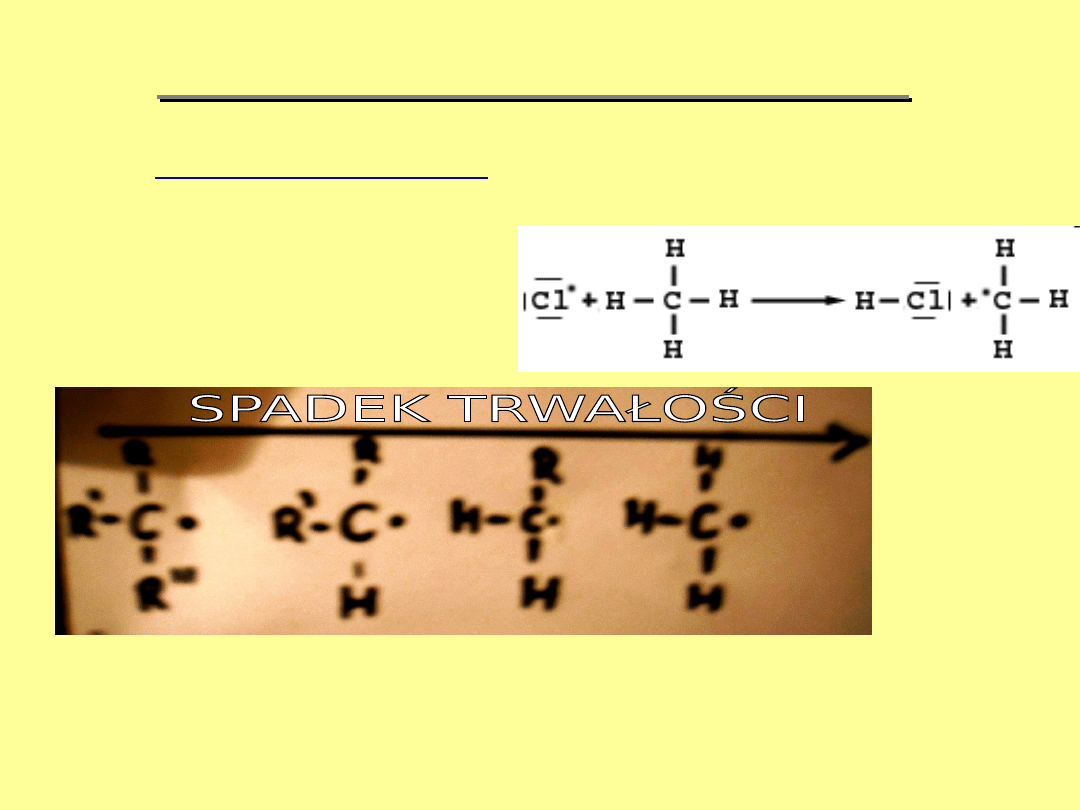
RODZAJE REAGENTÓW
RODZAJE REAGENTÓW
1. WOLNE RODNIKI
Rodnik- atom lub cząsteczka posiadający niesparowany
elektron
Np. rodnik metylowy
RODNIK
METYLOW
Y
RODNIK
DRUGO
-RZĘDOW
Y
RODNIK
PIERWSZ
O-
RZĘDOWY
RODNIK
TRZECIO-
RZĘDOWY
JAK WIDAĆ NA POWYŻSZYM SCHEMIACIE TRWAŁOŚĆ RODNIKÓW
ROŚNIE WRAZ Z WZROSTEM ICH RZĘDOWOŚCI!!!!
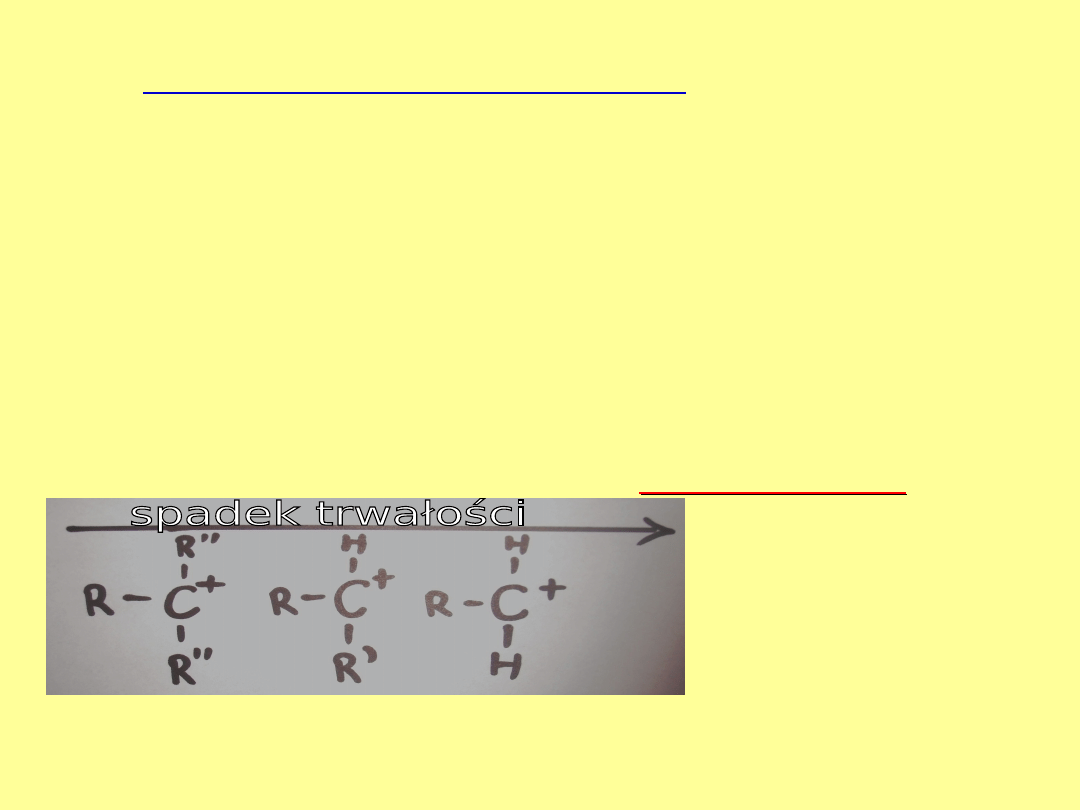
2. CZYNNIKI ELEKTROFILOWE
•
Kwasy Lewisa, czyli drobiny o deficycie elektronów (czyli
posiadają tzw.lukę elektronową) np, NO
2
+
, C
2
H
5
+
•Drobiny te dążą do połączenia się z wolnymi parami
elektronowymi innych atomów, cząsteczek bądź jonów; W
związku z tym nazywamy je
ELEKTROFILAMI ( „filują na
elektrony” )
•NAJCZĘŚCIEJ SĄ TO PROSTE KATIONY LUB FRAGMENTY
ZŁOŻONEJ CZĄSTECZKI OBDAŻONY ŁADUNKIEM +
•Szczególną grupę stanowią tutaj KARBOKATIONY
KARBOKATIONY
KARBOKATION
TRZECIORZĘDO
WY
KARBOKATION
DRUGORZĘDOW
Y
KARBOKATION
PIERWSZORZĘDOW
Y

KARBOKATION
KARBOKATION
• ładunek dodatni jest
zlokalizowany na atomie węgla
•Jest to kwas Lewisa
•Posiada znaczny deficyt
elektronów, posiada właściwości
elektrofilowe
•Podatny na atak nukleofilowy

3. CZYNNIKI NUKLEOFILOWE
•Są to zasady Lewisa, czyli aniony lub
cząsteczki obojętne mające wolne pary
elektronowe (np. NH
3
H
2
O)
•Drobiny te dążą do kontaktu z kationami i
cząsteczkami posiadającymi deficyt
elektronowy. W związku z tym nazywamy je
NUKLEOFILAMI („filują na ładunek +”)
•Najczęściej spotykane czynniki nukleofilowe
to: proste aniony, cząsteczki w których
występuje przynajmniej jeden atom
posiadający wolną parę elektronową
Szczególnymi czynnikami nukleofilowymi są
KARBOANIONY.
KARBOANIONY.

KARBOANION
KARBOANION
•Ładunek ujemny jest
zlokalizowany na atomie węgla
•Jest to zasada Lewisa
•Karboanion posiada nadmiarową
wolną parę elektronową i z tego
powodu posiada silne własności
nukleofilowe

ETAP PIERWSZY (INICJACJI)
Pod wpływem kwantów światła lub wysokiej temperatury, substancji
rodnikotwórczych np.nadtlenków, następuje dysocjacja cząsteczki chloru :
ETAP DRUGI (PROPAGACJA)
Aktywny rodnik chloru atakuje cząsteczkę metanu, odrywając od niej atom
wodoru, tworząc
rodnik metylowy
. Następnie rodnik metylowy reaguje z inną
cząsteczką chloru, co prowadzi do powstania
chlorku metylu
i uwolnienia
kolejnego rodnika chloru
Jest to reakacja
łańcuchowa!!
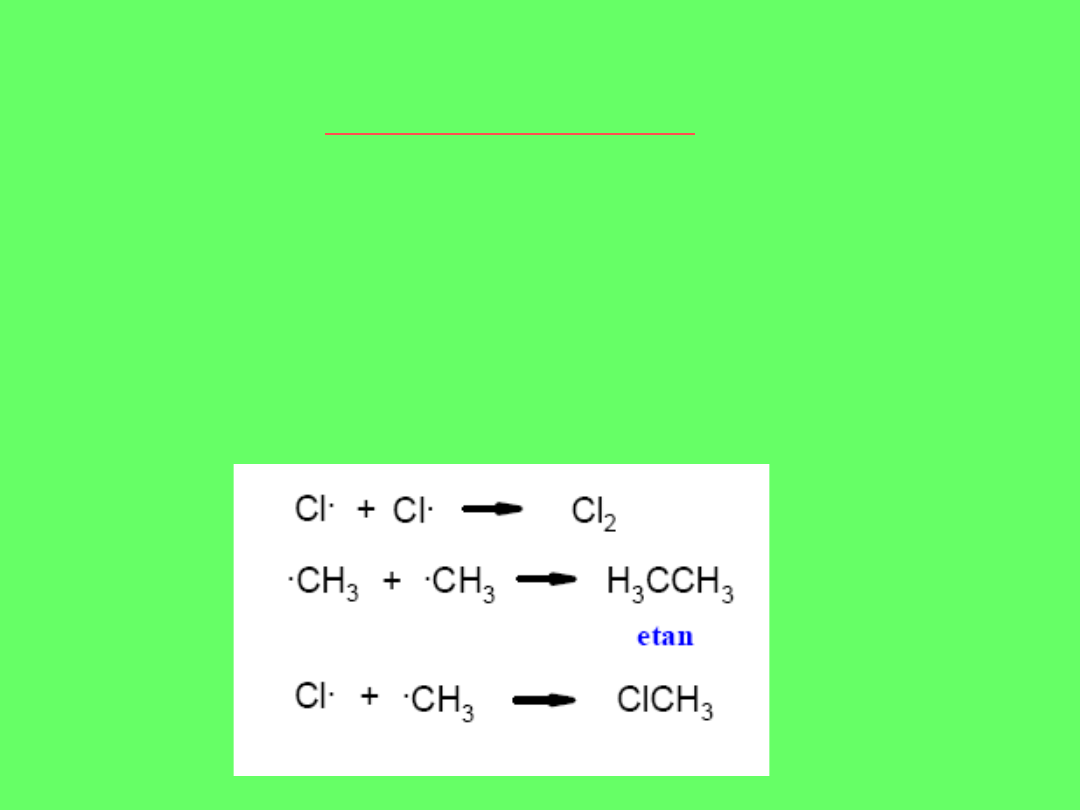
ETAP TRZECI (TERMINACJA)
Proces zostaje przerwany na skutek zderzenia dwóch
rodników- rekombinacja, albo też przez wytracenie energii, np.
poprzez zderzenie rodnika ze ściankami naczynia. Powstaje w
związku z tym mieszanina produktów.
W kwestii celowego zakończenia procesu do mieszaniny
reakcyjnej dodajemy też ilość substancji działającej jak
inhibitor. Łączy się ona z rodnikami, tworząc nowe rodniki o
małej reaktywności, które nie są zdolne do kontynuowania
reakcji łańcuchowych.
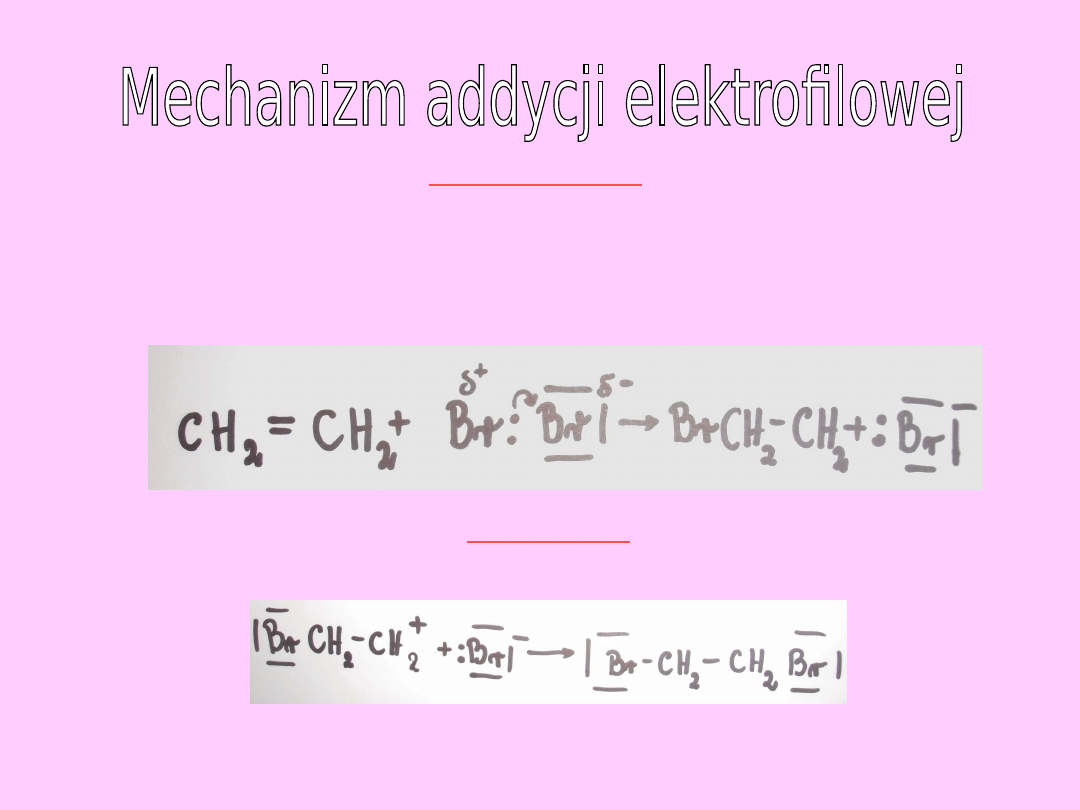
ETAP PIERWSZY
Pod wpływem elektronów wiązania pi cząsteczka Br
2
ulega
polaryzacji. Dodatnio naładowany koniec cząsteczki bromu
stanowy czynnik elektrofilowy, który atakuje podwójne
wiązanie węglowodoru nienasyconego.
ETAP DRUGI
Powstający karbokation w tym etapie łączy się z jonem bromkowym:
!!! O szybkości addycji bromu do etenu decyduje etap tworzenia się
karbokationu, gdyż jest to etap najwolniejszy (etap z jonami bromu
biegnie bardzo szybko)!!!
+
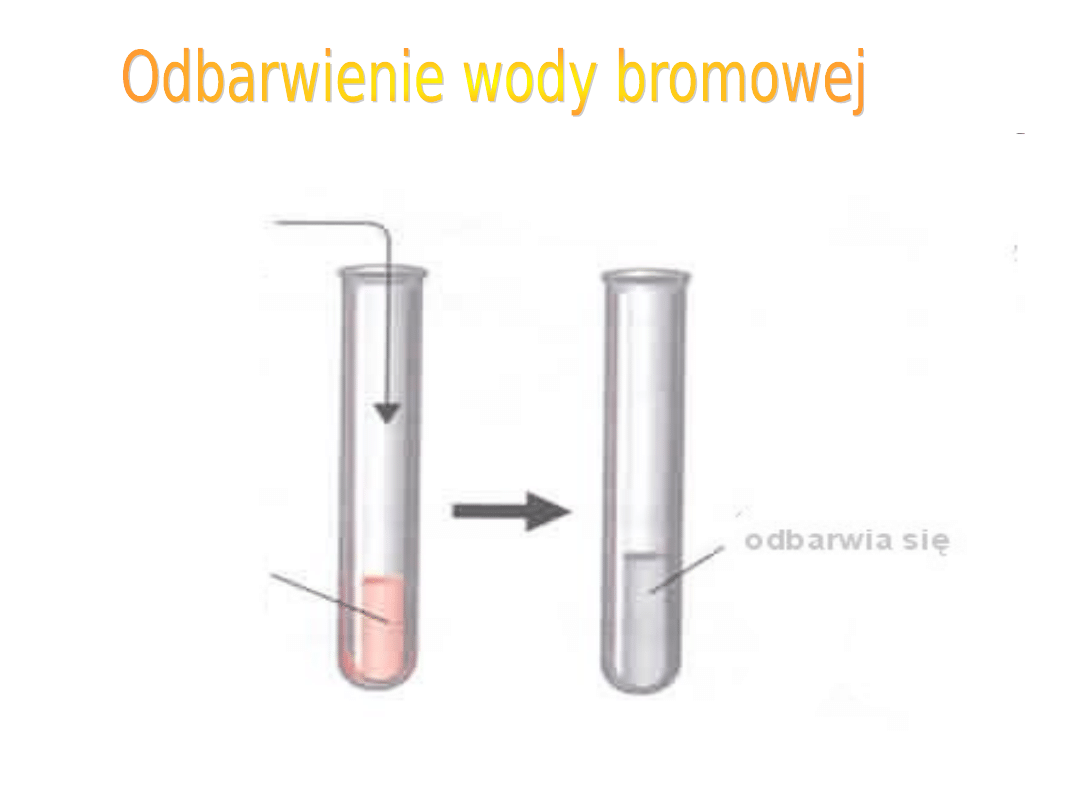
WODA
BROMOWA
WĘGLOWODÓR
NIENASYCONY
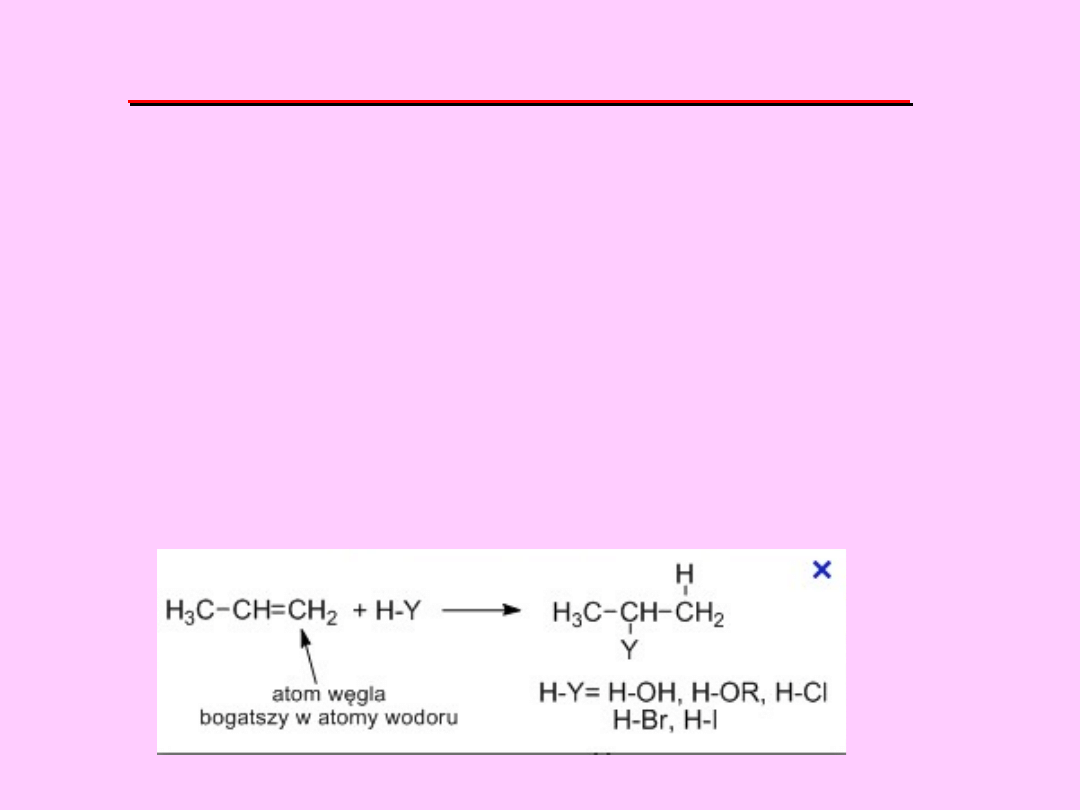
REGUŁA MARKOWNIKOWA
REGUŁA MARKOWNIKOWA
W REAKCJI ADDYCJI
W REAKCJI ADDYCJI
ELEKTROFILOWEJ ZWIĄZKU TYPU
ELEKTROFILOWEJ ZWIĄZKU TYPU
HY
HY
DO NIESYMETRYCZNEGO ALKENU
DO NIESYMETRYCZNEGO ALKENU
PROTON PRZYŁĄCZA SIĘ DO TEGO
PROTON PRZYŁĄCZA SIĘ DO TEGO
ATOMU WĘGLA, Z KTÓRYM JEST JUŻ
ATOMU WĘGLA, Z KTÓRYM JEST JUŻ
POŁĄCZONA WIĘKSZA LICZBA
POŁĄCZONA WIĘKSZA LICZBA
ATOMÓW WODORU, A GRUPA
ATOMÓW WODORU, A GRUPA
Y
Y
DO
DO
ATOMU WĘGLA UBOŻSZEGO W
ATOMU WĘGLA UBOŻSZEGO W
ATOMY WODORU.
ATOMY WODORU.
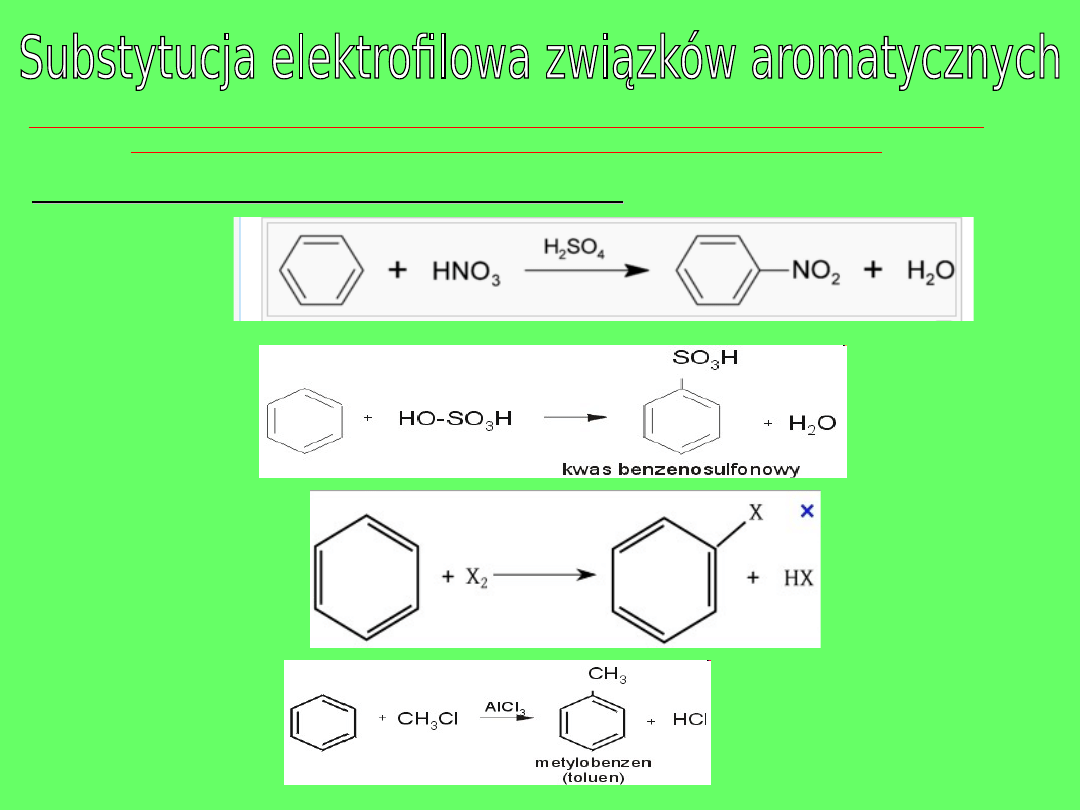
OBECNOŚĆ WIĄZAŃ π W CZĄSTECZKACH ZW.AROMATYCZNYCH SPRAWIA, ŻE SĄ
ONE PODATNE NA DZIAŁANIE CZYNNIKÓW ELEKTROFILOWYCH.
Najważniejsze substytucje elektrofilowe to:
Najważniejsze substytucje elektrofilowe to:
•
NITROWANIE
NITROWANIE
Stęż.
Stęż.
•
SULFONOWANIE
SULFONOWANIE
•
HALOGENOWANIE
HALOGENOWANIE
•
ALKILOWANIE
ALKILOWANIE
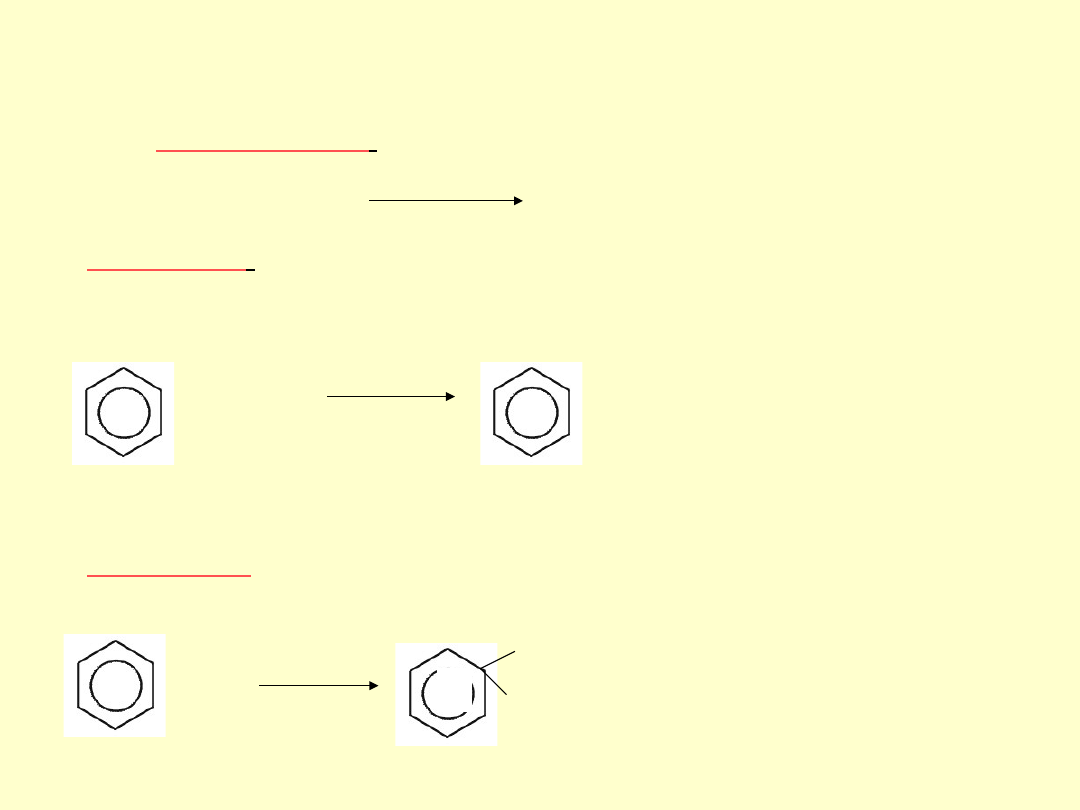
Etap pierwszy
polega na wytworzeniu czynnika
elektrofilowego E
+
EY E
+
+ Y
-
Etap drugi
polega na zaatakowaniu pierścienia aromatycznego
przez czynnik elektrofilowy. W wyniku jego oddziaływania ze
zdelokalizowaną chmurą elektronową tworzy nietrwałe połączenie
KOMPLEKS π
+
E
+
------ E
+
BENZEN CZYNNIK KOMPLEKS
π
ELEKTROFILOWY
Etap trzeci
polega na przyłączeniu czynnika elektrofilowego do
jednego z atomów C, następuje przekształcenie kompleksu π w
kompleks σ
------ E
+
+
E
H
KOMPLEKS π
KOMPLEKS σ
!!!NIEPEŁNE KÓŁKO TO
ZNAK ZABURZONEJ
AROMATYCZNOŚCI TEGO
KARBOKATIONU!!!
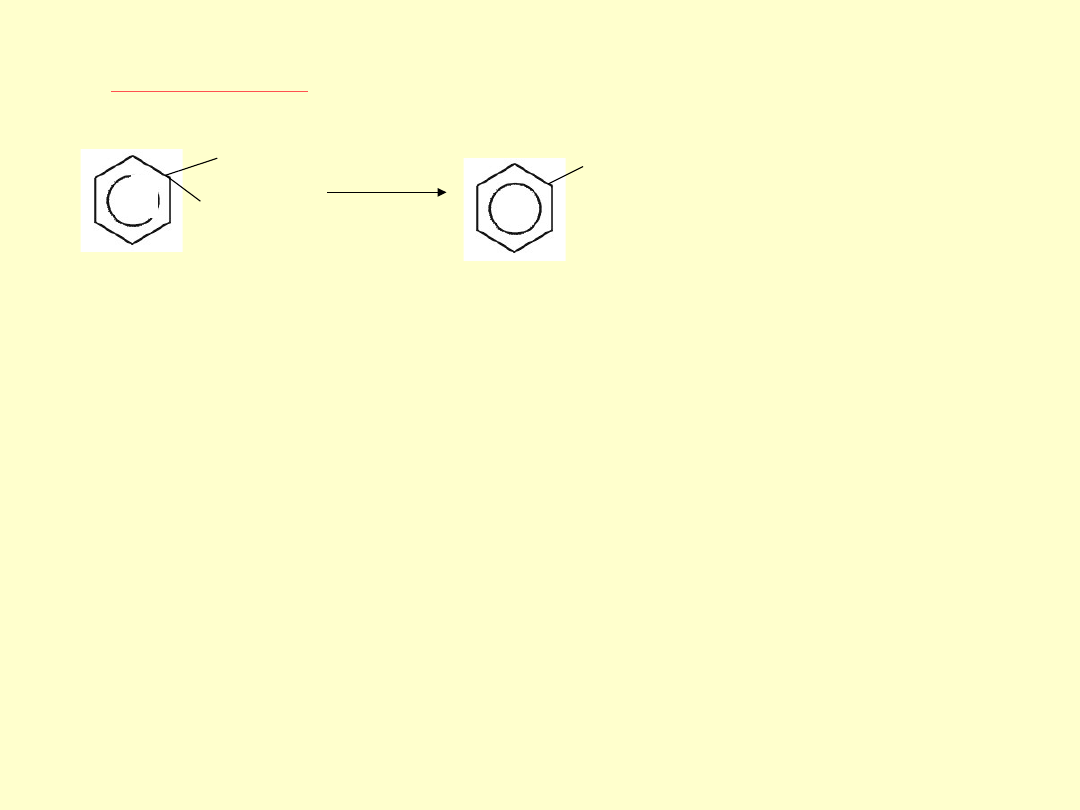
Etap czwarty
polega na odłączeniu protonu od kompleksu σ i
utworzeniu produktu substytucji elektrofilowej
+
E
H + Y
-
E
+ HY
TWORZENIE SIĘ KOMPLEKSU σ JEST ETAPEM
TWORZENIE SIĘ KOMPLEKSU σ JEST ETAPEM
NAJWOLNIEJSZYM, DLATEGO DECYDUJE O
NAJWOLNIEJSZYM, DLATEGO DECYDUJE O
SZYBKOŚCI REAKCJI.
SZYBKOŚCI REAKCJI.
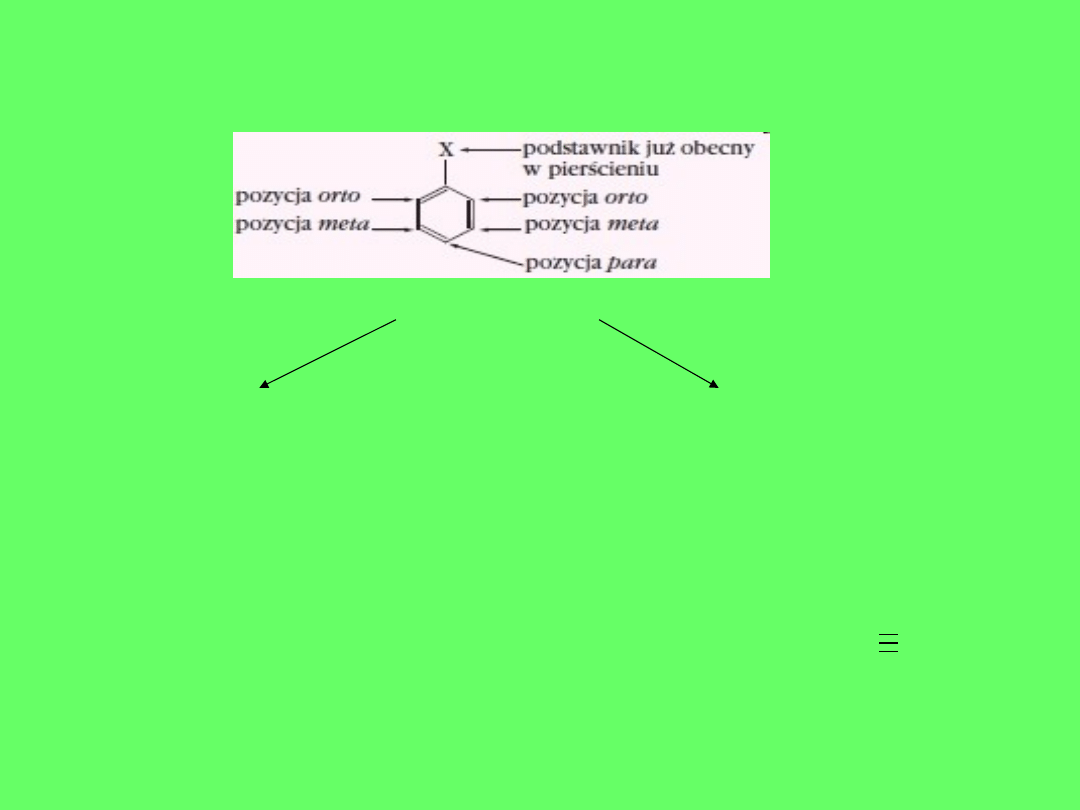
WPŁYW PODSTAWNIKÓW NA PRZEBIEG SUBSTYTUCJI
WPŁYW PODSTAWNIKÓW NA PRZEBIEG SUBSTYTUCJI
ELEKTROFILOWEJ W POCHODNYCH BENZENU
ELEKTROFILOWEJ W POCHODNYCH BENZENU
PODSTAWNIKI
PIERWSZORZĘDOWE DRUGORZĘDOWE
KIERUJĄ PODSTAWIENIE
W POZYCJĘ orto i para
KIERUJĄ PODSTAWIENIE
W POZYCJĘ meta
Są to np.
•Grupa wodorotlenowa
-OH
-
•Grupa aminowa -NH
2
•Grupa metylowa -CH
3
•Grupa etylowa –C
2
H
5
•Atom chloru, bromu,
jodu
Są to np.
Grupa aldehydowa -CHO
Grupa karboksylowa –
COOH
Grupa nitrylowa –CN(-C
N)
Grupa nitrowa -NO
2

S
S
N
N
Z badań kinetycznych nad substytucją nukleofilową
wynika, że może ona odbywać się według mechanizmu
jednocząsteczkowego S
N
1 (szybkość zależy tylko od
stężenia halogenku alkolu) lub dwucząsteczkowego S
N
2
(szybkośc zależy do od stężeń obu reagentów:
halogenku i nukleofila)
REAKCJA TA SŁUŻY DO WYMIANY ATOMÓW HALOGENKÓW
(CHLORU, BROMU, JODU) LUB NA INNE GRUPY FUNKCYJNE
SCHEMAT OGÓLNY TEJ SUBSTYTUCJI:
SUBSTRAT+ NUKLEOFIL PRODUKT + GRUPA OPUSZCZAJĄCA
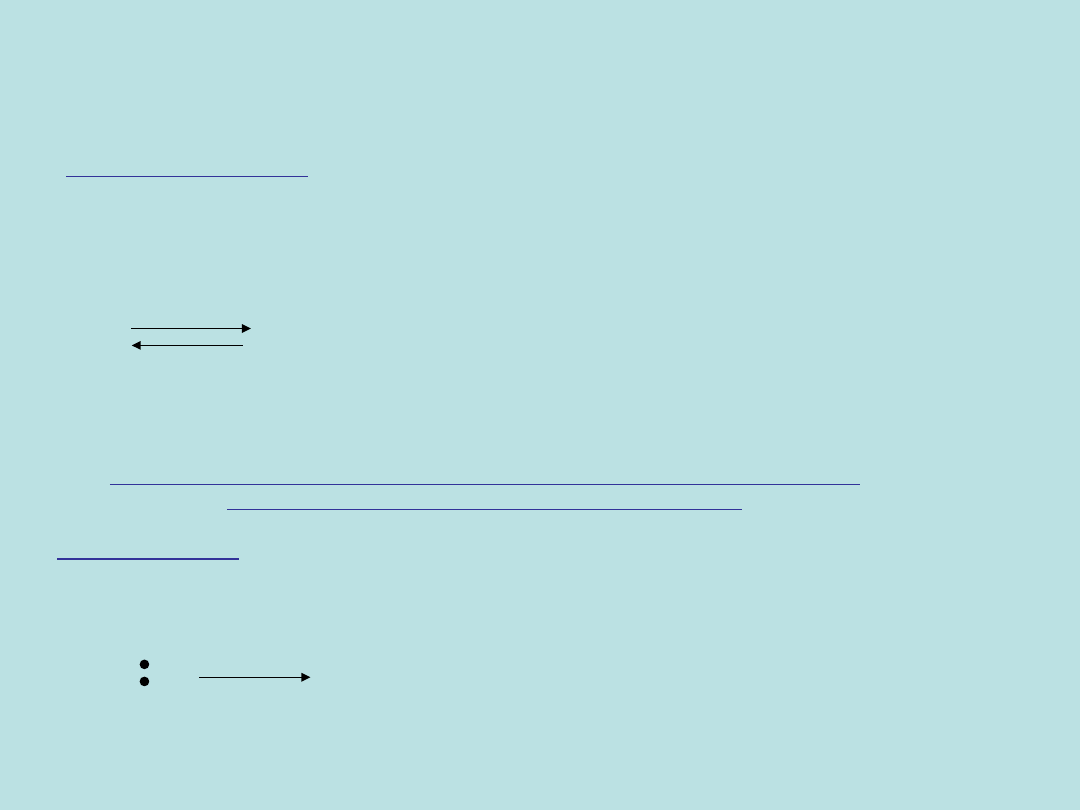
MECHANIZM S
MECHANIZM S
N
N
1 (dwuetapowy)
1 (dwuetapowy)
ETAP PIERWSZY
Zachodzi rozpad wiązania R-X (dysocjacja wiazania węgiel-
fluorowiec), prowadzący do powstania odpowiedniego
karbokationu, który następnie reaguje z cząsteczką odczynnika
nukleofilowego.
R-X R
+
+ X
-
POWOLI
KARBOKATION
ODCHODZĄCA
NP.FLUOROWIEC
JEST TO ETAP NAJWOLNIEJSZY, GDYŻ NASTĘPUJE ROZPAD MAŁO
SKŁONNEGO DO DYSOCJACJI WIĄZANIA C-X.
ETAP DRUGI
Bardzo szybko po utworzeniu reaktywne karbokationy reagują
z jakimkolwiek obecnym w roztworze nukleofilem.
R
+
+
v= k [RX]
Nu
-
szybko
R-Nu
Produkt
podstawienia
V= k [RX] [Nu
-
]
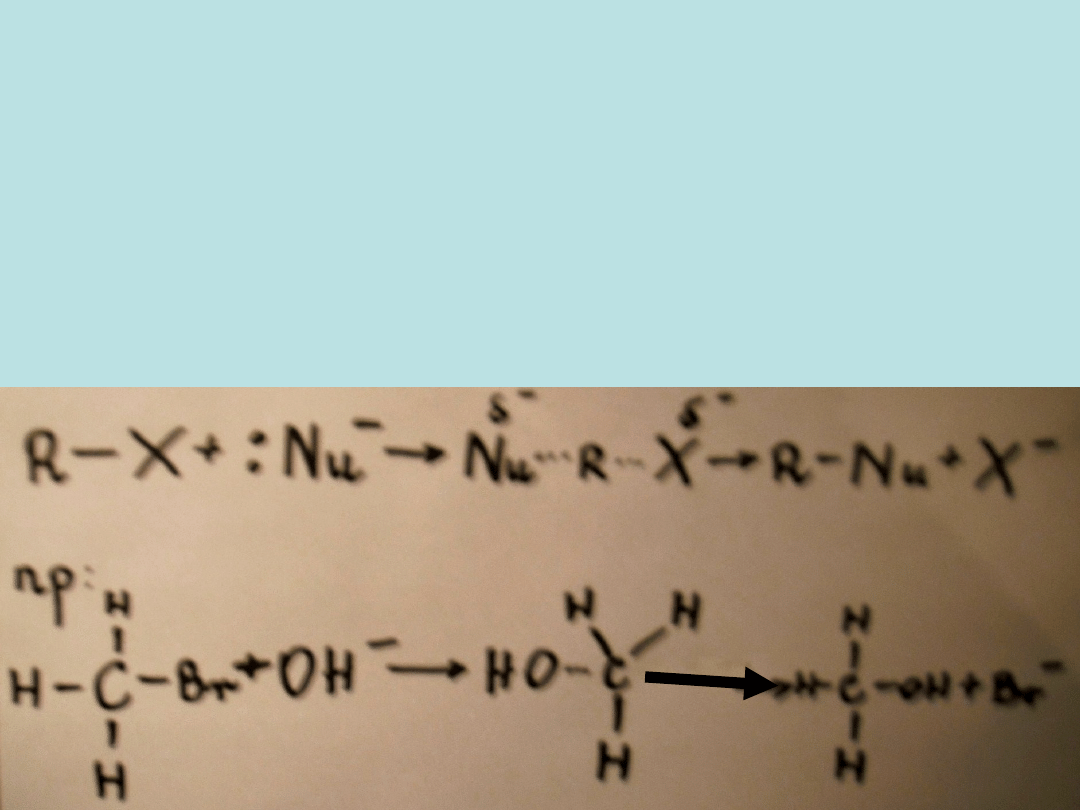
W PRZECIWIEŃSTWIE DO MECHANIZMU SN1, DWUCZĄSTECZKOWY
MECHANIZM SN2 JEST JEDNOETAPOWY. W REAKCJACH PRZEBIEGAJĄCYCH
WEDŁUG TEGO MECHANIZMU ROZPAD WIĄZANIA C-X I POWSTANIE
WIĄZANIA C-Nu SĄ PROCESAMI JEDNOCZESNYMI W OBRĘBIE KOMPLEKSU
AKTYWNEGO, POWSTAJĄCEGO W WYNIKU ZDERZENIA CZĄSTECZKI
ODCZYNNIKA NUKLEOFILOWEGO Z CZĄSTECZKĄ R-X. W ŚWIETLE
TAKIEGO MECHANIZMU DAJE SIĘ ZAUWAŻYĆ, ŻE WZROST STĘŻENIA
ODCZYNNIKA NUKLEOFILOWEGO POWODUJE WZROST SZYBKOŚCI
REAKCJI, ZGODNIE Z DANYMI KINETYCZNYMI.
KOMPLEKS
AKTYWNY
MECHANIZM S
MECHANIZM S
N
N
2 (dwuetapowy)
2 (dwuetapowy)

Do eliminacji dochodzi gdy przy atomie C
sąsiadującym z grupą CX, znajduje się atom
wodoru.
Przykład takiej reakcji:
Cechą charakterystyczną dla reakcji eliminacji
jest powstawanie produktów ubocznych.
Eliminacja (podobnie jak substytucja
nukleofilowa) może przebiegać według dwóch
mechanizmów- E1 i E2
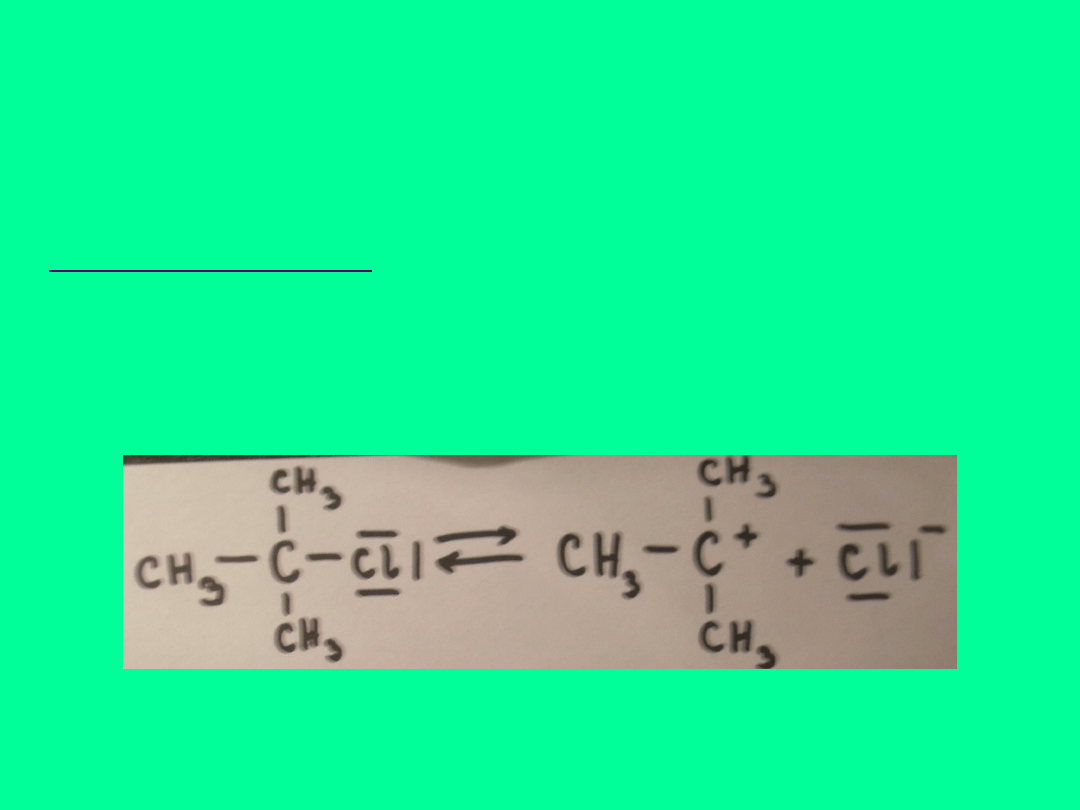
ELIMINACJA JEDNOCZĄSTECZKOWA
ELIMINACJA JEDNOCZĄSTECZKOWA
E1
E1
Omówienia na przykładzie reakcji tert-butylu
ETAP PIERWSZY
Polega na odłączeniu się od atomu węgla atomu
chloru wraz z wiążącą parą elektronową (jonu
chlorkowego) i powstanie karbokationu:
CHLOREK TERT-
BUTYLU
KATION TERT-BUTYLOWY
ANION
CHLORKOWY
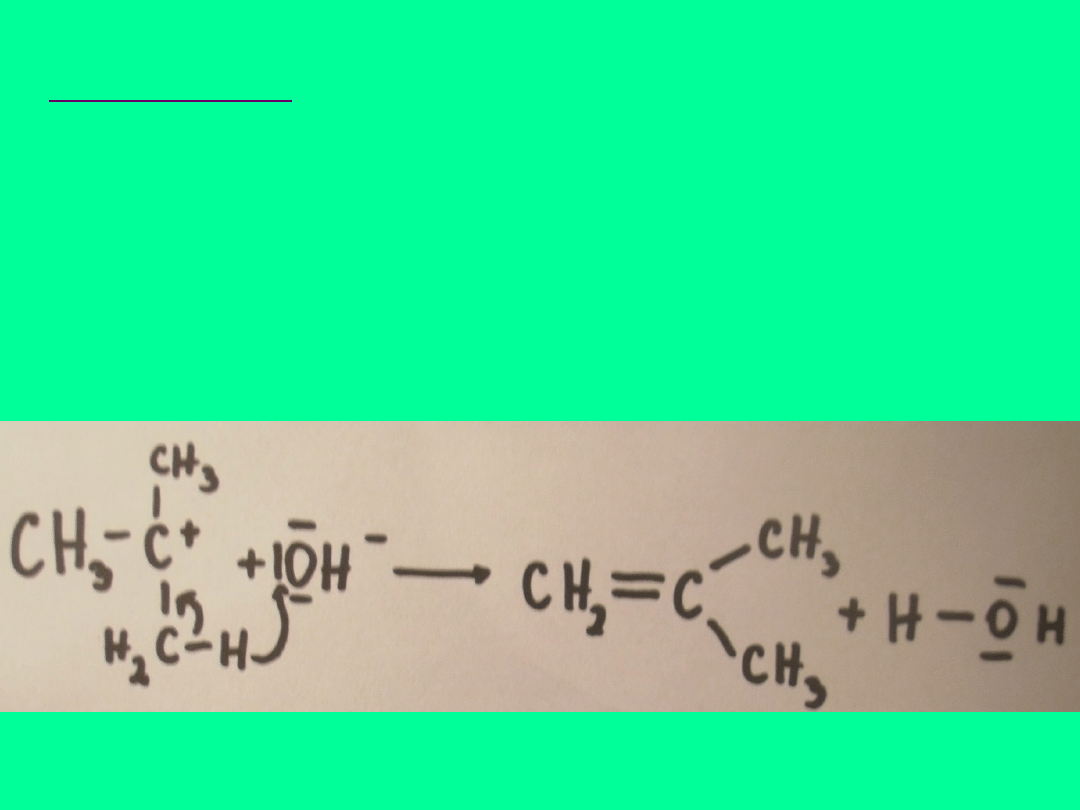
ETAP DRUGI
W tym etapie następuje odłączenie za pomocą
czynnika nukleofilowego (jon wodorotlenowy)
protonu od atomu C sąsiadującego z atomem C,
na którym jest ładunek + i utworzenie alkenu.
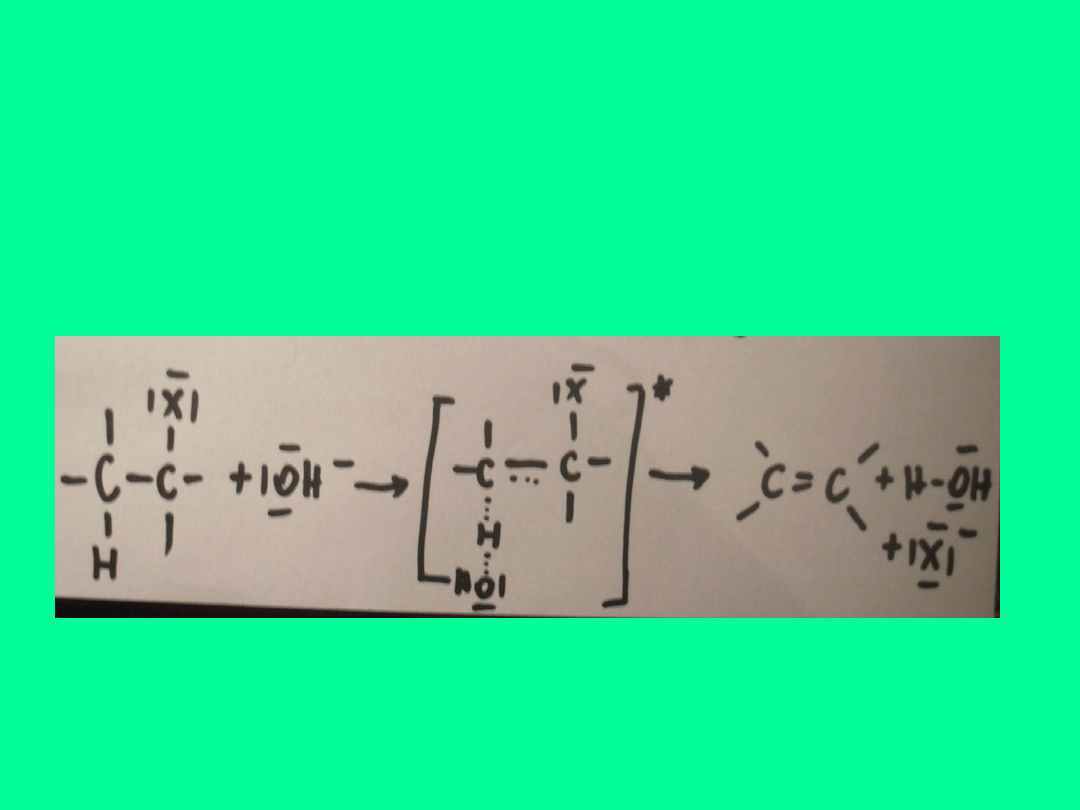
ELIMINACJA DWUCZĄSTECZKOWA
ELIMINACJA DWUCZĄSTECZKOWA
E2
E2
SZYBKOŚĆ REAKCJI ZALEŻY ZARÓWNO OD STĘŻENIA HALOGENKU
ALKILU JAK I CZYNNIKA NUKLEOFILOWEGO NP. JONÓW
WODOROTLENOWYCH
v= k [RX][OH
-
]
KOMPLEKS
AKTYWNY
Miejscem ataku czynnika nukleofilowego jest
tu atom wodoru, nie węgla jak to jest w
substytucji.
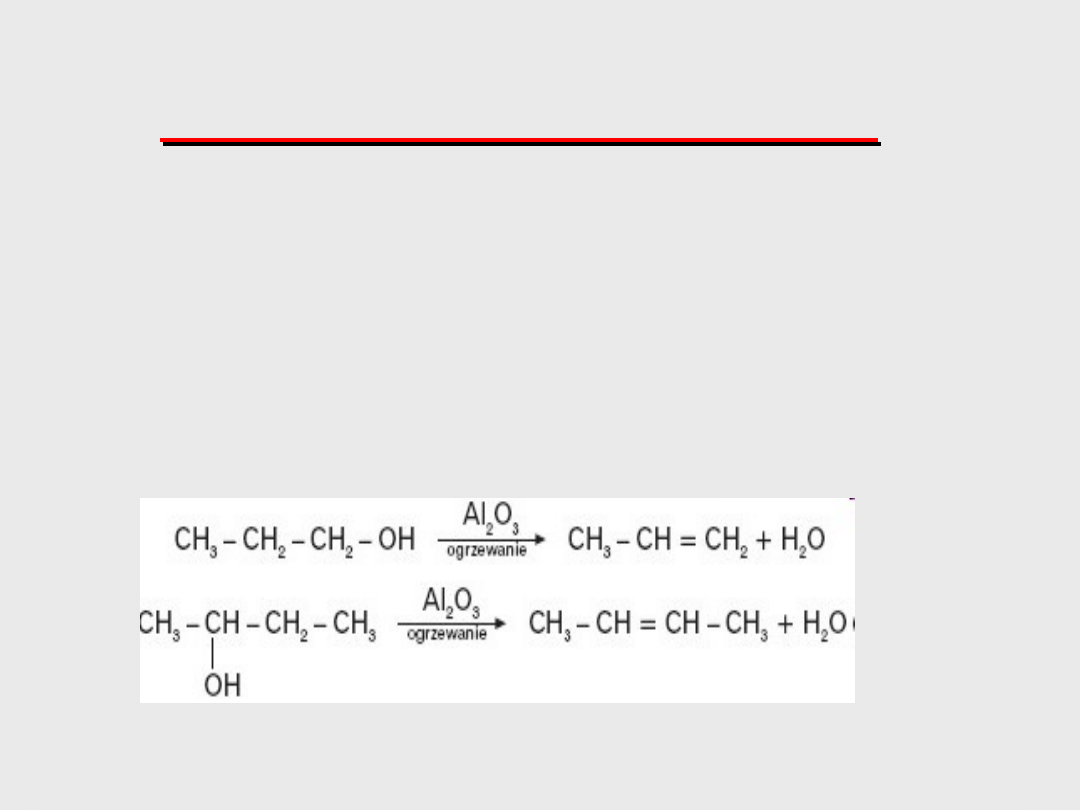
REGUŁA ZAJCEWA
REGUŁA ZAJCEWA
PODCZAS ELIMINACJI Z CZĄSTECZEK
POCHODNEJ WĘGLOWODORU JAKIEGOŚ
PROSTEGO ZWIĄZKU ATOM WODORU
ODRYWA SIĘ OD TEGO ATOMU WĘGLA
PRZY KTÓRYM JEST MNIEJ WODORU.

ROZWIĄŻ TEST:
1.
1.
Od czego zależy szybkość reakcji drugiego rzędu?
Od czego zależy szybkość reakcji drugiego rzędu?
A. TYLKO od substratu organicznego
B. zależy od stężenia substratu organicznego jak również od stężenia drugiego
partnera reakcji.
C. Szybkość nie zmienia się w trakcie przebiegu reakcji
D. Czasami zależy od stężenia substratu organicznego a czasami od drugiego
partnera reakcji
2. Reakcji addycji ulegają:
2. Reakcji addycji ulegają:
A. Alkany
B. Benzen
C. Alkeny i alkiny
D. Tylko alkiny
3. Wskaż zdanie prawdziwe dotyczące rodników?
3. Wskaż zdanie prawdziwe dotyczące rodników?
A. atomy lub cząsteczki posiadające niesparowany proton
B. Atomy nie posiadający elektronów
C. Trwałość rodników rośnie wraz z wzrostem ich rzędowości
D. Trwałość rodników rośnie wraz z wzrostem ich rzędowości

4.Wskaż zdanie fałszywe dotyczące karbokationu:
4.Wskaż zdanie fałszywe dotyczące karbokationu:
a. Jest czynnikiem elektrofilowym
b. Jest to zasada Lewisa
c. Posiada znaczny deficyt elektronów
d. Podatny na atak nukleofilowy
5. zaznacz zdanie fałszywe dotyczące substytucji wolnorodnikowej w alkenach:
5. zaznacz zdanie fałszywe dotyczące substytucji wolnorodnikowej w alkenach:
a. składa się z 3 etapów
b. jest to reakcja łańcuchowa
c. etap trzeci nosi nazwę terminacji
d. etap drugi to inicjacja
6. Wskaż zdanie prawdziwe
6. Wskaż zdanie prawdziwe
a. nitrowanie jest to reakcja substytucji elektrofliowej
b. alkilowanie jest to reakcja substytucji wolnorodnikowej
c. w pierwszym etapie substytucji elektrofilowej nigdy nie wytwarza się czynnik elektrofilowy
d. w etapie drugim substytucji elektrofilowej tworzy się kompleks sigma
7. wskaż zdanie prawdziwe:
7. wskaż zdanie prawdziwe:
a. grupa wodorotlenowa to podstawnik drugiego rzędu
b. grupa nitrowa kieruje podstawienie w pozycję meta
c. grupa aldehydowa to podstawnik pierwszego rzędu
d. grupa aminowa to podstawnik pierwszego rzędu

ODPOWIEDZI: 1B, 2C, 3C, 4B, 5D,
ODPOWIEDZI: 1B, 2C, 3C, 4B, 5D,
6A, 7B
6A, 7B
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
10 Typy reakcji chemicznychid 11130
123 Typy reakcji rodnikowych
instrukcja - TYPY REAKCJI CHEMICZNYCH, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, labora
typy reakcji chemicznych reakcje redoks, Nauka, CHEMIA, Szkoła, Chemia ogólna
TYPY REAKCJI CHEMICZNYCH, SZKOŁA, Chemia
Typy reakcji chemicznych, Liceum, testy
typy reakcji chemicznych
Typy reakcji chemicznych
Typy reakcji chemicznych teoria
IMMUNOLOGIA 2 KOLO ; TYPY REAKCJI I CHOROBY
Typy reakcji
Typy reakcji chemicznych-BCH, budownictwo pk, sem 1, chemia
Typy reakcji związków chemicznych, Studia, Chemia organiczna i nieorganiczna
typy reakcji
typy reakcji w chemii organicznej
TYPY REAKCJI CHEMICZNEJ, Chemia
Sprawozdanie 1 Typy reakcji chemicznych
więcej podobnych podstron