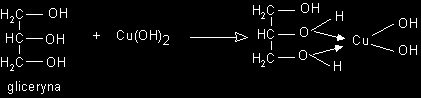Synteza
A + B → AB
np. gaszenie wapna:
CaO + H O → Ca(OH)
2
2
Reakcjami syntezy są m.in. wszystkie reakcje hydratacji.
P.Łukowski, 1
Analiza
AB → A + B
np. wypalanie skały wapiennej:
CaCO → CaO + CO
3
2
Reakcjami analizy są m.in. wszystkie reakcje dehydratacji.
P.Łukowski, 2
Wymiana
AB + C → A + BC
np. roztwarzanie metali w kwasach:
2HCl + Zn → H + ZnCl
2
2
P.Łukowski, 3
Podwójna wymiana
AB + CD → AC + BD
np. wypieranie słabych kwasów z ich soli
przez mocne kwasy:
2HCl + ZnCO → H CO + ZnCl
3
2
3
2
Reakcjami podwójnej wymiany są m.in. reakcje
zobojętniania oraz hydrolizy soli.
P.Łukowski, 4
Red-ox (utleniania-redukcji)
Jedna z substancji (reduktor) utlenia się, tzn. zwiększa stopień utlenienia przez oddanie elektronów, a druga (utleniacz) redukuje się, tzn. zmniejsza stopień utlenienia przyjmując elektrony oddane przez reduktor.
np. spalanie węgla:
C + O → CO
2
2
utlenianie węgla: C0 → C+4 + 4e-
redukcja tlenu: O 0 + 4e- → 2O-2
2
utlenianie i redukcja zawsze zachodzą równocześnie P.Łukowski, 5
Wytrącanie
Jeden z produktów reakcji wytrąca się w postaci stałej.
np. sprawdzanie obecności jonów
chlorkowych w roztworze przez reakcję
z jonami srebra:
AgNO + Cl– → AgCl ↓ + NO –
3
3
P.Łukowski, 6
Typy reakcji chemicznych
Kompleksowanie
Produktem reakcji jest związek kompleksowy, tj.
składający się z atomu lub jonu centralnego oraz połączonych z nim jonów lub grup atomów
P.Łukowski, 7
Wyszukiwarka
Podobne podstrony:
10 Typy reakcji chemicznychid 11130
instrukcja - TYPY REAKCJI CHEMICZNYCH, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, labora
typy reakcji chemicznych reakcje redoks, Nauka, CHEMIA, Szkoła, Chemia ogólna
TYPY REAKCJI CHEMICZNYCH, SZKOŁA, Chemia
Typy reakcji chemicznych, Liceum, testy
typy reakcji chemicznych
Typy reakcji chemicznych teoria
Typy reakcji chemicznych-BCH, budownictwo pk, sem 1, chemia
TYPY REAKCJI CHEMICZNEJ, Chemia
Sprawozdanie 1 Typy reakcji chemicznych
Laborka 1 TYPY REAKCJI CHEMICZNYCH2, Laborki z Fizyki
2.Typy reakcji chemicznych. Reakcje jonowe, Zad
typy reakcji chemicznych
Typy reakcji związków chemicznych, Studia, Chemia organiczna i nieorganiczna
w5 wzor reakcja chemiczna ilościowo
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
04 Kinetyka reakcji chemicznych i kataliza
więcej podobnych podstron