1
Synteza eterów oraz sulfidów chlorometylowoalkilowych
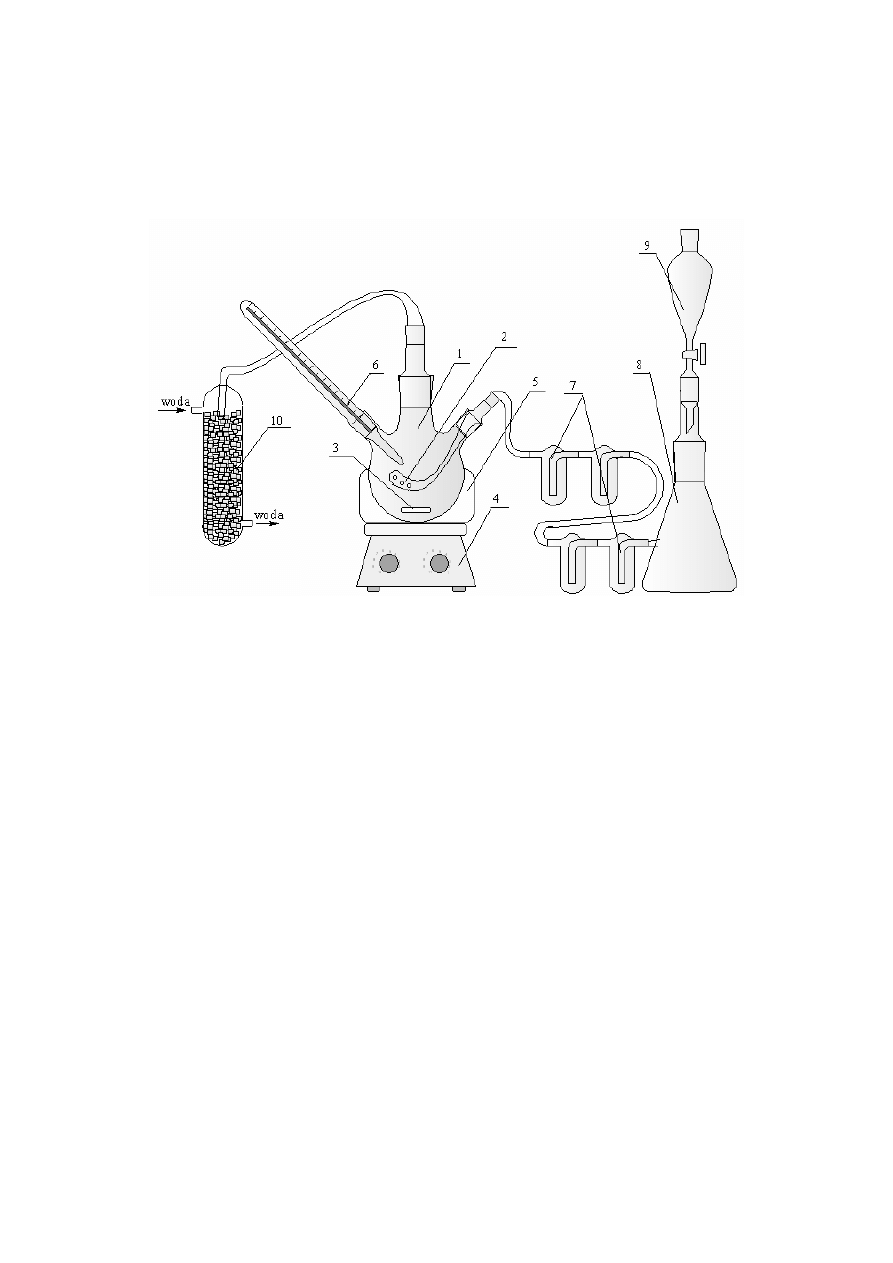
Na rys. 1 przedstawiono schemat instalacji do otrzymywania eterów oraz sulfidów
chlorometylowoalkilowych.
Rys. 1. Schemat instalacji do syntezy eterów oraz sulfidów chlorometylowoalkilowych [1]:
1-kolba reakcyjna, 2-spiek ceramiczny, 3-dipol magnetyczny, 4-mieszadło,
5-łaźnia wodna, 6-termometr, 7-bateria płuczek, 8-kolba z kwasem solnym,
9-wkraplacz z kwasem siarkowym(VI), 10-płuczka z wypełnieniem.
W okrągłodennej kolbie trójszyjnej o pojemności 500 cm
3
zaopatrzonej w dipol
magnetyczny, termometr i spiek ceramiczny, umieszczono 1,5-2 moli odpowiedniego alkoholu
lub tiolu oraz paraformaldehyd z 5% molowym nadmiarem. W przypadku, gdy alkohole były
ciałami stałymi np. dodekanol, cyklododekanol użyto 200 cm
3
toluenu jako rozpuszczalnika.
Otrzymany układ nasycono osuszonym chlorowodorem. Gazowy HCl był wytwarzany przez
ciągłe wkraplanie stężonego kwasu siarkowego(VI) do roztworu stężonego kwasu solnego, a
następnie suszony przez przepuszczanie przez system płuczek. Dwie płuczki zabezpieczały
przed ewentualnym cofnięciem się mieszaniny reakcyjnej lub mieszaniny kwasów na skutek
podciśnienia a pozostałe dwie, wypełnione stężonym kwasem siarkowym(VI), pełniły funkcję
osuszającą. Nieprzereagowany chlorowodór był absorbowany w płuczce z wypełnieniem, przez
którą przepływała woda. Płuczka wodna umieszczona była na końcu instalacji. W kolbie
reakcyjnej utrzymywano temperaturę w przedziale 15-20ºC. Po zakończeniu reakcji, o czym
ś
wiadczył brak absorpcji chlorowodoru oraz wyklarowanie się mieszaniny reakcyjnej, od-
dzielono warstwę organiczną i suszono ją przez dobę nad bezwodnym siarczanem(VI) sodu.
2
Następnie z warstwy organicznej odpędzono zaabsorbowany chlorowodór przez napowietrzanie
osuszonym powietrzem, a w przypadku prowadzenia reakcji w rozpuszczalniku usuwano go
przez odparowanie pod zmniejszonym ciśnieniem. W końcowym etapie surowe etery oraz
sulfid były oczyszczane metodą destylacji próżniowej. Ostatecznie otrzymano produkty
w postaci bezbarwnych cieczy.
Etery i sulfidy chlorometylowoalkilowe są znane i opisywane w literaturze [2].
Otrzymuje się je w reakcji chlorometylowania alkoholi oraz tioli przy użyciu
paraformaldehydu i gazowego HCl:
RYH + HCHO + HCl
g
RYCH
2
Cl + H
2
O
Y = O lub S
Produktem ubocznym reakcji jest powstawanie acetali i tioacetali dialkilowych formaldehydu:
2 RYH + HCHO (RY)
2
CH
2
+ H
2
O
RYH + RYCH
2
Cl (RY)
2
CH
2
+ HCl
Mieszanina
poreakcyjna
składa
się
z
dwóch
związków
eteru
(sulfidu)
chlorometylowoalkilowego oraz acetalu (tioacetalu) dialkilowego formaldehydu. Aby
ograniczyć powstawanie acetalu i tioacetalu, reakcje chlorometylowania należy prowadzić
w temperaturze poniżej 20
o
C.
Otrzymane etery oraz sulfid, które zestawiono w tabeli 1 posłużyły do czwartorzędowania
amin trzeciorzędowych.
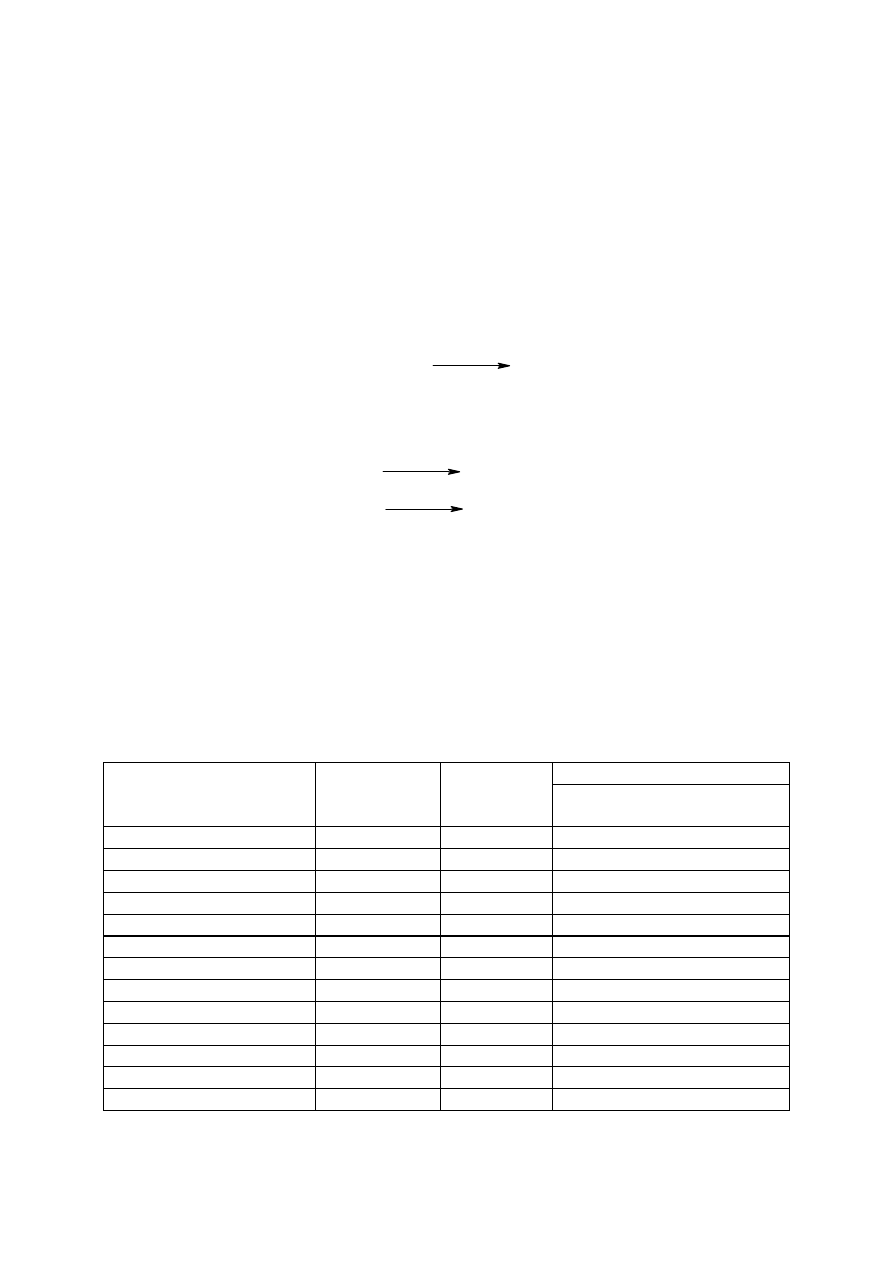
Tabela 1. Syntezowane etery i sulfid [1]
Destylacja
Związek
Wydajność
reakcji
[%]
Zawartość
procentowa
a
[%]
Ciśnienie
[hPa]
Temp. wrzenia
[°C]
C
2
H
5
OCH
2
Cl
74
85
95
29
C
3
H
7
OCH
2
Cl
72
98
35
29
C
4
H
9
OCH
2
Cl
71
96
20
38
C
5
H
11
OCH
2
Cl
85
89
1
30
C
6
H
13
OCH
2
Cl
92
91
1
46
C
7
H
15
OCH
2
Cl
95
99
1
59
C
8
H
17
OCH
2
Cl
93
96
1
82
C
9
H
19
OCH
2
Cl
91
88
1
89
C
10
H
21
OCH
2
Cl
90
95
1
106
C
11
H
23
OCH
2
Cl
98
96
1
119
C
12
H
25
OCH
2
Cl
99
91
1
126
C
12
H
23
OCH
2
Cl
(cykliczny)
99
93
1
138
C
10
H
21
SCH
2
Cl
85
70
1
120
a – zawartość procentowa eteru lub sulfidu w mieszaninie poreakcyjnej

3
Przeprowadzono 12 syntez eterów chlorometylowoalkilowych używając alkoholi od
etanolu do dodekanolu oraz alkoholu cyklicznego – cyklododekanolu i jedną syntezę sulfidu
chlorometylowodecylowego [1]. Wydajności reakcji wynosiły od 71 do 99%. Otrzymane
mieszaniny destylowano pod obniżonym ciśnieniem zbierając frakcję wrzącą w przedziale
1
o
C. Po destylacji oznaczano ponownie czystość związków metodą alkacymetryczną, aby
mieć pewność, że zbierana frakcja była oczekiwanym produktem, a nie mieszaniną
azeotropową. Czystość eterów i sulfidu po destylacji wyniosła 99%.
Etery oraz sulfidy chlorometylowoalkilowe są wrażliwe na kontakt z wodą.
W obecności wody natychmiast ulegają hydrolizie z wydzieleniem chlorowodoru,
formaldehydu oraz alkoholu (tiolu). Dlatego też produkty reakcji chlorometylowania
przechowywano w warunkach bezwodnych w szczelnie zamkniętych naczyniach.
Literatura
[1] A. Syguda, Sole deanolu i jego estrów, praca doktorska, Poznań, 2006.
[2] J. Pernak, Rozprawy nr 134, P.P., Poznań, 1982.
Wyszukiwarka
Podobne podstrony:
Etery chlorometylowoalkilowe
Rozpuszczalniki organiczne pochodne chloroorganiczne, etery, ppt
Fluorescencja chlorofilu
Chloroplast
W4 Mitochondria i chloroplasty
chloroform eros rc105
chlorowcop mat dla stud
chloroplasty
chlorofilantocyjany
alfa Naftyloaminy chlorowodorek
Chininy chlorowodorek 2×hydrat
Etery 2 id 164359 Nieznany
cw 4 Izolacja chloroplastów
chloro
Aluminium chlorohydrate
więcej podobnych podstron