
Pomiary fluorescencji
Pomiary fluorescencji
chlorofilu –
chlorofilu –
uniwersalne
uniwersalne
narzędzie biologii
narzędzie biologii
roślin
roślin

Plan wykładu:
Plan wykładu:
1.
1.
Charakterystyka zjawiska fluorescencji
Charakterystyka zjawiska fluorescencji
2.
2.
Fluorescencja chlorofilu
Fluorescencja chlorofilu
3.
3.
Techniki pomiaru fluorescencji chlorofilu w
Techniki pomiaru fluorescencji chlorofilu w
liściach
liściach
1.
1.
Pomiary szybkiej kinetyki fluorescencji chlorofilu w
Pomiary szybkiej kinetyki fluorescencji chlorofilu w
liściach zaadaptowanych do ciemności; JIP-test
liściach zaadaptowanych do ciemności; JIP-test
2.
2.
Pomiary modulowanego sygnału fluorescencyjnego
Pomiary modulowanego sygnału fluorescencyjnego
i analiza wygaszania fluorescencji
i analiza wygaszania fluorescencji
3.
3.
Technika obrazów fluorescencyjnych
Technika obrazów fluorescencyjnych
4.
4.
Możliwości wykorzystania technik
Możliwości wykorzystania technik
fluorescencyjnych
fluorescencyjnych
5.
5.
Podsumowanie
Podsumowanie

Zjawisko fluorescencji
Zjawisko fluorescencji
Fluorescencja jest jednym z rodzajów
Fluorescencja jest jednym z rodzajów
luminescencji. Luminescencja to najkrócej ujmując
luminescencji. Luminescencja to najkrócej ujmując
emisja światła przez cząsteczki. Zjawisko
emisja światła przez cząsteczki. Zjawisko
fluorescencji polega na emisji kwantów światła z
fluorescencji polega na emisji kwantów światła z
singletowych stanów wzbudzonych cząsteczek.
singletowych stanów wzbudzonych cząsteczek.
Wzbudzenie to następuje zazwyczaj pod wpływem
Wzbudzenie to następuje zazwyczaj pod wpływem
promieniowania elektomagnetycznego (UV, światło
promieniowania elektomagnetycznego (UV, światło
widzialne), lecz możliwe jest też wzbudzenie
widzialne), lecz możliwe jest też wzbudzenie
cząsteczek za pomocą promieniowania
cząsteczek za pomocą promieniowania
jonizującego, prądem elektrycznym czy też
jonizującego, prądem elektrycznym czy też
czynnikami mechanicznymi. Fluorescencja może
czynnikami mechanicznymi. Fluorescencja może
być także wywołana reakcjami chemicznymi czy
być także wywołana reakcjami chemicznymi czy
enzymatycznymi.
enzymatycznymi.
Zjawisko fluorescencji
Zjawisko fluorescencji
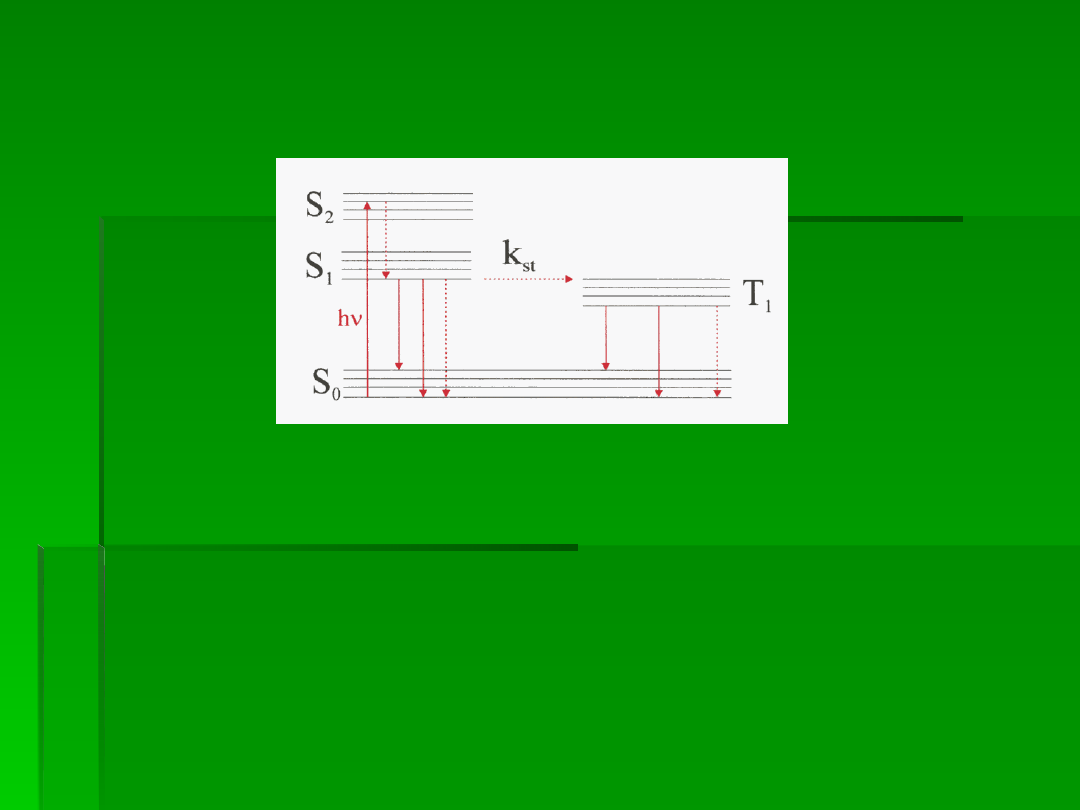
Diagram Jabłońskiego stanowi uproszczony układ kilku najniższych stanów
Diagram Jabłońskiego stanowi uproszczony układ kilku najniższych stanów
elektronowych oraz oscylacyjnych jakie może osiągnąć cząsteczka. Obecność
elektronowych oraz oscylacyjnych jakie może osiągnąć cząsteczka. Obecność
stanów singletowych (S0, S1, S2) i trypletowych (T1) spowodowana jest tym, że
stanów singletowych (S0, S1, S2) i trypletowych (T1) spowodowana jest tym, że
spiny elektronów decydujących o właściwościach optycznych mogą być
spiny elektronów decydujących o właściwościach optycznych mogą być
ustawione równolegle lub antyrównolegle. W stanie singletowym spiny
ustawione równolegle lub antyrównolegle. W stanie singletowym spiny
elektronów ustawione są antyrównolegle, natomiast w stanie trypletowym
elektronów ustawione są antyrównolegle, natomiast w stanie trypletowym
równolegle. Przejścia singlet-tryplet, czyli przejścia z odwróceniem spinu, są
równolegle. Przejścia singlet-tryplet, czyli przejścia z odwróceniem spinu, są
zabronione. Jednak obecność ciężkich atomów, może umożliwić bezpromieniste
zabronione. Jednak obecność ciężkich atomów, może umożliwić bezpromieniste
przejście cząsteczki z wzbudzonego stanu singletowego do stanów trypletowych.
przejście cząsteczki z wzbudzonego stanu singletowego do stanów trypletowych.
Pomimo małej odległości stanów S
Pomimo małej odległości stanów S
1
1
i T
i T
1
1
proces ten jest jednak bardzo wolny, gdyż
proces ten jest jednak bardzo wolny, gdyż
towarzyszy mu zabronione odwrócenie spinu elektronu. Stała szybkości tego
towarzyszy mu zabronione odwrócenie spinu elektronu. Stała szybkości tego
przejścia (kst) może wynosić od 10
przejścia (kst) może wynosić od 10
6
6
-10
-10
10
10
s
s
-1
-1
. Cząsteczka znajdująca się w stanie
. Cząsteczka znajdująca się w stanie
trypletowym T
trypletowym T
1
1
może przejść do stanu podstawowego S
może przejść do stanu podstawowego S
0
0
z udziałem emisji
z udziałem emisji
fosforescencji (strzałki ciągłe) lub bezpromieniście (strzałka przerywana).
fosforescencji (strzałki ciągłe) lub bezpromieniście (strzałka przerywana).
Zjawisko fluorescencji
Zjawisko fluorescencji
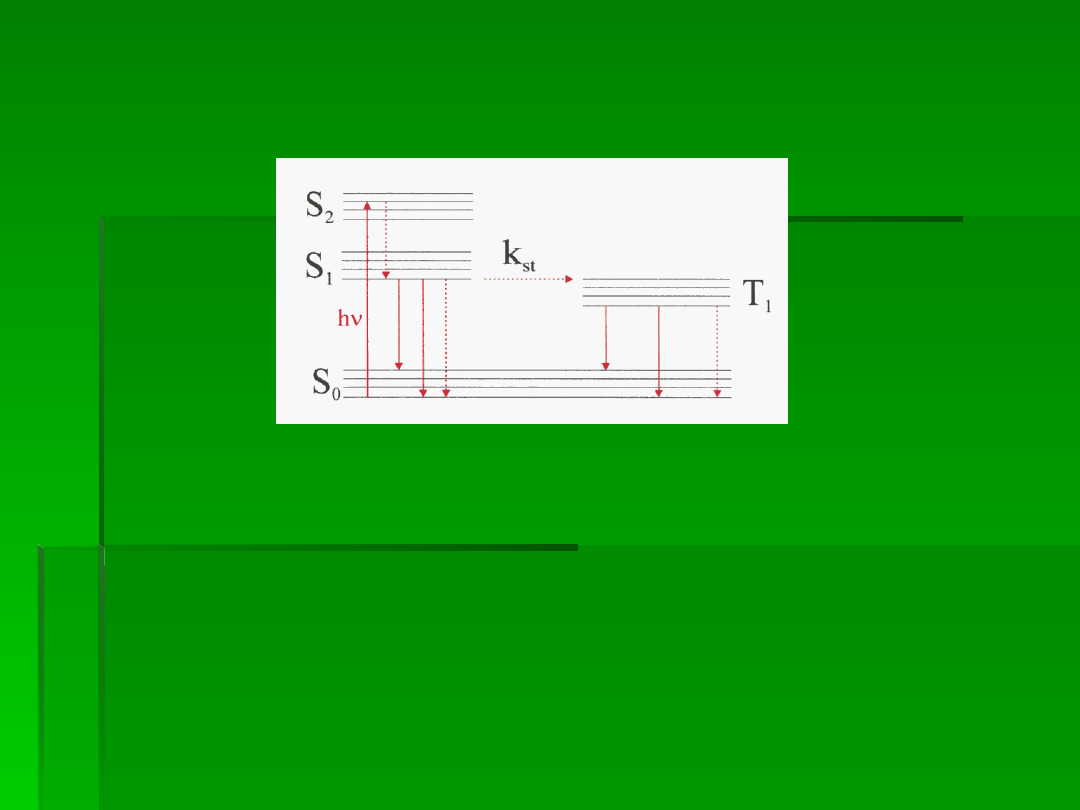
Przy danej konfiguracji elektronowej cząsteczka może znajdować się w różnych
Przy danej konfiguracji elektronowej cząsteczka może znajdować się w różnych
stanach oscylacyjnych. W temperaturze pokojowej, w warunkach równowagi
stanach oscylacyjnych. W temperaturze pokojowej, w warunkach równowagi
termodynamicznej większość cząsteczek zajmuje najniższy poziom oscylacyjny
termodynamicznej większość cząsteczek zajmuje najniższy poziom oscylacyjny
stanu podstawowego S
stanu podstawowego S
0
0
. Są one w stanie zaabsorbować w czasie około 10
. Są one w stanie zaabsorbować w czasie około 10
-15
-15
s
s
kwant promieniowania (hν) i przejść do wzbudzonego stanu oscylacyjnego
kwant promieniowania (hν) i przejść do wzbudzonego stanu oscylacyjnego
jednego z wyższych stanów elektronowych (S
jednego z wyższych stanów elektronowych (S
1
1
lub S
lub S
2
2
). Cząsteczka bardzo szybko
). Cząsteczka bardzo szybko
traci nadmiar energii (10
traci nadmiar energii (10
-11
-11
– 10
– 10
-12
-12
s) i przechodzi do najniższego stanu
s) i przechodzi do najniższego stanu
oscylacyjnego elektronowego stanu S
oscylacyjnego elektronowego stanu S
1
1
. Na tym poziomie przebywa ok. 10
. Na tym poziomie przebywa ok. 10
-8
-8
s i
s i
stąd rozpoczyna się proces promienisty czyli emisja fluorescencji przy powrocie z
stąd rozpoczyna się proces promienisty czyli emisja fluorescencji przy powrocie z
poziomu S
poziomu S
1
1
do stanu podstawowego S
do stanu podstawowego S
0
0
(strzałki ciągłe). Molekuła znajdująca się
(strzałki ciągłe). Molekuła znajdująca się
we wzbudzonym stanie singletowym (S
we wzbudzonym stanie singletowym (S
1
1
, S
, S
2
2
) może przejść do stanu
) może przejść do stanu
podstawowego również na drodze bezpromienistej przemiany (strzałki
podstawowego również na drodze bezpromienistej przemiany (strzałki
przerywane). Emisji fluorescencji towarzyszy wcześniejsza emisja ciepła, stąd
przerywane). Emisji fluorescencji towarzyszy wcześniejsza emisja ciepła, stąd
emitowany kwant ma mniejszą energię niż promieniowanie pochłonięte.
emitowany kwant ma mniejszą energię niż promieniowanie pochłonięte.
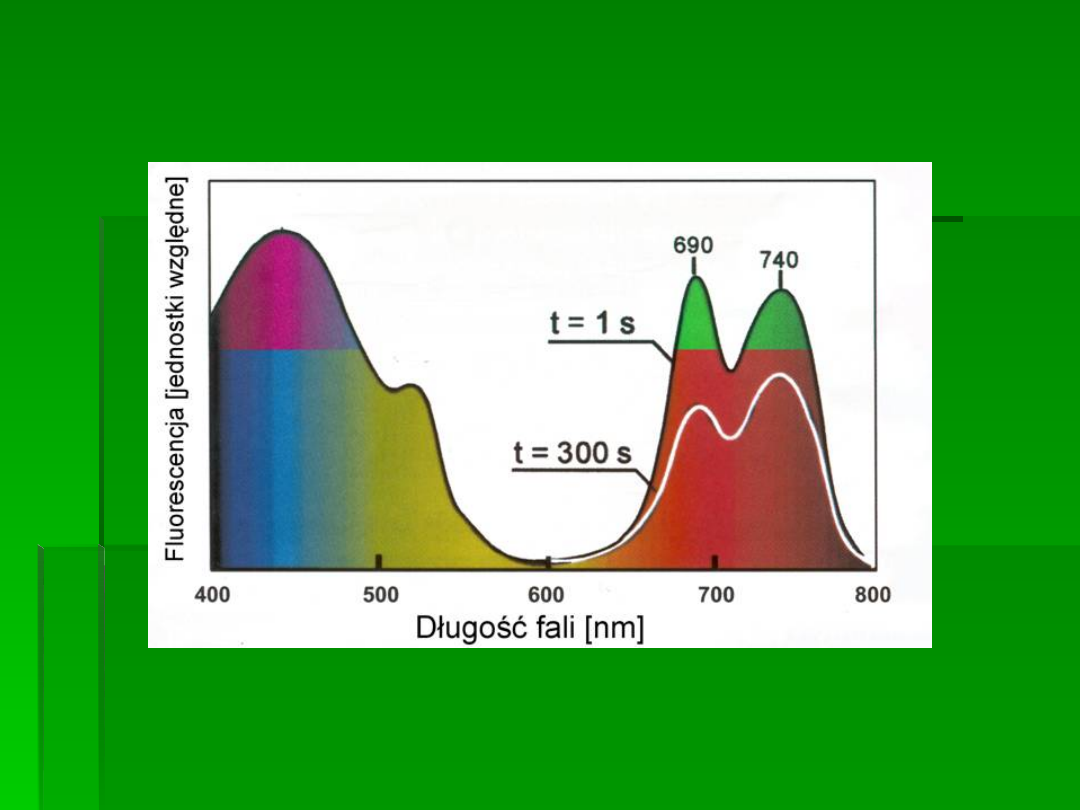
Widmo fluorescencji liścia
Widmo fluorescencji liścia
Wg. Buschmann i wsp. Photosynthetica 38: 483-491 (2000)
Wg. Buschmann i wsp. Photosynthetica 38: 483-491 (2000)

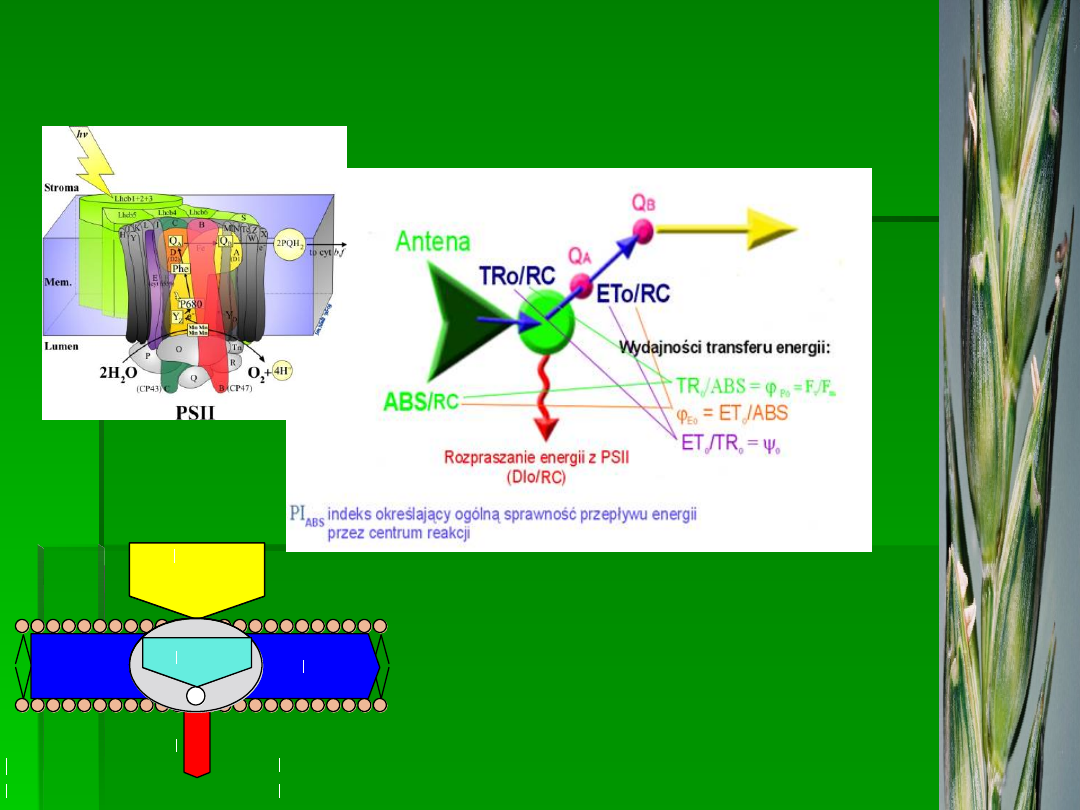
Energia świetlna jest absorbowana przez chlorofil
znajdujący się w tkankach roślinnych i używana
jako „siła napędowa” dla procesów
fotochemicznych fotosyntezy. Staje się ona
wówczas energią chemiczną, która może być
wykorzystywana przez rośliny. Chlorofil absorbuje
światło w zakresie długości fal 400 - 700nm
(promieniowanie fotosyntetycznie czynne, PAR).
Wydajność procesów fotochemicznych jest ograniczona i zależy od
wielu czynników, w
tym
działania niekorzystnych czynników
środowiska. Nadmiar energii w stosunku do możliwości jej
wykorzystania w procesach fotochemicznych musi być efektywnie
rozpraszany. Rozpraszanie obejmuje zarówno emisję ciepła, jak i
reemisję słabych, ale mierzalnych ilości promieniowania o wyższej
od promieniowania wzbudzającego długości fali (czerwonego i
dalekiej czerwieni). Emisja fluorescencji z liści jest zbyt słaba,
żeby można było ją zobaczyć gołym okiem. Maksimum emisji
przypada na zakres czerwony
(» 685nm) i emisja stopniowo spada
w zakresie dalekiej czerwieni i bliskiej podczerwieni (do około
800nm).

Wymienione procesy konkurują ze sobą o
ograniczoną pulę zaabsorbowanej energii,
stąd każda zmiana w wykorzystaniu energii
w którymkolwiek z procesów powoduje
odpowiednie zmiany w wydajności innych.
Sprawia to, że pomiar fluorescencji chlorofilu
może zostać użyty jako szybka, obiektywna i
nieinwazyjna metoda badania procesów
fotochemicznych fotosyntezy.
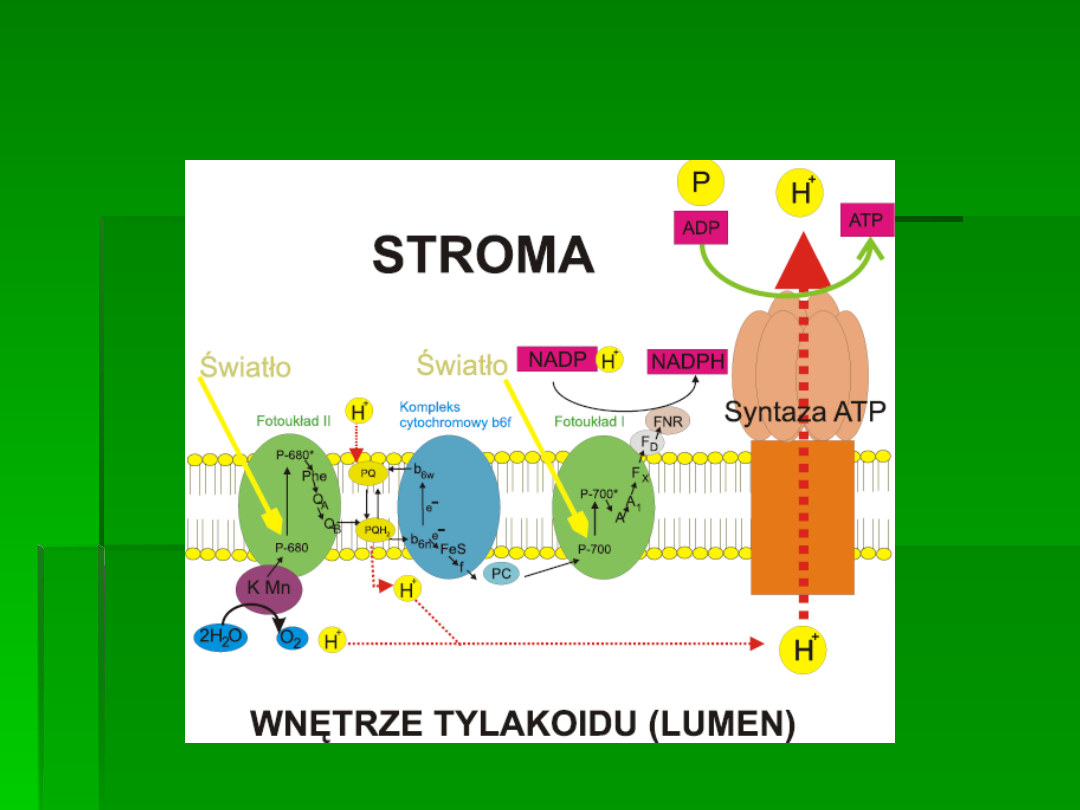
Procesy te zachodzą w dwóch różnych
układach białkowo-barwnikowych znanych
jako fotosystem I (PSI) i fotosystem II (PSII).
W fizjologicznym zakresie temperatur około
95% sygnału fluorescencji chlorofilu
pochodzi z cząsteczek chlorofilu związanych
z PSII.

Pomiary kinetyki indukcji
Pomiary kinetyki indukcji
fluorescencji po oświetleniu
fluorescencji po oświetleniu
światłem wysycającym
światłem wysycającym
Fluorymetr Handy-PEA firmy Hansatech-Instruments Ltd.
Zdjęcie – Hansatech-Instruments Ltd.
Faza jasna fotosyntezy
Faza jasna fotosyntezy
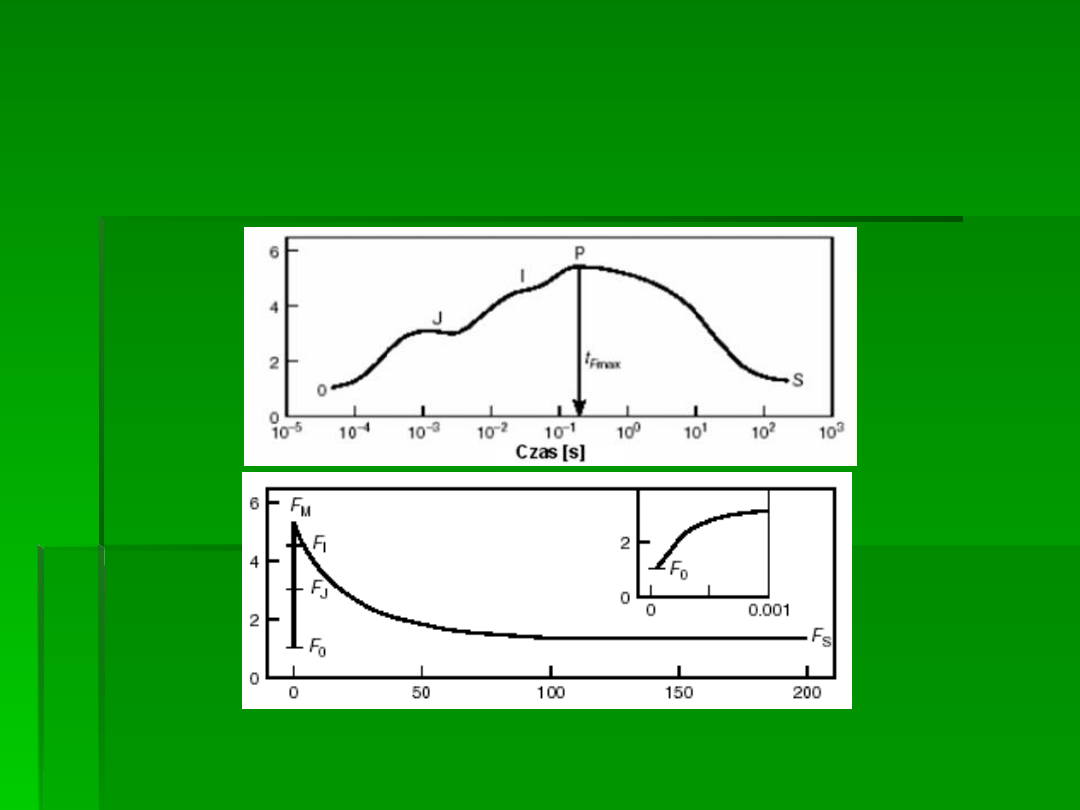
Zmiana sygnału fluorescencyjnego po
Zmiana sygnału fluorescencyjnego po
oświetleniu liścia zaadaptowanego do
oświetleniu liścia zaadaptowanego do
ciemności (fotosynteza nie zachodzi) –
ciemności (fotosynteza nie zachodzi) –
Krzywa Kautzkiego
Krzywa Kautzkiego

Dane te dostarczają informacji
Dane te dostarczają informacji
o:
o:
maksymalnej wydajności kwantowej
maksymalnej wydajności kwantowej
PSII: F
PSII: F
v
v
/F
/F
m
m
(F
(F
v
v
= F
= F
m
m
– F
– F
0
0
)
)

W przypadku stosowania czulszej
W przypadku stosowania czulszej
aparatury wykonać można
aparatury wykonać można
dokładniejszą analizę, np. JIP – test
dokładniejszą analizę, np. JIP – test
(Strasser i wsp. 1998). Podobne
(Strasser i wsp. 1998). Podobne
pomiary wykonać można tu zarówno
pomiary wykonać można tu zarówno
na liściach zaadaptowanych do
na liściach zaadaptowanych do
ciemności, jak i oświetlanych przed
ciemności, jak i oświetlanych przed
pomiarem.
pomiarem.

16
16
PRZEBIEG POMIARU
PRZEBIEG POMIARU
Badany fragment liścia jest zacieniamy przez
Badany fragment liścia jest zacieniamy przez
15 minut przy pomocy klipsa celem
15 minut przy pomocy klipsa celem
zahamowania procesu fotosyntezy.
zahamowania procesu fotosyntezy.
Klips nakłada się na głowicę oświetlającą liść.
Klips nakłada się na głowicę oświetlającą liść.
Uruchamia się program pomiarowy.
Uruchamia się program pomiarowy.
•
W programie ustala się czas (>0,3 s) i natężenie
W programie ustala się czas (>0,3 s) i natężenie
oświetlenia wzbudzającego chlorofil ‘a’ >2000 µmol
oświetlenia wzbudzającego chlorofil ‘a’ >2000 µmol
[hν] · m
[hν] · m
-2
-2
·s
·s
-1
-1
.
.
•
Matryca diod LED emituje promieniowanie z
Matryca diod LED emituje promieniowanie z
maksimum przy 650 nm,
maksimum przy 650 nm,
•
Natężenie fluorescencji chlorofilu ‘a’ po przejściu
Natężenie fluorescencji chlorofilu ‘a’ po przejściu
poprzez filtr Knoppa RG9 krótkofalowego
poprzez filtr Knoppa RG9 krótkofalowego
promieniowania niezwiązanego z fluorescencją
promieniowania niezwiązanego z fluorescencją
chlorofilu (<700 nm) mierzone jest przy pomocy
chlorofilu (<700 nm) mierzone jest przy pomocy
fotodiody PIN.
fotodiody PIN.
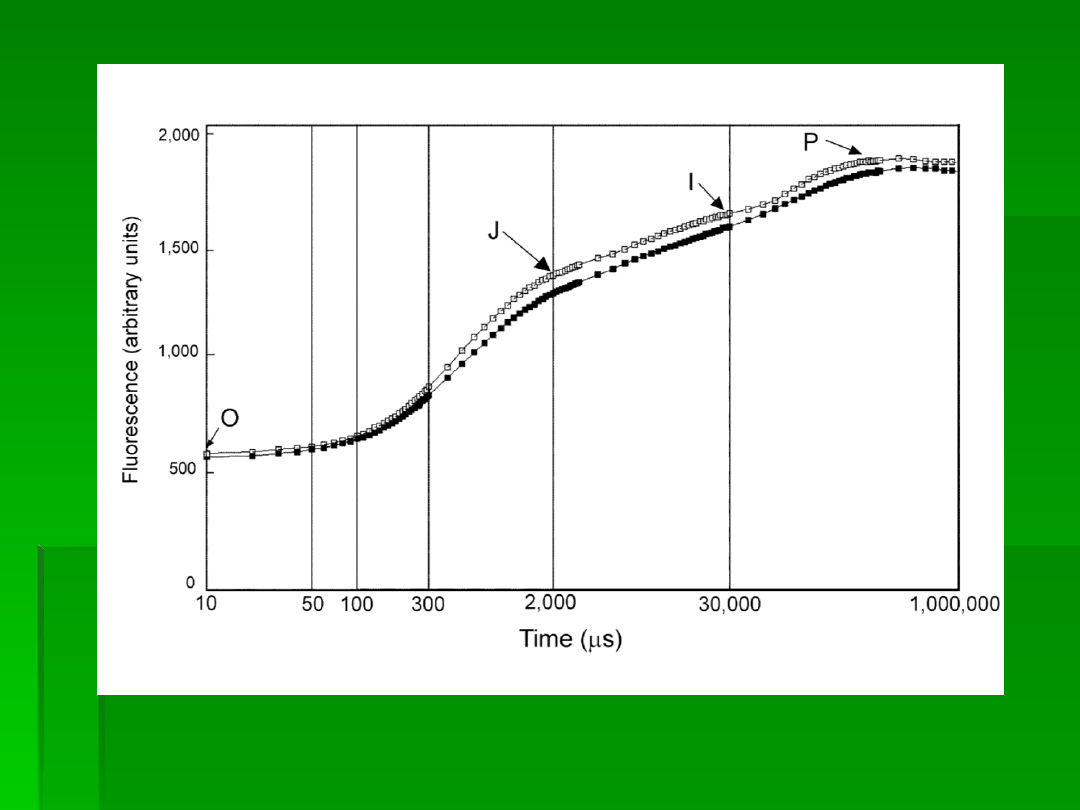
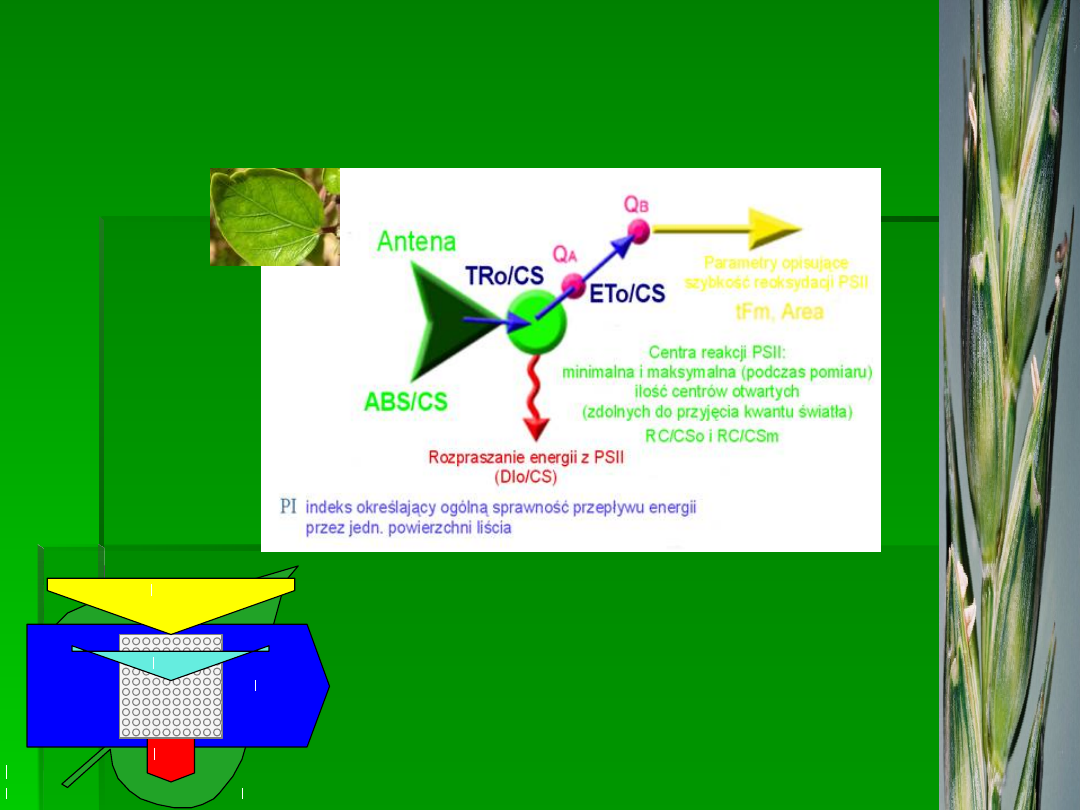
Fig. 1. Typowy przebieg krzywej indukcji fluorescencji (dane z przyrządu)
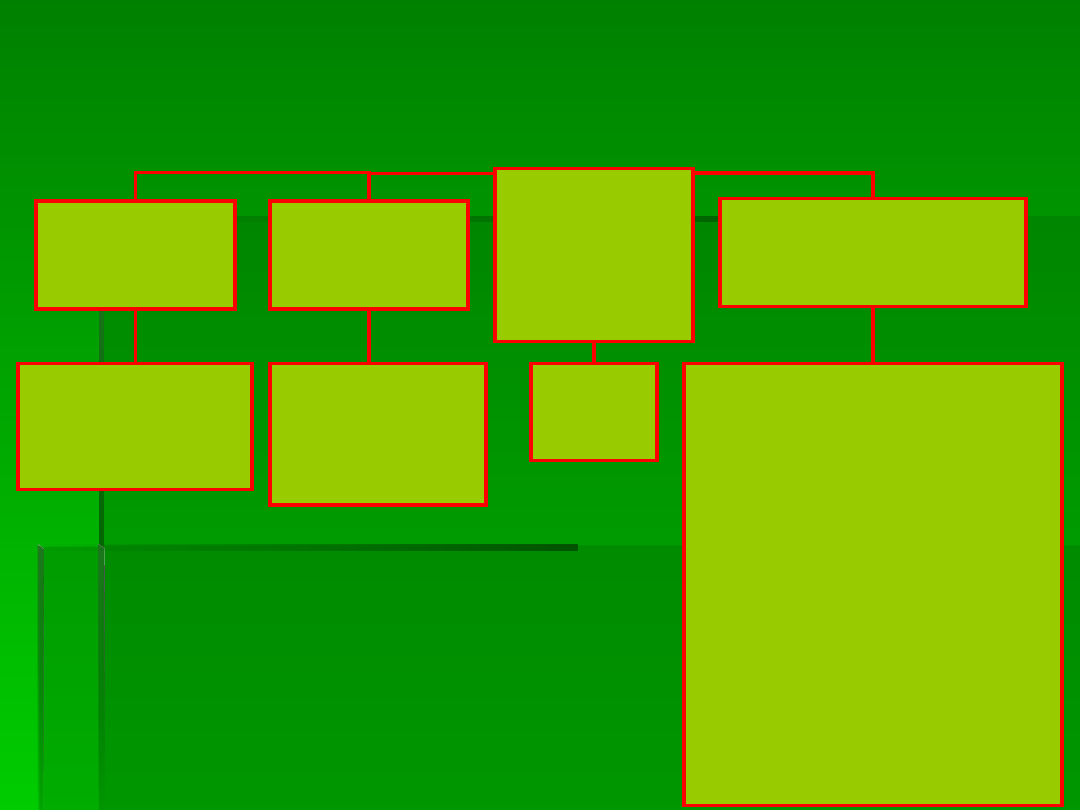
Wybrane parametry testu JIP
Wybrane parametry testu JIP
przepływy
strumieni
energii
ilorazy
strumieni
energii
• ABS/RC, ABS/CS
• ET/RC, ET/CS
• TR/RC, TR/CS
• DI/RC, DI/CS
• φ
Po
= TR/ABS
• ψ
o
= ET/TR
• φ
Eo
= ET / ABS
• RC/CS
•
RC/ABS
•SFI
(structure-function
indexes)
•PI (performance index)
•DF (driving-forces)
•OEC (O
2
evolving centers)
•N
•Sm
•Sm/t
Fmax
•k
p,
k
N
zagęszczen
ie
aktywnych
RC
wskaźniki
witalności
PSII

Obliczanie parametrów JIP-
Obliczanie parametrów JIP-
test
test
(Strasser
(Strasser
i wsp
i wsp
. 2000)
. 2000)
Liście zaadaptowane do ciemności wykazują po naświetleniu szybki wzrost intensywności
Liście zaadaptowane do ciemności wykazują po naświetleniu szybki wzrost intensywności
fluorescencji od początkowej
fluorescencji od początkowej
F
F
0
0
do maksymalnej
do maksymalnej
F
F
P
P
.
.
Intensywność tej ostatniej zależy od
Intensywność tej ostatniej zależy od
intensywności oświetlenia i jest najwyższa po przekroczeniu intensywności wysycającej
intensywności oświetlenia i jest najwyższa po przekroczeniu intensywności wysycającej
fotosyntezę, oznacza się ją wtedy
fotosyntezę, oznacza się ją wtedy
F
F
m
m
.
.
Pomiędzy tymi punktami intensywność fluorescencji
Pomiędzy tymi punktami intensywność fluorescencji
wykazuje też pośrednie maksima:
wykazuje też pośrednie maksima:
F
F
J
J
po około
po około
2 ms
2 ms
i
i
F
F
I
I
po
po
około
około
30 ms,
30 ms,
podczas gdy F
podczas gdy F
m
m
osiągane
osiągane
jest zwykle po czasie dłuższym od 300 ms
jest zwykle po czasie dłuższym od 300 ms
(Neubauer
(Neubauer
i
i
Schreiber, 1987, Strasser
Schreiber, 1987, Strasser
i wsp.
i wsp.
, 1995).
, 1995).
Używany tu fluorymetr
Używany tu fluorymetr
(Handy PEA,
(Handy PEA,
Hansatech Ltd. Kings Lynn, UK)
Hansatech Ltd. Kings Lynn, UK)
wykonuje pomiary
wykonuje pomiary
intensywności fluorescencji z dużą rozdzielczością czasową
intensywności fluorescencji z dużą rozdzielczością czasową
(10µs),
(10µs),
co umożliwia dokładną analizę
co umożliwia dokładną analizę
krzywej narastania sygnału fluorescencji
krzywej narastania sygnału fluorescencji
.
.
Fluorymetr mierzy:
Fluorymetr mierzy:
intensywność fluorescencji (F) po
intensywność fluorescencji (F) po
50
50
μ
μ
s, 100
s, 100
μ
μ
s, 300
s, 300
μ
μ
s, 2ms (F
s, 2ms (F
J
J
), 30ms (F
), 30ms (F
I
I
)
)
i maksymalny sygnał
i maksymalny sygnał
F
F
m
m
,
,
a ponadto
a ponadto
t
t
Fm
Fm
–
–
czas potrzebny
czas potrzebny
do osiągnięcia
do osiągnięcia
F
F
m
m
i
i
Area –
Area –
powierzchnię ponad krzywą indukcji od
powierzchnię ponad krzywą indukcji od
F
F
0
0
d
d
o F
o F
m
m
która jest
która jest
proporcjonalna do puli akceptorów elektronów po redukującej stronie PSII
proporcjonalna do puli akceptorów elektronów po redukującej stronie PSII
(Q
(Q
A
A
i ostatecznie
i ostatecznie
plastochinonu)
plastochinonu)
(Strasser
(Strasser
i
i
Strasser 1995) were recorded.
Strasser 1995) were recorded.
F
F
0
0
–
–
fluorescencja początkowa
fluorescencja początkowa
(minimalna) jest wyliczana przez wewnętrzne oprogramowanie
(minimalna) jest wyliczana przez wewnętrzne oprogramowanie
HandyPEA
HandyPEA
jako interpolacja
jako interpolacja
krzywej indukcji do czasu 0
krzywej indukcji do czasu 0
(Strasser
(Strasser
i
i
Strasser 1995).
Strasser 1995).
Dalsze parametry są wyliczane a
Dalsze parametry są wyliczane a
podstawie teorii przepływów energii w PSII
podstawie teorii przepływów energii w PSII
(Strasser
(Strasser
i
i
Tsimilli–Michael 2001)
Tsimilli–Michael 2001)
. Pomiary te, jak i
. Pomiary te, jak i
wyliczenia można wykonywać też na liściach oświetlanych przed pomiarem, wówczas w
wyliczenia można wykonywać też na liściach oświetlanych przed pomiarem, wówczas w
symbolach parametrów (
symbolach parametrów (
TR
TR
0
0
/CS, ET
/CS, ET
0
0
/CS, DI
/CS, DI
0
0
/CS, M
/CS, M
0
0
)
)
nie ma subskryptu 0, a
nie ma subskryptu 0, a
F
F
0
0
and F
and F
m
m
odnoszą się
odnoszą się
do minimalnej i maksymalnej fluorescencji na liściach preiluminowanych.
do minimalnej i maksymalnej fluorescencji na liściach preiluminowanych.
Pierwsza grupa parametrów reprezentuje tzw. fenomenologiczne przepływy energii:
Pierwsza grupa parametrów reprezentuje tzw. fenomenologiczne przepływy energii:
absorb
absorb
owanej
owanej
(ABS/CS),
(ABS/CS),
pułapkowanej w centrach reakcji PSII (
pułapkowanej w centrach reakcji PSII (
TR
TR
0
0
/CS),
/CS),
napędzającej transport
napędzającej transport
elektronów
elektronów
(ET
(ET
0
0
/CS)
/CS)
i rozpraszanej
i rozpraszanej
(DI
(DI
0
0
/CS),
/CS),
gdzie CS oznacza wzbudzony fragment przekroju
gdzie CS oznacza wzbudzony fragment przekroju
liścia liścia (z ang. cross-section)
liścia liścia (z ang. cross-section)
.
.
Wartość początkowej fluorescencji w liściach zaadaptowanych do ciemności
Wartość początkowej fluorescencji w liściach zaadaptowanych do ciemności
(F
(F
0
0
)
)
jest
jest
proponowana jako miara (w jednostkach arbitralnych) fenomenologicznego przepływu energii
proponowana jako miara (w jednostkach arbitralnych) fenomenologicznego przepływu energii
absorbowanej
absorbowanej
ABS/CS (Strasser
ABS/CS (Strasser
i
i
Strasser, 1995)
Strasser, 1995)
i jest używane w kalkulacjach dla próbek
i jest używane w kalkulacjach dla próbek
zacienianych i wcześniej oświetlanych
zacienianych i wcześniej oświetlanych
.
.

TR
TR
0
0
/CS = (F
/CS = (F
v
v
/F
/F
m
m
) ABS/CS
) ABS/CS
ET
ET
0
0
/CS = (F
/CS = (F
v
v
/F
/F
m
m
) [1–( F
) [1–( F
J
J
– F
– F
0
0
)/( F
)/( F
m
m
– F
– F
0
0
)]
)]
ABS/CS
ABS/CS
DI
DI
0
0
/CS = ABS/CS – TR
/CS = ABS/CS – TR
0
0
/CS
/CS
Możliwe jest też wyliczenie analogicznych
Możliwe jest też wyliczenie analogicznych
przepływów dla jednego, aktywnego
przepływów dla jednego, aktywnego
centrum reakcji (RC) – tu wyliczenia
centrum reakcji (RC) – tu wyliczenia
pominę
pominę
Dalsze parametry kalkulowane w JIP teście
Dalsze parametry kalkulowane w JIP teście
używają
używają
M
M
0
0
– znormalizowanej wartości
– znormalizowanej wartości
początkowego wzrostu fluorescencji
początkowego wzrostu fluorescencji
zmiennej
zmiennej
(M
(M
0
0
= dV/dt).
= dV/dt).
Fluorescencja
Fluorescencja
zmienna
zmienna
V = (F–F
V = (F–F
0
0
)/ (F
)/ (F
m
m
–F
–F
0
0
),
),
gdzie
gdzie
F –
F –
aktualna intensywność fluorescencji w
aktualna intensywność fluorescencji w
danym czasie
danym czasie
.
.
Po przekształceniach można
Po przekształceniach można
M
M
0
0
wyliczyć ze wzoru
wyliczyć ze wzoru
4 (F
4 (F
300µs
300µs
– F
– F
50µs
50µs
)/(F
)/(F
m
m
–
–
F
F
50µs
50µs
) (Tsimilli–Michael
) (Tsimilli–Michael
i
i
wsp
wsp
.
.
2000).
2000).

RC/CS
RC/CS
0
0
(
(
minimalna ilość aktywnych centrów
minimalna ilość aktywnych centrów
reakcji we wzbudzonym przekroju liścia)
reakcji we wzbudzonym przekroju liścia)
:
:
RC/CS
RC/CS
0
0
= [(ABS/CS)/(F
= [(ABS/CS)/(F
v
v
/F
/F
m
m
)]/{M
)]/{M
0
0
/[(F
/[(F
J
J
–F
–F
0
0
)/(F
)/(F
m
m
–F
–F
0
0
)]}
)]}
Dla wyliczenia ilości maksymalnej (RC/CS
Dla wyliczenia ilości maksymalnej (RC/CS
m
m
) w
) w
miejsce ABS/CS używa się
miejsce ABS/CS używa się
F
F
m
m
.
.
Wyliczyć można też ogólny indeks sprawności
Wyliczyć można też ogólny indeks sprawności
transferu energii (PI), dla przykładu, jeśli za
transferu energii (PI), dla przykładu, jeśli za
punkt wyjścia przyjmiemy jednakową absorpcję
punkt wyjścia przyjmiemy jednakową absorpcję
oznaczony jako
oznaczony jako
PI
PI
ABS
ABS
(Strasser
(Strasser
i
i
Tsimilli–Michael
Tsimilli–Michael
2001). PI
2001). PI
ABS
ABS
= {[(TR
= {[(TR
0
0
/ABS)/[1–(TR
/ABS)/[1–(TR
0
0
/ABS)]}
/ABS)]}
{[( ET
{[( ET
0
0
/TR
/TR
0
0
)/[1–( ET
)/[1–( ET
0
0
/TR
/TR
0
0
)]} [1/(ABS/RC)],
)]} [1/(ABS/RC)],
gdzie
gdzie
:
:
TR
TR
0
0
/ABS = Fv/Fm
/ABS = Fv/Fm
ET
ET
0
0
/TR
/TR
0
0
= 1–[(F
= 1–[(F
J
J
–F
–F
0
0
)/(F
)/(F
m
m
–F
–F
0
0
)]
)]
ABS/RC = M
ABS/RC = M
0
0
{1/[(F
{1/[(F
J
J
–F
–F
0
0
)/(F
)/(F
m
m
–F
–F
0
0
)]} (F
)]} (F
m
m
/F
/F
v
v
)
)
18
18
PARAMETRY
PARAMETRY
ETo/RC
ABS/RC
DIo/RC
TRo/RC
PI abs = 38,0717
1
biol-1
RC Scale: 4
19
19
PARAMETRY
PARAMETRY
ETo/CSm
DIo/CSm
TRo/CSm
ABS/CSm
biol-1
1
LM Scale: 2980

Pomiary modulowanego
Pomiary modulowanego
sygnału
sygnału
fluorescencyjnego
fluorescencyjnego
Fluorymetr FMS2 firmy Hansatech-Instruments Ltd.
Zdjęcie – Hansatech-Instruments Ltd.

Metoda umożliwia pomiary na świetle
Metoda umożliwia pomiary na świetle
Największą przewagą fluorescencji modulowanej
Największą przewagą fluorescencji modulowanej
w porównaniu do metody poprzedniej jest
w porównaniu do metody poprzedniej jest
możliwość pomiaru stopnia utlenienia PSII
możliwość pomiaru stopnia utlenienia PSII
Problemem w tym przypadku staje się
Problemem w tym przypadku staje się
rozróżnienie światła oświetlającego próbkę o
rozróżnienie światła oświetlającego próbkę o
długości odpowiadającej maksimum fluorescencji
długości odpowiadającej maksimum fluorescencji
od samej fluorescencji
od samej fluorescencji
Liść oświetla się dodatkowo wiązką światła o
Liść oświetla się dodatkowo wiązką światła o
modulowanej częstotliwości (
modulowanej częstotliwości (
1.8 µs
1.8 µs
),
),
dostarczającej sumarycznie bardzo niewielkiej
dostarczającej sumarycznie bardzo niewielkiej
ilości światła (<0.05 µmol m
ilości światła (<0.05 µmol m
-2
-2
s
s
-1
-1
), która nie może
), która nie może
spowodować zmian w aparacie fotosyntetycznym
spowodować zmian w aparacie fotosyntetycznym
Światło którym oświetlony jest liść podnosi
Światło którym oświetlony jest liść podnosi
poziom sygnału modulacji
poziom sygnału modulacji
Ponieważ intensywność światła odbieranego jako
Ponieważ intensywność światła odbieranego jako
sygnał fluorescencyjny wywoływanego przez
sygnał fluorescencyjny wywoływanego przez
wiązkę modulowaną jest stała układ elektroniczny
wiązkę modulowaną jest stała układ elektroniczny
może ten wzrost intensywności obliczyć (jest to
może ten wzrost intensywności obliczyć (jest to
właściwy sygnał fluorescencyjny)
właściwy sygnał fluorescencyjny)
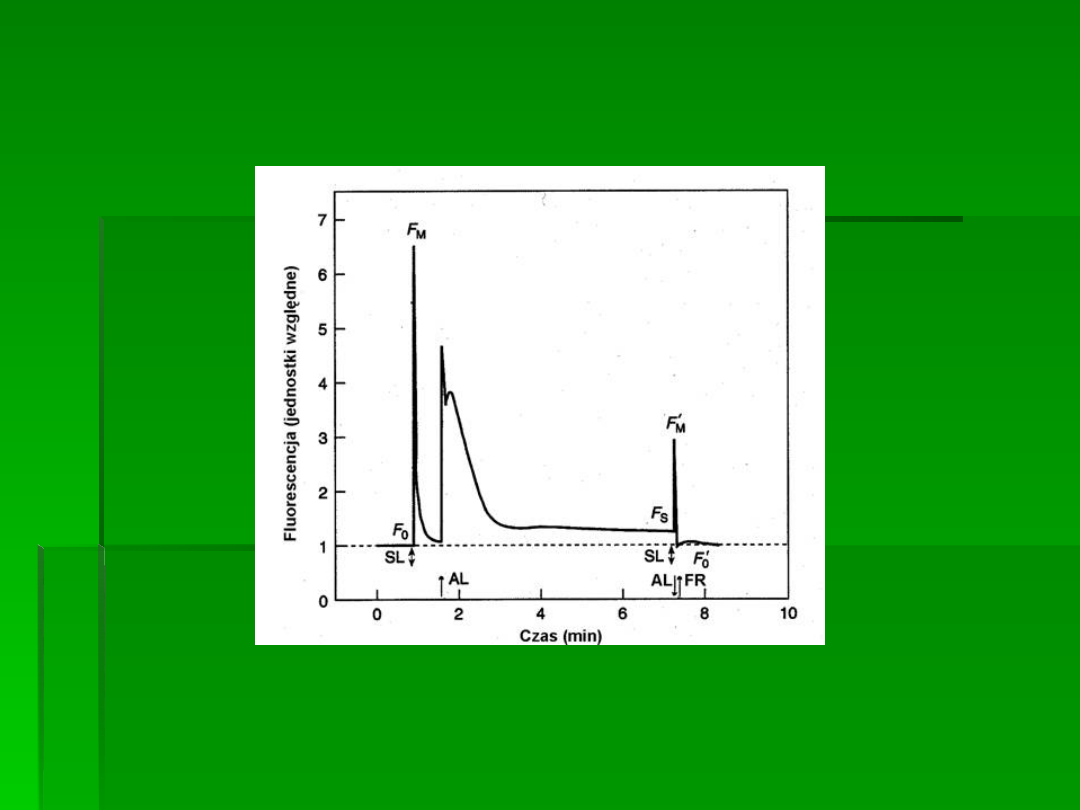
Typowy przebieg pomiaru fluorescencji
Typowy przebieg pomiaru fluorescencji
chlorofilu z wykorzystaniem metody
chlorofilu z wykorzystaniem metody
impulsowej
impulsowej
SL – światło wysycające
AL – światło aktyniczne (ciągłe)
FR – światło dalekiej czerwieni (wzbudzające selektywnie PSI)

Wyliczane parametry:
Wyliczane parametry:
maksymalna wydajność kwantowa PSII
maksymalna wydajność kwantowa PSII
(F
(F
v
v
/F
/F
M
M
) – jak w poprzedniej metodzie
) – jak w poprzedniej metodzie
aktualna wydajność kwantowa PSII
aktualna wydajność kwantowa PSII
PSII = (F’
PSII = (F’
M
M
– F
– F
S
S
)/F’
)/F’
M
M
Szybkość transportu elektronów
Szybkość transportu elektronów
ETR = PAR
ETR = PAR
·
·
0.82
0.82
·
·
2
2
·
·
PSII
PSII
wydajność pułapkowania światła przez
wydajność pułapkowania światła przez
anteny PSII (F’
anteny PSII (F’
V
V
/F’
/F’
M
M
)
)
współczynniki wygaszania fluorescencji
współczynniki wygaszania fluorescencji
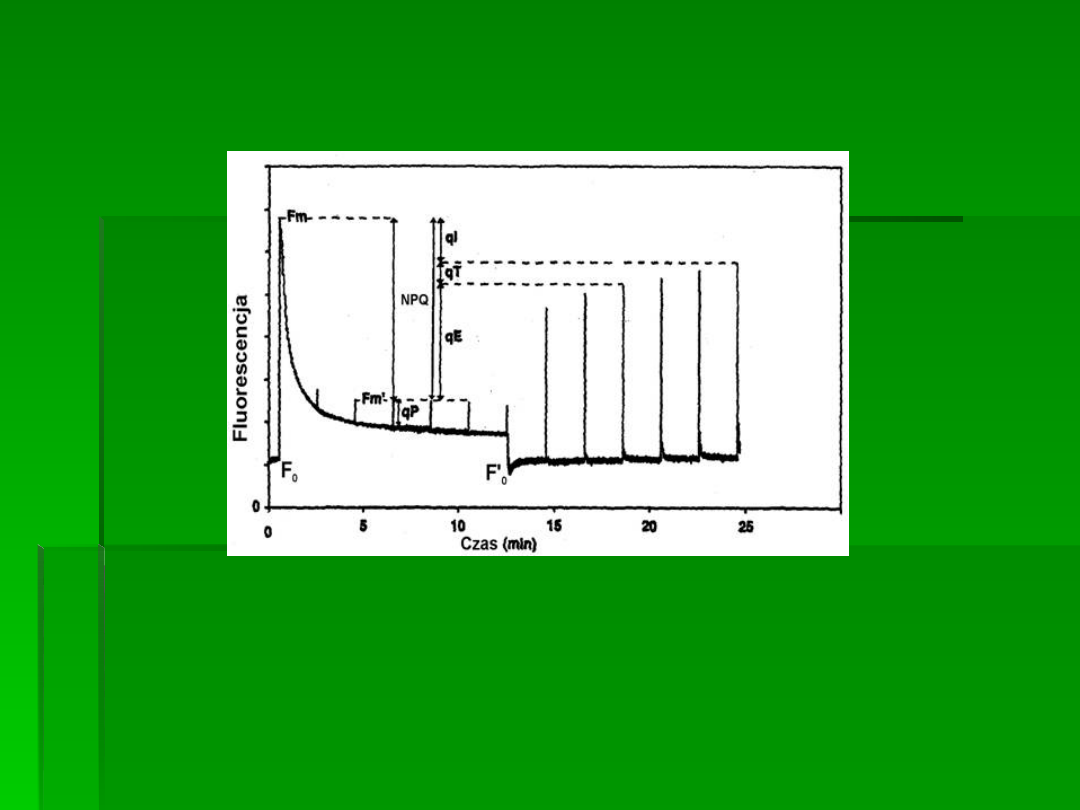
Wyznaczanie współczynników
Wyznaczanie współczynników
wygaszania fluorescencji chlorofilu
wygaszania fluorescencji chlorofilu
qP – współczynnik fotochemicznego wygaszania fluorescencji
qP – współczynnik fotochemicznego wygaszania fluorescencji
NPQ – współczynnik niefotochemicznego wygaszania fluorescencji:
NPQ – współczynnik niefotochemicznego wygaszania fluorescencji:
qE – wygaszanie związane z transtylakoidalnym gradientem protonów
qE – wygaszanie związane z transtylakoidalnym gradientem protonów
qT – wygaszanie związane z rozsprzęganiem systemów antenowych i
qT – wygaszanie związane z rozsprzęganiem systemów antenowych i
centrów reakcji PSII
centrów reakcji PSII
qI – wygaszanie fotoinhibitorowe (związane z cyklem ksantofilowym)
qI – wygaszanie fotoinhibitorowe (związane z cyklem ksantofilowym)

Współczynniki wygaszania
Współczynniki wygaszania
fluorescencji chlorofilu
fluorescencji chlorofilu
q
q
P
P
– Współczynnik fotochemicznmego
– Współczynnik fotochemicznmego
wygaszania fluorescencji informujący o
wygaszania fluorescencji informujący o
ilości energii napędzającej transport
ilości energii napędzającej transport
elektronów w tylakoidach (procesy
elektronów w tylakoidach (procesy
fotochemiczne), czyli o względnym
fotochemiczne), czyli o względnym
stopniu utlenienia Q
stopniu utlenienia Q
A
A
:
:
q
q
P
P
= (F’
= (F’
M
M
-F
-F
s
s
)/(F’
)/(F’
M
M
-F’
-F’
0
0
)
)
NPQ – Współczynnik
NPQ – Współczynnik
niefotochemicznego wygaszania
niefotochemicznego wygaszania
fluorescencji informujący o ilości
fluorescencji informujący o ilości
energii rozpraszanej w postaci ciepła:
energii rozpraszanej w postaci ciepła:
NPQ = (F
NPQ = (F
M
M
-F’
-F’
M
M
)/F
)/F
M
M
’
’

Technika obrazów
Technika obrazów
fluorescencyjnych
fluorescencyjnych
Fluorymetr IMAGING PAM firmy Heinz WALZ GmBH,
Zdjęcie Heinz WALZ GmBH

Jest ona modyfikacją fluorescencji
Jest ona modyfikacją fluorescencji
impulsowej umożliwiającą śledzenie
impulsowej umożliwiającą śledzenie
procesów zachodzących w całych
procesów zachodzących w całych
liściach, czy roślinach.
liściach, czy roślinach.
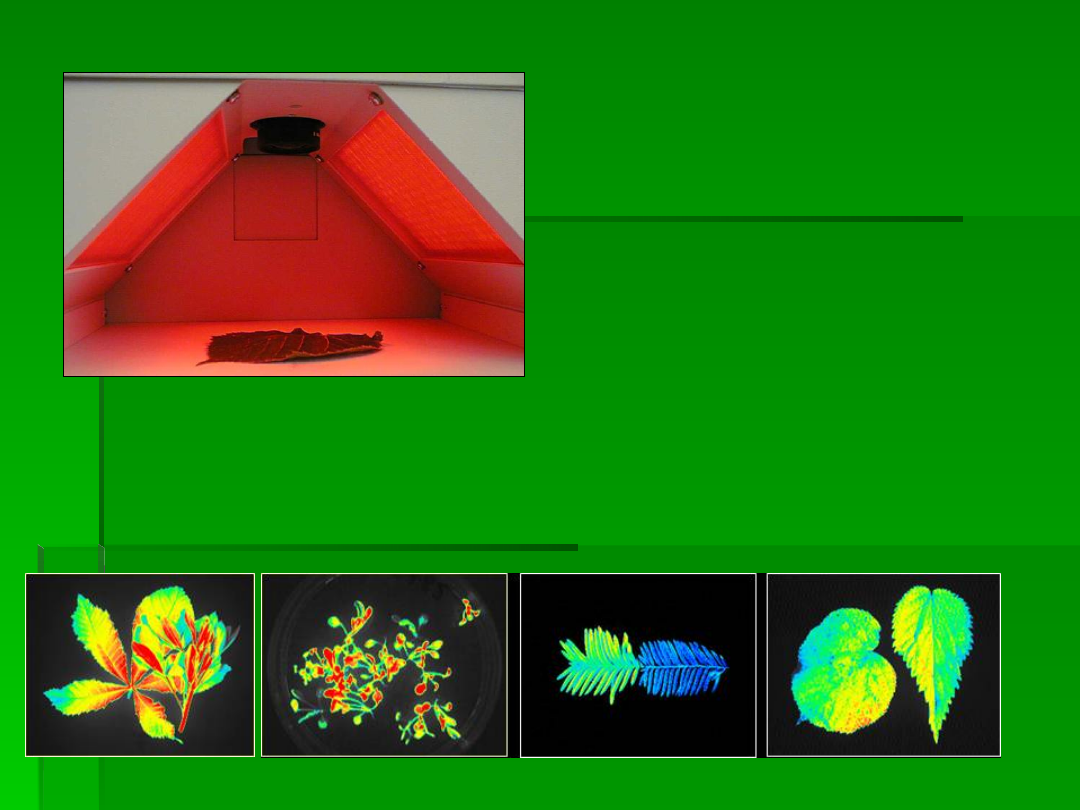
Typowo otrzymuje się
Typowo otrzymuje się
dwuwymiarowe mapy:
dwuwymiarowe mapy:
F
F
0
0
, F
, F
M
M
, F
, F
V
V
,
,
F
F
V
V
/F
/F
M
M
,
,
F
F
’
’
V
V
/F
/F
’
’
M
M
,
,
PSII czy
PSII czy
NPQ
NPQ

Zalety i wady metody
Zalety i wady metody
obrazowania
obrazowania
Bardzo duża dokładność i powtarzalność
Bardzo duża dokładność i powtarzalność
wyników
wyników
– pomiar na dużej powierzchni jest
– pomiar na dużej powierzchni jest
ważniejszy nawet od błędów wynikających z
ważniejszy nawet od błędów wynikających z
nierównomiernego oświetlenia czy kątowego
nierównomiernego oświetlenia czy kątowego
odbijania/rozpraszania światła.
odbijania/rozpraszania światła.
Trzeba bardzo starannie ustawiać przyrząd
Trzeba bardzo starannie ustawiać przyrząd
,
,
powtarzalności pomiaru nie może zapewnić
powtarzalności pomiaru nie może zapewnić
układ elektroniczny.
układ elektroniczny.
Ciężko zastosować wysokie natężenia
Ciężko zastosować wysokie natężenia
światła aktynicznego
światła aktynicznego
(zbyt duży wzrost
(zbyt duży wzrost
temperatury, nierównomierność oświetlania)
temperatury, nierównomierność oświetlania)

Inne możliwości
Inne możliwości
pomiarów fluorescencji
pomiarów fluorescencji
chlorofilu
chlorofilu
Obrazy fluorescencyjne mogą być
Obrazy fluorescencyjne mogą być
zbierane z pokładu samolotów, czy
zbierane z pokładu samolotów, czy
satelitów (przy bezchmurnym
satelitów (przy bezchmurnym
niebie) dla diagnozowania stanu
niebie) dla diagnozowania stanu
upraw. Obecnie technika ta
upraw. Obecnie technika ta
umożliwia jedynie pomiary F
umożliwia jedynie pomiary F
s
s
, ale
, ale
w przyszłości możliwy stanie się
w przyszłości możliwy stanie się
zapewne pomiar innych
zapewne pomiar innych
parametrów z wykorzystaniem
parametrów z wykorzystaniem
laserów wzbudzających
laserów wzbudzających
fluorescencję.
fluorescencję.

Możliwości zastosowań
Możliwości zastosowań
pomiarów fluorescencji
pomiarów fluorescencji
chlorofilu:
chlorofilu:
Fizjologia roślin – pomiary i demonstracje
Fizjologia roślin – pomiary i demonstracje
w badaniach mechanizmu fotosyntezy
w badaniach mechanizmu fotosyntezy
i w dydaktyce.
i w dydaktyce.
Hodowla roślin i produkcja roślin w
Hodowla roślin i produkcja roślin w
warunkach kontrolowanych – optymalizacja
warunkach kontrolowanych – optymalizacja
warunków fotosyntezy, unikanie warunków
warunków fotosyntezy, unikanie warunków
stresowych, selekcja roślin
stresowych, selekcja roślin
transgenicznych, selekcja roślin odpornych
transgenicznych, selekcja roślin odpornych
na niekorzystne czynniki środowiska.
na niekorzystne czynniki środowiska.

Możliwości zastosowań
Możliwości zastosowań
pomiarów fluorescencji
pomiarów fluorescencji
chlorofilu:
chlorofilu:
Produkcja roślinna – wczesne
Produkcja roślinna – wczesne
wykrywanie stresów środowiskowych
wykrywanie stresów środowiskowych
i deficytu składników mineralnych,
i deficytu składników mineralnych,
określanie wpływu warunków uprawy
określanie wpływu warunków uprawy
czy systemów produkcji na fotosyntezę.
czy systemów produkcji na fotosyntezę.
Badania agrochemikaliów – określanie
Badania agrochemikaliów – określanie
wpływu na fotosyntezę, badania
wpływu na fotosyntezę, badania
skuteczności działania herbicydów oraz
skuteczności działania herbicydów oraz
tolerancji na ich stosowanie.
tolerancji na ich stosowanie.

Możliwości zastosowań
Możliwości zastosowań
pomiarów fluorescencji
pomiarów fluorescencji
chlorofilu:
chlorofilu:
Badania zanieczyszczeń
Badania zanieczyszczeń
środowiskowych – wpływ ozonu,
środowiskowych – wpływ ozonu,
tlenków azotu, tlenków siarki i innych
tlenków azotu, tlenków siarki i innych
zmian środowiskowych na rośliny.
zmian środowiskowych na rośliny.
Leśnictwo – badania zamierania lasów
Leśnictwo – badania zamierania lasów
i zanieczyszczeń środowiskowych,
i zanieczyszczeń środowiskowych,
określanie starzenia się drzew.
określanie starzenia się drzew.

Możliwości zastosowań
Możliwości zastosowań
pomiarów fluorescencji
pomiarów fluorescencji
chlorofilu:
chlorofilu:
Ekologia – badania tolerancji na
Ekologia – badania tolerancji na
stresy
stresy
i aklimacji. Badania zjawiska
i aklimacji. Badania zjawiska
allelopatii.
allelopatii.
Testowanie świeżości produktów
Testowanie świeżości produktów
pochodzenia roślinnego (warzywa,
pochodzenia roślinnego (warzywa,
kwiaty, owoce), np. w celu
kwiaty, owoce), np. w celu
optymalizacji terminu ich sprzedaży.
optymalizacji terminu ich sprzedaży.

Podsumowanie
Podsumowanie
Fluorescencja chlorofilu jest techniką
Fluorescencja chlorofilu jest techniką
niezastąpioną w badaniach aparatu
niezastąpioną w badaniach aparatu
fotosyntetycznego roślin.
fotosyntetycznego roślin.
Wydaje się też być najbardziej
Wydaje się też być najbardziej
uniwersalną i bardzo prostą metodą
uniwersalną i bardzo prostą metodą
diagnozowania stanu roślin („roślinne
diagnozowania stanu roślin („roślinne
EKG”).
EKG”).

Podsumowanie
Podsumowanie
Jednak każde konkretne wdrożenie metody
Jednak każde konkretne wdrożenie metody
poprzedzone być powinno wnikliwymi fizjologicznymi
poprzedzone być powinno wnikliwymi fizjologicznymi
badaniami zależności pomiędzy pracą aparatu
badaniami zależności pomiędzy pracą aparatu
fotosyntetycznego, a danym czynnikiem (dobór
fotosyntetycznego, a danym czynnikiem (dobór
metod i warunków pomiarów, parametrów i t.d.).
metod i warunków pomiarów, parametrów i t.d.).
Dla przykładu spadek maksymalnej wydajności
Dla przykładu spadek maksymalnej wydajności
kwantowej PSII kojarzony zwykle z negatywnym
kwantowej PSII kojarzony zwykle z negatywnym
wpływem czynnika zewnętrznego może być w
wpływem czynnika zewnętrznego może być w
niektórych przypadkach (np. w badaniach
niektórych przypadkach (np. w badaniach
zimotrwałości niektórych gatunków roślin) przejawem
zimotrwałości niektórych gatunków roślin) przejawem
zwiększonej odporności na ten czynnik, a nie
zwiększonej odporności na ten czynnik, a nie
sygnałem uszkodzeń.
sygnałem uszkodzeń.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
Wyszukiwarka
Podobne podstrony:
Chloroplast
W4 Mitochondria i chloroplasty
chloroform eros rc105
ćw nr 2 badanie lamp fluorescencyjnych (2)
Techniki Fluorescencji w Analizie instrumentalnej, Analityka medyczna, Analiza instrumentalna
chlorowcop mat dla stud
chloroplasty
chlorofilantocyjany
Sodu fluorek cz
alfa Naftyloaminy chlorowodorek
Cyny (II) fluorek
Chininy chlorowodorek 2×hydrat
cw 4 Izolacja chloroplastów
chloro
Fluorescencja
więcej podobnych podstron