
Biotechnologia ogólna dla studentów kierunku biotechnologia wersja 1.1
PRODUKCJA KWASU CYTRYNOWEGO
Kwas cytrynowy
Kwas cytrynowy (2-hydroksy-1,2,3-propanotrikarboksylowy) o M
cz
= 192 i temperaturze topnienia 153ºC po raz
pierwszy został wyizolowany z soku cytryn. W formie krystalicznej kwas ten występuje w postaci bezwodnej lub
jednowodnej. Jednowodna forma jest otrzymywana przez krystalizację w temperaturze poniżej 36,6ºC, powyżej tej
temperatury powstaje forma bezwodna.
Kwas cytrynowy występuje w przyrodzie w owocach cytrusowych i ananasach. Owoce te do niedawna były głównym
źródłem tego kwasu. Światowa produkcja kwasu cytrynowego przekracza 300 000 ton rocznie, co jest podyktowane
bardzo dużym zapotrzebowaniem na ten kwas ze strony przemysłu spożywczego, farmaceutycznego, chemicznego
oraz metalurgicznego. Jego wykorzystanie wynika m.in. z działania konserwującego na skutek obniżania wartości pH
środowiska. Jednocześnie jest związkiem nietoksycznym, o dobrych walorach smakowych i zapachowych.
Zastosowanie kwasu cytrynowego i jego pochodnych
-
w produkcji i przetwórstwie żywności jest stosowany (za zgodą FAO/WHO) jako inhibitor enzymów, głównie
oksydaz powodujących utlenianie polifenoli, co objawia się ciemnieniem owoców i warzyw,
-
wykorzystywany jest do produkcji napojów, słodyczy, owoców kandyzowanych i win, jako środek zakwaszający i
stabilizujący,
-
tworzenie połączeń kompleksowych z jonami metali (Fe, Cu, Zn) zadecydowało o zastosowaniu jako stabilizatora
olejów; wiążąc metale katalizujące proces jełczenia tłuszczów, kwas cytrynowy przerywa reakcję tworzenia
nadtlenków i innych produktów powstałych w wyniku utleniania nienasyconych kwasów tłuszczowych w procesie
autooksydacji olejów,
-
zdolność do wiązania metali ciężkich umożliwiła wykorzystanie kwasu cytrynowego do oczyszczania powierzchni
metali przed spawaniem lub pokrywaniem powłokami ochronnymi,
-
w mleczarstwie, wodne roztwory kwasu cytrynowego są stosowane do usuwania z aparatury kamienia mlecznego
(osad z białka, tłuszczu i soli mineralnych mleka),
-
w przemyśle farmaceutycznym stosowany jest jako środek dodawany do tabletek powodujący efekt musujący,
-
w stacjach krwiodawstwa pochodne kwasu cytrynowego są stosowane jako środki zapobiegające krzepnięciu krwi,
-
w chemii gospodarczej sole kwasu cytrynowego wypierają trudno biodegradowane fosforany ze składu
detergentów,
-
estry kwasy cytrynowego znalazły zastosowanie jako nietoksyczne plastyfikatory w cienkich powłokach
ochraniających żywność.
W 1893 roku Wehmer po raz pierwszy wykrył kwas cytrynowy w kulturach pędzlaków i nazwał je Citromyces pfefferianus, a
Curie w 1917 roku stworzył przemysłowe podstawy produkcji tego kwasu dzięki odkryciu, że Aspergillus niger rośnie dobrze i
wydziela duże ilości kwasu cytrynowego w pożywkach płynnych o pH 2,5-3,5. Wzrost pH powoduje przestawienie produkcji
na kwas glukonowy, a dalej na szczawiowy. Niska wartość pH chroni pożywkę przed zakażeniami, głównie bakteryjnymi.
Producentami kwasu cytrynowego są wyselekcjonowane szczepy Aspergillus niger, A. wentii, A. clavatus oraz liczne drożdże
z rodzaju Candida (C. lipolytica, C. tropicalis, C. intermedia, C. guilliermondi), które syntezują kwas cytrynowy w
środowisku zawierającym n-alkany. Wśród szczepów z gatunku C. lipolytica został wyselekcjonowany szczep, u którego
stwierdzono cykl płciowy (został nazwany na cześć odkrywcy Yarrowia lipolytica) i który może wytwarzać kwas cytrynowy z
n-parafin, dzięki czemu znalazł szybko zastosowanie w przemyśle. Kwas cytrynowy wytwarzają także Penicillium citrinum,
Mucor piriformis. Jednak w praktyce przemysłowej największe znaczenie mają szczepy Aspergillus niger.
Proces produkcyjny
Produkcję kwasu cytrynowego prowadzi kilkoma metodami. Na początku najczęściej stosowano metodę powierzchniową,
potem wgłębną, a ostatnio – szczególnie w Japonii – stosuje się hodowlę na pożywkach stałych.
Metoda powierzchniowa
Oczyszczony melas rozcieńcza się wodą do zawartości 15 – 17% cukru, zakwasza kwasem siarkowym do pH 6,3, dodaje
pewną ilość żelazocyjanku potasowego, sterylizuje, ochładza do temp. 40ºC i przetłacza do komór fermentacyjnych,
odkażonych dwutlenkiem siarki lub formaliną.
Komory fermentacyjne zawierają ok. 80 płytkich tac fermentacyjnych, które napełnia się roztworem melasy buraczanej i
szczepi zarodnikami kultury A. niger, wyhodowanymi na podłożu z ziemniaczanym w probówkach i przeniesionymi następnie
do kolb z wodą wodociągową. Wodna zawiesina grzyba jest pistoletem natryskowym równomiernie rozprowadzana na
powierzchnię tac. Po około dwóch dniach powierzchnia pożywki pokrywa się białą grzybnią kiełkujących zarodników. W
czasie fermentacji tworzy się duża ilość dwutlenku węgla, który usuwa się poprzez nawiew jałowego powietrza. Nadmierne
przewietrzanie wzmacnia jednak procesy oddechowe pleśni i zmniejsza wydajność fermentacji. Ponadto przyczynia się do
nadmiernego parowania pożywki. Proces fermentacji trwa 9 – 11 dni w temp. 30 – 34ºC. Po zakończeniu procesu można
spuścić melasę a pozostałą warstwę kożucha grzybni podwarstwić świeżą pożywką. W zebranym płynie pohodowlanym
wytrąca się kwas szczawiowy (jako szczawian wapnia) i oddziela przez sączenie. Kwas cytrynowy jest wytrącany za pomocą
węglanu wapnia (cytrynian wapnia), krystalizuje i uwalnia przy użyciu kwasu siarkowego. Wydajność fermentacji wynosi 50-
70% w stosunku do użytego cukru. Suchy cytrynian zawiera 62 – 68% kwasu cytrynowego. Materiał odpadowy jakim jest
grzybnia pleśni (ok. 10 kg/1 m
2
tac) może być wykorzystana jako źródło białka (ok. 20%).
Metoda wgłębna
W chwili obecnej główny sposób produkcji kwasu cytrynowego. Dość duże trudności napotkało przestawienie używanych
szczepów z rozwoju na powierzchni na rozwój wewnątrz cieczy z zachowaniem wydajności wytwarzania kwasu cytrynowego.
Biotechnologia ogólna dla studentów kierunku biotechnologia wersja 1.1
Obecnie nadal trwają badania nad dopracowaniem optymalnego składu pożywki i warunków fermentacji. Standardowo
fermentacja przebiega w kadziach zaopatrzonych w mieszadła i systemy napowietrzające, w temp. 30 – 32ºC w ciągu 10 dni.
Wydajność tej metody liczona na kwas w stosunku do użytego cukru przekracza 90%.
Metoda na pożywkach stałych
Najpowszechniej rozwinięta w Japonii, gdzie 20% ilości produkowanego kwasu cytrynowego pochodzi z hodowli na
podłożu stałym. Surowcem w tej metodzie mogą być otręby, wytłoki z trzciny cukrowej, wadliwa melasa buraczana lub
trzcinowa i inne odpadowe surowce roślinne. Technologia ta budzi też duże nadzieje ze względu na znacznie niższe obciążenie
produkcji ściekami oraz wyższą tolerancję A. niger na obecność jonów metali i mikroelementów.
Szczepy Aspergillus niger stosowane do produkcji kwasu cytrynowego
Szczepy A. niger stosowane w przemysłowej produkcji kwasu cytrynowego otrzymane zostały w wyniku mutagenizacji
oraz skriningowych selekcji szczepów naturalnych. Jako mutageny stosowane są czynniki fizyczne (promieniowanie UV o dł.
λ=260 nm), chemiczne lub kombinacje obu. Wykorzystuje się także techniki rekombinacji genetycznej. Selekcja szczepów o
cennych właściwościach technologicznych prowadzona jest pod kątem dalszego zastosowania w ściśle określonych warunkach
produkcyjnych. Uzyskane mutanty należy zabezpieczyć przed degradacją cech materiału biologicznego, np. poprzez
liofilizację, przechowywanie konidiów z jałowym piaskiem, węglem aktywnym lub cytrynianem wapnia. Jednak mimo takich
metod zabezpieczenia często dotychczasowy metabolizm ukierunkowany na syntezę kwasu cytrynowego zmienia się na
oksydacyjny, w wyniku czego powstaje biomasa. Stąd konieczna jest ciągła selekcja odmian o pożądanych cechach.
Biochemiczne uwarunkowania nadprodukcji kwasu cytrynowego u Aspergillus niger
Nadprodukcja kwasu cytrynowego u niektórych odmian Aspergillus niger jest wynikiem zakłócenia cyklu Krebsa na
skutek braku lub niskiej aktywności enzymów odpowiedzialnych za jego dalszą konwersję. Efekt ten jest warunkowany
genetycznie, ale poprzez odpowiednie warunki hodowli można zintensyfikować aktywność produkcyjną szczepów,
zapewniając wysoką wydajność kwasu cytrynowego. Kwas cytrynowy jest jednym z etapów cyklu Krebsa, którego głównym
zadaniem jest utlenianie związków organicznych, a nie wydzielanie ich do podłoża. Fermentacja cytrynowa, polega na
gromadzeniu się znacznych ilości kwasu cytrynowego wskutek zablokowania enzymu biorącego udział w tlenowym
rozkładzie cukrów. Jeśli weźmiemy pod uwagę, że niektóre metale (cynk, mangan, żelazo) są aktywatorami pewnych
enzymów, to ich brak w pożywce powoduje blokowanie i powstają warunki, w których wytworzony kwas cytrynowy nie może
być zmetabolizowany i jest gromadzony w podłożu. Jest to korzystne z punktu widzenia mikrobiologii technicznej i znalazło
praktyczne wykorzystanie w przemyśle.
Produkcja kwasu cytrynowego jest w wysokim stopniu uzależniona od składu pożywki. Korzystne warunki procesu:
-
wysokie stężenie cukru (ok. 10% w hodowli wgłębnej i 16% w powierzchniowej)
-
niedobór jonów metali: Mn
+2
, Zn
+2
, Fe
+2
(< 0,1 mg/ 100 cm3)
-
ograniczona ilość związków azotu i fosforu (limitacja wzrostu grzybni)
-
niska wartość pH (ok. 2,4-2,6)
-
dobre natlenienie środowiska (dot. procesu wgłębnego na pożywkach syntetycznych).
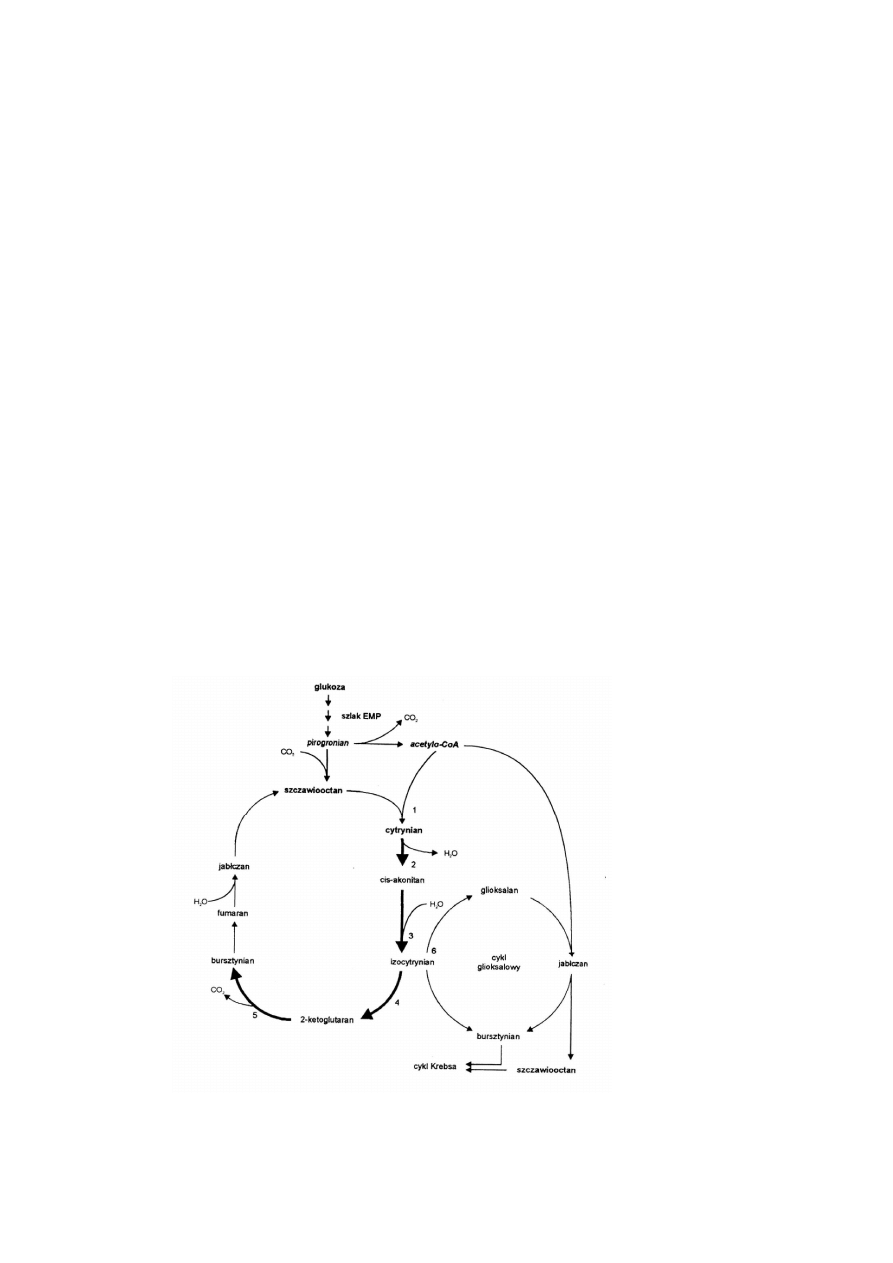
Kwas cytrynowy powstaje w początkowych przemianach cyklu Krebsa, w wyniku kondensacji acetylo-CoA i szczawiooctanu,
katalizowanej przez syntazę cytrynianową enzym 1, rys. 1.). W procesie wzrostu grzybni (trofofaza), a następnie produkcji
kwasu cytrynowego (idiofaza) heksozy asymilowane są w dwóch metabolicznych szlakach: glikolizie (EMP) i
pentozofosforanowym (HMP). Szlak HMP uaktywnia się w fazie intensywnego wzrostu, po czym ustępuje glikolizie w fazie
produkcji kwasu cytrynowego. Głównym regulatorem szybkości glikolizy jest tu fosfofruktokinaza, która staje się
jednocześnie regulatorem biosyntezy kwasu cytrynowego. Enzym ten jest wrażliwy na obecność cytrynianu w środowisku,

Biotechnologia ogólna dla studentów kierunku biotechnologia wersja 1.1
ale u szczepów A. niger w procesie produkcji kwasu cytrynowego represja ta może być zniesiona nadmiarem jonów NH
4
+
, w
wyniku zakłóconych przemian białkowych spowodowanych niedoborem Mn
2+
w podłożu.
Mechanizmem regulującym biosyntezę kwasu cytrynowego jest także ograniczenie syntezy ATP, inhibitora fosfofruktokinazy.
Wykonanie ćwiczenia (cz. 1)
1. Przygotowanie podłoża
a. Podłoże melasowe
W kolbie o pojemności 250-300 cm
3
przygotować 100 cm
3
pożywki zawierającej:
- 10% melasy
- 0,06% K
4
Fe(CN)
6
,
- 1-2 krople 85% kwasu fosforowego
- 0,2% węgla aktywnego.
Odważoną ilość melasy rozpuścić w 80 cm
3
wody destylowanej i przed uzupełnieniem do 100 cm
3
dodać
odpowiednią ilość żelazocyjanku potasu (rozpuszczonego wcześniej w niewielkiej ilości wody) oraz pozostałe
składniki. Całość uzupełnić do kreski wodą destylowaną. Roztwór melasowy zakwasić do pH ok. 3-4 za
pomocą 10N H
2
SO
4
.
Otrzymaną w ten sposób 20% brzeczkę melasową, zakorkować i przygotować do wyjałowienia.
b. Podłoże syntetyczne
Przygotować 100 cm
3
pożywki syntetycznej o składzie:
- 20% sacharoza
-
0,3% NH
4
NO
3
-
0,15% KH
2
PO
4
-
0,1% MgSO
4
Odważone składniki rozpuścić w 100 cm
3
wody destylowanej. Podłoże zakwasić do pH ok. 3-4 za pomocą
10N H
2
SO
4
. Kolbę zakorkować i przygotować do wyjałowienia.
c. 20% roztwór sacharozy
Przygotować 100 cm
3
20% roztworu sacharozy w wodzie destylowanej. Roztwór zakwasić do pH ok. 3-4 za
pomocą 10N H
2
SO
4
. Kolbę zakorkować i przygotować do wyjałowienia.
2. Posiew Aspergillus niger
Przygotowane podłoża (a-c) zaszczepić konidiami kwasotwórczego szczepu Aspergillus niger w ilości 1 cm
3
gęstej zawiesiny na 100 cm
3
podłoża. Inkubować w cieplarce w temp. 30ºC przez 7 dni.
Wykonanie ćwiczenia (cz. 2)
1. Ocena wyglądu makroskopowego grzybni w poszczególnych próbach
Dokonać opisu makroskopowego wyglądu grzybni we wszystkich badanych próbach.
2. Oznaczanie kwasowości ogólnej
Kwasowość ogólna jest to suma wszystkich kwasów organicznych, jakie tworzą się podczas fermentacji
cytrynowej, wśród których najwięcej powstaje kwasu cytrynowego (ponad 90%), reszta to głównie kwas
szczawiowy i glukonowy.
Wykonanie:
Pobrać spod grzybni 2ml płynu pohodowlanego i przenieść do kolby stożkowej o pojemności 50/100 cm
3
.
Dodać 20ml wody destylowanej i miareczkować 0,1 N NaOH wobec fenoloftaleiny (3-4 krople) do pierwszego
trwałego różowego zabarwienia.
Wynik podać w cm
3
0,1 N NaOH/100 cm
3
pożywki.
Aktywna kultura powinna wykazywać kwasowość ogólną odpowiadającą 30 – 40 cm
3
0,1 N NaOH na 2ml
roztworu (wymagania normatywne mieszczą się w granicach 20 – 25 cm
3
0,1 N NaOH na 2 cm
3
roztworu).
Wyliczyć ilość wytworzonego kwasu cytrynowego wiedząc, że 1 cm
3
0,1 N NaOH odpowiada 7 mg kwasu
cytrynowego jednowodnego lub 6,4 mg bezwodnego.
3. Kolorymetryczna metoda oznaczania kwasu cytrynowego (metoda Furtha-Herrmanna)
Metoda kolorymetrycznego oznaczania kwasu cytrynowego polega na specyficznej i bardzo czułej reakcji
zachodzącej pomiędzy stosowanymi odczynnikami: bezwodnikiem kwasu octowego, pirydyną i kwasem
cytrynowym. W wyniku reakcji w badanym roztworze powstaje barwny kompleks, którego zabarwienie,
zmieniające się od żółtego do brązowego zależy od stężenia kwasu cytrynowego. Dokładność metody wynosi
ok. 3,5% i zależy od szybkości dodawania ściśle określonych objętości odczynników oraz temperatury, która
podczas oznaczania powinna być utrzymywana na stałym poziomie 32ºC przez 30 minut. Stężenie kwasu
cytrynowego w 1 cm
3
powinno zawierać się w granicach 0,1 – 0,5 mg.
- Sporządzanie roztworów wzorcowych do wykreślenia krzywej wzorcowej
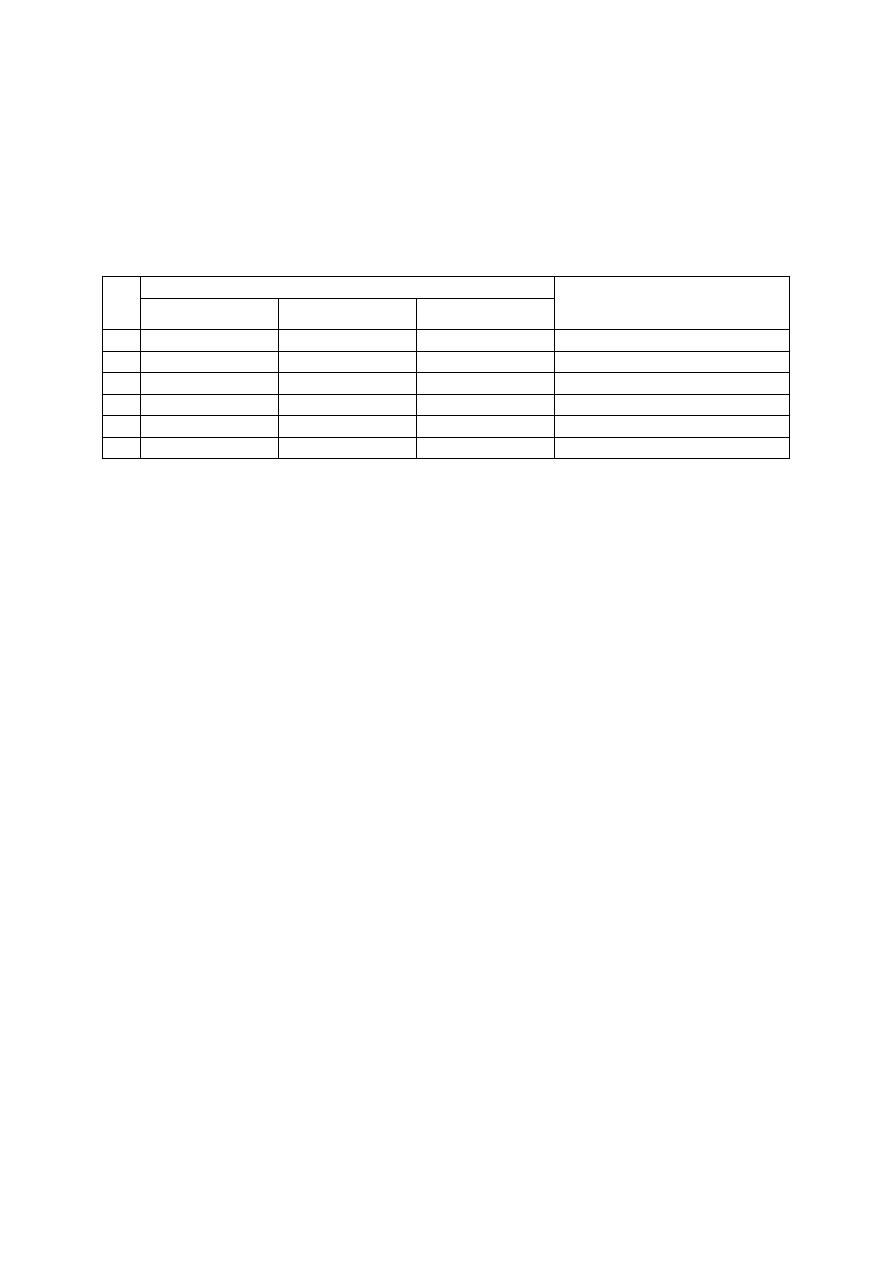
Biotechnologia ogólna dla studentów kierunku biotechnologia wersja 1.1
· Roztwór barwny (A)
do cylindra miarowego o objętości 100 cm
3
wprowadzić 10ml pożywki syntetycznej (pożywka 1b.) i
uzupełnić wodą destylowaną do 100 cm
3
(1 cm
3
roztworu zawiera 0,1 cm
3
wyjściowego roztworu pożywki
syntetycznej).
· Roztwór (B)
W kolbie miarowej o objętości 500 cm
3
rozpuścić 2,5 g kwasu cytrynowego w 500ml wody destylowanej
(1 cm
3
roztworu zawiera 5 mg kwasu cytrynowego).
Do zestawu kolbek miarowych (6x50 cm
3
) dodać 2ml roztworu barwnego (A) oraz odpowiednią ilość roztworu B
(tabela 1). Dopełnić do kreski wodą destylowaną.
T
ABELA
1. Roztwory wzorcowe kwasu cytrynowego
Lp.
50 cm
3
roztworu wzorcowego zawiera
Uwagi
Roztwór A [cm
3
]
Roztwór B [cm
3
]
Woda dest. [cm
3
]
1
2
0,0
48,0
Próba ślepa = 0 mg kwasu cytr.
2
2
1,0
47,0
1 cm
3
= 0,10 mg kw. cytr.
3
2
2,0
46,0
1 cm
3
= 0,20 mg kw. cytr.
4
2
3,0
45,0
1 cm
3
= 0,30 mg kw. cytr.
5
2
4,0
44,0
1 cm
3
= 0,40 mg kw. cytr.
6
2
5,0
43,0
1 cm
3
= 0,50 mg kw. cytr.
- Wykonanie oznaczeń do krzywej wzorcowej
Do probówki (szklanej) przenieść 1ml roztworu wzorcowego, dodać najpierw 1,3ml pirydyny, a następnie
5,7ml bezwodnika kwasu octowego, szybko wymieszać (vortex) i wstawić na 30 min. do łaźni wodnej o temp.
32ºC. Pomiar absorbancji wykonać w ciągu 30 minut od wyjęcia próbek z łaźni, przy długości fali 420 nm.
Średnie wyniki z trzech powtórzeń pomiarów absorbancji dla każdego ze stężeń kwasu cytrynowego użyć do
wykreślenia krzywej wzorcowej.
- Oznaczenie kwasu cytrynowego w płynie pohodowlanym
Pobrać 2 cm
3
płynu pohodowlanego i uzupełnić wodą destylowaną do 500 cm
3
w kolbie miarowej. Dalej
postępować jak w punkcie powyżej.
Stężenie kwasu cytrynowego w hodowli odczytać z wykresu krzywej wzorcowej.
- Pomiar absorbancji
a.
przed rozpoczęciem pomiaru należy otworzyć pokrywę spektrofotometru – urządzenie nagrzewa się 15 minut!!!
b.
po 15 minutach za pomocą pipety automatycznej wypełniamy szklaną kuwetę w 2/3 objętości roztworem wzorcowym – próba ślepa (0g
kw. cytrynowego)
trzymając kuwetę staramy się nie dotykać przeźroczystych ścianek naczynia !!!
c.
w celu dokonania pomiaru naciskamy przycisk A, wpisujemy długość fali (420 nm), potwierdzamy naciskając A i umieszczamy kuwetę
w urządzeniu, po chwili odczytujemy wynik absorbancji dla próby kontrolnej
d.
pomiar powtarzamy 3 razy, za każdym razem wyciągając i ponownie wkładając kuwetę (urządzenie reaguje na nacisk wywołany
ciężarem kuwety) – nie naciskamy żadnych przycisków !!!
e.
wynik końcowy podajemy jako średnią trzech pomiarów
f.
analogiczne pomiary wykonujemy dla kolejnych stężeń kw. cytrynowego, po każdym pomiarze dokładnie płuczemy kuwetę wodą
destylowana i delikatnie suszymy w bibule
g.
podobnie wykonujemy oznaczenie kw. cytrynowego w płynie pohodowlanym
h.
po pomiarach kuwety dokładnie płuczemy wodą destylowaną i pozostawiamy do wysuszenia na bibule
i.
urządzenie wyłączamy zamykając pokrywę spektrofotometru
4. Opracowanie wyników
Wyniki pomiarów przestawić w formie sprawozdania (opis makroskopowy grzybni, zawartość kw.
cytrynowego, kwasowość ogólna). Wyciągnąć wnioski z uzyskanych wyników.
5. Zagadnienia teoretyczne:
- metody otrzymywania kwasu cytrynowego
- mikroorganizmy produkujące kwas cytrynowy
- uwarunkowania produkcji kwasu cytrynowego u Aspergillus niger
- przykłady zastosowania kwasu cytrynowego
6. Literatura
- Kowal K., Libudzisz Z.; Mikrobiologia techniczna; Wyd. Politechniki Łódzkiej; 2000
- Kunicki-Goldfinger W.; Życie bakterii; Wyd. PWN; Warszawa; 1998
-
Schlegel H.; Mikrobiologia ogólna; Wyd. PWN; Warszawa; 2000
Wyszukiwarka
Podobne podstrony:
Produkcja i zastosowania helu
Olejek cytrynowy i jego zastosowanie w kosmetyce
Metody energetyczne zastosowanie twierdzenia Menabre'a Zad 1(1)
27 Ulepszanie podłoża gruntowego, metody wykonawstwa, zastosowania, technologie
65.Metody aktywne zastosowane do nauki czytanuia ze zrozumi9eniem, pomoce do przedszkola, Odimienna
Strategie produktu na różnych etapach jego cyklu życia
SUROWCE DO PRODUKCJI KWASU MLEKOWEGO
siarczan miedzi, produkcja bez kwasu siarkowego
utlenianie propylenu do akroleiny produkcja kwasu akrylowego
Biochemia 7K Cykl kwasu cytrynowego
Cykl Krebsa cykl kwasu cytrynowego
Wykorzystanie wytłoczyn do pozyskiwania kwasu cytrynowego
Cykl Krebsa, cykl kwasu cytrynowego
14 BIOCHEMIA cykl kwasu cytrynowego 2id 15387 ppt
Nadprodukcja kwasu cytrynowego w kulturach Aspergillus niger
więcej podobnych podstron