
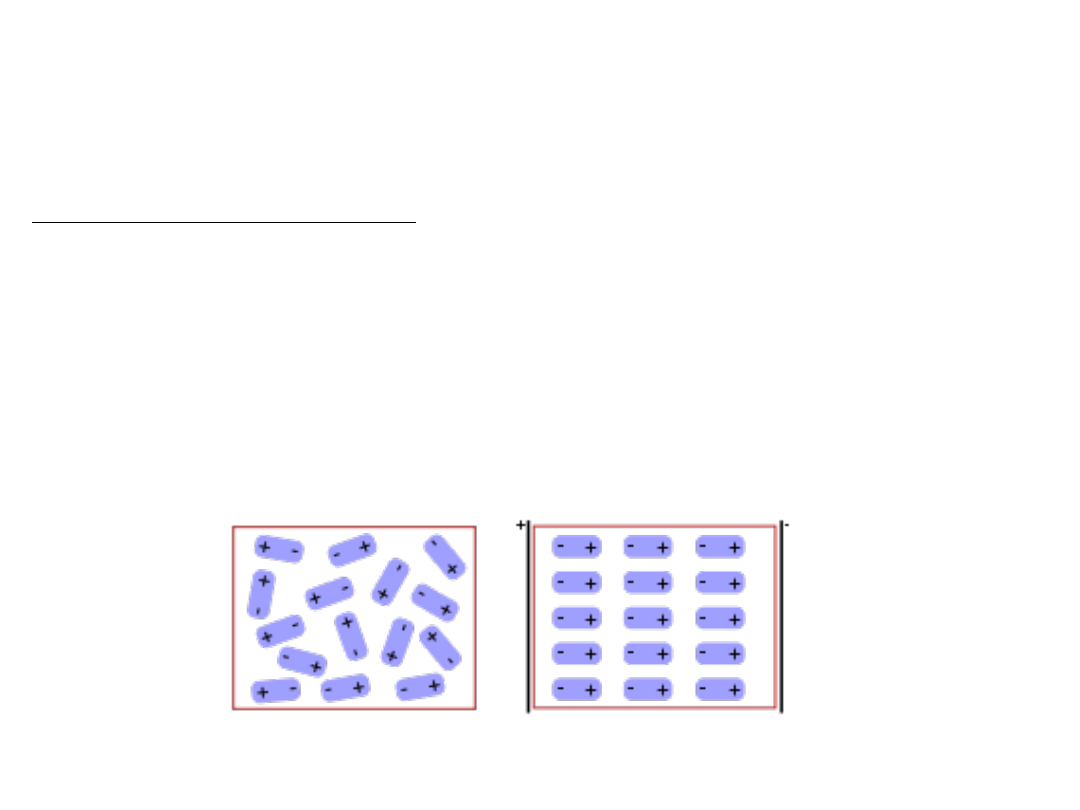
Wprowadzenie dielektryku pomiędzy okładki kondensatora powoduje osłabienie natężenia
pola elektrycznego między płytkami, na których nagromadzony jest dany ładunek. Przyczyną
zmniejszenia natężenia jest polaryzacja dielektryka.
Mechanizm polaryzacji dielektryka:
Jeżeli kondensator naładowany jest do odpowiedniego potencjału i na okładkach znajdują
się ładunki +q i –q, to ładunki na okładkach kondensatora zakłócają równowagę elektryczną
w dielektryku, indukując w nim ładunki przeciwnego znaku. Efekt ten opisuje się poprzez
polaryzację (P)
, czyli sumaryczny moment dipolowy indukowany w jednostkowej objętości
dielektryka.
-
Dipole indukowane
w spolaryzowanym dielektryku
Efekt indukowanego momentu dipolowego w cząsteczce jest proporcjonalny do
natężenia pola działającego na cząsteczkę (E
1
):
oraz
Gdzie:
- współczynnik proporcjonalności - polaryzowalność, skłonność konfiguracji
elektronowej cząsteczki do ulegania deformacji pod wpływem pola elektrycznego
Miarą wpływu przyłożonego pola na polaryzację cząsteczki jest jej
polaryzowalność
,
liczbowo równa momentowi dipolowemu wzbudzonemu przez pole elektryczne o
natężeniu jednostkowym.
1
E
ind
ind
1
E
n
P
ind
3
4
2
'
1
'
A
m
N
d
M
P
Polaryzowalność cząsteczki (
), polaryzację molową (P) czy moment dipolowy cząsteczki
(
) można obliczyć na podstawie pomiarów stałej dielektrycznej:
Równanie
CLAUSIUSA - MOSOTTIEGO
M – masa cząsteczkowa
d - gęstość związku
N
A
– liczba Avogadro
k – stała Boltzamanna
kT
N
M
d
P
A
m
3
3
4
2
'
1
'
2
Równanie
DEBYE’A
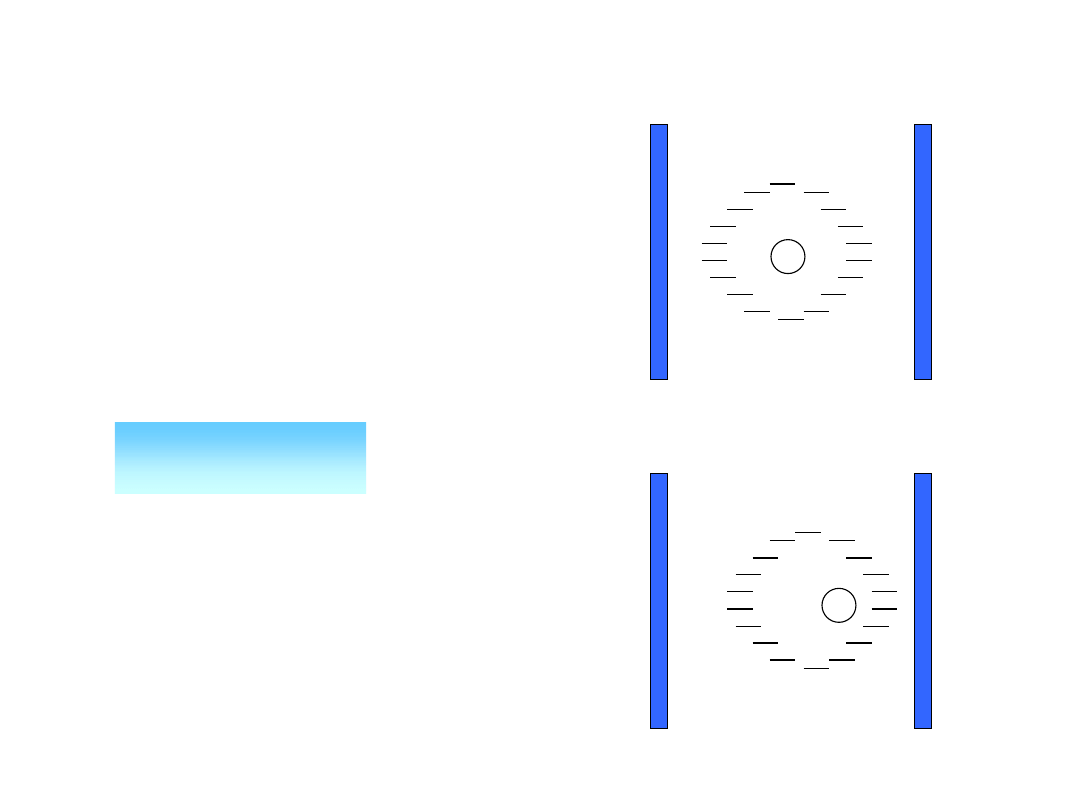
Polaryzacja elektronowa (P
el
)
Wynika z zaburzenia rozkładu gęstości
elektronowej wokół jąder atomowych. Pod
wpływem pola elektrycznego indukowany
jest w każdym atomie moment dipolowy,
proporcjonalny do natężenia pola:
- polaryzowalność (ma wymiar objętości,
jest rzędu 10
-24
cm
3
,
tzn. objętości kuli o promieniu
orbity elektronowej).
E
el
ind
+
+
+
+
+
+
+
-
-
-
-
-
-
-
+
+
nieobecne pole
pole elektryczne
Zjawiska zachodzące podczas
polaryzacji elektronowej
Polaryzacja atomowa (P
at
)
Jest
rezultatem
zmiany
geometrii
cząsteczek,
a
więc
odległości
międzyatomowych
oraz
kątów
walencyjnych. Polaryzacja atomowa jest
znaczna w przypadku związków o
charakterze jonowym lub zawierających
silne polarne grupy, łatwo deformujące
się pod wpływem pola. Moment
indukowany,
wskutek
polaryzacji
atomowej, również jest proporcjonalny
do natężenia pola.
+
+
+
+
+
+
+
-
-
-
-
-
-
-
nieobecne pole
pole elektryczne
Zjawiska zachodzące podczas
polaryzacji atomowej
-
+
-
+
-
-
Polaryzacja dipolowa (orientacji) (P
or
)
Występuje w przypadku związków, których
cząsteczki maja trwałe momenty dipolowe.
Pod wpływem pola elektrycznego dochodzi
do orientowania się trwałych dipoli
względem kierunku pola i uzyskuje się stan
statystycznego uporządkowania.
Średnia polaryzowalność dipolowa zależy od
trwałych momentów dipolowych oraz od
temperatury, która niekorzystnie wpływa na
stan uporządkowania:
kT
dip
3
2
+
+
+
+
+
+
+
-
-
-
-
-
-
-
nieobecne pole
pole elektryczne
Zjawiska zachodzące podczas
polaryzacji dipolowej
-
+
-

Polaryzacja indukowana (P
ind
)
Każdy dielektryk, nawet taki, którego cząsteczki nie są dipolami, ulega wpływowi
zewnętrznego pola elektrycznego. Efekt ten nazwany jest polaryzacją indukowaną i można
go rozłożyć na dwie składowe:
- polaryzację elektronową (P
el
) wywołaną zaburzeniem przez zewnętrzne pole chmury
elektronowej w cząsteczkach dielektryka;
- polaryzacja atomową (P
at
) wywołaną przesunięciem jąder atomowych jednych w
stosunku do drugich (zmiana geometrii cząsteczki)
ind
A
at
el
ind
N
P
P
P
0
3
d
M
kT
N
P
P
P
ind
A
or
ind
c
2
1
3
3
2
0
POLARYZOWALNOŚĆ
Polaryzowalność ogólna (całkowita) równa jest sumie wszystkich trzech składowych
dip
at
el
Polaryzowalność ogólna jest związana z mierzalną, makroskopową właściwością
substancji – przenikalnością dielektryczną
.
Natomiast jeżeli w polu elektrycznym znajduje się cząsteczka polarna o trwałym
momencie dipolowym, to ulega ona zarówno polaryzacji dipolowej, jak i indukowanej.
Średni całkowity moment elektryczny takiej cząsteczki jest sumą obu polaryzacji:
1
1
2
3
E
E
kT
ind
or
ind
c
gdzie: całkowita polaryzowalność cząsteczki
=
ind
+
or

Wyznaczanie refrakcji molowej
Badając zjawisko załamania światła można wyciągnąć pewne wnioski odnośnie struktury
cząsteczek ośrodka przezroczystego na które pada światło. Promień świetlny przechodząc
z ośrodka, w którym ma prędkość c
1
do ośrodka, w którym ma prędkość c
2
, ulega na
powierzchni granicznej częściowemu odbiciu i załamaniu. W wyniku tego zjawiska
promień zmienia swój pierwotny kierunek, przy czym, zgodnie z
prawem Snelliusa
,
stosunek sinusa kąta padania do sinusa kąta załamania jest dla danej pary ośrodków
wielkością stałą, zwaną współczynnikiem załamania światła, równą stosunkowi prędkości
światła w obydwu ośrodkach.
2
1
sin
sin
c
c
n
- kąt padania,
- kąt załamania, c
1
, c
2
– prędkość światła w ośrodku 1 i 2
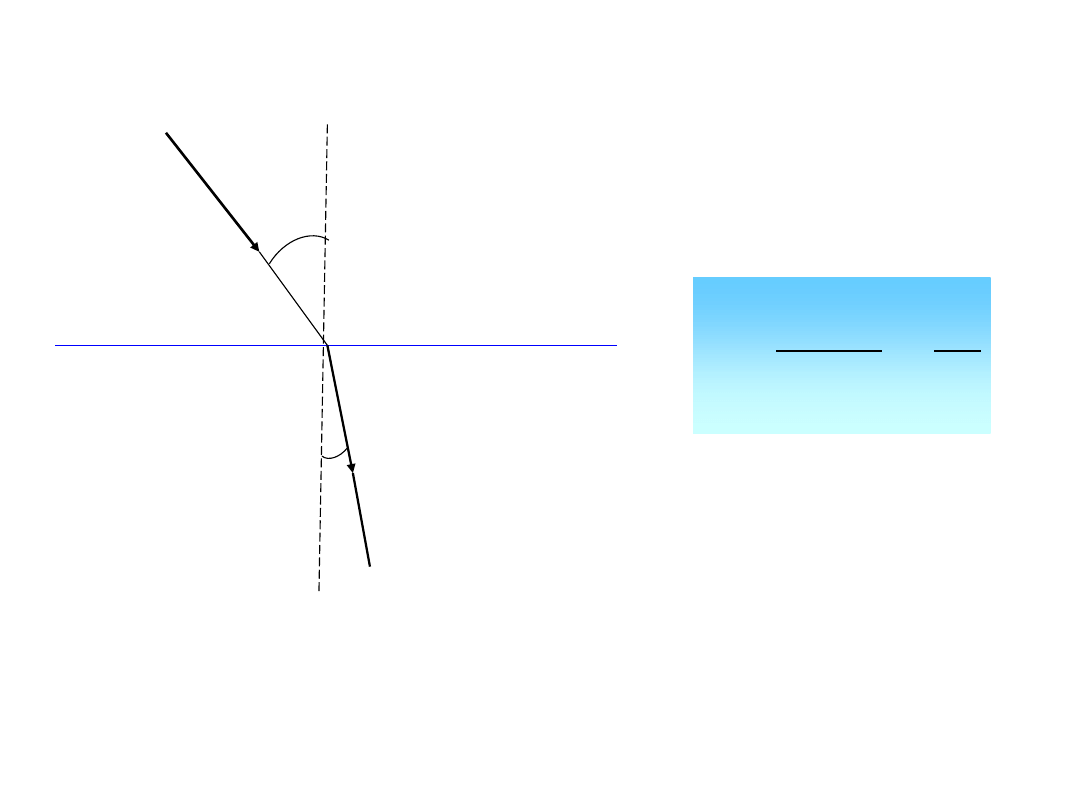
Załamanie światła
Ośrodek 1
Ośrodek 2
2
1
sin
sin
c
c
n
Jeżeli załamanie światła następuje w ten sposób, że kąt
jest mniejszy od kąta
, to
ośrodek 2 nosi nazwę optycznie gęstszego niż ośrodek 1.
Jeżeli kąt
jest większy od kąta
, to ośrodek 2 jest ośrodkiem optycznie rzadszy niż
ośrodek 1.
Próżnia jest ośrodkiem optycznie najrzadszym – największa prędkość.
GRANICA FAZ
Współczynnik załamania światła wyznaczony względem próżni nazywa się bezwzględnym
współczynnikiem załamania (N), który oznacza się z reguły tylko dla gazów.
Dla cieczy i ciał stałych wyznacza się zwykle współczynnik załamania (n) względem
powietrza, ponieważ różnica pomiędzy wartościami N i n jest niewielka (ok. 0,03%)
Badania współczynnika załamania znajdują zastosowanie m.in. przy określaniu budowy
związków chemicznych, wykorzystując równania Lorentza i Lorenza na refrakcję właściwą
i molową:
d
M
n
n
R
2
1
2
2
d
n
n
r
1
2
1
2
2
M
r
R

Refrakcja molowa ma wymiar objętości molowej, a jej jednostką jest jednostka objętości
molowej, a więc m
3
/mol lub cm
3
/mol (współczynnik załamania światła jest wielkością
niemianowaną).
Refrakcja molowa określa objętość, którą rzeczywiście zajmują w przestrzeni cząsteczki 1
mola substancji (jest mniejsza od objętości molowej).
Refrakcja molowa jest wielkością charakterystyczną i stałą dla danego związku
chemicznego, niezależną od temperatury i ciśnienia, natomiast zależną od długości fali
światła. W przypadku stosowania linii żółtego światła sodowego oznacza się ją symbolem
R
D
.

Refrakcja molowa jest
wielkością
addytywną
– może być rozłożona na stałe udziały
atomowe (suma refrakcji atomów R
a
) i udziały wiązań (suma refrakcji wiązań R
w
) z
uwzględnieniem poprawek, wynikających ze szczególnej struktury elektronowej (np.
układy z elektronami
, które wykazują zwykle podwyższoną podatność do polaryzacji, a
także pewne zdeformowane układy atomowe).
i
w
i
i
a
i
R
n
R
n
R
n
i
– oznacza liczbę określonych atomów i wiązań w cząsteczce
Korzystając z powyższego równania można obliczyć refrakcję molową związku, gdy znana
jest jego budowa. Wielkość tę można wyznaczyć również doświadczalnie, mierząc w
określonej temperaturze współczynnik załamania światła i gęstość oraz wyznaczając masę
molową danego związku. Porównując wyniki otrzymane teoretycznie i eksperymentalnie
dla kilku możliwych struktur badanego połączenia, można określić, która z nich jest
właściwa.
Refrakcja molowa mieszaniny (roztworu) wykazuje również właściwości addytywne i równa
się sumie udziałów refrakcji molowych poszczególnych składników mieszaniny.
Dla roztworu dwuskładnikowego wielkość tą można wyrazić wzorem:
2
2
1
1
R
x
R
x
R
mieszaniny
x
1
,x
2
– ułamki molowe substancji 1 i 2; R
1
, R
2
– refrakcje molowe czystych substancji 1 i 2.
Doświadczalną wartość refrakcji molowej roztworu dwuskładnikowego wyznacza się na
podstawie równania:
mieszaniny
mieszaniny
mieszaniny
mieszaniny
d
M
x
M
x
n
n
R
2
2
1
1
2
2
2
1

Pomiar współczynnika załamania światła
Przyrządy stosowane do pomiaru współczynnika załamania światła noszą nazwę
refraktometrów. Zasada ich działania polega na tym, że jeżeli promień świetlny
przechodząc z ośrodka optycznie rzadszego do gęstszego pada na powierzchnię graniczną
pod kątem 90
0
, to załamanie następuje pod kątem
g
, który nazywa się katem granicznym.
Obserwacja promienia załamanego pozwala zauważyć, że w tych warunkach pole widzenia
jest podzielone na 2 ostro od siebie oddzielone części: jasną i ciemną. W tej sytuacji, tzn.
dla kąta padania
=90
0
g
g
n
sin
1
sin
90
sin
0
Pomiaru współczynnika załamania światła dokonuje się poprzez zmierzenie wartości
kąta granicznego w refraktometrze.
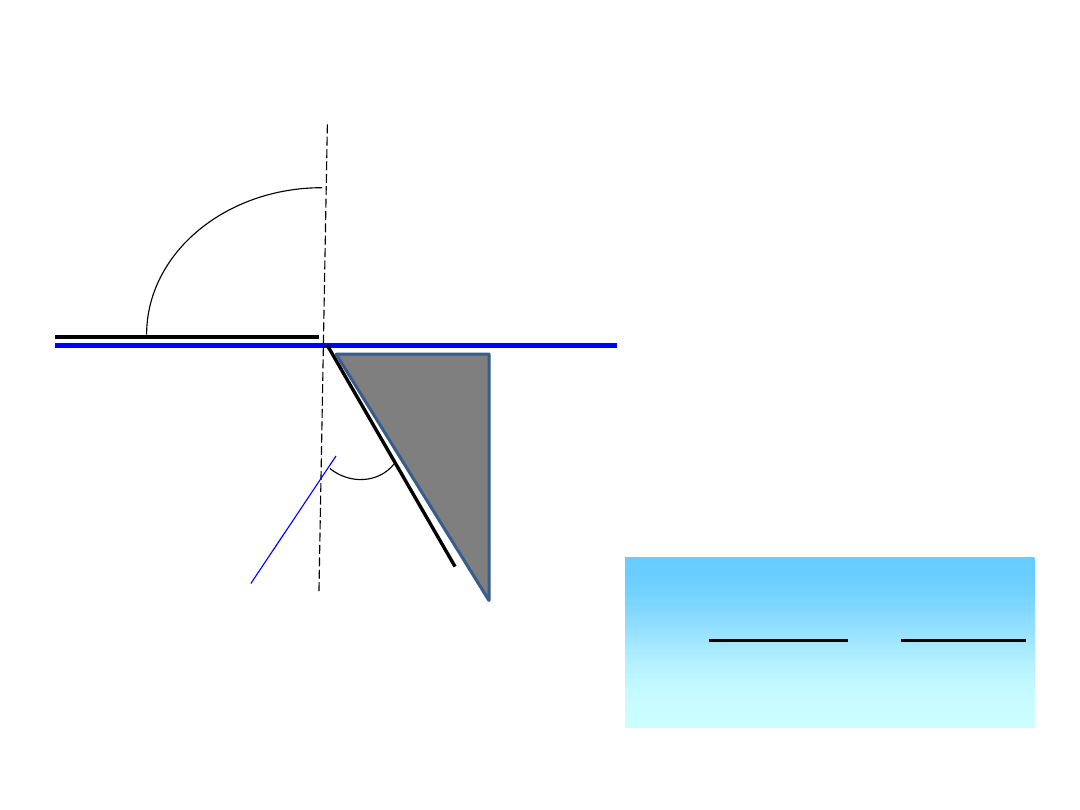
Kąt graniczny i zasada działania refraktometru
GRANICA FAZ
Ośrodek
optycznie
rzadszy
Pole
jasne
90
0
g
Ośrodek
optycznie
gęstszy
Pole ciemne
Kąt
graniczny
g
g
n
sin
1
sin
90
sin
0
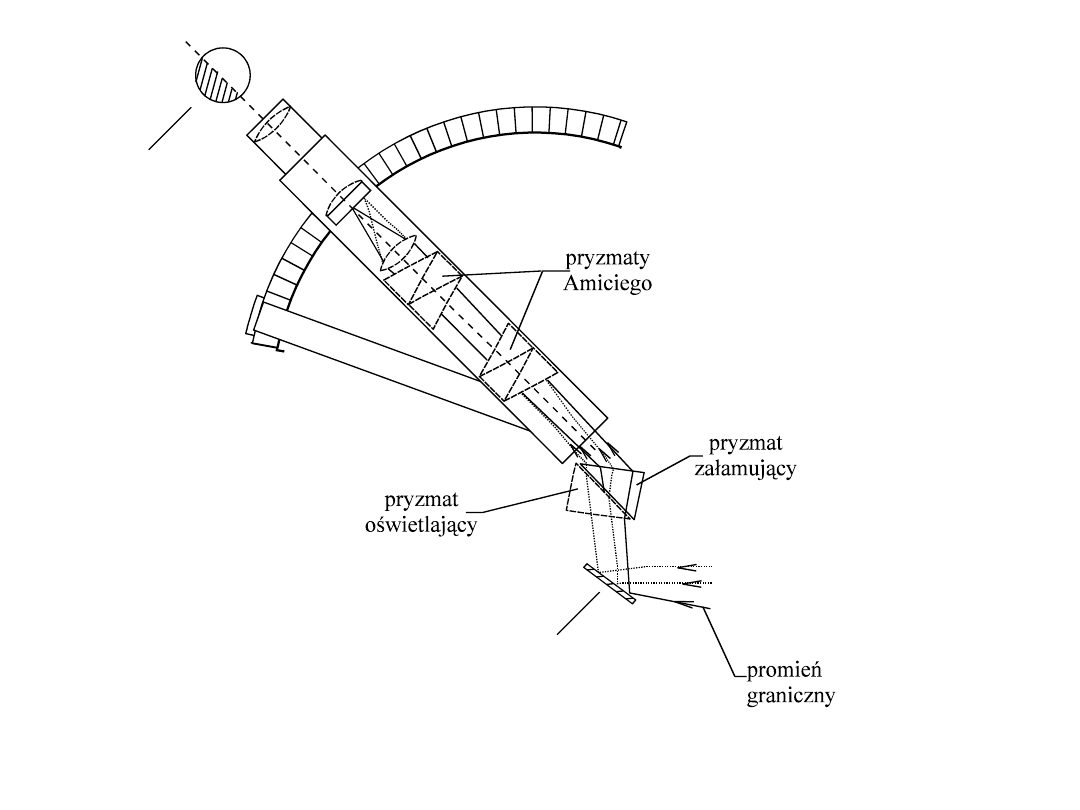
Refraktometr Abbego
lusterko
okular

Zasada działania refraktometru Abbego
Cienką warstwę badanej cieczy umieszcza się pomiędzy dwoma pryzmatami wykonanymi
ze szkła charakteryzującego się dużym współczynnikiem załamania. Promienie świetlne
(monochromatyczne) odbite od lusterka przechodzą do pryzmatu oświetlającego o
matowej powierzchni wewnętrznej, załamują się w nim i pod różnymi kątami padają na
badaną substancję. Następnie po przejściu przez warstwę substancji trafiają pod kątem
90
0
na pryzmat załamujący, w którym załamują się pod kątem granicznym, przez co pole
widzenia w okularze jest częściowo jasne a częściowo ciemne. Wszystkie promienie, które
padają pod kątem większym niż kąt graniczny zostają całkowicie odbite i nie przedostają
się do drugiego pryzmatu. Ustawiając lunetkę tak, aby granica cienia była w środku pola
widzenia (umożliwiają to dwie cienkie skrzyżowane nici „pajęcze”), można na
odpowiedniej skali odczytać współczynnik załamania światła badanej cieczy za pomocą
lunetki.
Wbudowany w refraktometr zespół pryzmatów Amiciego powoduje odchylanie
wszystkich promieni o długości fal innych niż żółta linia światła sodowego.

Wyznaczanie momentu dipolowego i polaryzowalności cząsteczki
Stałą dielektryczną materiału mierzy się umieszczając go między okładkami kondensatora –
w przypadku cieczy wypełnia się nią naczynie, w którym zanurza się płytki kondensatora.
Kondensator włącza się następnie w jedno ramię mostka elektrycznego, np. mostka
Wheatstone’a do pomiaru oporów i równoważy się pojemność badanego kondensatora za
pomocą regulowanego kondensatora porównawczego, nie zawierającego dielektryka
między okładkami. Pojemność kondensatora porównawczego można obliczyć na podstawie
jego
geometrii.
Tą metodą wyznacza się pojemność kondensatora badanego, z dielektrykiem i bez
dielektryka, oraz określa się stała dielektryczną badanego materiału. Do pomiarów stosuje
się prąd zmienny o częstotliwości ok. 1 MHz.
Gdy badany związek jest ciekły lub stały, pomiarom poddaje się jego roztwory
w nieaktywnych rozpuszczalnikach niepolarnych, np. w CCl
4
lub benzenie.

Równanie Debye’a zakłada niezależne zachowanie się cząsteczek polarnych. Cząsteczki
dipolowe silnie oddziałują na siebie wzajemnie; najbardziej uzasadnione jest więc
stosowanie równania Debye’a do rozcieńczonych roztworów związków polarnych w
niepolarnych rozpuszczalnikach.
Pomiar stałej dielektrycznej i zastosowanie równania Debye’a nie umożliwia
bezpośredniego wyznaczenia oddzielnie
i
.
kT
N
M
d
P
A
m
3
3
4
2
1
2
Równanie
DEBYE’A
Istnieją dwie zasadnicze metody uzyskiwania tych dwóch wielkości.
T
k
N
N
d
M
P
A
A
1
3
3
4
3
4
2
1
2
Pierwsza metoda polega na pomiarze
i d jako funkcji temperatury i wykorzystaniu
otrzymanych danych do graficznego przedstawienia jako funkcji 1/T.
d
M
2
1
Y
X
a
b
=
+
Na podstawie równania Debye’a można oczekiwać, że zależność ta będzie prostoliniowa (jest
ona spełniona przez chlorowcowodory). Na podstawie nachylenia prostej można wyznaczyć
moment dipolowy, a z przecięcia się prostej z osią Y polaryzowalność. Metoda ta jest dość
prosta i zawodzi jedynie w przypadku, gdy cząsteczki są w różnym stopniu zasocjowane w
różnych temperaturach lub gdy konfiguracja cząsteczki zmienia się z temperaturą.

Druga metoda, umożliwiająca wyznaczenie polaryzowalności w polaryzacji molowej (P), oparta
jest na zależności między stałą dielektryczną a współczynnikiem załamania, wynikającej z
elektromagnetycznej teorii promieniowania Maxwella. Użyte do pomiaru współczynnika
załamania promieniowanie widzialne związane jest z polem elektrycznym o tak dużej
częstotliwości (ok. 10
15
Hz), że orientacja cząsteczek nie nadąża za zmianami pola. Stąd nie
odgrywają tutaj roli dipole trwałe, lecz jedynie polaryzacja cząsteczek.
Z teorii Maxwella wynika, że w przypadku substancji zbudowanych z cząsteczek nie mających
trwałych momentów dipolowych:
n
2
=
gdzie: n – współczynnik załamania światła

Wynika z tego, że nawet gdy cząsteczki dielektryka mają momenty dipolowe, można obliczyć
udział polaryzowalności w całkowitej polaryzacji molowej (P) za pomocą wzoru:
Pomiary współczynnika załamania umożliwiają więc określenie wartości
, którą łącznie z
danymi dotyczącymi stałej dielektrycznej można wykorzystać do wyznaczenia momentu
dipolowego cząsteczki (
).
3
4
2
1
2
2
A
N
d
M
n
n
P

Uproszczoną metodę wyznaczenia momentu dipolowego czystych cieczy polarnych
zaproponował Onsager:
2
2
2
2
0
2
2
2
9
n
d
M
n
n
N
kT
A
Równanie to wynika z przybliżonego założenia, że cząsteczka badanej cieczy jest dipolem
znajdującym się w sferycznej jamie. Z takich dipoli składa się cały rozpuszczalnik.
W celu obliczenia momentu dipolowego należy wykonać pomiary:
1) gęstości (piknometr)
2) współczynnika załamania światła (refraktometr Abbego)
3) względnej przenikalności elektrycznej badanych cieczy (metoda mostkowa –
uniwersalny mostek RLC)
w temperaturze otoczenia.
Wyszukiwarka
Podobne podstrony:
Opór elektryczny właściwy(1)
Elektryczne Właściwości Materiałów Izolacyjnych
Własn elektr, Właściwości elektr.2, Opracował: Marcin Zając
21 Falowe właściwości cząstek
21 - Falowe właściwości cząstek, Politechnika Lubelska, Studia, Studia, FIZA
02 Elektrony w atomach i czasteczkach
27 Wyznaczanie elektronowej polaryzowalności cząsteczki wody
Opór elektryczny właściwy(1)
Fala elektromagnetyczne i właściwości fotonów
Cw 07 E 01 Badanie właściwości elektrycznych kondensatora pł
Cw 10 (51) Pomiar ładunku właściwego e m elektronu
więcej podobnych podstron