
UNIWERSYTET ZIELONOGÓRSKI
WYDZIAŁ INśYNIERII LĄDOWEJ I ŚRODOWISKA
INSTYTUT INśYNIERII ŚRODOWISKA
Zakład Technologii Wody, Ścieków i Odpadów
Ćwiczenia laboratoryjne
z Odnowy wody
USUWANIE AZOTU AMONOWEGO
PRZEZ
UTLENIANIE CHLOREM
Usuwanie azotu amonowego przez utlenianie chlorem
1
1. PODSTAWY TEORETYCZNE
Metody usuwania azotu amonowego:
I. Odpędzanie w wieżach stripingowych,
II. Wymiana jonowa,
III. Wymiana jonowa na klinoptylolicie,
IV. Utlenianie chlorem,
V. Utlenianie ozonem.
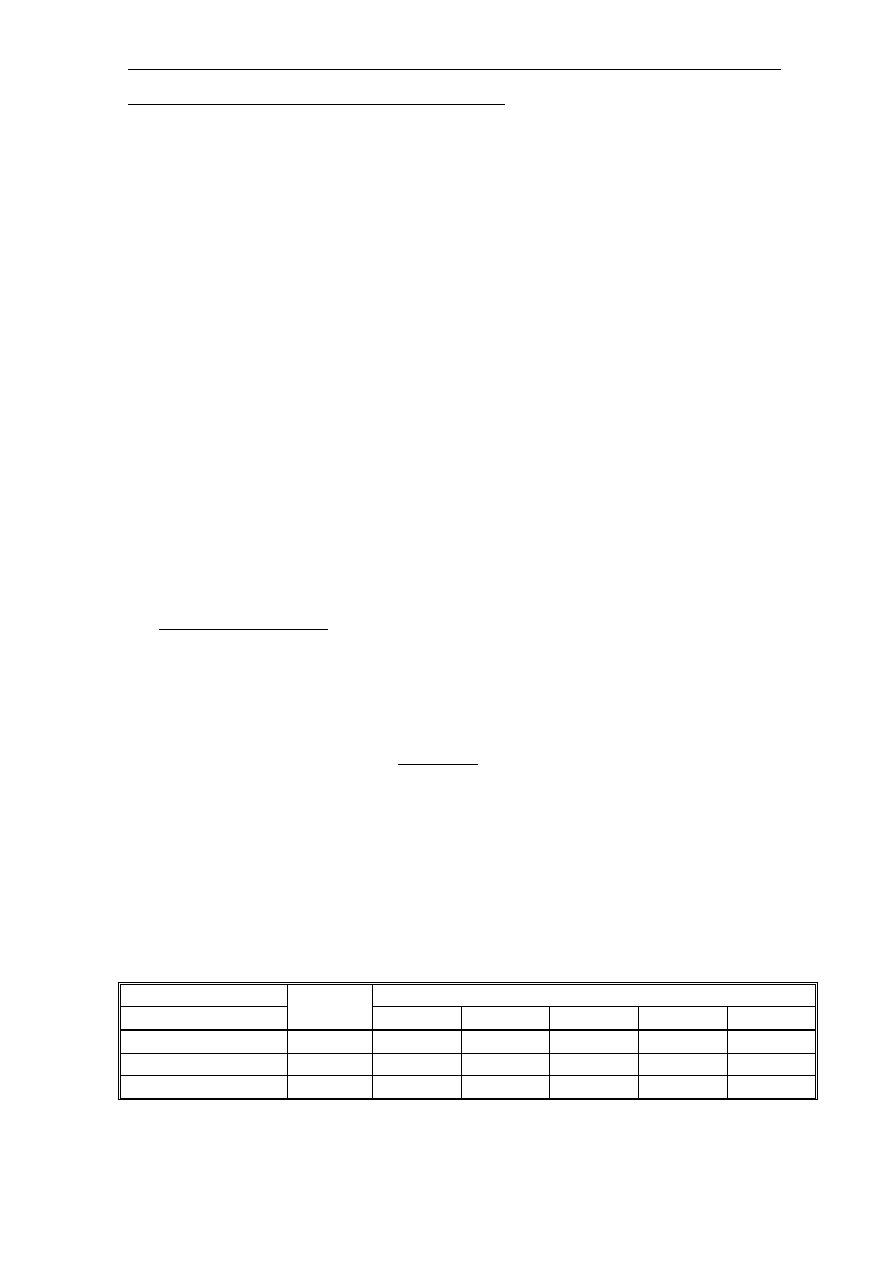
W wyniku chlorowania zmiennymi dawkami chloru wód lub ścieków,
zawierających azot amonowy, otrzymujemy krzywą zapotrzebowania chlorowego, na
której można wyróżnić punkt maksymalny i minimalny (punkt przełamania). W
pierwszej fazie chlorowania (aż do punktu maksymalnego) powstają chloroaminy, a
następnej do punktu przełamania następuje ich rozkład. Poza punktem przełamania
obserwuje się występowanie chloru wolnego, trójchloroazotu i dwuchloroaminy.
Przebieg powstawania chloroamin można opisać następująco:
NH
3
+ OCl
-
→ NH
2
Cl + OH
-
2NH
2
Cl + H
+
→ NHCl
2
+ NH
4
+
3NHCl
2
+ H
+
→ 2NCl
3
+ NH
4
+
W przypadku dużych dawek chloru może nastąpić bezpośrednia reakcja azotu
amonowego z chlorem:
NH
4
+
+ HOCl → NH
2
Cl + H
2
O + H
+
NH
4
+
+ 2HOCl → NHCl
2
+ 2H
2
O + H
+
NH
4
+
+ 3HOCl → NCl
3
+ 3H
2
O + H
+
Rodzaj wytworzonych chloroamin zależy przede wszystkim od odczynu:
pH > 8 – monochloroaminy,
pH 8-5 – monochloroaminy, dwuchloroaminy i azot amonowy równowagowy,
pH 5-3 – dwuchloroaminy, trójchloroazot i azot amonowy równowagowy,
pH < 3 – trójchloroazot i azot amonowy równowagowy.
Krzywa zapotrzebowania chloru
Usuwanie azotu amonowego przez utlenianie chlorem
2
Warunki stosowania procesu utleniania chlorem
Usuwanie azotu amonowego przez utlenianie chlorem ma sens tylko przy małym
stężeniu azotu amonowego rzędu 10 mg/dm
3
N i niewielkim zasoleniu – ciała
rozpuszczone rzędu 500 – 600 mg/dm
3
. Do usunięcia 1 g azotu amonowego potrzeba
10 g chloru co powoduje przyrost 10 g chlorków.
2. CEL ĆWICZENIA
Zasadniczym celem ćwiczenia jest zapoznanie się z chemizmem procesu
chlorowania ścieków.
3. WYKONANIE ĆWICZENIA
Ścieki chloruje się zmiennymi dawkami chloru, które należy obliczyć na
podstawie zawartości azotu amonowego. Należy zastosować następujące dawki
chloru:
0,5
*
mgN-NH
4
/dm
3
Cl
2
; 1,0
*
mgN-NH
4
/dm
3
Cl
2
; 2,5
*
mgN-NH
4
/dm
3
Cl
2
5,0
*
mgN-NH
4
/dm
3
Cl
2
;
7,5
*
mgN-NH
4
/dm
3
Cl
2
; 10,0
*
mgN-NH
4
/dm
3
Cl
2
; 12,5
*
mgN-NH
4
/dm
3
Cl
2
Do 0,5 dm
3
erlenmajerki ze szlifem wlać po 0,5 dm
3
ścieków. Zbadać miano wody
chlorowej i na tej podstawie obliczyć ile ml należy jej dodać do każdej kolby. Dodać
odpowiednie ilości wody chlorowej do kolb, zatkać je korkiem i starannie wymieszać. Po
upływie 30 min. Kontaktu ścieków z chlorem należy wykonać następujące oznaczenia:
- chlor pozostały jodometrycznie,
- azot amonowy po 1 min. kontaktu z odczynnikiem,
-
pH.
Miano wody chlorowej
Do kolbki ze szlifem odmierzyć 10 cm
3
wody chlorowej, dodać 5 cm
3
kwasu octowego i
10 cm
3
KJ. Przygotowaną próbę zamknąć korkiem i odstawić na 5 min. do ciemni. Po 5
min. miareczkować tiosiarczanem sodu do uzyskania słomkowego zabarwienia, dodać
ok. 1 cm
3
skrobii i dalej miareczkować do odbarwienia się próby.
X =
V
f
a
1000
⋅
⋅
mg/dm
3
Cl
2
a – ilość ml tiosiarczanu sodu zużyta na zmiareczkowanie próby,
f – ilość chloru odpowiadającego 1 cm
3
tiosiarczanu sodu[mg]
f = 0,355 – 0,01 M tiosiarczan sodu
f = 0,886 – 0,025 M tiosiarczan sodu
V – objętość próby ( 10 cm
3
).
4. OBLICZANIE WYNIKÓW
Po wykonaniu ćwiczenia wyniki należy zestawić w tabeli oraz narysować
krzywą zapotrzebowania chloru po upływie 30 min. kontaktu ścieków z chlorem.
Dawka chloru mg/dm
3
mg/dm
3
Ścieki
surowe
Chlor pozostały
Azot amonowy
pH
Literatura:
1.
Kowal A. L.; Odnowa wody; Skrypt Politechniki Wrocławskiej; Wrocław 1996.
Wyszukiwarka
Podobne podstrony:
2 Usuwanie azotu amonowego przez odpedzanie
2 Usuwanie azotu amonowego przez odpedzanie
Usuwanie azotu amonowego metodą wymiany jonowej
3 Usuwanie A amonowego utlenianie chlorem Tabela
Sprawko 1-Określenie wpływu temperatury na szybkość utleniania azotu amonowego
Biologiczne usuwanie azotu mineralnego ze ścieków
usuwanie azotu
3 Oznaczanie azotu amonowego me Nieznany (2)
Biologiczne usuwanie azotu mineralnego ze ścieków
azotu amonowego i azotanowego, Ochrona Środowiska, semestr III, CHEMIA, Chemia środowiska
Poprawa skuteczności usuwania azotu w oczyszczalni ścieków Zürich Werdhöelzli
2 Usuw A amonowego przez odpedzanie Tabela
Oznaczanie azotu amonowego metodą miareczkowania alkacymetrycznego po wstępnej?stylacji
Zaawansowane metody usuwania azotu mineralnego ze ścieków
ĆW9Kolorymetryczne oznaczanie azotu amonowego metod bezpośredniej nessleryzacji
Usuwanie jonów amonowych z wody podziemnej
PRZEBIEG AKCJI USUWANIA SKUTKÓW KATASTROFY KOLEJOWEJ CYSTERN Z CHLOREM W BIAŁYMSTOKU POWSTAŁEJ 9 09
więcej podobnych podstron