127
BIOMONITORING MUTAGENNOŚCI POWIETRZA
ATMOSFERYCZNEGO I WODY
Dr Anicenta Bubak
Instytut Medycyny Pracy i Zdrowia Środowiskowego, Sosnowiec
Wszystkie dotychczas prowadzone badania nad narażeniem populacji ludzkich na wystę-
pujące w powietrzu atmosferycznym substancje o działaniu mutagennym i rakotwórczym
wskazują na konieczność uzupełnienia rutynowych badań jakości powietrza atmosferycz-
nego o monitoring działania biologicznego. Biorąc pod uwagę fakt, że dorosły człowiek
wdycha codziennie od 12 do 15 m
3
powietrza badania aktywności genotoksycznej prób
pyłowych zanieczyszczeń powietrza mogą stanowić podstawę do szacowania ryzyka za-
chorowalności na choroby nowotworowe oraz do wprowadzenia działań profilaktycznych.
Uniwersalność DNA jako materiału genetycznego różnych organizmów pozwala na bada-
nie mutagenności powietrza dzięki zastosowaniu różnych systemów badawczych: bakterii,
drożdży, owadów, zwierząt doświadczalnych i kultur komórek ssaków oraz ekstrapolowa-
nie ich na organizm człowieka.
Badanie mutagenności prób powietrza przy pomocy testu Salmonella
Testem bakteryjnym o najszerszym zastosowaniu, odznaczającym się znaczną czułością,
jest test Salmonella opracowany przez Amesa i współpracowników. Test Salmonella
oparty jest na wykorzystaniu zdolności bakterii do rewersji mutacji, pod wpływem czynni-
ków wywołujących mutację powrotną. Histydyno-zależne auksotroficzne mutanty bakterii
Salmonella typhimurium ulegają rewersji do form prototroficznych, które posiadają zdol-
ność do wzrostu na podłożu minimalnym, pozbawionym aminokwasu L-histydyny.
W teście można stosować różne szczepy testowe Salmonella typhimurium, które powstały
po wprowadzeniu mutacji do operonu histydyny szczepu wyjściowego LT2. Szczepy S.
typhimurium oprócz mutacji w genach D (hisD3052 - szczepów TA1538 i TA98) oraz G
(hisG46 - i szczepów TA1535 i TA100) operonu histydynowego posiadają dodatkowe
mutacje zwiększające ich wrażliwość. Mutacja rfa powoduje zwiększenie przepuszczalno-
ści ściany komórkowej bakterii i umożliwia penetrację związków chemicznych o dużych
cząstkach (np. B(a)P). Delecja
∆uvrB powoduje zmniejszenie zdolności naprawy uszko-
dzeń DNA poprzez wycinanie, z przyczyn technicznych oprócz genu B wycięto również
dwa gen kodujący syntezę biotyny. Do szczepów TA 98 i TA 100 wprowadzono także
plazmidy pKM101 (czynnik R), który warunkuje mutagenezę zależną od systemu błędnej
naprawy DNA oraz oporność bakterii na ampicylinę. Na bazie tych szczepów skonstru-
owano wiele ich pochodnych wykorzystywanych do bardziej selektywnego wykrywania
określonych typów związków mutagennych.
128
Przemiany metaboliczne związków promutagennych do mutagenów zachodzą przy pomo-
cy występujących u kręgowców enzymów z rodziny cytochromu P-450, które są związane
z retikulum endoplazmatycznym. W związku z tym testy bakteryjne przeprowadza się w
obecności enzymów oksydacyjnych, zawartych w homogenatach tkankowych. Najczęściej
stosuje się homogenaty z wątroby szczurów określane jako frakcja mikrosomalna S9.
Test Salmonella wykazuje znaczną zgodność wyników z innymi testami w badaniu muta-
genności pyłowych zanieczyszczeń atmosfery. Stwierdzono również korelację pomiędzy
stężeniami związków z grupy WWA w powietrzu atmosferycznym a efektem mutagennym
badanym przy pomocy różnych szczepów testowych. Występuje również zależność mię-
dzy wynikami badania mutagenności powietrza testem Salmonella a zachorowalnością
i śmiertelnością szczurów z powodu nowotworów płuc.
Badanie mutagenności prób powietrza z wykorzystaniem szczepu Salmo-
nella typhimurium TM 677
W teście stosuje się szczep Salmonella typhimurium TM 677 niezdolny do wzrostu w
obecności 8-azaguaniny (8-AG). Pod wpływem mutagenów dochodzi do mutacji postępo-
wej w genie transferazy fosforybozylo-ksantynoguaninowej, dzięki czemu szczep staje się
odporny na działanie 8-AG i może rosnąć w obecności tego związku. Próbę uznaje się za
mutagenną, jeśli liczba kolonii rosnących na podłożu z badaną próbą i 8-AG jest staty-
stycznie istotnie wyższa od liczby kolonii mutantów spontanicznych. Pomimo, że wykaza-
no, iż ten test może być przydatny do badania efektu mutagennego pyłów zanieczyszczają-
cych powietrze atmosferyczne nie jest powszechnie stosowany w tym celu.
Badanie mutagenności prób powietrza przy użyciu SOS chromotestu
Test opiera się na indukcji procesu naprawy DNA nazywanego systemem SOS uruchamia-
nym w przypadku błędów w replikacji bakteryjnego DNA. Organizmami testowymi są
komórki bakterii Escherichia coli K12 PQ37, w których połączono gen operatora systemu
SOS (sfi A) z genem kodującym β-galaktozydazę. Dzięki temu do pomiaru genotoksycz-
ności próby wykorzystuje się nie sam system naprawczy, a aktywność enzymatyczną genu,
który równocześnie ulega ekspresji. Badając aktywność fosfatazy alkalicznej – enzymu nie
związanego z naprawą DNA, określa się toksyczność próby. Wadą tego testu jest to, że
wykrywa tylko związki zaburzające proces replikacji.
Badanie mutagenności prób powietrza z zastosowaniem testu umu
Test umu jest odmianą SOS chromotestu, w którym najczęściej stosuje się szczep Salmo-
nella typhimurium TA1535/pSK1002. Podobnie jak w poprzednim teście aktywność β-
galaktozydazy - enzymu nie związanego z systemem SOS, decyduje o toksyczności bada-
nej próby. Czynniki, które mogą uszkodzić DNA, czyli potencjalnie mogą być kanceroge-
nami, włączają w tym teście operon Umu.
129
Badanie mutagenności prób powietrza przy pomocy testu drożdżowego
Drożdże to najczęściej wykorzystywane komórki eukariotyczne w badaniach genotoksycz-
ności substancji chemicznych. W teście drożdżowym stosuje się szczepy Saccharomyces
cerevisiae i Schizosaccharomyces pombe, które w formie niezmutowanej do wzrostu po-
trzebują aminokwasów. Dużą popularnością cieszą się szczepy Saccharomyces cerevisiae
XV185-14C oraz D7. Pierwszy z nich stosuje się do badania mutacji genowych u drożdży,
a drugi umożliwia badanie mitotycznego crossing-over, konwersji genowej i mutacji
punktowych.
Badanie mutagenności prób powietrza z wykorzystaniem roślin
Do oceny mutagennej aktywności zanieczyszczeń atmosfery in situ stosuje się badania
polegające na indukcji mikrojąder w komórkach macierzystych pyłku (wykrywanie aber-
racji w chromosomach mejotycznych) i wykrywaniu mutacji genu odpowiedzialnego za
barwę włosków pręcików trzykrotki Tradescantia paludosa BNL 4430 (wykrywanie so-
matycznych mutacji genowych) oraz powstawanie mutacji letalnych pyłków roślin rosną-
cych na badanym obszarze.
Dwa pierwsze testy mogą być wykonywane również w warunkach in vitro w komorach
hodowlanych, dzięki czemu można ominąć ograniczenia, jakie niesie ze sobą test w wa-
runkach naturalnych związanych z cyklem życiowym trzykrotki (roślina ciepłolubna).
Wyniki badań porównawczych z zastosowaniem testów na trzykrotce i innych testów ro-
ślinnych wykazały, że jest ona idealną rośliną do monitorowania mutagenności zanie-
czyszczeń atmosfery. Testy roślinne mają jednak szereg ograniczeń i prawdopodobnie,
dlatego nie znajdują szerszego zastosowania. Na podstawie ich wyników można z większą
dokładnością wnioskować o wpływie zanieczyszczeń na lokalną florę niż zdrowie ludzkie.
Testy te pozwalają jedynie na ocenę przestrzennego zróżnicowania mutagenności, np. w
zależności od odległości od punktowych źródeł emisji np. wysypisk i spalarni śmieci, par-
kingów, garaży, tuneli samochodowych i dróg, elektrowni jądrowych.
Badanie mutagenności prób powietrza przy pomocy testu SMART
Test SMART pozwala na badanie mutacji somatycznej i rekombinacji na muszkach owo-
cowych Drosophila melanogaster. Objawiają się one deformacjami włosków na skrzy-
dłach. Test ten był wykorzystywany do badania mutagenności WWA i ich nitrowych po-
chodnych oraz ekstraktów prób pyłów zanieczyszczających powietrze atmosferyczne. Jego
zaletą jest to, że przy kosztach porównywalnych do testów bakteryjnych, pozwala oceniać
działanie mutagenne substancji przy użyciu organizmów eukariotycznych, wadą – stosun-
kowo duża ilość badanej próby podawana larwom nienaturalną (w przypadku zanieczysz-
czeń atmosfery) drogą pokarmową. Analiza mikroskopowa zdeformowanych włosków jest
bardzo praco- i czasochłonna. Z tych powodów test ten jest mało rozpowszechniony.
130
Badanie mutagenności prób powietrza przy użyciu testu mikrojądrowego z
wykorzystaniem zwierząt doświadczalnych in vivo
Test mikrojądrowy służy do wykrywania związków klastogennych, czyli takich, które wy-
wołują zmiany strukturalne w chromosomach. Mikrojądra powstają w wyniku uszkodzenia
wrzeciona podziałowego, co prowadzi do wyodrębnienia jednego lub kilku mniejszych
jąder zawierających głównie acentryczne fragmenty chromosomów, a czasem nawet całe
chromosomy. Najłatwiej mikrojądra wykrywane są w erytrocytach - komórkach nie posia-
dających jądra głównego. Ekstrakty powietrza atmosferycznego powodowały wzrost czę-
stości mikrojąder w szpiku kostnym myszy BALB/c in vivo. Metoda ta nie ma jednak szer-
szego zastosowania w rutynowym biomonitoringu.
Badanie mutagenności prób powietrza przy pomocy testu mikrojądrowego w
limfocytach krwi obwodowej in vitro
Test mikrojądrowy w hodowanych limfocytach krwi obwodowej człowieka przeprowa-
dzono do tej pory tylko dla ekstraktów spalin z silników wysokoprężnych. Wyniki badań
pozwoliły na stwierdzenie, iż ekstrakty z silników wysokoprężnych o małej mocy częściej
wywoływały aneupoloidalność, czyli utratę całego chromosomu, niż ich złamania.
Badanie mutagenności prób powietrza przy pomocy testu na aneuploidal-
ność
Do wykonania testu wykorzystywano komórki V79 - fibroblasty płuc chomika chińskiego.
Statystycznie istotny wzrost komórek aneuploidalnych zawierających 24-33 chromosomy
zaobserwowano dla frakcji zawierającej monofenole, natomiast ekstrakt całkowity indu-
kował wzrost liczby komórek poliploidalnych posiadających powyżej 33 chromosomów.
Badanie mutagenności prób powietrza przy pomocy testu SCE
W teście wymiany chromatyd siostrzanych (sister chromatid exchange (SCE)) obserwuje
się wzajemne, symetryczne wymiany fragmentów pomiędzy identycznymi sekwencjami
DNA obu chromatyd w chromosomie. Zastosowanie do hodowli bromodezoksyurydyny
(BrdU) wbudowującej się zamiast tymidyny do nowosyntetyzowanej nici DNA oraz prze-
prowadzenie odpowiedniego barwienia umożliwia obserwowanie SCE pod mikroskopem.
Do wykonania testu wykorzystuje się linie komórkowe pochodzące najczęściej
z różnych części układu oddechowego ssaków i człowieka oraz świeże limfocyty krwi ob-
wodowej, a jeszcze rzadziej spotyka się prace z zastosowaniem roślin (bobu Vicia faba) i
komórek jajowych chomika chińskiego (CHO). Komórki nabłonka tchawicy lub oskrzeli
uznane zostały za najlepszą tkankę do stosowania w teście SCE jako miejsce docelowe
powstawania raka przy inhalacyjnym wchłanianiu zanieczyszczeń gazowych i pyłowych.
Za najlepsze do testowania zanieczyszczeń powietrza uznano kultury ludzkich linii komór-
kowych z nabłonka oskrzelowego (BEAS-2B).
131
Badanie mutagenności prób powietrza przy pomocy testu na aberracje
chromosomowe
Aberracje chromosomowe są wynikiem uszkodzeń DNA, które prowadzą do przerw w
podwójnych niciach DNA i obejmują co najmniej jedno złamanie podwójnej nici. Czynni-
ki genotoksyczne indukują aberracje tylko wtedy gdy w komórce następuje replikacja
DNA. Do wykonania testu stosuje się najczęściej komórki jajowe chomika chińskiego
(CHO), limfocyty krwi obwodowej człowieka oraz fibroblasty płuc chomika (komórki
V79). Po wybarwieniu preparatów obserwuje się chromosomy w pierwszym podziale me-
tafazowym. Aberracje są klasyfikowane na ogół jako chromatydowe – obejmujące jedną
chromatydę i chromosomowe – obejmujące obydwie chromatydy. W innym systemie
translokacje chromosomowe są dzielone na trwałe (np. translokacje) i nietrwałe (np. di-
centryki), w zależności od tego czy mogą utrzymywać się przez kolejny cykl komórkowy.
Test na aberracje nie jest często stosowany w badaniach mutagenności powietrza.
Badanie mutagenności prób powietrza z wykorzystaniem testu na HPRT i TK
Metoda polega na hodowaniu komórek w podłożach selekcjonujących, zawierających
czynnik działający toksycznie na wszystkie komórki nie będące mutantami. W tych wa-
runkach tylko zmutowane komórki przeżywają i tworzą kolonie. Zasada metody polega na
tym, że efekt genetyczny jest następstwem mutacji w specyficznym locus genu. Dwa naj-
częściej wykorzystywane geny to gen kodujący enzym fosforybozylo-transferazę hipok-
santyny (hypoksantine quanine phosphoribosyl-transpherase – HPRT) oraz kodujący kina-
zę tymidynową (TK). HPRT jest jednym z enzymów “ratujących”, którego funkcją jest
ochrona produktów syntezy kwasów nukleinowych przed degradacją. Podstawę selekcji
mutantów stanowi dodanie do podłoża analogów puryn (6-tioguaniny, 8-azoguaniny), któ-
re nie są wbudowywane do DNA mutantów. TK umożliwia wbudowywanie tymidyny i jej
toksycznych analogów ze źródeł egzogennych do komórki. Selekcję mutantów homo- i
heterozygotycznych umożliwia dodanie 5-bromodezoksyurydyny lub trójfluorotymidyny.
Do badań substancji chemicznych in vitro najczęściej stosuje się trzy linie komórek ssa-
ków: V79, CHO i chłoniaka myszy L 41784 lub L 55178Y TK
+
/TK
-
.
Produkty reakcji atmosferycznych naftalenu i fenantrenu należących do niegenotoksycz-
nych WWA poddano ocenie z wykorzystaniem ludzkich komórek linii
B-limfoblastoidalnych MCL-5, o podwyższonej ekspresji genów P450 i hydrolazy epoksy-
dowej. Nitrowe pochodne tych związków miały większy potencjał mutagenny od związ-
ków macierzystych, indukując większą częstość mutacji TK, natomiast wzrost HPRT nie
był statystycznie istotny.
Badanie mutagenności prób powietrza z zastosowaniem testu na indukowa-
nie adduktów DNA in vitro
W teście hoduje się DNA z grasicy cielęcej z ekstraktem frakcji zanieczyszczeń powietrza
w warunkach tlenowych po dodaniu i bez mieszaniny S9 oraz w warunkach beztlenowych
(w atmosferze azotu), w obecności systemu redukcyjnego zależnego od oksydazy ksanty-
nowej (XO). Do oznaczenia adduktów DNA i ich ilości wykorzystuje się techniki chro-
matograficzne: chromatografię cienkowarstwową (TLC), autoradiografię, radiografię oraz
analizę adduktów metodą
32
P-postlabellingową przy pomocy HPLC lub GC-MS. Zaobser-
wowano addukty następujących związków: 9-hydroksybenzo(a)pirenu, benzo(a)piren-r-
7, t-8dihydrodiol-t-9,10epoksydu(
±), benzo(b,j,k)fluorantenów, chryzenu,
benz(a) antrace-

132
nu i indeno(cd)pirenu. 1-nitropiren, 9-nitroantracen i 3-nitrofluorantenu wykrywano przy
użyciu GC-MS w słabo polarnej frakcji.
Testy wykorzystywane do badania mutagenności prób wody
Do wstępnej oceny zanieczyszczenia wody związkami mutagennymi i rakotwórczymi naj-
częściej stosowane w praktyce są szybkie testy bakteryjne. Wynika to z faktu, iż w wyniku
obserwacji zmian w genomie komórek prokariotycznych można wykazać większość indu-
kowanych związkami chemicznymi uszkodzeń DNA. Te proste i w miarę tanie systemy
wykazują znaczną korelację z badaniami na zwierzętach.
Najczęściej stosowanym w badaniach wody jest test Salmonella. Został on wprowadzony
bardzo szeroko w połowie lat siedemdziesiątych, stąd testem tym przebadano największą
pulę związków chemicznych. Test ten proponowany jest w Standard Methods for Exami-
nation of Water and Wastwater US EPA do oceny jakości zdrowotnej wody do picia.
Innym testem bakteryjnym stosowanymi do oceny właściwości mutagennych wody jest
SOS chromotest. Ponadto wykorzystuje się testy z użyciem komórek eukariotycznych:
testu drożdżowego, wymiany chromatyd siostrzanych (SCE), aberracji chromoso-
mów(CA), oraz test mikrojądrowy. Testy te wykonywane są bezpośrednio na zwierzętach
(ssakach) lub na różnych typach izolowanych i hodowanych komórek takich jak szpik
kostny, komórki nabłonkowe, komórki płciowe, limfocyty krwi obwodowej, fibroblasty i
linie komórkowe CHO, V79, L5178Y itd.
Przeprowadzone przez Pracownię Mutagenezy Środowiskowej Instytutu Medycyny Pracy i
Zdrowia Środowiskowego w Sosnowcu w bardzo szerokim zakresie, na terenie woje-
wództwa katowickiego, badania mutagenności prób powietrza z użyciem szczepów pod-
stawowych TA98 i 100 oraz pochodnych YG.... – największe badania tego typu na świe-
cie, umożliwiły opracowanie systemu monitorowania jakości powietrza atmosferycznego
w odniesieniu do substancji rakotwórczych i teratogennych. W przypadku pozytywnej od-
powiedzi w teście bakteryjnym, proponuje się badanie aktywności genotoksycznej prób
przy pomocy testu SCE. Spośród różnych komórek używanych w teście SCE polecamy
stosowanie komórek płuc chomika V79 lub ludzkich linii komórkowych z nabłonka
oskrzelowego (BEAS-2B), jako tkanki docelowej przy narażeniu na pyłowe zanieczysz-
czenia powietrza.
Poniżej przestawiono propozycję systemu monitorowania zanieczyszczeń pyłowych po-
wietrza atmosferycznego.
133
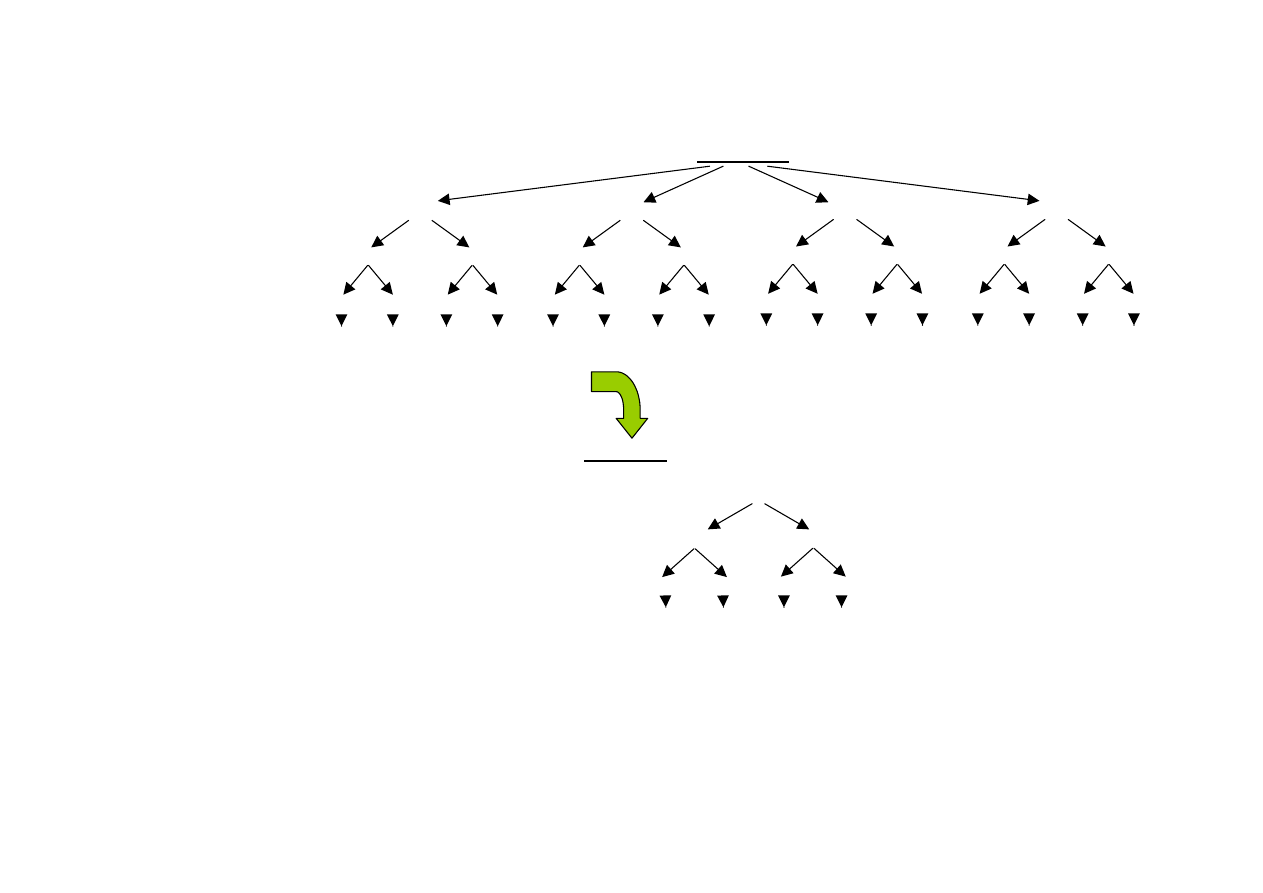
Algorytm skriningu efektu mutagennego pyłowych zanieczyszczeń powietrza w sezonie
zimowym
Test Amesa
badanie I
TA 98
TA 100
bez S9
z S9
bez S9
z S9
aktywność mutagenna <2 ≥2 <2 ≥2 <2 ≥2 <2 ≥2
ocena próby
–
+
–
+
–
+
–
+
badanie przy po-
mocy szczepów
YG1026, YG1029
i YG1042
badanie II
YG 1021
YG 1024
YG 1041
bez S9
z S9
bez S9
z S9
bez S9
z S9
aktywność mu-
tagenna
<2
≥2
<2
≥2
<2
≥2
<2
≥2
<4
≥4
<4
≥4
ocena próby
–
+
–
+
–
+
–
+
–
+
–
+
Co najmniej jeden wynik dodatni dla szczepów YG upoważnia do przeprowadzenia
Testu SCE
komórki
V79
bez S9
z S9
aktywność genotoksyczna
<2
≥2
<2
≥2
ocena próby
–
+
–
+
134
Algorytm skriningu efektu mutagennego pyłowych zanieczyszczeń powietrza w sezonie letnim
Test Amesa
TA 98
YG 1021
YG 1024
YG 1041
bez S9
z S9
–S9
z S9
bez S9
z S9
bez S9
z S9
aktywność mutagenna
<1
≥1
<1
≥1
<2
≥2
<2
≥2
<2
≥2
<2
≥2
<2
≥2
<2
≥2
ocena próby
–
+
–
+
–
+
–
+
–
+
–
+
–
+
–
+
Co najmniej jeden wynik dodatni upoważnia do przeprowadzenia
Testu SCE
komórki
V79
bez S9
z S9
aktywność genotoksyczna
<2
≥2
<2
≥2
ocena próby
–
+
–
+
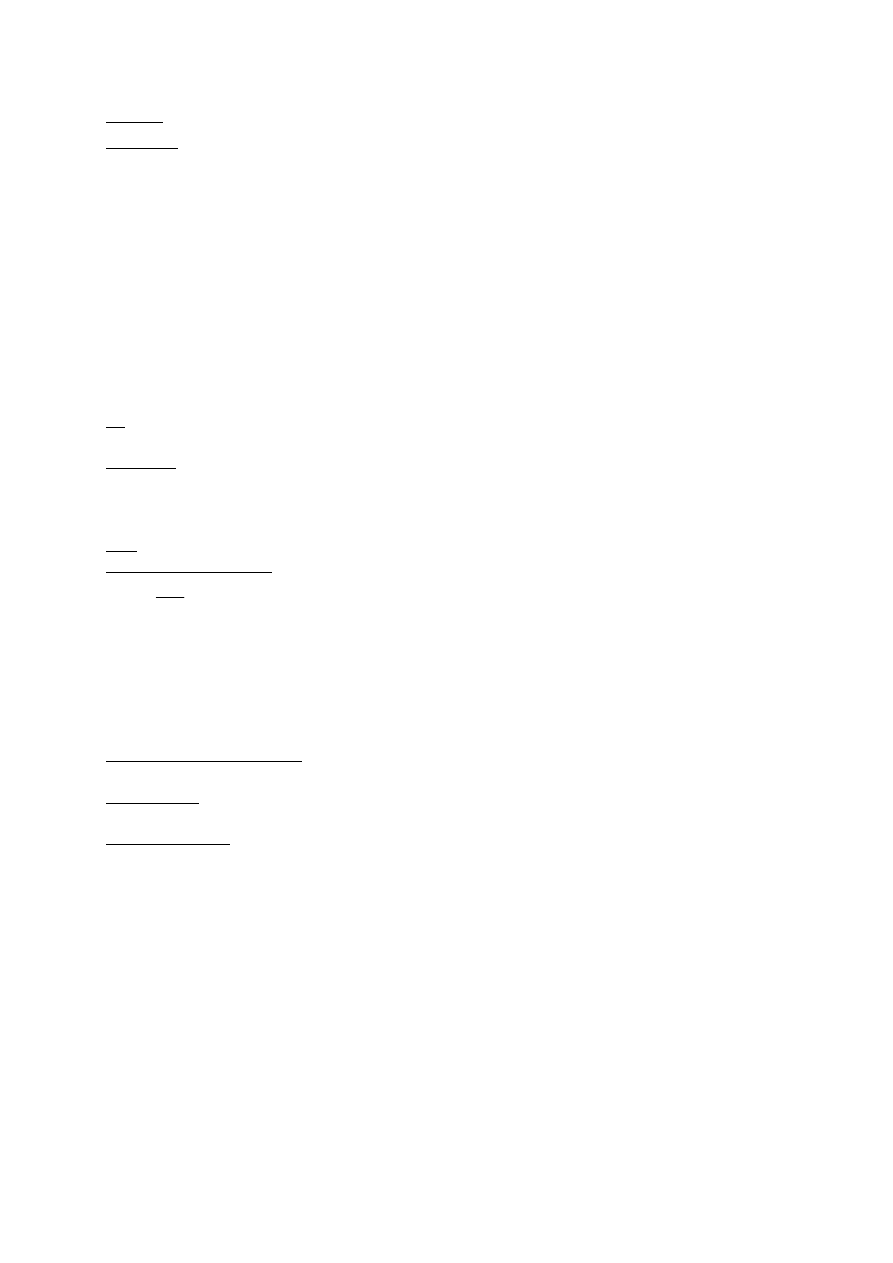
135
Legenda:
Test Amesa – test bakteryjny wykorzystujący zdolność histydyno-zależnych mutantów Salmonella typhimurium
do rewersji mutacji pod wpływem czynników wywołujących mutację powrotną, która przejawia się wzrostem na
podłożu minimalnym, pozbawionym aminokwasu L-histydyny.
Szczepy
testowe
Opis szczepów i plazmidów niosących zwielokrotnione kopie enzymów biorących udział w
metabolizmie nitroarenów i amin aromatycznych (w nawiasach)
TA98
wykrywa mutageny zmiany fazy odczytu
YG1021
TA98 (pYG216): nadprodukcja nitroreduktazy
YG1024
TA98 (pYG219): nadprodukcja O-acetylotransferazy
YG1041
TA98 (pYG233): nadprodukcja nitroreduktazy i O-acetylotransferazy
TA100
wykrywa mutageny podstawienia pary zasad
YG1026
TA100 (pYG216): nadprodukcja nitroreduktazy
YG1029
TA100 (pYG219): nadprodukcja O-acetylotransferazy
YG1042
TA100 (pYG233): nadprodukcja nitroreduktazy i O-acetylotransferazy
S9 – mieszanina enzymatyczna zawierająca homogenat z wątroby szczura określany jako
frakcja mikrosomalna S9,
Test SCE – test wykonywany przy użyciu komórek ssaków: limfocytów lub fibroblastów, w
którym można stwierdzić czy dochodzi do uszkodzeń DNA polegających na złamaniach i
ponownych łączeniach fragmentów chromatyd w chromosomie dzięki zastosowaniu bromo-
dezoksyurydyny (analog tymidyny).
V79 - fibroblasty płuc chomika.
Aktywność mutagenna – względna miara efektu mutagennego
AM =
NR
KR
NR – netto rewertanty - różnica pomiędzy liczbą rewertantów indukowanych przez ekstrakt
próby, obliczona z krzywej dawka-odpowiedź dla 1m
3
powietrza, a liczbą rewertantów w
odpowiedniej kontroli negatywnej,
KR - liczba rewertantów w odpowiedniej kontroli negatywnej.
Próbę uznaje się za mutagenną w zależności od przyjętej wartości granicznej 1, 2 lub 4.
Aktywność genotoksyczna – względna miara efektu genotoksycznego, obliczana zgodnie ze
wzorem na AM, próbę uznaje się za genotoksyczną, jeśli wynik jest równy lub wyższy od 2.
Ocena próby – wynik ujemny (niższy) lub dodatni (równy lub wyższy) od granicznej wartości
aktywności mutagennej i genotoksycznej badanej próby.
Ocena końcowa: próba mutagenna w odniesieniu do organizmów bakteryjnych i genotok-
syczna dla komórek ssaków – stanowi zagrożenie dla zdrowia i życia ludzi.
Na podstawie danych literaturowych sformułowano założenia teoretyczne, które w przybliżo-
nym zakresie pozwalają na zidentyfikowanie substancji odpowiedzialnych za efekt mutagen-
ny na przykładzie badań prób pyłowych zanieczyszczeń powietrza przeprowadzonych przy
pomocy szczepu TA98 i jego pochodnych YG:
1. większe wartości AM po zastosowaniu aktywacji metabolicznej w porównaniu z warian-
tem bez mieszaniny S9 sugeruje występowanie w próbach powietrza związków mutagen-
nych typu wielopierścieniowych węglowodorów aromatycznych,
2. większe wartości AM dla szczepów YG1021, YG1024 i YG1041 niż dla TA98 w warian-
cie bez aktywacji metabolicznej przemawiają za obecnością nitroarenów,
3. o występowaniu w ekstraktach nitroarenów świadczą również dużo niższe odpowiedzi ze
strony szczepów YG1021, YG1024 i YG1041 po zastosowaniu S9,
136
4. podwyższenie wartości AM dla szczepu YG1021+S9 może wskazywać na obecność ni-
troarenów, które wymagają zastosowania aktywacji metabolicznej, np. 6-
nitrobenzo(a)piren,
5. wyższe wartości AM dla szczepów YG1024 i YG1041 po dodaniu S9 w porównaniu
z wartościami AM dla szczepu TA98+S9 świadczą o obecności amin aromatycznych i
hydroksyloamin,
6.
potwierdzenie obecności amin aromatycznych i hydroksyloamin dają również większe
wartości AM dla szczepów YG1024 i YG1041 w wariancie z mieszaniną S9 w porówna-
niu do wariantu bez mieszaniny.
W odniesieniu do wody do picia, Zakład Biologii i Ekologii Instytutu Inżynierii Środowiska,
Politechniki Wrocławskiej zaproponował następujący system badania efektu mutagennego.
Algorytm skriningu efektu mutagennego wody do picia
Test Amesa
TA 98
TA 100
bez S9
z S9
bez S9
z S9
aktywność mutagenna <2 ≥2 <2 ≥2 <2 ≥2 <2 ≥2
ocena próby
–
+
–
+
–
+
–
+
Ocena próby – wynik ujemny (niższy) lub dodatni (równy lub wyższy) od granicznej wartości
(2) aktywności mutagennej badanej próby.
Ocena końcowa: próba mutagenna w odniesieniu do organizmów bakteryjnych - stanowi za-
grożenie dla zdrowia konsumentów w rezultacie picia wody.
Poniżej podano założenia teoretyczne, które w przybliżonym zakresie pozwalają na zidentyfi-
kowanie substancji odpowiedzialnych za efekt mutagenny na podstawie badań prób wody
przeprowadzonych przy pomocy szczepów TA98 i TA100:
1. Jeżeli wartości AM są wyższe po dodaniu S9 dowodzi to obecności w wodzie związków
o charakterze promutagenów, w tym wielopierścieniowych węglowodorów aromatycz-
nych.
2. Jeżeli wartości AM są wyższe w wariancie bez aktywacji enzymatycznej, to najprawdo-
podobniej za efekt mutagenny badanej wody odpowiedzialne są nielotne produkty ubocz-
ne procesu dezynfekcji.
3. Jeżeli wartości AM
≥2 w obu wariantach to woda zawiera zanieczyszczenia o charakterze
mutagenów działających bezpośrednio i pośrednio.
Równolegle z testem Salmonella proponuje się monitorowanie w powietrzu i wodzie związ-
ków chemicznych o właściwościach rakotwórczych lub teratogennych, które nie wykazują
efektu genotoksycznego w testach bakteryjnych: arsenu, chromu, kadmu (tylko w próbach
powietrza), niklu, ołowiu i benzenu.
W miarę potrzeb, do kolejnych etapów monitoringu można będzie włączyć chemiczne pomia-
ry innych związków rakotwórczych i teratogennych po ich identyfikacji i wykryciu źródła
emisji.
Wyszukiwarka
Podobne podstrony:
instrukcja cw 1, II rok, II semestr, Chemia wody i powietrza
kwicińska,CHEMIA WODY I POWIETRZA,OZNACZENIE TLENU W WODZIE
kwicińska,CHEMIA WODY I POWIETRZA,OZNACZANIE CHLORKÓW I SIARCZANÓW
kwicińska,CHEMIA WODY I POWIETRZA,ODCZYN
Chemia wody i powietrza sprawozdanie 2
kwicińska,CHEMIA WODY I POWIETRZA,OZNACZENIE DWUTLENKU SIARKI W POWIETRZU ATMOSFERYCZNYM
trusek hołownia, procesy membranowe,?DANIE CZYSTOŚCI MIKROBIOLOGICZNEJ WODY PITNEJ I POWIETRZAx
kwicińska,CHEMIA WODY I POWIETRZA,TWARDOŚĆ WODY
chromatografia analiza jakościowa, II rok, II semestr, Chemia wody i powietrza
FLOTACJA CIŚNIENIOWA ROZPUSZCZONYM POWIETRZEM, Technologia Wody i Ścieków
Chemia powietrza harmonogram, II rok, II semestr, Chemia wody i powietrza
chromatografia analiza ilościowa, II rok, II semestr, Chemia wody i powietrza
Badanie czystości wody i powietrza, Mikrobiologia
Air Com Zawartosc wody w powietrzu
Chemiczna Analiza ZanieczyszczeńĆW wody, powietrza i gleby
instrukcja cw 2, II rok, II semestr, Chemia wody i powietrza
więcej podobnych podstron