Egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor P
. Sagnowski i Wspólnicy spółka jawna, Kraków 201
1
Z
K
am
or
1
MODEL
ODPOWIEDZI I SCHEMA
T PUNKT
OW
ANIA
Poziom r
ozszerzony
Zadanie
Odpowiedzi
Uwagi
Punktacja
za czynność
za
zadanie
1
–
za prawidłowe uzupełnienie schematu
: 12
6
C
1.1
1
2
– za napisanie skróconej konfiguracji elektronowej: [He] 2s
2
2p
2
lub
[He] 2s
2
p
2
1.2
1
2
– za napisanie równania reakcji: CO
2
+ 2NaOH → Na
2
CO
3
+ H
2
O
lub
CO
2
+ NaOH → NaHCO
3
2.1
1
1
3
– za poprawne uzupełnienie kolumny
tabeli:
Pierwiastek
X
Y
Z
Liczba elektronów walencyjnych
2
6
3
Liczba powłok elektronowych
5
4
3
Wzór sumaryczny tlenku, w którym pierwiastek osiąga
najwyższy stopień utlenienia
SrO
CrO
3
Al
2
O
3
3.1
3 x 1
3
Egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor P
. Sagnowski i Wspólnicy spółka jawna, Kraków 201
1
Z
K
am
or
2
4
– za poprawne uzupełnienie wierszy tabeli:
W
arunek
Nazwy substancji
Mają wiązania kowalencyjne (atomowe)
azot, grafit
Mają wiązania kowalencyjne spolaryzowane
(atomowe spolaryzowane)
amoniak
Mają budowę jonową
br
omek sodu
Mogą przewodzić prąd elektryczny w stanie stałym
miedź, grafit
Dobrze rozpuszczają się w wodzie
amoniak,
br
omek
sodu
4.1
5 wierszy – 3 pkt 3–
4
w
ie
rs
ze
–
2
p
kt
2 wiersze – 1 pkt 0–
1
w
ie
rs
z –
0
p
kt
3
5
a) za uzupełnienie opisu doświadczenia:
I. Na
2
[Zn(OH)
4
]
II.
ZnCl
2
5.1
1
3
b) za poprawne uzupełnienie zdań:
Doświadczenie I –
Tlenek cynku zachowuje się jak
tlenek
kwasowy
.
Doświadczenie II –
Tlenek cynku zachowuje się
jak
tlenek
zasadowy
.
5.2
1
c)
ZnO + 2OH
–
+ H
2
O → [Zn(OH)
4
]
2–
5.3
1
6
a) za wybór odczynnika:
woda utleniona (H
2
O
2
)
6.1
1
2
b) za podanie obserwacji:
Zielonkawy osad Fe(OH)
2
zmienia barwę na brunatną.
lub inne prawidłowe określenie
barw osadów
6.2
1
7
a) za napisanie równania reakcji:
2HgO → 2Hg + O
2
lub
HgO → Hg + ½O
2
7.1
1
3
b) – za metodę
– za obliczenia i
wynik z jednostką:
0,103 dm
3
np.: m
tlenu
= 2 g – 1,853 g = 0,147 g
32 g — 22,4 dm
3
0,147 g —
x
x = 0,103 dm
3
lub 217 g HgO — 22,4 dm
3
O
2
2 g HgO —
x dm
3
O
2
x = 0,103 dm
3
lub każda inna poprawna metoda
7.2
1 1
Egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor P
. Sagnowski i Wspólnicy spółka jawna, Kraków 201
1
Z
K
am
or
3
8
– za ocenę podanych zdań:
Zdania
P/F
Zmniejszenie ciśnienia obniża wydajność reakcji.
F
Obniżenie temperatury nie wpływa na wydajność reakcji.
F
Zwiększenie stężenia jodowodoru obniża wydajność reakcji.
P
Użycie katalizatora zwiększa wydajność reakcji.
F
8.1
4 poprawne
odpowiedzi – 2 pkt 2–3 odpowiedzi
– 1 pkt
0–1 odpowiedź
– 0 pkt
2
9
– za podanie wzorów substancji zmieszanych w każdej z probówek: Probówka I
A
–
Na
2
CO
3
B –
HCl
lub odwr
otnie
Probówka II
X –
BaCl
2
Y
–
MgSO
4
lub odwr
otnie
Probówka III
Z –
NH
4
Cl
W
–
NaOH
lub odwr
otnie
9.1
3 x 1
3
10
– za napisanie jonowych równań reakcji:
I.
CO
3
2–
+ 2H
+
→ CO
2
(↑) + H
2
O
II.
Ba
2+
+ SO
4
2–
→ BaSO
4
(↓)
III.
NH
4
+
+ OH
–
→ NH
3
(↑) + H
2
O
należy uznać zapis równań reakcji bez (
↑)
lub (
↓)
10.1
3 x 1
3
11
a) za identyfikację metali:
X –
Na (sód)
Y
–
Ca (wapń)
Z –
Mg (magnez)
11.1
1
2
b) za podanie uzasadnienia:
np. (różna szybkość reakcji z wodą)
wynika z
różnych wielkości pr
omieni
atomowych
lub
różnej siły oddziaływań elektr
onów walencyjnych z jądr
em
atomowym
lub
różnej łatwości
oddawania elektr
onów
.
lub każde inne poprawne uzasadnienie
11.2
1
12
a) za podanie obserwacji:
Roztwór
z oranżem metylowym zabarwił się na czerwono
lub
oranż metylowy
zmienił zabarwienie z pomarańczowego na czerwone.
lub każda inna poprawna odpowiedź
12.1
1
2
b) za uzupełnienie
ciągu przemian:
P
4
P
4
O
10
H
3
PO
4
O
2
H
2
O
odpowiedź P
2
O
5
nie będzie
punktowana
12.2
1
13
– za określenie charakteru jonu i napisanie równania reakcji:
Jon
Teoria Brönstada (kwas, zasada)
Równanie r
eakcji
S
2–
zasada
S
2–
+ H
2
O
⇄
HS
–
+ OH
–
NH
4
+
kwas
NH
4
+
+ H
2
O
⇄
NH
3
+ H
3
O
+
13.1
2 x 1
2
Egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor P
. Sagnowski i Wspólnicy spółka jawna, Kraków 201
1
Z
K
am
or
4
14
– za metodę – za obliczenia i
wynik z jednostką:
T = 30ºC
np.: 18,7 g — 100 g roztworu
⇒
81,3 g wody
18,7 g — 81,3 g wody
x — 100 g
x = 23 g
⇒
T = 30ºC
14.1
1 1
2
15
a) za napisanie sumarycznego równania reakcji:
Cd
0
+ Pb
2+
→ Cd
2+
+ Pb
0
15.1
1
2
b) za obliczenie SEM i podanie wyniku z jednostką:
0,26
V
SEM = (E
k
– E
a
) = –0,14 + 0,40
= 0,26
V
15.2
1
16
– za bilans elektronowy: Cr
2
O
7
2–
+ 14H
+
+ 6e
–
→ 2Cr
3+
+ 7H
2
O
| (x 1)
CH
3
CH
2
OH → CH
3
CHO + 2H
+
+ 2e
–
| (x 3)
należy uznać również zapis:
C
r
e
C
r
x
C
C
e
x
V
I
III
I
I
+
+
−
3
2
2
3
→
→
lub inna poprawna
forma zapisu
16.1
1
2
– za dobranie współczynników stechiometrycznych: Cr
2
O
7
2–
+ 3CH
3
CH
2
OH + 8H
+
→ 2Cr
3+
+ 3CH
3
CHO + 7H
2
O
16.2
1
17
– za metodę – za obliczenia i wynik z jednostką:
α =
1,7·10
–2
lub
α =
1,7%
np
pH
H
K
c
c
H
cz
yl
i
K
H
K
.:
=
⇒
=
=
⋅
=
=
⋅
=
+
−
+
+
−
3
10
10
3
2
0
0
α
α
α
α
33
2
1
7
10
1
7
=
⋅
=
−
,
,
%
α
lub każda inna poprawna metoda
17.1
1 1
2
18
– za metodę – za obliczenia i
wynik z jednostką:
33,3 kJ
np.:
ΔH
x
=
ΔH
0 2
–
ΔH
0 1
= 53,5 – 20 =
33,3 kJ
18.1
1 1
2

Egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor P
. Sagnowski i Wspólnicy spółka jawna, Kraków 201
1
Z
K
am
or
5
19
– za napisanie wzorów izomerów geometrycznych:
Izomer
cis
Izomer
trans
H
3
C
CH
O
H
H
C
═
C
H
3
C
CH
O
H
H
C
═
C
19.1
1
1
20
– za podanie wzoru produktu: CH
3
─
CH
═
CH
─
COOH
20.1
1
1
21
a) za napisanie równania reakcji:
CH
3
─
CH
═
CH
─
CHO + Br
2
→ CH
3
─
CHBr
─
CHBr
─
CHO
21.1
1
3
b) za podanie obserwacji:
Roztwór bromu
odbarwia się
lub
zanika
(pomarańczowe, brunatne)
zabarwienie.
21.2
1
c) za określenie typu reakcji:
addycja lub przyłączanie
21.3
1
22
– za napisanie równania reakcji: NaC
≡
CNa + 2H
2
O → 2NaOH + HC
≡
CH
lub
C
2
Na
2
+ 2H
2
O → 2NaOH + C
2
H
2
22.1
1
1
Egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor P
. Sagnowski i Wspólnicy spółka jawna, Kraków 201
1
Z
K
am
or
6
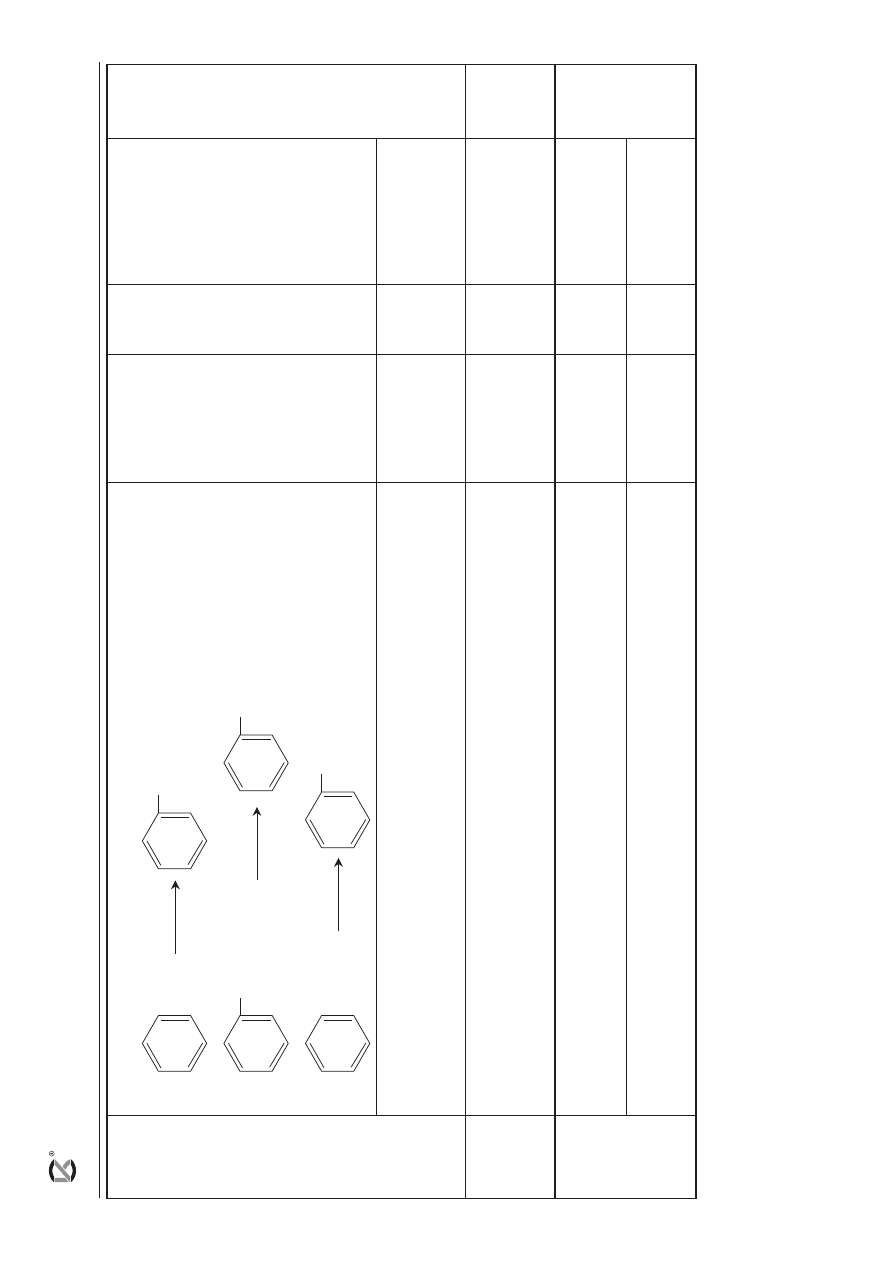
23
a) za napisanie równań reakcji:
Cl
kat.
1
+ Cl
2
+ HCl
OH
Cl
+ NaCl
+ NaOH
(aq)
2
+ HCl
+ CH
3
Cl
CH
3
kat.
3
23.1
3 x 1
4
b) za podanie nazw:
1.
chlor
obenzen
2.
hydr
oksybenzen (fenol, benzenol)
3.
metylobenzen
23.2
1
24
– za podanie obserwacji: I. Białko
ścina się
, powstaje
żółty osad.
II.
Zanika
niebieski galar
etowaty osad
, tworzy się
ceglasty osad.
III.
Zanika
niebieski galar
etowaty osad
, powstaje
klar
owny szafir
owy r
oztwór
.
24.1
3 x 1
3
25
a) za podanie obserwacji:
I. Mydło
rozpuszcza się
, r
oztwór
zabarwia się na malinowo,
powstaje piana.
III. Nie zachodzą żadne zmiany
, r
oztwór
nie zmienia barwy
.
25.1
2 x 1
3
b) za napisanie równania reakcji:
2C
15
H
31
COO
–
+ Ca
2+
→ (C
15
H
31
COO)
2
Ca (↓)
należy uznać zapis równania reakcji bez (
↓)
25.2
1
Egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor P
. Sagnowski i Wspólnicy spółka jawna, Kraków 201
1
Z
K
am
or
7
26
– za uzupełnienie tabeli:
Związek organiczny
Nazwa grupy związków organicznych
nitrometan
nitr
ozwiązki
alanina
aminokwasy
metyloamina
aminy
azotan(V) metylu
estry
należy uznać odpowiedź: związki nitrowe, związki aminowe
26.1
1
1
27
– za napisanie równań reakcji:
CH
3
C
H
COOH + NaOH → CH
3
C
H
COONa + H
2
O
NH
2
NH
2
CH
3
C
H
COOH + HCl → CH
3
C
H
COOH
NH
2
N
H
3
Cl
+
–
lub CH
3
C
H
COOH + HCl → CH
3
C
H
COOH
NH
2
N
H
2
�HCl
lub każdy inny poprawny zapis
27.1
2 x 1
2
Wyszukiwarka
Podobne podstrony:
2011 kwiecien zamkor klucz
2011 kwiecien zamkor
2011 listopad operon klucz
2011 2012 wojewódzki klucz
2011 listopad matma klucz
biologia 2011 pp sierpien klucz
2011 2012 wojewódzki klucz
2010 2011 wojewódzki test+klucz
2011 2012 szkolny klucz
2010 2011 rejon test+klucz
2010 2011 szkolny test+klucz
2011-2012 rejon klucz
2011 01 pisemny klucz
Pazdro kwiecień 2010 klucz
01 2011 cz1 test klucz Adm
Pazdro kwiecień 2012 klucz
2011 2012 szkolny klucz
więcej podobnych podstron