
Przydatność diagnostyczna elektroforezy
W ludzkiej krwi znajduje się kilkaset białek, jednak zaledwie 100 z nich zostało
scharakteryzowanych pod względem strukturalnym oraz czynnościowym. Poziom białka
całkowitego w surowicy krwi waha się w granicach 6,6-8,7 g/dl i może ulegać zmianie w
zależności od stanu zdrowia człowieka. Obok wahań ilościowych białka całkowitego mogą
występować zmiany w proporcjach poszczególnych białek, czyli tzw. dysproteinemia [2].
Elektroforeza białek surowicy (proteinogram) jest podstawowym badaniem laboratoryjnym
umożliwiającym wykrycie dysproteinemii, dając odpowiedzi na często trudne zagadnienia
diagnostyczne.
Proteinogram pozwala zwykle na uzyskanie 6 frakcji białkowych. Wśród nich znajduje się największa
homogenna frakcja albumin oraz pozostałe frakcje reprezentujące globuliny: α-1, α-2, β-1, β-2 oraz γ-
globuliny. Poszczególne frakcje składają się z różnych białek specyficznych o zbliżonym ładunku i
ruchliwości elektroforetycznej, ale o odmiennej budowie i funkcji biologicznej [1, 4].
Tab. 1. Prawidłowy udział frakcji białkowych w rozdziale elektroforetycznym [3]
Stężenia poszczególnych białek we frakcjach mogą ulec zmianie, ale procentowy udział niektórych z
nich jest tak niewielki, że nie wpływa to ani na poziom białka całkowitego, ani na zmianę udziału
odsetka danej frakcji w elektroforezie. Dlatego poniżej zostaną omówione tylko te, które mają
największe znaczenie diagnostyczne.
ALBUMINA
Albumina (35-52 g/l) jest produkowana w wątrobie i stanowi 2/3 białek osocza. Utrzymuje ciśnienie
osmotyczne krwi oraz jest głównym białkiem transportowym, które wiąże nieswoiście związki słabo
rozpuszczalne w wodzie (np. kwasy żółciowe, bilirubinę, miedź, wapń). W rozdziale
elektroforetycznym albumina umiejscawia się najbliżej katody [2, 3].
Obniżenie frakcji albumin może wynikać ze zwiększonej utraty białka z moczem (np. w zespole
nerczycowym) lub z układem pokarmowym (enteropatia wysiękowa). Do hipoalbuminemii dochodzi
również w przewlekłym niedożywieniu, oparzeniach, wstrząsie oraz w ciężkiej niewydolności
wątroby. Ze względu na dużą pulę rezerwową albuminy w wątrobie, hipoalbuminemia występuje w
przypadku znacznego uszkodzenia tego narządu. Synteza albuminy jest hamowana w reakcjach
ostrej fazy, w nowotworach, szpiczaku plazmocytowym, zespole Cushinga i chorobie Gravesa-

Basedowa [2, 5, 6].
Wzrost frakcji albumin wskazuje na ostre odwodnienie i towarzyszy wzrostowi innych białek [2].
Bisalbuminemia: uwarunkowane genetycznie występowanie dwóch odmian albumin. W niektórych
przypadkach może występować przejściowa bisalbuminemia, która wynika ze zdolności albuminy do
wiązania np. kwasów żółciowych w ostrym zapaleniu trzustki, bilirubiny w chorobach wątroby lub
penicyliny w trakcie terapii wysokimi dawkami tego antybiotyku [4,5].
Analbuminemia: bardzo rzadko występujący, dziedziczny brak frakcji albuminowej (ok. 0,5 g/dl).
Pacjenci z analbuminemią mają niskie ciśnienie tętnicze i umiarkowane obrzęki [1, 4].
FRAKCJA α-1-GLOBULIN
Orozomukoid, czyli α-1-kwaśna glikoproteina (0,5-1,5 g/l) jest białkiem ostrej fazy, mającym udział
w agregacji płytek i rozszerzaniu naczyń krwionośnych. α-1-antytrypsyna (0,9-2,0 g/l) stanowi 90%
osoczowych α-1-globulin i jest obecna w wielu tkankach, głównie w płucach, gdzie chroni pęcherzyki
płucne przed działaniem elastazy granulocytowej [2, 3].
Rutynowo wykonywany proteinogram pozwala na uzyskanie 6 frakcji białkowych: albumin
oraz α-1, α-2, β-1, β-2 i γ-globulin.
Źródło: Wikimedia Commons, licencja: CC BY SA 3.0
Zmniejszenie frakcji α-1-globulin związane jest głównie z wrodzonym niedoborem α-1-antytrypsyny,
który prowadzi do rozwoju rozedmy płuc oraz rzadziej chorób wątroby. Zmniejszenie tej frakcji może
być także następstwem niedożywienia lub niewydolności wątroby i zazwyczaj towarzyszy mu spadek
innych frakcji [1, 5, 6].
Wzrost frakcji α-1-globulin najczęściej wynika ze wzrostu białek ostrej fazy, takich jak orozomukoid.
Poziom orozomukoidu wolno wzrasta do 5 dnia odczynu zapalnego, nie przekraczając 3-krotnie
wartości referencyjnej. Największe znaczenie kliniczne przypisuje się temu białku w rozpoznawaniu
infekcji bakteryjnych w okresie noworodkowym. Wzrost stężenia orozomukoidu u noworodków w
zakresie 6-8 g/l jest wskaźnikiem sepsy. Wzrost frakcji α-1-globulin może wynikać również ze
znacznego wzrostu α-fetoproteiny (AFP) w nowotworach i u kobiet w ciąży, a także wynikać z
podwyższenia stężenia α-1-antytrypsyny w chorobie Crohna [1, 3, 5, 6].
FRAKCJA α-2- GLOBULIN
Haptoglobina (30-200 mg/dl) jest białkiem ostrej fazy, odpowiedzialnym za wiązanie i transport
hemoglobiny oraz miedzi. Ceruloplazmina (20-60 mg/dl) odpowiada za 80% właściwości
oksydacyjnych osocza, powodując utlenianie żelaza i umożliwiając jego łączenie z transferryną. α--
-makroglobulina (130-300 mg/dl) stanowi 1/3 białek omawianej frakcji, jej duża masa cząsteczkowa
uniemożliwia przechodzenie tego białka poza łożysko naczyniowe. Tyreoglobulina (9,6-18 mg/l) jest
białkiem odpowiedzialnym za syntezę i magazynowanie hormonów tarczycy [2, 5].
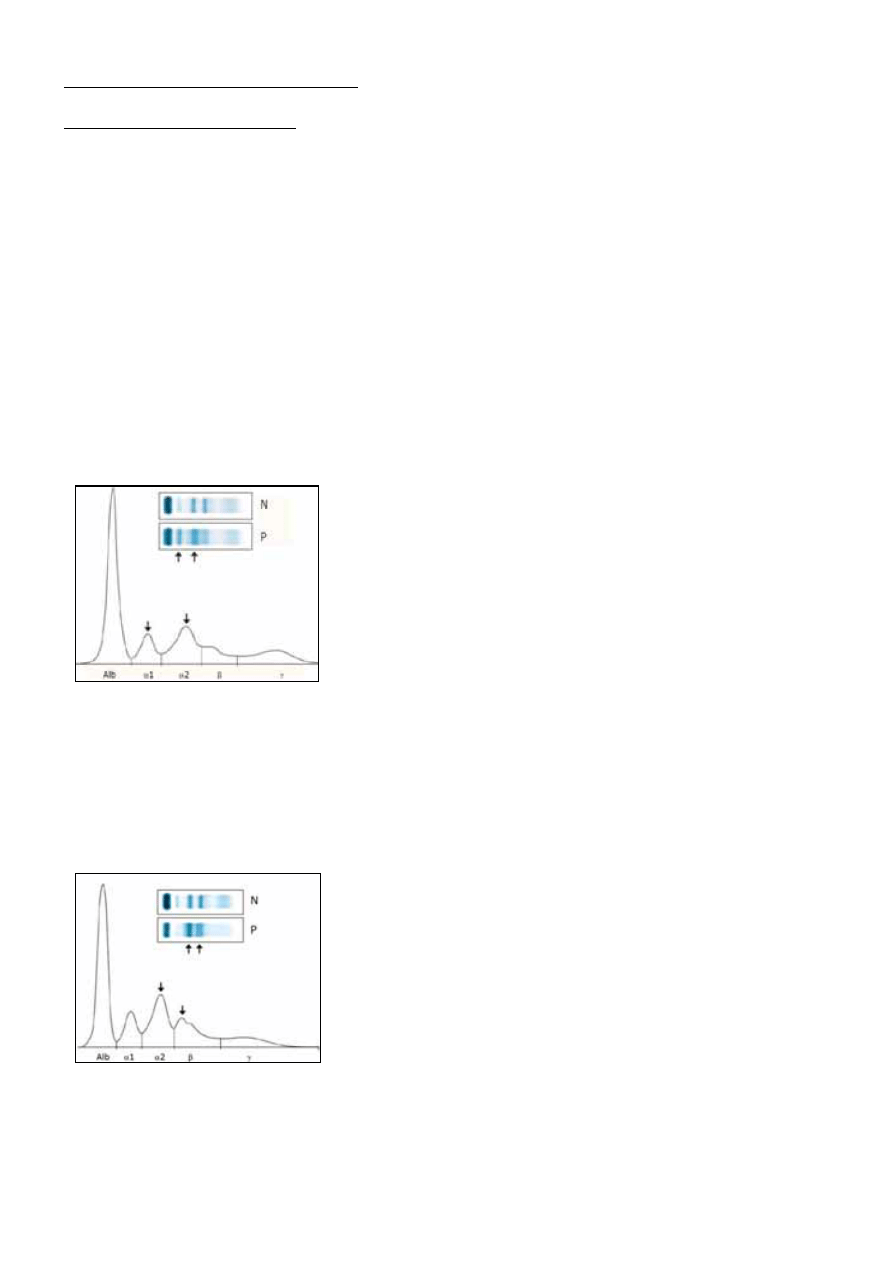
Zmiany w zakresie frakcji α-2-globulin:
Obniżenie frakcji α-2-globulin występuje w przypadku niewydolności wątroby, utraty białka, np. z
moczem, a także w wyniku hemolizy wewnątrznaczyniowej.
Zmniejszenie się stężenia haptoglobiny jest najczulszym i najbardziej swoistym markerem
hemolizy wewnątrznaczyniowej.
Na obniżenie frakcji α-2-globulin może mieć również wpływ niedobór ceruloplazminy w chorobie
Menkesa i Wilsona (poniżej 150 mg/l) [2, 6].
Ze wzrostem frakcji α-2-globulin mamy do czynienia w stanach zapalnych, co wynika z 15% wzrostu
haptoglobiny i ceruloplazminy oraz w zespole nerczycowym, w którym rośnie poziom α--
-makroglobuliny. Wzrost poziomu haptoglobiny może występować również w chłoniaku ziarniczym i
w cholestazie, a także u osób leczonych kortykosterydami, natomiast wzrost tyreoglobuliny w
nadczynności tarczycy [1,2,6].
R
y
c
.
1
.
O
s
tra faza- podwyższenie frakcji
globulin α-1 i α-2. Wzrost tylko
frakcji α-1 można obserwować w
przewlekłym zapaleniu wątroby i w
ostrej fazie, której towarzyszy
hemoliza [4].
R
y
c
.
2
.
Z
espół nerczycowy – obniżenie
albumin i frakcji γ w połączeniu ze
wzrostem α-2-globulin. Obniżenie
stężenia albumin musi być rzędu
1/3 ich prawidłowej wartości, aby

było uwidocznione w elektroforezie
[4].
Frakcja podwójna może być wynikiem użycia surowicy wykazującej ślady hemolizy lub występującej
rzadko nietypowej migracji elektroforetycznej apolipoproteiny B [1,4].
FRAKCJA β-GLOBULIN
Frakcja β-1-globulin składa się głównie z transferyny (200-400 mg/dl), która transportuje żelazo do
szpiku kostnego. W skład β-2-globulin wchodzą β-lipoproteiny, β-2-mikroglobulina, IgA, IgM,
czasem IgG oraz białka dopełniacza, z których składnik C3 (90-180 mg/dl) ma największy udział
procentowy tej frakcji [2, 3].
Zmiany w zakresie frakcji β-globulin:
Obniżenie frakcji β-globulin następuje w wyniku znacznego obniżenia stężenia transferyny, co ma
miejsce w niedożywieniu, nowotworach oraz reakcjach ostrej fazy. Spadek tej frakcji może wynikać z
obniżenia stężenia C3, co związane jest głównie ze starzeniem się próbki i dezaktywacją dopełniacza,
a także w chorobach autoimmunologicznych, np. toczniu rumieniowatym i reumatoidalnym zapaleniu
stawów [1, 3, 6].
Wzrost frakcji β-globulin występuje w niedoborze żelaza, czego konsekwencją jest wzrost stężenia
transferyny. Wzrost udziału tej frakcji ma miejsce w chorobach wątroby, głównie w marskości. Może
być też wynikiem występowania białka monoklonalnego a także wolnych łańcuchów kappa i lambda
w przebiegu szpiczaka mnogiego. Wzrost stężenia β-2-mikroglobuliny powyżej 35 mg/l jest
negatywnym markerem prognostycznym szpiczaka mnogiego [1, 3, 6].
FRAKCJA γ-GLOBULIN
Jest głównym miejscem lokowania się immunoglobulin.
Zmiany w zakresie frakcji γ-globulin:
Obniżenie frakcji γ-globulin jest stanem fizjologicznym u noworodków. U dorosłych może wynikać z
zaburzeń odporności spowodowanych chemio- i radioterapią, leczeniem immunosupresyjnym oraz
podawaniem kortykoidów. Jest to również objaw charakterystyczny dla szpiczaka produkującego
wolne łańcuchy [1, 4].
R
y
c
.
3
.
H
ipogammaglobulinemia – wyraźny spadek
stężenia γ-globulin [1].
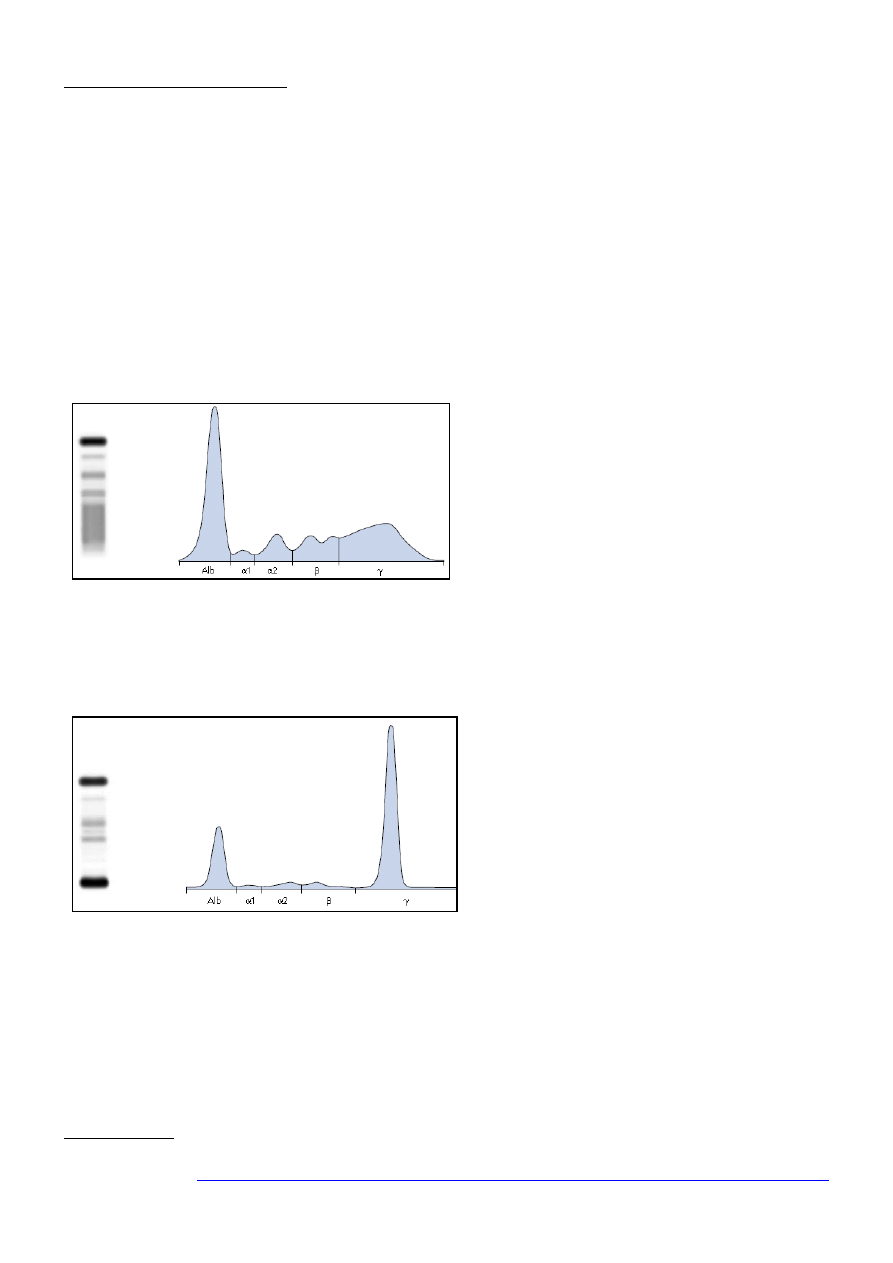
Wzrost frakcji γ-globulin w postaci rozlanego prążka jest typowy dla tzw. gammapatii
poliklonalnych obserwowanych w przebiegu przewlekłego zapalenia, a także chorób
nowotworowych, AIDS i niektórych chorób o podłożu autoimmunologicznym (np. chorobie Crohna).
W niewydolności wątroby występuje gammapatia poliklonalna z charakterystycznym mostkiem
gamma-beta między tymi dwoma strefami.
Ostry, jednorodny szczyt w rejonie γ-globulin, powodujący zniekształcenie strefy beta i gamma,
świadczy o gammapatiach monoklonalnych związanych zazwyczaj z procesem rozrostowym,
takim jak makroglobulinemia Waldenstroma, szpiczak mnogi czy pierwotna amyloidoza. Między
frakcją beta i gamma lokuje się białko C-reaktywne, dlatego w wyniku wybitnego wzrostu tego białka
ostrej fazy może dochodzić do uwidocznienia słabego prążka we frakcji γ-globulin [1, 3, 4].
R
y
c
.
4
.
M
ostek β-γ – obraz zlania frakcji beta i gamma,
charakterystyczny dla marskości wątroby, a także
reumatoidalnego zapalenia stawów i przewlekłych
stanów zapalnych [1].
R
y
c
.
5
.
G
ammapatia monoklonalna – ostry, jednorodny szczyt
w rejonie γ-globulin [1].
Proteinogram białek surowicy dostarcza istotnych informacji o stanie klinicznym pacjenta.
Największe znaczenie przypisuje się analizie rozdziału całościowo, z ewentualnym
uzupełnieniem o oznaczanie ilościowe poszczególnych białek. Szczególnego opracowania
wymaga pojawianie się frakcji białka monoklonalnego oraz obecność białka całkowitego
powyżej 8,6 g/dl.
Piśmiennictwo:
1. Bobilewicz D.
Elektroforeza w praktyce laboratoryjnej. Cz. 1 Rozdział elektroforetyczny białek

. Przegl Med Lab, 2005; 4, 2: 3-6.
2. Bobilewicz D., Jasińska A, Kowalska K. Diagnostyka medyczna. Białka w pytaniach i
odpowiedziach. Warszawa, 2010; Roche Diagnostics.
3. Dembińska-Kieć A., Naskalski W. J. Diagnostyka laboratoryjna z elementami biochemii klinicznej.
Wrocław, 2005; Elsevier Urban & Partner.
4. Giot J-F.
Agarose gel electrophoresis – applications In clinical chemistry.
JMB, 2010; 29:9-14.
Protein electrophoresis in clinical diagnosis
. 2003; Edward Arnold.
6. O’Connell X. T., Horita J. T., Kasravi B.
Understanding and Interpreting Serum Protein
. American Falimy Physician, 2005; 71, 1:105-112.
Wyszukiwarka
Podobne podstrony:
materialy na diagnoze, Wyklad VI diagnoza
Naprawa elektroniki w aucie, Diagnostyka dokumety
Referat wpływ elektrotechniki na rozwój techniki
instrukcja bhp przy eksploatacji urzadzen i instalacji elektroenergetycznych na placu budowy
Wpływ mediów elektronicznych na psychikę i rozwój dziecka”, Media - przemoc
nie ważne jest ustalenie odbiorników I kategorii i dopuszcza, SGSP, SGSP, cz.1, elektroenergetyka, e
Irmina Krakowiak Wiśniowska Instalacje Elektryczne na terenach wiejskich okładka
SPRAWOZDANIE ĆWICZENIE 6 elektronika na 8 05
Elektronika na egzamin
Ochrona przed hałasem, Ucho, Ucho- przetwornik mechano- elektryczny ( na wejściu do ucha en mechanic
Wpływ prądu elektrycznego na organizmy żywe
Praca na diagnostykę, Diagnostyka
Egzamin elektronika na telefon
25 WPŁYW STĘŻENIA MOCMNEGO ELEKTROLITU NA PRZEWODNICTWO
Urządzenia z osłoną olejową Exo, SGSP, SGSP, cz.1, elektroenergetyka, energetyka, elektra na egzamin
elektryka na" 03 10
materialy na diagnoze, R. 1, DIAGNOZA PSYCHOLOGICZNA - ROZDZIAŁ 1 (s
materialy na diagnoze, R. 1, DIAGNOZA PSYCHOLOGICZNA - ROZDZIAŁ 1 (s
więcej podobnych podstron