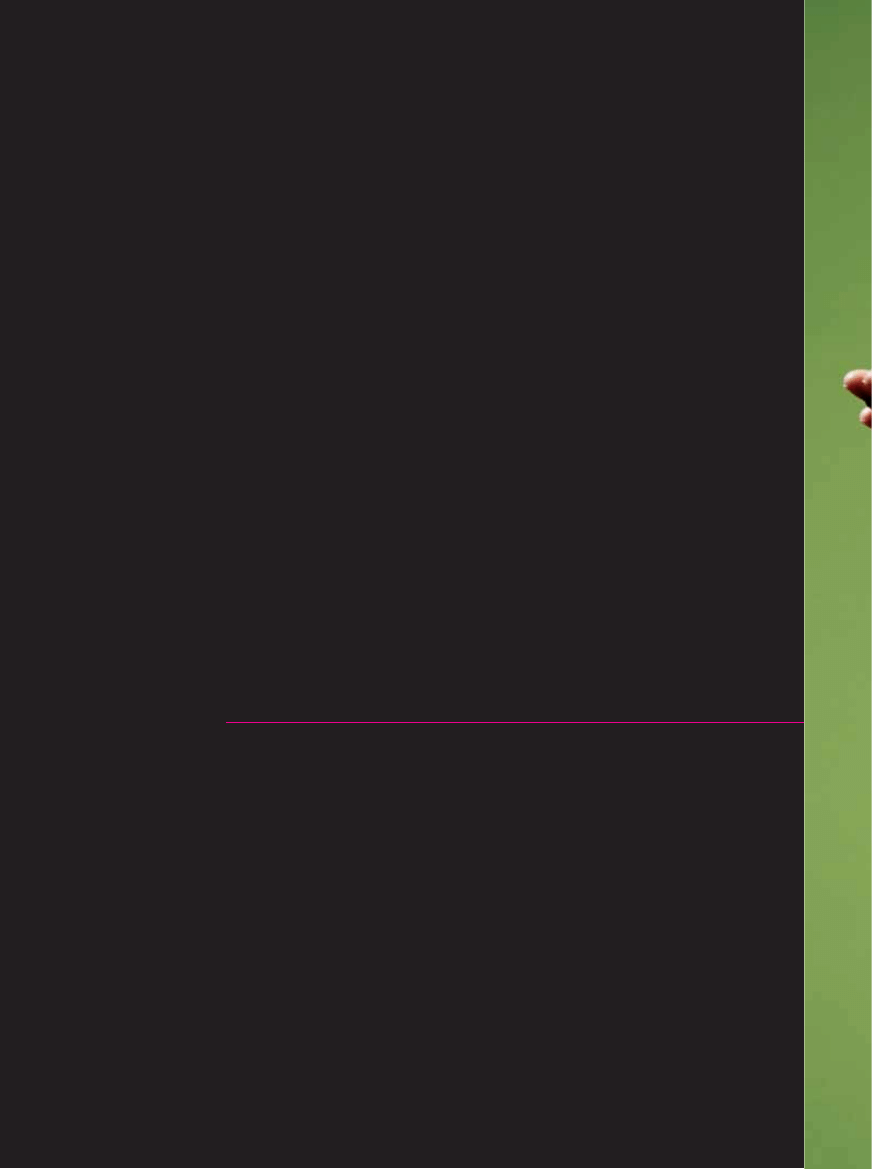
GIL AST
40
ÂWIAT NAUKI MAJ 2005
Geny myszy i ludzi sà a˝ w 88% podobne. Wiele
ró˝nic pomi´dzy nami a gryzoniami wynika
ze sposobu obróbki tej samej informacji genetycznej.
A
l
t
e
r
na
t
y
w
n
y
g
e
n
o
m
Zasada „jeden gen, jedno bia∏ko”
ju˝ nie obowiàzuje. Im bardziej
skomplikowany organizm,
tym bardziej prawdopodobne,
˝e podstawà jego z∏o˝onoÊci
jest zdolnoÊç kodowania wielu
bia∏ek przez pojedyncze geny


dobiega∏y koƒca, biolodzy molekularni
robili zak∏ady, ile˝ to genów on liczy.
Najwy˝sze szacunki si´ga∏y 153 tys. Ar-
gumentowano, ˝e skoro ludzki organizm
wytwarza oko∏o 90 tys. ró˝nych bia∏ek,
to musi je kodowaç co najmniej tyle sa-
mo genów. Ponadto istota tak z∏o˝ona
jak cz∏owiek powinna byç wyposa˝ona
w bogatszy zestaw genów ni˝ sk∏adajà-
cy si´ z zaledwie tysiàca komórek nicieƒ
Caenorhabditis elegans, w którego ge-
nomie jest 19.5 tys. genów, czy te˝ kuku-
rydza, majàca 40 tys. genów.
Dlatego te˝ po og∏oszeniu kilka mie-
si´cy póêniej wst´pnej wersji ludzkiego
genomu wiele osób nie kry∏o zaskocze-
nia. Zespó∏ sekwencjonujàcy wyliczy∏
bowiem, ˝e cz∏owiek ma od 30 tys. do
35 tys. genów kodujàcych bia∏ka. Zdzi-
wienie wzros∏o jeszcze w kolejnych la-
tach, gdy w miar´ ustalania mapy ge-
nomu szacowana liczba genów nadal
mala∏a, a˝ spad∏a poni˝ej 25 tys. Tym-
czasem genetycy zaczynali pojmowaç,
˝e to w∏aÊnie jest oznakà wyrafinowa-
nia – Êwiadczy bowiem, jak wszech-
stronny u˝ytek nasz organizm robi z tak
niewielkiej liczby genów.
Dzi´ki mechanizmowi zwanemu alter-
natywnym sk∏adaniem (alternative spli-
cing) informacj´ zawartà w genach z∏o˝o-
nych organizmów mo˝na przetwarzaç na
ró˝ne sposoby, co pozwala jednemu geno-
wi kodowaç dwa lub wi´cej bia∏ek. Po-
równawcze badania genomu cz∏owieka
i innych istot uÊwiadomi∏y badaczom, w
jak wielkim stopniu alternatywne sk∏ada-
nie odpowiada za zró˝nicowanie organiz-
mów o stosunkowo podobnych zestawach
genów. Ponadto dzi´ki temu mechani-
zmowi ró˝ne tkanki jednego organizmu
mogà wype∏niaç ró˝ne funkcje, wykorzy-
stujàc ten sam ograniczony zbiór genów.
Punkty zwrotne
ZNACZENIE
alternatywnego sk∏adania jest
tym wi´ksze, im bardziej z∏o˝ony jest
organizm – szacuje si´, ˝e procesowi te-
mu podlega nawet trzy czwarte ludz-
kich genów. Co wi´cej, samo jego ist-
nienie najprawdopodobniej odegra∏o
znaczàcà rol´ w powstaniu tej z∏o˝o-
noÊci i dalej kszta∏tuje ewolucj´. Na-
ukowcy zaczynajà te˝ odkrywaç, jak
nieprawid∏owe sk∏adanie prowadzi do
powstawania nowotworów i chorób
wrodzonych i jak mo˝na ten proces wy-
korzystaç w terapii.
Znaczenie alternatywnego sk∏adania
dla prawid∏owego funkcjonowania wie-
lu organizmów jest nie do przecenienia.
Zale˝y od niego na przyk∏ad ˝ycie komó-
rek. Ka˝da z nich nieustannie Êledzi zmia-
ny zarówno w otaczajàcym Êrodowisku,
jak i we w∏asnym wn´trzu i na tej pod-
stawie rozstrzyga, czy rosnàç dalej, czy
dokonaç samozniszczenia w procesie
programowanej Êmierci, zwanym apop-
tozà. To drugie wybiera m.in. wtedy, gdy
nie jest w stanie naprawiç uszkodzeƒ
DNA. Craig B. Thompson z University of
Pennsylvania i jego wspó∏pracownicy nie-
dawno pokazali, ˝e gen zwany Bcl-x, b´-
dàcy regulatorem apoptozy, w wyniku al-
ternatywnego sk∏adania koduje jedno
z dwóch ró˝nych bia∏ek, Bcl-x(L) lub
Bcl-x(S). Pierwsze z nich zapobiega apop-
tozie, a drugie jà aktywuje.
Mo˝liwoÊç produkcji tak ró˝norod-
nych form bia∏ek na podstawie informa-
cji z jednego genu zosta∏a po raz pierw-
szy zaobserwowana 25 lat temu, lecz
uwa˝ano wtedy, ˝e zdarza si´ to rzadko.
Najnowsze badania nad genomem po-
kaza∏y, ˝e jest to zjawisko bardzo cz´ste
i wr´cz niezb´dne. Klasyczne uj´cie prze-
p∏ywu informacji genetycznej od DNA
do bia∏ek wymaga∏o zatem rewizji.
Wi´kszoÊç postulatów podtrzymano.
Pe∏en genom zawiera wszelkie informa-
cje potrzebne do stworzenia i utrzyma-
nia organizmu przy ˝yciu, które sà zapi-
sane w DNA jako ciàg zestawiony z
czterech ró˝nych nukleotydów (opisy-
wanych skrótowo A, C, G i T). Ludzkie
chromosomy z∏o˝one sà w sumie z oko-
∏o 3 mld nukleotydów na ka˝dej z dwóch
komplementarnych nici DNA tworzà-
cych struktur´ podwójnej helisy. Gdy
trzeba odczytaç informacj´ zawartà w
okreÊlonym fragmencie DNA, nici heli-
sy rozchodzà si´ jak zamek b∏yskawicz-
ny na tyle, by umo˝liwiç przekopiowa-
nie (transkrypcj´) sekwencji genu na
postaç jednoniciowego RNA, chemicznie
42
ÂWIAT NAUKI MAJ 2005
BILL STEELE (
popr
zednie str
ony
)
n
Informacja zawarta w genie mo˝e byç przekszta∏cana przez komórk´, uzyskujàc
kilka ró˝nych znaczeƒ. Dzi´ki temu na podstawie niewielkiej liczby genów
mo˝e powstaç o wiele wi´cej bia∏ek.
n
Od dawna by∏o wiadomo, ˝e informacyjny RNA mo˝e byç posk∏adany na kilka
sposobów. Jednak˝e znaczenie i powszechnoÊç tego mechanizmu u organizmów wy˝szych
oraz ró˝norodnoÊç, jakà mo˝na dzi´ki niemu osiàgnàç przy zachowaniu wielkiego
podobieƒstwa genów, doceniono dopiero po poznaniu i porównaniu genomów
ludzi i innych organizmów.
n
Dzi´ki alternatywnemu sk∏adaniu nawet ma∏a liczba genów wystarczy do rozwoju
i prze˝ycia bardzo skomplikowanych organizmów. Mo˝liwa jest tak˝e kontrola czasu
i miejsca produkcji ró˝nych bia∏ek. Byç mo˝e nied∏ugo nauczymy si´ ingerowaç
w proces alternatywnego sk∏adania w celu leczenia chorób.
Przeglàd /
Z∏o˝onoÊç ci´cia i sk∏adania
Gdy wiosnà 2000 roku prace nad zsekwencjonowaniem ludzkiego genomu

spokrewnionego z DNA, nazywanego
transkryptem pierwotnym.
Ka˝dy fragment DNA, który jest w ten
sposób przepisywany na czàsteczk´
RNA, nazywamy genem. Niektóre z po-
wsta∏ych czàsteczek RNA nie kodujà bia-
∏ek, pe∏nià natomiast kluczowe funkcje
regulacyjne w komórce [patrz: W. Wayt
Gibbs „Genomowe klejnoty i Êmieci”;
Âwiat Nauki, grudzieƒ 2003]. Wi´kszoÊç
z nich zaÊ, która koduje bia∏ka, zostanie
odczytana i przet∏umaczona na odpo-
wiadajàce im sekwencje aminokwasów.
Proces ten, zachodzàcy w rybosomach,
nazywamy translacjà. Nastàpi on jed-
nak dopiero po obróbce pierwotnego
transkryptu RNA.
W 1977 roku Phillip A. Sharp z Mas-
sachusetts Institute of Technology oraz
Richard J. Roberts pracujàcy w firmie
New England Biolabs odkryli, ˝e nowo
MAJ 2005 ÂWIAT NAUKI
43
L
UCY READING
-IKKANDA
JEDEN GEN, A WIELE BIA¸EK
Klasyczne rozumienie ekspresji genów by∏o proste: DNA genu jest najpierw przepisywany podczas transkrypcji na czàsteczk´
RNA, nast´pnie maszyneria odpowiedzialna za sk∏adanie RNA wycina „Êmieciowe” odcinki zwane intronami, a w koƒcu ∏àczy
odcinki kodujàce bia∏ko zwane eksonami. W wyniku tych reakcji powstaje ostateczna czàsteczka RNA informacyjnego (mRNA),
która ulega translacji na bia∏ko. Okazuje si´ jednak, ˝e te proste regu∏y nie sà uniwersalne. Pierwotna czàsteczka RNA mo˝e
ulegaç alternatywnemu sk∏adaniu – niektóre eksony mogà byç wycinane, a introny w∏àczane do dojrza∏ego mRNA. Dzi´ki te-
mu z jednego genu powstaje zestaw ró˝nych czàsteczek mRNA, a co za tym idzie, ró˝ne bia∏ka.
KLASYCZNY SCHEMAT EKSPRESJI GENÓW
Sekwencja DNA jest kopiowana
na jednoniciowy RNA. Nast´pnie
maszyneria komórkowa poddaje pierwotny
transkrypt sk∏adaniu. Introny, wyznaczone
przez obecnoÊç konkretnych nukleotydów
na obu kraƒcach, zwanych miejscami
ci´cia 5’ (pi´ç prim) i 3’ (trzy prim),
sà wycinane i niszczone, podczas gdy
eksony zostajà po∏àczone w czàsteczk´
mRNA. Po przet∏umaczeniu jej sekwencji
w procesie translacji powstanie
czàsteczka bia∏ka.
ALTERNATYWNE SK¸ADANIE
Pierwotny transkrypt genu mo˝e zostaç
z∏o˝ony na szereg ró˝nych sposobów,
które przedstawiono po prawej,
gdzie obszary wycinane oznaczone sà
przerywanà linià. Ekson czasem zostaje
omini´ty (a). Mogà byç rozpoznawane
alternatywne miejsca ci´cia 5’ (b)
lub 3’ (c) intronów. Intron mo˝e byç
zachowany w dojrza∏ej czàsteczce mRNA
(d). Wreszcie obecnoÊç dwóch eksonów
w ostatecznym mRNA nieraz wzajemnie
si´ wyklucza (e).
Ekson zawsze zachowany
Ekson podlegajàcy
alternatywnemu sk∏adaniu
Intron
DNA genu
Ekson
Intron
Transkrypcja
Pierwotny transkrypt RNA
Informacyjny RNA
Sk∏adanie
Translacja
Bia∏ko
Wyci´te
introny
KO¡COWY mRNA
a
OMINI¢TY EKSON
b
ALTERNATYWNE MIEJSCA CI¢CIA 5’
c
ALTERNATYWNE MIEJSCA CI¢CIA 3’
d
ZACHOWANY INTRON
e
WZAJEMNIE WYKLUCZAJÑCE SI¢ EKSONY
5’
3’
powstajàce transkrypty RNA sà podob-
ne do ksià˝ek z wieloma nieistotnymi
rozdzia∏ami wstawionymi w ró˝nych
miejscach tekstu. Aby czàsteczka RNA
sta∏a si´ sk∏adnà „opowieÊcià”, te nie-
potrzebne rozdzia∏y, zwane intronami,
trzeba wyciàç, a pozosta∏e – po∏àczyç.
Proces wycinania i ∏àczenia, zwany sk∏a-
daniem (splicing), polega w∏aÊnie na
wyci´ciu intronów z pierwotnego trans-
kryptu. Fragmenty RNA zawierajàce
sekwencje kodujàce bia∏ko, zwane
eksonami, sà nast´pnie ∏àczone. W ten
sposób powstaje ostateczna wersja trans-
kryptu, zwana RNA informacyjnym
(mRNA) [ramka na stronie 43].
W roku 1980 Randolph Wall z Uni-
versity of California w Los Angeles
udowodni∏, ˝e wizja prostego sk∏ada-
nia, w którym wszystkie introny sà wy-
cinane, a wszystkie eksony w∏àczane do
czàsteczki mRNA, nie zawsze jest praw-
dziwa. Okazuje si´, ˝e system komór-
kowy mo˝e zdecydowaç o wyci´ciu
jakiegoÊ eksonu lub pozostawieniu in-
tronu w dojrza∏ej czàsteczce mRNA.
Ta umiej´tnoÊç alternatywnego sk∏ada-
nia czàsteczek pre-mRNA mo˝e w istot-
ny sposób zwi´kszyç wielofunkcyjnoÊç
genu. Dzi´ki temu od przebiegu sk∏a-
dania zale˝y, ile bia∏ka konkretnego
rodzaju powstanie w porównaniu z in-
nymi mo˝liwymi bia∏kami kodowany-
mi przez ten sam gen.
W 1984 roku Tom Maniatis, Michael
Green i ich wspó∏pracownicy z Harvard
University opracowali prostà procedu-
r´ laboratoryjnà s∏u˝àcà do poznania
molekularnej maszynerii wycinajàcej
introny i sklejajàcej ze sobà eksony.
Szczegó∏y jej dzia∏ania i regulacji nie
zosta∏y jeszcze w pe∏ni poznane, ale do-
tychczasowe badania pozwoli∏y ju˝ na-
ukowcom zrozumieç, ˝e jest to wyrafi-
nowany mechanizm o intrygujàcym
pochodzeniu.
No˝yczki i klej
Z
¸O
˝
ONE ORGANIZMY
majà dwa odr´bne
mechanizmy zaanga˝owane w sk∏ada-
nie pierwotnych transkryptów mRNA
(pre-mRNA). Tak zwana maszyneria
podstawowa wyst´pujàca u wszystkich
organizmów, których geny zawierajà in-
trony, jest silnie chroniona ewolucyjnie
i u cz∏owieka wyglàda podobnie jak u
dro˝d˝y. Sk∏ada si´ z pi´ciu typów ma-
∏ych jàdrowych RNA (snRNA), zwanych
U1, U2, U4, U5 i U6. Czàsteczki te mo-
gà si´ ∏àczyç a˝ ze 150 bia∏kami, two-
rzàc kompleks zwany splajsosomem,
który rozpoznaje poczàtki i koƒce intro-
nów, wycina je z czàsteczki pre-mRNA
i ∏àczy eksony w dojrza∏y mRNA.
Cztery krótkie sekwencje nukleotydo-
we s∏u˝à jako znaczniki miejsc, w któ-
rych splajsosom ma przeciàç czàstecz-
k´ RNA [ramka obok]. Jedna z tych
sekwencji znajduje si´ na poczàtku intro-
nu i nazywa si´ miejscem ci´cia 5’ (pi´ç
prim); pozosta∏e znajdujà si´ na koƒcu
intronu i zwane sà miejscem rozga∏´-
zienia, traktem polipirymidynowym i
miejscem ci´cia 3’.
Osobny mechanizm kontroluje kiero-
wanie maszynerii podstawowej do
44
ÂWIAT NAUKI MAJ 2005
L
UCY READING
-IKKANDA
SR
SR
SR
U1
U2
U2
U6 U4
U1 U2
U5
U6 U4
U1 U2
U5
SR
SR
SR
SR
SR
SR
U2
U1
U1
U2
U1
U1
U2
U1
U2
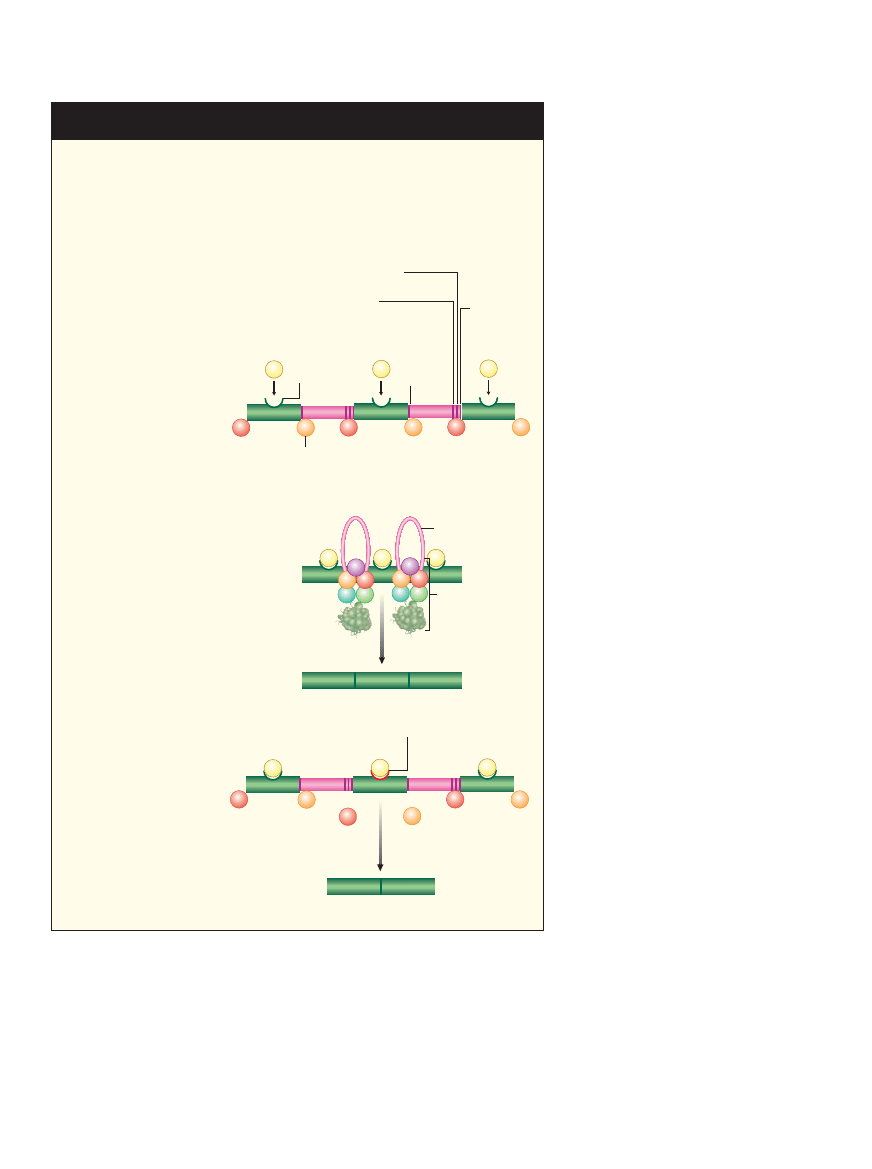
MASZYNERIA SK¸ADAJÑCA
Struktura zwana splajsosomem przeprowadza reakcj´ ci´cia i sk∏adania pierwotnej
czàsteczki RNA przepisanej z sekwencji genu. W organizmach wy˝szych proces ten
kontrolujà bia∏ka regulujàce sk∏adanie (SR), które wyznaczajà po∏o˝enie eksonów
oraz kierujà splajsosom do odpowiednich miejsc ci´cia. Zatem te czàsteczki okreÊla-
jà, gdzie i kiedy ma zajÊç alternatywne sk∏adanie. Ró˝ne formy bia∏ek SR produko-
wane sà w ró˝nych tkankach i typach komórek podczas ró˝nych etapów rozwoju.
WYZNACZENIE EKSONÓW
Bia∏ka SR wià˝à si´ z konkretnà
sekwencjà nukleotydowà zwanà
eksonowym wzmacniaczem
sk∏adania (ESE) w ka˝dym
eksonie pierwotnej czàsteczki
RNA. Przy∏àczenie bia∏ka SR
wyznacza po∏o˝enie eksonu
i pozwala na zwiàzanie si´
ma∏ych jàdrowych RNA (snRNA)
U1 i U2 do miejsc ci´cia
w intronie sàsiadujàcym
z danym ESE.
UFORMOWANIE SPLAJSOSOMU
Gdy pierwsze snRNA po∏àczà si´
z miejscami ci´cia w intronie,
wià˝à si´ z innymi snRNA
oraz z ponad setkà bia∏ek.
Kompleks ten, zwany
splajsosomem, wycina introny
i ∏àczy eksony, dzi´ki czemu
powstaje czàsteczka dojrza∏ego
mRNA.
HAMOWANIE SK¸ADANIA
Bia∏ko SR mo˝e tak˝e utrudniaç
wiàzanie si´ snRNA,
gdy po∏àczy si´ z sekwencjà
zwanà eksonowym
supresorem sk∏adania (ESS).
W ten sposób mo˝e doprowadziç
do wyci´cia eksonu z ostatecznej
czàsteczki mRNA. Pomijanie
eksonów jest najcz´stszà
formà alternatywnego sk∏adania
u ludzi i innych ssaków.
Ciàg pirymidyn
Miejsce rozga∏´zienia
Miejsce
ci´cia 5’
Miejsce
ci´cia 3’
ESE
Ekson
Ekson 1
Ekson 1
Ekson 3
Ekson 2
Ekson 3
Intron
Intron
Bia∏ka
mRNA
mRNA
Wyci´cie
Splajsosom
snRNA
ESS
miejsc ci´cia. Dotychczas wyodr´bnio-
no ju˝ 10 bia∏ek regulatorowych sk∏a-
dania (SR – splicing regulatory), które
mogà przybieraç ró˝ne formy w ró˝nych
tkankach, a nawet na ró˝nych etapach
rozwoju tej samej tkanki. Bia∏ka SR wià-
˝à krótkie sekwencje nukleotydowe w
eksonach pre-mRNA. Sekwencje te zna-
ne sà jako eksonowe wzmacniacze sk∏a-
dania (ESE – exonic splicing enhancers),
poniewa˝ wiàzanie ich przez bia∏ko SR
powoduje doprowadzenie snRNA splaj-
sosomu do miejsc ci´cia na ka˝dym z
koƒców eksonu. Bia∏ko SR mo˝e rów-
nie˝ zwiàzaç si´ z eksonowym supreso-
rem sk∏adania (ESS – exonic splicing
supressor) i uniemo˝liwiç wiàzanie si´
maszynerii podstawowej z koƒcami te-
go eksonu, powodujàc jego wy∏àczenie
z dojrza∏ego mRNA.
Pomini´cie jednego eksonu podczas
sk∏adania mo˝e mieç dramatyczne skut-
ki. Alternatywne sk∏adanie jest na przy-
k∏ad mechanizmem odpowiedzialnym
za determinacj´ p∏ci muszki owocowej.
Przy obróbce transkryptu genu Sex-le-
thal mo˝e nastàpiç pomini´cie eksonu
specyficznego dla osobników m´skich,
co prowadzi do syntezy bia∏ka specy-
ficznego dla samic. Bia∏ko to nast´pnie
wià˝e wszystkie transkrypty pre-mRNA
w∏asnego genu dzi´ki czemu „m´ski”
ekson b´dzie nadal wycinany z mRNA
i produkowane b´dzie tylko bia∏ko wy-
st´pujàce u samic. Je˝eli podczas sk∏a-
dania pierwszego pierwotnego trans-
kryptu Sex-lethal „m´ski” ekson zostanie
zachowany, powstanie niefunkcjonalny
mRNA, na bazie którego nie mo˝na
wyprodukowaç bia∏ka. W efekcie za-
rodek muszki rozwinie si´ w osobnika
m´skiego.
Pomijanie eksonów to najcz´Êciej spo-
tykany u ssaków typ alternatywnego
sk∏adania, ale opisano ju˝ kilka innych,
w tym zachowanie sekwencji introno-
wych w dojrza∏ej czàsteczce mRNA, ty-
powe dla roÊlin i ni˝szych organizmów
wielokomórkowych. Prawdopodobnie
ten typ sk∏adania powsta∏ najwczeÊniej
w ewolucji. Do dziÊ w organizmach jed-
nokomórkowych, takich jak dro˝d˝e,
sk∏adanie mRNA opiera si´ na rozpo-
znaniu sekwencji intronowych. Nato-
miast organizmy wy˝sze majà bia∏ka
SR, które wià˝à si´ z eksonami.
W organizmach jednokomórkowych
maszyneria sk∏adajàca mRNA rozpo-
znaje jedynie sekwencje intronowe krót-
sze ni˝ 500 nukleotydów. Strategia ta
sprawdza si´ dobrze w przypadku dro˝-
d˝y, których geny majà niewiele intro-
nów o przeci´tnej d∏ugoÊci 270 nukle-
otydów. Jednak˝e w trakcie ewolucji
ros∏y zarówno ca∏e genomy, jak i d∏u-
goÊç i liczba intronów, przez co maszy-
neria sk∏adajàca zmuszona zosta∏a do
zasadniczej zmiany sposobu dzia∏ania:
od identyfikacji krótkich sekwencji in-
tronowych wÊród eksonów przesz∏a do
rozpoznawania krótkich eksonów w mo-
rzu intronów. Ârednia d∏ugoÊç ludzkie-
go genu kodujàcego bia∏ko to 28 tys. nu-
kleotydów, na co sk∏ada si´ przeci´tnie
8.8 eksonu rozdzielonego przez 7.8 in-
tronu. Sekwencje eksonowe sà doÊç
krótkie, zwykle oko∏o 120 nukleotydów.
Natomiast introny mogà mieç d∏ugoÊç
od 100 nukleotydów do 100 tys.
Zbytek czy po˝ytek
WIELKO
Âå I LICZBA
intronów w ludzkich
genach – mamy ich wi´cej na gen ni˝
jakikolwiek inny organizm – stanowi za-
gadk´. Przecie˝ tak d∏ugie i liczne in-
trony sà doÊç du˝ym obcià˝eniem dla
naszego organizmu. Znaczna cz´Êç
dziennego wydatku energii przeznacza-
na jest na utrzymanie i napraw´ ich se-
kwencji w genomowym DNA, transkryp-
cj´ na pre-mRNA, a nast´pnie usuwanie
podczas sk∏adania mRNA i ostatecznie
degradacj´. Ponadto system sk∏adania
mo˝e byç êród∏em powa˝nych b∏´dów.
Ka˝de nieprawid∏owe ci´cie i z∏o˝enie
czàsteczki pre-mRNA prowadzi do zmia-
ny w sekwencji kodujàcej bia∏ko, a w
konsekwencji do syntezy wadliwego pro-
duktu bia∏kowego.
Jednym z przyk∏adów tego zjawiska
jest choroba, której dotyczà moje ba-
dania naukowe – dysautonomia rodzin-
na. Powstaje ona na skutek mutacji
jednego nukleotydu w genie IKBKAP,
co powoduje zmian´ sk∏adania jego
mRNA w tkankach uk∏adu nerwowe-
go. Powsta∏y w ten sposób mRNA kodu-
je niepe∏nowartoÊciowe bia∏ko, co z ko-
lei prowadzi do nieprawid∏owego
rozwoju uk∏adu nerwowego. Po∏owa
chorych na dysautonomi´ rodzinnà
umiera przed 30 rokiem ˝ycia. Szacuje
si´, ˝e co najmniej 15% mutacji wywo-
∏ujàcych choroby genetyczne (a tak˝e
najprawdopodobniej niektóre nowotwo-
ry) wp∏ywa na alternatywne sk∏adanie.
Dlaczego wi´c u organizmów wy˝szych
wyewoluowa∏ tak skomplikowany sys-
tem, który w dodatku mo˝e prowadziç
do rozwoju chorób? Byç mo˝e dlatego,
˝e korzyÊci z jego istnienia przewa˝ajà
nad stratami.
Mo˝liwoÊç wyprodukowania dwóch
lub wi´cej rodzajów czàsteczek mRNA,
a co za tym idzie – wi´kszej liczby bia-
∏ek na bazie jednego genu pozwala ludz-
kiemu organizmowi na wytworzenie
90 tys. bia∏ek bez koniecznoÊci utrzy-
mywania w genomie tylu genów. Prze-
ci´tnie transkrypcja ka˝dego naszego
genu daje trzy alternatywne mRNA.
Lecz nawet ta statystyka nie t∏umaczy
faktu istnienia tak du˝ej liczby intronów
zajmujàcych znacznà cz´Êç genomu
– sekwencje eksonowe stanowià zaled-
wie 1–2% jego d∏ugoÊci.
Publikacja w 2001 roku takiej pozor-
nie „pustej” mapy genomu ludzkiego wy-
wo∏a∏a zdziwienie, które pog∏´bi∏o si´,
gdy rok póêniej og∏oszono sekwencj´
MAJ 2005 ÂWIAT NAUKI
45
GIL AST jest starszym wyk∏adowcà na Wydziale Genetyki Cz∏owieka i Medycyny Molekular-
nej w Szkole Medycznej Uniwersytetu w Tel Awiwie w Izraelu. Jego badania naukowe kon-
centrujà si´ wokó∏ mechanizmów molekularnych sk∏adania pre-mRNA, ewolucji i regulacji al-
ternatywnego sk∏adania oraz niesprawnego sk∏adania zwiàzanego z nowotworami i choro-
bami dziedzicznymi. W ostatnich czasach wspó∏pracowa∏ z naukowcami z firmy Compugen
nad systemem bioinformatycznym, który pozwoli∏by przewidywaç przebieg alternatywnego
sk∏adania w celu wykrycia nieznanych bia∏ek.
O
AUTORZE
Pomini´cie nawet pojedynczego eksonu
mo˝e mieç dramatyczne skutki dla organizmu.

genomu mysiego. Okaza∏o si´, ˝e mysz
ma prawie tyle samo genów co cz∏o-
wiek. Choç nasz wspólny przodek ˝y∏ a˝
100 mln lat temu, zdecydowana wi´k-
szoÊç ludzkich i mysich genów wywo-
dzi si´ w∏aÊnie od niego, a nawet zacho-
wuje uk∏ad intronów i eksonów oraz, w
du˝ym stopniu, sekwencj´ nukleotydo-
wà eksonów.
Ruchliwe eksony naczelnych
SKORO RÓ
˚NICA
pomi´dzy ludzkim a my-
sim genomem jest tak znikoma, co spra-
wia, ˝e jesteÊmy od gryzoni tak inni?
Christopher J. Lee i Barmak Modrek z
University of California w Los Angeles
ostatnio wykazali, ˝e Êrednio co czwar-
ty alternatywnie sk∏adany ekson jest
specyficzny albo dla myszy, albo dla
cz∏owieka. Takie eksony mogà byç od-
powiedzialne za powstawanie bia∏ek
charakterystycznych dla danego gatun-
ku i zró˝nicowanie pomi´dzy gatunka-
mi. Okazuje si´ nawet, ˝e jeden typ ekso-
nów wyst´puje tylko u naczelnych (lu-
dzi i ma∏p), a jego pojawienie si´ mog∏o
przyczyniç si´ do oddzielenia si´ tej gru-
py od reszty ssaków. Poznajàc proces
powstawania takiego eksonu, mo˝emy
uzmys∏owiç sobie ogólne po˝ytki p∏ynà-
ce z istnienia intronów, a tym samym
uzasadniç sens ponoszenia kosztów ich
utrzymania.
Eksony charakterystyczne dla naczel-
nych pochodzà z ruchomych elemen-
tów genetycznych zwanych sekwencja-
mi Alu, które nale˝à do wi´kszej klasy
sekwencji zwanych retrotranspozona-
mi. Retrotranspozony to krótkie sekwen-
cje DNA, których funkcjà jest powielanie
samych siebie i wstawianie nowych ko-
pii w przypadkowe miejsca w genomie
na podobieƒstwo ma∏ych genomowych
paso˝ytów. Retrotranspozony znajdujà
si´ w genomach prawie wszystkich or-
ganizmów i odegra∏y bardzo wa˝nà ro-
l´ ewolucyjnà, przyczyniajàc si´ do eks-
pansji genomów podczas powstawania
organizmów wielokomórkowych. Nie-
mal po∏owa ludzkiego genomu sk∏ada
si´ z elementów ruchomych, z których
sekwencje Alu sà najliczniejsze.
Alu mierzà zaledwie 300 nukleoty-
dów, a ich charakterystyczna sekwen-
cja zakoƒczona jest ciàgiem nukleoty-
dów A (poli(A)). W naszym genomie
znajduje si´ oko∏o 1.4 mln kopii sekwen-
cji Alu. Wiele z nich nadal si´ powiela i
wstawia w nowe miejsca w genomie z
cz´stoÊcià raz na 100–200 urodzeƒ.
Wygrzebane ze Êmietnika
PRZEZ D
¸UGIE LATA
uznawano sekwencje
Alu za tzw. Êmieciowy DNA. Naukowcy
nabrali do nich szacunku, gdy stwierdzi-
li, ˝e wstawianie si´ tych elementów w
genom zwi´ksza ró˝norodnoÊç bia∏ek,
które mo˝na wyprodukowaç na podsta-
wie sekwencji jednego genu. Oko∏o 5%
alternatywnie sk∏adanych eksonów w
ludzkim genomie zawiera element Alu.
Powstawa∏y one najpewniej poprzez
wstawianie tych elementów w obr´b in-
tronów. Zazwyczaj pozostawa∏o to bez
znaczenia dla funkcjonowania organiz-
mu, poniewa˝ wi´kszoÊç intronów jest
i tak wycinana z pre-mRNA i degrado-
wana. Mo˝e si´ jednak zdarzyç, ˝e wsta-
wiony element Alu przekszta∏ci cz´Êç in-
tronu w nowy ekson. Dzieje si´ tak wtedy,
gdy w sekwencji Alu dojdzie do mutacji
prowadzàcej do powstania miejsca sk∏a-
dania 5’ lub 3’. (Tego typu mutacje zwy-
kle powstajà podczas podzia∏ów komór-
kowych, kiedy genom jest powielany i
mo˝e dojÊç do pomy∏ki, swoistej literów-
ki, przy przepisywaniu sekwencji DNA).
Wtedy cz´Êç intronu b´dzie przez bia∏ka
splajsosomu traktowana jako ekson.
JeÊli nowy ekson z elementem Alu jest
w∏àczany do dojrza∏ego mRNA alterna-
tywnie (warunkowo), stanowi to dla or-
ganizmu czysty zysk. Gdy ekson Alu zo-
stanie w∏àczony do dojrza∏ego mRNA,
jego translacja da nowe bia∏ko. Nato-
miast w ˝aden sposób nie zaburza to
pierwotnej funkcji genu, poniewa˝ ory-
ginalny mRNA równie˝ powstaje, gdy
ekson Alu jest usuwany z pre-mRNA.
ObecnoÊç eksonu Alu staje si´ k∏opotli-
wa jedynie w przypadku, gdy jest on za-
wsze w∏àczany do mRNA. Taka sytuacja
grozi rozwojem zaburzeƒ wynikajàcych
z braku oryginalnego bia∏ka. Dotych-
czas opisano trzy choroby genetyczne
wywo∏ane niew∏aÊciwie wstawionymi
sekwencjami Alu: zespó∏ Alporta, zespó∏
Slya oraz niedobór OAT.
Wraz z moimi wspó∏pracownikami
wykazaliÊmy, ˝e do przemiany utajonej
intronowej sekwencji Alu w prawdziwy
ekson wystarczy jedynie zmiana jedne-
go nukleotydu w sekwencji DNA. Obec-
nie w genomie ludzkim oko∏o 500 tys.
sekwencji Alu le˝y w obr´bie intronów,
a 25 tys. z nich mog∏oby na drodze jed-
46
ÂWIAT NAUKI MAJ 2005
MIKEL ROBER
TS
Corbis Sygma
GENOMY SZYMPANSÓW I LUDZI sà do siebie podobne w 99%, wliczajàc w to ruchome elemen-
ty genetyczne, zwane sekwencjami Alu, które wyst´pujà wy∏àcznie u naczelnych. Sekwencje Alu
sà odpowiedzialne za powstawanie nowych bia∏ek na drodze alternatywnego sk∏adania RNA, co
prawdopodobnie doprowadzi∏o do oddzielenia si´ naczelnych od innych ssaków. Mo˝liwe, ˝e po-
wstanie gatunku ludzkiego zawdzi´czamy równie˝ alternatywnemu sk∏adaniu: najnowsze bada-
nia pokazujà, ˝e produktami prawie identycznych genów u ludzi i u szympansów sà we wszyst-
kich tkankach w zasadzie te same bia∏ka, z wyjàtkiem obszarów mózgu, w których jedne geny
ludzkie sà bardziej aktywne, a inne, na skutek alternatywnego sk∏adania RNA, kodujà bia∏ka
znacznie ró˝niàce si´ od szympansich.
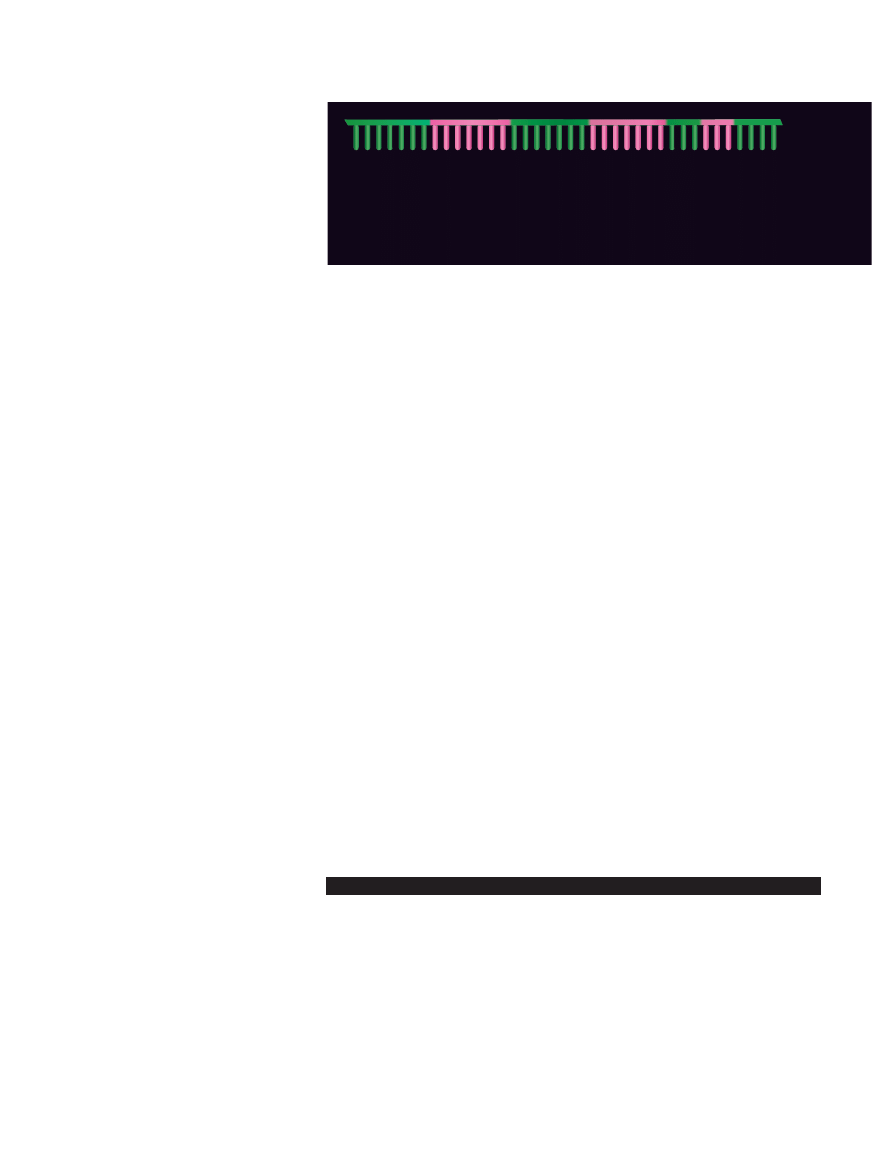
nonukleotydowej mutacji przemieniç si´
w eksony. Sekwencje Alu kryjà zatem
ogromne mo˝liwoÊci wzbogacania puli
informacji genetycznej s∏u˝àcej do pro-
dukcji ludzkich bia∏ek.
Ponad 400 laboratoriów i 3 tys. nau-
kowców na Êwiecie pracuje nad zrozu-
mieniem skomplikowanych reakcji za-
chodzàcych podczas alternatywnego
sk∏adania. Choç badania te nie sà jesz-
cze zaawansowane, uczeni sà zgodni,
˝e ostatnie odkrycia wskazujà na mo˝-
liwoÊci zastosowaƒ terapeutycznych, na
przyk∏ad opracowania metod terapii ge-
nowej wykorzystujàcych alternatywne
sk∏adanie w leczeniu zarówno chorób
wrodzonych, jak i nabytych, zw∏aszcza
nowotworów.
Leczenie sk∏adaniem
ZASTOSOWANIE
krótkich syntetycznych czà-
steczek RNA lub DNA, zwanych antysen-
sownymi oligonukleotydami, do wiàzania
z konkretnymi sekwencjami DNA lub
RNA chorego jest jednà z mo˝liwych
terapii. Takie oligonukleotydy po wpro-
wadzeniu do komórki maskowa∏yby miej-
sce ci´cia RNA lub innà sekwencj´
regulatorowà, powodujàc, ˝e ci´cie i sk∏a-
danie nastàpi w innym regionie.
Ryszard Kole z University of North
Carolina w Chapel Hill pierwszy sku-
tecznie zastosowa∏ t´ koncepcj´ na pre-
kursorach komórek krwiotwórczych po-
branych od chorych na dziedzicznà
beta-talasemi´, w której nieprawid∏owe
miejsce ci´cia 5’ powoduje tworzenie
zdeformowanych czàsteczek hemoglo-
biny, odpowiadajàcej za transport tle-
nu. Kole, blokujàc nieprawid∏owe miej-
sce ci´cia, wymusi∏ wykorzystanie przez
splajsosom miejsca typowego, dzi´ki
czemu sk∏adanie mRNA przebieg∏o pra-
wid∏owo i przywrócona zosta∏a produk-
cja normalnie dzia∏ajàcej hemoglobiny.
Kole pokaza∏ równie˝, ˝e t´ samà
technik´ mo˝na zastosowaç na ludzkich
komórkach nowotworowych utrzymy-
wanych w hodowli laboratoryjnej. Za-
s∏oni´cie miejsca ci´cia 5’ w pre-mRNA
genu Bcl-x regulujàcego apoptoz´ spo-
wodowa∏o sk∏adanie g∏ównie formy
Bcl-x(S) mRNA zamiast formy Bcl-x(L).
Dzi´ki temu spad∏a produkcja bia∏ka ha-
mujàcego apoptoz´, a wzros∏a synteza
bia∏ka proapoptotycznego. W niektórych
komórkach nowotworowych powoduje
to aktywacj´ programu apoptozy; w in-
nych wzmaga dzia∏anie podawanych
równoczeÊnie chemioterapeutyków.
Adrian Krainer i Luca Cartegni z Cold
Spring Harbor Laboratory w stanie No-
wy Jork opracowali w 2003 roku inny
sposób wykorzystania alternatywnego
sk∏adania w celach terapeutycznych. Po-
lega on na zmuszeniu komórki, by w∏à-
czy∏a do mRNA ekson zwykle pomijany
przy sk∏adaniu. W tym celu stworzyli syn-
tetycznà czàsteczk´, która jednà cz´Êcià
rozpoznaje konkretnà sekwencj´ RNA, a
drugà ∏àczy si´ z bia∏kami SR. Taka chi-
mera molekularna mo˝e wiàzaç si´ z do-
wolnie wybranà przez badaczy sekwen-
cjà pre-mRNA i za poÊrednictwem bia∏ek
SR wskazaç podstawowej maszynerii
sk∏adajàcej miejsce ci´cia RNA. Krainer
i Cartegni naprawili tà metodà w hodo-
wanych w laboratorium komórkach sk∏a-
danie zmutowanego genu BRCA1, który
odgrywa rol´ w rozwoju raka sutka, oraz
genu SMN2, odpowiedzialnego za rdze-
niowy zanik mi´Êni.
Inny pomys∏ na terapi´ wykorzystuje
zdolnoÊç splajsosomu do ∏àczenia ze so-
bà dwóch ró˝nych czàsteczek pre-mRNA.
Reakcja ta, zwana sk∏adaniem w trans
(trans-splicing), wyst´puje cz´sto u nicie-
ni, ale stosunkowo rzadko w komórkach
ludzkich. Wymuszenie sk∏adania w trans
mog∏oby pozwoliç na zastàpienie zmuto-
wanej cz´Êci genu przez sekwencj´ prawi-
d∏owà, pochodzàcà z transkrypcji drugie-
go, prawid∏owego allelu. John Engelhardt
z University of Iowa niedawno wykorzy-
sta∏ t´ technik´ na komórkach w hodow-
li do cz´Êciowej naprawy pre-mRNA ge-
nu, którego mutacje odpowiadajà za roz-
wój mukowiscydozy.
Przed ukoƒczeniem projektu sekwen-
cjonowania ludzkiego genomu niewielu
naukowców uwa˝a∏o, ˝e istota tak z∏o-
˝ona jak cz∏owiek mo˝e mieç zaledwie
25 tys. genów. Jednak od czasu opubli-
kowania ostatecznej wersji genomu zro-
zumiano, ˝e dzi´ki alternatywnemu sk∏a-
daniu na bazie niewielkiej liczby genów
mo˝na wyprodukowaç o wiele liczniej-
szy zestaw bia∏ek i zyskaç kontrol´ nad
ich pojawianiem si´ w odpowiednim
miejscu i czasie w ró˝nych tkankach.
Istnienie alternatywnego sk∏adania wy-
jaÊnia te˝, jak na bazie podobnych ge-
nomów powstajà organizmy tak ró˝ne
jak cz∏owiek i mysz.
Dzia∏anie ewolucji polega na przy-
padkowym zmienianiu cech organiz-
mów, a nast´pnie wybieraniu tych, któ-
re dzi´ki zmianom uzyska∏y przewag´
nad resztà. Dlatego te˝ powstawanie no-
wych bia∏ek w wyniku w∏àczania do
mRNA eksonów pochodzàcych z se-
kwencji Alu musia∏o odegraç istotnà ro-
l´ w kszta∏towaniu gatunku ludzkiego.
Ale nie wszystkie zmiany sk∏adania sà
korzystne. Dzi´ki dalszym badaniom
mo˝emy nauczyç si´ naprawiaç szkody
wyrzàdzane przez ten proces i popra-
wiç jakoÊç naszego ˝ycia.
n
MAJ 2005 ÂWIAT NAUKI
47
Ukryty program genetyczny. John S. Mattick; Âwiat Nauki, 11/2004.
How Did Alternative Splicing Evolve? Gil Ast; Nature Reviews Genetics, tom 5 nr 10 s. 773-782,
X/2004
Differential Alu Mobilization and Polymorphism Among the Human and Chimpanzee Lineages.
Dale J. Hedges i in.; Genome Research, tom 14, nr 6, s.1068-1075, I/2004.
http://www.genome.org/cgi/content/full/14/6/1068
Pre-mRNA Splicing and Human Disease. N. A. Faustino i T. A. Cooper; Genes and Development,
tom 17, nr 4, s. 419-437, 15 II 2003. http://www.genesdev.org/cgi/content/full/17/4/419
Signals and Their Transduction Pathways Regulating Alternative Splicing: a New Dimension of the
Human Genome. Stefan Stamm; Human Molecular Genetics, tom 11, nr 20, s. 2409-2416,
1 X 2002. http://hmg.oupjournals.org/cgi/content/full/11/20/2409
Mammalian Retroelements. Prescott L. Deininger i Mark A. Batzer; Genome Research, tom 12,
nr 10, s. 1455-1465, X/2002. http://www.genome.org/cgi/content/full/12/10/1455
Alternative pre-mRNA Splicing and Proteome Expansion in Metazoans. T. Maniatis i B. Tasic;
Nature, tom 418, nr 6894, s.236-243, 11 VII 2002.
JEÂLI CHCESZ WIEDZIEå WI¢CEJ
Dlaczego ewolucja chroni∏a skomplikowany
mechanizm, który mo˝e powodowaç choroby?
Wyszukiwarka
Podobne podstrony:
Fwd dydaktyka, Metody alternatywne
REGUŁA DOŁĄCZANIA ALTERNATYWY
Energia alternatywna
Jak zamienić prądnicę na alternator w URSUSIE C 330
Glottodydaktyka, Traditionelle und alternative Unterrichtsmethoden
wyniki tabela zad7, Ochrona Środowiska, semestr V, Alternatywne źródła energii, PROJEKT 2
dieta nielaczenia1, MEDYCYNA ALTERNATYWNA, diety=#
Rozwój edukacji alternatywnej i ustawicznej 8, Pedagogika porównawcza, odpowiedzi na pytania
Paliwa Alternatywne
Alternatywne teorie wymiany międzynarodowej
6 Organizacja genomow genom czlowieka
alternatywne
Odq alternative v 1 0
1 genom
marketing alternatywny
więcej podobnych podstron