2010-05-06
1
Chemia org. II
dr M. Wojtkowska
Alkeny
- Alkeny to węglowodory łańcuchowe, które
zawierają przynajmniej jedno wiązanie
podwójne pomiędzy atomami węgla.
- Jest to więc rodzaj węglowodorów
nienasyconych.
- Wzór ogólny: C
n
H
2n
(n>1)
2010-05-06
2
Właściwości fizyczne
- Podobne do właściwości alkanów.
- Temperatury wrzenia i topnienia są na
ogół niższe niż te u analogicznych
alkanów.
- Gęstość na ogół wyższa.
- Nierozpuszczalne w wodzie.
Właściwości chemiczne
- Alkeny są dość reaktywne.
- Ulegają reakcji addycji (przyłączenia) do
wiązań podwójnych z wodorem, chlorowcami,
kwasami chlorowcowodorowymi, kwasem
siarkowym i ozonem.
- Charakterystyczna jest też zdolność do
polimeryzacji (polietylen, polipropylen).
2010-05-06
3
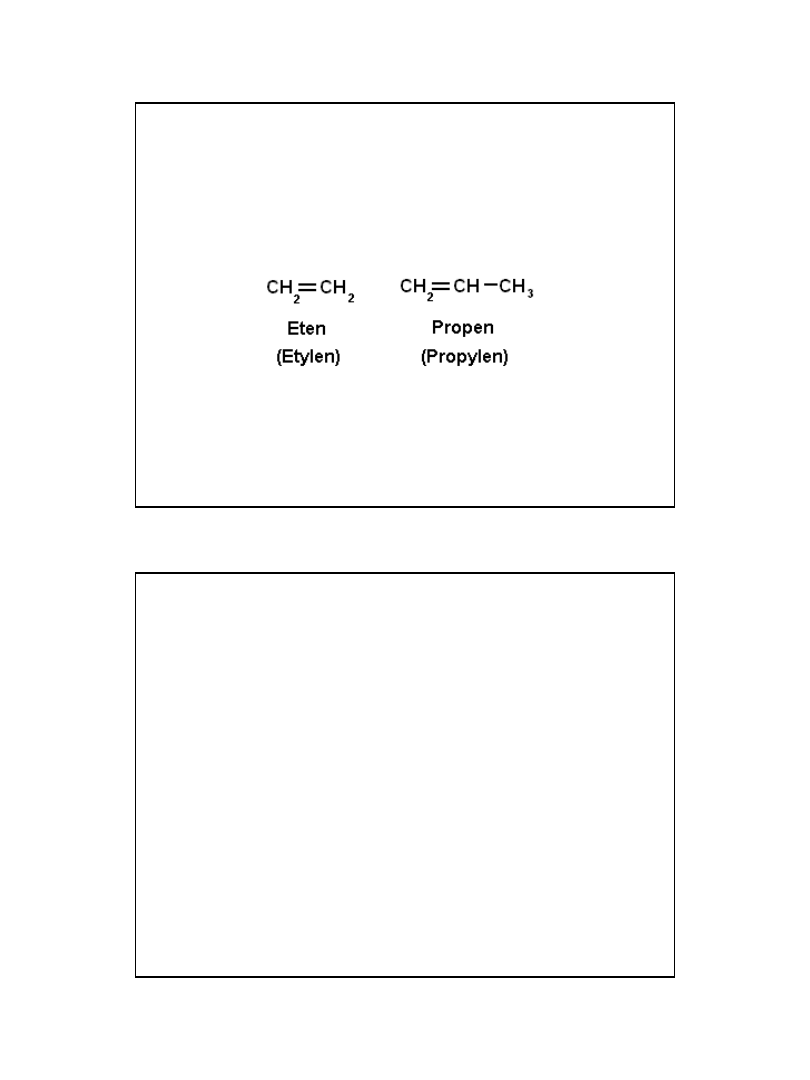
Przykłady
Alkiny
- Alkiny to węglowodory łańcuchowe,
które zawierają przynajmniej jedno
wiązanie potrójne pomiędzy atomami
węgla.
- Jest to więc rodzaj węglowodorów
nienasyconych.
- Wzór ogólny: C
n
H
2n-2
(n>1)
2010-05-06
4
Właściwości fizyczne
- Temperatury wrzenia i topnienia są na
ogół wyższe niż te u analogicznych
alkenów.
- Wraz ze wzrostem liczby atomów węgla
alkinu, temperatury te mają coraz
wyższe wartości.
- Dość duża rozpuszczalność w wodzie.
Właściwości chemiczne
- Alkiny są bardzo reaktywne.
- Ulegają reakcji addycji (przyłączenia) do wiązań
potrójnych z wodorem, chlorowcami, kwasami
chlorowcowodorowymi, cyjanowodorem i wodą.
- Charakterystyczna jest też zdolność do tworzenia soli z
metalami lekkimi i ciężkimi, ale dotyczy ona jedynie
alkinów, mających atom wodoru przy przynajmniej
jednym węglu wiązania potrójnego (kwasowy wodór).
- Powszechnie znaną solą alkinu: acetylenu jest karbid
(węglik wapnia).

2010-05-06
5
Przykłady
Węglowodory nienasycone – alkeny,
alkiny
• Węglowodory zawierające w cząsteczce wiązania wielokrotne, to
• węglowodory nienasycone.
• Alkeny – węglowodory zawierające jedno wiązanie podwójne. Wzór
• ogólny: C
n
H
2n
. Nazwy związków podaje się z końcówką –en,
• poprzedzoną numerem węgla, przy którym występuje wiązanie
• podwójne. Przedstawiciel – eten (nazwa zwyczajowa – etylen).
H
2
C=CH
2
• Alkiny – węglowodory zawierające jedno wiązanie potrójne. Wzór
• ogólny: C
n
H
2n-2
. Nazwy związków podaje się z końcówką –yn lub -
• in, poprzedzoną numerem węgla, przy którym występuje wiązanie
• potrójne. Przedstawiciel – etin (nazwa zwyczajowa – acetylen).
HC=CH
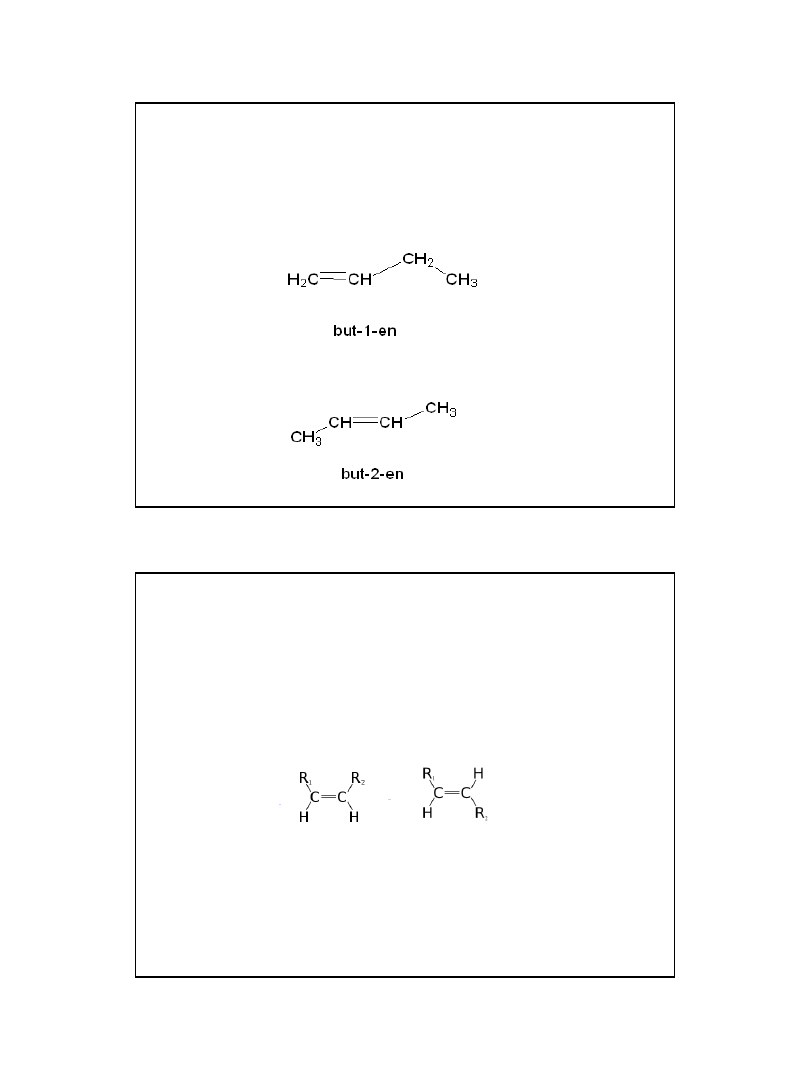
2010-05-06
6
Izomeria węglowodorów
nienasyconych
1. Izomeria położenia wiązania wielokrotnego:
Izomeria węglowodorów nienasyconych
2. Izomeria geometryczna – w związku z zahamowaniem
rotacji wokół wiązania podwójnego, możliwe jest różne
rozmieszczenie podstawników wokół wiązania
podwójnego
:
Forma cis (Z) Forma trans (E)
2010-05-06
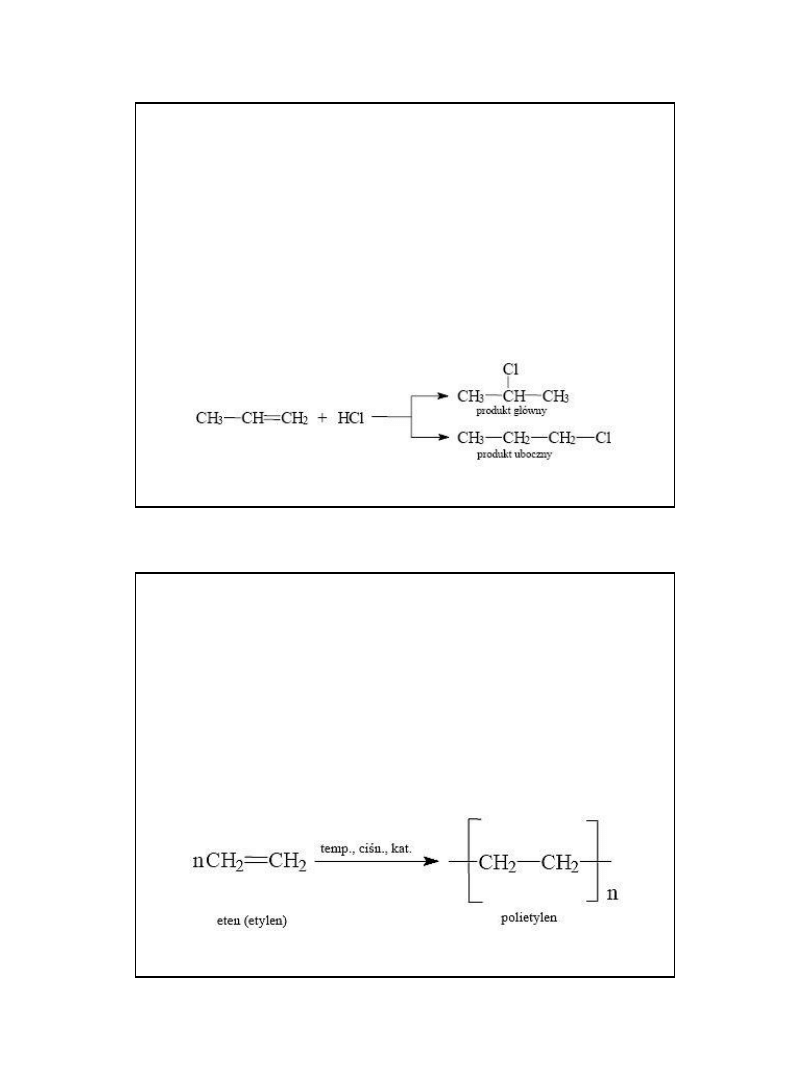
7
reguła Markownikowa:
Podczas addycji niesymetrycznych cząstek
reagentów do niesymetrycznych alkenów
atom wodoru przyłącza się do tego atomu
węgla przy podwójnym wiązaniu, który
związany jest z większą liczbą atomów
wodoru.
.
polimeryzacja
wolnorodnikowa
Polega ona na łączeniu się cząsteczek alkenu w
długie łańcuchy zawierające wiązania
pojedyncze. Substrat w reakcji polimeryzacji
to monomer, zaś otrzymany produkt to
polimer. Fragment powtarzający się w
polimerze to mer.
2010-05-06
8
Areny – węglowodory aromatyczne
- zawierają zawsze układ naprzemiennie
występujących wiązań podwójnych i
pojedynczych między atomami węgla,
tworzącymi pierścień.
- Najbardziej znane są pierścienie
sześciowęglowe z trzema wiązaniami
podwójnymi.
- Wyróżniamy areny jednopierścieniowe i o
pierścieniach skondensowanych.
Właściwości fizyczne
- Ciecze lub ciała stałe.
- Cechuje je dość przyjemny zapach i
gęstość mniejsza od gęstości wody.
- Areny są nierozpuszczalne w wodzie,
rozpuszczalne w rozpuszczalnikach
organicznych.
2010-05-06
9
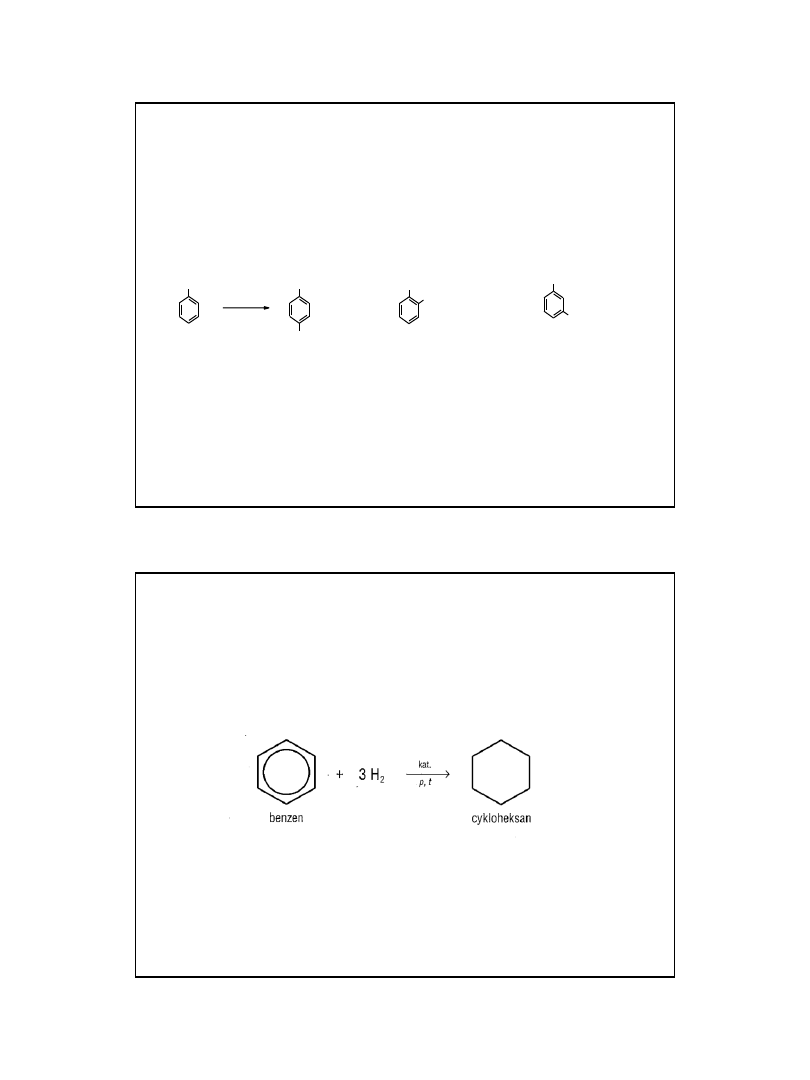
Właściwości chemiczne
- Dość łatwo ulegają reakcjom substytucji
(podstawienia) z kwasem azotowym
(nitrowanie), siarkowym (sulfonowanie),
chlorem i bromem (chlorowcowanie).
- W podwyższonej temperaturze i w
obecności katalizatora - niklu, ulegają
redukcji wodorem do odpowiednich
cykloalkanów.
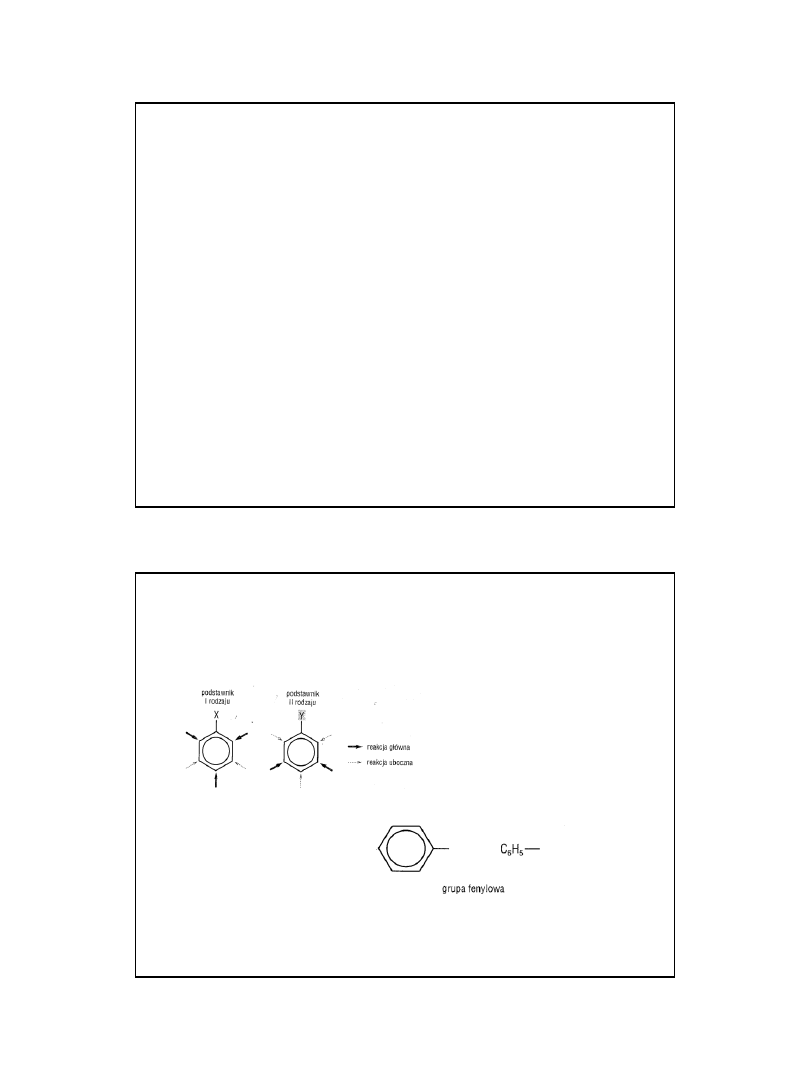
Podstawniki w arenach
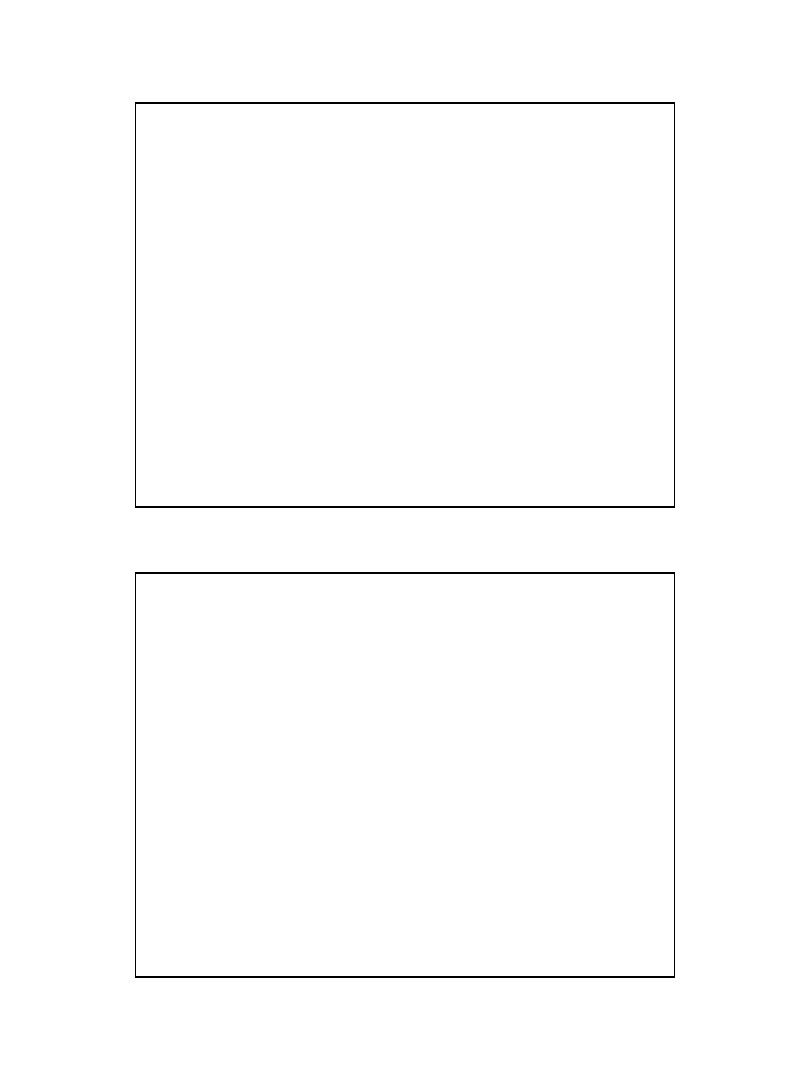
2010-05-06
10
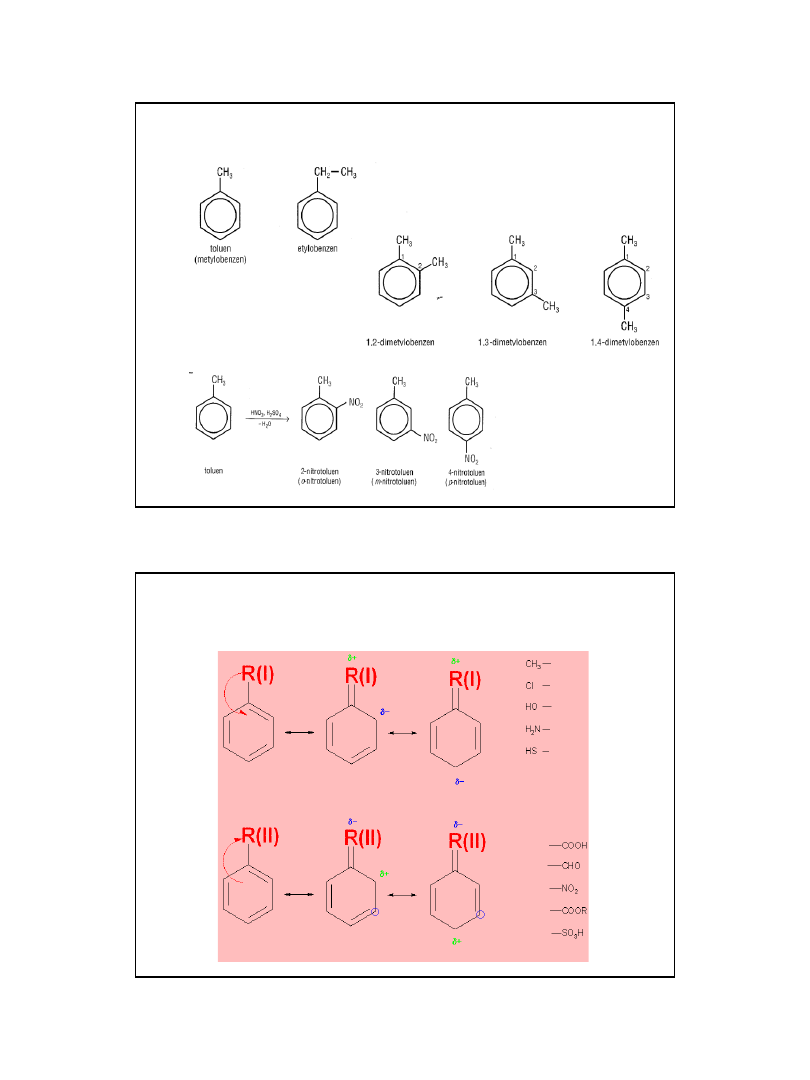
Podstawniki I i II rodzaju
• Klasyfikacja podstawników kierowanych do pierścienia
aromatycznego oparta na kryterium elektroujemności podstawnika
względem elektroujemności pierścienia aromatycznego.
• Podstawniki I rodzaju to takie, których elektroujemność jest
mniejsza od elektroujemności pierścienia i w związku z tym część
ładunku ujemnego podstawnika zostaje przeniesiona do pierścienia
aromatycznego (najczęściej główna część ładunku pochodzi z tzw.
wolnych par elektronowych).
• Podstawniki II rodzaju to takie, których elektroujemność jest
większa od elektroujemności pierścienia i w związku z tym część
ładunku ujemnego pierścienia aromatycznego zostaje przeniesiona do
podstawnika.
Położenie podstawników
dyslokacja ładunku ujemnego w cząsteczce zawierającej podstawiony pierścień
aromatyczny prowadzi do wzrostu ładunku ujemnego w pozycjach o– lub p
(podstawniki I rodzaju) lub do zmniejszenia ładunku ujemnego w tych pozycjach
(podstawniki II rodzaju).
W tym drugim przypadku efektem wypadkowym jest względne zwiększenie
ładunku ujemnego w pozycji m– (przez zmniejszenie ładunku w pozycjach
pozostałych).
Jedną z konsekwencji takiego rozłożenia ładunków w pierścieniu jest
kierowanie się następnego podstawnika elektrofilowego w pozycje o– i p– w
przypadku pierścienia z podstawnikiem I rodzaju lub w pozycję m–, gdy mamy
do czynienia z pierścieniem podstawionym podstawnikiem II rodzaju (tam
bowiem jest największa względna wartość ładunku ujemnego).
2010-05-06
11
Kierowanie podstawników
Przykłady
2010-05-06
12
Benzen: C
6
H
6
• -
ciecz palna, o charakterystycznym zapachu
• -
toksyczny, o właściwościach rakotwórczych
• -
ma sześć węgli zamkniętych w pierścień oraz
trzy podwójne wiązania między węglami
• -
ma symetryczną budowę
• -
nie odbarwia wody bromowej – nie wykazuje
właściwości węglowodorów nienasyconych
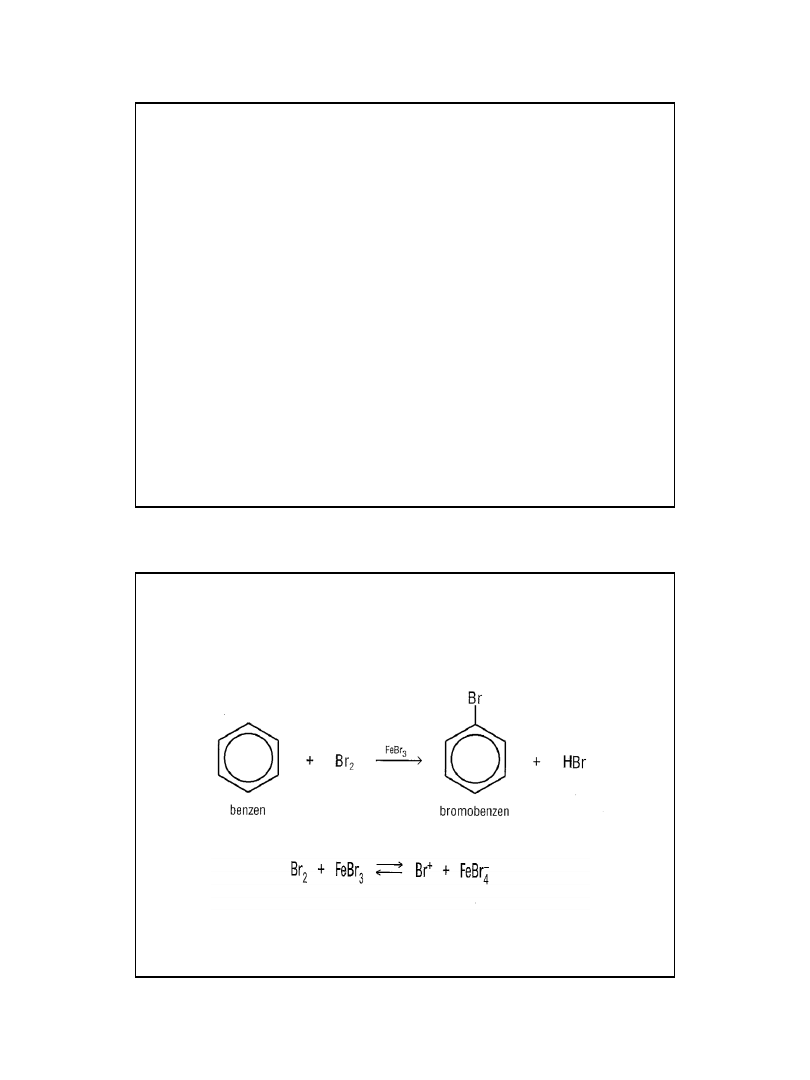
• -
reaguje z bromem w obecności katalizatora –
FeCl
3
reaguje z bromem w obecności
katalizatora – FeCl
3
2010-05-06
13
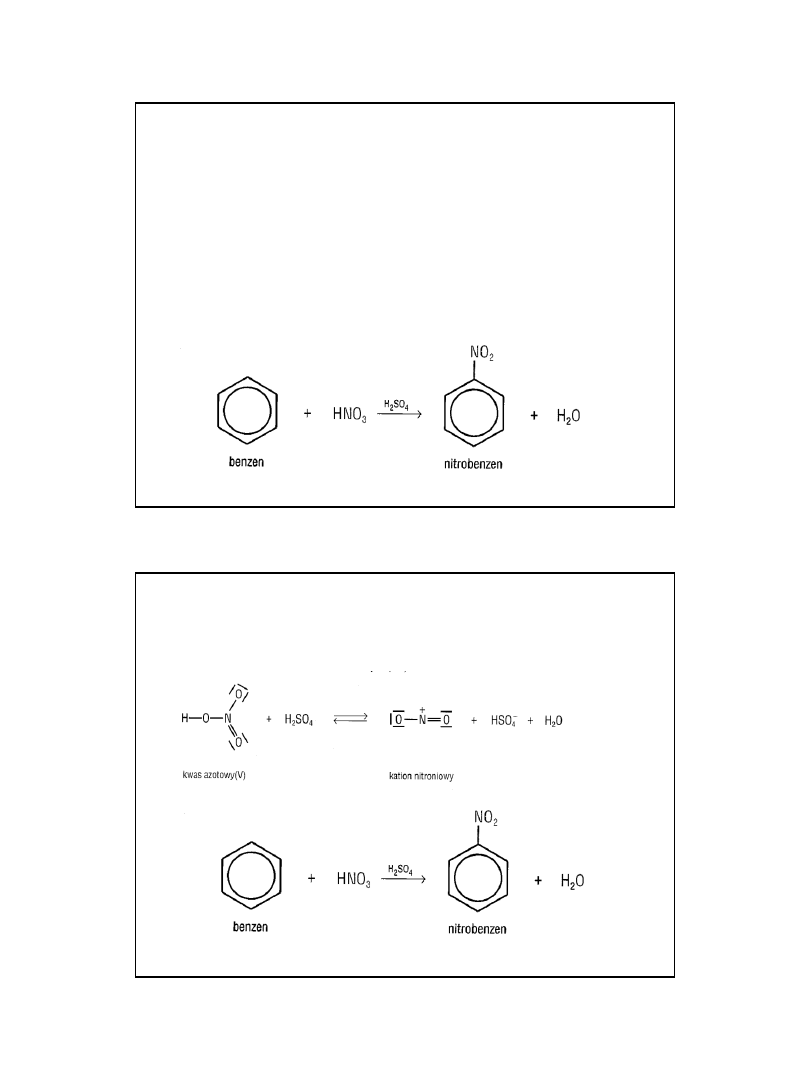
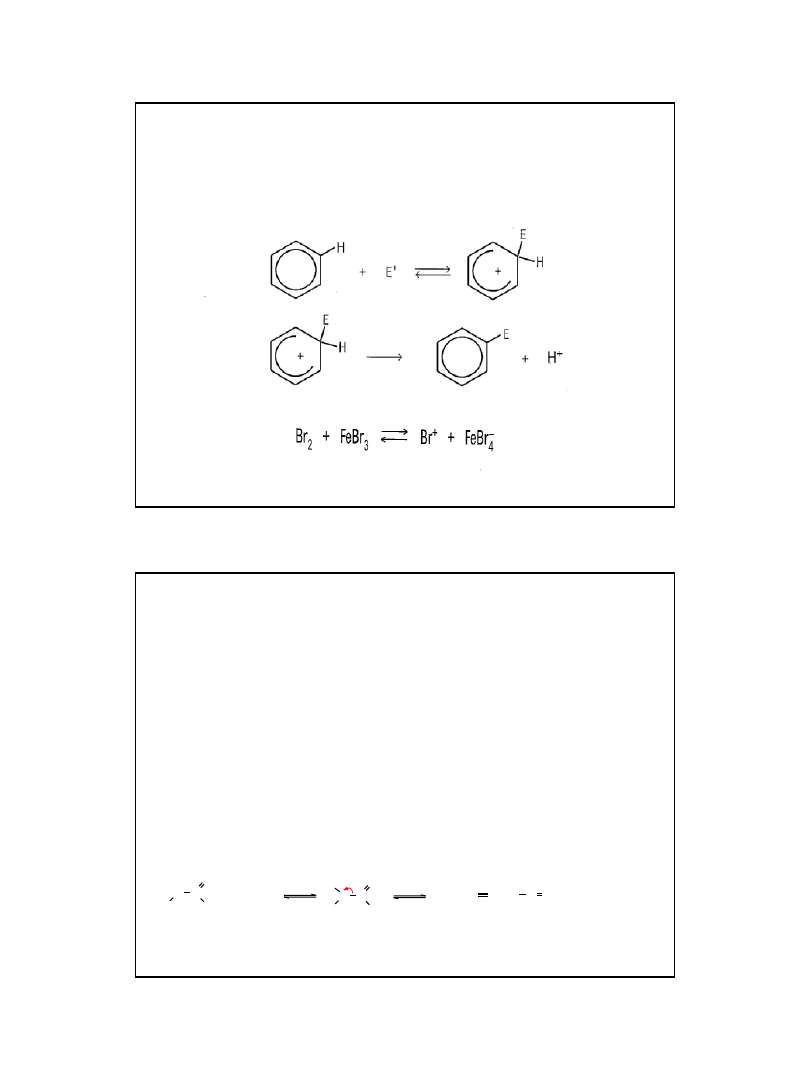
reakcją charakterystyczną dla
benzenu jest nitrowanie
• w reakcji nitrowania funkcję czynnika
elektrofilowego pełni kation nitroniowy
tworzący się w odwracalnej reakcji kwasu
azotowego(V) z kwasem siarkowym(VI):
Nitrowanie
2010-05-06
14
W reakcjach zachodzi reakcja
podstawiania elektrofilowego –
kationu:
Grupę nitrową do pierścienia aromatycznego wprowadza się
najczęściej za pomocą mieszaniny nitrującej czyli kwasu
azotowego i siarkowego o różnych stężeniach, zależnych od
reaktywności arenu. W mieszaninie tych kwasów wytwarza
się
kation nitroniowy
+NO2, który jako silny elektrofil
wchodzi na miejsce jednego z aromatycznych atomów
wodoru.
O N
H
O
O
O N
H
O
O
H
O
O
..
:
-
:
..
..
..
..
..
+
+ H
2
SO
4
:
-
:
..
..
..
..
+
+
- HSO
4
-
N
2
+
-
:
:
..
..
NO
2
+
kation nitroniowy
- HOH
2010-05-06
15
Stany mezomeryczne nitrowania
toluenu
mechanizm nitrowania benzenu z uwzględnieniem
wszystkich stanów mezomerycznych adduktu po
przyłączniu kationu nitroniowego
Toluen jest bardziej podatny na reakcje SE niż benzen; jego
nitrowanie biegnie około 25 razy szybciej niż benzenu. To
grupa metylowa obecna w cząsteczce toluenu uaktywnia ją
na reakcję SE.
CH
3
NO
2
CH
3
NO
2
CH
3
NO
2
CH
3
HNO
3
/H
2
SO
4
40
o
C
+
+
toluen
60%
36%
4%
p-nitrotoluen
o-nitrotoluen
m-nitrotoluen
uwodornienie – wysokie
ciśnienie i katalizator
2010-05-06
16
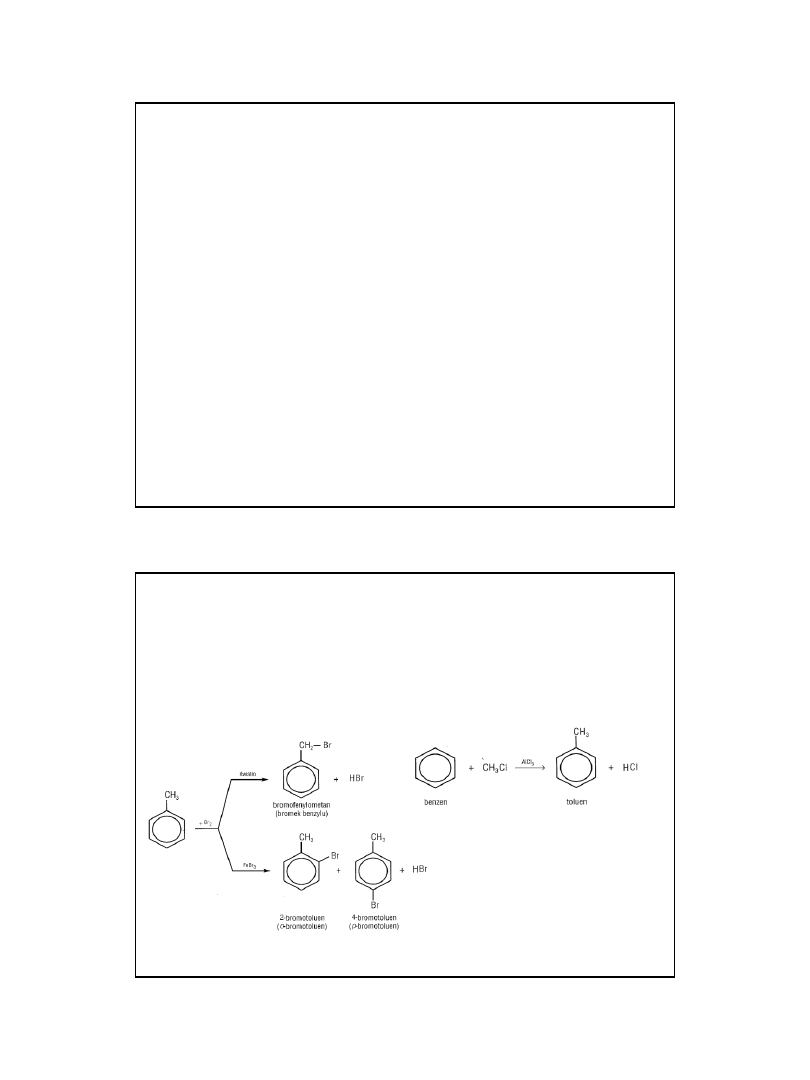
Homologi benzenu
Podział podstawników
2010-05-06
17
Kierunek reakcji
• W zależności od warunków homologi benzenu mogą
reagować zarówno jak alkany i węglowodory aromatyczne.
• Reakcja aromatycznego podstawiania elektrofilowego
2010-05-06
18
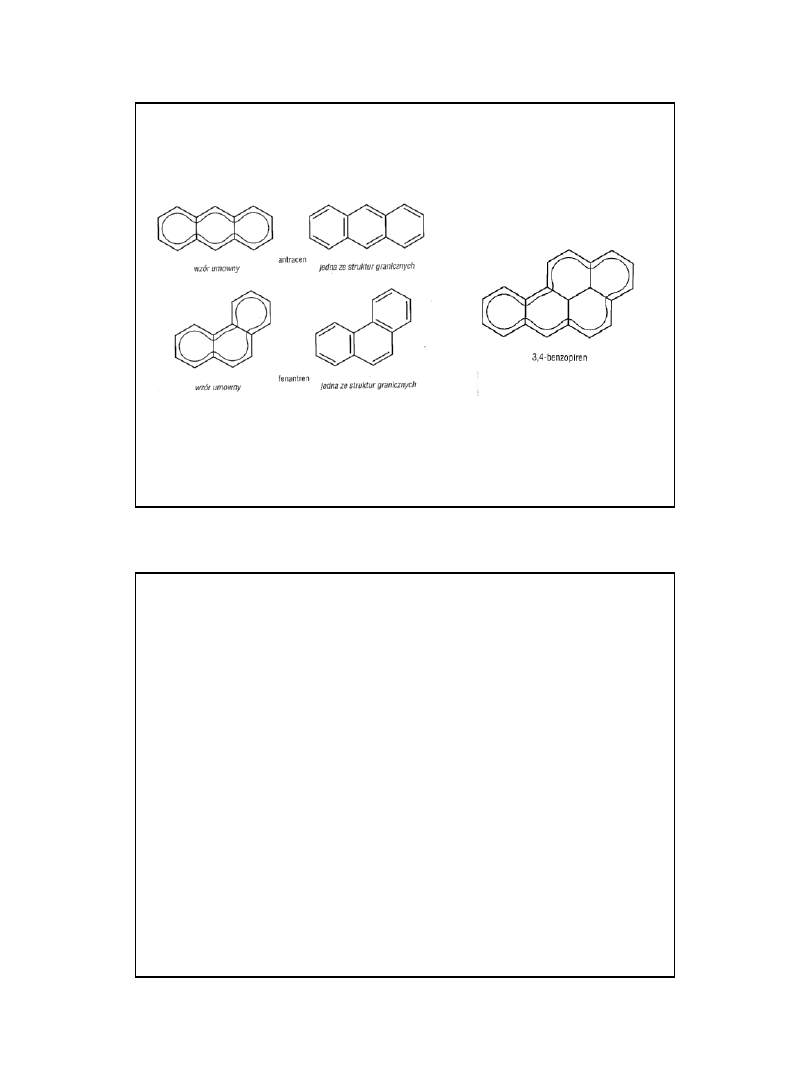
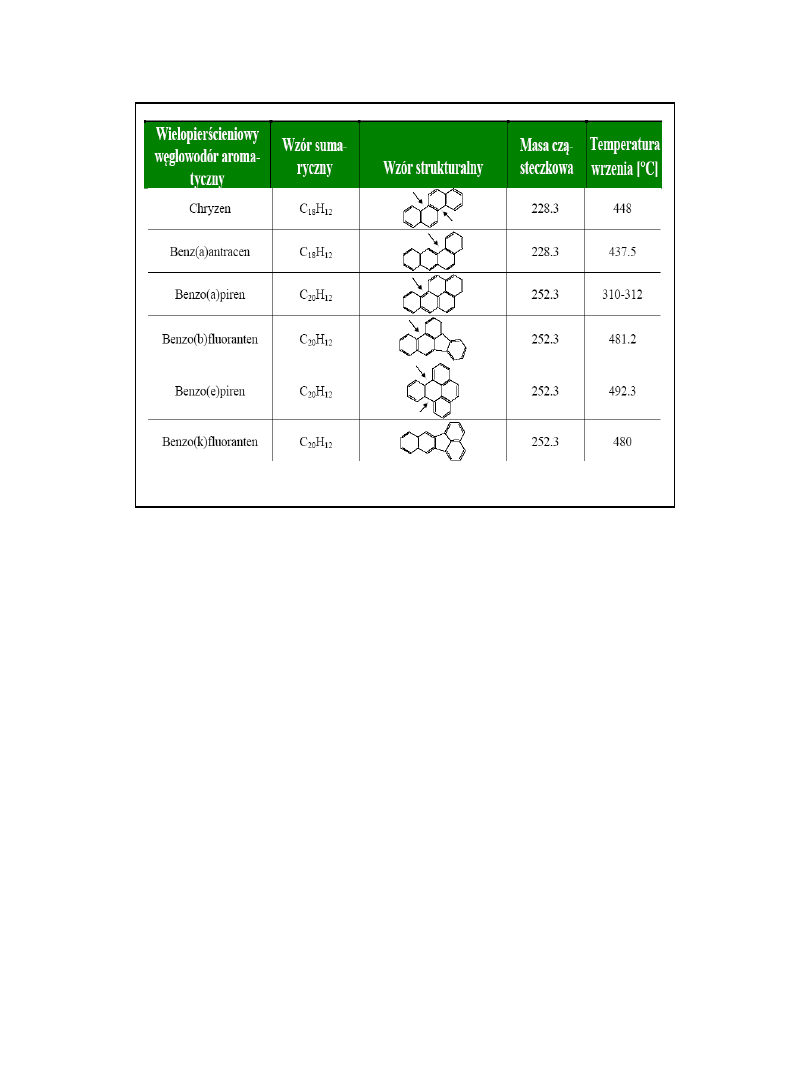
WWA – wielopierścieniowe
węglowodory aromatyczne
Toksyczność WWA
Związków tej grupy jest ponad sto, z uwagi na
toksyczność, oddziaływanie na człowieka oraz wielkość
dostępnych informacji, najczęściej oznaczanych jest 17.
WWA posiadają różne formy strukturalne
charakteryzujące
się różnym wzajemnym ułożeniem pierścieni
benzenowych
w cząsteczce.
W pewnych molekułach WWA występuje tzw. "bay
region„
/struktura fenantrenu/ -
obszar o zwiększonej gęstości
elektronowej umożliwiający tworzenie się np. adduktów
z
DNA, dlatego związki te mogą oddziaływać na replikację
2010-05-06
19
benzo/a/piren
• Podkreślić należy, że związki te nie występują
pojedynczo, lecz zawsze w mieszaninie.
• Liczne badania potwierdzają, że obecność jednego
ze związków z grupy WWA w próbie środowiskowej
wskazuje na to, że inne związki tej grupy też są
obecne.
• Najlepiej przebadanym węglowodorem z grupy
WWA jest benzo/a/piren
, który ze względu na siłę
działania rakotwórczego oraz powszechność
występowania w środowisku uznany został za
wskaźnik całej grupy WWA.
WWA w środowisku
• Wielopierścieniowe węglowodory aromatyczne,
występujące w środowisku człowieka,
pochodzą głównie ze źródeł antropogennych.
W aspekcie ogólnego skażenia, ilości WWA
pochodzące ze źródeł naturalnych i stanowiące
"naturalne tło" są niewielkie w porównaniu z
ilościami będącymi wynikiem działalności
człowieka. WWA powstają jako produkty
uboczne w wielu procesach chemicznych.
2010-05-06
20
Źródła
• Zasadniczo każdy proces związany z silnym
ogrzewaniem lub niecałkowitym spalaniem
związków organicznych, może być źródłem
emisji WWA, poza przemysłowym /spalarnie
odpadów, pożary lasów, spaliny pojazdów
mechanicznych/.
• Odrębnym źródłem WWA jest palenie tytoniu,
przy czym zarówno bierne jak i czynne
palenie jest czynnikiem ryzyka
nowotworowego.
WWA
• Występowanie WWA we wszystkich
elementach środowiska człowieka: w powietrzu,
w wodzie, w glebie oraz żywności powoduje, że
narażenie na ich działanie ma charakter
powszechny.
• Dostają się do organizmu ludzkiego różnymi
drogami: podczas spożywania pokarmów,
drogą inhalacyjną oraz przez skórę.
• Nie ma ilościowych danych na temat absorpcji,
dystrybucji i wydalania WWA u ludzi. Informacje
na powyższy temat pochodzą głównie z badań
eksperymentalnych na zwierzętach.
2010-05-06
21
Drogi migracji
• Obecność WWA i ich metabolitów w moczu i
krwi ludzi w następstwie zawodowej ekspozycji
inhalacyjnej oraz dermalnej są dowodem na to,
że związki te są wchłaniane do organizmu.
• Różnice we wchłanianiu WWA do organizmu
wynikają z ich różnej lipofilności. Absorpcja
wzrasta z większą lipofilnością lub w obecności
tłuszczów w układzie pokarmowym.
Wchłanianie przez skórę okazuje się być
szybkie zarówno u ludzi jak i zwierząt.
Drogi migracji
Przy narażeniu zawodowym główną drogą
wchłaniania WWA do organizmu ludzkiego jest
układ oddechowy, do którego mniej lotne WWA,
w tym benzo/a/piren, dostają się jako aerozole
zaadsorbowane na cząsteczkach pyłu,
natomiast przy narażeniu środowiskowym
główną drogą wchłaniania WWA jest przewód
pokarmowy.
2010-05-06
22
Wyszukiwarka
Podobne podstrony:
instrukcja - CHEMIA ORGANICZNA II, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratori
Chemia Organiczna I II
instrukcja - CHEMIA ORGANICZNA II, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratori
I Pracownia - zakres materiału, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZN
Egzamin termin II i III chemia organiczna
Instrukcja do prób barwnych I (alkohole, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady
podstawniki, TŻ, SEMI, SEM II, chemia organiczna
octan cykloheksylu, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA CZŁOWIEKA, ROK II, SEM 4, Chemia orga
sale, TŻ, SEMI, SEM II, chemia organiczna
chemia organiczna skrocone, Wiertnictwo - AGH, ROK I - Semestr II, Chemia organiczna, egzamin
program zajęć 2008, WNoŻ, Studia inżynierskie, II semestr, Chemia organiczna
semquiz 12-5a, farmacja I i II, chemia organiczna, seminaria
Zestaw treningowe nr 2 do sprawdzianu S2, WNOŻCiK (moje studia), Semestr II, Chemia organiczna
Pracownia z Chemii Organicznej dla II roku Ochrony Srodowiska, Chemia, chemia organiczna
acetanilid, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA CZŁOWIEKA, ROK II, SEM 4, Chemia organiczna
Zestaw 3, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem II, Chemia organiczna
CHemia org Tow stac 2013 2014, Studia, I o, rok II, semestr III, chemia organiczna [egz]
Program chemia organiczna, TŻ, SEMI, SEM II, chemia organiczna
Ćwiczenia – węglowodory alifatyczne, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
więcej podobnych podstron