
215
Przegl¹d Lekarski 2001 / 58 / 4
PRACE POGL¥DOWE REVIEW PAPERS
Ocena toksykologiczna metod
diagnostycznych stosowanych w zatruciach
rodkami psychoaktywnymi
Toxicological evaluation of diagnostic methods used in
intoxication with psychoactive substances
Roman WACHOWIAK
Katedra i Zak³ad Medycyny S¹dowej
Akademii Medycznej im. K. Marcinkowskiego
w Poznaniu
Kierownik:
Prof. dr hab. med. Zygmunt Przybylski
Dodatkowe s³owa kluczowe:
metody analityczne
analiza zwi¹zków psychoaktywnych
zatrucia
oceny
Additional key words:
analytical techniques
psychoactive drug testing
intoxication
evaluation
Adres do korespondencji:
Prof. dr hab. farm. Roman Wachowiak
Katedra i Zak³ad Medycyny S¹dowej
Akademii Medycznej
ul. wiêcickiego 6, 60-781 Poznañ, POLAND
Tel./Fax: (61) 869-91-81 w. 551
e-mail: ZMS@eucalyptus.usoms.poznan.pl
Wprowadzenie
Diagnostyka toksykologiczna przypad-
ków zatruæ miertelnych, obok monitoringu
kontrolowanej terapii przedawkowania le-
ków (overdose drug monitoring) odgrywa
aktualnie wa¿n¹ rolê w nowoczesnej toksy-
kologii klinicznej i s¹dowej. Zapotrzebowa-
nie na tego typu badania ci¹gle wzrasta,
bowiem s¹ ono determinowane czêstotliwo-
ci¹ zatruæ zwi¹zanych z systematycznym
nadu¿ywaniem leków, w tym rodków psy-
choaktywnych. Motywacja i celowoæ ozna-
czania poziomów leków i ich metabolitów w
p³ynach ustrojowych w przypadku zatruæ
stanowi podstawê racjonalnego dzia³ania
terapeutycznego, a szczególnie detoksyka-
cyjnego. Koniecznoæ okrelenia poziomu
ksenobiotyku w p³ynach ustrojowych i tkan-
kach ma szczególne znaczenie w toksyko-
logii s¹dowej, bowiem wielokrotnie w spo-
sób obiektywny pozwala ustaliæ przyczynê i
mechanizm zgonu. Szczególne zapotrzebo-
wanie diagnostyczne dotyczy równie¿ inter-
pretacji wielu przypadków medyczno-s¹do-
wych czy klinicznych, okrelonych jako trud-
ne, z racji m.in. nieprzytomnego stanu pa-
cjenta, przy braku jakichkolwiek informacji
dotycz¹cych okolicznoci zdarzenia. Ko-
niecznoæ indywidualizacji w odniesieniu do
poszczególnych stanów zatruæ pacjentów
leczonych w oddzia³ach toksykologii klinicz-
nej, wymaga specjalistycznych oznaczeñ
poziomów leków w osoczu z czêstotliwoci¹
adekwatn¹ do istniej¹cych zagro¿eñ, wyni-
kaj¹cych z obserwacji klinicznych. Propo-
nowane metody analityczne, przeznaczone
do rutynowych oznaczeñ, powinny byæ wy-
starczaj¹co czu³e, bardzo selektywne, aby
Diagnostyka toksykologiczna przy-
padków zatruæ zwi¹zkami psychoak-
tywnymi, notowanymi w toksykologii
klinicznej i s¹dowej wymaga odpo-
wiednich badañ laboratoryjnych. Pra-
ca dotyczy oceny aktualnie u¿ywanych
metod analizy jakociowo-ilociowej
badanych zwi¹zków psychoaktywnych
w materiale biologicznym. Przydatnoæ
najczêciej stosowanych metod skri-
ningowych (immunochemicznych) i
potwierdzaj¹cych (fizykochemicznych)
oceniono w aspekcie kryteriów wali-
dacyjnych, dotycz¹cych specyficzno-
ci limitu detekcji i oznaczalnoci.
Toxicological diagnosis in cases of
intoxication with psychoactive sub-
stances known in clinical and foren-
sic toxicology requires appropriate
laboratory studies. The paper pertains
evaluation of the currently employed
techniques of quantitative and quali-
tative analysis of psychoactive sub-
stances in a biological material. Use-
fulness of the most frequently applied
screening (immunochemical) ap-
proaches and the confirmation (physi-
cochemical) techniques was evaluated
against the validation criteria, relating
to the specificity, detection limit and
sensitivity of the discussed sub-
stances.
w sposób obiektywny mog³y wykazaæ zale¿-
noæ pomiêdzy poziomem leku w osoczu, a
efektem notowanych oddzia³ywañ toksyko-
dynamicznych. Powszechnoæ stosowania
szybkich i wiarygodnych metod analizy ja-
kociowo-ilociowej ksenobiotyków w p³y-
nach ustrojowych jest uzale¿niona od po-
stêpu technicznego, który w ostatnim okre-
sie jest wyranie zauwa¿alny. Koszty zwi¹-
zane z zakupem odpowiedniego wyposa¿e-
nia aparaturowego i niezbêdnych odczyn-
ników, przy obecnych mo¿liwociach finan-
sowych wskazuj¹ na zasadnoæ centraliza-
cji us³ug diagnostycznych u³atwiaj¹cych
szybkie, kompleksowe badanie.
Aktualnie istnieje zwiêkszone zapotrze-
bowanie w zakresie toksykologicznych ba-
dañ diagnostycznych, klinicznych, jak i s¹-
dowych, wynikaj¹ce z potencjalnego zagro-
¿enia zwi¹zanego z dystrybucj¹ i nadu¿y-
waniem leków psychoaktywnych i realizacji
za³o¿eñ Ustawy o zapobieganiu narkoma-
nii. Potwierdzeniem tych obserwacji jest
wzrost doniesieñ kazuistycznych, dotycz¹-
cych ostrych zatruæ i zgonów.
Maj¹c na uwadze koniecznoæ wykony-
wania odpowiednich badañ diagnostycz-
nych, niezbêdnych w kompleksowej moni-
torowanej terapii zatruæ, przedstawiono tren-
dy i mo¿liwoci analityczne, warunkuj¹ce
obiektywn¹ interpretacjê istniej¹cych zale¿-
noci, w aspekcie wybranych zwi¹zków psy-
choaktywnych.
Wyniki badañ diagnostycznych
a uwarunkowania interpretacyjne
W rozwa¿aniach dotycz¹cych u¿ywania
rodków psychoaktywnych (odurzaj¹cych,
216
Przegl¹d Lekarski 2001 / 58 / 4
R. Wachowiak
narkotycznych), nale¿y uwzglêdniæ cztery
dominuj¹ce grupy zwi¹zków chemicznych
wykazuj¹cych efekt oddzia³ywañ na orod-
kowy uk³ad nerwowy. Wskazaæ tutaj nale¿y
na nastêpuj¹ce grupy zwi¹zków:
narkotyczne zwi¹zki przeciwbólowe
(morfina, heroina, kodeina) i syntetyczne
analogi, np. (metadon, dolargan);
zwi¹zki dzia³aj¹ce depresyjnie na
orodkowy uk³ad nerwowy (barbiturany, ben-
zodiazepiny, tricykliczne antydepresanty,
kwas gamma hydroksymas³owy [GHB]);
psychostymulanty (amfetamina, ko-
kaina, efedryna, kofeina);
zwi¹zki halucynogenne (LSD, me-
skalina, ecstasy, psylocybina, kwas ibote-
nowy).
Powy¿szy podzia³ systemowy rodków
psychoaktywnych zosta³ rozbudowany w
oparciu o raport Komitetu Ekspertów WHO.
Wyró¿niono w nim 8 grup zwi¹zków, które
w aspekcie oddzia³ywañ farmakologicznych
mieszcz¹ siê w wymienionym wykazie czte-
rogrupowym. Wysoka aktywnoæ farmako-
logiczna rodków psychoaktywnych, deter-
minowana niskimi dawkami ich za¿ywania,
przy równoczenie niekorzystnym wspó³-
czynniku terapeutycznym (rozpiêtoæ miê-
dzy dawk¹ lecznicz¹ a mierteln¹), stwarza
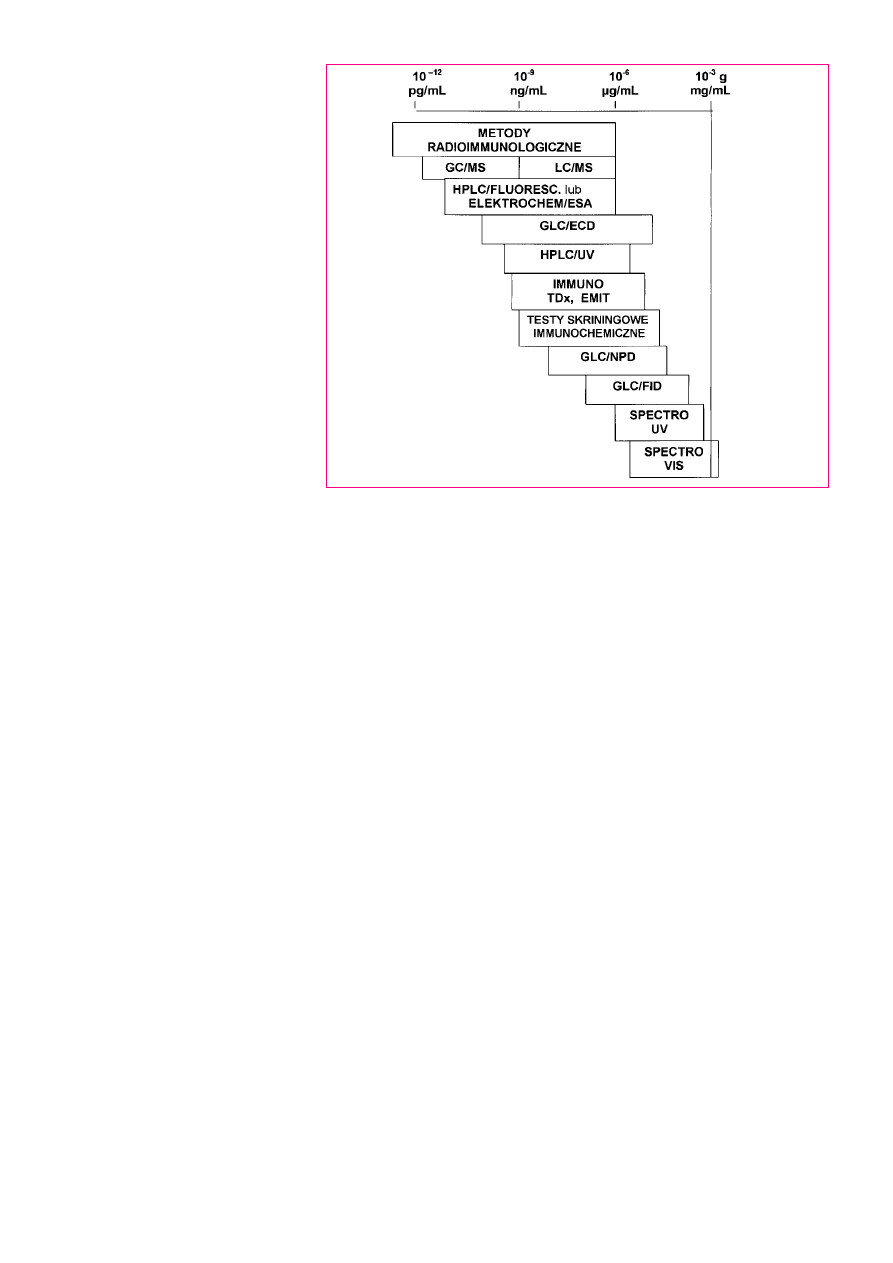
trudny uk³ad analityczny, zwi¹zany z wyj¹t-
kowo niskimi zakresami stê¿eñ w p³ynach
ustrojowych (10
-6
-10
-12
g/ml). Zakresy ozna-
czalnoci uzyskane najczêciej stosowany-
mi metodami przedstawiono na rycinie 1.
W ocenie zale¿noci przyczynowo-skut-
kowej, obowi¹zuj¹ce miêdzynarodowe nor-
my interpretacyjne zakresów stê¿eñ tera-
peutycznych, toksycznych i miertelnych,
dotycz¹ wy³¹cznie krwi, jako bardziej stabil-
nego objêtociowo uk³adu odniesienia w
porównaniu z moczem. Poziomy stê¿eñ
najczêciej notowanych rodków psychoak-
tywnych oraz okresy ich biologicznego pó³-
trwania w organizmie cz³owieka, s¹ dostêp-
ne w wielu monografiach [4,8,9,13,26], czy
programach np. TOXINET (Internet), czy
MICROMEDEX (INFO TECHNOLOGY Sup-
plied Ltd.).
Wa¿nym elementem niezbêdnym w
kompleksowej ocenie analizowanych zale¿-
noci toksykodynamicznych ksenobiotyku
jest koniecznoæ uwzglêdnienia (udzia³u)
metabolitów produktów ich biochemicz-
nych przekszta³ceñ. Metabolity, obok zwi¹z-
ków macierzystych, mog¹ interferowaæ za-
równo w zakresie oddzia³ywañ toksykody-
namicznych, jak równie¿ uzyskiwanego wy-
niku badañ analitycznych. Klasyczny przy-
k³ad synergistycznego oddzia³ywania karba-
mazepiny i jej aktywnego metabolitu 10,11-
epoksydu, czy oddzia³ywañ nordiazepamu,
metabolitu jego prekursorów klorazepatu,
diazepamu, chlorodiazepoksydu, jest po-
wszechnie znany [8,9,13,29]. W³aciwa in-
terpretacja istniej¹cych oddzia³ywañ toksy-
kodynamicznych dla tych uk³adów jest mo¿-
liwa po uprzedniej selektywnej identyfikacji
i ró¿nicuj¹cej analizie ilociowej poszczegól-
nych komponentów zawartych w p³ynach
ustrojowych. Wyniki badañ laboratoryjnych
uzyskane niespecyficznymi i tym samym
niew³aciwymi metodami analitycznymi nie
pozwalaj¹ na obiektywn¹ interpretacjê ob-
jawów klinicznych. Mo¿liwoæ równoczesne-
go okrelenia poziomów zwi¹zku macierzy-
stego i jego aktywnego metabolitu we krwi
przy ich zró¿nicowanych parametrach far-
makokinetycznych (szybkoæ eliminacji,
czas biologicznego pó³trwania, klirens), po-
zwala wyjaniæ nietypowy przebieg klinicz-
ny zatrucia. Krytyczna ocena powinna do-
tyczyæ zawsze wyników badañ uzyskanych
niespecyficznymi metodami, np. metody
immunochemiczne mog¹ byæ sum¹ oddzia-
³ywañ interferuj¹cych pochodnych o podob-
nym uk³adzie strukturalnym, (reaktywnoæ
krzy¿owa cross-reactivity). Z tego te¿
wzglêdu dla danego testu oznaczanych kse-
nobiotyków uwzglêdnia siê reaktywnoæ
krzy¿ow¹, która okrela iloæ wybranego
zwi¹zku interferuj¹cego, wywo³uj¹cego w
uk³adzie analitycznym tak¹ sam¹ wartoæ
parametru pomiarowego (absorbancja), jak
wybrane stê¿enie odpowiedniego wzorca,
np. 100 mg/ml nordiazepamu w tecie na
obecnoæ benzodiazepin. Uzyskany wiêc
pozytywny wynik badañ immunochemicz-
nych, przy braku informacji o innych za¿y-
wanych lekach przez pacjenta, wymaga
odpowiedniej interpretacji o istniej¹cych za-
k³óceniach z mo¿liwoci¹ wyst¹pienia wy-
niku fa³szywie pozytywnego. Przyk³adowo
fa³szywie pozytywny wynik badañ, potwier-
dzaj¹cy obecnoæ tricyklicznych antyde-
presantów jest czêsto obserwowany dla
przypadków zatruæ wy³¹cznie karbamaze-
pin¹ podczas jej równoczesnej analizy
metod¹ TDx.
Z tego te¿ wzglêdu handlowa propozy-
cja wielu producentów zestawów analitycz-
nych ostrzega i okrela prawdopodobieñ-
stwo wystêpowania reaktywnoci krzy¿owej
wskazuj¹c na ich ograniczon¹ pewnoæ i
skutecznoæ analityczn¹. Powy¿sze niedo-
godnoci sprawiaj¹, ¿e pozytywny test ba-
dañ jakociowych, a nawet ilociowych, uzy-
skany metodami homogenicznymi-immuno-
chemicznymi wymaga zawsze dodatkowo
potwierdzenia innymi metodami fizykoche-
micznymi.
Diagnostyka toksykologiczna zatruæ
rodkami psychoaktywnymi opiera siê
przede wszystkim na analizie chemicznej
materia³u biologicznego (krew, mocz, lina,
w³osy) - zatrucia kliniczne, poszerzone do-
datkowo o tkanki (zatrucia miertelne). Sze-
reg uwarunkowañ sprawia, ¿e mocz okazu-
je siê wa¿nym materia³em biologicznym
przydatnym w diagnostyce toksykologicznej
[8,28].
Wiêkszoæ dostêpnych skriningowych
metod diagnostycznych rodków psychoak-
tywnych dotyczy wiêc ich analizy w moczu
[DAU-test Drug of abuse urine]. Za u¿y-
ciem moczu jako preferencyjnego materia-
³u biologicznego przemawia szereg uwarun-
kowañ, wród których mo¿na wymieniæ:
d³u¿szy czas przebywania ksenobio-
tyków w moczu ani¿eli we krwi, stê¿enie we
krwi jest ograniczone czasem pó³trwania
(t
1/2
);
wy¿sze poziomy stê¿eñ w moczu w
porównaniu z krwi¹ (LSD jest typowym przy-
k³adem);
nieinwazyjny sposób pobierania pró-
bek moczu do badañ.
W ostatnich latach zwrócono uwagê na
mo¿liwoæ wykorzystania w³osów osoby
podejrzanej o d³u¿sze nadu¿ywanie leków,
w tym narkotyków jako w³aciwego mate-
ria³u dowodowego. Badania lat 90-tych
wskazuj¹ jednoznacznie, ¿e wiêkszoæ nad-
u¿ywanych zwi¹zków psychoaktywnych,
takich jak kokaina, heroina, amfetamina,
metadon, mog¹ byæ wykryte i oznaczone ilo-
ciowo we w³osach [14]. Kontrola przestrze-
gania okresu abstynencji w czasie leczenia
odwykowego, czy te¿ jej dorane przepro-
wadzenie w przypadku podejrzeñ o za¿y-
Rycina 1
Metody i zakresy najczêciej notowanych oznaczalnoci zwi¹zków psychoaktywnych w p³ynach ustrojowych.
Methods and ranges of detection for psychoactive drugs in body fluids.

217
Przegl¹d Lekarski 2001 / 58 / 4
wanie rodka psychoaktywnego jest deter-
minowana okresem biologicznego pó³trwa-
nia, tj. czasokresem przebywania zwi¹zków
narkotycznych w p³ynach ustrojowych. Za-
bezpieczenie wiêc najczêciej spotykanego
materia³u (krew, mocz) po okresie ukoñczo-
nej eliminacji narkotyku z organizmu nie
pozwala na obiektywn¹ ocenê potwierdza-
j¹c¹ za¿ycie, czy te¿ uzale¿nienie.
Homogeniczne metody analityczne
stosowne w diagnostyce zatruæ
Najbardziej przydatnymi metodami ana-
lizy jakociowo-ilociowej ksenobiotyków,
stosowanymi w laboratoriach toksykologii
klinicznej i s¹dowej (szybki skrining), s¹ te
które nie wymagaj¹ odrêbnych technik izo-
lacji z materia³u biologicznego (krew, mocz,
lina). Stosowane w tym wzglêdzie metody
homogeniczne oparte s¹ przede wszystkim
na badaniach immunochemicznych. Mo¿li-
woæ wytwarzania przeciwcia³ dowolnych
leków w organizmie ¿ywym spowodowa³a
istotny postêp w badaniach jakociowo-ilo-
ciowych ksenobiotyków, a szczególnie
rodków psychoaktywnych. Standardowy
proces otrzymywania trwa³ych po³¹czeñ
chemicznych lek-bia³ko, opiera siê na wy-
korzystaniu reaktywnych grup (karboksyko-
wych, aminowych, tiolowych, hydroksylo-
wych), które z wybranym lekiem tworz¹
czynny zwi¹zek immunologiczny wysoko-
cz¹steczkowy hapten (immunogenic conju-
gate). Przyk³adowo, produkt po³¹czenia bia³-
ka z morfin¹ nastêpuje poprzez grupy hy-
droksylowe przy C-3 i C-6 lub heterocyklicz-
ny atom azotu tworz¹c hapten o ukierunko-
wanej zdolnoci wytwarzania przeciwcia³ w
odniesieniu do morfiny, kodeiny czy teba-
iny. Podanie haptenu drog¹ parenteraln¹
zwierzêtom dowiadczalnym stymuluje wy-
tworzenie wysoce specyficznych przeciwcia³
monoklonalnych, które po odpowiednim
mianowaniu mog¹ byæ wykorzystane w ana-
lizie jakociowo-ilociowej danego ksenobio-
tyku [25].
Jakociowa i pó³ilociowa ocena
toksykologiczna
Istotnym postêpem w szybkim skrinin-
gu toksykologicznym rodków psychoaktyw-
nych jest u¿ycie czu³ych testów p³ytkowych,
których rozwój chronologicznie zapocz¹tko-
wa³ Abuscreen ONTRAKT firmy Roche Dia-
gnostics (test aglutynacyjny) [2]. Zasada
oznaczania testem ONTRAKT sprowadza
siê do potwierdzenia, wzglêdnie wyklucze-
nia aglutynacji uk³adu konkurencyjnej reak-
cji ksenobiotyku zawartego w badanym
materiale (mocz) i osadzonym na tzw. LA-
TEXIE z przeciwcia³ami przeciw oznacza-
nemu zwi¹zkowi. U¿ycie testu ONTRAKT
wymaga zakupu odpowiednich zestawów
np. dla wybranych grup zwi¹zków psycho-
aktywnych. Wykrywalnoæ poszczególnych
ksenobiotyków w materiale biologicznym
jest zró¿nicowana, a o jej wymiarze decy-
duje wartoæ stê¿enia progowego (cutoff),
powy¿ej którego odczyt nale¿y uznaæ za
pozytywny. Progowe wartoci stê¿enia cut-
off dla wybranych oznaczeñ grup zwi¹zków
w odniesieniu do wybranej substancji kali-
bracyjnych oscyluj¹ w zakresie 25-1000 ng/
ml.
Istotny postêp w szybkim zró¿nicowa-
nym skriningu toksykologicznym rodków
psychoaktywnych spowodowa³o wprowa-
dzenie przez firmê Merck zestawów anali-
tycznych TRIAGE. Zaproponowany system
pozwala dokonaæ szybkiej zró¿nicowanej
analizy jakociowej moczu, w kierunku sied-
miu (TM-7) czy omiu (TM-8) podstawowych
grup rodków psychoaktywnych Metadon
(MTD), benzodiazepiny (BZO), kokaina
(COC), amfetamina (AMT), kannabinole
(THC), alkaloidy grupy opium (OPI), barbi-
turany (BAR) i tricykliczne antydepresanty
(TCA).
Istot¹ dzia³ania testu jest konkurencyj-
na reakcja zwi¹zku psychoaktywnego za-
wartego w moczu z jego chemicznie znako-
wanym po³¹czeniem z koloidalnym z³otem
(koningat) o okrelon¹ liczbê miejsc prze-
ciwcia³a umieszczonego na pasku membra-
nowym w tzw. strefie testowej p³ytki. W koñ-
cowym etapie pomiaru trwaj¹cym ok. 3-8
minut barwny pr¹¿ek w strefie testowej jest
obserwowany wówczas, gdy w badanym
moczu nie wystêpuje poszukiwany kseno-
biotyk (próba ujemna). Brak pr¹¿ka barw-
nego w strefie testowej potwierdza obecnoæ
ksenobiotyku w próbie badanej (wynik do-
datni).
W rutynowych badaniach skriningo-
wych, obok systemu TRIAGE, u¿ywane s¹
bardzo czêsto jednostopniowe testy immu-
nochemiczne ukierunkowane na dan¹ gru-
pê zwi¹zków psychoaktywnych. Na rynku
dominuj¹ testy firm HUMAN, HYDREX, IN-
TIMEX, SYVA BEHRING.
Ostatnia pozycja firmy SYVA BEHRING
i Roche Diagnostic dotyczy jednostopniowe-
go testera kasetowego (SYVA-RADIO
TEST), kubkowego (SYVA-RAPID) oraz
ONTRAK TESTSTIK czy ONTRAK Test cup-
5, pozwalaj¹cego na równoczesn¹ identyfi-
kacjê pochodnych siedmiu lub piêciu grup
rodków psychoaktywnych (amfetaminy,
barbiturany, benzodiazepiny, kannabinole,
kokaina, metamfetamina, opiaty, fencyklidy-
na oraz tricykliczne antydepresanty).
Metody immunochemiczne
stosowane w analizie ilociowej
zwi¹zków psychoaktywnych
Konsekwencj¹ rozszerzenia zakresu
u¿ycia jakociowych metod immunoche-
micznych by³o ich przystosowanie dla ce-
lów analiz ilociowej. Metody immunoche-
miczne nale¿¹ obecnie do najczêciej sto-
sowanych technik homogenicznych i nie
wymagaj¹cych wstêpnej izolacji moczu czy
osocza. Mniejsze zainteresowanie dotyczy
metod radioimmunologicznych (RIA) i radio-
receptorowych (RRA), które obok koniecz-
noci etapu rozdzia³u (metody heterogenicz-
ne) wymagaj¹ wzorca zwi¹zku znakowane-
go izotopem oraz odpowiedniego wyposa-
¿enia z racji u¿ycia izotopów promieniotwór-
czych.
Powszechnie stosuje siê dwie metody
homogeniczne, tj. enzymatyczno-immuno-
logiczn¹ (Enzyme-Multiplied Immunoasay
Technique EMIT-SYVA) oraz immunolo-
giczn¹ metodê fluoroscencyjno-polaryzacyj-
n¹ FPIA, TDx firmy ABBOT. Mniejsze za-
stosowanie znajduje heterogeniczna tech-
nika immunoenzymatyczna ELISA (enzyme-
linked-immunosorbent assays) w uk³adzie
analitycznym enzymu osadzonego na fazie
(solid phase enzyme immunoassay).
Zasada metody EMIT proponowanej
przez SYVA CORPORATION oparta jest na
fakcie hamowania aktywnoci enzymu w
uk³adzie konkurencyjnego wi¹zania przeciw-
cia³a, np. wolnego leku zawartego w prób-
ce z lekiem znakowanym enzymem. Wolny
lek konkuruje z lekiem znakowanym enzy-
mem o po³¹czenia z przeciwcia³ami a ak-
tywnoæ enzymu jest wprost proporcjonal-
ne do iloci wolnego leku w próbce. Aktyw-
noæ enzymu nie zwi¹zanego z przeciwcia-
³ami (najczêciej bakteryjna dehydrogena-
za glukozo-6 fosforanowa) mierzona reduk-
cj¹ substratu NADP do NADPH jest deter-
minowana porednio stê¿eniem oznaczane-
go leku Ab=f (c) stê¿enie przy l = 340 nm.
Druga metoda homogeniczno-immunolo-
giczno-fluorescencyjno-polaryzacyjna
(FPIA) pozwala na okrelenie poziomów
wybranych zwi¹zków w osoczu, surowicy
czy moczu. W uk³adzie analitycznym wystê-
puje przeciwcia³o przeciw zwi¹zkowi ozna-
czonemu, zwi¹zek oznaczony po³¹czony z
barwnikiem fluorescencyjnym (znakowany
hapten), próbka badana, w której oznaczo-
ny jest zwi¹zek (nieznakowany hapten w
roztworze buforu rozcieñczonego). W te-
stach FPIA mierzona jest emisja wiat³a spo-
laryzowanego po uprzedniej kompetycyjnej
reakcji znakowanego i nieznakowanego
haptenu o miejsca wi¹zania w przeciwcia-
³ach. Automatyczny uk³ad rejestruj¹cy okre-
la stopieñ depolaryzacji wiat³a, który jest
odwrotnie proporcjonalny do wielkoci cz¹-
steczek rotuj¹cych. Stopieñ depolaryzacji
promieniowania fluoroscencyjnego jest
wprost proporcjonalny do stê¿enia leku w
próbce biologicznej. Metoda ta jest ca³ko-
wicie zautomatyzowana i z tego wzglêdu
czêciej stosowana w porównaniu z inny-
mi. Obie metody charakteryzuj¹ siê wyso-
k¹ oznaczalnoci¹ i dyskusyjn¹ specyficz-
noci¹ nie pozwalaj¹c¹ ustaliæ udzia³u po-
szczególnych pochodnych tworz¹cych dan¹
grupê. Przyk³adowo wszystkie pochodne
benzodiazepiny s¹ mniej lub bardziej czyn-
ne w tecie immunologicznym, a uzyskiwa-
ny wynik badania jest sum¹ oddzia³ywañ w
przeliczeniu na wybran¹ pochodn¹ tzw. ka-
libratora, np. nordiazepamu. W uk³adzie
oddzia³ywañ interferencyjnych nie rzadko
mo¿e wyst¹piæ interakcja zak³ócaj¹ca przez
inn¹ strukturalnie grupê chemiczn¹ zwi¹z-
ków.
Metody heterogeniczne
potwierdzaj¹ce skriningowe wyniki
badañ immunochemicznych
Zastosowanie metod potwierdzaj¹cych
(confirmation) jest bardziej czasoch³onne i
wymaga zawsze zastosowania wstêpnej
izolacji z materia³u biologicznego. Wartoæ
u¿ytkowa nowoczesnych metod analizy ja-
kociowo-ilociowej ksenobiotyków w ma-
teriale biologicznym zale¿y wiêc przede
wszystkim od wydajnoci stosowanych me-
tod izolacji. Wród preferowanych technik
izolacji nale¿y wymieniæ klasyczn¹ ekstrak-
cjê typu ciecz/ciecz oraz znacznie szybsz¹
i bardziej wydajn¹ z u¿yciem fazy sta³ej (so-
lid phase extraction SPE) [1,22]. Wydaj-
ny proces izolacji klasycznej ksenobiotyku
z osocza czy moczu, po uprzednim jego
uwolnieniu z po³¹czeñ bia³ka czy koniugatu

218
Przegl¹d Lekarski 2001 / 58 / 4
R. Wachowiak
II-ej fazy metabolizacji enzymatycznej, mo¿e
byæ osi¹gniêty wy³¹cznie w warunkach w³a-
ciwego doboru pH, uwarunkowanego cha-
rakterem kwasowo-zasadowego analitu.
Znajomoæ wartoci pka ksenobiotyku (war-
toæ pH, przy którym 50% zwi¹zku znajduje
siê w postaci zjonizowanej) jest w tym przy-
padku najwa¿niejszym parametrem odnie-
sienia. Przyk³adowo izolacja amfetaminy
(pka 9.9) wymaga rodowiska o pH powy-
¿ej 11, przy którym 100% jej postaci bêdzie
woln¹ zasad¹ podatn¹ do ekstrakcji roz-
puszczalnikami organicznymi.
Efektywny, a zarazem uproszczony i
szybki proces izolacji ksenobiotyków z oso-
cza, mo¿na uzyskaæ wykorzystuj¹c depro-
tonizuj¹ce w³aciwoci acetonitrylu w uk³a-
dzie 1:1. Oddzielony supernatat od precy-
pitatu bia³kowego, po uprzednim wyparowa-
niu i odpowiednim rozcieñczeniu, umo¿liwia
szybk¹ analizê w uk³adach analitycznych
(HPLC, GC). Znacznie przyspieszon¹ pro-
cedurê izolacji rodków psychoaktywnych
z materia³u biologicznego zapewnia ekstrak-
cja z u¿yciem faz sta³ych. Dyskutowane fazy
s¹ zmodyfikowanymi chemicznie postacia-
mi ¿elu krzemionkowego (zawieraj¹ m.in.
podstawione ³añcuchy wêglowodorów C
8
,
C
18
), czêsto z dodatkowymi podstawnika-
mi odpowiedzialnymi za polarnoæ adsor-
benta. U¿ywane najczêciej w krajowych
laboratoriach fazy sta³e s¹ produkowane
przez firmy J.T. Baker, Supelco, Varian, z
ukierunkowanym przeznaczeniem do izola-
cji zró¿nicowanych chemicznie grup rod-
ków psychotropowych. Koniecznoæ uzyski-
wania wyniku badañ w mo¿liwie jak najkrót-
szym czasie sprawia, ¿e aktualne trendy i
zapotrzebowania lansuj¹ szybkie metody
izolacji g³ównie z u¿yciem faz sta³ych nie
wymagaj¹cych wstêpnych etapów przygo-
towawczych (kondycjonowanie, aktywacja).
Powy¿sze oczekiwania spe³nia propozycja
firmy Varian dotycz¹ u¿ycia fazy sta³ej Ab-
selut Nexus. Procedura wykonawcza szyb-
kiej izolacji z wysok¹ wydajnoci¹ w zakre-
sie 80-100% sprowadza siê do trzyetapo-
wego prostego postêpowania w kolejnoci:
adsorbcja analitu z osocza, p³ukania wod¹ i
desorbcji metanolem. Uproszczone postê-
powanie ma zasadnicz¹ przewagê nad in-
nymi bardziej restrykcyjnymi i czasoch³on-
nymi. W praktyce, obok wymienionych faz
octyl -C
8
, octaldecyl C
18
, Narc-2 (Becker)
w rutynowych badaniach w toksykologii s¹-
dowej szersze zastosowanie znajduje Extre-
lut (Merck) jako uniwersalny sorbent zwi¹z-
ków o zró¿nicowanym charakterze kwaso-
wo-zasadowym i obojêtnym [7,11].
Wspó³czesna toksykologia kliniczna czy
s¹dowa, dysponuj¹ca nowoczesnymi tech-
nikami wykrywania trucizn musi dokonaæ ich
szybkiej i pewnej identyfikacji w materiale
biologicznym na drodze trudnej i skompli-
kowanej eliminacji co najmniej kilku tysiêcy
zwi¹zków chemicznych towarzysz¹cych
¿yciu cz³owieka. Zagadnienia zwi¹zane z
szybk¹ identyfikacj¹ ksenobiotyków w ma-
teriale biologicznym dotycz¹ ci¹g³ego roz-
wijania ró¿nych metod fizykochemicznych,
tworz¹c coraz bardziej doskona³e programy
tzw. systematycznej analizy toksykologicz-
nej. W celu wyeliminowania wielu czynni-
ków zak³ócaj¹cych powtarzalnoæ miêdzy-
laboratoryjn¹, w rutynowych badaniach tok-
sykologicznych stosuje siê korekcje para-
metrów identyfikacyjnych dla najczêciej
stosowanych metod chromatograficznych.
Zast¹pienie przez Kovatsa [15] parametru
czasu retencji stabilnym uk³adem odniesie-
nia indeksem retencji, da³o pocz¹tek no-
wym technikom identyfikacji zwi¹zków pro-
ponowanym przez Mofota i wspó³pracowni-
ków [1,19,20]. Podobne zasady systema-
tycznej analizy identyfikacyjnej, opartej na
bazie indeksów retencji, zaproponowano dla
metody chromatografii cieczowej HPLC
[3,5,12,17]. Chromatografia cieczowa nale-
¿y aktualnie do najbardziej przydatnych i
efektywnych metod analizy jakociowo-ilo-
ciowej ksenobiotyków w materiale biolo-
gicznym. Jej zastosowanie dla celów iden-
tyfikacyjnych znacznie wzros³o po wprowa-
dzeniu nowej techniki detekcji typu DIODE-
ARRAY. Zastosowanie tego typu detekcji
pozwala uzyskaæ obok sygna³u piku dane-
go zwi¹zku na chromatogramie jego widmo
UV (200-350 nm) w uk³adzie trójwymiaro-
wym, potwierdzaj¹c¹ jego jednorodnoæ. Ta
w³aciwoæ detektora DIODE-ARRAY pod-
nosi znacz¹co mo¿liwoci identyfikacji
zwi¹zków [6,11,16,18,23,24].
Komputerowe sterowanie uk³adu HPLC
zawieraj¹cego dodatkowo bank widm w
nadfiolecie, umo¿liwia szybk¹ identyfikacjê
dowolne zarejestrowanego piku badanego
zwi¹zku. Aktualnie istniej¹ gotowe progra-
my komputerowe pozwalaj¹ce na podsta-
wie banku widm (library search) dokonaæ
identyfikacji zwi¹zku ujêtego w rejestrze
danych. Wród dostêpnych programów
uwagê zwraca propozycja handlowa firmy
Hewlett Packard aktualny dystrybutor w
Polsce - AGILENT TECHNOLOGY, dotycz¹-
ca programu obejmuj¹cego identyfikacjê
ponad 1600 zwi¹zków (g³ównie leków i ich
metabolitów oraz pestycydów i innych), w
uk³adzie 12-blokowego podzia³u (sublibra-
ries). Niezast¹pion¹ metodê identyfikacji i
analizy ilociowej zwi¹zków psychoaktyw-
nych jest metoda chromatografii gazowej i
spektrofotometrii masowej (GC/MS) z rów-
noczesn¹ mo¿liwoci¹ korzystania z biblio-
teki widm masowych np. systemu HP 5997
OC MS/MD Chemistation. Wród mo¿liwych
technik analitycznych w tym uk³adzie, za-
stosowanie znalaz³a technika pe³nego wid-
ma masowego (MID - multiple ion detection)
stosowanego dla wy¿szych stê¿eñ bada-
nych zwi¹zków. Dla przypadków ni¿szych
stê¿eñ ksenobiotyków typowych dla mate-
ria³u biologicznego zastosowanie znajduje
technika SIR (selected ion recording) czy
SIM (selected ion monitoring). Obie techni-
ki pozwalaj¹ na monitorowanie zmian inten-
sywnoci wybranych specyficznych frag-
mentów cz¹steczki tworz¹cych widmo ma-
sowe. Uzyskane dane dla materia³u bada-
nego przy u¿yciu dowolnej techniki, mog¹
znaleæ potwierdzenie w komputerowym
uk³adzie porównawczym z odpowiednim
wzorcem wybranym z banku widm. Metoda
GC/MS znajduje równie¿ zastosowanie w
analizie ilociowej [21,30]. Rutynowo, z uwa-
gi na oznaczalnoæ, stosuje siê technikê SIM
z równoczesnym u¿yciem wzorca wewnêtrz-
nego, którym jest pochodna deuterowana
oznaczonego zwi¹zku. Kalibracja dotyczy
poredniej zale¿noci funkcji zró¿nicowa-
nych stê¿eñ zwi¹zku oznaczonego, wyra-
¿onego stosunkiem intensywnoci wybrane-
go z widma jonu w odniesieniu do intensyw-
noci okrelonego jonu pochodnej determi-
nowanej, dodanej w sta³ym stê¿eniu do roz-
tworów wzorcowych.
Niezast¹pion¹ metod¹ stosowan¹ w tok-
sykologii s¹dowej i klinicznej jest chromato-
grafia gazowa z mo¿liwoci¹ u¿ycia innych
detektorów ani¿eli masowy. Zastosowanie
uk³adu GLC z odpowiednim detektorem
(ECD, NPD, AFID, FID, TCD) pozwala re-
gulowaæ nie tylko oznaczalnoæ ksenobio-
tyków, ale równie¿ zapewnia eliminacjê
mo¿liwych wp³ywów interferuj¹cych, np.
pochodz¹cych od u¿ytego rozpuszczalnika.
Ró¿norodnoæ rozwi¹zañ technicznych,
mo¿liwoæ wyboru odpowiednich technik
analitycznych, analiza ksenobiotyków jako
pochodnych sililowych, acetylowych, alkilo-
wych, estrowych, eliminacja t³a interferuj¹-
cych zanieczyszczeñ, predystynuj¹ chroma-
tografiê gazow¹ do podstawowych metod
badawczych stosowanych w toksykologii
[1,9,10,20].
W rutynowych badaniach toksykologicz-
nych zastosowanie znajduj¹ równie¿ inne
programy systematycznej analizy ksenobio-
tyków, wród których wymieniæ mo¿na sys-
tem Remedi-HS (Bio-Rad Laboratories,
Hercules CA US). Program Remedi-HS
oparty jest na zasadach chromatografii cie-
czowej (HPLC) i detekcji UV. System Re-
medi-HS umo¿liwia szybk¹ analizê ok. 500
leków i ich metabolitów w uk³adzie wielo-
punktowego pomiaru UV (multiwavelenght
ultraviolet detection). Niezale¿nie od uk³a-
dów sprzê¿onych w analizie metod¹ HPLC
wykorzystuje siê zró¿nicowan¹ zdolnoæ
detekcji, m.in. (UV, fluorescencyjnej, elek-
trochemicznej), której u¿ycie jest determi-
nowane strukturalnymi uwarunkowaniami
badanych zwi¹zków [23]. Najnowszym roz-
wi¹zaniem analitycznym jest zastosowanie
chromatografii cieczowej z spektrometri¹
masow¹ LC/MS. Osi¹gi detekcji dla ozna-
czeñ wielu zwi¹zków w tym uk³adzie s¹ ni¿-
sze ani¿eli uzyskane w systemie GC/MS i
najczêciej wystêpuj¹ w zakresie od 10 ng/
ml. Wzglêdy ekonomiczne sprawiaj¹, ¿e
technika ta nie znajduje jeszcze powszech-
nego zastosowania i tylko nieliczne placówki
w Polsce dysponuj¹ tymi mo¿liwociami
analitycznymi.
Notowane wysokie poziomy ksenobio-
tyków w p³ynach ustrojowych dla przypad-
ków zatruæ przekraczaj¹cych zakres stê¿eñ
terapeutycznych stwarzaj¹ mo¿liwoci wy-
korzystania dodatkowych metod potwierdza-
j¹cych. Najwy¿sz¹ wartoæ u¿ytkow¹ nale-
¿y przypisaæ m.in. testom wielokrotnej ko-
rekty wartoci RF opracowanych dla metod
chromatografii cienkowarstwowej, umo¿li-
wiaj¹cych analizê wiêkszej liczby leków
[9,10,23]. Podobne zastosowanie znajduje
system TOXI-LAB
TM
(Analytical systems,
Division of Marion Laboratories, Inc.) umo¿-
liwiaj¹cy szybki skrining (TLC) powszech-
nie nadu¿ywanych leków psychoaktywnych
i ich metabolitów w kompleksowym zesta-
wie analitycznym, zapewniaj¹cym proces
ekstrakcji, rozdzia³u i wizualizacji badanych
ksenobiotyków na chromatogramie [27].
Wspó³czesna analityka toksykologiczna
dysponuj¹ca nowoczesnymi technikami,
musi dokonaæ szybkiej i pewnej identyfika-

219
Przegl¹d Lekarski 2001 / 58 / 4
cji i analizy ilociowej substancji toksycznej
w materiale biologicznym i stanowi integral-
n¹ czêæ postêpowania diagnostycznego,
przydatnego w kontroli procesu skutecznej
detoksykacji. Przedstawione powy¿ej wybra-
ne zagadnienia, dotycz¹ce wykorzystania
niektórych rutynowych analitycznych metod
badawczych, stanowi¹ fragment wa¿nego
problemu zwi¹zanego z diagnostyk¹ che-
miczn¹ zatruæ, która ulega systematyczne-
mu doskonaleniu uwarunkowanego dyna-
micznym postêpem technicznym, którego
inicjacj¹ s¹ m.in. zapotrzebowania toksyko-
logii klinicznej i s¹dowej.
Wnioski
1. Systematyczny wzrost uzale¿nieñ
oraz zatruæ rodkami psychoaktywnymi
wymaga odpowiednich metod diagnostycz-
nych, niezbêdnych w monitorowanej terapii
i skutecznej detoksykacji.
2. Homogeniczne, immunochemiczne
techniki diagnostyczne proponowane w ró¿-
nych modyfikacjach charakteryzuj¹ siê
znaczn¹ czu³oci¹, lecz ograniczon¹ spe-
cyficznoci¹, z racji reaktywnoci krzy¿owej
cross reactivity i wymagaj¹ odpowiednie-
go potwierdzenia innymi metodami badaw-
czymi.
3. Wród rutynowych metod potwier-
dzaj¹cych nale¿y wskazaæ na chromatogra-
fiê cieczow¹ (HPLC), gazow¹ (GLC) oraz
sprzê¿one uk³ady GC/MS i LC/MS, jako
najbardziej specyficzne systemy analitycz-
ne.
4. Komputerowe programy systema-
tycznej analizy toksykologicznej zapropono-
wane dla uk³adów HPLC-DIODA ARRAY
oraz GC/MS stanowi¹ istotny postêp w szyb-
kiej i skutecznej analizie zwi¹zków psycho-
aktywnych.
Pimiennictwo
1. Ardrey R., Moffat A.: Gas liquid chromatography
retention indices of 1318 substances of toxicological
interest on SE-30 or OV-1 stationary phase. J.
Chromatogr. 1981, 220, 195.
2. Armbruster D.A., Krolak J.M.: Screening for drug
of abuse with the Roche ONTRAKT Assays. J. Anal.
Toxicol. 1992, 16, 172.
3. Baker I., Skelton R.: Estimation of HPLC retention
indices of narcotic analgesics and related drugs. J.
Chromatogr. 1980, 18, 153.
4. Baselt R.C., Cravey R.H.: A compendium of thera-
peutic and toxic concentrations of toxicologically sig-
nificant drugs in human biofluids. J. Anal. Toxicol.
1977, 1, 81.
5. Bogusz M., Erkens M.: Reversed phase high-per-
formance liquid chromatographic data base of reten-
tion indices and UV spectra of toxicologically relevant
substances and its interlaboratory use. J. Chroma-
togr. 1994, 674, 97.
6. Bogusz M. Wu M.: Standardized HPLC-DAD sys-
tems based on retention for systematic toxicological
screening. J. Anal. Toxicol. 1991, 15, 188.
7. Breiter J., Helger R., Lang H.: Evaluation of col-
umn extraction: A new procedure for the analysis of
drugs in body fluids. Forens. Sci. 1976, 7, 131.
8. Chamberlain J.: The analysis of drugs in biological
fluids. CRP Press. Boca Ration New York, London,
Tokyo 1995.
9. Clarks isolation and identification of drugs. Pharma-
ceutical Society, London 1986.
10. Daldrup T., Susanto F., Michalke P.: Combination
of TLC, GL and HPLC (RP 18) for rapid detection of
drugs and related compounds. Z. Anal. Chem. 1981,
308, 413.
11. Ferara S.D., Tedeschi L., Frison G., Castanga F.:
Solid phase extraction and HPLC-UV confirmation
of drug of abuse in urine. J. Anal. Toxicol. 1992, 16,
217.
12. Hill D.W., Kind A.J.: Reversed-phase solvent-gra-
dient HPLC retention indexes of drugs. J. Anal.
Toxicol. 1994, 18, 233.
13. Karch S.B.: Drug abuse handbook. CRS Press.
Boca-Raton, Boston, New York, Washington D.C.
1998.
14. Kintz P.: Drug testing in hair. CRS. Boca-Raton, New
York, London, Tokyo, 1996.
5. Kovats E.: Gaschromatographische charakteri-
sierung organischer Verbindungen. Teil 1: retentions
indices aliphatischer halogenide, alcohole, aldehyde,
und ketone. Helv. Chim. Acta 1958, 41, 1915.
16. Koves E.M., Wells B.S., Wells J.: Evaluation of a
photodiod array HPLC-based system for the detec-
tion and quantification of basic drugs in postmortem
blood. J. Forens. Sci. 1992, 37, 42.
17. Lambert W.E., Meyer E., De Leenheer A.P.: Sys-
tematic toxicological analysis of basic drugs by gra-
dient eluation of an alumina-based HPLC packing
material under alkaline condition. J. Anal. Toxicol.
1995, 19, 73.
18. Logan G.K., Stafford D.T., Tebbett J.R., Moore
C.M.: Rapid screening for 100 basic drugs and
metabolites in urine using cation exchange solid
phase extraction and high-performance liquid chro-
matography with diode array detection. J. Anal.
Toxicol. 1990, 14, 154.
19. Moffat A.C.: The standardisation of thin-layer chro-
matographic systems for the identification of basic
drugs. J. Chromatogr. 1975, 110, 341.
20. Moffat A.C.: Use of Se-30 stationary phase for the
gas-liquid chromatography of drugs. J. Chromatogr.
1975, 113, 69.
21. Mushoff F., Daldrup T.: Detection and quantifica-
tion of low concentrations of 11-nor-delta-9-tetrahy-
drocannabinol-9-carboxylic acid from minimal
amount of urine. J. Leg. Med. 1991, 104, 263.
22. Scheurer J., Moore C.M.: Solid-phase extraction of
drugs from biological tissues a review. J. Anal.
Toxicol. 1992, 12, 264.
23. Schütz H.: Modern screening strategies in analyti-
cal toxicology with special regard to new
benzodiazepines. Z. Rechtsmedizin. 1988, 24, 19.
24. Smith R., Turdley T., Gill R., Moffat A.: The appli-
cation of retention indices using the alkylarylketone
scale to the separation of the barbiturates by HPLC.
II. The effect of the stationary phase. Chromatogr.
1984, 19, 407.
25. Smith R.N.: Radioimmunoassay of drugs in body flu-
ids in a forensic context. Forensic Science Progress
3, Springer Verlag, Berlin, Heidelberg. 1988.
26. Stead A.H., Moffat A.C.: A collection of therapeutic,
toxic and fatal blood drug concentration in man. Hu-
man Toxicol. 1983, 3, 437.
27. TOXI-LAB screening and confirmation of drug abuse.
Analytical Systems Division of Marion Laboratories
Irvine, CA. 1987.
28. Thelander G., Jonsson J., Schuberth J.: Is urine
a suitable material for the preliminary screening of
drugs in autopsy cases. Forens. Sci. Inter. 1983, 22,
189.
29. Weaver D.F., Camfield P., Frase A.: Massive carba-
mazepine overdose. Clinical and pharmacologic
observations in five episodes. Neurology 1988, 38,
755.
30. Yinon J.: Forensic application of mass spectrometry.
CRS Press Inc. 1995, 16.
Wyszukiwarka
Podobne podstrony:
Złożone zatrucie środkami psychoaktywnymi, Forensic science, Medycyna sądowa i antropologia, Toksyko
analiza toksykologiczna w sprawach o podanie środka psychoaktywnego
LOTS, Metody zbierania danych w psychologii osobowości, Zasadniczo całość metod stosowanych w psycho
analiza toksykologiczna w sprawach o podanie środka psychoaktywnego
analiza toksykologiczna w sprawach o podanie środka psychoaktywnego
Przegl d metod stosowanych w analizie w aÂciwoÂci antyoksydacyjnych
Ocena skuteczności i bezpieczeństwa stosowania adalimumabu w leczeniu RZS, reumatologia
Psychologiczne problemy metod przesłuchań świadków Przegląd psychologiczny, nr 2
Ocena skuteczności metod zapobiegania i leczenia
Ocena przydatności i zasady stosowania różnorodnych odpadów do rekultywacji zwałowisk
Charakterystyka metod stosowanych w wychowaniu metody indywidualne
wyklady toksyki1-2 , Toksykologia-nauka o truciznach i zatruciach, dyscyplina naukowa zajmująca się
Przyklady zabaw stosowanych w terapii nadpobudliwosci psychoruchowej(1)(1), PEDAGOGIKA SPECJALNA1, A
notatek pl charakterystyka metod stosowanych w analizie zywnosci
PIERWSZA POMOC w zatruciach srodkami ochrony roslin, instrukcje BHP
Psychospołeczne aspekty stosowania środków wczesnoporonnych, Psychologia prokreacji
Toksykologia cz 3 trucizny, zatrucia i ich przyczyny
Zatrucia środkami ochrony roślin notka
więcej podobnych podstron